Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра Общей Химической Технологии
Реферат
по курсу: Технология химических производств
на тему:
Хлорирование метана
Казань 2008
Содержание
Хлорирование метана
Технологические и технико-экономические показатели
Реклама
Список литературы
Процесс совместного получения хлорметанов можно осуществлять в реакторе со стационарным илипсевдоожиженным слоем катализатора. Вторая технология более перспективна, она включает следующие стадии: хлорирование в псевдоожиженном слое катализатора; пылеулавливание и отпаривание газов кислотного характера; абсорбция хлороводорода; нейтрализация и осушка рециркулирующего реакционного газа; компримироваиие рециркулирующих газов; ректификация хлорметанов с выделением товарных продуктов.
Хлор и метан подают в реактор в соотношении от 1: 2 до 3,88: 1 в зависимости от того, какое хлорпроизводное желательно получить. Например, при соотношении С12
: СН4
-1: 2 образуется продукт, содержащий [п% (мол)]: СН3
С1 - 62; СН2
С12
- 30; СНС13
- 7; СС14
- 1; при соотношении С12
: СН4
= 3,88: 1 образуется продукт, содержащий только 4% (мол) СНС13
и 96% (мол) СС14
.
Метан и хлор поступают в реактор 1 с псевдоожиженным слоем катализатора. Реактор выполнен из хромоникелевоп стали.
Хлорирование ведут; при 350 °С и атмосферном давлении, время контакта 0,1-20 с. Реакционная смесь проходит систему пылеулавливания (циклон 2) и поступает на нейтрализацию в колонну 3, где отпариваются кислые газы. После этой колонны продукты реакции промывают водой в скруббере 6; при этом получается товарная соляная кислота. Далее газы нейтрализуют раствором щелочи в скруббере 7 и осушают серной кислотой в скруббере 8.
Нейтрализованные газы, содержащие в основном метан и метилхлорид, компримируют и возвращают в реактор на хлорирование. Конденсат после отпаривания кислых газов поступает на ректификацию в колонны 10, 12 и 13, в которых последовательно выделяют метиленхлорид, хлороформ и тетрахлорид углерода.
Для удалении инертных примесей часть реакционного газа после компрессора 9 и скруббера 6 выводят в атмосферу (на схеме не показано). Расход основного сырья на 1 т готового продукта составляет 133 кг метана и 1784 кг хлора.
В процессе на 1 т хлороформа образуется 0,9 т метиленхлорида и 0,5 т тетрахлорида углерода. Кубовые остатки (в основном со стадии ректификации) в количестве 0,01 т на 1 т хлороформа направляют па установку термического обезвреживания. В процессе образуется соляная кислота (примерно 1 т па 1 т хлороформа), которую после очистки от хлорорганических примесей можно применять вместо синтетической. Отработанную серную кислоту (0,1 т на 1 т хлороформа) передают на производство сульфата натрия.
Задание:
Составить и описать технологическую схему процесса хлорирование метана
Составить материальный баланс процесса
Рассчитать технологические технико-экономические показатели
В основу расчета принять следующие реакции:
CH4
+Cl2
→CH3
Cl+HCl
CH3
Cl+Cl2
→CH2
Cl2
+HCl
CH2
Cl2
+Cl2
→CHCl2
+HCl
CHCl3
+Cl2
→CCl4
+HCl
Исходные данные:
| Производительность установки по хлорсодержащим продуктам, т/сут |
60 |
Состав сырья,% масс
природный газ с содержание метана
технический хлор с содержанием примесей
|
93
1.5
|
Состав продуктов,% моль
метан
хлористый метан
хлористый метилен
хлороформ
четыреххлористый углерод
|
32
18
25
20
5
|
| Мольное соотношение хлор-метан |
2.6 |
| Потери метана,% масс |
1.3 |
Материальный баланс. Схема потоков:
  CH
4
;
Cl
2
; природный газ;
CH
3
Cl
;
CH
2
Cl
2
;
CHCl
3
;
CCl
4
;
CH
4
; CH
4
;
Cl
2
; природный газ;
CH
3
Cl
;
CH
2
Cl
2
;
CHCl
3
;
CCl
4
;
CH
4
;
примесь
Cl
2
Cl
2
; прир. газ; примесь
Cl
2
;
HCl
| Приход
|
Расход |
| кг/ч
|
кмоль/ч
|
кг/ч
|
кмоль/ч |
CH4
Cl2
CH3
Cl
CH2
Cl2
CHCl3
CCl4
HCl
прим.
CH4
прим.
Cl2
|
604,88
6969,9
0
0
0
0
0
45,53
106,14
|
37,81
98,306
0
0
0
0
0
|
191 + 7,76
3053,38
339
792,25
890,75
287
2013,5
45,53
106,14
|
11,94 + 0,485
43,07
6,72
9,33
7,46
1,87
55,24
|
| Σ1
= 7726,45 |
Σ2
= 7726,31 |
Молярные массы веществ:
Mr (CH4
) = 12+4=16 кг/кмоль
Mr (Cl2
) = 35,45*2=70,9 кг/кмоль
Mr (CH3
Cl) = 12+3+35,45=50,45 кг/кмоль
Mr (CH2
Cl2
) = 12+2+35,45*2=84,9 кг/кмоль
Mr (CHCl3
) = 12+1+35,45*3=119,35 кг/кмоль
Mr (CCl4
) = 12+35,45*4=153,8 кг/кмоль
Mr (HCl) = 1+35,45=36,45 кг/кмоль.
1. m (прод) = 60*1000/24=2500кг/ч
2. Найдем массовый процентный состав продуктов:
на 100 моль смеси:
32 моль CH4
m=32*16=512кг/ч
18 моль CH3
Clm = 18*50,45=908,1 кг/ч
25 моль CH2
Cl2
m = 25*84,9=2122,5 кг/ч
20 моль CHCl3
m = 20*119,35=2387 кг/ч
5 моль CCl4
m = 5*153,8=769 кг/ч
всего: 6698,6 кг/ч
W
мас
(СН4
) = 512/6698,6*100% = 7,64%
W
мас
(СН3
Cl) = 908,1/6698,6*100% = 13,56%
W
мас
(CH2
Cl2
) = 2122,5/6698,6*100% = 31,69%
W
мас
(CHCl3
) = 2387/6698,6*100% = 35,63%
W
мас
(CCl4
) = 769/6698,6*100% = 11,48%
Состав продуктов:
mост
(СН4
) =2500*0,0764=191кг/ч
m (СН3
Cl) =2500*0,1356=339кг/ч
m (CH2
Cl2
) =2500*0,3169=792,25кг/ч
m (CHCl3
) =2500*0,3563=890,75кг/ч
m (CCl4
) =2500*0,1148=287кг/ч
Wост
(СН4
) =191/16=11,94кмоль/час
W (СН3
Cl) = 339/50,45=6,72кмоль/час
W (CH2
Cl2
) = 792,25/84,9=9,33кмоль/час
W (CHCl3
) = 890,75/119,35=7,46кмоль/час
W (CCl4
) = 287/153,8=1,87кмоль/час
Прореагировало хлороформа: Wпр
(CHCl3
) = W (CCl4
) = 1.87 кмоль/ч
Образовалось хлороформа: Wо
(CHCl3
) = Wпр
+ W = 1.87 + 7.46 = 9.33 кмоль/ч.
Прореагировало хлористого метилена: Wпр
(CH2
Cl2
) = Wо
(CHCl3
) = 9.33 кмоль/ч.
Образовалось хлористого метилена: Wо
(CH2
Cl2
) = Wпр
+ W = 18.66 кмоль/ч
Прореагировало хлористого метила: Wо
(CH2
Cl2
) = Wо
(CH2
Cl2
) = 18.66 кмоль/ч.
Образовалось хлористого метила: Wо
(CH2
Cl2
) = Wпр
+ W = 18.66 + 6.72 = 25.38 кмоль/ч.
Прореагировало метана: Wпр
(СН4
) = 25.38 кмоль/ч
Всего подано на реакцию: W (СН4
) = Wпр
+ Wо
= 25.38 + 11.94 = 37.32
mо
(СН4
) = 37.32 * 16 = 597.12
Всего подано метана с учетом потерь: mвсего
(СН4
) - 100%,
597.12 - 98.7%
mвсего
(СН4
) = 597.12 * 100/ 98.7 = 604.88 кг/ч
W (СН4
) = 604.88/16 = 37.81 кмоь/ч
mп
(СН4
) = 604.88 - 597.12 = 7.76 кг/ч
W (СН4
) = 7.76,16 = 0.485 кмоь/ч
Количество превращенного кислорода и образовавшегося HCl:
1 р - я:
W1
(Cl2
) = W1
(HCl) = Wо
(СН3
Cl) = 25.38 кмоль/ч
2 р - я:
W2
(Cl2
) = W2
(HCl) = Wо
(CH2
Cl2
) = 18.66 кмоль/ч, 3 р - я:
W3
(Cl2
) = W3
(HCl) = Wо
(CHCl3
) = 9.33 кмоль, 4 р - я:
W4
(Cl2
) = W4
(HCl) = W (CCl4
) = 1.87 кмоь/ч
Wо
(Cl2
) = W3
(HCl) = 55.24 кмоль/ч
m о
(Cl2
) =55.24 * 70.9 = 3916.52 кг/ч
m о
(HCl) = 55.24 * 36.45 = 2013.5 кг/ч
Хлор с учетом избытка:
Wвсего
(Cl2
) = 2.6 * Wвсего
(СН4
) = 98.306 кмоль/ч
mвсего
(Cl2
) = 98.306 * 70.9 = 6969.9 кг/ч
Избыток:
mизб
(Cl2
) = mвсего
(Cl2
) - mо
(О2
) = 6969.9 - 3916.52 = 3053.38 кг/ч
Wизб
(Cl2
) = 3053.38/70.9 = 43.07 кмоль/ч
Подано природного газа (примесь метана):
604.88 - 93%
х - 7%
х = m (пр. газ)
= 604.88 * 7/93 = 45.53 кг/ч
Подано примесей хлора:
6969.9 - 98.5%
х - 1.5%
х = mприм
(Cl2
) = 6969.9 * 1.5/98.5 = 106.14
Пропускная способность установки:
m (CH4
) + m (Cl2
) + m (прим Cl2
) + (прим CH4
) = 7726,45 кг/ч
Конверсия или степень превращения метана:
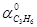 = M (CH4
) подано - M (CH4
) непрореагировало / M (CH4
) подано * 100% = M (CH4
) подано - M (CH4
) непрореагировало / M (CH4
) подано * 100%
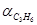 = 604,88 - 198,76/604,88* 100% = 67% = 604,88 - 198,76/604,88* 100% = 67%
Теоретические расходные коэффициенты:
по СН4
:
sт
СН
4
= Mr (CH4
) / Mr (CH3
Cl) = 16/50,45 = 0,317 кг/кг;
sт
СН
4
= Mr (CH4
) / Mr (CH2
Cl2
) = 16/84,9 = 0,188 кг/кг;
sт
СН
4
= Mr (CH4
) / Mr (CHCl3
) = 16/119,35 = 0,134 кг/кг;
sт
СН
4
= Mr (CH4
) / Mr (CCl4
) = 16/153,8 = 0,104 кг/кг;
по Cl2
:
sт
Cl2
= Mr (Cl2
) / Mr (CH3
Cl) = 70,9/50,45 = 1,405 кг/кг.
sт
Cl2
= Mr (Cl2
) / Mr (CH2
Cl2
) = 70,9/84,9 = 0,835 кг/кг.
sт
Cl2
= Mr (Cl2
) / Mr (CHCl3
) = 70,9/119,35 = 0,594 кг/кг.
sт
Cl2
= Mr (Cl2
) / Mr (CCl4
) = 70,9/153,8 = 0,461 кг/кг.
Фактические расходные коэффициенты:
по СН4
:
sф
СН4
= m (CH4
) / m (CH3
Cl) = 604,88/339 = 1,78 кг/кг;
sф
СН4
= m (CH4
) / m (CH2
Cl2
) = 604,88/792,25 = 0,764 кг/кг;
sф
СН4
= m (CH4
) / m (CHCl3
) = 604,88/890,75 = 0,679 кг/кг;
sф
СН4
= m (CH4
) / m (CCl4
) = 604,88/287 = 2,108 кг/кг;
по Cl2
:
sф
Cl
2
= m (Cl2
) / m (CH3
Cl) = 6969,9/339 = 20.56 кг/кг.
sф
Cl
2
= m (Cl2
) / m (CH2
Cl2
) = 6969,9/792,25 = 8,798 кг/кг.
sф
Cl
2
= m (Cl2
) / m (CHCl3
) = 6969,9/890,75 = 7,825 кг/кг.
sф
Cl
2
= m (Cl2
) / m (CCl4
) = 6969,9/287 = 24,285 кг/кг.
Выход на поданное сырье:
Фактический выход CCl4
:
QФ
= m (CCl4
) = 287 кг;
Теоретический выход CCl4
:
Mr (СН4
) ¾ Mr (CCl4
), 16 ¾153,8,m (СН4
) ¾ QТ
; 604,88 ¾QТ
;
QТ
= (604,88 * 153,8) / 16 = 5814,409 кг;
Выход CCl4
:
bCCl
4
= QФ
/ QТ
* 100%= 287 кг / 5814,409 кг * 100% = 4,936%.
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., "Химия", 2005, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: "Химия", 2008, 846 с.
3. Расчеты химико-технологических процессов / Под ред. И.П. Мухленова. Л.: Химия, 2008, 300 с.
|