Сумськийдержавний університет
ЕлИТ факультет
Кафедра прикладної фізики
КУРСОВА РОБОТА
з дисципліни
„ТЕХНОЛОГІЧНІ ОСНОВИ ЕЛЕКТРОНІКИ”
Тема роботи: Загальна характеристика напівпровідникових матеріалів
Виконала: ст. гр. ЕП-81
Копил А.М.
Перевірив: Опанасюк Н.М.
Суми – 2010
ЗМІСТ
Вступ
1. Класифікація напівпровідникових матеріалів
1.1 Германій
1.2 Кремній
1.3 Селен
1.4 Карбід кремнію
1.5 Окисні напівпровідники
1.6 Склоподібні напівпровідники
1.7 Органічні напівпровідники
2. Застосування напівпровідникових матеріалів та вимоги до них
3. Електрофізичні властивості
3.1 Зонна структура напівпровідникових сплавів
3.2 Методи виробництва кремній – германієвих сплавів
3.3 Дислокації в місцях концентраційних флуктуацій
Висновки
Література
ВСТУП
Кількість типів напівпровідникових приладів дуже великий і кожний прилад залежно від принципу дії й необхідних електричних параметрів має потребу в напівпровідниковому матеріалі з певними властивостями.
Швидке зростання виробництва й підвищення надійності виробів електронної техніки залежать не тільки від методів їхнього виготовлення й культури, але й у значній мірі від електрофізичних й інших властивостей застосовуваних матеріалів, які в багатьох випадках визначає параметри напівпровідникових приладів й інтегральних мікросхем і впливають на стабільність їхньої роботи в електричних і теплових режимах, а також при тривалому зберіганні.
Технологія промислового виробництва напівпровідникових приладів й інтегральних мікросхем - складний багатоступінчастий процес, що вимагає застосування на кожному етапі великої кількості специфічних матеріалів з певними властивостями. Так, основою для створення цілого ряду виробів електронної техніки став клас матеріалів - напівпровідники, які мають властивості, необхідні для одержання приладів з високими електричними характеристиками.
Напівпровідникові матеріали, які застосовують для виготовлення різних класів приладів і інтегральних схем, повинні відповідати ряду вимог.
При розгортанні виробництва нових електронних приладів на напівпровідниковій основі віддача від інвестицій носить кумулятивний характер: на кожному етапі впровадження нових технологій неможливе без виробничої бази, створеної раніше. Тому має сенс максимально використовувати наявне устаткування, удосконалюючи його під постійно змінні вимоги ринку. Такий підхід дозволяє без величезних разових вкладень працювати на сучасному рівні, його використовують більшість сучасних фірм, таких як Intel, Sony, Toshiba, IBM. Одна із сторін методу – використання матеріалів з новими властивостями, що дозволяють використовувати для своєї обробки широко поширені, налагоджені і такі, що окупили себе технології.
1. КЛАСИФІКАЦІЯ НАПІВПРОВІДНИКОВИХ МАТЕРІАЛІВ
Напівпровідникові матеріали по хімічному складі можна розділити на прості й складні. Простими напівпровідниковими матеріалами є хімічні елементи: бор В, вуглець СО2
, германій Ge, кремній Si, селенів So, сірка S, сурма Sb, телур Ті й йод J. Найбільш широке застосування як самостійні напівпровідникові матеріали знайшли тільки три з них: германій, кремній і селенів. Інші використаються як легуючі добавки до германія й кремнію або компонентів складних напівпровідникових матеріалів.
У групу складних напівпровідникових матеріалів входять хімічні сполуки, що володіють напівпровідниковими властивостями й включають у себе два, три або більше елементи, наприклад арсенід галію GaAs, телурид вісмуту Bi2
Te3
, силіцид цинку й фосфору ZnSi2
і ін. Напівпровідникові матеріали цієї групи, що складаються із двох елементів, називаються бінарними сполуками й так само, як це прийнято в неорганічній хімії, мають найменування того компонента, у якого металеві властивості виражені слабкіше. Так, бінарні сполуки, що містять миш'як, називають арсенідами, сірку - сульфідами, телур-телуридами, вуглець - карбідами.
Тверді розчини напівпровідникових матеріалів позначають символами вхідних у них елементів з індексами, які визначають атомну частку цих елементів у розчині [1].
До складних напівпровідникових матеріалів відносять також тирит, сіліт, ферит, аморфні стекла й ін.
По ступені досконалості решітки всі кристали можна розділити на ідеальні й реальні, а по сполуці — на стехіометричні й нестехіометричні.
Ідеальні — це кристали, кожний атом яких перебуває у положенні, які характеризують мінімумом потенційної енергії, тобто упорядковано розташований як стосовно своїх найближчих сусідніх атомів, так і до атомів усього об'єму кристала. Стехіометричністю прийнято називати пропорційність масової сполуки вхідних елементів атомним масам у хімічній формулі речовини, що утворить даний, кристал. Якщо масова сполука кристалічної речовини пропорційна його хімічній формулі, кристал має стехіометрична сполука. Таким чином, ідеальні кристали по сполуці є стехіометричні.
Більшість напівпровідникових матеріалів являє собою кристалічні тверді речовини з упорядкованою періодичною структурою. При описі різних структур користуються наступними термінами:
- елементарний осередок, що представляє собою найменший об'єм кристалічної речовини у вигляді паралелепіпеда, переміщаючи який уздовж трьох незалежних напрямків, можна одержати кристал;
- постійна решітки, обумовлена як довжина елементарного осередку уздовж однієї з осей;
- кристалографічні осі, що показують напрямки кристала й визначають ребра елементарного осередку.
Розглянемо основні типи кристалічних решіток.

Рисунок 1 -
Розташування атомів у простій кубічній решітці [1]
Проста кубічна решітка (рис. 1) складається з атомів, що лежать у вершинах куба. Типовим матеріалом з такою структурою є хлористий цезій, у решітці якого послідовно чергуються позитивні іони цезію й негативні іони хлору.
Гранецентрована кубічна решітка (рис. 2, а) більш складніша, чим проста кубічна, тому що в ній атоми розміщені не тільки у вершинах куба, але й у середині кожної грані. Типовими матеріалами з такою структурою є хлористий натрій (рис. 2, б) і алюміній.
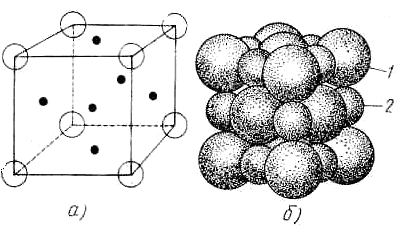
Рисунок 2 - Розташування атомів у гранецентрованій кубічній решітці[1]: а) Загальний вид: 1-хлор; 2-натрій; б) Решітка іонного кристала хлористого натрію
Об’ємноцентрована кубічна решітка складається з атомів, розташованих у кутах і в центрі куба (але не на його гранях). Типовим матеріалом з такою структурою є залізо при нормальній температурі.

Рисунок 3 - Решітка типу алмаза [1]
Крім цих порівняно простих, структур існують більше складні, але також з кубічним елементарним осередком. Найбільш важливої з них є решітка типу алмаза (рис. 3).
Більшість напівпровідникових матеріалів після кристалізації мають решітку типу алмаза. Основну роль у цій решітці грає наявність тетраедричних зв'язків; кожний атом з'єднаний із чотирма найближчими атомами валентними зв'язками. Решітка типу алмаза являє собою модифікацію гранецентрованої кубічної решітки й складається із двох гранецентрованих решіток, зрушених відносно один одного на l
/4 діагоналі осередку. У решітці цього типу ребра елементарного осередку не збігаються з напрямками валентних зв'язків[1] .
1.1 Германій
Германій Ge ставиться до IV групи періодичної системи елементів. Атомна маса 72,59. Температура плавлення 937° С.
Зміст германія в земній корі невелике й становить близько 0,001%. У незначних кількостях германій утримується в цинкових рудах, вугільного пилу, золі, сажі й морській воді. Германій майже не має своїх руд. Єдина руда германія – германіт – містить набагато більше міді, заліза й цинку, чим германія. Видобуток германія – складний технологічний процес.
В твердому стані германій — типовий ковалентний кристалічний матеріал, що володіє характерним блиском. Механічна обробка германія утруднена, а на звичайних токарських, свердлильних і фрезерних верстатах взагалі неможлива, тому що це дуже твердий тендітний матеріал.
Кристалічний германій хімічно стійкий на повітрі при кімнатній температурі; при температурі вище 600° С окисляється до двоокису германія Ge02
. Вода на германій не діє, у соляній НС1, азотній HN03
кислотах германій не розчиняється. Активно розчиняють германій при кімнатній температурі царська горілка (суміш соляної й азотної кислот), розчин перекису водню, різні травники (суміші кислот). У розчинах киплячих лугів КІН і NaOH германій добре розчиняється, а в холодні мало розчинний. Додавання в розчини лугів перекису водню підвищує розчинність германія. У розплавлених лугах германій швидко розчиняється з утворенням розчинних у воді германітов. Розплавлені вуглекислий і азотнокислий натрій також швидко розчиняють германій з виділенням відповідного газу.
В напівпровідниковій технології широко використають кварцові й графітові тиглі, касети, контейнери й інші вироби.
Основними сполуками германія є двоокис, моноокис і тетрахлорид германія.
Двоокис германія Ge02
— аморфна або кристалічна речовина. Аморфну (склоподібна) модифікацію одержують швидким охолодженням розплавленого двоокису германія. У присутності каталізаторів склоподібна модифікація переходить у кристалічну тетрагональну, котра потім перетворюється в гексагональну. У більшості випадків двоокис, що утвориться в багатьох процесах, германія являє собою суміш аморфної й гексагональної модифікацій [1].
Двоокис германія розчиняється в соляний і сарною кислотах, а також у лузі.
Двоокис германія — порошок білих кольорів, використовуваний для виробництва напівпровідникового полікристалічного й монокристалічного германія, випускають трьох груп: ГД1, ГД2 і ГДЗ, які відрізняються друг від друга змістом основної речовини й домішок.
Моноокис германія Ge утворюються в результаті диспропорційності або в процесі відновлення двоокису германія. У деяких випадках вона утвориться в розчинах. Моноокис германія має аморфну структуру. У воді моноокис германія практично не розчиняється, а в сарною й соляний кислотах розчиняється повільно.
Тетрахлорид германія GeCl4
утвориться в результаті хлорування й солянокислої обробки германієвих продуктів. Твердий тетрахлорид германія існує у двох модифікаціях.
Виготовлення чистого монокристалічного германія складається з наступних основних процесів: одержання тетрахлориду германія і його очищення, гідролізу тетрахлориду германія й одержання з нього двоокису германія, відновлення двоокису германія воднем і одержання полікристалічного злитка, очищення полікристалічного злитка від домішок зонною плавкою, вирощування з розплавленого полікристалічного германія злитка монокристала германія.
Вирощують монокристалічні злитки по методу Чохральского, для чого германій завантажують у графітовий тигель і нагрівають у вакуумі до температури, при якій він переходить у розплав. Потім у тигель до зіткнення з поверхнею розплаву опускають запал (стрижень) з монокристалічного германія й після невеликої витримки в розплаві починають її повільно піднімати з розплаву, одночасно обертаючи.
У міру підйому на торцевій поверхні запалу кристалізується шар розплаву, на якому у свою чергу кристалізується новий шар розплаву. У такий спосіб створюється злиток германія з монокристалічною структурою. Кристалічна структура вирощеного злитка повторює структуру запалу.
Для виробництва різноманітних напівпровідникових приладів необхідний германій електронного й діркового типів провідності, що володіє певним питомим опором. Тип провідності й питомий опір германія визначаються кількістю уведених у вихідний матеріал акцепторних і донорних домішок (рис. 4).

Рисунок 4 -
Залежність питомого опору германія від концентрації акцепторних і донорних домішок [2]
Процес введення домішок називають легуванням. Легуючі домішки звичайно вводять у певних кількостях у робочий об’єм розплавленого полікристалічного германія перед вирощуванням монокристалів.
Використання монокристалічних злитків у технології виготовлення напівпровідникових приладів і інтегральних схем сполучено з більшими втратами германія при механічній обробці (різання, шліфування, полірування). Тому в цей час широке застосування знаходять напівпровідникові монокристалічні плівки германія. Види тонких шарів на підкладки з різних матеріалів (кварцу, сапфіра, германія, кремнію), що одержали назву епітаксій них [2].
1.2 Кремній
Кремній Si – елемент IV групи Періодичної системи елементів; після кисню – найпоширеніший елемент у природі: він становить приблизно 1\4 маси земної кори. Численні сполуки кремнію входять до більшості гірських порід і мінералів. Пісок і глина, що утворять мінеральну частину ґрунту, також являють собою сполуки кремнію. Найпоширенішою сполукою цього елемента є двоокис кремнію SiО2
. Вільний двоокис кремнію зустрічається – головним чином у вигляді мінералу кварцу. Кремній у вільному стані в природі не зустрічається.
Кремній, як і германій, кристалізується в складній кубічній просторовій решітці типу алмаза. Кристалічний кремній – темно-сіра тверда й тендітна речовина з металевим блиском, хімічно досить інертне.
Кремній добре розчинний у багатьох розплавлених металах. При кімнатній температурі він хімічно стійкий. У воді не розчинний. Не реагує з багатьма кислотами в будь-якій концентрації. Однак добре розчиняється в суміші плавикової й азотної кислот. Менш інтенсивно кремній розчиняється в азотній кислоті з невеликими добавками брому або перекису водню. Кремній добре розчиняється в киплячих лугах; невеликі добавки перекису водню до киплячого водяного розчину лугу прискорюють його розчинення. Ще більш інтенсивно кремній розчиняється в розплавлених лугах.
Основними сполуками, які використаються в напівпровідниковому виробництві для одержання полікристалічного й монокристалічного кремнію, є двоокис кремнію, моноокис кремнію, тетрахлорид кремнію, полікристалічний, монокристалічний і т.д [2].
Двоокис кремнію Si2
– кварцове скло, по зовнішньому вигляді мало відрізняється від звичайного скла й має високу хімічну стійкість до багатьом кислотам, за винятком плавикової, котра, взаємодіючи із кварцом, утворить кремнієву кислоту.
Двоокис кремнію реагує з розплавленими металами: літієм, натрієм, калієм, кальцієм, стронцієм, барієм, магнієм, алюмінієм, лантаном, церієм, кремнієм і марганцем. При високих температурах двоокис кремнію взаємодіє із твердими елементами: залізом, титаном, танталом, вольфрамом і бором, а також з газоподібним фтором.
При сплавці двоокису кремнію одержують кварцове скло, що широко застосовують при виробництві напівпровідникових матеріалів для виготовлення робочих камер, ампул і касет.
Моноокис кремнію Si у природі не зустрічається й може бути отримана відновленням двоокису при 13,50°С кремнієм або при 1500°С вуглецем. Моноокис кремнію при кімнатній температурі являє собою аморфна речовина у вигляді порошку, гранул або спечених шматочків від бежевого до чорного квітів. Навіть при високих температурах моноокис кремнію не проводить електричний струм, тому неї використають в інтегральній мікроплівковій технології для виготовлення ізоляційних покриттів, діелектричних і плівок, що просвітлюють. Моноокис кремнію знаходить застосування також світлотехнічний і оптичної промисловості.
Випускається моноокис кремнію двох категорій. Моно окис першої категорії використають для напилювання діелектричних плечей нок і шарів плівкових конденсаторів, а також для одержання ізоляційних покриттів інтегральних схем, а другої категорії – для утворення захисних шарів на напівпровідникових кристалах.
Тетрахлорид кремнію SiCl4
одержують хлоруванням при 250—600° С технічного кремнію або одного з його сплавів – феросіліція, що містить 60—90% кремнію. При кімнатній температурі тетрахлорид кремнію являє собою прозору безбарвну рідину. Тетрахлорид кремнію добре змішується з органічними речовинами: ефіром, хлороформом, бензолом і бензином. При взаємодії з водою й у вологому повітрі він розкладається на хлористий водень і силікагель.
Полікристалічний кремній одержують двома основними способами: водневим відновленням з галоїдних сполук (хлорсиланів) і термічним розкладанням гідридів (моносилана) і випускають у вигляді стрижнів, діаметр яких залежить від подальшого застосування. Стрижні великого діаметра (до 100 мм) використають для мірних завантажень у тиглі установок при вирощуванні монокристалічного кремнію по методу Чохральского, а малого (до 40 мм) – як заготівлі для бестигельної зонної плавки.
Монокристалічний кремній одержують із полікристалічного вирощуванням з розплаву по методу Чохральского або бестигельною зонною плавкою. Перший метод застосовують, як правило, для одержання низькоомних злитків з питомим опором, що не перевищує 250 Ом-см. Отримані цим методом злитки мають великий діаметр (до 60-80 мм). Другий метод використають для одержання високоомних монокристалічних злитків з питомим опором до 2000 Ом-см. Діаметр цих злитків звичайно менше (до 30 мм).
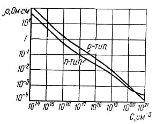
Рисунок 5 - Залежність питомого опору кремнію від концентрації акцепторних і донорних домішок [2]
Промисловість випускає різні марки монокристалічного кремнію, тому що в цей час він, володіючи рядом спеціальних властивостей, займає провідне місце серед інших матеріалів, застосовуваних для виготовлення напівпровідникових приладів. Кремнієві прилади мають малі зворотні струми, працюють при підвищених температурах, допускають високі питомі навантаження. Питомий опір кремнію, як і германія, залежить від концентрації акцепторних і донорних домішок (рис. 5).
1.3 Селен
Селен Se – елемент VI групи Періодичної системи елементів Д. И. Менделєєва широко розповсюджений у земній корі, але в малих концентраціях. Зміст його не перевищує 6• 10-5
% ,(по масі) і приблизно дорівнює змісту в земній корі сурми, кадмію, срібла. Однак власних руд промислового типу мінерали селен не утворять, тому його відносять до числа рідких неуважних елементів. Селен – супутник сульфідних руд важких кольорових металів. Основними джерелами його одержання служать анодні шлаки мідних і, нікелевих електролітних виробництв.
Атомна маса 78,96. Існує кілька різновидів селен різних кольорів аморфного й кристалічного (рис. 6) будови.
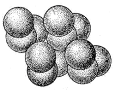
Рисунок 6 - Структура селена [1]
По хімічних властивостях селен близький до сірки, але менш активний. При кімнатній температурі він не взаємодіє з киснем повітря, а при нагріванні на повітрі згоряє з утворенням двоокису селен.. Соляна й розведена сірчана кислоти на селен не діють. Азотна кислота окисляє його до двоокису селен, а лугу розчиняють із утворенням солей.
Селен при температурі 200° С реагує з воднем з утворенням селенистого водню, з киснем утворить ряд сполук (Se, Se02
, Se03
), а з галогенами — кілька сполук типу SeCl4
. Селен утворює сполуки із сіркою, азотом, фосфором і багатьма металами.
Залежно від способу одержання, а також режиму проведення процесу (температури, тиску, швидкості охолодження розплаву) селен може існувати в чотирьох алотропічних формах: склоподібний, аморфної, моноклінної й гексагональної [4].
Склоподібний селен одержують швидким охолодженням розплаву від температури вище крапки плавлення. Селен такої модифікації утвориться при виливанні розплаву на охолоджувану водою металеву пластину або в холодну воду. У цьому випадку одержують селен у вигляді пластинок або дрібних дробинок. Тонкі плівки склоподібного селену одержують конденсацією його пар у вакуумі.
Склоподібний селен знайшов широке застосування у фотографічному процесі ксерографії.
Аморфний селен буває різного фарбування, що обумовлюється різним ступенем дисперсності колоїдних часток, що випадають із розведеного розчину (селенідів) солей селен при додаванні відновлювачів. Так, при відновленні розчинів селенідів при температурах нижче 70° С утвориться аморфна модифікація селен червоних кольорів.
Моноклінний селен одержують обробкою тонко здрібненого селен сірковуглецем. Із що утвориться насиченого розчину темно-жовтогарячих кольорів повільним випаром одержують кристали селен . моноклінної структури.
Гексагональний селен – найбільш важлива модифікація цього матеріалу – застосовується для виготовлення напівпровідникових приладів. Це сама стійка форма, що одержала назву сірого селен, що має структуру у вигляді зиґзаґоподібних гвинтових ланцюгів.
1.4 Карбід кремнію
Карбід кремнію Si — сполука кремнію й вуглецю елементів IV групи. В природі цей матеріал зустрічається вкрай рідко в обмежених кількостях. Карбід кремнію існує у двох модифікаціях: кубічної й гексагональної. Гексагональна модифікація, що одержала назву α – SiС, утвориться при високих температурах і володіє поруч коштовних електрофізичних властивостей.
По типі хімічного зв’язку карбід кремнію ставиться до ковалентних кристалів. Залежно від сировини й технології одержання кристали карбіду кремнію мають найрізноманітніше фарбування: білу, жовту, сіру, зелену й чорну. Домішки можуть бути як чужорідними, тобто включеннями в кристалічну решітку карбіду кремнію чужорідних елементів, так і власними. Кристали карбіду кремнію мають незначні розміри.
Електропровідність кристалів карбіду кремнію визначається кількістю й типом домішки. Домішки елементів V групи (азоту, фосфору, миш’яку, сурми, вісмуту) дають карбіду кремнію зелене фарбування й електропровідність n-типу, а елементів II (кальцію, магнію) і III (бору, алюмінію, галію, індію) груп — чорне фарбування й електропровідність р-типа.
Карбід кремнію має високу хімічну стійкість: при нагріванні на повітрі він починає помітно окислятися при температурах вище 800° С; він стійкий до більшості кислот, за винятком суміші азотної й плавикової кислот, але бурхливо розчиняється в розплавлених лугах [3].
Карбід кремнію, використовуваний у напівпровідниковому виробництві для виготовлення світодіодів, являє собою поліровані із двох сторін монокристали гексагональної модифікації політипів 6Н и 15R. Монокристали карбіду кремнію легуються азотом і мають електронний тип провідності.
Карбід кремнію завдяки його високій твердості (по твердості він небагато уступає алмазу) використають для механічної, обробки різних матеріалів. Із суміші порошку карбіду кремнію, елементарного кремнію й вуглецю випалом в атмосфері азоту одержують сіліт, що застосовують для виготовлення високотемпературних нагрівачів.
На основі карбіду кремнію одержують різні матеріали. Наприклад, при випалі карбіду кремнію із глинистим зв’язуванням одержують нелінійний матеріал – тирит, а при випалі його з ультрапорцеляновим зв’язуванням – нелінійний матеріал – летін.
Окісними напівпровідниками прийнято називати бінарні сполуки полярного типу, у яких ясно розрізняються металевий і металоїдний. До цього класу напівпровідникових матеріалів ставляться такі речовини, як Сu2
О, ZnO, CdO, NiO, Fe2
03
. На (рис. 7) і (рис. 8) показані структури закису міді й окиси цинку.
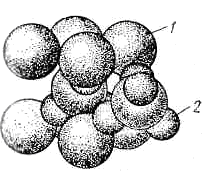
Рисунок 7 - Структура закису міді [1]: 1 – кисень; 2 – мідь
Перевага окісних напівпровідників полягає в тому, що технологія їхнього виготовлення порівняно проста. Ці матеріали використають у полікристалічній формі у вигляді зразків, які легко приготувати методами керамічної технології.

Рисунок 8 - Структура окису цинку[1]: а) розташування атомів; б) кристалічна решітка
Напівпровідниковими властивостями, володіють не всі окисли металів, а тільки, ті, у яких іон металу ставиться до елемента перехідного ряду періодичної таблиці, наприклад Zn, Си, Ni, Co, Fe, Mn, Сг, V, Ti.
Найбільше застосування серед окісних напівпровідників одержала закис міді СиО – матеріал жовтий або червоний кольори [4].
Окісні напівпровідники широко застосовують для виготовлення термо- і фоторезисторів.
1.6 Склоподібні напівпровідники
Склоподібні напівпровідники - новий клас напівпровідникових матеріалів, які характеризуються розорієнтованістю структури й ненасичених хімічних зв'язків.
Склоподібність - це особливий вид аморфної речовини. Така речовина має механічні властивості, подібними з механічними властивостями кристалічного твердого тіла, і може після розплавлювання вертатися при деякому заданому режимі охолодження у вихідний стан. Для склоподібного напівпровідникового матеріалу характерним є наявність просторової решітки, у якій крім ковалентно зв'язаних атомів є полярні угруповання іонів. У таких матеріалах зв'язок між групами атомів і іонів здійснюється за рахунок короткодійсних ковалентних ван-дер-ваальсових сил. Цим пояснюється підвищена енергія активації зсуву часток у склоподібним матеріалі.
Одним з важливих відмінностей склоподібних напівпровідникових матеріалів від кристалічних є відсутність у них примісної провідності, тобто домішки в склоподібних напівпровідникових матеріалах не можуть бути ні донорами, ні акцепторами.
Склоподібні напівпровідникові матеріали поки мало вивчені й не мають широкого промислового застосування. Як приклад розглянемо декілька склоподібних напівпровідникових матеріалів.
Матеріал типу Gaх
AsSeу
— склоподібний напівпровідник, властивості якого визначаються кількісною сполукою вхідних у нього елементів. Властивості арсенідо - селенідних стекол змінюються при введенні в них галію до 3 ат. %. При введенні галію в більших кількостях зменшується швидкість розчинення й електропровідність напівпровідникового матеріалу [5].
Матеріал типу Tlх
AsSу
— склоподібний напівпровідник, що може містити в собі до 30 ат. % талія. Термічна стійкість і мікротвердість матеріалу помітно зменшуються в міру збільшення кількості вмісту в його сполуку талія.
Матеріал типу AsSeх
Teу
— склоподібний напівпровідник, що містить у собі до 40 ат.% телуру. При збільшенні змісту телуру відбувається зниження температури розм'якшення матеріалу з 400 до 100° С.
Матеріал типу AsSeх
Iу
— склоподібний напівпровідник, що включає, у себе до 15 ат. % йода. Температура розм'якшення матеріалу залежно від його сполуки може змінюватися від 20 до 160° С. Найбільш стійка сполука As2
Se3
—Asl3
.
1.7 Органічні напівпровідники
Органічні напівпровідникові матеріали відрізняються від інших напівпровідників як по властивостях, так і методам одержання .і можливим областям застосування. До найбільш вивчених органічних напівпровідникових матеріалів ставляться антрацен, нафталін, фталоціанін, пірин, тефеніл і ін., ширина забороненої зони яких коливається від 0,6 до 3,7 еВ, а питомий опір — від 10б
до 1015
Ом-см.
Напівпровідникові властивості в органічних сполук (антрацену) були відкриті в 1906 р. Спочатку була виявлена фотопровідність барвників. Далі було знайдено, що провідність інших органічних сполук (фталоціанінові) змінюється з підвищенням температури, як і в неорганічних напівпровідників. У цей час антрацен знаходить широке застосування як напівпровідниковий матеріал як кристалічні лічильники в ядерній фізиці.
Поряд із зазначеними органічними напівпровідниковими матеріалами відоме широке коло хімічних сполук, у яких електропровідність здійснюється електронами або дірками. Питомий опір цих сполук лежить у межах від 10 до 1016
Ом-см, тобто в інтервалі електропровідності звичайних елементарних напівпровідників і ізоляторів. З ростом температури Їхня електропровідність також зростає; у деяких з них проявляється ефект Холу й фотоефект [6].
Разом з тим органічні напівпровідники багато в чому відрізняються від звичайних напівпровідників (германія, кремнію). Так, рухливість носіїв заряду в. їх на кілька порядків нижче, ніж у германія. Добре вираженої примісної провідності при низьких температурах у багатьох органічних напівпровідників не виявляється. Органічні напівпровідники становлять значний інтерес, тому що напівпровідникові властивості в них сполучаються з еластичністю, здатністю до утворення плівок і волокон, міцністю й ін.
Для твердих органічних напівпровідникових матеріалів характерна наявність у їхній структурі ароматичних кілець зі сполученими зв'язками. Типовим представником матеріалів з такою будовою є антрацен, що містить три бензольних кільця. Процес Провідності органічних напівпровідників визначається рухом носіїв зарядів усередині молекули речовини і їхніх переходів від молекули до молекули.
Домішки в органічних напівпровідниках у порівнянні з елементарними напівпровідниками відіграють другорядну роль. При введенні в органічних напівпровідників у якості домішки кисню може відбуватися як збільшення, так і зменшення електропровідності вихідного матеріалу, що обумовлено особливостями будови його молекул. Крім того, органічні напівпровідники мають внутрішній і зовнішній фотоефект. Фотопровідність органічних напівпровідників зростає зі збільшенням освітленості й температури й має певну спектральну характеристику.
Всі органічні тверді напівпровідникові матеріали можна розділити на п'ять груп: молекулярні кристали, молекулярні комплекси, металоорганічні комплекси, полімерні напівпровідники й пігменти.
Молекулярні кристали - поліциклічні низькомолекулярні ароматичні сполуки, відмінними рисами яких є їх кристалічністю і наявність ароматичних кілець із системою сполучених подвійних зв'язків. До таких матеріалів ставляться антрацен С14
Н10
, нафталін С10
Н8
, фенатрен, перилен,
коронен, віолантрен і фталоціаніни. Серед речовин цього класу багато з них володіє дірковою провідністю й .характеризуються енергією активації порядку 1—3 еВ, низькою рухливістю носіїв заряду і питомим опором.
Молекулярні комплекси — поліциклічні низькомолекулярні сполуки, що характеризуються електронною взаємодією між молекулами речовини. Молекулярні комплекси володіють, як правило, значно більшою електропровідністю, чим молекулярні кристали, і являють собою сполуки донорно-акцепторного типу. Одна молекула такої речовини здатна приєднувати електрон, а друга - його віддавати. Тому такі сполуки називають також комплексами з передачею заряду. При передачі заряду виникає іонний зв'язок між молекулами [7].
Металоорганічні комплекси — низькомолекулярні речовини, молекула яких містить у центрі атом металу. Прикладом таких речовин може служити фталоціанін міді. Такі матеріали мають енергію активації носіїв заряду більше
1 еВ і відрізняються щодо високою рухливістю носіїв зарядів, що досягає 10 см2
/с. Основними носіями є дірки.
Полімерні напівпровідники — матеріали, відмінними рисами яких у порівнянні з низькомолекулярними є довгі ланцюги сполучення в макромолекулах і більше складна фізико-хімічна будова. З подовженням ланцюгового сполучення підвищується електропровідність і знижується енергія активації.
Пігменти - барвники, що володіють напівпровідниковими властивостями. Прикладом можуть служити індиго, еозин, пінаціонол, радофлавін, радамін, тріпафлавін і ін. Є також природні пігменти: хлорофіл, каротин і ін. Серед пігментів зустрічаються як електронні, так і діркові напівпровідники: катіонні пігменти мають провідність n-типу, аніонні - р-типа. Для пігментів характерна висока енергія забороненої зони й низька електропровідність.
Основним критерієм використання органічних напівпровідникових матеріалів є їхня чистота. Тому питання очищення цих матеріалів від домішок дуже важливий. Звичайно для очищення органічних речовин використають чотири методи: кристалізацію з розчину, сублімацію, хроматографію з розчину або пари й зонне очищення. Як вихідні матеріали, використовуваних для виготовлення різних приладів, застосовують як монокристалічні, так і полікристалічні зразки органічних напівпровідників.
Органічні напівпровідники знаходять застосування в окремих областях електроніки й радіотехніки. Так, їх використають при виготовленні терморезисторів з високою температурною стабільністю п'єзоелементів, резонансних контурів в інтегральних схемах, радіаційних дозиметрів, детекторів інфрачервоного випромінювання, фоторезисторів, квантових генераторів, й іншими приладами. До переваг різних типів приладів і інтегральних схем, виготовлених на основі органічних напівпровідникових матеріалів, ставляться висока механічна й кліматична стійкість в умовах тропічного клімату й при підвищених вібраційних і ударних навантаженнях.
У цей час ведуться роботи з одержання нових видів органічних напівпровідникових матеріалів і дослідженню їх електрофізичні властивостей. Відкриття раніше невідомих властивостей цих матеріалів дозволить ще ширше використати їх у народному господарстві.
2. ЗАСТОСУВАННЯ НАПІВПРОВІДНИКОВИХ МАТЕРІАЛІВ ТА ВИМОГИ ДО НИХ
Більшість приладів виготовляють із напівпровідникових пластин або кристалів, вирізаних з монокристалічних злитків. Монокристалічні злитки круглого перетину одержують методом спрямованої кристалізації розплавів. Останнім часом широке застосування знаходять також монокристалічні епітаксійні плівки.
Легуючі домішки повинні бути розподілені рівномірно але всьому об'єму монокристалічного злитка, що забезпечує однакові параметри всієї партії приладів, виготовлених з одного злитка напівпровідникового матеріалу, і дозволяє налагодити масовий випуск однотипних приладів.
Більшість напівпровідникових матеріалів, такі, як германій, кремній, карбід кремнію й ін., мають високу стійкість до впливу навколишнього середовища. Однак деякі напівпровідникові сполуки типу А111
—Bv
(антимонід, арсенід і фосфід алюмінію) не стійки у вологій атмосфері, тобто вони гідролізуються, що є серйозною перешкодою для їхнього масового застосування.
Вимоги до температуростійкості диктуються максимальними й мінімальними робочими температурами експлуатації напівпровідникових діодів, транзисторів і інтегральних схем. Верхня межа робітників, температур напівпровідникових матеріалів залежить від ширини їхньої забороненої зони. Нижня межа робочих температур напівпровідникових матеріалів визначається енергією іонізації легуючих домішок.
Верхня межа робочої частоти напівпровідникових діодів, транзисторів і інтегральних схем визначається рухливістю електронів і дірок, а також діелектричною проникністю матеріалів, з яких вони виконані. Для напівпровідникового матеріалу певного типу провідності, рухливість має максимальне значення в некомпенсованому матеріалі. Тому матеріал, застосовуваний для виготовлення приладів, повинен мати яскраво вираженими електронними або дірковими властивості.
Більшість напівпровідникових приладів, за винятком імпульсних, виготовляють із матеріалу з досить більшим часом життя неосновних носіїв зарядів, а імпульсні напівпровідникові діоди - з матеріалу з малим часом життя неосновних носіїв зарядів. Для приладів, що використають ефект Холу, найкраще підходять напівпровідникові матеріали з високою рухливістю й малою концентрацією носіїв заряду, що забезпечують велику холівську напругу. Для виготовлення магнітоелектричних приладів використають арсенід індію й телурид ртуті.
Термоелектричні прилади виготовляють із напівпровідникових матеріалів, що забезпечують максимальний коефіцієнт ефективності, тобто які мають високу і низьку теплопровідність. Такими властивостями володіють антимонід цинку телурид і селенід вісмуту [7].
При виборі матеріалів для фотоприладів керуються в першу чергу спектральною чутливістю напівпровідникового матеріалу. Зменшують інерційність фотоприладів застосуванням матеріалів з малим часом життя неосновних носіїв заряду. При виготовленні фотоперетворювачів (сонячних батарей) особливе значення має ширина забороненої зони, що визначає ефективність роботи цих приладів.
Напівпровідникові матеріали для лазерів повинні мати зроблену структуру, тому що сторонні домішки й дефекти приводять до появи усередині забороненої зони проміжних енергетичних рівнів. Крім того, ці матеріали повинні мати високу рухливість носіїв заряду при даній їхній концентрації.
Люмінесцентні діоди виготовляють із напівпровідників, що володіють здатністю до випромінювальної рекомбінації: арсенідів і фосфідів індію й галію, карбіду кремнію, сульфіду цинку й ін. Основний параметр цих приладів - довжина хвилі випромінювання залежить від властивостей вихідного, напівпровідникового матеріалу й, зокрема, від ширини забороненої зони.
3. ЕЛЕКТРОФІЗИЧНІ ВЛАСТИВОСТІ
3.1 Зонна структура напівпровідникових сплавів
На зонній діаграмі бінарної системи Ge-xSi-x в області Ge0.85-Si0.15 виявляється злам. Це було виявлено ще в 1954 році [4], але отримало пояснення пізніше, з розвитком математичного апарату фізики твердого тіла.
Ширина забороненої зони в германії визначається енергетичною щілиною в забороненій зоні між мінімумом у краю зони провідності в напрямі [111] і максимумом валентної зони в крапці [000]. При додаванні кремнію в германій щілина, що визначає ширину забороненої зони, збільшується практично лінійно. Швидкість підйому мінімумів, лежачих в напрямі [111], більше, ніж швидкість пониження мінімумів, лежачих в напрямі [100].
При 15% Si в розчині обидва типи мінімумів (уподовж [100] в кремнії і уподовж [111] (у германії) однаково віддалені від максимуму валентної зони в крапці [000]. Таким чином, в розчинах при концентрації кремнію нижче 15% ширина забороненої зони сплаву визначається мінімумом, лежачим в напрямі [111], а вище за це значення концентрацій - в напрямі [100] [3].
З цього виходить, що при виготовленні електронних приладів бажано уникати використання сплавів складу Si0.15Ge0.85, оскільки мабуть поява в матеріалі (в результаті обробки і пов'язаних з нею процесів) острівців з параметрами, що відрізняються від параметрів решти об'єму матеріалу. Особливо це може бути помітно при створенні елементів на пластинах, вирощених методом Чохральського, як буде показано нижче.
3.2 Методи виробництва кремній германієвих сплавів
Виробництво Si1-xGex сплавів і структур можливо різними методами, такими як кристалізація з розплавів, метод БЗП (бестигельной зонної плавки), жидкофазная эпитаксия і ін. Технології виробництва, як правило, не освітлюють у пресі, але із статей можна прослідкувати основні джерела матеріалів.
Наприклад:
- монокристали Si1-xGex p-типа провідності вирощувалися в інституті зростання кристалів (Берлін, Німеччина) методом Чохральського [4];
- монокристали твердих розчинів Si1-xGex були вирощені методом електронно-променевої бестигельной зонної плавки [5];
- тверді розчини Si1-xGex вирощені методом ЖФЕ на монокристалічних підкладках мазкі КЕФ-5 з питомим опором і кристалографічною орієнтацією (111) [6].
Перш за все це означає, що розвернути виробництво кремній-германієвих злитків і пластин на наявному в Росії парку устаткування – це питання невеликого часу. Для цих матеріалів можливо використовувати наявні установки зростання, різкі шліфовки епітаксіального нарощування і тому подібне без змін конструкції і, можливо, без значного втручання в технології, що діють.
3.3 Дислокації в місцях концентраційних флуктуацій
У монокристалах германієвих сплавів, вирощених з розплаву, виявлені ряди краєвих дислокації, розташованих паралельно тим послідовним положенням, які приймає поверхня розділу жидкость-твердая фаза в процесі твердіння [7]. Дислокації, мабуть, утворюються тому, що вони знижують енергію пружної напруги між сусідніми шарами кристала, що мають різні параметри грат.
Ямки розташовуються строго паралельно смугам флуктуації складу, з чого зрозуміла причина їх виникнення. Ряди виявляються парами, що пов'язане із смужчатістю складу сплаву, що формується при зростанні злитка; при цьому вони з'являються тільки уздовж деяких смуг, це обумовлено тим, що дислокації утворюються лише тоді, коли градієнт концентрації досягає критичного значення, пов'язаного з пружною напругою, необхідною для утворення дислокації. Ці дислокації можуть значно знижувати час життя носіїв заряду в германієво-кремнієвих сплавах і негативно позначатися на параметрах приладів, виготовлених з таких сплавів.
ВИСНОВКИ
1 Швидке зростання виробництва й підвищення надійності виробів електронної техніки залежать не тільки від методів їхнього виготовлення й культури, але й у значній мірі від електрофізичних й інших властивостей застосовуваних матеріалів, які в багатьох випадках визначає параметри напівпровідникових приладів й інтегральних мікросхем і впливають на стабільність їхньої роботи в електричних і теплових режимах, а також при тривалому зберіганні.
2 Властивості напівпровідникових матеріалів дозволяють отримувати монокристали із заданими параметрами шляхом апроксимації залежності властивостей від складу. Можливе використання установок, що діють, для всіх етапів виробництва злитків, пластин і епітаксіальних композицій.
3 Хороші частотні властивості приладів, виготовлених за кремній - германієвою технологією, дозволяють застосовувати їх в області ВЧ і СВЧ частот замість приладів на арсеніді галію.
4 Широке застосування знаходять напівпровідникові монокристалічні плівки германія. Використання монокристалічних плівок у технології виготовлення напівпровідникових приладів і ІМС сполучено з більшими втратами германія при механічній обробці (різання, шліфування, полірування).
ЛІТЕРАТУРА
1 Курносов А.И. Материалы для полупроводниковых приборов и интегральных микросхем. – М.: Высш. школа, 1989. – 327 с.
2 Ефимов И.Е., Козырь И.Я.. Основы микроэлектроники. – Москва: Высшая школа, 1983. –384с .
3 Степаненко И.П. Основы микроэлектроники. – М.: Советское радио, 1986. – 424с.
4 Методичні вказівки до лабораторних робіт із курсу «Технологічні основи електроніки». І.Ю. Проценко, А.М. Черноус, Л.В. Однодворець. Суми: СумДУ, 1988. – 43с.
5 http://mogilev.rlst.org.by/bulletin203_markova.htm
6 http://www.phys.msu.ru/rus/struct/div/div-geophys
7 Физическое металоведение . Вып. I. Атомное строение металов и сплавов /Под ред. Новикова И.И.- Москва: Мир, 1967. – 335с.
8 Закалик Л.І., Ткачук Р.А. Основи мікроелектроніки. – Тернопіль: ТДТУ ім.. І.Пулюя, 1998. – 352 с.
|