ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО« ОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Ф.М. Достоевского»
КАФЕДРА НЕОРГАНИЧЕСКОЙ ХИМИИ
Дипломная работа
Особенности сорбционного извлечения палладия (II) из хлоридных растворов волокнами ЦМ-А2, Мтилон-Т и ВАГ
Выполнил:
студент гр. хх-001
Михеев М.С.
Омск-2010
Содержание
Введение
1. Литературный обзор
1.1 Ионообменное равновесие
1.2 Кинетика ионного обмена
1.3 Преимущества волокнистых хелатообразующих сорбентов
1.4 Сорбционное извлечение платиновых металлов
1.4.1 Сорбенты применяемые для извлечения платиновых металлов
1.4.2 Изучение кинетики сорбции палладия на комплексообразующих сорбентах
1.4.3 Формы нахождения палладия в растворе
2. Экспериментальная часть
2.1 Техника безопасности при выполнении работы
2.1.1 Правила работы с едкими веществами (кислоты, щелочи)
2.1.2 Правила безопасной работы с электрооборудованием и электроприборами
2.2 Методика анализа
2.2.1 Спектрофотометрическое определение концентрации палладия с нитрозо-R-солью
2.3 Методики эксперимента
2.3.1 Подготовка волокна
2.3.2 Определение обменной емкости ионита в статических условиях
2.4 Результаты и их обсуждение
2.4.1 Изучение зависимости сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ от концентрации металла в равновесном растворе
2.4.2 Расчет термодинамических характеристик процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ
2.4.3 Изучение зависимости сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ от времени.
2.4.4 Расчет энергии активации процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ
2.4.5 Изучение возможности регенерации волокон ЦМ-А2, Мтилон-Т и ВАГ
Выводы
Литература
Приложение 1
Приложение 2
Приложение 3
Приложение 4
Введение
Одним из перспективных направлений в комплексном решении экологических проблем является разработка высокоэффективных процессов очистки промышленных газовоздушных выбросов, сточных вод и средств индивидуальной защиты органов дыхания. Важную роль в создании этих процессов играют хемосорбционные волокнистые материалы, обладающие более развитой удельной поверхностью, чем у гранулированных сорбентов, обеспечивающей высокие кинетические параметры процессов сорбции. Изучение механизма сорбции платиновых металлов на ионитах с различными функциональными группами является актуальным и этому вопросу в последнее время уделяется особое внимание.
В литературе есть сообщения об изучении механизма сорбции платиновых металлов на азот и серосодержащих волокнах. Однако публикаций об исследовании механизма сорбции платиновых металлов на комплексообразующих сорбентах сравнительно невелико.
Целью данной работы является изучение особенностей сорбционного извлечения палладия (II) из хлоридных растворов волокнами ЦМ-А2, Мтилон-Т и ВАГ. Определение лимитирующей стадии процесса сорбции палладия волокнами, а так же установление механизма сорбции хлорокомплексов палладия (II) на данных волокнах, влияние температуры и способов регенерации сорбентов.
1. Литературный обзор
1.1 Ионообменное равновесие
Ионный обмен - обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Обычно одна из этих фаз ионит, а другая раствор электролита [1].
Если ионит, содержащий только противоионы А, поместить в раствор, содержащий только противоионы В, то ионы А начнут замещаться ионами В из раствора. Через некоторое время установится равновесие: ионит и раствор будут содержать ионы обоих сортов в определенном соотношении. Такое состояние называется ионообменным равновесием[2].
Ионный обмен является обратимой химической реакцией. В соответствии с этим, должно, достигаться состояние равновесия, удовлетворяющее закону действующих масс.
RA + В+
↔ RB + А+
,
где R — матрица ионита с присоединенным к ней фиксированным ионом, А+
и В+
— подвижные ионы[3].
Ионообменное равновесие обусловлено концентрацией раствора, свойствами ионита и обменивающихся ионов, а также температурой. Селективность ионного обмена проявляется в различии абсолютных значений коэффициентовраспределения ионов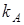 и и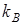 , которые для рассматриваемого равновесия можно определить как , которые для рассматриваемого равновесия можно определить как
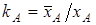 и и  (1), (1),
где  и и 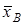 - эквивалентные доли ионов А+
и В+
в ионите, - эквивалентные доли ионов А+
и В+
в ионите,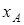 и и 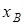 - в растворе. - в растворе.
Деля 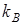 на на 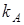 , получим коэффициент селективности, или константу обмена , получим коэффициент селективности, или константу обмена  , которая, зависит от концентрации обменивающихся ионов: , которая, зависит от концентрации обменивающихся ионов:
 (2). (2).
Введя поправки на коэффициенты активности ионов в растворе и и 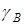 , получают уточненный коэффициент селективности , получают уточненный коэффициент селективности 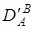
 (3). (3).
Следует отметить, что постоянство значений уточненного коэффициента селективности сохраняется только при данной степени замещения. С изменением  величина величина изменяется. В таких случаях рассчитывают истинную константу обмена: изменяется. В таких случаях рассчитывают истинную константу обмена:
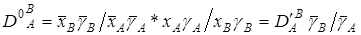 (4). (4).
Поскольку определение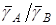 затруднительно, предлагается избрать стандартное состояние ионита в А- и В- формах, в котором затруднительно, предлагается избрать стандартное состояние ионита в А- и В- формах, в котором  и и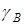 равны единице. равны единице.
Истинная константа равновесия обмена разновалентных ионов с зарядами  и и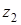 выражается уравнением Никольского: выражается уравнением Никольского:
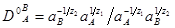 (5), (5),
соответствующая взаимодействию эквивалентного числа ионов ионита и раствора:

На основе теоремы Больцмана Никольский показал, что соотношение коэффициентов активности ионов в твердой фазе не меняется, если свободная энергия их взаимодействия со средой остается постоянной. С известным приближением такое положение справедливо при замещении одного противоиона в ионите на другой, и это позволяет пользоваться для расчета констант обмена уравнением, аналогичным уравнению (3), в котором активности ионов в твердой фазе заменены их концентрациями:
 (6), (6),
где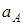 и и  - активности катионов с зарядами - активности катионов с зарядами и и 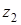 в растворе; в растворе; и и  - концентрации противоионов в твердой фазе, выражаемые в экв на 1 кг или в, мг-экв на 1 г сухого ионита. - концентрации противоионов в твердой фазе, выражаемые в экв на 1 кг или в, мг-экв на 1 г сухого ионита.
1.2 Кинетика ионного обмена
Стадия, определяющая скорость ионного обмена.
Процесс обмена противоионов включает в себя 5 последовательных стадий:
1. перемещение вытесняющего иона через пленку, окружающую зерно, к его поверхности (пленочная, внешнедиффузионная кинетика);
2. перемещение вытесняющего иона внутри зерна к фиксированным ионам, т. е. к точке обмена (гелевая, внутридиффузионная кинетика);
3. химическую реакцию двойного обмена (химическая кинетика);
4. перемещение вытесняемого иона внутри зерна от точки обмена к поверхности;
5. перемещение вытесняемого иона через пленку, окружающую зерно [3].
Суммарная скорость многостадийного процесса определяется скоростью наиболее медленной стадии. Выявление этой стадии и является первым этапом изучения кинетики ионного обмена [1].
Проблема распознавания лимитирующей стадии решается на основе фундаментального кинетического анализа ионообменных процессов. Кинетические уравнения имеют сравнительно простой вид, если изменениями состава ионита в результате ионного обмена можно пренебречь.
По результатам анализа рассчитывают степень достижения равновесия  : :
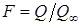 (7), (7),
где  - сорбция ионов из раствора за время t; - сорбция ионов из раствора за время t;  - равновесная сорбция. - равновесная сорбция.
Если лимитирующей стадией является сам акт обмена ионов, то
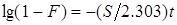 (8), (8),
Величину 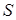 вычисляют по уравнению вычисляют по уравнению
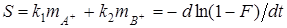 (9), (9),
где 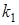 и и 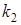 — соответственно константы скорости прямой и обратной реакций, — соответственно константы скорости прямой и обратной реакций,  и и  — концентрации обменивающихся ионов А+ и В+ в растворе [2]. — концентрации обменивающихся ионов А+ и В+ в растворе [2].
Вывод уравнения для кинетики ионного обмена, лимитирующегося внешней диффузией, был выполнен на основе предположения о постоянстве концентрации раствора и коэффициента распределения адсорбирующегося иона А+
между фазами:
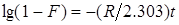 (10), (10),
Константа скорости диффузии R определяется соотношением
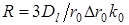 (11), (11),
где 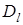 — коэффициент диффузии через пленку толщиной — коэффициент диффузии через пленку толщиной  , покрывающую зерно ионита радиусом , покрывающую зерно ионита радиусом 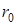 , , 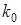 — коэффициент распределения, т. е. отношение концентрации сорбирующегося иона А+
в ионите к концентрации того же иона в растворе в условиях равновесия. — коэффициент распределения, т. е. отношение концентрации сорбирующегося иона А+
в ионите к концентрации того же иона в растворе в условиях равновесия.
Вывод кинетического уравнения ионообменного процесса, скорость которого лимитируется гелевой диффузией, был сделан для частицы имеющей точно шарообразную форму:
F=1-(6/p2
)å(1/n2
)exp(-Btn2
) (12),
где B=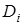 p2
/r2
0
и называется константой скорости гелевой диффузии. p2
/r2
0
и называется константой скорости гелевой диффузии.
Проверка применимости уравнения (12) сводится к построению графика зависимости Bt от t, который должен быть прямолинейным, если процесс лимитируется гелевой диффузией. Значения Bt удобно определять по экспериментально найденным величинам F с помощью специальной таблицы (Приложение 1). По величине Вτ и известному радиусу зерен смолы можно посчитать среднее значение коэффициента диффузии 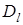 [4]. [4].
Для выяснения механизма кинетики целесообразно работать с проточным раствором[1]. Количественное рассмотрение ионного обмена приводит к следующим зависимостям: ln(l –F) = -ktдля пленочной кинетики и F=k(t)½ для гелевой кинетики при малых значениях τ (F< 0,05), где k константа. Следовательно, при пленочной кинетике должна получиться прямолинейная зависимость ln(l –F) от t; при гелевой кинетике зависимость F от t½ должна выражаться кривой, которая при малых значениях t имеет прямолинейный ход, а затем искривляется. Построение графических зависимостей на основании экспериментально полученных значений F и t позволяет, таким образом, отличить гелевую кинетику от пленочной. Наличие гелевой кинетики можно также проверить в широкой области, вычислив для каждой пары значений F и t коэффициент взаимодиффузии Di
. При этом при всех значениях F и t должно получиться одно и то же значение D. Рассмотренные критерии строго применимы только к изотопному обмену. Сколько-нибудь надежные заключения могут быть получены лишь в том случае, если найденные пары значений согласуются с одним механизмом и не согласуются с другим. Механизм кинетики может быть установлен также на основании данных о зависимости скорости обмена от размера частиц, количества поперечных связей, концентрации раствора и скорости перемешивания, или, соответственно, скорости потока [5].
1.3 Преимущества волокнистых хелатообразующих сорбентов
Волокнистые сорбенты имеют ряд особенностей, связанных с их структурой. Основное преимущество – их высокая удельная поверхность, которая примерно на два порядка выше, чем у гранулированных ионообменников гелевой структуры и в 5-6 раз выше, чем у сорбентов на основе сополимеров пористой структуры[6]. Диаметр частиц волокнистых сорбентов на 1-2 порядка меньше среднего размера частиц гранульных сорбентов[7].
Основными характеристиками хелатообразующих сорбентов, в том числе и волокнистых, являются сорбционная ёмкость, кислотно-основные и комплексообразующие свойства, кинетические параметры. Важны так же химическая устойчивость, набухаемость и возможность многократного использования[8].
· Кислотно-основные свойства. Хелатообразующие волокнистые сорбенты, как правило, содержат несколько различных функциональных групп. Это может быть обусловлено неполным превращением реакционно-способных групп промежуточных продуктов при синтезе, гидролизом групп, входящих в состав полимерной матрицы, наличием активных групп в исходном полимере.
· Сорбционные свойства. Величина сорбционной ёмкости волокнистых сорбентов зависит от содержания функциональных групп в сорбенте, природы сорбируемого иона и условий сорбции и изменяется в широком интервале. Высокую сорбционную ёмкость имеют сорбенты с тиоамидными, гидроксамовыми, амидоксимными и др. группами. Эффективность волокнистых сорбентов, особенно при сорбции из разбавленных растворов, можно оценить по величине коэффициентов распределения, достигаемых при их использовании. Для волокнистых сорбентов обычно величины коэффициентов распределения составляют 103
-105
мл/г.
· Кинетические свойства. Хорошие кинетические свойства волокнистых сорбентов обусловлены, прежде всего, их высокой удельной поверхностью и хорошей способностью к набуханию. Для характеристики кинетических свойств сорбентов обычно определяют время достижения равновесия при определенном отношении объема анализируемого раствора и массы сорбента (V/m), постоянной температуре и концентрации солевого фона. Также устанавливают скорость, определяющую стадию и определяют эффективные коэффициенты диффузии, используя те же методы, что и при изучении свойств обычных сорбентов.
· Комплексообразующие свойства. Механизм взаимодействия ионов металлов с хелатообразующими сорбентами, в том числе волокнистой структуры, довольно сложен. Основное внимание уделяется выяснению механизма сорбции, состава и структуры образующихся комплексов, а также количественному описанию процесса комплексообразования, который характеризуется величинами констант устойчивости комплексов в фазе сорбента. Для изучения механизма используется ряд методов: элементный анализ, масс-спектроскопия, термогравиметрия, ИК- и ЯГР-спектроскопия.
· Химическая и механическая устойчивость. Для синтеза волокнистых сорбентов применяют различные полимерные материалы, которые в значительной степени определяют их химическую и механическую устойчивость. Химическая устойчивость зависит также от природы введенных функциональных групп.
1.4
Сорбционное извлечение платиновых металлов
К настоящему времени выполнено большое количество работ по извлечению и концентрированию платиновых металлов на различных ионитах. Для изучения механизма сорбции платиновых металлов с различными функциональными группами, исследователями в основном используются такие методы как ИК-спектроскопия, РЭС, дериватография и др.
Сильноосновные аниониты: Палладий (II) прочно удерживается анионитом АВ-17, на основе сополимера стирола и дивинилбензола (8%), содержащий триметиламмонийные активные группы, в Cl-форме. Вымыть палладий (II) можно только 11,5н раствором соляной кислоты, причем процесс элюирования очень длительный. Хорошим элюентом для палладия (II) в этих условиях является раствор 3н хлорной кислоты. Палладий в 1н растворе фтористого водорода хорошо сорбируется анионитом АВ-17 в F-форме. Десорбция палладия (II) из ионита удается лишь концентрированной плавиковой кислотой (20н) [9].
Слабоосновные аниониты: В работе [10] исследован механизм сорбции платины (IV) из солянокислых растворов на сероазотсодержащих сорбентах с моно- и бидентатными функциональными группами. Продукты взаимодействия платины (IV) и сорбентов исследовались методом ИК-спектроскопии. Исследовали три сорбента: слабоосновный анионит с третичной аминогруппой, серосодержащий нейтральный сорбент с сульфидной и третичной аминной группировками:
Сорбент
|
Функц.гр |
%S |
%Э |
%N |
%Э |
СОЕ |
| АСП-S-N-1 |
CH2
S(CH2
)2
N(C2
H5
)2
|
8,2 |
2,6 |
3,6 |
2,6 |
1,8 |
| АСП-N-H |
CH2
N(C2
H5
)2
|
- |
- |
4,1 |
2,9 |
2,2 |
| КПП-S-139/7 |
CH2
SC2
H5
|
6,6 |
2,1 |
- |
- |
0 |
ИК-спектры соединений получали на однолучевом спектрометре ИКС-21 с призмой CsI (220-400 см-1
). Образцы готовили в виде суспензии в вазелиновом масле между окнами CsI. Процесс сорбции платины на анионите происходит по ионообменному механизму, а на сероазотсодержащем сорбенте ионообменный механизм усложнен другим процессом – взаимодействием платины с донорным атомом серы. Для выяснения роли атома азота в образовании комплексов платины с сорбентом был использован метод длинноволновой ИК-спектроскопии. Приведены ИК-спектры поглощения области проявления колебаний связи металл-лиганд (200-400 см-1
) образцов сорбентов, насыщенных платиной (IV) из солянокислых растворов. В спектре наблюдается интенсивная широкая полоса поглощения с максимумом 315-325 см-1
, которую можно отнести к валентному колебанию металл-хлор. В рассматриваемой области интерпритация валентных колебаний связи платина-азот (в случае ее образования при сорбции из солянокислых растворов) затруднена наличием интенсивной полосы νPt
-
Cl
, поскольку известно, что полоса νPt
-
N
в ИК-спектрах малоинтенсивна.
Позднее [11] была изучена сорбция палладия (II) анионитами на основе стирола и дивинилбензола пористой структуры (АН-511 и АН-406) и анионитом на основе метакрилата и длинноцепочного сшивающего агента - тетравинилового эфира пентаэритрита макросетчатой структуры. Исследования показали, что при переходе к слабокислым средам степень извлечения палладия (II) возрастает до 96%.
Анпилогова Г.Р. с сотрудниками [12] исследовала анионит сетчатой структуры на основе эпихлоргидрина и алифатических полиаминов по отношению к металлам платиновой группы (МПГ). Анионит характеризуется высокими скоростями сорбции МПГ из солянокислых растворов, химической и термической устойчивостью. Для установления механизма сорбции Pt (IV) и Pd (II) анионитом рассмотрены ИК-спектры в дальней области и результаты элементного анализа равновесных продуктов сорбции, полученных в условиях предельного насыщения. Из сильнокислых растворов при комнатной температуре данные металлы извлекаются по анионообменному механизму, при этом взаимодействие оканчивается на стадии образования ионных ассоциатов, о чем свидетельствует соотношение M:N:Cl в продуктах сорбции, а также соответствие значений ν (M-Cl) в ИК спектрах сорбционных комплексов литературным данным для ониевых хлорокомплексов МПГ. Установлено изменение механизма сорбции Pt (IV) и Pd (II) с анионообменного на внутрисферное замещение при переходе от кислых растворов к слабокислым и нейтральным.
В работе [13] изучена адсорбция хлоридных и аммиачных комплексов платины (IV) на синтетических волокнах ВИОН в широком интервале концентраций платины (IV). Показано, что адсорбция комплексных ионов платины (IV) на анионитных волокнах подчиняется уравнению Ленгмюра: изотерма адсорбции на катионитном волокне имеет S-образный вид. Установлено, что адсорбция из растворов аммиаката для всех изученных волокон (АН-1, АН-3 и КН-1) значительно превышает величину адсорбции из кислых растворов. Методом ИК-спектроскопии показано, что координация платины (IV) на волокне АН-1 происходит по атому азота замещенного пиридинового кольца; координация по нитрильной группе не происходит ни на одном из изученных волокон.
Комплексообразующие аниониты: Изучение [14] нового гетероцепного сероазотсодержащего комплексита показало, что он характеризуется высокой химической и термической устойчивостью, высокими величинами сорбционных емкостей по Pd (II). Сорбент проявляет высокую селективность к благородным металлам в присутствии ряда цветных металлов. Методом ИК-спектроскопии установлено, что в слабокислых растворах Pd (II) медленно взаимодействует с вторичными аминогруппами по механизму внутрисферного замещения, а в сильнокислых растворах быстро образует ионные ассоциаты с протонированными аминогруппами с последующим внутрисферным замещением атомов хлора атомами серы диалкилсульфидных групп.
Симанова С.А. с сотрудниками [15] исследовала сорбционные свойства волокнистого сорбента типа Глипан по отношению к хлорокомплексу палладия (II). Установлено, что сорбенты типа Глипан на основе полиакрилонитрила, модифицированные полиэтиленполиаминами (Глипан-А), аминогунидином (Глипан-3) и тиосемикарбазидом (Глипан-1), способны извлекать хлорокомплексы палладия (II) из кислых растворов, а Глипан-А – и из нейтральных. Определены кинетические и емкостные характеристики в солянокислых растворах. При измерении ИК спектров сорбентов в ближней и дальней областях заметны изменения после сорбции хлорокомплекса палладия (II). Показано, что извлечение палладия (II) из кислых растворов волокнами Глипан-А и Глипан-3 происходит по ионообменному механизму с образованием в фазе волокон ониевых хлорокомплексов палладия (II). В случае волокна Глипан-1 сорбция палладия (II) связана с реакциями комплексообразования с функциональными группами сорбента как с полимерным лигандом.
Позже [16] были изучены сорбционные свойства азотсеросодержащего волокна Глипан-1 по отношению к хлорокомплексу платины (II) - K2
[PtCl4
]. Волокнистый сорбент Глипан-1 получали обработкой ПАН волокна тиосемикарбазидом. Волокно содержит группы NH2
-NH-C(S)-NH- и карбоксильные группы. Сорбцию проводили в растворах 0,1-4,0 м HCl, 0,1 м KCl, 0,1-1,0 м NaCl (CPt
=1-10 ммоль·л-1
). ИК спектры сорбентов в области 400-4000 см-1
измеряли на спектрофотометре ИКС-29 с тремя призмами LiF (4000-3000 см-1
), CsCl (1800-700см-1
), KBr (700-400см-1
). Образцы готовили прессованием с KBr. ИК спектры волокон после сорбции в области 140-400 см-1
измеряли на спектрофотометре FIS-3, Hitachi. Образцы готовили прессованием в порошкообразном полиэтилене.
В ДИК спектрах волокна после сорбции K2
[PtCl4
] наблюдается широкий размытый максимум в области 322-326 см-1
и перегиб в области 300 см-1
. Было предположено образование в фазе волокна комплекса состава [(RThscH)Pt2+
Cl2
] цис-конфигурации. Часть тиоамидных групп волокна не участвует в реакции комплексообразования. Высокие скорости извлечения K2
[PtCl4
] волокном Глипан-1 из кислой среды позволили предположить, что происходит образование ониевых комплексов:В [17] изучена сорбция Глипан-1 по отношению к хлорокомплексу платины (IV) - K2
[PtCl6
]. На основании совокупности сорбционных характеристик волокна Глипан-1 по отношению к хлоркомплексам Pt (IV) и результатов измерения ДИК спектров предположены основные стадии химических превращений в процессе сорбции. Во всех случаях сорбция связана с реакциями комплексообразования с сорбентом как полимерным лигандом и окислительно-восстановительными превращениями в фазе
волокна. Сорбируемой формой платины оказывается комплекс состава:Выявлено, что реакции комплексообразования хлорокомплексов платины (II) и платины (IV) с полимерным лигандом, волокном Глипан-1 с привитыми тиосемикарбазидными группами протекают различно.
Авторы работы [18] изучали сорбционные свойства волокна Глипан-А по отношению к хлорокомплексу платины (IV). Данный сорбент получили обработкой ПАН волокна полиэтиленполиамином при повышенной температуре в среде жидкого полиамина. Волокно содержит аминогруппы R-NH2
и R-NH-R´
(СОЕHCl
5.5-6 ммоль·г-1
) и карбоксильные группы (СОЕNaOH
1.2 ммоль·г-1
). В ДИК спектре волокна Глипан-А после сорбции K2
[PtCl6
] из кислых растворов наблюдается полоса валентных колебаний Pt-Cl326-328 см-1
. Полосы же валентных колебаний Pt-Cl в соединениях ониевого типа (AH)2
[PtCl6
] находятся в области 330-340 см-1
, а для соединений типа (AH)2
[PtCl4
] ν (Pt-Cl) располагаются в области 320 см-1
. Таким образом, на основании ИК-спектроскопии предположили, что процесс сорбционного извлечения K2
[PtCl6
] волокном Глипан-А сопровождается частичным восстановлением Pt (IV) до Pt (II). При этом происходит реакция внутримолекулярного окисления-восстановления и в качестве восстановителя выступает хлорид-ион. Т.е. процесс сорбционного извлечения хлорокомплекса Pt (IV) из солянокислых растворов сопровождается образованием в фазе волокна Глипан-А комплексов состава (R2
NH2
)2
[PtCl6
] и (R2
NH2
)2
[PtCl4
]. При сорбции K2
[PtCl6
] волокном Глипан-А в кислом растворе происходит усложнение контура поглощения ИК-спектра в ближней области (2500-3000 см-1
), что свидетельствует об образовании водородных связей между внутрисферными хлорид-ионами и протонами, находящимися во внешней сфере. Изменение контура поглощения полос деформационных колебаний N-H (δNH) в области 1600 см-1
указывает на возникновение водородных связей. Интересно отметить, что при сорбции K2
[PtCl6
] волокном Глипан-А из кислых растворов при нагревании (80˚С) в ДИК спектре волокна наблюдаются две размытые полосы валентных колебаний Pt-Cl, которые можно отнести к аминохлорокомплексам Pt(IV) и Pt(II) [(R2
NH)2
PtCl4
] и [(R2
NH)2
PtCl2
] или [R2
NH2
][(R2
NH)PtIV
Cl5
] и [R2
NH2
][(R2
NH)PtII
Cl3
]. После сорбции K2
[PtCl6
] из нейтральных растворов (растворов KCl) волокном Глипан-А не наблюдается заметных изменений в ИК спектрах ни в ближней, ни в дальней областях.
Позже [19] изучены особенности сорбционного извлечения хлорокомплекса платины (II) волокном Глипан-А из солянокислых растворов. Для установления состава комплексов, образующихся в фазе волокна, были сняты ИК спектры в дальней области. Показано, что сорбция K2
PtCl4
из кислой среды сопровождается образованием в фазе волокна ониевых соединений типа (R2
NH2
)2
[PtCl4
] или (RNH3
)2
[PtCl4
], а из сред, близких к нейтральным – цис-диаминодихлорокомплексов - [(R2
NH)2
PtCl2
] или [(RNH2
)2
PtCl2
]. Термогравиметрические исследования образцов волокна Глипан-А с сорбированными на них ионами платины (II) подтвердили результаты спектроскопического исследования.
В статических условиях исследованы [20] сорбционные свойства волокнистых сорбентов, полученных модифицированием полиакрилонитрила полиэтиленполиамином (ГЛИПАН-2), поли-2-метил-5-винилпиридином (ПАН-МВП) и тиосемикарбазидом (ГЛИПАН-1) по отношению к сульфату палладия (II) в 0.1- 5.0 м растворах серной кислоты.
Методами ИК, РФЭ спектроскопии, ЭСП, элементного и дериватографического анализов установлено, что извлечение палладия во всех случаях связано с реакциями комплексообразования с функциональными группами сорбентов. Волокна с азотсодержащими группами отличаются более быстрой кинетикой сорбции. На основании кинетических данных высказано предположение, что вначале происходит образование ониевых соединений с дальнейшим превращением типа андерсоновской перегруппировки и образованием в фазе волокна аминосульфатокомплексов [(RPy)2
PdSO4
] [(RNH2
)2
PdSO4
], где сульфат-ион выступает в роли бидентантного или мостикового лиганда. Аминосульфатокомплексы палладия (II) прочно удерживаются в фазе волокна (десорбция не превышает 10-15%).
Авторами работы [21] синтезированы гетероцепные полимерные сорбенты, содержащие третичный атом азота. Сорбенты могут быть использованы для концентрирования платиновых металлов. Сорбционным центром является третичный атом азота. Для подтверждения этого проведен элементный анализ образующихся при сорбции комплексов, полученных в разных условиях и выделенных при насыщении сорбента из слабокислых сред. Отношение Me:Cl:N для палладия, золота и платины составляет соответственно 1:2:2, 1:3:1 и 1:6:2. Можно предположить, что из сред, близких к нейтральным, золото и палладий сорбируются с образованием координационно - сольватированных соединений. В случае платины комплексообразование, по-видимому, протекает с образованием ионных ассоциатов, что, вероятно, преобладает при сорбции из кислых сред.
Исследована [22] сорбция родия (III), палладия (II) и платины (IV) из хлоридных растворов полимером на основе полистирола, содержащим диэтилентриаминные группировки. Палладий (II) количественно извлекается из растворов 2-5 М HCl при скорости пропускании раствора до 10 мл/мин на микроколонках с сорбентом объемом 0,1 мл. Родий (III) наиболее эффективно извлекается из 6-7 М HCl, платина (IV) – из 3 М HCl. Методами спектрофотометрии и спектроскопии диффузионного отражения исследованы формы металлов в растворе и твердой фазе. Показано, что при сHCl
>1 моль/л сорбция обусловлена ионообменным взаимодействием; извлекаются преимущественно безводные хлорокомплексы металлов. Извлечение металлов на сорбенте при pH>1 сопровождается внутрисферной координацией металлов с азотом функциональных групп. Предложена процедура группового динамического концентрирования родия (III), палладия (II) и платины (IV), заключающаяся в разбавлении пробы до оптимальной концентрации HCl в потоке непосредственно перед колонкой.
Хелатные смолы: В последнее время все большее внимание уделяется использованию хелатных сорбентов для сорбции платиновых металлов [23]. Наиболее детально изучена сорбция хлорокомплексов палладия (II) из растворов соляной, серной и хлорной кислот хелатным сорбентом марки ХМС-8-АХ, полученным аминированием хлорметилированного сополимера стирола с дивинилбензолом 8-аминохинолином. Из 1 н раствора соляной кислоты сорбция Pd (II) 100%. Это объясняется тем, что палладий образует прочные хелатные циклы с функциональными группами сорбента.
Исследованы комплексообразующие свойства растворимых ионитов на основе хлормитилированных полистиролов, пиридинкарбоновых кислот и их нитрилов. На основании проведенных исследований найдены оптимальные условия выделения и концентрирования ионов платиновых в частности и палладия (II) из растворов.
Авторами работы [24] был синтезирован новый хелатный сорбент ПВБ-МП-8Т аминированием 3(5)-метилпиразолом хлорметилированного сополимера стирола с дивинилбензолом макропористой структуры. Сорбент представляет собой гранулы сферической формы, окрашенные в бледно-желтый цвет, устойчивые при нагревании в сильнокислых растворах.
Исследована сорбция благородных металлов сорбентом ПВБ-МП-8Т, а также возможности применения сорбента для концентрирования благородных металлов из сложных солевых растворов. Характер взаимодействия сорбента с ионами благородных металлов изучен методом ИК-спектроскопии. ИК-спектры сорбента, насыщенного металлами, исследовали в области 200-4000 см-1
. Анализ спектров показал, что полосы поглощения пиразольной группы и полимерной основы прекрываются в области 400-4000 см-1
и существенно не меняются при насыщении сорбента металлом. В области 200-400 см-1
появляются полосы, отнесенные к колебаниям связи Me-N (для Pt-300 см-1
), что может свидетельствовать о комплексообразовании благородных металлов по атому азота пиразольнoй группы. Отсутствие в спектрах изменений валентных колебаний группы NH пиразольного цикла при насыщении сорбента металлом позволяет предполагать, что при взаимодействии благородных металлов с сорбентом ионообменные механизм маловероятен.
В работе [25] исследовали хлоро- и бромокомплексов Pd двумя типами анионообменных волокон, содержащих третичные амины, на основе поливинилспиртового волокна. Авторы установили, что бромидные комплексы сорбируются лучше, чем хлоридные. Для обоих волокон с повышением концентрации HClпроцент сорбция Pd снижается.
Сорбцию Pd из 0,5М раствора HCl изучали в динамических условиях на волокне – сополимере целлюлозы с поли-2-метилвинилпиридином и с полиметакриловой кислотой. Ёмкость до проскока по палладию составляет 28,2 мг/г.
Микрограммовые количества хлорокомплексов палладия из солянокислых растворов сорбировали волокнами на основе целлюлозы и ПВС. В таблице 1 приведены типы исследованных волокон и величины сорбции палладия. Авторы установили, что сорбционные свойства мало зависят от температуры (20 и 100ºС).
Таблица 1. Сорбционные свойства модифицированных ПВС и целлюлозных волокон
| № волокна |
Волокно |
Сорбировано, % |
| III |
ПВС волокно с первичными аминогруппами |
85,0 |
| IV |
Дегидратированное ПВС волокно с третичными аминогруппами |
100 |
| V |
Дегидратированное ПВС волокно с четвертичными аминогруппами |
97,3 |
| VI |
Привитой сополимер (30%ПМВП и 70%ПВС) |
100 |
| VII |
Сополимер целлюлозы и поли-2-метил-5-винилпиридина |
95,7 |
В работах [26,27] предложены сорбенты волокнистой структуры на основе поливиниленового карбоцепного волокна – ПОЛИОРГС-VI и ПОЛИОРГС-Х. Сорбенты устойчивы в кислых и щелочных средах, обладают высокой селективностью к платиновым металлам. Сорбционная ёмкость сорбентов в 1М НСlсоставляет 48 и 50 мг/г соответственно. Она сохраняется высокой в присутствии 5*106
-кратных количествах солей меди, железа, кобальта, никеля.
Было исследовано волокно Мтилон-Т, которое содержит тиоамидные группы. Оно получено методом привитой сополимеризацией полиакрилонитрила и целлюлозы с последующей обработкой сероводородом. Данное волокно обладает высокой селективностью по отношению к платиновым металлам. Сорбционная ёмкость волокна по отношению к хлорокомплексам палладия определена при 100ºС в 1М НСl и составляет 83 мг/г. В присутствии солей железа и меди сорбция снижается на 50-70%. Необходимо отметить, что волокно неустойчиво в кислых растворах и в при действии окислителей происходит разрушение как целлюлозной матрицы, так и функциональных групп. Опыты показали, что разбавленные растворы азотной кислоты, аммиака, перекиси водорода и щавелевой кислоты вытесняют из волокна не более 10% поглощенных ионов металлов[28]. Это свидетельствует о большой прочности ионов с тиоамидными группами, что вряд ли может быть при связывании ионов металлов по ионообменному механизму. Полное вытеснение ионов металлов происходит при действии концентрированной азотной кислотой. Однако при этом разрушается волокно. ИК-спектры волокна Мтилон-Т до и после сорбции свидетельствуют о возможности образования связей между ионами металлов и атомами азота и серы тиоамидной группы[29].
Симановой С.А. и Кукушкиным Ю.Н. было исследовано волокно МСПВС, которое получено на основе привитого сополимера ПВС-ПАН с последующей модификацией его раствором сульфида натрия. В волокне присутствуют тиоамидные группы находящиеся в таутомерном равновесии, включающем тионную и сульфгидрильную группы. Это волокно устойчиво к действию кислот, щелочей и окислителей. МСПВС волокно селективно по отношению к платиновым металлам. Емкостные и кинетические характеристики МСПВС волокна исследованы в солянокислых комплексам платиновых металлов при температуре 20 и 98ºС (См=0,001-0,01 моль/л). Во всех случаях сорбция зависит от интенсивности перемешивания, следовательно, лимитирующей стадией сорбции является диффузия. Зависимость кинетического коэффициента Вτ и –ln(1-F) от времени для всех хлоркомплексов платиновых металлов свидетельствует о смешанно-диффузионном типе кинетики сорбции. Небольшие значения энергий активации согласуются с диффузионным типом кинетики сорбции [30]. Для изучения механизма сорбции оценивалось отношение серы в волокне к количеству сорбированного металла. Они установили, что 90% всей серы волокна участвует в образовании связи М-S, что подтверждает тёмная окраска волокон, сорбировавших платиновые металлы. После сорбции наблюдается понижение значения рН растворов. Образование прочных донорно-акцепторных связей М-S приводит к необратимой сорбции платиновых металлов модифицированными ПВС волокнами. Действительно, попытки элюировать металлы с волокон концентрированной соляной кислотой, HNO3
(1:1), аммиаком, перекисью водорода не привели к успеху. В подтверждение образования связи М-S при сорбции хлоридных комплексов платиновых металлов волокнами ПВС были измерены ИК-спектры волокна до и после сорбции. Образование связи М-S подтверждается и масс-спектрами модифицированных ПВС волокон до и после сорбции платиновых металлов[31].
Симанова С.А. с сотрудниками [32] исследовала сорбционные свойства волокнистого сорбента типа Глипан по отношению к хлорокомплексу палладия (II). Установлено, что сорбенты типа Глипан на основе полиакрилонитрила, модифицированные полиэтиленполиаминами (Глипан-А), аминогунидином (Глипан-3) и тиосемикарбазидом (Глипан-1), способны извлекать хлорокомплексы палладия (II) из кислых растворов, а Глипан-А – и из нейтральных. Определены кинетические и емкостные характеристики в солянокислых растворах. При измерении ИК спектров сорбентов в ближней и дальней областях заметны изменения после сорбции хлорокомплекса палладия (II). Показано, что извлечение палладия (II) из кислых растворов волокнами Глипан-А и Глипан-3 происходит по ионообменному механизму с образованием в фазе волокон ониевых хлорокомплексов палладия (II). В случае волокна Глипан-1 сорбция палладия (II) связана с реакциями комплексообразования с функциональными группами сорбента как с полимерным лигандом.
Группой ученых были исследованы сорбционные свойства сорбентов типа Тиопан – сополимеров полиакрилонитрила с привитым полиглицидилметакрилатом, с последующей модификацией. Определены кинетические и ёмкостные характеристики сорбентов в солянокислых и хлоридных растворах. Анализ кинетических зависимостей сорбционного процесса при 98ºС позволяет им предположить смешано-диффузионный тип кинетики сорбции Pd из солянокислых растворов. Сорбция хлорокомплекса Pd серосодержащими волокнами типа Тиопан во всех случаях имеет практически необратимый характер. На примере, Тиопана-2 было показано, что 4-6М НСl удается десорбировать не более не более 2% палладия(1-2ч контакта при 20ºС), однако палладий количественно десорбировать 10%-ным раствором тиомочевины в 0,5М НСl. Для установления состава и строения комплексов, образующихся в фазе сорбентов, снимали ИК-спектры в дальней области. В случае сорбции хлорокомплексов палладия(II) Тиопаном-2 в ДИК спектрах отсутсвуют характерные полосы, соответствующие валентным колебаниям Pd-Cl. На основании, ДИК спектров высказано, предположение, что процесс извлечения палладия Тиопаном-2 протекает через две стадии: образование комплексных соединений с тиоамидными группами волокна через атом серы, с последующим гидролитическим разрывом связи C-S и образованием сульфида палладия, удерживаемого в порах волокна силами Ван-дер-Ваальса. На образование сульфида в процессе сорбции указывает черный цвет волокна[33].
В работе [34] изучена сорбция К2
[PdCl4
] на сополимере полиакрилонитрильного волокна с поли-2-метил-5-винилпиридином и установлен состав и строение комплекса палладия с сорбентом как полимерным лигандом. Равновесие в распределении палладия между волокном и раствором в кислых средах устанавливается в течение 10-15 минут, а статическая сорбционная ёмкость ПАН-МВП по 0,1М НСl составляет 4,2 - 4,5 ммоль/г. Сорбированный палладий окрашивает волокно в желтый цвет (исходное волокно имеет светло-бежевую окраску). Хлорокомплексы палладия сравнительно прочно удерживаются в фазе волокна. Десорбировать 70% палладия лишь 6М соляной кислотой. Для определения состава комплекса металла с волокном были сняты ИК-спектры в ближних и дальних областях. Определенно, что сорбция из кислых растворов протекает преимущественно по ионообменному механизму и связано с образованием в фазе волокна ониевых хлорокомплексов.
Палладий (II) прочно удерживается анионитом АВ-17, на основе сополимера стирола и дивинилбензола (8%), содержащий триметиламмонийные активные группы, в Cl-форме. Вымыть палладий (II) можно только 11,5н раствором соляной кислоты, причем процесс элюирования очень длительный. Хорошим элюентом для палладия (II) в этих условиях является раствор 3н хлорной кислоты. Палладий в 1н растворе фтористого водорода хорошо сорбируется анионитом АВ-17 в F-форме. Десорбция палладия (II) из ионита удается лишь концентрированной плавиковой кислотой (20н) [35].
Необратимое взаимодействие ПМГ по механизму внутрисферного обмена лигандов обусловлено образованием прочной связи металла с сорбентом, которая может усилиться при нагревании или высыхании насыщенного сорбента. Если комплексообразование в процессе сорбции завершится на стадии образования ониевых хлорокомплексов, то возможно элюирование с помощью кислот. Наиболее эффективнее использование раствора тиомочевины в соляной кислоте[36].
На основе литературных данных были сделаны сводные таблицы применяемых сорбционных материалов.В таблице 2 представлены основные свойства и функциональные группы волокнистых сорбентов и их кинетические характеристики, а в таблице 3 механизмы взаимодействия ионов металлов с волокнистыми сорбентами.
Таблица 2. ССЕ и тип кинетики волокнистых сорбентов
| Название сорбента |
Функциональные группы |
ССЕ или степень извлечения |
Тип кинетики |
Литература |
| МСПВС |
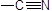
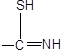
|
Из хлоридных комплексов в 2м HCI при 20°C
Pd(2)-0,77 ммоль/г
При 98°C
Pd(2)-1,80 ммоль/г
|
Смешанно-диффузионный (“гелевая” и “пленочная” диффузия) |
30,31 |
| Мтилон-Т |
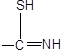
|
Из хлоридных комплексов в 1м HCI при 100°C
Pd(2)-83,0 мг/г
|
Смешанно-диффузионный |
28,29 |
| Полимер стирольного типа с меркапто- группами. |

|
Из хлоридных комплексов в 1м HCI при 20°C
Pd(2)-0,62 ммоль/г
|
31 |
Тиопан-2
Основа ПАН
|
Модифиц. реагент
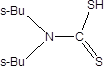
|
Из хлоридных комплексов в 1м HCI
При 20°C
Pd(2)-0,83 ммоль/г
При 98°C
Pd(2)-1,43 ммоль/г
|
Смешанно-диффузионный |
33 |
Тиопан-5
Основа ПАН
|
Модифиц. реагент

|
Из хлоридных комплексов в 1м HCI
При 20°C
Pd(2)-0,53 ммоль/г
При 98°C
Pd(2)-0,82 ммоль/г
|
Смешанно-диффузионный |
33 |
Тиопан-6
Основа ПАН
|
Модифиц. реагент
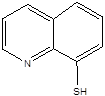
|
Из хлоридных комплексов в 1м HCI при 20°C
Pd(2)-0,41 ммоль/г
При 98°C
Pd(2)-0,57 ммоль/г
|
Смешанно-диффузионный |
33 |
Таблица 3. Механизм взаимодействия волокнистых сорбентов
| Волокно |
Предполагаемый механизм сорбции |
Литература |
| ПАН-МВП |
2RPy∙HCl+[PdCl4
]2-
↔(RPyH)2
[PdCl4
]+2Cl-

|
34 |
| Полимер стирольно-го типа с меркапто- группами |
2R-CH2
-SH+2K2
[PdCl4
]→[Pd(R-CH2
-SH)Cl2
]2
+4KCl

|
31 |
| МСПВС |
1.При рН≥7
[PdCl4
]-2
+H2
O↔[Pd(H2
O)n
Cl4-
n
]-2-
n
+nCl-
, где n≤2
[Pd(H2
O)2
Cl2
]+R-С(NH2
)S→[Pd{R-С(NH2
)S}H2
OCl]
2.При рН<7
[PdCl4
]-2
+ R-С(NH2
)S→[Pd{R-С(NH2
)S}Cl3
]-
+Cl-
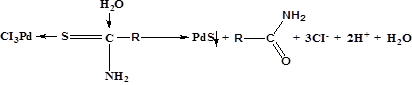
|
30,31 |
| Мтилон-Т |
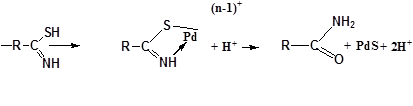 |
28,29 |
| Тиопан-2 |
[PdCl4
]-2
+R-S-CS-N(C2
H5
)2
→[Pd{D-S-CS-N(C2
H5
)2
}Cl3
]-
+Cl-

|
33 |
Возможность выделения палладия с помощью ионного обмена напрямую связана с формами нахождения его в растворах различного состава.
Высокая склонность палладия, как и всех платиновых металлов, к комплексообразованию, приводит к тому, что палладий легко извлекается из технических растворов в виде комплексов. Рассмотрим некоторые из них.
Хлоридные комплексы палладия являются наиболее широко распространенными. Гексахлорпалладаты ( ) устойчивы лишь в присутствии окислителей, при нагревании разлагаются до тетрахлорпалладатов по схеме: ) устойчивы лишь в присутствии окислителей, при нагревании разлагаются до тетрахлорпалладатов по схеме:

В водных растворах хлорида палладия (2) при рН<1,0 и концентрации металла 10-6—10-2 моль/л в зависимости от концентрации хлорид-иона образуются плоскостные комплексы 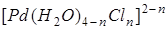 , состав которых и значения констант устойчивости установлены различными физико-химическими методами [37]. , состав которых и значения констант устойчивости установлены различными физико-химическими методами [37].
Кривые распределения отмечают отсутствие доминирования, каких либо комплексов, но при концентрации хлорид-иона больше 1моль/л, доминирует форма  . В области концентраций хлорид-иона 0.1-0.5 моль/л сосуществуют комплексы . В области концентраций хлорид-иона 0.1-0.5 моль/л сосуществуют комплексы  и и  . .
Таким образом, в литературе есть сообщения об изучении сорбции платиновых металлов на азот и серосодержащих волокнистых сорбентах. Однако публикаций об исследовании сорбции платиновых металлов на сорбентах, в составе которых тиоамидные и пиридиновые группы, сравнительно невелико. Поэтому исследование сорбции палладия на данных сорбентах является актуальным и этому вопросу нами уделено особое внимание.
палладий
сорбция хлоридный волокно
2. Экспериментальная часть
2.1 Техника безопасности при выполнении работы
2.1.1.Правила работы с едкими веществами (кислоты, щелочи)
1. Едкие вещества (кислоты и концентрированные растворы щелочей) попадая на кожу, вызывают ожоги. Щелочь в сухом виде при попадании на кожу также может вызвать ожоги. Особая опасность заключается в возможности поражения глаз.
2. При любых работах с едкими веществами обязательно применение защитных очков или масок.
3. Переливать кислоты можно только при включенной тяге в вытяжном шкафу. Дверцы шкафа должны быть прикрыты. Рекомендуется переливать кислоты с помощью специального сифона.
4. Разбавление серной кислоты следует производить приливанием кислоты в воду и только в жаростойких и фарфоровых стаканах, т.к. при этом происходит значительное выделение тепла. Склянки с концентрированными кислотами, а также бромом переносить только в ведре, а при переливании склянку нельзя держать за горлышко. Растворять едкие щелочи следует путем медленно прибавления к воде небольших кусочков; куски щелочи брать щипцами.
5. Разлитые кислоты и щелочи следует немедленно нейтрализовать и только после этого проводить уборку.
2.1.2 Правила безопасной работы с электрооборудованием и электроприборами
1. При работе с электрооборудованием и электроприборами возможны поражения электрическим током, причинами которых могут быть:
a) работа при неисправном электрооборудовании (рубильники, двигатели и т.п.);
b) электрический ток может вызвать пожар и взрыв.
2. Работы в лаборатории должны проводиться при наличии исправного электрооборудования.
3. Все неисправности электроприборов, электроарматуры, электросети и прочего электрооборудования должны устраняться только электриком.
4. Запрещается переносить включенные приборы и ремонтировать оборудование, находящееся под током.
5. Для защиты глаз от действия света электрической дуги и лазерного излучения следует надевать специальные очки со стеклами желто-зеленого цвета.
6. Для предупреждения несчастных случаев на установках высокого напряжения следует вывешивать плакаты с изображением красной зигзагообразной стрелы и надписью: "Не трогать - смертельно!".
7. Шкафы, в которых установлены щитки электрорубильников, должны быть закрыты.
8. Запрещается вешать на штепсельные розетки, выключатели и электропровода различные вещи, укреплять провода веревкой или проволокой.
9. В случае перерыва в подаче тока все электроприборы, электромоторы и другое электрооборудование должно быть немедленно выключено.
2.2.1 Спектрофотометрическое определение концентрации палладия с нитрозо-R-солью
Метод основан на образовании окрашенного комплекса [PdCl4
]2-
с нитрозо-R-солью. Комплекс образуется при кипячении в водной среде с большим избытком реагента[38].
Приготовление растворов:
0.1% раствор нитрозо-R-соли.
0,5000 г нитроза-R-соли, взвешенной с точностью 0,0002 г, растворяют дистиллированной водой в мерной колбе, вместимостью 500 мл, после растворения доводят дистиллированной водой до метки. Готовый раствор хранится в колбе с притертой крышкой.
Стандартный раствор хлорида палладия (2).
А) навеску диметилглиоксимата палладия, полученного из палладий содержащего раствора по [38], массой 6,32249 г, взвешенного с точностью до 0,0002 г, высыпают в стакан на 600 мл, растворяют в 40 мл "царской водки" при нагревании (сначала дабавляют 30 мл HCl (конц.), а затем, по каплям, 10 мл HNO3
.(конц.)). При поднятии «шапки» – интенсивно перемешивать. При необходимости добавляют еще "царской водки". После растворения, полученный раствор упаривают до влажных солей, прибавляют 10 мл концентрированной соляной кислоты и снова упаривают до влажных солей (упаривание необходимо проводить 2 раза). Затем добавляют дистиллированной воды (170-200 мл) и выпаривают до влажных солей 2-3 раза.
Полученные влажные соли хлорида палладия (2) переносят в мерную колбу на 1000 мл, доводят полученный раствор до метки дистиллированной водой. В одном мл данного раствора содержится 2,000 мг палладия.
Б) Навеску хлорида палладия, массой 3,33 растворяют в стакане на 600 мл, при нагревании в 40 мл "царской водки". Полученный раствор упаривают до влажных солей, растворяют в 10 мл соляной кислоты и снова упаривают, но до влажных солей. Последние операции повторяют дважды. Затем добавляют дистиллированной воды (170-200 мл) и выпаривают до влажных солей 2-3 раза.
Полученные влажные соли хлорида палладия (2) переносят в мерную колбу на 1000 мл, доводили полученный раствор до метки дистиллированной водой. В одном мл данного раствора содержится 2,000 мг палладия.
Проведение анализа.
В колбу на 250 мл помещают раствор хлорида палладия (2), содержащего от 30 до 250 мкг палладия, добавляют 10 мл 0,1% раствора нитрозо-R-соли) и доводят до кипения на нагревательной электрической плитке. После охлаждения до комнатной температуры раствор переносят в мерную колбу на 100 мл и доводят до метки дистиллированной водой, тщательно перемешивают. Оптическую плотность полученного раствора измеряют на приборе КФК-2-УКЛ.4.2. в кюветах толщиной 30 мм при длине волны 490 нм (сине-зеленый светофильтр). В качестве раствора сравнения применяют раствор, содержащий все реактивы кроме хлорида палладия. Количество палладия находят по предварительно построенному градуировочному графику.
2.2.2 Построение градуировочного графика
В шесть термостойких колб на 250 мл приливают 3,0; 5,0; 10,0; 15,0; 20,0; 25,0 мл стандартного раствора хлорида палладия (2) (С=10 мкг/мл), добавляют по 10 мл 0.1% раствора нитрозо-R-соли и доводят до кипения на электрической нагревательной плитке. Остывшие до комнатной температуры растворы переносят в мерные колбы на 100 мл и доводят до метки дистиллированной водой. Оптическую плотность полученного раствора измеряют на приборе КФК-2-УКЛ.4.2. в кюветах толщиной 30 мм при длине волны 490 нм (сине-зеленый светофильтр). В качестве раствора сравнения применяют раствор, содержащий все реактивы кроме хлорида палладия.
По полученным данным строят градуировочный график, результаты приведены в таблице 4 и на рисунке 1.
Таблица 4. Зависимость оптической плотности от концентрации палладия
| № |
С, мкг/мл |
D |
| 1 |
0,30 |
0,11 |
| 2 |
0,50 |
0,17 |
| 3 |
1,0 |
0,26 |
| 4 |
1,5 |
0,42 |
| 5 |
2,0 |
0,54 |
| 6 |
2,5 |
0,72 |
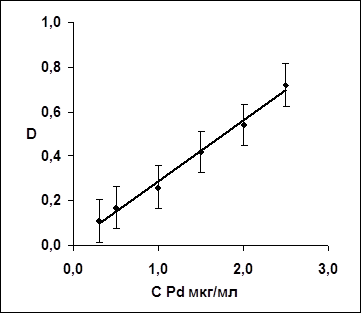
Рис.1. Градуировочный график на палладий
Уравнение: в = 0,0179 + 0,28*С,
Корреляция достоверна с доверительной вероятностью 0.95
r(таб.)
= 0.754, r(расчет.)
= 0,992; a = 0,018 5.2*10-3
; b = 0,27 5.2*10-3
; b = 0,27 3.7*10-3 3.7*10-3
Коэффициент "a" статистически незначим.
2.3.1 Подготовка волокна
Методика подготовки хелатообразующей смолы состоит в следующем: волокно помещают в химический стакан на 400 мл и добавляют 250 мл 5% раствора соляной кислоты[39]. Через 10 часов, смолу перемещают в пористый стеклянный фильтр и промывают дистиллированной водой, порциями по 250 мл до нейтральной среды. Промытое волокно сушат на воздухе в течение 1-3 суток, либо при температуре 1100
С в течение 3-4 часов.
2.3.2 Определение обменной емкости ионита в статических условиях
Навеску воздушно-сухого волокна предварительно подготовленного по п. 3.4.1., массой 0,100 ± 0,002 г. помещают в бюкс на 50 мл, и приливают 20 мл заданного раствора[40,41]. Через определенное время (время контакта 24 ч), отделяют волокно от раствора декантацией. Отделенный раствор анализируют на содержание металла по п. 3.3.1.
Статическая обменная емкость волокна в заданных условиях рассчитывается по формуле:
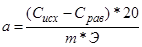 (мг-экв/г), (мг-экв/г),
где Сисх и Срав — соответственно исходная и равновесная концентрация металла в растворе (мг/мл); m — масса навески волокна; Э — масса эквивалента металла.
При необходимости рассчитывают процентную статическую обменную емкость:
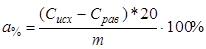 (%), (%),
Состав исходного раствора, время контакта, а также методика анализа указывается индивидуально для каждого опыта.
2.4 Результаты и их обсуждение
2.4.1 Изучение зависимости сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ от концентрации металла в равновесном растворе.
Сорбцию проводили в статических условиях при температуре 20±1°С, масса волокна составила 0,100±0,002г. рН составляла 1,0±0,1. Концентрация палладия от 0,2 до 3 мг/мл. Концентрацию палладия определяли по методике 2.2.1. Объем составлял 20 мл. Сорбцию определяли по отношению количества палладия до и после сорбции (Приложение 2).
По полученным данным построили изотермы рис.2.
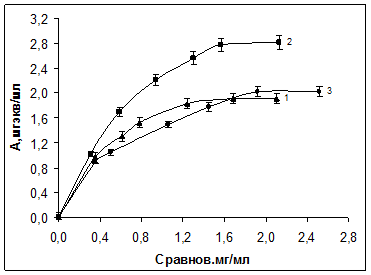
Рис.2. Изотерма сорбции палладия на волокнах ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
Из изотерм сорбции определена статическая обменная емкость (СОЕ), которая в изучаемых условиях составляет 1,91 ± 0,1 мг-экв/г для волокна ЦМ-А2, 2,75 ± 0,1 мг-экв/г для волокна Мтилон-Т и 2,02 ± 0,1 для волокна ВАГ.
Изотермы описываются уравнением Никольского:

или в линейном виде:
СR
=CR
max
-(1/К)1/
n
*p1/
n
.
Для характеристики ионообменного поглощения палладия (II) из растворов были определены коэффициенты распределения и концентрационные константы равновесия, которые представленны в таблице 5.
Таблица 5.Анализ изотерм в координатах уравнения Никольского
| ОЕmax |
К расп. |
Кравн. |
n |
| ЦМ-А2 |
2,45 |
1374 |
228 |
2 |
| Мтилон-Т |
3,74 |
2854 |
236 |
2 |
| ВАГ |
2,69 |
803 |
111 |
2 |
Проведенные расчеты показали, что коэффициент распределения палладия(II) на волокнах ЦМ-А2, Мтилон-Т и ВАГ составляют соответственно 1374, 2854 и 803. По полученным коэффициентам распределения видно, что волокно Мтилон-Т обладает большей селективностью по отношению к палладию, чем волокна ЦМ-А2 и ВАГ. Концентрационные константы равновесия, рассчитанные по уравнению Никольского равны для волокна ЦМ-А2 23, для волокна Мтилон-Т 24 и для волокна ВАГ 11. Максимально возможная обменная емкость по палладию составляет 2,45 мг-экв/г, 3,74 мг-экв/г и 2,69 мг-экв/г для волокна ЦМ-А2, Мтилон-Т и ВАГ соответственно. Расчетным путем установлено, что в образовании комплекса с палладием участвует по 2 функциональные группы для каждого из волокон.
Сорбцию проводили в статических условиях при температурах 20±1°С; 45±1°С; 60±1°С. Масса волокна составила 0,100±0,002 г. Концентрация палладия от 0,3 до 2,5 мг/мл. Объем составлял 20 мл, рН составляла 1,0±0,1. Концентрацию палладия определяли по методике 2.2.1. (Приложение 4).
Изотермы сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ при разных температурах представлены на рисунках 3, 4 и 5 соответственно.
 
Рис.3. Изотерма сорбции палладия на волокне ЦМ-А2 при 20(1), 45(2) и 60ºС(3)
Рис.4. Изотерма сорбции палладия на волокне Мтилон-Т при 20(1), 45(2) и 60ºС(3)
По полученным данным были рассчитаны концентрационные константы равновесия для процессов сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ при температурах 20ºС, 45ºС и 60ºС, результаты приведены в таблице 6. Как видно из таблицы с увеличением температуры константы равновесия увеличивается как для ЦМ-А2, Мтилон-Т, так для ВАГ.

Рис.5. Изотерма сорбции палладия на волокне ВАГ при 20(1), 45(2) и 60ºС(3)
Таблица 6. Термодинамические характеристики процессов сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ
| Т,ºС |
ЦМ-А2 |
Мтилон-Т |
ВАГ |
| Кравн |
-∆Н,
кДж/
моль
|
∆S,
Дж/
К*моль
|
-∆G,
кДж/
моль
|
Кравн |
-∆Н,
кДж/
моль
|
∆S,
Дж/
К*моль
|
-∆G,
кДж/
моль
|
Кравн |
-∆Н,
кДж/
моль
|
∆S,
Дж/
К*моль
|
-∆G,
кДж/моль
|
| 20 |
228 |
24,1 |
37,2 |
13,2 |
236 |
25,8 |
42,6 |
13,3 |
111 |
22,6 |
37,8 |
11,5 |
| 45 |
564 |
496 |
189 |
| 60 |
606 |
696 |
291 |
Энтальпию рассчитывали методом наименьших квадратов путем графического решения уравнения
lnKравн
=-∆H/RT+∆S/R.
Зависимость lnКравн
от 1/Т*10-3
представлена на рис.6.
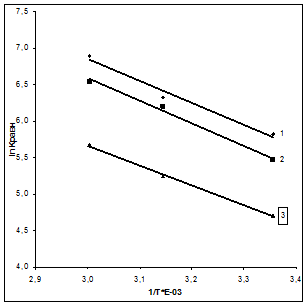
Рис.6. Зависимость константы равновесия от температуры для сорбции палладия на волокнах ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
По полученным данным рассчитываем энергию Гиббса процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ, по формуле
∆G=-RTLnKравн
.
По полученным энтальпии и энергии Гиббса рассчитываем энтропию процесса сорбции по формуле
∆S=(∆H-∆G)/T.
ИЗ полученных результатов видно, что значения энтропии и энтальпии способствуют самопроизвольному процессу сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ.
2.4.3 Изучение зависимости сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ от времени
Сорбцию проводили в статических условиях при температуре 20±1°С, масса волокна составила 0,100 ±0,002 г. Растворы палладия готовились по методике 2.2.1, рН составляла 1,0±0,1. Объем раствора 20 мл, концентрация палладия 2,0 мг/мл. Время насыщения задавали в интервале от 1 часа до 24 часов. По полученным данным (Приложение 3) построил кинетические кривые сорбции палладия в зависимости от времени рис.7.

Рис.7. Кинетические кривые сорбции палладия на волокнах ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
Из рисунка 5 следует, что при концентрировании палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ максимальная сорбция достигается за 6, 4 и 4 часов соответственно. Время полунасыщения для волокна ЦМ-А2 равно 1,5 часа, для волокна Мтилон-Т равно 2 часа и для волокна ВАГ 1 час.
Для определения лимитирующей стадии были посчитаны степень обмена – F, по формуле 7, Вτ по методу Бойда – Адомсона (Приложение 1) и -ln(1-F) значения, которых приведены в таблице 7.
Таблица 7. Кинетические характеристики сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ.
| время,ч |
аср
, мг-экв/г |
F |
Bt |
-ln(1-F) |
| ЦМ-А2 |
| 0,5 |
0,22 |
0,12 |
0,02 |
0,13 |
| 1 |
0,67 |
0,35 |
0,20 |
0,43 |
| 2 |
1,23 |
0,65 |
0,72 |
1,04 |
| 4 |
1,80 |
0,94 |
1,60 |
2,81 |
| 6 |
1,91 |
0,99 |
1,79 |
4,61 |
| Мтилон-Т |
| 0,5 |
0,34 |
0,13 |
0,02 |
0,13 |
| 1 |
0,79 |
0,29 |
0,13 |
0,35 |
| 2 |
1,57 |
0,58 |
0,58 |
0,88 |
| 4 |
2,24 |
0,83 |
1,24 |
1,80 |
| 6 |
2,58 |
0,96 |
1,67 |
3,18 |
| 8 |
2,69 |
0,99 |
1,79 |
4,61 |
| ВАГ |
| 0,5 |
0,45 |
0,22 |
0,07 |
0,25 |
| 1 |
1,01 |
0,50 |
0,41 |
0,69 |
| 2 |
1,57 |
0,78 |
1,07 |
1,50 |
| 4 |
1,91 |
0,95 |
1,62 |
2,90 |
| 6 |
2,02 |
0,99 |
1,79 |
4,61 |
По полученным результатам построили зависимости Вτ и –ln(1-F) от времени сорбции волокон ЦМ-А2, Мтилон-Т и ВАГ (рисунки 8 и 9 соответственно).
 
Рис.8. Кривая зависимости Вt от времени для волокон ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
Рис.9. Кривая зависимости Ln(1-F) от времени для волокон ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
На основании зависимостей 8 и 9 можно утверждать, что процесс сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ имеет смешанно-диффузионный характер.
Сорбцию проводили в статических условиях при температурах 20±1°С; 45±1°С; 60±1°С. Масса волокна составила 0,100±0,002 г. Концентрация палладия 2,0 мг/мл. Объем составлял 20 мл, рН составляла 1,0±0,1. Концентрацию палладия определяли по методике 2.2.1. Сорбцию определяли по отношению количества палладия до и после сорбции.
По полученным данным были рассчитаны коэффициенты диффузии для процессов сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ при температурах 20ºС, 45ºС и 60ºС, результаты приведены в таблице 8. Как видно из таблицы с увеличением температуры коэффициент диффузии увеличивается как для ЦМ-А2, Мтилон-Т, так для ВАГ.
Таблица 8. Коэффициенты диффузии и энергии активации для процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ
| Т,ºС |
ЦМ-А2 |
Мтилон-Т |
ВАГ |
| D,см²/с |
∆Еакт, кДж/моль |
D,см²/с |
∆Еакт, кДж/моль |
D,см²/с |
∆Еакт, кДж/моль |
| 20 |
2,4*10-9
|
12,2 |
1,66*10-9
|
4,9 |
3,3*10-9
|
10,5 |
| 45 |
3,7*10-9
|
1,99*10-9
|
4,8*10-9
|
| 60 |
4,3*10-9
|
2,17*10-9
|
5,3*10-9
|
Энергию активации рассчитывали методом наименьших квадратов путем графического решения уравнения
D=D0
e–
E
/
RT
.
Зависимость –lnD от 1/Т*10-3
представлена на рисунке 10.

Рис.10. Зависимость коэффициента диффузии от температуры для сорбции палладия на волокнах ЦМ-А2(1), Мтилон-Т(2) и ВАГ(3)
Значение энергии активации процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ равны 12,2, 4,8 и 10,5 кДж/моль соответственно. Невысокие значения энергии активации свидетельствуют о том, что лимитирующей стадией процесса сорбции является диффузия.
2.4.5 Изучение возможности регенерации волокон ЦМ-А2, Мтилон-Т и ВАГ.
Сорбцию проводили в статических условиях при температуре 20±1°С, масса волокна составила 0,100±0,002г. рН составляла 1,0±0,1. Концентрация палладия 2,13 мг/мл. Концентрацию палладия определяли по методике 2.2.1. Объем составлял 20 мл. Сорбцию определяли по отношению количества палладия до и после сорбции. Десорбцию проводили при температуре 20±1°С, масса волокна составила 0,100±0,002г. Объем составлял 20 мл.
Была исследована возможность десорбции палладия, следующими растворами:
Соляная кислота концентрированная;
Соляная кислота раствор 6н;
Соляная кислота 0,5н;
Гидроксид аммония концентрированный;
10% раствор тиомочевины в 0,5н соляной кислоте.
После регенерации волокна сжигали при температуре 950ºС в течении 3-4 часов и определяли концентрацию палладия по методике 2.2.1.
По полученным результатам рассчитаны массы сорбированного и десорбированного палладия. Результаты представлены в таблице 9.
Таблица 9. Регенерация волокон
| Элюент |
Волокно |
М,мг
до
|
М,мг
после
|
Регенерация,
%
|
| 10% раствор тиомочевины в 0,5н HCl |
цм-а2 |
10,08 |
1,08 |
89,3 |
| мтилон-т |
16,03 |
1,64 |
89,7 |
| ВАГ |
11,27 |
1,05 |
90,7 |
| Аммиак концентрированный |
цм-а2 |
9,49 |
1,53 |
83,9 |
| мтилон-т |
17,82 |
13,11 |
26,4 |
| ВАГ |
11,27 |
0,75 |
93,3 |
| 12н HCl(концентрированный) |
цм-а2 |
11,27 |
6,15 |
45,5 |
| мтилон-т |
13,06 |
11,50 |
12,0 |
| ВАГ |
9,49 |
0,00 |
100,0 |
| 6н HCl |
цм-а2 |
8,89 |
6,74 |
24,3 |
| мтилон-т |
14,25 |
13,58 |
4,7 |
| ВАГ |
13,06 |
7,03 |
46,1 |
| 0,5н HCl |
цм-а2 |
8,89 |
7,52 |
15,5 |
| мтилон-т |
14,25 |
13,88 |
2,6 |
| ВАГ |
11,87 |
9,71 |
18,2 |
Результаты десорбции палладия показывают, что для волокна ЦМ-А2 хорошим элюентом является 10% раствор тиомочевины в 0,5н соляной кислоте и гидрооксид аммония концентрированный, десорбция палладия составила 89,3% и 83,9% соответственно. Соляной кислотой удается десорбировать от 45% до 15% в зависимости от концентрации.
С волокна Мтилон-Т количественно десорбировать палладий удается лишь 10% раствором тиомочевины в 0,5н соляной кислоте, в остальных случаях десорбция не превышает 26%.
Для волокна ВАГ количественно десорбировать палладий возможно 10% раствором тиомочевины в 0,5н соляной кислоте, гидрооксидом аммония концентрированным и концентрированной соляной кислотой, но при использовании последней волокно разрушается. Десорбция палладия составила 90,7%, 93,3% и 100% соответственно. При уменьшении концентрации соляной кислоты величина десорбции падает.
Выводы
1. Волокна ЦМ-А2, Мтилон-Т и ВАГ можно использовать для сорбции палладия из хлоридных растворов.
2. По изотермам сорбции палладия волокнами ЦМ-А2, Мтилон-Т и ВАГ установлено, что на волокне Мтилон-Т сорбционная емкость больше, чем на волокне ЦМ-А2 и ВАГ и составляет 2,92 ± 0,1 мг-экв/г, 2,13 ± 0,1 мг-экв/г и 2,02 ± 0,1 мг-экв/г соответственно.
3. Рассчитаны термодинамические параметры процессов сорбции. Значения энтропии и энтальпии способствуют самопроизвольному процессу сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ.
4. По кинетическим кривым было установлено, что максимальная сорбция палладия достигается на волокне ВАГ и ЦМ-А2 за 4 часа, а на волокне Мтилон-Т за 6 часов.
5. Из кинетических зависимостей Вτ-τ, -ln(1-F) установлено, что лимитирующей стадией кинетики сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ является смешанная диффузия. Что подтверждается рассчитанными значениями энергиями активации.
6. 10% раствор тиомочевины в 0,5н соляной кислоте позволяет десорбировать палладий с волокон ЦМ-А2, Мтилон-Т и ВАГ на 89-91%.
Литература
1. Лебедев К.Б., Казанцев Е.И., Розманов В.М., Пахолков В.С., Чемезов В.А. Иониты в цветной металлургии. М.; "Металлургия", 1975. 352с.
2. Гельферих Ф. Иониты. М., Издатлит. 1962. 490с.
3. Полянский Н.Г. Методы исследования ионитов. М.,”Химия”, 1976.208с.
4. Салдадзе К.М. Ионообменные высокомолекулярные соединения. М., Госхимиздат, 1960. 355с.
5. Салдадзе К.М., Ионнообменные материалы.
6. Зверев М.П. Хемосорбционные волокна. М., ”Химия”, 1981.191с.
7. Лурье А.А. Сорбенты и хроматографические носители. М., ”Химия”, 1972.320с.
8. Мясоедова Г.В., Савин С.Б. Хелатообразующие сорбенты. М., ”Наука”, 1984.173с.
9. Салдадзе К.М., Пашков В.А., Титов В.С., Ионообменные высокомолекулярные соединения, М.; Госхимиздат, 1960. 355с.
10. ЖАХ, 1976, №4, с.742-745
11. Копылова В.Д., Погодина Т.Б., Клюев Н.В. ЖФХ, 1990, № 3, с. 724-728
12. Анпилогова Г.Р., Афзалетдинова Н.Г., Хисамутдинов Р.А., Муринов Ю.И., ЖНХ, 1998, т.71, вып. 8, с. 1286-1291
13. Горленко Л.Е., Емельянова Г.И., Зверев М.П. и др., ЖФХ, 1993, т.67, №9
14. Анпилогова Г.Р., Алеев Р.С., Афзалетдинова Н.Г. и др., ЖНХ, 1995, т.40, №3, с. 466-471
15. Симанова С.А., Бурмистрова Н.М., Казакевич Ю.Е. и др., ЖПХ, 1996, т.69, вып. 5, с.772-777
16. Симанова С.А., Кузнецова Т.В., Беляев А.Н. и др., ЖПХ, 1999, т.72, вып.8, с.1276-1281
17. Симанова С.А., Князьков О.В., Беляев А.Н. и др., ЖПХ, 1998, т.71, вып.2, с.220-226
18. Симанова С.А., Кукушкин Ю.Н, Известия ВУЗов ХиХТ, 1986, т.29, №5, с.3-14
19. Симанова С.А., Кузнецова Т.В., Беляев А.Н. и др., ЖПХ, 1999, т.72, вып.4, с.580-586
20. Бурмистрова Н.М., Симонова С.А., Тезисы докладов 17 Международного Черняевского Совещания по химии и технологии платиновых металлов, М.: 2001
21. Половкина Г.М., Салазкин С.Н., Малофеева Г.И. и др., ЖПХ, 1989, т.62, №2, с.337-341
22. Ковалев И.А., Цизин Г.И., Формановский А.А. и др., ЖНХ, 1995, т.40, №5, с. 828-833
23. Мясоедова Г.В., Антокольская И.И. и др. ЖАХ, 1974, т. 29, № 11, с. 2104-2108.
24. Шаулина Л.П., ЖФХ, 1982, №5, с.1212-1216
25. Мясоедова Г.В.,ЖАХ, 1988, т.43, №12, с. 2117.
26. Симанова С.А., Бурмистрова Н.М., ЖНХ, 1994, т.32, №2, с. 288.
27. Назаренко Р.М., ЖПХ, 1972, т.4, №2, с.342.
28. Химия и химическая технология. 1974, №2, 26с.
29. Оробинская В.А., Назаренко Р.М., Научные труды института ”Сибцветметниипроект”, Красноярск, 1973,105с.
30. Кузнецова Т.В.ЖАХ, 1982, №9, с. 1574.
31. Симанова С.А., Князьков О.В.ЖПХ, 1984, №11 с. 2464.
32. Симанова С.А., Бурмистрова Н.М., Казакевич Ю.Е. и др., ЖПХ, 1996, т.69, вып. 5, с.772-777
33. Бурмистрова Н.М., Казакевич Ю.Е. ЖАХ, 1974, №11, с.2142.
34. ЖФХ, 1984, т.48, №8, с. 1976.
35. Химия и химическая технология. 1976., Т.19, 97с.
36. Химия и химическая технология. 1986., Т.29, 3с.
37. Гинзбург С.И. и др., Аналитическая химия платиновых металлов, М.; Наука, 1972, 614с.
38. Креймер С.Е. и др. ЖАХ, 1960, № 15, с. 467
39. ГОСТ 10896-76, Иониты. Подготовка к испытанию.
40. ГОСТ 20255.1-89, Иониты. Методы определения статической обменной емкости.
41. ГОСТ 20255.2-89, Иониты. Методы определения динамической обменной емкости.
Приложение 1
Зависимость Вτ от F
| Вτ*104
|
F |
Вτ*102
|
F |
Вτ |
F |
| 0,1 |
0,0035 |
30,00 |
0,059 |
60 |
0,65 |
| 0,2 |
0,0050 |
0,2 |
0,035 |
70 |
0,690 |
| 0,4 |
0,007 |
1,0 |
0,090 |
1,0 |
0,720 |
| 0,6 |
0,0083 |
2,0 |
0,125 |
1,2 |
0,775 |
| 0,8 |
0,0095 |
3,0 |
0,155 |
1,5 |
0,818 |
| 1,00 |
0,0105 |
4,0 |
0,180 |
2,0 |
0,865 |
| 1,5 |
0,0130 |
5,0 |
0,205 |
2,5 |
0,915 |
| 2,00 |
0,0153 |
6,0 |
0,225 |
3,0 |
0,956 |
| 3,00 |
0,0190 |
8,0 |
0,265 |
3,5 |
0,98 |
| 4,00 |
0,0228 |
10,0 |
0,3 |
| 5,00 |
0,0240 |
15,0 |
0,365 |
| 6,00 |
0,026 |
20,0 |
0,42 |
| 8,00 |
0,030 |
25,0 |
0,462 |
| 10,00 |
0,034 |
30 |
0,497 |
| 15,00 |
0,042 |
40 |
0,555 |
| 20,00 |
0,048 |
50 |
0,605 |
Приложение 2
Изучение зависимости сорбции палладия на волокнах от равновесной концентрации.
Статистические параметры: Р=0,95; N=3.
| ЦМ-А2 |
| Сравн, мг/мл |
Сисх, мг/мл |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
| 1,60 |
2,10 |
1,46 |
2,13 |
2,13 |
1,91 |
0,02 |
3,15 |
| 1,18 |
1,69 |
1,57 |
1,91 |
2,25 |
1,91 |
0,03 |
4,84 |
| 0,75 |
1,24 |
1,94 |
1,78 |
1,78 |
1,83 |
0,02 |
3,04 |
| 0,41 |
0,78 |
1,40 |
1,40 |
1,40 |
1,40 |
0,00 |
0,00 |
| 0,26 |
0,61 |
1,38 |
1,27 |
1,27 |
1,30 |
0,03 |
3,66 |
| 0,09 |
0,35 |
0,98 |
0,98 |
0,95 |
0,97 |
0,02 |
2,15 |
| Мтилон-Т |
| 1,39 |
2,13 |
2,58 |
2,92 |
2,92 |
2,81 |
00,0 |
0,00 |
| 0,84 |
1,57 |
2,67 |
2,84 |
2,67 |
2,73 |
0,02 |
3,39 |
| 0,62 |
1,30 |
2,50 |
2,50 |
2,67 |
2,56 |
0,02 |
3,76 |
| 0,35 |
0,94 |
2,25 |
2,19 |
2,19 |
2,21 |
0,03 |
4,12 |
| 0,14 |
0,59 |
1,67 |
1,74 |
1,67 |
1,69 |
0,03 |
3,78 |
| 0,04 |
0,31 |
0,99 |
1,04 |
1,04 |
1,02 |
0,04 |
2,58 |
| ВАГ |
| 1,98 |
2,52 |
2,02 |
2,02 |
2,02 |
2,02 |
0,00 |
0,00 |
| 1,39 |
1,92 |
2,13 |
1,79 |
2,13 |
2,02 |
0,03 |
4,21 |
| 0,98 |
1,45 |
1,72 |
1,88 |
1,72 |
1,77 |
0,03 |
2,78 |
| 0,66 |
1,06 |
1,44 |
1,44 |
1,60 |
1,49 |
0,02 |
2,86 |
| 0,22 |
0,50 |
1,13 |
1,00 |
1,00 |
1,04 |
0,02 |
1,92 |
| 0,11 |
0,35 |
0,92 |
0,88 |
0,88 |
0,89 |
0,04 |
5,00 |
Приложение 3
Изучение зависимости сорбции палладия на волокнах от времени.
Статистические параметры: Р=0,95; N=3.
При 20˚С.
| ЦМ-А2 |
| Время,ч. |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
F |
Bt |
ln(1-F) |
| 0,5 |
0,00 |
0,34 |
0,34 |
0,22 |
0,05 |
7,18 |
0,12 |
0,02 |
0,13 |
| 1 |
0,67 |
0,67 |
0,67 |
0,67 |
0,00 |
0,00 |
0,35 |
0,20 |
0,43 |
| 2 |
1,35 |
1,01 |
1,35 |
1,23 |
0,03 |
8,57 |
0,65 |
0,72 |
1,04 |
| 4 |
1,68 |
2,02 |
1,68 |
1,80 |
0,03 |
3,22 |
0,94 |
1,60 |
2,81 |
| 6 |
2,02 |
1,68 |
2,02 |
1,91 |
0,02 |
4,56 |
0,99 |
1,79 |
4,61 |
| Мтилон-Т ЦМ-А2 |
| 0,5 |
0,45 |
0,11 |
0,45 |
0,34 |
0,03 |
4,44 |
0,13 |
0,02 |
0,13 |
| 1 |
0,79 |
1,12 |
0,45 |
0,79 |
0,03 |
9,38 |
0,29 |
0,13 |
0,35 |
| 2 |
1,46 |
1,46 |
1,80 |
1,57 |
0,03 |
5,71 |
0,58 |
0,58 |
0,88 |
| 4 |
2,47 |
2,13 |
2,13 |
2,24 |
0,05 |
4,34 |
0,83 |
1,24 |
1,80 |
| 6 |
2,80 |
2,80 |
2,13 |
2,58 |
0,06 |
8,57 |
0,96 |
1,67 |
3,18 |
| 8 |
2,47 |
2,80 |
2,80 |
2,69 |
0,01 |
2,21 |
0,99 |
1,79 |
4,61 |
| ВАГ |
| 0,5 |
0,67 |
0,34 |
0,34 |
0,45 |
0,01 |
5,57 |
0,22 |
0,07 |
0,25 |
| 1 |
1,01 |
1,01 |
1,01 |
1,01 |
0,03 |
7,32 |
0,50 |
0,41 |
0,69 |
| 2 |
1,68 |
1,35 |
1,68 |
1,57 |
0,04 |
3,64 |
0,78 |
1,07 |
1,50 |
| 4 |
1,68 |
2,02 |
2,02 |
1,91 |
0,03 |
6,51 |
0,95 |
1,62 |
2,90 |
| 6 |
2,02 |
2,02 |
2,02 |
2,02 |
0,00 |
0,00 |
0,99 |
1,79 |
4,61 |
При 45˚С.
| ЦМ-А2 |
| Время,ч. |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
F |
Bt |
ln(1-F) |
| 0,5 |
0,45 |
0,45 |
0,11 |
0,34 |
0,02 |
3,15 |
0,18 |
0,04 |
0,19 |
| 1 |
1,12 |
0,78 |
0,78 |
0,90 |
0,03 |
4,84 |
0,47 |
0,36 |
0,63 |
| 2 |
1,46 |
1,46 |
1,46 |
1,46 |
0,00 |
0,00 |
0,76 |
1,03 |
1,45 |
| 3 |
2,13 |
1,79 |
1,79 |
1,91 |
0,00 |
0,00 |
0,98 |
1,75 |
3,91 |
| 4 |
1,80 |
1,80 |
2,13 |
1,91 |
0,03 |
3,66 |
0,99 |
1,79 |
4,61 |
| Мтилон-Т |
| 0,5 |
0,45 |
0,45 |
0,11 |
0,34 |
0,03 |
4,21 |
0,12 |
0,02 |
0,13 |
| 1 |
0,79 |
0,45 |
1,12 |
0,79 |
0,03 |
2,78 |
0,29 |
0,13 |
0,34 |
| 2 |
1,46 |
1,12 |
1,46 |
1,35 |
0,02 |
2,86 |
0,49 |
0,40 |
0,67 |
| 4 |
2,47 |
2,13 |
2,13 |
2,24 |
0,02 |
1,92 |
0,82 |
1,18 |
1,69 |
| 5 |
2,47 |
2,80 |
2,80 |
2,69 |
0,04 |
5,00 |
0,98 |
1,75 |
3,83 |
| 6 |
2,80 |
2,64 |
2,80 |
2,75 |
0,03 |
4,21 |
0,99 |
1,79 |
4,61 |
| ВАГ |
| 0,5 |
0,67 |
0,34 |
0,67 |
0,56 |
0,01 |
5,57 |
0,28 |
0,12 |
0,33 |
| 1 |
1,35 |
1,01 |
1,35 |
1,23 |
0,03 |
7,32 |
0,61 |
0,64 |
0,94 |
| 2 |
1,68 |
2,02 |
1,68 |
1,79 |
0,04 |
3,64 |
0,89 |
1,42 |
2,19 |
| 3 |
2,35 |
2,02 |
2,02 |
2,13 |
0,03 |
6,51 |
0,98 |
1,75 |
3,91 |
| 4 |
2,02 |
2,02 |
2,02 |
2,02 |
0,00 |
0,00 |
0,99 |
1,79 |
4,61 |
При 60˚С.
| ЦМ-А2 |
| Время,ч. |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
F |
Bt |
ln(1-F) |
| 0,5 |
0,67 |
0,34 |
0,67 |
0,56 |
0,01 |
2,13 |
0,26 |
0,11 |
0,31 |
| 1 |
1,35 |
1,01 |
0,67 |
1,01 |
0,05 |
4,48 |
0,47 |
0,37 |
0,64 |
| 2 |
1,68 |
1,35 |
1,68 |
1,57 |
0,06 |
7,22 |
0,74 |
0,96 |
1,34 |
| 2,5 |
2,02 |
2,02 |
2,36 |
2,13 |
0,02 |
3,76 |
0,98 |
1,75 |
3,91 |
| 3 |
2,02 |
2,02 |
2,35 |
2,13 |
0,02 |
3,54 |
0,99 |
1,79 |
4,61 |
| Мтилон-Т |
| 0,5 |
0,56 |
0,56 |
0,22 |
0,45 |
0,03 |
4,44 |
0,15 |
0,03 |
0,17 |
| 1 |
0,90 |
0,90 |
0,56 |
0,78 |
0,03 |
9,38 |
0,27 |
0,11 |
0,31 |
| 2 |
1,24 |
1,57 |
1,24 |
1,35 |
0,03 |
5,71 |
0,46 |
0,35 |
0,62 |
| 3 |
2,25 |
1,91 |
1,91 |
2,02 |
0,05 |
4,34 |
0,69 |
0,83 |
1,18 |
| 4 |
2,91 |
2,91 |
2,91 |
2,91 |
0,06 |
8,57 |
0,98 |
1,75 |
3,91 |
| 5 |
2,92 |
2,92 |
2,92 |
2,92 |
0,01 |
2,21 |
0,99 |
1,79 |
4,61 |
| ВАГ |
| 0,5 |
0,79 |
0,45 |
0,79 |
0,67 |
0,05 |
4,78 |
0,32 |
0,16 |
0,38 |
| 1 |
1,46 |
1,12 |
1,46 |
1,35 |
0,04 |
3,12 |
0,63 |
0,69 |
1,00 |
| 2 |
1,79 |
2,13 |
1,46 |
1,79 |
0,08 |
12,03 |
0,84 |
1,27 |
1,84 |
| 2,5 |
2,14 |
2,14 |
1,80 |
2,02 |
0,02 |
2,56 |
0,95 |
1,64 |
3,00 |
| 3 |
2,13 |
2,13 |
2,13 |
2,13 |
0,00 |
0,00 |
0,99 |
1,79 |
4,61 |
Приложение 4
Расчет термодинамических характеристик процесса сорбции палладия на волокнах ЦМ-А2, Мтилон-Т и ВАГ.
Статистические параметры: Р=0,95; N=3.
При 20˚С.
| Сисх, мг/мл |
Сравн, мг/мл |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
Краспр. |
| ЦМ-А2 |
| 2,10 |
1,60 |
1,46 |
2,13 |
2,13 |
1,91 |
0,00 |
0,00 |
7,96 |
| 1,69 |
1,18 |
1,57 |
1,91 |
2,25 |
1,91 |
0,03 |
4,21 |
9,26 |
| 1,24 |
0,75 |
1,94 |
1,78 |
1,78 |
1,83 |
0,03 |
2,78 |
11,35 |
| 0,78 |
0,41 |
1,40 |
1,40 |
1,40 |
1,40 |
0,02 |
2,86 |
13,44 |
| 0,61 |
0,26 |
1,38 |
1,27 |
1,27 |
1,30 |
0,02 |
1,92 |
16,20 |
| 0,35 |
0,09 |
0,98 |
0,98 |
0,95 |
0,97 |
0,04 |
5,00 |
23,40 |
| Мтилон-Т |
| 2,13 |
1,39 |
2,58 |
2,92 |
2,92 |
2,81 |
0,01 |
5,57 |
10,36 |
| 1,57 |
0,84 |
2,67 |
2,84 |
2,67 |
2,73 |
0,03 |
7,32 |
13,10 |
| 1,30 |
0,62 |
2,50 |
2,50 |
2,67 |
2,56 |
0,04 |
3,64 |
14,79 |
| 0,94 |
0,35 |
2,25 |
2,19 |
2,19 |
2,21 |
0,03 |
6,51 |
18,16 |
| 0,59 |
0,14 |
1,67 |
1,74 |
1,67 |
1,69 |
0,00 |
0,00 |
25,24 |
| 0,31 |
0,04 |
0,99 |
1,04 |
1,04 |
1,02 |
0,01 |
5,57 |
38,98 |
| ВАГ |
| 2,52 |
1,98 |
2,02 |
2,02 |
2,02 |
2,02 |
0,02 |
3,15 |
7,35 |
| 1,92 |
1,39 |
2,13 |
1,79 |
2,13 |
2,02 |
0,03 |
4,84 |
8,78 |
| 1,45 |
0,98 |
1,72 |
1,88 |
1,72 |
1,77 |
0,00 |
0,00 |
9,81 |
| 1,06 |
0,66 |
1,44 |
1,44 |
1,60 |
1,49 |
0,00 |
0,00 |
10,91 |
| 0,50 |
0,22 |
1,13 |
1,00 |
1,00 |
1,04 |
0,03 |
3,66 |
15,71 |
| 0,35 |
0,11 |
0,92 |
0,88 |
0,88 |
0,89 |
0,02 |
3,15 |
20,29 |
При 45˚С.
| Сисх, мг/мл |
Сравн, мг/мл |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
Краспр. |
| ЦМ-А2 |
| 2,13 |
1,57 |
1,91 |
2,24 |
2,24 |
2,13 |
0,03 |
4,44 |
8,49 |
| 1,57 |
1,01 |
2,16 |
2,16 |
2,00 |
2,11 |
0,03 |
9,38 |
10,54 |
| 1,06 |
0,56 |
1,94 |
1,94 |
1,78 |
1,89 |
0,03 |
5,71 |
13,37 |
| 0,60 |
0,22 |
1,39 |
1,46 |
1,46 |
1,44 |
0,05 |
4,34 |
18,44 |
| 0,29 |
0,07 |
0,82 |
0,82 |
0,89 |
0,84 |
0,06 |
8,57 |
25,38 |
| 2,13 |
1,57 |
1,91 |
2,24 |
2,24 |
2,13 |
0,01 |
2,21 |
8,49 |
| Мтилон-Т |
| 2,13 |
1,36 |
2,92 |
2,92 |
2,92 |
2,92 |
0,02 |
3,15 |
10,68 |
| 1,57 |
0,79 |
2,47 |
3,14 |
3,14 |
2,92 |
0,03 |
4,84 |
13,97 |
| 1,06 |
0,34 |
2,62 |
2,78 |
2,78 |
2,73 |
0,00 |
0,00 |
20,72 |
| 0,60 |
0,11 |
2,09 |
1,74 |
1,74 |
1,85 |
0,00 |
0,00 |
29,60 |
| 0,29 |
0,05 |
0,89 |
0,95 |
0,95 |
0,93 |
0,03 |
3,66 |
32,96 |
| 2,13 |
1,36 |
2,92 |
2,92 |
2,92 |
2,92 |
0,02 |
3,15 |
10,68 |
| ВАГ |
| 2,13 |
1,60 |
2,25 |
1,91 |
1,91 |
2,02 |
0,02 |
3,15 |
8,19 |
| 1,57 |
1,03 |
1,80 |
2,13 |
2,13 |
2,02 |
0,03 |
4,84 |
10,20 |
| 1,06 |
0,55 |
1,94 |
1,94 |
1,94 |
1,94 |
0,00 |
0,00 |
13,74 |
| 0,60 |
0,32 |
0,73 |
1,23 |
1,23 |
1,06 |
0,00 |
0,00 |
13,24 |
| 0,29 |
0,08 |
0,73 |
0,73 |
0,90 |
0,79 |
0,03 |
3,66 |
22,29 |
| 2,13 |
1,60 |
2,25 |
1,91 |
1,91 |
2,02 |
0,02 |
3,15 |
8,19 |
При 60˚С
| Сисх, мг/мл |
Сравн, мг/мл |
а1
, мгэкв/г |
а2
, мгэкв/г |
а3
, мгэкв/г |
аср
, мгэкв/г |
S |
W |
Краспр. |
| ЦМ-А2 |
| 2,13 |
1,60 |
1,91 |
2,25 |
1,91 |
2,02 |
0,01 |
5,57 |
8,19 |
| 1,57 |
1,02 |
2,00 |
2,16 |
2,00 |
2,05 |
0,03 |
7,32 |
10,32 |
| 1,06 |
0,57 |
1,94 |
1,77 |
1,77 |
1,83 |
0,04 |
3,64 |
12,98 |
| 0,60 |
0,23 |
1,39 |
1,39 |
1,46 |
1,41 |
0,03 |
6,51 |
18,04 |
| 0,29 |
0,07 |
0,82 |
0,82 |
0,89 |
0,84 |
0,00 |
0,00 |
25,38 |
| 2,13 |
1,60 |
1,91 |
2,25 |
1,91 |
2,02 |
0,01 |
5,57 |
8,19 |
| Мтилон-Т |
| 2,13 |
1,39 |
2,58 |
2,92 |
2,92 |
2,81 |
0,02 |
3,15 |
10,36 |
| 1,57 |
0,82 |
2,13 |
3,14 |
3,14 |
2,81 |
0,03 |
4,84 |
13,45 |
| 1,06 |
0,37 |
2,62 |
2,62 |
2,62 |
2,62 |
0,02 |
3,04 |
19,45 |
| 0,60 |
0,11 |
2,09 |
1,74 |
1,74 |
1,85 |
0,00 |
0,00 |
29,60 |
| 0,29 |
0,03 |
0,89 |
1,02 |
1,02 |
0,98 |
0,03 |
3,66 |
39,29 |
| 2,13 |
1,39 |
2,58 |
2,92 |
2,92 |
2,81 |
0,02 |
2,15 |
10,36 |
| ВАГ |
| 2,13 |
1,57 |
2,25 |
2,25 |
1,91 |
2,13 |
0,00 |
0,00 |
8,50 |
| 1,57 |
1,03 |
1,80 |
2,13 |
2,13 |
2,02 |
0,03 |
4,21 |
10,20 |
| 1,06 |
0,57 |
1,94 |
1,77 |
1,77 |
1,83 |
0,03 |
2,78 |
12,99 |
| 0,60 |
0,32 |
0,73 |
1,40 |
1,06 |
1,06 |
0,02 |
2,86 |
13,24 |
| 0,29 |
0,07 |
0,56 |
1,07 |
0,90 |
0,84 |
0,02 |
1,92 |
25,44 |
| 2,13 |
1,57 |
2,25 |
2,25 |
1,91 |
2,13 |
0,04 |
5,00 |
8,50 |
|