Содержание
Задача №3
Задача №13
Задача №23
Задача №33
Задача №43
Задача №53
Задача №63
Задача №73
Задача №83
Задача №93
Рекомендуемая литература
Задача № 3
Дано: m (Zn) = 1,5 кг
V(Ha
) = ?
Уравнение реакций:
Zn + 2HCl = ZnC + H2
-
По уравнению реакции количество водорода равно:
N(H2
) = n(Zn)
Найти количество цинка
N =
N - количество вещества, моль
m – масса вещества, г
M – молярная масса, г/мольN = 23 моль
N(H2
) = 23 моль
Найдём объём водорода при нормальных условиях
V(H2
) = N(H2
)*Vм
V – объём, л
N – количество вещества
Vм
– молярный объём, л/моль
При нормальных условиях молярный объем любого газа равен 22,4 л/моль.
V(H2
) = 23 * 22,4 = 515,2 л
Ответ: V(H2
) = 515,2 л
Задача № 13
Элемент № 24 – хром (Cr)
Положение в периодической системе: 4 период, 6 группа, побочная подгруппа.
Число протонов в ядре атома равно заряду ядра атома т.е. номеру элемента: Z = 24
Число нейтронов N равно:
N = A – Z,
где А - массовое число
N = 53 – 24 = 28
Электронная формула элемента для внешнего и продвинутого уровня:
+24
Сr …3s2
3p6
4s1
3d5
Электронная графическая формула для внешнего и продвинутого уровня:
Для хрома характерен проскок электрона, для образования более устойчивой электронной конфигурации, электрон проскакивает на орбитале с более высокой скоростью.
Максимальное число валентных электронов 6 они находятся на 4s, 4p и 4d – орбиталях.
Хром – переходный элемент и относится к семейству в – элементов.
Возможные степени окисления +2, +3, +6.
Кислородные соединение хрома: Cr2
O3
, CrO3
, CrO. Cr2
O3
– оксид хрома (3) относительно к амфотерным оксидам.
Cr2
O3
– нерастворимый в воде
В высокодисперсном состоянии растворяется в сильных кислотах с образованием солей хрома(3):
Cr2
O3
+ 6HCl- 2CrCl3
+ 3H2
O
При взаимодействии с щелочами, содой и кислыми солями даёт соединение Cr3+
растворимый в воде:
Cr2
O3
+ 2KOH - 2KCrO2
+ H2
O
Cr2
O3
+ Na2
CO3
- 2NaCrO2
+ CO2
-
Cr2
O3
+ 6 KHSO-Cr2
(SO4
)3
+ 3H2
O
В присутствии сильного окисления в щелочной среде Сr2
O окисляется до хроматы:
Сr2
O3
+ 3KNO3
+ 2Na2
CO3
- 2Na2
CrO4
+ 3KNO2
+ 2CO2
Сильные восстановители восстанавливают Cr2
O3
:
Сr2
O3
+ 3Al-Al2
O3
+ 2 Cr
CrO3
– кислотный оксид хрома (4), ангидрид хромовой и дихромовой кислот. При его растворении в воде образуется хромовая кислота (при недостатке СrO3
):
CrO3
+ H2
O-H2
Cr4
O4
или дихромовая кислота (при избытке CrO3
):
2CrO3
+ H2
O-H2
Cl2
O7
CrO3
реагирует со щелочами образует хроматы:
CrO3
+ 2KOH-K2
CrO4
+ H2
O
В кислой среде ион CrO4
2-
превращается в ион Cr2O7
2-
. В щелочной среде эта реакция протекает в обратном направлении:
2CrO4
2-
+ 2Н+
-Cr2
O7
2-
+ H2
O (кислотная среда)
2CrO4
2-
+ 2Н+
-Cr2
O7
2-
+ H2
O (щелочная среда)
При нагревании выше 2500
С CrO3
разлагается:
4CrO3
- 2Сr2
O3
+ 3O2
-
CrO3
– сильный окислитель (восстанавливается до Cr2
O3
). Окисляет йод, серу, фосфор, уголь:
4CrO3
+ 3S- 2 Cr4
O3
+ SO2
-
CrO – оксид хрома (3), пирофорный(в тонкораздробленном состоянии воспламеняется на воздухе), чёрный порошок, растворяется в разбавленной соляной кислоте:
CrO + 2HCl-CrCl2
+ H2
O
CrO – сильный восстановитель, чрезвычайно неустойчив в присутствии влаги и кислорода:
4СrO + 3O2
- 2Cr2
O3
Гидратные соединения: Сr(OH)2
, Cr(OH)3
, H2
CrO4
, HCr2
O7
Cr(OH)2
– сильный восстановитель, переходит в соединение Сr3+
под действием кислорода воздуха:
4 Сr(OH)2
+ O2
+ 2H2
O - 4Cr(OH)3
При прокаливании в отсутствие кислорода образуется оксид хрома (2) СrO. При прокаливании на воздухе превращается в Сr2
O3
.
Cr(OH)3
– нерастворимый в воде гидроксид хрома (3), обладает амфотерными свойствами Cr(OH)3
растворяется как в кислотах, так и в щелочах:
2Cr(OH)3
+ 3H2
SO4
- Cr2
(SO4
)3
+ 6H2
O
Cr(OH)3
+ KOH - K[Cr(OH)4]
При прокаливании Сr(OH)3
получают оксид Сr2
O3
:
2 Сr(OH)3
-Cr2
O3
+ 3H2
O
2H2
CrO4
– хромовая кислота, кислота средне силы.
H2
Cr2
O7
– дихромовая кислота, более сильная
Задача № 23
Дано:
T = 298 K
∆ 1
H0
= 298 - ?, ∆ 1
S0
= 298 - ?, ∆ 1
G0
= 298 - ?
CaCO4
= CaO + CO2
Стандартные термодинамические характеристики участков реакции:
кДж
 ∆ 1
H0
298
, моль ∆ 1
H0
298
, моль
|
Дж
 ∆ 1
S0
298
, моль*К ∆ 1
S0
298
, моль*К
|
кДж
 ∆ 1
G0
298
, моль ∆ 1
G0
298
, моль
|
CaCO4
CaO
CO2
|
-1207
-635,5
-393,5
|
88,7
39,7
213,7
|
-1127,7
-604,2
-394,4
|
∆ 1
H0
298
– тепловой эффект реакции при стандартной температуре.
∆ 1
S0
298
– изменение энтропии реакции при стандартной температуре.
∆ 1
G0
298
– химическое средство (изменение энергии Гиббса) при стандартной температуре.
∆ 1
H0
298
– стандартная энтальпия образования вещества при T = 298
∆ 1
S0
298
– стандартное изменение энтропии образования вещества при T = 298
∆ 1
G0
298
– стандартное изменение энергии Гиббса образования вещества при T = 298
∆ 1
H0
298
= ∑∆ 1
H0
298
(продуктов реакции) – ∑∆ 1
H0
298
(исходных веществ)
∆ 1
H0
298
= (∆ 1
H0
298
(CaO) + ∆ 1
H0
298
(CO2
)) - ∆ 1
H0
298
(CaCO3
)
∆ 1
H0
298
= (-635,5 + (-393,5)) – (-1207) = -1029 + 1207 = 178 кДж
Вывод: в ходе реакции поглотилось 178 кДж тепла, так как ∆ 1
H0
298
> 0
∆ 1
S0
298
= ∑∆ 1
S0
298
(продуктов реакции) – ∑∆ 1
S0
298
(исходных веществ)
∆ 1
S0
298
= (∆ 1
S0
298
(CaO) + ∆ 1
S0
298
(CO2
)) - ∆ 1
S0
298
(CaCO3
)
∆ 1
S0
298
= (39,7 + 213,7) - 88,7 = 164 Дж/К
Вывод: молекулярный беспорядок в системе увеличивается, так как ∆ 1
S0
298
> 0
∆ 1
G0
298
= ∑∆ 1
H0
298
(продуктов реакции) – ∑∆ 1
H0
298
(исходных веществ)
∆ 1
G0
298
= (∆ 1
H0
298
(CaO) + ∆ 1
H0
298
(CO2
)) - ∆ 1
H0
298
(CaCO3
)
∆ 1
G0
298
= (-604,2 + (-394,4)) – (-1127,7) = 129,1 кДж
Вывод: самопроизвольное протекание реакции невозможно, так как ∆ 1
G0
298
> 0
Задача № 33
Дано: г = 3 Т1 =
1200
С , Т2
= 800
С
V1
– скорость реакции
г – температурный коэффициент скорости реакции Вант-Гоффа
Т – температура  3 = 34
= 81 3 = 34
= 81
Ответ: скорость химической уменьшается в 81 раз
Задача № 43
Дано: mр-ра 1
= 300 г
mр-ра 2
= 400 г
щ1
= 25 %
щ2
= 40 %
щ3
= ?
Массовая доля вещества в растворе равна:
щ = * 100 %
щ1
= 25 % щ = массовая доля, %
mв-ва
– масса вещества
mр-ра
– масса раствора
Массу вещества в первм и во втором растворе найти можно по формуле:
 mв-ва 1
= mв-ва 1
=
 mв-ва 2
= mв-ва 2
=
 mв-ва 1
= = 75 г mв-ва 1
= = 75 г
 mв-ва 2
= = 160 г mв-ва 2
= = 160 г
Масса вещества в растворе после смещения:
mр-ра 3
= mр-ра 1
+ mр-ра 2
mр-ра 3
= 75 + 160 = 235 г
Масса полученного раствора равна:
mр-ра 3
= mр-ра 1
+ mр-ра 2
mр-ра 3
= 300 + 400 = 700 г
Массовая доля вещества в полученном растворе равна:
 щ3
= * 100 % щ3
= * 100 %
 щ3
= * 100 % = 33,6 % щ3
= * 100 % = 33,6 %
Ответ: щ3
= 33,6 %
Задача № 53
HF + KOH = KF + H2
O
HF, H2
O – слабые электролиты
KOH, KF – сильные электролиты, диссоциируют на ионы в растворе
HF + OH = F + H2
O – уравнение в сокращённой ионно-молекулярной форме
Задача № 63
  Fe2
(SO4
)3
2Fe3+
+ 3SO4
2-
(уравнение диссоциации) Fe2
(SO4
)3
2Fe3+
+ 3SO4
2-
(уравнение диссоциации)
Гидролиз по катиону:
 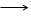 Fe3+
H+
OH-
FeOH2+
+ H+
(уравнение 1 стадии гидролиза в сокращённой форме) Fe3+
H+
OH-
FeOH2+
+ H+
(уравнение 1 стадии гидролиза в сокращённой форме)
В гидролизе применяют участие ионы железа (3).
рН < 7, кислая среда
Задача № 73
Cu + H2
SO4
(конц.) -CuSO4
+ 2H2
O + SO2
   Cu0
– 2e-Cu+2
1 окислительные Cu0
– 2e-Cu+2
1 окислительные
 S+6
+ 2e-S+4
1 восстановительные S+6
+ 2e-S+4
1 восстановительные
окислитель - Н2
SO4
восстановитель - Сu
Задача № 83
| AAg |
AgNO3
0,1 M
|
KNO3
|
AgNO3
0,01 M
|
Ag |
Для расчёта потенциала электродов используют уравнение Нернcта:
Еок/вос
= Еок/вос
+ = lgC
Еок/вос
- электродный потенциал, В
Е0
ок/вос
– стандартный электродный потенциал , В
n – число электронов принимающих участие в процессе
С – концентрация ионов металла в растворе, М
ок – окислительная форма
иос – восстановительная форма
Е0
Ag
+
/Ag
= 0,80 B
ЕAg
+
/Ag
= 0,80 + lg 0,1 = 0,741 B
ЕAg
+
/
Ag
= 0,80 + lg 0,01 = 0,682 BЭДС гальванического элемента разности электродных потенциалов катода и анода.
Катодом будит служить электрод с более положительным электродным потенциалом, а анодом – электрод с более отрицательным потенциалом.
ЭДС = Е (катода) – Е (анода) = 0,741 – 0,682 = 0,059 В
 Уравнение реакций на катоде: Ag+
+ e-Ag0 Уравнение реакций на катоде: Ag+
+ e-Ag0
 на аноде: Ag+
+ e-Ag+ на аноде: Ag+
+ e-Ag+
Задача № 93
K3
[Fe(CN)6
] – гексацианоферрат (3) калия
Центральный атом: Fe
Лиганды: CN-
Координальное число: 6
Ионы внешней среды: К+
Заряд центрального атома: 3+
Заряд комплексного иона: 3-
Уравнение первичной диссоциации:
  K3
[Fe(CN)6
] 3К+
+ [Fe(CN)6
]3- K3
[Fe(CN)6
] 3К+
+ [Fe(CN)6
]3-
Уравнение полной вторичной диссоциации:
  [Fe(CN)6
]3-
Fe3+
+ 6CN- [Fe(CN)6
]3-
Fe3+
+ 6CN-
Выражение для константы неустойчивости:
[
Fe3+
][
CN-
]6
[[Fe(CH)6
]3-
]
|
|
Кн
=
[ ] – равновесные концентрацииводород хром реакция гидролиз
Источники
Н.Л. Глинка «Задачи и упражнения по общей химии»
Н.В. Коровин. Общая химия. М., Высшая школа
|