Самарский Государственный Технический Университет
Кафедра: «металловедение и порошковая металлургия»
Лабораторная работа № 1
Расчёт горения газового топлива. Определение состава и количества продуктов горения.
Выполнил: студент III – ФТ - 1
Соловьева Ю.Б.
Проверил:
Якубович Е.А.
Самара 2009 г.
Цель работы
– изучить методы и освоить практические навыки расчётов горения топлива на примере сжигания смеси газов.
Основные понятия и определения:
1) Теплота сгорания топлива
2) Количество необходимого для горения окислителя
3) Теоретическая и калориметрическая температура горения
4) Энтальпия
1) Теплота сгорания топлива:
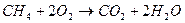 - для метана (полная реакция горения) - для метана (полная реакция горения)
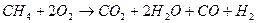 - (не полная реакция горения) - (не полная реакция горения)
При горении топлива, выделяется большое количество тепла. Как видно из реакции в продуктах сгорания присутствуют пары воды. В зависимости от того, в каком виде водяной пар находится в дымовых газах, различают высшую
и низшую
теплоту сгорания топлива.
Высшая теплота сгорания ( 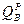 )
соответствует условию, при котором продукты горения охлаждаются до )
соответствует условию, при котором продукты горения охлаждаются до 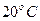 (293 К), а пары воды конденсируются и охлаждаются до (293 К), а пары воды конденсируются и охлаждаются до 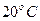 . При этом выделяется две составляющие тепла: теплота нагрева с 293 К до 373 К (418 кДж/кг),а также скрытая теплота парообразования испарения 2256,8 кДж/кг. Итого выделяется 2675,5 кДж/кг. . При этом выделяется две составляющие тепла: теплота нагрева с 293 К до 373 К (418 кДж/кг),а также скрытая теплота парообразования испарения 2256,8 кДж/кг. Итого выделяется 2675,5 кДж/кг.
Низшая теплота сгорания (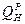 )
соответствует условию, при котором содержащаяся в продуктах сгорания влага в виде пара охлаждается до температуры )
соответствует условию, при котором содержащаяся в продуктах сгорания влага в виде пара охлаждается до температуры 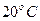 и не конденсируется. При этом выделяется: и не конденсируется. При этом выделяется:
 , ,
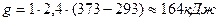
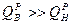
На практике в реальных условиях к сожалению, выделяется только низшая теплота сгорания.
2) Количество необходимого для горения окислителя (воздуха):
Количество окислителя определяется по уравнению реакции горения. Определённое количество является теоретическим. Для реального сжигания всегда подают несколько большее количество окислителя, т.к. есть потери . На 10 – 20 % больше.
Коэффициент избытка воздуха: 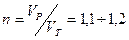
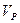 - реальный объём, - реальный объём,  - теоретический объём. - теоретический объём.
3) Температура горения: теоретическая и калориметрическая
:
Необходимость введения двух определений связано с двумя возможными подходами процесса горения. А именно, с учётом или игнорированием затрат тепла на диссоциацию продуктов сгорания. Соответственно различают: теоретическую и калориметрическую температуру горения топлива:
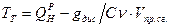
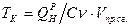
 - теплота диссоциации. - теплота диссоциации.
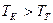
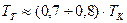
4) Энтальпия
:
Это понятие является одним из фундаментальных в теплотехнике и термодинамике. По определению энтальпия представляет из себя произведение теплоёмкости на температуру:
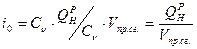
Практическая часть
Рассмотрим горение газа состоящего из: 1) 93,48% метана (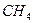 ); 2) 3,85% этана ( ); 2) 3,85% этана ( ); 3) 0,67% пропана ( ); 3) 0,67% пропана (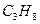 ); 4) 0,3% бутана ( ); 4) 0,3% бутана (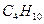 ); 0,75% углекислого газа (СО2) и 0,95% азота ( ); 0,75% углекислого газа (СО2) и 0,95% азота (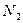 ). Найти объём сгорания количества кислорода, ). Найти объём сгорания количества кислорода, 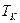 и и 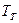 . .
I
.
Определение необходимого количества воздуха:
1) 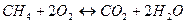
Из реакции видно, что для горения 1 моля 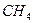 нужно 2 моля нужно 2 моля 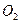 . 1 моль любого газа занимает 22,4 . 1 моль любого газа занимает 22,4 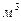 , это значит, что для сжигания 1 , это значит, что для сжигания 1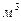 метана, нужно 2 метана, нужно 2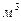 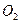 . .
Известно, что в сухом воздухе содержится 21% 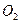 , а остальное азот ( , а остальное азот (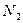 ), 79%. ), 79%.

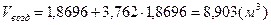 . .
2) 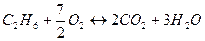 - для этана; - для этана;
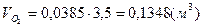

 . .
3) 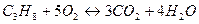 - для пропана; - для пропана;


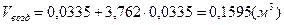 . .
4) 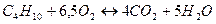 - для бутана; - для бутана;


 . .
Поскольку, реальное топливо – это смесь горючих газов, то общий расход воздуха определяется суммированием для отдельно горючих компонентов.
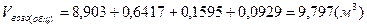 . .
II
. Определение состава и количества продуктов сгорания:
Состав продуктов сгорания: 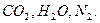
В состав объёма азота войдёт также азот из окислителя (воздуха).
1) для метана:
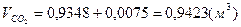 ; ; 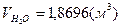 ; ; 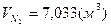 . .
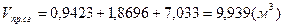 - суммарный объём продуктов сгорания. - суммарный объём продуктов сгорания.
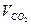 =9,48%, =9,48%, 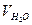 =18,81%, =18,81%, 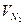 =71,72%; =71,72%;
2) для этана:
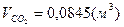 ; ; 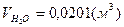 ; ; 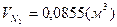 . .
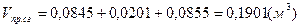 - суммарный объём продуктов сгорания. - суммарный объём продуктов сгорания.
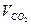 =44,4%, =44,4%, 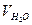 =10,57%, =10,57%, 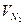 =45,03%; =45,03%;
3)для пропана:
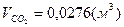 , , 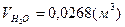 , , 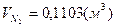 . .
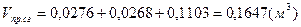 - суммарный объём продуктов сгорания. - суммарный объём продуктов сгорания.
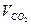 =16,75%, =16,75%, 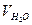 =16,27%, =16,27%, 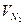 =66,98%; =66,98%;
4) для бутана:
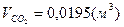 , , 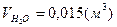 , , 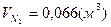 . .
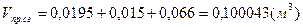 - суммарный объём продуктов сгорания. - суммарный объём продуктов сгорания.
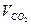 =19,42%, =19,42%, 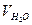 =14,94%, =14,94%, 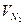 =65,64%; =65,64%;
Суммируем объёмы продуктов сгорания 4-х газов:
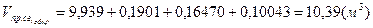 ; ;
 , , 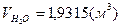 , , 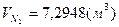
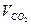 =10,33%, =10,33%, 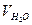 =18,59%, =18,59%, 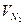 =71,08%. =71,08%.
III
. Определение калориметрической и теоретической температуры:
Как видно, для расчёта калориметрической температуры нужно знать 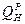 , , 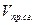 , , 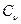 . .
Требуемую для расчёта 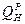 находят расчётным путём, зная тепловые эффекты реакции горения (таблица) и входящие в состав топлива доли соединений.
находят расчётным путём, зная тепловые эффекты реакции горения (таблица) и входящие в состав топлива доли соединений.
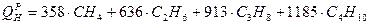 ; ( ; ( );
);
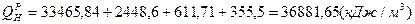 . .
Для определения температуры ,воспользуемся понятием энтальпии и определим энтальпию продуктов сгорания  : :
 ; ; 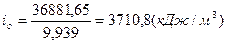 ; ;
С другой стороны,  есть сумма энтальпий конкретно составляющих продукты сгорания:
есть сумма энтальпий конкретно составляющих продукты сгорания: 
Зададимся возможной температурой продуктов сгорания  и найдём энтальпию продуктов сгорания при этой температуре:
и найдём энтальпию продуктов сгорания при этой температуре:
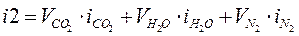 ; ;
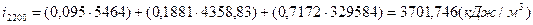 ; ;
 ; ;
Если величина  ,
то значит нами принята низкая температура в ,
то значит нами принята низкая температура в  ,
тогда находим величину энтальпии для большей температуры на ,
тогда находим величину энтальпии для большей температуры на 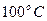 ,
т.е. для ,
т.е. для 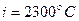 : :
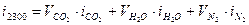 ; ;
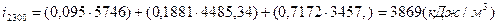 ; ;
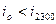 ; ;
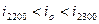 ; ;
Обычно, 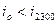 ,
в этом случае, считается, что действительная калориметрическая температура лежит в пределах ,
в этом случае, считается, что действительная калориметрическая температура лежит в пределах 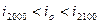 и конкретное её значение находится методом интерполяции по формуле:
и конкретное её значение находится методом интерполяции по формуле:
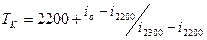 ;
;
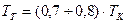 . .
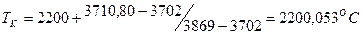
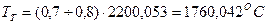 . .
Вывод:
вычислили расход воздуха:
 , , 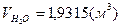 , , 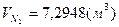
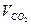 =10,33%, =10,33%, 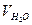 =18,59%, =18,59%, 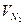 =71,08%. =71,08%.
количество продуктов сгорания:
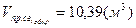
определили температуру калориметрическую и теоретическую:
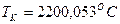 ;
;
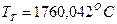 . .
|