ТЕМА
III
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Основой современной химии является открытый в 1869 году
Д.И.Менделеевым периодический закон
, графическим изображением которого является таблица периодической системы (ПС).
Согласно теории строения атома главной характеристикой атома
является положительный заряд ядра
, который определяет число электронов
в атоме и его электронное строение
. Химические свойства атомов и их соединений определяются главным образом строением внешних энергетических уровней
 . Заряд ядра атома определяет все свойства элемента и его положение в ПС. . Заряд ядра атома определяет все свойства элемента и его положение в ПС.
Поэтому современная формулировка ПЗ такова:
Свойства атомов химических элементов, а также состав и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от зарядов атомных ядер.
Возрастание заряда ядра атомов элементов от +1 до +118 приводит к постепенной
"застройке" электронной структуры атомов, при этом строение электронных оболочек периодически изменяется и повторяется, а так как свойства элементов зависят от строения электронной оболочки (в первую очередь - внешнего энергетического уровня), то и они периодически изменяются и повторяются. В этом заключается физический смысл ПЗ
.
В ПС все химические элементы располагаются в порядке возрастания заряда ядра
, которому соответствует т.н. атомный (порядковый) номер (ПН) химического элемента. В этом состоит физический смысл ПН.
Структура ПС связана с электронной структурой элементов. В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре семейства
элементов: у элементов s-
и р-семейств
последними заполняются соответственно s и р-подуровни внешнего энергетического уровня: y d-элементов - d-подуровень предпоследнего энергетического уровня, у f-элементов - f-подуровень третьего снаружи энергетического уровня.
Семь горизонтальных рядов ПС называют периодами, вертикальные ряды - группами.
Период
- последовательный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов), электронная конфигурация внешнего энергетического уровня которых изменяется от ns1
до ns2
np6
(для 1 периода от 1s1
до 1
s2
). При этом номер периода совпадает с номером внешнего энергетического уровня. Т.е. у элементов одного периода электронами заполняется одинаковое число энергетических уровней, равное номеру этого периода. В этом заключается физический смысл номера периода.
Элементы, имеющие сходное электронное строение, объединены в колонках, называемых группами. У элементов А-групп (главных)
последними заполняются s и р-подуровни внешнего
энергетического уровня, у элементов В-групп (побочных)
последними заполняются d-
и
f-
подуровни второго и третьего
снаружи
энергетических уровней соответственно.
Элементы А- и В-групп с одинаковым номером (например, VIA и VIB) различаются по свойствам, однако имеют определенное сходство (например, состав и свойства высших оксидов и гидроксидов: CrO3
и SO3
- кислотные оксиды, H2
CrO4
и H2
SO4
- сильные кислоты). Это связано с тем, что число валентных электронов
(электронов, способных к образованию химических связей) у элементов А и В групп с одинаковым номером - одинаково, но для элементов А групп валентными являются электроны внешнего энергетического уровня, а у элементов В групп - электроны внешнего и предпоследних энергетических уровней. В этом основное различие между элементами групп А и В. Таким образом номер группы показывает число валентных электронов. В этом заключается физический смысл № группы.
Группа
- это вертикальный ряд элементов, расположенных в порядке увеличения зарядов ядер атомов, которые содержат одинаковое число валентных электронов.
ПЕРИОДИЧНОСТЬ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
И ИХ СОЕДИНЕНИЙ
Атомные и ионные радиусы:
С точки зрения квантовой механики атом не имеет строго определенных границ, поэтому установить его абсолютные размеры невозможно.
В химической практике наиболее широко используются так называемые эффективные радиусы
- ковалентные, металлические, ионные - рассчитанные по экспериментальным данным из межъядерных расстояний в молекулах или кристаллах. Так, радиусы катионов всегда меньше радиусов соответствующих нейтральных атомов,арадиусы анионов - больше, т.к. катионы образуются при отдаче электронов, а анионы - при присоединении электронов (Rкат <Rат; Rан > Rат).
В настоящее время также используют понятие "орбитальный радиус"
- теоретически рассчитанное расстояние от ядра до главного максимума электронной плотности внешней орбитали. Орбитальный радиус - характеристика свободного, химически несвязанного атома.
У элементов одной группы ПС при движении сверху вниз с возрастанием заряда ядра увеличивается число энергетических уровней, значит увеличивается расстояние от внешних электронов до ядра  происходит увеличение радиуса атомов и ионов. происходит увеличение радиуса атомов и ионов.
У элементов одного периода с возрастанием положительного заряда ядра при движении слева направо (→) увеличивается сила притяжения электронов к ядру, что приводит к уменьшению атомных и ионных радиусов.
Энергия ионизации. Энергия сродства к электрону (сродство к электрону):
Способность атомов химических элементов отдавать или присоединять электроны определяет проявление атомом металлических или неметаллических свойств. Эта способность зависит от электронного строения атома, его радиуса и силы притяжения электрона к ядру.
Энергия ионизации (Еи
, I)
- минимальная энергия, необходимая для отрыва наибольшее слабо связанного электрона от невозбужденного атома
для процесса
Эо
+ Eи
→ Э+
+ ē
Выражается в кДж/моль. Определяется зарядом ядра, радиусом атома и конфигурацией внешних электронных оболочек.
По периоду слева направо с ростом заряда ядра и уменьшением атомного радиуса
E
и
увеличивается. В А-группах сверху вниз с увеличением атомного радиуса
Eи
уменьшается.
Энергия ионизации (Eи
) характеризует проявление металличности
у атомов элементов. Чем меньше Eи
, тем более выражена способность атома отдавать электроны, его восстановительные и металлические свойства.
По периоду слева направо металлические и восстановительные свойства атомов уменьшаются, по группе сверху вниз растут.
Количественной характеристикой способности атомов присоединять электроны является энергия сродства к электрону Еср
, F).
Энергия сродства к электрону
- это энергия, которая выделяется при присоединении электрона к нейтральному атому
Эо
+ ē → Э-
+ Еср
Чем больше Еср
, тем легче атом присоединяет электроны и тем сильнее проявляются его окислительные и неметаллические свойства элементов.
Выражается обычно в кДж/моль.
В периодах слева направо с возрастанием заряда ядра и уменьшением радиуса атома Еср
увеличивается, в группе сверху вниз с увеличением радиуса атома Еср
уменьшается.
Так Еср
большинства металлов невелика или даже отрицательна, поэтому они не образуют устойчивых анионов.
Неметаллические и окислительные свойства элементов по периоду слева направо усиливаются, а по группе сверху вниз уменьшаются.
Электроотрицательность:
Атомы присоединяют или отдают электроны в процессе химического взаимодействия. Комплексной характеристикой атома, учитывающей его способность и к присоединению, и к отдаче электронов, является электроотрицательность - ЭО (χ).
ЭО элемента
- условная величина, характеризующая способность его атомов в химических соединениях притягивать к себе электроны от атомов-партнеров (тех, с которыми непосредственно связан данный атом).
Величина ЭО зависит от Еи
и Еср
и упрощено может быть определена
χ = 1/2 (Еи
+ Еср
)
Для практической оценки этой способности атомов используют условную шкалу, относительных электроотрицательностей. Согласно ей самый ЭО элемент F, а наименее ЭО - Fr.
Очевидно, что в периоде слева направо с уменьшением радиуса атома и увеличением Е
и
и Еср
увеличивается ОЭО
 происходит ослабление восстановительных и усиление окислительных свойств, а в группе сверху вниз с увеличением радиус атома и уменьшением Е
и
и Еср
ОЭО уменьшается, происходит ослабление восстановительных и усиление окислительных свойств, а в группе сверху вниз с увеличением радиус атома и уменьшением Е
и
и Еср
ОЭО уменьшается,
 происходит ослабление окислительных и усиление восстановительных свойств атомов химических элементов. происходит ослабление окислительных и усиление восстановительных свойств атомов химических элементов.
По величине ОЭО можно отнести элемент к металлам или неметаллам.
Как правило, неметаллы имеют значения ОЭО больше 2 (по другим источникам больше 1,7). Они располагаются в А-группах правой верней части ПС над условной диагональю В - Аt. У металлов значение ОЭО < 2 (<1,7). Наиболее активные металлы находятся в нижнем левом углу ПС в А-группах. Несколько элементов (В, Si, Ge, As, Te) со значение ОЭО близким к 2, проявляют промежуточные свойства, их иногда называют полуметаллы.
ПЕРИОДИЧЕСКИЕ СВОЙСТВА СЛОЖНЫХ ВЕЩЕСТВ
Характеристики атомов элементов - Еи
, Еср
, χ - непосредственно связаны с типами химических реакций, в которые способны вступать атомы этих элементов, а также с типами и свойствами веществ, ими образуемых.
С изменением электронной конфигурации атомов элементов по периоду от
ns1
до
ns2
np6
изменяется высшая степень окисления атомов элементов
(от +1 до +7 (+8)), что приводит к изменению состава и свойств высших оксидов и гидроксидов. Это изменение также носит периодический характер.
По периоду
слева направо с уменьшением металлических свойств атомов элементов и образуемых ими простых веществ происходит уменьшение основных
свойствоксидов, и гидроксидов и соответственно их кислотные свойства увеличиваются
.
По группе
сверху вниз с уменьшением неметаллических и усилением металлических свойств атомов элементов происходит уменьшение кислотных
и увеличение основных
свойств оксидов и гидроксидов.
Этот переход обычно осуществляется через так называемые амфотерные гидроксиды
, способные диссоциировать и как кислота, и как основание.
Низшая степень окисления металлов равна 0, а неметаллов - (№ группы - 8), т.е. определяется числом электронов, недостающих до завершения внешнего энергетического уровня.
Значит, при изменении электронной конфигурации атома неметалла от ns2
np2
до ns2
np5
низшая степень окисления изменяется от - 4 до -1. Такое изменение также периодично. Это приводит к периодическому изменению состава и свойств летучих водородных соединений неметаллов
(RH4
, RH3
, H2
R, RH).
Кислотно-основный характер их водных растворов изменяется следующим образом: по периоду слева направо кислотные свойства усиливаются вследствие увеличения ОЭО неметалла, что приводит к увеличению полярности связи R - Н; по группе сверху вниз кислотные свойства также усиливаются в следствие увеличения радиусов атомов, что приводит к увеличению длины связи R - H и ее ослаблению.
Металлы не образуют летучих водородных соединений, их гидриды солеобразны (NaH, CaH2
) или металлоподобны.
Изменение свойств химических элементов и их соединений можно проиллюстрировать на примере 2 и 3 периодов:
| высшая с.о.
|
+ 1 |
+ 2 |
+ 3 |
+ 4 |
+ 5 |
+ 6 |
+ 7 |
- |
| высший оксид
и характер свойств
|
Li2
O
основный
Na2
O основный
|
BeO
амфотерный
MgO основный
|
B2
O3
кислотный
Al2
O3
амфотерный
|
CO2
кислотный
SiO2
кислотны й
|
N2
O5
кислотный
P2
O5
кислотный
|
-
SO3
кислотный
|
-
Cl2
O7
кислотный
|
-
|
| Высший гидроксид и характер свойств
|
LiOH щелочь
NaOH щелочь
|
Be(OH)2
амфотер-ный гидроксид
Mg(OH)2
нераство-римое основание
|
H3
BO3
слабая кислота
Al(OH)3
амфотер-ный гидроксид
|
H2
CO3
слабая кислота
H2
SiO3
слабая кислота
|
HNO3
сильная кислота
H3
PO4
слабая кислота
|
-
H2
SO4
сильная кислота
|
-
HClO4
сильная кислота
|
- |
| низшая с.о.
|
0 |
0 |
0 |
-4 |
-3 |
-2 |
-1 |
- |
| летуч. Водородные соединения и характер свойств
|
-
|
-
|
-
|
СH4
-
SiH4
-
|
NH3
слабое основание
PH3
очень слабое основание
|
H2
O
амфотер
H2
S
слабая кислота
|
HF
слабая кислота
HCl сильная кислота
|
-
|
Такой характер изменения свойств в основном повторяется во всех периодах (кроме первого), поэтому такое изменение свойств называют периодическим
.
Кислотный характер оксидов и гидроксидов, образованных атомами одного элемента, с увеличением его степени окисления увеличивается.
Например:
Mn2+
O, 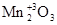 , Mn+4
O2
, Mn+6
O3
, , Mn+4
O2
, Mn+6
O3
, 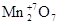 . .
основные амфотерный кислотные
оксиды оксид оксиды
Mn+2
(OH)2
, Mn+3
(OH)3
, Mn+4
(OH)4
, H2
Mn+6
O4
, HMn+7
O4
.
основания амфотерный кислоты
слабые гидроксид сильные
 кислотные свойства усиливаются кислотные свойства усиливаются
Для сравнения:
слабые кислоты сильные кислоты
сернистая Н2
S+4
O3
серная H2
S+6
O4
азотистая HN+3
O2
азотная HN+5
O3
Такова же и закономерность изменения окислительной способности атома.
Например:
Mno
→ Mn+2
→ Mn+3
→ Mn+4
→ Mn+6
→ Mn+7
только окислительно-восстановительная только
восстановитель двойственность окислитель

окислительные свойства возрастают
ВТОРИЧНАЯ ПЕРИОДИЧНОСТЬ
Изменение многих характеристик атомов зачастую не монотонно. Так, для элементов 2 периода слева направо энергия ионизации Еи
в целом растет, однако, возрастая от лития к бериллию, она уменьшается к бору, а далее растет к углероду и азоту, снова уменьшаясь к кислороду, а далее увеличивается ко фтору, достигая максимума у неона.
При переходе к 3 периоду с ростом радиуса атома Еи
резко уменьшается, а при движении по периоду слева направо от натрия до аргона растет аналогично 2 периоду – немонотонно:
Li B Be C O N F Ne
Na Al Mg Si S P Cl Ar
Такое явление получило название вторичная периодичность.
|