|
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ
ВВЕДЕНИЕ
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Влияние психолептиков на пептидергические системы
1.1.1. Нейропептиды при действии диазепама
1.1.2. Нейропептиды при действии галоперидола
1.2. Основные карбоксипептидазы и их роль в процессинге регуляторных пептидов
1.2.1. Протеолитические ферменты обмена регуляторных пептидов при действии психолептиков
1.2.2. Карбоксипептидаза Н
1.2.3. Карбоксипептидаза М
1.2.4. ФМСФ-ингибируемая карбоксипептидаза
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Материалы исследования
2.1.1. Схема эксперимента
2.2. Методы исследования
2.2.1. Метод определения активности карбоксипептидазы Н
2.2.2. Метод определения активности карбоксипептидазы М
2.2.3. Метод определения активности ФМСФ-ингибируемой карбоксипептидазы
2.2.4. Статистическая обработка результатов исследования
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1. Активность карбоксипептидазы Н в тканях крыс в норме и при действии психолептиков
3.1.1. Распределение активности карбоксипептидазы Н в тканях интактных крыс
3.1.2. Влияние физиологического раствора на активность карбоксипептидазы Н в тканях крыс
3.1.2.1. Влияние однократного введения физиологического раствора на активность карбоксипептидазы Н в тканях крыс
3.1.2.2. Влияние хронического введения физиологического раствора на активность карбоксипептидазы Н в тканях крыс
3.1.3. Активность карбоксипептидазы Н в тканях крыс при введении диазепама
3.1.3.1. Влияние однократного введения диазепама на активность карбоксипептидазы Н в тканях крыс
3.1.3.2. Влияние хронического введения диазепама на активность карбоксипептидазы Н в тканях крыс
3.1.4. Активность карбоксипептидазы Н в тканях крыс при введении галоперидола
3.1.4.1. Влияние однократного введения галоперидола на активность карбоксипептидазы Н в тканях крыс
3.1.4.2. Влияние хронического введения галоперидола на активность карбоксипептидазы Н в тканях крыс
3.2. Активность ФМСФ-ингибируемой карбоксипептидазы в тканях крыс в норме и при действии психолептиков
3.2.1. Распределение активности ФМСФ-ингибируемой карбоксипептидазы в тканях интактных крыс
3.2.2. Активность ФМСФ-ингибируемой КП в тканях крыс при введении физиологического раствора
3.2.2.1. Влияние однократного введения физраствора на активность ФМСФ-ингибируемой КП в тканях крыс
3.2.2.2. Влияние хронического введения физиологического раствора на активность ФМСФ-ингибируемой КП в тканях крыс
3.2.3. Активность ФМСФ-ингибируемой КП в тканях крыс при введении диазепама
3.2.3.1. Влияние однократного введения диазепама на активность ФМСФ-ингибируемой КП в тканях крыс
3.2.3.2. Влияние хронического введения диазепама на активность ФМСФ-ингибируемой КП в тканях крыс
3.2.4. Активность ФМСФ-ингибируемой КП в тканях крыс при введении галоперидола
3.2.4.1. Влияние однократного введения галоперидола на активность ФМСФ-ингибируемой КП в тканях крыс
3.2.4.2. Влияние хронического введения галоперидола на активность ФМСФ-ингибируемой КП в тканях крыс
3.3. Активность карбоксипептидазы М в тканях крыс в норме и при введении психолептиков
3.3.1. Распределение активности карбоксипептидазы М в тканях интактных животных
3.3.2. Активность карбоксипептидазы М в тканях крыс при введении физиологического раствора
3.3.2.1. Влияние однократного введения физраствора на активность карбоксипептидазы М в тканях крыс
3.3.2.2. Влияние хронического введения физиологического раствора на активность карбоксипептидазы М в тканях крыс
3.3.3. Активность карбоксипептидазы М в тканях крыс при введении диазепама
3.3.3.1. Влияние однократного введения диазепама на активность карбоксипептидазы М в тканях крыс
3.3.3.2. Влияние хронического введения диазепама на активность карбоксипептидазы M в тканях крыс
3.3.4. Активность карбоксипептидазы М в тканях крыс при введении галоперидола
3.3.4.1. Влияние однократного введения галоперидола на активность карбоксипептидазы М в тканях крыс
3.3.4.2. Влияние хронического введения галоперидола на активность карбоксипептидазы М в тканях крыс
3.4. Активность основных карбоксипептидаз in vitro при действии психолептиков
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ВЫВОДЫ
ЛИТЕРАТУРА
СПИСОК СОКРАЩЕНИЙ
АКТГ – адренокортикотропный гормон
АПМЯК – аминопропилмеркаптоянтарная кислота
АПФ – ангиотензинпревращающий фермент
БД-рецепторы – бензодиазепиновые рецепторы
ГАМК – γ-аминомасляная кислота
ГТ-Рг – гонадотропин-рилизинг гормон
ГПЯК – гуанидинопропилянтарная кислота
ГЭМЯК – гуанидиноэтилмеркаптоянтарная кислота
ДА-рецептор – дофаминовый рецептор
DBI – ингибитор связывания диазепама
ДСИП – дельта-сон индуцирующий пептид
КП – карбоксипептидаза
КПА – карбоксипептидаза А
КПВ – карбоксипептидаза В
КПM – карбоксипептидаза M
КПN – карбоксипептидаза N
КП Н – карбоксипептидаза Н
КРФ – кортикотропин-рилизинг фактор
МСГ – меланоцитстимулирующий гормон
ODN – октадеканейропептид
ПБР – периферический бензодиазепиновый рецептор
ПОМК – проопиомеланокортин
ПХМБ – п-хлормеркурийбензоат
TTN – триаконтатетранейропептид
ФМСФ – фенилметилсульфонилфторид
ФМСФ-КП – фенилметилсульфонилфторид-ингибируемая карбокси-пептидаза
ЭДТА – этилдиаминтетрауксусная кислота
Психические заболевания занимают в современной медицине довольно обширную нишу болезней человека. Их можно отнести к группе наиболее трудно излечимых. Учитывая высокий риск возникновения психических расстройств, в том числе из-за роста в современном мире различных стрессовых воздействий, экологических факторов, актуальной является проблема профилактики и лечения патологии нервной системы.
В психофармакологии используют препараты, действующие на медиаторные системы [39, 107, 328]. Общепризнано, что галоперидол является анатгонистом дофаминовых, а диазепам – агонистом бензодиазепиновых рецепторов [39, 169, 310]. Однако многообразие фармакологических эффектов этих препаратов трудно объяснить только с этой позиции. В последнее время обсуждается вопрос об участии пептидергической системы в механизмах действия психолептиков [120, 173, 174]. Установлено при этом, что введение галоперидола и диазепама приводит к нарушению баланса ряда пептидов, участвующих в развитии стресс-реакции (АКТГ, энкефалинов, вещества Р) [95, 263], психических болезней (кортикотропин-рилизинг фактора, нейротензина, вещества Р, холецистокинина) и других регуляторных пептидов [164, 193, 228]. Однако механизм влияния психолептиков на уровень биологически активных пептидов до сих пор остается неизученным.
Содержание регуляторных пептидов в организме зависит от соотношения скоростей их синтеза и распада [184, 196]. Нейропептиды синтезируются в виде высокомолекулярных предшественников, которые активируются при ограниченном расщеплении пептид-гидролазами (процессинге) [106, 166, 184, 196, 309]. В конечной стадии процессинга участвуют основные карбоксипептидазы, катализирующие отщепление остатков аргинина и лизина с С-конца предшественников регуляторных пептидов [9, 26, 147, 311]. Одним из основных ферментов, участвующих в синтезе таких нейропептидов как АКТГ [128, 175], энкефалины [147, 148], вещество P [104], гормон роста [103], пролактин [103] является карбоксипептидаза Н (КФ 3.4.17.10). Известно также, что в обмен энкефалинов и других нейропептидов в организме вовлекается карбоксипептидаза М (КФ 3.4.17.12) [118]. Она участвует в инактивации или модулировании активности пептидных гормонов до или после их взаимодействия с рецепторами [301]. Вместе с тем предполагают, что функции недавно обнаруженной ФМСФ-ингибируемой карбоксипептидазы сходны с таковыми КП Н [9, 26]. Однако биологическая роль этого фермента практически остается неясной.
Таким образом, изучение активности КП Н, ФМСФ-КП и КП М в отделах мозга и органах крыс при введении психолептиков может способствовать уточнению биологической роли этих ферментов, а также выяснению молекулярных механизмов взаимодействия дофамин- и ГАМК-ергических систем с пептидергической.
Целью настоящей работы
было выяснение роли основных карбоксипептидаз (карбоксипептидазы Н, фенилметилсульфонилфторид-ингибируемой карбоксипептидазы и карбоксипептидазы М) в механизмах действия психолептиков на пептидергическую систему.
При выполнении работы были поставлены следующие задачи
:
1. Исследование острого введения диазепама и галоперидола на активность карбоксипептидазы Н, фенилметилсульфонилфторид-ингибируемой карбоксипептидазы и карбоксипептидазы М в головном мозге, надпочечниках и семенниках крыс через различные промежутки времени.
2. Изучение изменения активности исследуемых карбоксипептидаз в тканях самцов крыс через различные сроки после хронического введения диазепама и галоперидола.
3. Исследование активности карбоксипептидазы Н, ФМСФ-ингибируемой карбоксипептидазы и карбоксипептидазы М in vitro при действии аналогичных доз данных препаратов.
Научная новизна и практическая ценность работы
. Впервые изучено влияние галоперидола и диазепама на активность КПН, ФМСФ-КП и КПМ в тканях крыс. Показано, что активность ферментов различным образом изменяется в отделах мозга и органах животных при остром и хроническом введении изучаемых психолептиков. Установлена зависимость изменения активности исследуемых ферментов от времени после введения препаратов.
Полученные результаты представляют интерес для понимания механизмов функционирования пептидергических систем и роли основных карбоксипептидаз в реализации этих механизмов при введении психолептиков. Полученные данные могут быть использованы при разработке фармакологических препаратов для коррекции деятельности пептидергических систем при психических заболеваниях.
Апробация работы.
Материалы диссертации доложены: на научной конференции Российской Академии Естествознания «Фундаментальные и прикладные проблемы медицины и биологии» (Тунис, июнь, 2005 г.), на V Сибирском физиологическом съезде (Томск, июнь-июль 2005 г.), на международной конференции «Нейроспецифические метаболиты и энзимологические основы деятельности центральной нервной системы» (Пенза, сентябрь 2006 г.) и на итоговых научных конференциях ПГПУ (2004, 2005 гг.). По теме диссертации опубликовано 6 работ.
Структура и объем диссертации.
Диссертация изложена на 156 страницах машинописного текста и состоит из 6 разделов: введения, обзора литературы по теме диссертации (I глава), материалов и методов исследования (II глава), результатов (III глава), обсуждения (IV глава), выводов. Работа иллюстрирована 6 рисунками, 19 таблицами и 1 схемой. Список литературы содержит 336 наименований на русском и иностранных языках.
Диазепам (7-хлор-1,3-дигидро-1-метил-5-фенил-2Н-1,4-бензодиазепин-2-он) является классическим транквилизатором, который проявляет анксиолитический, седативный, снотворный, миорелаксирующий, противосудорожный и другие эффекты [39]. Бензодиазепины были введены в клиническую практику около 40 лет назад и до сих пор находят широкое применение [52]. В 1977 г. было обнаружено, что бензодиазепины взаимодействуют с безодиазепиновыми рецепторами, которые, как оказалось, были неотъемлемой частью ГАМКA
-рецептора [163]. Комплекс рецептора был изолирован и секвенирован в 1987 г. [249].
Наибольшая плотность бензодиазепиновых рецепторов обнаружена в коре больших полушарий, затем в гиппокампе, мозжечке, гипоталамусе, стриатуме, среднем мозге [40, 218, 222]. По ряду фармакологических и биохимических свойств бензодиазепиновые рецепторы можно разделить на центральные и периферические: центральные найдены только в головном мозге, а периферические – как в мозге, так и в других органах [40, 152, 276]. Наибольшая плотность периферических бензодиазепиновых рецепторов обнаружена в коре надпочечников [40]. Согласно результатам опытов in vitro периферические бензодиазепиновые рецепторы, в отличие от центральных, не связаны с ГАМК-рецепторами [267].
В головном мозге бензодиазепиновые рецепторы локализованы на постсинаптических мембранах ГАМК-ергических систем и входят в состав ГАМКА
-бензодиазепин-ионофорного комплекса, состоящего из трех компонентов: бензодиазепинового рецептора, ГАМК-рецептора и хлорного канала [267, 325]. Работа всего комплекса направлена на открывание хлорных каналов, опосредуемое ГАМК-рецептором. Классические бензодиазепины в клиническом использовании увеличивают эффективность ГАМК, понижая концентрацию, необходимую для открытия канала.
ГАМКА
-бензодиазепиновый рецептор состоит из пяти белковых субъединиц, расположенных подобно розетке вокруг центрального канала и пронизывающих мембрану клетки, непроницаемую для Cl—
ионов [249]. Анализ литературных данных [74, 121, 249] показывает, что активная форма ГАМКА
-бензодиазепинового рецептора представлена двумя α-субъединицами, двумя β-субъединицами и одной γ-субъединицей. Полагают, что α-субъединица связывает бензодиазепины, а β-субъединица – ГАМК [121, 249]. γ-субъединица, по-видимому, не связывает бензодиазепины и ГАМК, но она может оказывать влияние на способность α- и β-субъединиц к рецепции «своих» лигандов. Таким образом, ГАМК, связываясь с β-субъединицей, вызывает конформационные изменения белков ионофорного канала, приводящие к усилению тока Cl–
. Алостерическая модуляция этих изменений обусловлена связыванием лигандов с α-субъединицей рецептора [74, 249].
Наличие на синаптических мембранах нервных клеток высокоаффинных мест связывания для бензодиазепинов свидетельствовало о существовании эндогенного лиганда этих рецепторов. Costa с сотрудниками выделили сначала из мозга крысы, а затем и человека белок, способный ингибировать связывание [3
Н]-диазепама с синаптическими мембранами [112, 133]. Было определено, что эндогенный лиганд представляет собой полипептид с Mr 9000, который был назван DBI – ингибитор связывания диазепама (англ. diazepam binding inhibitor). В структуре DBI преобладают основные аминокислоты, N-конец пептида защищен; С-конец определяет биологическую активность при взаимодействии пептида с рецептором [77]. DBI является предшественником ряда биологически активных пептидов, главные из которых DBI 33-50, или октадеканейропептид (ODN), DBI 17-50, или триаконтатетранейропептид (TTN) и DBI 26-50, или эйкозапентанейропептид (EPN). Все эти пептиды содержат одинаковую последовательность на С-конце: Глн-Ала-Тре-Вал-Гли-Асп-Вал-Асн-Тре-Асп-Арг-Про-Гли-Лей-Лей-Асп-Лей-Лиз [112]. DBI и его фрагменты объединяют термином эндозепины. Они являются негативными аллостерическими модуляторами ГАМКА
-рецептора, снижающими эффективность взаимодействия ГАМК с рецептором [8, 112], и относятся к анксиогенным соединениям, усиливающим состояние тревоги, страха и «проконфликтные» ответы в тесте Фогеля [8, 152].
Эндозепины найдены в тканях человека, крысы, свиньи, быка, лягушки Rana ridibunda, форели [209, 264, 320]. Имунногисто-химическое картирование мозга крысы показало наибольшие концентрации DBI (10 - 50 мМ) в коре больших полушарий, гиппокампе, мозжечке, гипоталамусе, миндалине [72, 113]. У человека самые высокие концентрации были найдены в мозжечке, миндалине, гиппокампе, гипоталамусе и черном веществе, а также в спинном мозге и спинномозговой жидкости [133]. На клеточном уровне, DBI был обнаружен в нейронах и клетках глии, тогда как ODN и TTN были главным образом найдены в нейронах [61, 113, 320]. Наиболее высокие уровни мРНК DBI были найдены в мозжечке и эпендиме третьего желудочка мозга крысы, промежуточные уровни – в обонятельной луковице, дугообразном ядре, эпифизе и гипофизе [62].
С помощью электронной микроскопии показано присутствие ODN в перикарионе нейронов, эндоплазматическом ретикулуме, аппарате Гольджи, микротрубочках, свободных рибосомах [61]. В окончании нейронов DBI и ODN накапливаются в синаптических везикулах [61, 132]. При деполяризации синаптических окончаний под действием К+
одновременно с DBI высвобождаются ГАМК и энкефалины, что указывает на их сосуществование в одном пресинаптическом окончании. К+
-стимулируемый выброс DBI зависит от присутствия Са2+
[132].
Есть данные, согласно которым эндозепины влияют на рост клеток глии через аутокринные механизмы [149]. Низкие концентрации ODN (10-10
-10-14
М) in vitro стимулировали синтез ДНК в глиальных клетках крысы, действуя через центральный тип бензодиазепиновых рецепторов.
DBI и его производные широко распространены в тканях, содержащих периферические бензодиазепиновые рецепторы и участвующие в липидном обмене [55, 88, 108, 128]. Наибольшая концентрация эндозепинов обнаружена в клетках надпочечников, печени, семенников, почек [63, 72, 113]. Количество ODN в этих тканях составляет 400-800 пмоль/г сырой массы [8]. Кроме того, эндозепины обнаружены в клетках Шванна [63]. Присутствие мРНК DBI в периферических органах крысы [62, 91] и человека [252] позволяет заключить, что эндозепины синтезируются и в периферических тканях. Здесь DBI выполняет иные функции, чем в нейронах: он не высвобождается из срезов периферических органов при деполяризации [132]. Через рецепторы, расположенные на мембране митохондрий, эндозепины могут осуществлять регуляцию внутриклеточного метаболизма [96, 124]. В частности, DBI транспортирует холестерол к внутренней мембране митохондрий [113]. Взаимодействие DBI с периферические бензодиазепиновыми рецепторами усиливает вход холестерола в митохондрии с последующим усилением синтеза предшественника стероидов прегненолона. Этот процесс наблюдается как в клетках коры надпочечников [96, 113, 131], так и в глиальных клетках мозга [113, 124]. В надпочечниках это АКТГ-зависимый процесс. Идентичность DBI и белка, связывающего ацил-коэнзим А, выделенного из ткани печени [100, 113], указывает на способность DBI опосредовать синтез жирных кислот. Таким образом, DBI играет существенную роль в синтезе стероидных гормонов в различных тканях за счет регуляции лимитирующей стадии [202].
Уровень DBI в надпочечниках зависит от уровня АКТГ в организме. Удаление гипофиза у крыс вызвало уменьшение концентрации DBI и ПБР в надпочечниках, введение АКТГ уменьшило этот эффект, то есть существует положительная корреляция между уровнем DBI и ПБР в надпочечниках и уровнем кортикостерона в плазме крови [96, 131]. Возможно, что de novo синтез DBI в надпочечниках является важным фактором, опосредующим АКТГ-зависимый стероидогенез.
Локализация бензодиазепиновых рецепторов позволяет предположить, что они вовлечены в регулирование стресс-систем: 1) гипоталамо-гипофизаро-надпочечниковой оси, 2) симпатической нервной системы, 3) ренин-ангиотензиновой системы и 4) нейроэндокринно-иммунной оси. Плотность ПБР наиболее высока в периферических органах, которые активизируются при стрессе (сердце, почки, надпочечники и легкие). Увеличение количества ПБР в мозгу и периферических тканях при остром стрессе может обеспечить нервную и метаболическую подготовку организма для его преодоления [270]. Кроме того, при плавательном и операционном стрессе происходит увеличение плотности и ЦБР в коре больших полушарий [248, 270]. Различные виды стресса вызвали увеличение уровня DBI в надпочечниках и гиппокампе крыс [24, 45, 131], а также уровень мРНК DBI в мозге мыши [192]. Введение диазепама восстанавливает уровень DBI [45]. Поскольку лиганды ПБР могут регулировать транспорт холестерина в митохондрии, то, возможно, увеличение синтеза и секреции глюкокортикоидов при стрессе опосредуется именно ПБР.
ГАМК-ергическая система влияет на уровень регуляторных пептидов и их предшественников. Так, ГАМК проявляет тонизирующее ингибирующее влияние на ПОМК нейроны гипоталамуса, а также на меланотропные клетки промежуточной доли гипофиза [83, 151]. Введение ингибиторов ГАМК-трансаминазы в течение четырех дней привело к увеличению уровня ГАМК в передней и промежуточной долях гипофиза, что, в свою очередь, вызвало уменьшение уровня мРНК ПОМК на 40-60 % в промежуточном, но не в переднем гипофизе. Уже через сутки после первой инъекции уровень ПОМК был уменьшен на 40%, а концентрация α-меланоцитстимулирующего гормона увеличена на 34% по отношению к контролю, возможно, из-за ингибирования секреции гормона. После 4 и 8 дней обработки уровень α-меланоцитстимулирующего гормона, также как и уровень мРНК ПОМК уменьшился. В опытах in vitro ГАМК в концентрации 10 мкмоль/л уменьшила уровни мРНК ПОМК на 40 % после 3 дней обработки. Эти результаты показывают, что ГАМК проявляет прямой ингибирующий эффект на экспрессию гена ПОМК в промежуточной доле гипофиза [213].
Внутривенная и интрацеребровентрикулярная инъекции ODN произвели дозозависимое ингибирование экспрессии гена ПОМК в промежуточном гипофизе крыс. Подобные результаты были получены и в нейронах гипоталамуса [108, 153]. Интрацеребровентрикулярная инъекция ODN в дозах 1 и 0,1 мкг/кг вызвала увеличение уровня мРНК ПОМК в гипоталамусе на 33,5 и 27,4%, соответственно [108]. Givalois и др. в подобных условиях получили уменьшение уровня мРНК ПОМК на 17 и 7% в передней и промежуточной долях гипофиза крыс соответственно [156]. Приведенные данные показывают, что активация ГАМКА
-рецептора эндогенным бензодиазепиновым лигандом может ингибировать экспрессию гена ПОМК в гипофизе и гипоталамусе [151, 156]. Удаление надпочечников привело к изменению эффекта, вызванного ODN: произошло увеличение уровня мРНК ПОМК в промежуточном и переднем гипофизе на 60 и 10% соответственно, по сравнению с контролем. Удаление семенников вызвало уменьшение содержания мРНК ПОМК в передней доле и увеличение в промежуточной доле гипофиза, но не изменило отрицательного влияния ODN, наблюдаемого в контрольных животных. Таким образом, in vivo уменьшение уровня мРНК ПОМК в гипофизе, вызванное эндогенными бензодиазепинами, модулируется гормонами надпочечников и половых желез [156].
Введение диазепама (2 мг/кг) значительно увеличило уровни β-эндорфина в гипоталамусе, гиппокампе и коре головного мозга [193, 194].
Острая внутрибрюшинная инъекция диазепама (2 мг/кг) ингибирует деятельность гипоталамо-гипофизарно-надпочечниковой оси самок крыс, то есть уменьшает концентрацию АКТГ и кортикостерона [263]. Такое же действие оказывает диазепам и на уровень АКТГ в плазме человека [290]. Holloway и другие показали, что диазепам in vitro ингибирует синтез кортизола и альдостерона в клетках надпочечников быка [170]. Кроме того, введение диазепама стрессированным животным приводило к уменьшению уровня кортикостерона, АКТГ и норадреналина [51, 111, 316, 330].
Обратный агонист бензодиазепиновых рецепторов, ODN, в дозах 0,1, 1 и 4 мкг/кг, уменьшил содержание мРНК кортикотропин-рилизинг гормона в гипоталамусе на 33, 18 и 26%, соответственно [106]. Удаление надпочечников изменило действие ODN и вызвало увеличение уровня мРНК кортикотропин-рилизинг гормона на 21%. Возможно, это связано с прекращением ингибирующего эффекта глюкокортикоидов. Кастрация не изменила ингибирующего действия ODN. Эти результаты показывают, что эндогенный ODN, через активацию бензодиазепиновых участков ГАМКА
-рецептора, отрицательно модулирует деятельность нейронов, синтезирующих КРФ, и что на этот процесс могут влиять центральные и периферические стероиды [155].
Эндозепины влияют на репродуктивную систему на различных ее уровнях. Так, интрацеребровентрикулярное введение ODN в дозе 3 мкг/кг вызвало 40%-ое уменьшение уровня мРНК ГнРф [119, 207]. Кроме того, DBI (0,3-10 нмоль, интрацеребровентрикулярно) уменьшил уровни половых гормонов в сыворотке крови самцов и самок мышей. Этот эффект наблюдался уже через 1 час и продолжался в течение четырех часов после инъекции. Эти результаты предполагают, что DBI действует как эндогенный модулятор, регулирующий уровни половых гормонов in vivo [123].
В опытах in vitro инкубация клеток гипофиза с ГАМК (10-100 мкM) вызвала дозозависимое уменьшение уровня мРНК пролактина. Ингибиторы ГАМКА
-рецептора предотвращали данное действие. Такие же результаты были получены и в опытах in vivo при введении ингибиторов трансаминазы. Данные результаты свидетельствуют об ингибирующем влиянии ГАМК на секрецию пролактина и экспрессию его гена в гипофизе [213].
Обратный агонист ГАМКА
-рецептора произвел противоположный эффект на экспрессию гена пролактина. Так, интрацеребровентрикулярная инъекция ODN за 4 часа до декапитации вызвала увеличение уровня мРНК пролактина в гипофизе самцов крыс. Удаление надпочечников привело к увеличению уровня мРНК пролактина и усилению эффекта ODN. Авторы предполагают, что эндогенный лиганд ГАМКА
-рецептора может стимулировать экспрессию гена пролактина и что в надпочечниках синтезируется фактор(ы), способный уменьшить уровень мРНК пролактина [327].
Агонист ГАМКА
-рецептора, диазепам, введенный внутрибрюшинно в дозе 5 мг/кг, увеличил концентрацию лютеинизирующего и не повлиял на уровень фолликулостимулирующего гормонов в сыворотке крови самцов крыс [224].
Диазепам влияет на уровень энкефалинов – компонентов стресс-лимитирующих систем [95, 117, 237]. Так, однократная инъекция диазепама вызвала изменение концентрации энкефалинов в мозге крыс: увеличила в гипоталамусе на 35% и понизила в стриатуме примерно на 25%, в продолговатом и среднем мозге изменения не выявлены. Максимальный эффект от введения препарата был достигнут уже через 2-5 минут после инъекции. Изменения, наблюдаемые в гипоталамусе, были краткосрочными, тогда как уменьшение концентрации энкефалинов в стриатуме имело более длительную продолжительность [117]. Увеличение уровня мет-энкефалина в гипоталамусе свиньи Гвинеи наблюдалось и при хроническом увеличении концентрации ГАМК (обработка аминооксиуксусной кислотной) [237].
1, 2, 4, 8-дневная активация ГАМК-ергической системы привела к уменьшению уровня мет-энкефалина в стриатуме самцов крыс. В гипоталамусе, гиппокампе, лобной коре и мосте подобных изменений не обнаружено. Увеличение концентрации ГАМК в течение 8 дней вызвало рост уровня мРНК препроэнкефалина, тогда как 1-, 2- или 4-дневные обработки не повлияли на него [272, 298]. Хроническое повышение уровня ГАМК в стриатуме при введении ингибиторов ГАМК-трансаминазы (аминооксиуксусная кислота, этаноламин-О-сульфат, γ-винил-ГАМК) привело также к уменьшению уровня динорфина (1-8) и увеличению уровня его мРНК [272].
Таким образом, ГАМК влияет на уровень энкефалина и динорфина в стриатуме через ингибирование экспрессии их мРНК [238, 272].
По данным ряда исследователей вещество Р вовлекается в модуляцию стресса и беспокойства [126, 285]. Воздействие разнообразных стрессоров повышает уровень вещества Р в различных областях мозга: миндалине, перегородке, гипоталамусе [95, 105, 126]. Введение антагонистов нейрокининовых рецепторов предотвращает данный эффект и оказывает транквилизирующий эффект [126, 285]. Кроме того, у пациентов с депрессивными расстройствами уровень вещества Р повышен в цереброспинальной жидкости [78] и плазме крови [126]. Ведение диазепама в дозе 5 мг/кг приводит к уменьшению уровня вещества P через 140 минут после инъекции в гиппокампе и сером веществе спинного мозга на 40 % (p <0,001) и 28 % (p <0,05) соответственно по сравнению с контролем [95].
Авторы [126, 285] предполагают, что ингибирование вещество Р-ергической системы может быть использовано для разработки новых антидепрессантов и транквилизаторов.
Нейропептид Y играет в мозге роль транквилизатора [24, 93, 94]. ODN, анксиогенное вещество, вызвал существенное уменьшение уровня мРНК нейропептида Y в гипоталамусе на 17,4-31,4%. Степень воздействия зависела от дозы вещества [108].
Введение диазепама в течение 28 дней привело к повышению уровня мРНК интерлейкина-1-бета (пептид, активирующий Т-лимфоциты) в гипоталамусе, гиппокампе, фронтальной коре и стволе мозга крысы [312].
Таким образом, диазепам и агонисты бензодиазепиновых рецепторов изменяют уровень ПОМК и его дериватов (эндорфинов, АКТГ), энкефалинов, пептидов половой системы (ГнРф, лютеинизирующего гормона, пролактина) и других регуляторных пептидов, участвующих в развитии психических расстройств, через модуляцию ГАМК-ергической системы. Механизм данного явления до конца не выяснен.
Галоперидол (4-(пара-хлорфенил)-1-[3'- (пара-фторбензоил)-пропил]- пиперидинол-4) широко применяют в клинической практике в качестве антипсихотического средства при лечении шизофрении, различных психозов, а также для купирования психомоторного возбуждения различного генеза [38, 69, 262]. Кроме того, для галоперидола характерна противорвотная активность, связанная с избирательным угнетением хеморецепторных триггерных зон продолговатого мозга [38, 256], а также анестезирующее действие [99].
Клинические действия нейролептика обусловлены способностью избирательно блокировать дофаминовые рецепторы ЦНС [328]. В настоящее время охарактеризовано пять типов ДА-рецепторов. Галоперидол связывается преимущественно с Д2
-рецепторами. ДА-рецепторы могут располагаться на пресинаптических мембранах дофаминовых нейронов (авторецепторы), а также на постсинаптических мембранах различных нейронов, включая пептидергические нейроны. Постсинаптические ДА-рецепторы могут быть представлены всеми подтипами, в качестве же авторецепторов могут выступать только Д2
- и Д3
-рецепторы. Активация авторецептора ингибирует дофаминовую трансмиссию путем уменьшения секреции и синтеза дофамина в нейронах. Низкие концентрации агонистов ДА-рецепторов приводят к активации авторецепторов, тогда как более высокие концентрации активируют постсинаптические ДА-рецепторы, что приводит к увеличению дофаминовой передачи [79].
В пределах ЦНС ДА-рецепторы найдены в среднем, промежуточном мозге, обонятельной луковице и сетчатке. 80-90% всех ДА-рецепторов обнаружено в стриатуме. Кроме того, тела нейронов дофаминергической системы находятся в лимбических образованиях, коре головного мозга, некоторых ядрах гипоталамуса, мозговых оболочках и в периферических тканях [3, 49, 79, 101]. В зависимости от локализации ДА-рецепторов дофамин оказывает различное действие. При связывании с постсинаптическими ДА-рецепторами полосатого тела дофамин стимулирует двигательную активность, поведенческие эффекты; связывание дофамина с постсинаптическими ДА-рецепторами гипофиза приводит к ингибированию секреции гипофизарных гормонов; с ДА-рецепторами надпочечников – к регуляции секреции альдостерона [70, 79, 103, 284]. Нейролептики блокируют эти эффекты [1, 2, 49, 98, 273, 287].
В патогенез шизофрении, шизотипических и бредовых расстройств кроме ДА-рецепторов вовлекаются и пептидные рецепторы [4]. В развитие психических болезней вовлекаются КРФ, вазопрессин, нейротензин, вещество Р, холецистокинин [120, 173, 174].
В организме деятельность пептидергических нейронов находится под контролем дофаминовой системы, поэтому изменение ее функционирования при введении галоперидола приводит к изменению уровня регуляторных пептидов в мозге.
Однократное введение нейролептика увеличило уровень мРНК препроэнкефалина в стриатуме и аккумбентном ядре [66]. Так, однократная внутрибрюшинная инъекция галоперидола увеличила содержание мРНК проэнкефалина и пронейротензина в хвостатом и аккумбентном ядрах у крыс [261]. Подхроническая доза галоперидола (3 мг/кг, вводимая внутрибрюшинно ежедневно в течение 5 дней) вызвала рост уровня мРНК препроэнкефалина в стриатуме в 1,8 раз (р<0,001) по сравнению с контрольными животными. Уровень опиоидных пептидов повысился в 1,6 раз (р<0,001) [57].
Таким образом, дофамин проявляет ингибирующее действие на экспрессию мРНК препроэнкефалина в стриатуме и аккумбентном ядре крысы, которое осуществляется через Д2
-рецепторы [97, 154, 239]. При введении антагониста этих рецепторов, галоперидола, данный эффект подавляется [167, 228, 314].
Активация или ингибирование дофаминовых рецепторов влияет на содержание мет-энкефалина в гипофизе крыс.
Так, введение бромокриптина (агониста дофамина) в течение 3 дней вызвало уменьшение уровня мет-энкефалина в промежуточной доле гипофиза, а после 4-недельной обработки уровень мет-энкефалина снизился на 60-70%. Эти эффекты сохранялись в течение 4 дней после прекращения введения бромокриптина. В гипоталамусе и передней доли гипофиза существенные изменения выявлены не были [153, 154]. Соответственно при введении галоперидола уровень мет-энкефалина в промежуточной доле гипофиза был выше, чем в контроле [153]. Но существуют также данные о снижении содержания мет- и лей-энкефалина при повторной инъекции галоперидола [43] и уменьшении уровня мРНК препроэнкефалина на 42 % при хроническом потреблении нейролептика (3 недели) в передней доле гипофиза у самцов крыс.
Галоперидол влияет на секрецию энкефалина. В опытах in vitro агонисты Д2
-рецептора увеличивали секрецию энкефалина при деполяризации клеток стриатума, не влияя на секрецию недеполяризованных клеток. Этот эффект был предотвращен галоперидолом. Возможно, возбуждение Д2
-рецептора in vitro или in vivo облегчает секрецию энкефалина в стриатуме, но эндогенный дофамин не влияет на деятельность нейронов при обычных условиях [183, 211].
Вещество P участвует в развитии психоневрологических расстройств через взаимодействие с дофаминовой системой [169].
Однократное или многократное внутрибрюшинное введение нейролептика в дозе 1 мг/кг снижало в нигростриатальной области мозга содержание вещества Р и К, а также α- и β-препротахикининовых мРНК. Кроме того, наблюдался параллелизм между сроками снижения содержания исследованных мРНК и сроками максимального клинического действия галоперидола как антипсихотического вещества. Полагают, что галоперидол снижает биосинтез препротахикининовой мРНК, а взаимодействие между тахикининовыми и дофаминовыми нейронами играет роль в модуляции функций базальных ганглиев [67, 73, 187].
Хроническое воздействие галоперидола привело к увеличению уровня мРНК препротахикинина А в гиппокампальной CA3 подобласти и в коре больших полушарий [334], а также к уменьшению уровня мРНК препротахикинина А в аккумбентном ядре (14 %) [210, 226], в дорсолатеральной (19%) и медиальной (15%) частях хвостатого ядра [210, 226, 294]. Содержание мРНК препросоматостатина не изменились в исследованных областях мозга [65, 226]. В гипофизе и септе нейролептик увеличил экспрессию мРНК препротахикинина [89, 294]. Потребление галоперидол в течение 45 дней привело к уменьшению содержания фактора роста нервов в гиппокампе [254].
Холецистокинин проявляет эффекты, сходные с действием нейролептиков [323, 336]. У пациентов с диагнозом шизофрения, получающих нейролептики, уровень мРНК холецистокинина в мозге повышен по сравнению со здоровыми людьми [286]. Такой же эффект наблюдался в гиппокампе и коре больших полушарий при введении галоперидола [324].
Главные участки экспрессии гена ПОМК - промежуточная и передняя доли гипофиза и дугообразное ядро гипоталамуса [260]. Роль дофамина была исследована путем введения галоперидола и бромокриптина. В дугообразном ядре бромокриптин увеличил, а галоперидол уменьшил уровень мРНК ПОМК. Наоборот, в промежуточной доле гипофиза бромокриптин заметно понизил, а галоперидол повысил уровень мРНК на 100-150% [69, 172, 253]. Эффект бромокриптина на клетки гипофиза подтвердился и опытами in vitro [76]. Повышение уровня мРНК ПОМК в промежуточной доле гипофиза в результате действия галоперидола наблюдалось уже через 6 часов после обработки [103]. Полное аннулирование эффектов галоперидола было замечено спустя 2 недели после отмены препарата [172]. Эти данные указывают на то, что экспрессия гена ПОМК регулируется дофамином и что этот процесс отличается в мозгу и гипофизе [258, 319]. Хронический галоперидол (2 мг/кг в течение 14 дней) увеличил уровень мРНК ПОМК, пролактина, гормона роста и Д2
-рецептора в гипофизе [187]. Даже кратковременная обработка галоперидолом (5 и 2 дня, 2 мг/кг в день) вела к существенным увеличениям уровня мРНК Д2
-рецепторов и ПОМК в промежуточной доле гипофиза. В передней доле гипофиза подобных изменений не было обнаружено [70, 103].
Meador-Woodruff и соавт. обнаружили увеличение уровня мРНК ПОМК, а также β-эндорфина, α- и γ-меланоцитстимулирующего гормона в промежуточной доле гипофиза после хронического введения галоперидола и понижение уровня мРНК ПОМК, β-эндорфина, АКТГ и γ-меланоцитстимулирующего гормона в передней доле [229]. Авторы [229] предполагают, что биосинтез, процессинг и секреция ПОМК в гипофизе контролируется дофаминергической системой, но механизм влияния дофамина на переднюю и промежуточную долю гипофиза различен.
В опытах in vitro на клетках гипофиза дофамин (1 мM) уменьшил уровень мРНК ПОМК в промежуточной доле на 77%, но не повлиял на экспрессию гена ПОМК в передней доле. Бромокриптин (100 нМ) оказывал действие подобное дофамину. Эффектам дофамина и бромокриптина противодействовал галоперидол (10 мM). Уровни β-эндорфина и α-меланоцитстимулирующего гормона изменялись параллельно изменению синтеза ПОМК [212].
Галоперидол, вводимый в течение 7 – 21 дней (1,5 мг/кг, ежедневно), увеличил уровень β-эндорфина на 80 – 100% в промежуточной доле гипофиза крыс [69, 171, 172] и секрецию β-эндорфина in vitro [172], а также стимулировал меланотропную деятельность [284]. Бромокриптин соответственно уменьшал уровень α-меланоцитостимулирующего гормона в промежуточной доле гипофиза [284].
Хроническое воздействие антагониста Д2
-рецептора (1 мг/кг) увеличило уровень β-эндорфина в промежуточной доле гипофиза, особенно N-ацетил-β-эндорфина-(1-31) и N-ацетил-β-эндорфина-(1-27), не затронув уровень N-ацетил-β-эндорфина-(1-26) [236], а также в среднем и продолговатом мозге всех N-ацетильных производных эндорфина. Уровень NH2
-пептидов не изменился ни в одном из отделов [165, 236]. Обработка галоперидолом вызвала существенное увеличение концентрации β-, γ-, α-эндорфина и α-меланоцитстимулирующего гормона в промежуточной доле и β-эндорфина в передней доле гипофиза [103, 314]. В передней доле гипофиза значительно увеличилось соотношение β-эндорфин/α-эндорфин. В промежуточной доле подобных эффектов не наблюдалось [314]. Эти результаты указывают, что дофаминергическая система влияет не только на секрецию, но и на посттрансляционную модификацию гипофизарного β-эндорфина [165, 237]. Кроме того, нейролептик выборочно увеличил содержание β-, γ- и α-эндорфина в гипоталамусе [314], гиппокампе [314] и перегородке [164, 171].
Повышение уровня β-эндорфина в плазме наблюдалось при однократной инъекции галоперидола. Причем степень изменения зависела от дозы препарата [129, 164, 171, 229]. Увеличение концентрации β-эндорфина, а также α-меланотропина в плазме происходило и при хроническом введении нейролептика [171, 314].
Таким образом, синтез и секреция β-эндорфина в промежуточной доле гипофиза и de novo синтез ПОМК находится под ингибирующим влиянием дофамина [103, 172].
Нейротензин, возможно, играет важную роль в этиологии и/или медикаментозном лечении шизофрении и других психоневрологических заболеваний. Установлено, что уровень нейротензина в цереброспинальной жидкости больных шизофренией уменьшен, но восстанавливается после лечения галоперидолом [58, 92, 269, 290]. При этом, чем выше был уровень психопатологии, тем ниже уровень данного пептида [89, 292].
Сходные эффекты, наблюдаемые при периферическом введении антипсихотических лекарств и центральном введении нейротензина, привели к возникновению гипотезы о том, что нейротензин является эндогенным антипсихотическим средством [243]. Локализация нейротензина и его рецепторов в мезолимбической ДА-системе подтверждает гипотезу о вовлечении нейротензина в этиологию шизофрении. Кроме того, предполагается участие данного пептида в экстрапирамидальных расстройствах (паркинсонизм, дискинезии, гиперкинезы), развивающихся при лечении антипсихотическими препаратами [73, 269].
Существует множество данных о влиянии галоперидола на нейротензиновую систему [59, 73, 243]. Так, острая инъекция галоперидола (1 мг/кг) увеличила экспрессию гена нейротензин/нейромедина N в дорсолатеральном стриатуме и аккумбентном ядре у крыс [117, 231, 233]. Причем время после инъекции влияло на уровень мРНК. Экспрессия мРНК нейротензин/нейромедина N в дорсолатеральной части хвостатого ядра, не обнаруженная в контроле, увеличилась через 0,5 и 7 часов после инъекции и уменьшалась через 20-24 часа. В дорсомедиальной и вентролатеральной части хвостатого ядра, едва обнаруживаемая базальная экспрессия мРНК нейротензин/нейромедина N, наблюдаемая в контроле, заметно увеличилась через 24 часа после введения галоперидола [231, 335]. Вызванному нейролептиком повышению уровня зрелой мРНК в стриатуме предшествовало увеличение уровня гяРНК. Эти данные указывают, что острое воздействие активирует транскрипцию гена нейротензин/нейромедина N, хотя сопутствующий эффект на стабильность первичных транскриптов не исключается [231]. Даже единственная достаточно низкая доза нейролептика (0,5 мг/кг) через час приводила к увеличению уровня мРНК нейротензин/нейромедина N почти в 3 раза в дорсолатеральном стриатуме мышей и крыс [233]. Хроническое потребление галоперидола увеличило концентрацию нейротензина в аккумбентном, хвостатом ядрах и в черной субстанции [244]. Кроме того, галоперидол (1 мг/кг), вводимый крысам в течение 2 недель увеличил уровень мРНК рецептора нейротензина на 10% (p<0,05) в черном веществе [85]. Эти эффекты являются следствием блокады галоперидолом дофаминовых Д2
-рецепторов [59].
Очевидному повышению транскрипции гена нейротензин/нейромедина N после единственной инъекции галоперидола предшествовало увеличение уровня c-fos мРНК в той же самой области [117, 162, 232, 235]. При этом в клетках дорсолатерального стриатума мРНК c-fos и нейротензин/нейромедина N солокализованы [232]. Введение пептида, блокирующего экспрессию c-fos гена, привело к 50%-ному понижению уровня мРНК нейротензин/нейромедина N в дорсолатеральном стриатуме после введения нейролептика. С другой стороны, экспрессия мРНК препроэнкефалина в дорсолатеральном стриатуме и нейро-тензин/нейромедина N в аккумбентном ядре не изменилась. Таким образом, c-fos играет определенную роль в регулировании транскрипции гена нейротензин/нейромедина N в дорсолатеральном стриатуме крыс после острого воздействия галоперидола [230]. Существуют данные о том, что промотор гена нейротензина содержит два предполагаемых участка для закрепления Fos-белков, которые могут увеличить транскрипцию гена [52].
Уменьшение концентрации нейропептида Y в стриатуме наблюдалось после хронического введения галоперидола и аминазина [250]. После хронического воздействия нейролептиков в дорсальном стриатуме произошло увеличение как числа клеток, экспрессирующих мРНК нейрокинина В (45 %), так и концентрации пептида в отдельных клетках (37 %) [227]. Введение галоперидола в течение 28 дней привело к повышению уровня мРНК интерлейкина-1-бета (пептид, активирующий Т-лимфоциты) в гипоталамусе, гиппокампе, фронтальной коре и стволе мозга крысы [312].
Агонист дофаминовых рецепторов, бромокриптин, влияет на ростовые процессы в клетке. Так, введение бромокриптина в течение 8 дней вызвало уменьшение диаметра ядра и понижение синтеза ДНК в клетках гипофиза [188].
Дофаминергическая система влияет на репродуктивную систему. Хроническое введение бромокриптина увеличило уровень мРНК ГТ-Рг в мозге крыс на 70%, галоперидол снизил этот параметр на 20% [208].
Таким образом, галоперидол через ингибирование дофаминергической системы изменяет функционирование репродуктивной системы, влияет на концентрацию опиоидных пептидов и их предшественников, а также на экспрессию их мРНК в головном мозге.
Большинство биологически активных пептидов синтезируется в виде высокомолекулярных неактивных предшественников – препробелков, которые подвергаются посттрансляционной модификации [43, 309]. Синтез предшественников осуществляется на мембраносвязанных рибосомах ЭПР. Наличие на N-конце препроформы нейропептида набора гидрофобных аминокислот, так называемой сигнальной последовательности, позволяет предшественнику транспортироваться внутрь ЭПР. Здесь сигнальная последовательность отщепляется сигнальной пептидазой и образуется пропептид. Дальнейший процессинг осуществляется в ходе передвижения молекул по ЭПР, комплексу Гольджи и в секреторных везикулах [309].
Сначала под действием эндопептидаз, расщепляющих нейропептиды по синглетным и дуплетным остаткам основных аминокислот (фурин, РС1/3, РС2, РС4 [291], проопиомеланокортин-превращающий фермент [215], тиоловая прогормонконвертаза [71], динорфин-превращающий фермент [115] и др.), образуются неактивные пептиды, содержащие на N- и С-концах “лишние” остатки основных аминокислот. Удаление этих аминокислот в секреторных везикулах осуществляется соответственно аминопептидазо-В-подобным(и) [19] и карбоксипептидазо-В-подобным(и) ферментами [12, 21, 137].
Таким образом, для понимания механизмов действия нейропептидов существенным моментом является изучение их образования и деградации. Основным карбоксипептидазам как ферментам, участвующим в конечных стадиях образования и начальных стадиях деградации, принадлежит важная роль в регуляции уровня нейропептидов в организме. В связи с этим, большой интерес представляет изучение активности основных карбоксипептидаз в норме и при различных физиологических и патологических состояниях организма, сопровождающихся изменением содержания биологически активных пептидов.
Биологические свойства регуляторных пептидов, изменение их уровня под влиянием различных воздействий в определенной степени обусловлены особенностями функционирования ферментативных систем обмена биологически активных пептидов. Изменение интенсивности процессов синтеза и деградации при изменении функционирования медиаторных систем [65, 83, 95, 193, 225, 238] свидетельствует о регуляторной функции протеолиза, которая состоит в запуске и прерывании ряда биохимических и физиологических процессов. Биологически активные пептиды, в свою очередь, могут определять физиологические эффекты лекарственных препаратов, вовлекаться в развитие зависимости от них. Поэтому очень важным представляется исследование активности ферментов обмена нейропептидов при остром и хроническом введении галоперидола и диазепама.
При хроническом потреблении диазепама наблюдалась тенденция к снижению активности ангиотензинпревращающего фермента и повышению активности карбоксипептидазы Н в гипофизе, гипоталамусе и стриатуме крыс [20]. Вместе с тем, введение в течение 10 дней диазепама сопровождается повышением содержания в мозге эндозепинов [8], что может указывать на усиление их биосинтеза и ослабление распада. Авторы [20] предполагают, что исследуемые ферменты вовлекаются в обмен этих пептидов.
При совместном воздействии стресса и диазепама изменения активности карбоксипептидазы Н во всех отделах были меньшими, чем при их раздельном воздействии. Введение диазепама при эмоциональном стрессе привело к снижению активности ангиотензинпревращающего фермента по сравнению с животными, подвергавшимися воздействию только диазепама или только стресса [20].
Таким образом, если при приеме диазепама в сочетании с эмоциональным стрессом наблюдалась тенденция к компенсации изменений активности КП Н, то снижение активности ангиотензинпревращающего фермента было более выраженным. Известно, что карбоксипептидаза Н участвует в биосинтезе АКТГ [128, 304], секреция которого при стрессе возрастает. Введение бензодиазепиновых транквилизаторов, в частности, феназепама уменьшает концентрацию АКТГ [51, 111, 316, 330] при стрессе. Активность карбоксипептидазы Н в случае введения диазепама при стрессе снижается по сравнению с таковой только при стрессе. Вместе с тем, ангиотензинпревращающий фермент участвует, по-видимому, в деградации энкефалинов, вещества Р и пептида дельта-сна [182], которые способствуют адаптации к стрессу [48]. Снижение активности ангиотензинпревращающего фермента могло бы, вероятно, способствовать повышению их содержания. Возможно, что диазепам оказывает антистрессорное воздействие на организм путём модуляции активности карбоксипептидазы Н и ангиотензин-превращающего фермента, что, в свою очередь, может приводить к уменьшению содержания АКТГ, и увеличению содержания пептидов, способствующих адаптации.
Степень эмоциональности животных влияла на активность ангиотензинпревращающего фермента в мозге крыс. Наиболее выраженные изменения наблюдались у низкоэмоциональных животных [20]. Также влиял диазепам и на активность ангиотензинпревращающего фермента в сыворотке крови. Однако введение диазепама на фоне стресса привело к наиболее значимому понижению активности фермента в мозге у высокоэмоциональных, а в сыворотке – у низкоэмоциональных животных [20].
Потребление диазепама в течение 10 дней вызывало снижение активности ангиотензинпревращающего фермента в мозге крыс. Наиболее выраженное снижение активности наблюдалось в гипофизе (на 63%) [13]. В гипоталамусе и стриатуме снижение активности фермента было менее выраженным (на 20 и 23% соответственно). Авторы [13] предполагают, что ангиотензинпревращающий фермент играет определенную роль в обмене опиоидных, стресс- и DBI-происходящих пептидов.
При одновременном потреблении крысами этанола и диазепама наблюдалось повышение активности ангиотензинпревращающего фермента по сравнению с активностью при раздельном потреблении этих веществ в гипофизе и гипоталамусе [13]. По мнению авторов, купирование диазепамом алкогольного абстинентного синдрома может быть обусловлено тем, что при совместном воздействии эти вещества вызывают менее выраженное снижение активности ангиотензинпревращающего фермента, чем при раздельном. Сходство поведенческих и физиологических эффектов этанола и диазепама возможно объясняется их сходным влиянием на активность ангиотензинпревращающего фермента.
Введение галоперидола (1 мг/кг) в течение 7 дней привело к уменьшению активности аминопептидазы N в стриатуме и коре больших полушарий, что, в свою очередь, вызвало уменьшение накопления фрагментов (тирозин и гли-гли-фен-мет), образующихся при действии фермента на мет-энкефалин [199].
Тир-гли-гли – производное энкефалина, полученное при действии энкефалиназы. Острое воздействие агонистов Д2
-рецепторов вызвало повышение содержания трипептида в стриатуме крыс. Этот эффект был блокирован галоперидолом, в то время как, просто инъекция галоперидола не изменила уровень тир-гли-гли. Однако хроническое потребление нейролептика привело к увеличению содержания фрагмента энкефалина в стриатуме, возможно, путем активации энкефалиназы [199, 213].
Нейтральная эндопептидаза 24.11, как известно, использует в качестве субстратов ряд нейропептидов, включая энкефалины и нейротензин. Хроническая обработка галоперидолом (1 мг/кг/день, 12 дней) увеличила активность фермента в аккумбентном ядре. Более высокие дозировки практически не повлияли на активность нейтральной эндопептидазы 24.11. активность фермента в гипоталамусе не изменилась при введении галоперидола [198].
Острое воздействие галоперидола привело к повышению уровня каталитической единицы цАМФ-зависимой киназы в стриатуме [321].
Grigoriants и соавт. обнаружили увеличение уровня мРНК КП Н при введении его в течение 14 и 21 дня в дозе 2 мг/кг в промежуточной и задней долях гипофиза на 90 – 110% [158]. Введение бромокриптина в течение 1 – 5 дней привело к снижению уровня мРНК прогормонконвертазы 2, КП Н и пептидилглицин-α-амидирующей монооксигеназы в промежуточной доле гипофиза, потребление галоперидола вызвало обратный эффект [253].
Уровень мРНК аминопептидазы N, нейтральной эндопептидазы 24.11 и прогормонконвертаз 1 и 2 в хвостатом ядре и фронтальной коре мозга крысы не изменился после 7-дневного потребления галоперидола (1 мг/кг). Авторы предполагают, что возможно большую роль в модуляции деятельности пептидаз играет трансляция мРНК или встраивание белка в мембрану [329].
Каликреиноподобный фермент относится к семейству аргининовых эндопептидаз. В опытах in vivo введение бромокриптина и галоперидола вызвало соответственно уменьшение и увеличение уровня мРНК фермента в промежуточной, но не в передней доле гипофиза самцов крыс [266, 268].
Таким образом, психолептики вызывают изменение активности ряда протеолитических ферментов. Это, в свою очередь, ведет к изменению уровня многих регуляторных пептидов, обеспечивающих основные и побочные эффекты препаратов.
Карбоксипептидаза Н (КП Н, энкефалинконвертаза, карбоксипепти-даза Е, КФ 3.4.17.10) впервые была выделена и охарактеризована в 1982 г. Fricker L.D. и Snyder S.H. из хромаффинных гранул надпочечников [147].
КП Н широко представлена в тканях человека, быка, крысы, мыши, акулы, шпорцевой лягушки, ската-удильщика, моллюска Aplysia [143, 149, 280, 297, 311] и обладает сходным региональным распространением, физико-химическими и каталитическими свойствами.
Высокая активность КП Н была обнаружена в гормонпродуцирующих клетках гипофиза [128, 145, 181, 190, 197], a- и b-клетках поджелудочной железы [111, 119, 157], хромафинных клетках надпочечников [147, 148, 149, 175, 311], более низкая – в пептидергических нейронах гипоталамуса, стриатума, гиппокампа, среднего мозга, больших полушарий и мозжечка [15, 148, 149, 308]. При этом в гипоталамусе высокая активность КП Н обнаружена в медиальном возвышении, супраоптическом, паравентрикулярном и супрахиазматическом ядрах [220]. В гиппокампе фермент обнаружен в пирамидальных клетках и во внутренней части молекулярного слоя зубчатой извилины. КП Н также обнаружена в центральных нейронах миндалины [219]. Имеются сведения о наличии активности КП Н в водянистой жидкости глаза человека [251], в плаценте [26]. Таким образом, тканевое распределение активности этой карбоксипептидазы в целом соответствует распределению нейропептидов [26].
В клетке КП Н локализована, в основном, в секреторных гранулах, в структурных элементах эндоплазматического ретикулума и комплекса Гольджи, содержащих биологически активные пептиды – АКТГ [128, 175], гормон роста [103], пролактин [103], инсулин [114], глюкагон [159], энкефалины [147, 148], вазопрессин [282], окситоцин [247], вещество Р [104], атриальный натрийуретический фактор [220].
Ген КП Н был клонирован и секвенирован [60, 225, 277]. Транскрипция КП Н осуществляется с единственного сайта транскрипции [245, 304]. мРНК КП Н состоит из 2100 нуклеотидов [137]. Полный ген охватывает приблизительно 50000 оснований и состоит из девяти экзонов, каждый из которых содержит кодирующие белок области [190].
Уровни мРНК КП Н и активности КП Н в мозге и тканях в целом коррелируют между собой [81]. Наивысшие уровни мРНК КП Н обнаружены в пирамидальных клетках гиппокампа, в передней и промежуточной долях гипофиза, эпендимных клетках боковых желудочков мозга, базолатеральной миндалине, супраоптическом и паравентрикулярном ядрах. Средние уровни мРНК КП Н у крыс обнаружены в таламусе, медиальном коленчатом ядре, коре мозжечка и промежуточной оливе. Наименьшие уровни выявлены в гранулярном клеточном слое гиппокампа, латеральном гипоталамусе, бледном шаре и в ретикулярной формации ножки мозга [221]. Высокая экспрессия мРНК КП Н отмечена в паравентрикулярном и супраоптическом ядрах гипоталамуса – местах преимущественного синтеза окситоцина и вазопрессина [86]. мРНК КП Н и ферментативная активность обнаружена также в клонах эндокринных клеток – AtT-20, GH-3, GH4C1 и неэндокринных – L, 3T3, SK-HEP-1, HEK293, COS, C127 [124, 188], а также в культуре астроцитов [198].
КП Н является гликопротеином и состоит из одной полипептидной цепи [15, 114, 140, 220, 245]. Фермент синтезируется в виде неактивного зимогена, состоящего из 476 аминокислотных остатков, с Mr 75000 [240, 277, 306], который превращается в активную форму под действием трипсиноподобных ферментов в ходе созревания секреторных везикул [134, 160]. Сначала образуется неактивная форма с Mr 65000 [176, 177], которая превращается в активные формы с Mr 52000 – 53000 и 55000 – 57000 [134, 160, 255]. Отличия в Mr этих форм не зависят от степени гликозилирования [134, 255, 257]. Форма с Mr 55000 – 57000 отличается от формы с Mr 52000 – 53000 наличием N-концевого сигнального пептида [255]. Обе формы существуют и в растворимом, и в связанном с мембранами виде [134, 160]. Имеются сведения о том, что мембранная форма КП Н (57000) связана с эндоплазматическим ретикулумом и элементами комплекса Гольджи, а растворимая форма КП Н (54000) – с секреторными гранулами [159]. За связывание фермента с мембранами отвечает C-концевая амфифильная последовательность, которая присутствует только у мембраносвязанной формы [140]. Она состоит из 21 остатка чередующихся гидрофобных и гидрофильных аминокислот. Активность растворимой формы фермента в расчёте на молекулу фермента выше, чем мембраносвязанной [136, 141]. Соотношение между растворимой и мембраносвязанной формами изменяется по мере созревания секреторных везикул [178]. Активность растворимой и мембраносвязанной форм КП Н в разных клетках и тканях различно. В частности, в клетках линий RIN 1046-38 и RIN 1046-44 75% зрелой КП Н обнаружено в мембраносвязанной форме [134]. С другой стороны, в передней и задней долях гипофиза 70% всей активности КП Н представлено растворимой формой [255].
Фермент проявляет максимальную активность при рН 5,6-6,0, что соответствует рН внутри секреторных гранул [137, 148, 149, 247]. КП Н сильно активируется ионами Со2+
(в 5 – 10 раз) и в меньшей степени – ионами Ni2+
(в 2 – 3 раза), полностью ингибируется ионами Cu2+
, Cd2+
и ЭДТА. Ионы других двухвалентных металлов (Zn2+
, Ca2+
, Mg2+
) не влияют на его активность [147, 148, 149]. Ионы Zn2+
полностью восстанавливают активность КП Н после ингибирования его действия 1 мМ раствором ЭДТА, при добавлении ионов Со2+
и Ni2+
активность фермента значительно повышалась, а Ca2+
и Mg2+
активность фермента не восстанавливали [15]. Ионы Ca2+
влияют на агрегацию и высвобождение белка из секреторных везикул [161, 242, 305]. Таким образом, карбоксипептидаза Н – это металлозависимый фермент, в активном центре которого находится ион Zn2+
[15]. Реагенты на сульфгидрильные группы HgCl2
и N-этилмалеимид существенно ингибируют активность фермента [144]. 2-меркаптоэтанол, каптоприл и ФМСФ не оказывают заметного влияния на активность КП Н [15, 220]. Карбоксипептидаза Н содержит SH-группу(ы) и является тиолзависимым цинк-металлоферментом [15]. Активность КП Н ингибируется CuCl2
, HgCl2
, р-хлормеркурфенилсульфатом, АПМЯК, ЭДТА, 1,10-фенантролином и 2-меркаптометил-3-гуанидилэтилтиопропановой кислотой [123, 149, 175, 181]. Наиболее эффективными ингибиторами являются ГЭМЯК и ГПЯК с Ki
8,8 и 7,5, соответственно [114, 144, 280, 311]. Активность фермента существенно снижается при добавлении рилизинг-фактора лютеинизирующего гормона, вещества Р, тиреотропин-рилизинг фактора, вазопрессина, окситоцина, Met- и Leu-энкефалина, АКТГ [180, 259, 282].
КП Н обладает, практически, абсолютной специфичностью по отношению к пептидным субстратам с С-концевыми основными аминокислотами [26, 27, 123, 326]. КП Н хорошо отщепляет остатки -Lys и -Arg от природных и синтетических субстратов. 125
I-Met-энкефалин-Arg6
, 125
I-Met-энкефалин-Lys6
[19], АКТГ-Lys15
-Lys16
-Arg17
, Arg8
-вазопрессин-Gly-Lys-Arg являются природными субстратами исследуемого фермента [175, 181, 282]. Для определения активности КП Н разработано множество методов, наиболее часто используемым является флюорометрический метод Friker и Snyder с использованием таких субстратов как дансил-Phe-Ala-Arg и дансил-Phe-Leu-Аrg [144, 149, 311]. О-кумароил-Phe-Ala-Arg [45], даларгин [47], Leu5
-энкефалин [47], [3
Н]-бензоил-Phe-Leu-Arg, [3
Н]-бензоил-Phe-Ala-Arg [278, 308], 125
I-acetyl-Tyr-Ala-Arg, гиппурил-Arg [143] и другие также были предложены в качестве субстратов для определения активности КП Н.
У мышей линии fat/fat единичная точечная мутация Ser202 на Pro в гене, кодирующем КП Н, приводит к нарушению созревания регуляторных пептидов: инсулина [186], холецистокинина [203], пронейротензина и промеланоцитстимулирующего гормона [102, 283], тириолибирина [246], проэнкефалина [139], а также изменяет деятельность опиоидных рецепторов [88, 139]. Кроме того, нарушается внутриклеточный транспорт гормонов гипофиза через конститутативный путь [246, 293]. Это приводит к многочисленным эндокринным нарушениям, включая гиперинсулинемию и бесплодие [110, 216, 307].
Следует отметить, что внешнее воздействие способно быстро изменять уровень мРНК КП Н. Увеличение концентрации мРНК КП Н в гипоталамусе наблюдается при увеличении содержания окситоцина и вазопрессина [86], в ганглионарных клетках сетчатки глаза уровень мРНК КП Н повышается сразу после смены условий освещенности [288].
В клетках GH4C1 (из переднего гипофиза крысы, продуцирующих пролактин) 50 мМ раствор KCl увеличивает секрецию КП Н и пролактина в 10 раз, а 100 мМ тиреотропин-рилизинг фактор – в 2 – 3 раза [145]. Кроме того, эстрадиол (1 нМ), инсулин (300 нМ) и фактор роста эпидермиса (10 нМ) увеличивают внутриклеточный уровень КП Н в 2 раза по сравнению с контролем. Km при этом не изменяется, но увеличивается Vmax
[145].
Rodriguez и соавт. обнаружили, что действие дексаметазона на клетки AtT-20 снижает уровень мРНК КП Н и ПОМК примерно на 30% [277]. С другой стороны, прибавление кортикотропин-рилизинг фактора к клеткам, которые подвергались воздействию дексаметазона, вызывает 2 – 3-х кратное увеличение уровня мРНК КП Н и ПОМК [277]. Авторы считают, что уровни мРНК ПОМК и КП Н согласованно регулируются кортикотропин-рилизинг фактором и стероидными гормонами. При действии кортикотропин-рилизинг фактора на клетки AtT-20, не подверженные действию дексаметазона, происходит возрастание активности КП Н [223].
При хроническом прибавлении дексаметазона, кортикостерона, кортикотропин-рилизинг фактора, соматостатина к клеткам линии AtT-20/D16v уровень мРНК КП Н и активность КП Н не изменяются [223, 318].
При внутрибрюшинном введении дексаметазон и гидрокортизон (в дозах 1 и 100 мг на кг массы тела, соответственно) снижают активность растворимой и мембраносвязанной формы КП Н в гипофизе, гипоталамусе и стриатуме крыс, но динамика влияния во времени отличается [19]. В изученные интервалы (0,5, 4 и 24 часа после инъекции) дексаметазон сильнее подавляет активность в начальный период, тогда как действие гидрокортизона более выражено через 24 часа после введения. In vitro дексаметазон и гидрокортизон не оказывают влияния на активность КП Н [19]. Авторы [19] предполагают, что снижение активности КП Н in vivo происходит за счет снижения синтеза мРНК КП Н.
Субстратная специфичность, оптимум рН, клеточное и субклеточное распределение, совместная локализация фермента и биологически активных пептидов, свидетельствуют о вовлечении КП Н в процессинг многих нейропептидов, таких как окситоцин, вазопрессин, нейротензин, меланоцитстимулирующий гормон, вещество Р, энкефалины и др. [149, 175, 181, 259, 282, 283]. Показано, что КП Н вовлекается в определение агрессивности [30], устойчивости к стрессу [29], предрасположенности к потреблению этанола [31], в развитие физической зависимости от этанола [6, 30, 31] in vivo. Кроме того, изменение уровня мРНК КП Н и активности фермента под действием галоперидола [158, 219], глюкокортикоидов [19, 223, 277, 318] in vivo обуславливают интерес к изучению активности КП Н в условиях изменения функционирования медиаторных систем при введении галоперидола и диазепама.
Карбоксипептидаза М (КП М, КФ 3.4.17.2) была обнаружена Skidgel и соавторами в цитоплазматических мембранах периферических тканей и мозга [302].
Фермент широко распространен в человеческой плаценте, почках, легких [303], периферических нервах, головном мозге [241], желтом теле [333], гранулярных клетках растущих и незрелых фолликулов [333], эндотелиальных клетках кровеносных сосудов [289], лейкоцитах [116], Активность карбоксипептидазы М в нервной ткани на порядок ниже, чем в плаценте, а в периферических нервах выше, чем в головном мозге [241]. В мозге фермент обнаружен в клетках глиии, а также в комплексе с миелином и миелинформирующими клетками [241].
КП М является гликопротеином с Mr 62000 [118, 301]. Фермент представлен одной полипептидной цепью и связан с плазматической мембраной при помощи остатка гликозил-фосфатидилинозитола [118, 301]. При воздействии трипсина и фосфолипазы С КП М переходит в растворимую форму за счет удаления остатка гликозил-фосфатидилинозитола [118, 300]. Этот процесс возможен и in vivo, так как фермент обнаружен в моче и амниотической жидкости [300]. При химическом дегликозилировании образуется полипептид с Mr 48000, который состоит из 439 аминокислотных остатков [295, 303]. Аминокислотная последовательность фермента на 41% идентична КПN и КП Н, на 15% – КПВ и КПА. Многие остатки активного центра соответствуют таковым КПА и КПВ, но перекрестной реакции с антисыворотками к другим КП фермент не дает [303, 315].
Максимальная активность КП М отмечается при рН 7,0. В активном центре фермента находится ион Zn2+
[301]. Ионы Со2+
повышают активность КП М в 1,5 – 2 раза, причем степень активации возрастает при снижении рН [118]. Действие фермента ингибируется ионами Cd2+
, о-фенантролином, 2-меркаптометил-3-гуанидилэтилтиопропановой кислотой и ГЭМЯК [118, 301]. HgCl2
, ФМСФ, апротинин, каптоприл и фосфорамидон не влияют на его активность [120, 301].
КП М отщепляет остатки только основных аминокислот, причем в отсутствие ионов Со2+
предпочтительней отщепляет аргинин, а в присутствии Со2+
– лизин. Фермент в большей степени проявляет эстеразную активность, чем пептидазную [118, 301]. In vitro КП М отщепляет остатки аргинина и лизина с С-конца Met5
-энкефалин-Arg6
, Met-энкефалин-Lys6
, Leu5
-энкефалин-Arg6
, брадикинина, динорфина А1-13
[120, 271, 301], фактора роста эпидермиса [189, 300], анафилотоксинов С3а, С4а и С5а [265], различных синтетических пептидов [118, 302].
Считают, что карбоксипептидаза М участвует в инактивации или модулировании активности пептидных гормонов до или после их взаимодействия с рецепторами, вовлекается в процессы клеточного роста и дифференциации. В связи с этим представляет интерес изучение активности КП М при введении галоперидола и диазепама.
ФМСФ-ингибируемая карбоксипептидаза была впервые описана в растворимой фракции серого вещества головного мозга котов [22]. Поскольку фермент полностью ингибируется ФМСФ, он был назван ФМСФ-ингибируемой карбоксипептидазой [22].
ФМСФ-ингибируемая КП найдена во всех отделах мозга и практически во всех тканях и органах крыс. Наибольшая активность фермента отмечена в надпочечниках, яичниках, семенниках, гипофизе, обонятельных луковицах [9]. В гипофизе активность была в 1,6 раза меньше, а в семенниках – в 2,5 раза меньше, чем в надпочечниках [53, 54]. В порядке снижения активности фермента отделы головного мозга можно расположить следующим образом: гипофиз, обонятельные луковицы, большие полушария, гипоталамус, стриатум, мозжечок, гиппокамп, четверохолмие [16, 23, 53, 54]. В отделах мозга, богатых телами нейронов, активность фермента выше, чем в проводящих путях [16, 23].
ФМСФ-ингибируемая карбоксипептидаза имеет Mr 100000 – 110000, проявляет максимальную активность при рН 6,0 – 6,5 [22, 26, 27]. При нейтральных и слабощелочных значениях pH фермент инактивируется, но стабилизируется NaCl [26, 27]. ФМСФ-ингибируемая КП, по-видимому, не является металлозависимой карбоксипептидазой, т.к. не ингибируется ЭДТА и ГЭМЯК [9, 19]. Активность фермента полностью подавляется ингибитором сериновых протеиназ – ФМСФ и реагентом на сульфгидрильные группы – ПХМБ. Иодацетамид снижает активность действия фермента примерно в 2 раза. ЭДТА, 2-меркаптоэтанол, N-этилмалеимид, ионы Со2+
не изменяют активность ФМСФ-ингибируемой КП [22, 25, 26].
ФМСФ-ингибируемая КП представлена в мозге как в растворимой форме, так и в комплексе с мембранами субклеточных структур [9]. Согласно данным тонкослойной хроматографии фермент отщепляет аргинин от Leu5
-энкефалин-Arg6
и дансил-Phe-Leu-Arg, причем сродство фермента к дансил-Phe-Leu-Arg в несколько раз выше, чем к дансил-Phe-Ala-Arg (Кm
для гидролиза дансил-Phe-Leu-Arg 48 мкМ, дансил-Phe-Ala-Arg – 96 мкМ) [22, 25, 26].
Тканевое и региональное распределение ФМСФ-ингибируемой КП коррелирует с распределением нейропептидов и секретируемых белков [9, 33, 201]. Вместе с тем следует отметить, что в отделах головного мозга распределение активности фермента несколько не совпадает с распределением биологически активных пептидов в целом [201]. Наиболее высокая активность ФМСФ-КП обнаружена в эндокринных тканях, синтезирующих стероидные гормоны: яичниках, надпочечниках, семенниках [54]. В надпочечниках, где синтезируется большое число энкефалинов, активность ФМСФ-КП в 8 – 9 раз выше, чем активность КП Н. Кроме того, сродство ФМСФ-КП к дансил-Phe-Leu-Arg значительно выше, чем сродство КП Н [9]. Это позволяет предположить, что ФМСФ-ингибируемая КП как и КП Н участвует в процессинге нейропептидов, и вероятно, наиболее предпочтительным эндогенным субстратом для ФМСФ-ингибируемой КП является проэнкефалин (энкефалин- Leu5
-Arg6
).
Обнаружено, что ФМСФ-КП вовлекается в развитие алкогольной зависимости [17], в ответ на различные стрессирующие воздействия [5], поэтому представляет интерес изучение активности этого фермента при модуляции ГАМК- и дофаминергических систем.
Таким образом, данные препараты изменяют деятельность пептидергических систем. Введение психолептиков приводит к изменению уровня регуляторных пептидов в тканях. Для понимания динамики процессов, происходящих в пептидергической системе при введении психолептиков, необходима информация о процессах синтеза и деградации регуляторных пептидов [11, 21]. Карбоксипептидазы участвуют в конечных стадиях обмена пептидов [21, 30]. Поэтому изучение активности КП Н, ФМСФ-КП и КП М при введении галоперидола и диазепама представляет значительный интерес, как для уточнения биологической роли самих ферментов, так и для понимания механизмов функционирования пептидергических систем мозга.
Опыты проводили на самцах лабораторных белых беспородных крыс массой 200-250 г. Животных содержали в стандартных условиях вивария.
При изучении острого влияния психолептиков на активность КП Н, КП М и ФМСФ-КП in vivo диазепам вводили внутрибрюшинно в физрастворе в дозе 5 мг/кг веса, галоперидол – 2 мг/кг веса. Контрольные животные получали равное количество физраствора. Крыс декапитировали под наркозом через 0,5, 4, 24 и 72 часа после введения препаратов. При изучении хронического влияния психолептиков вышеуказанные дозы препаратов вводились в течение 10 дней. Через 1 и 3 суток после воздействия животных декапитировали. Для исследования влияния препаратов на КП Н, КП М и ФМСФ-КП in vitro гомогенаты тканей инкубировали с психолептиками в течение 60 мин при 4ºС. Концентрации препаратов соответствовали дозам при введении in vivo.
После декапитации извлекали гипофиз, гипоталамус, четверохолмие, мозжечок, стриатум, гиппокамп, большие полушария, надпочечники и семенники. Ткани очищали от оболочек и кровеносных сосудов, высушивали фильтровальной бумагой.
Для определения активности основных карбоксипептидаз ткани взвешивали, а затем гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком в 10 мМ натрий-ацетатном буфере (рН=5,6), содержащем 50 мМ NaCl в соотношении 1:100 (вес:объем).
В качестве специфических ингибиторов применяли ФМСФ (”Serva”, США) и ГЭМЯК (Serva”, США). В качестве субстратов использовали дансил-фен-ала-арг и дансил-фен-лей-арг (синтезированы к.х.н. Калихевичем В.Н.). В работе использовали трис-HCl (“Serva”, США) и ацетат натрия (“Merck”, Германия), все остальные реактивы были отечественного производства с квалификацией ”ХЧ” и ”ОСЧ”.
 
Активность КП Н определяли модифицированным методом Fricker L.D. и Snyder S.H. [148].
Для определения активности фермента к 150 мкл (в случае опытной пробы) или 140 мкл (в случае контрольной пробы) 50 мМ натрий-ацетатного буфера, содержащего 50 мМ NaCl (рН 5,6), добавляли 50 мкл гомогената ткани. В контрольные пробы, кроме того, добавляли 10 мкл 25 мкМ водного раствора ГЭМЯК. Пробы преинкубировались 8 мин при 37о
С. Реакцию начинали прибавлением 50 мкл предварительно нагретого до 37°С 210 мкМ дансил-фен-ала-арг, приготовленного на воде (конечная концентрация в реакционной смеси составляла 42 мкМ). Далее пробы инкубировали 60 мин при 37о
С. Реакцию останавливали прибавлением 50 мкл 1М раствора соляной кислоты.
Для экстракции продукта реакции – дансил-фен-ала – к пробам приливали 1,5 мл хлороформа и встряхивали в течение 60 сек. Для разделения фаз пробы центрифугировали 10 мин при 1000 об/мин. Измерение флюоресценции хлороформной фазы проводили на флюориметре ФМЦ-2 в кювете толщиной 1 см при lex
=360 нм и lem
=530 нм. В качестве стандарта использовали 1 мкМ раствор дансил-фен-ала в хлороформе.
Активность КП Н определяли как разность в накоплении продукта реакции в пробах, не содержащих и содержащих ГЭМЯК, и выражали в нмоль дансил-фен-ала образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Определение активности КП М проводится по выше изложенной схеме, но в качестве буфера используется 200 мМ трис-HCl, рН 7,4 [148].
Активность ФМСФ-ингибируемой карбоксипептидазы определяли флюориметрическим методом [148]. Контрольные пробы содержали 140 мкл 50 мМ натрий-ацетатного буфера, содержащего 50 мМ NaCl (рН 5,6), 10 мкл 25 мМ раствора ФМСФ, приготовленного на этиловом спирте (конечная концентрация ФМСФ в реакционной смеси составляла 1 мМ) и 50 мкл гомогената. В опытные пробы вносили 150 мкл буфера и 50 мкл гомогената.
Дальнейшее определение активности ФМСФ-ингибируемой карбоксипептидазы проводилось так же, как и для КП Н, с той лишь разницей, что вместо дансил-фен-ала-арг в качестве субстрата использовали 50 мкл 210 мкМ дансил-фен-лей-арг. Активность фермента определяли как разность в накоплении продукта дансил-фен-лей в пробах, несодержащих и содержащих ФМСФ. Активность выражали в нмоль дансил-фен-лей образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Количество белка в пробах определяли по методу Lowry и соавт. [217].
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента [37]. Корреляционный и дисперсионный анализы проводили с помощью программы Statgraphics (версия 3.0) (“STSC, Inc.” США) в режимах Simple Correlation, One-Way ANOVA и Multifactor ANOVA. Принадлежность подгрупп животных к разным гомогенным группам оценивали с помощью Multiple range analysis (Statgraphics (версия 3.0) (“STSC, Inc.” США)). Принадлежность экспериментальных (временных) подгрупп к разным гомогенным группам проводили только в случае достоверности критерия Фишера. При этом оценивали количество гомогенных групп, образуемых экспериментальными подгруппами, с уровнем достоверности р<0,05. Баллы подгруппам присваивали на основании их принадлежности к разным гомогенным группам по мере увеличения среднего. При этом минимальный балл получала временная подгруппа с минимальным средним, максимальный балл – временная подгруппа с максимальным средним, а дробный балл (1,5) получали подгруппы, входящие одновременно в две гомогенные группы. На основании присвоенных баллов судили о динамике изменения активности ферментов.
Данные о распределении активности КП Н, полученные в ходе исследования, представлены в таблице 1.
Таблица 1. Активность КП Н у интактных животных (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ± m, n = 7-8)
| Отделы мозга, органы
|
КП Н M±m
|
| Гипофиз
|
1,36±0,18
|
| Гипоталамус
|
0,29±0,02
|
| Четверохолмие
|
0,30±0,02
|
| Мозжечок
|
0,18±0,01
|
| Стриатум
|
0,21±0,01
|
| Гиппокамп
|
0,26±0,02
|
| Большие полушария
|
0,23±0,01
|
| Надпочечники
|
0,13±0,01
|
| Семенники
|
0,06±0,01
|
Максимальная активность КП Н обнаружена в гипофизе, где синтезируются пептидные гормоны. В остальных отделах мозга активность фермента в 5-6 раз ниже, чем в гипофизе (по убыванию): четверохолмие, гипоталамус, гиппокамп, большие полушария, стриатум и мозжечок. В надпочечниках и семенниках активность фермента в 10-20 раз ниже по сравнению с гипофизом. Такое распределение активности коррелирует с распределением биологически активных пептидов в отделах мозга [201].
3.1.2.1. Влияние однократного введения физиологического раствора на активность карбоксипептидазы Н в тканях крыс
. Введение физиологического раствора вызывало уменьшение активности КП Н в гипофизе через 0,5 часа - на 69%, через 4 часа - на 52% и через 24 часа - на 35% по сравнению с интактной группой (рис. 1). Активность исследуемого фермента снижалась через 0,5 часа в гипоталамусе и мозжечке на 28%, в стриатуме на 29% относительно нормы. Вероятно, это связано с особенностями воздействия внутрибрюшинной инъекции физраствора, при которой в организм поступает дополнительное количество жидкости. Понижение активности КП Н может способствовать ускорению высвобождения жидкости из организма благодаря уменьшению образования вазопрессина [41]. В четверохолмии, гиппокампе, надпочечниках и семенниках изменения активности КП Н при внутрибрюшинном введении физраствора не обнаружено.
 
Рис. 1. Активность КП Н в тканях крыс при введении диазепама (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
 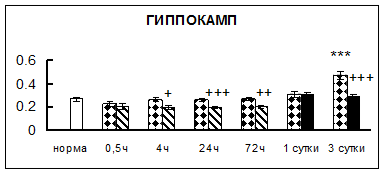 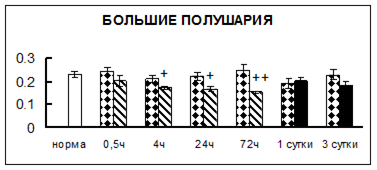 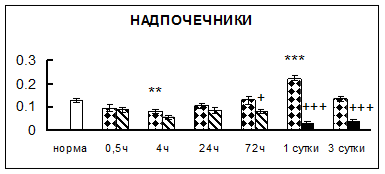   
Рис. 1 (продолжение). Активность КП Н в тканях крыс при введении диазепама.
3.1.2.2. Влияние хронического введения физиологического раствора на активность карбоксипептидазы Н в тканях крыс
. Хроническое введение физиологического раствора вызывало повышение активности карбоксипептидазы Н в большинстве исследуемых отделах и тканях через сутки после воздействия и разнонаправленные изменения в отдельных отделах головного мозга через 3 суток (рис. 1).
В гипоталамусе активность КП Н увеличивалась через сутки после воздействия на 79%, в четверохолмии – на 33%, в мозжечке – на 33%, в стриатуме – на 43%, в надпочечниках – на 69%, в семенниках – в 6 раз относительно интактных животных.
Через трое суток после хронического воздействия наблюдалось понижение активности исследуемого фермента в гипоталамусе на 24% и повышение активности в мозжечке на 55%, в гиппокампе – на 81%, в семенниках – в 3 раза по сравнению с нормой.
Введение физиологического раствора в течение 10 дней можно рассматривать в качестве стресса для животных. В связи с этим повышение активности карбоксипептидазы Н может быть связано с увеличением синтеза регуляторных пептидов при стрессе [51].
Для более полного понимания характера выявленных изменений активности основных карбоксипептидаз первичный экспериментальный материал был подвергнут дисперсионному анализу влияния времени после инъекции физраствора (табл. 2).
Зависимость активности КП Н от времени после инъекции наблюдалась во всех исследуемых отделах мозга и тканях за исключением больших полушарий. В гипофизе активность фермента снижалась через 0,5 часа после однократной инъекции физраствора и оставалась таковой до четырех часов, через 24 часа наблюдалось небольшое повышение активности КП Н, которое сохранялось до 72 часов после введения. Хроническое введение физиологического раствора не влияло на изменение активности через сутки после воздействия и немного повышало активность карбоксипептидазы Н через трое суток.
Табл. 2. Дисперсионный анализ влияния времени после инъекции физиологического раствора на активность КП Н в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4 ч.
|
24 ч.
|
72 ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
4,30**
|
2
|
1
|
1
|
1,5
|
1,5
|
2
|
1,5
|
| Гипоталамус
|
9,70***
|
1,5
|
1
|
1,5
|
1,5
|
2
|
3
|
1,5
|
| Четверохолмие
|
1,77*
|
1,5
|
1
|
1,5
|
1,5
|
1,5
|
2
|
1,5
|
| Мозжечок
|
7,96***
|
1
|
1
|
1
|
1
|
1
|
2
|
2
|
| Стриатум
|
4,14***
|
1
|
1
|
1
|
1
|
1
|
2
|
1,5
|
| Гиппокамп
|
5,24***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Большие полушария
|
0,59
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Надпочечники
|
8,22***
|
1
|
1
|
1
|
1
|
1
|
2
|
1
|
| Семенники
|
30,97***
|
1
|
1
|
1
|
1
|
1
|
3
|
2
|
В гипоталамусе и четверохолмии активность КП Н немного понижалась через 0,5 часа после острого введения физраствора, а через 4 часа повышалась до уровня нормы и оставалась таковой в четверохолмии до 72 часов, а в гипоталамусе до 24 часов. В гипоталамусе наблюдалось повышение активности фермента относительно нормы через 72 часа после однократной инъекции физиологического раствора. Хроническое введение физраствора вызывало значительное повышение активности карбоксипептидазы Н в гипоталамусе через сутки после воздействия и снижение до уровня нормы через трое суток. В четверохолмии введение физраствора в течение 10 дней приводило к небольшому повышению активности КП Н только через сутки после воздействия. Активность фермента в мозжечке, стриатуме, гиппокампе, надпочечниках и семенниках не изменялась в течение 72 часов после острого введения физраствора. Хроническое воздействие вызывало повышение активности карбоксипептидазы Н в мозжечке через 1 и 3 суток, в гиппокампе только через 3 суток после последней инъекции физраствора. В стриатуме активность фермента повышалась через сутки и немного снижалась через трое суток после хронического воздействия. Повышение активности КП Н в надпочечниках происходило через сутки, а через трое суток после хронического введения физиологического раствора наблюдалось снижение активности до уровня интактных животных. В семенниках активность карбоксипептидазы Н повышалась через 1 и 3 суток после хронического воздействия, но через сутки изменения были более выражены.
Таким образом, однократная инъекция физиологического раствора вызывала снижение активности карбоксипептидазы Н только в гипофизе, гипоталамусе и четверохолмии, в то время как хроническое воздействие повышало активность фермента во всех исследованных тканях. Другими словами длительное воздействие вызывало более выраженные изменения активности фермента.
3.1.3.1. Влияние однократного введения диазепама на активность карбоксипептидазы Н в тканях крыс
. Однократное введение диазепама вызывало снижение активности карбоксипептидазы Н в гипофизе через 24 и 72 часа на 59 и 39% по сравнению с соответствующими значениями контроля (рис. 1). В гипоталамусе активность исследуемого фермента через 4, 24 и 72 часа была ниже, чем у контрольных животных, на 33, 27 и 36% соответственно. Снижение активности карбоксипептидазы Н на 38% наблюдалось в надпочечниках через 72 часа после воздействия. Полученные результаты согласуются с представлениями о стресс-протективном действии диазепама [51] путем ингибирования гипоталамо-гипофизарно-надпочечниковой системы и уменьшения секреции и образования АКТГ при его введении [263, 290]. Диазепам понижал активность КП Н в четверохолмии через 4 и 24 часа в 1,3 раза, через 72 часа в 1,5 раза относительно соответствующих значений контроля. Активность карбоксипептидазы Н в больших полушариях через 4 часа составляла 81%, через 24 часа – 72% и через 72 часа – 65% от соответствующих значений контрольной группы. В мозжечке активность фермента изменялась через 4, 24 и 72 часа после введения диазепама: она снижалась по сравнению с контрольными животными на 25, 28 и 39% соответственно. Активность КП Н в гиппокампе была меньше, чем у контроля в 1,4 раза через 4, 24 и 72 часа. На основе полученных данных можно предположить, что уменьшение уровня холецистокининов под действием бензодиазепинов [24] вызвано снижением активности КПН. Кроме того, по данным ряда ученых [126, 285] вещество Р вовлекается в модуляцию стресса и его уровень повышен у пациентов с депрессивными расстройствами. Понижение уровня этого пептида в гиппокампе при введении диазепама [95] можно быть связано с понижением активности КПН. В семенниках активность КП Н снижалась в 2,3 раза относительно контроля через 72 часа после инъекции диазепама. В половых железах самцов синтезируются энкефалины, холецистокинины и другие биологически активные пептиды [195, 260], в обмене которых участвует карбоксипептидаза Н, поэтому снижение активности фермента может влиять на уровень пептидов в семенниках. Однократная инъекция диазепама не влияла на активность КП Н только в стриатуме.
3.1.3.2. Влияние хронического введения диазепама на активность карбоксипептидазы Н в тканях крыс
. Введение диазепама в течение 10 дней вызывало снижение активности КП Н во всех исследуемых тканях за исключением гиппокампа и больших полушарий через сутки после воздействия (рис. 1). Наибольшие изменения активности фермента обнаружены в периферических тканях: в надпочечниках – в 7 раз и семенниках – в 6,5 раз относительно контрольной группы. В гипофизе активность карбоксипептидазы Н уменьшалась в 4 раза, в гипоталамусе – в 2,5 раза, в мозжечке – на 58%, в стриатуме – на 47% и в четверохолмии – на 42% по сравнению с соответствующими значениями контроля. Таким образом, хроническое введение диазепама приводило к таким же изменениям активности КП Н, как и при остром воздействии препарата. Диазепам, вводимый в течение 10 дней, вызывал ингибирование гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной систем, а также отделов, отвечающих за двигательную активность животных. Через трое суток после хронического введения диазепама снижение активности КП Н обнаружено в отделах с высоким содержанием опиоидных пептидов: в гиппокампе в 1,6 раза и в надпочечниках в 3 раза относительно контрольных животных (рис. 1). Таким образом, хроническое введение диазепама вызывало наибольшие изменения активности карбоксипептидазы Н через сутки после воздействия. Статистически значимая временная динамика изменения активности КП Н наблюдалась в гипофизе, гипоталамусе, четверохолмиях, мозжечке, гиппокампе, больших полушариях, надпочечниках и семенниках (табл. 3).
В гипофизе наблюдалось снижение активности карбоксипептидазы Н относительно нормы как после однократного, так и после хронического введения диазепама. Острое воздействие вызывало снижение активности фермента в гипоталамусе через 0,5 часа; через 4 часа наблюдалось небольшое повышение активности КП Н, которое сохранялось на протяжении 72 часов, а также после хронического воздействия.
Табл. 3. Дисперсионный анализ влияния времени после инъекции диазепама на активность КП Н в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4
ч.
|
24
ч.
|
72
ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
6,18***
|
2
|
1
|
1
|
1
|
1
|
1
|
1
|
| Гипоталамус
|
3,16**
|
2
|
1
|
1,5
|
1,5
|
1,5
|
1,5
|
1,5
|
| Четверохолмие
|
4,17**
|
2
|
1
|
1
|
1
|
1
|
1,5
|
1,5
|
| Мозжечок
|
12,29***
|
2
|
1,5
|
1
|
1,5
|
1
|
1,5
|
3
|
| Стриатум
|
1,71
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Гиппокамп
|
5,99***
|
1,5
|
1
|
1
|
1
|
1
|
2
|
2
|
| Большие полушария
|
3,92**
|
2
|
1,5
|
1
|
1
|
1
|
1,5
|
1,5
|
| Надпочечники
|
12,61***
|
3
|
2,5
|
1,5
|
2
|
2
|
1
|
1
|
| Семенники
|
29,63***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
В четверохолмии активность фермента снижалась через 0,5 часа после инъекции диазепама и сохранялась на этом уровне до 72 часов. Хроническое введение диазепама вызывало только небольшое снижение активности КП Н относительно нормы через 1 и 3 суток. Активность карбоксипептидазы Н в мозжечке постепенно снижалась до 4 часов, через 24 часа немного повышалась и опять снижалась через 72 часа после острого воздействия диазепама. Небольшое снижение активности фермента в мозжечке происходило через сутки после хронического введения диазепама, через трое суток активность КП Н значительно повышалась относительно нормы. В гиппокампе наблюдалось небольшое понижение активности карбоксипептидазы Н после однократной инъекции диазепама и повышение активности после хронического введения препарата. Активность КП Н в больших полушариях снижалась в течение 4 часов после однократной инъекции диазепама и до 72 часов сохранялась на этом уровне. Небольшое повышение активности фермента в больших полушариях происходило после хронического введения препарата. В надпочечниках инъекция диазепама вызывала постепенное снижение активности КП Н до 4 часов, затем небольшое повышение через 24 часа, которое сохранялось до 72 часов. Препарат, вводимый в течение 10 дней, вызывал значительное снижение активности фермента в надпочечниках через 1 и 3 суток после воздействия. В семенниках повышение активности карбоксипептидазы Н наблюдалось только через трое суток после хронического введения диазепама.
Таким образом, однократное введение диазепама вызывало понижение активности карбоксипептидазы Н относительно интактных животных, а хроническое воздействие приводило к разнонаправленным изменениям в изучаемых тканях.
3.1.4.1. Влияние однократного введения галоперидола на активность карбоксипептидазы Н в тканях крыс
. Введение галоперидола не повлияло на активность КП Н в четверохолмии, стриатуме, гиппокампе и больших полушариях. В семенниках достоверное снижение активности приблизительно в 2 раза по отношению к контролю наблюдалось через 24 и 72 часа после воздействия (рис. 2). Известно, что инъекция галоперидола вызывает повышение секреции гонадотропина [273, 276], влияющего на уровень половых стероидов, которые в свою очередь снижают активность карбоксипептидазы Н [47]. В гипоталамусе и мозжечке активность фермента через 0,5 часа была выше, чем у контрольной группы на 57 и 46% соответственно. Наблюдалось повышение активности КП Н в гипофизе через 0,5 часа в 2 раза и через 4 часа на 74% в сравнении с контролем. В надпочечниках значение исследуемого параметра было в 1,6 раза выше, чем у контрольных животных, через 4 часа и в 1,4 раза через 72 часа после инъекции галоперидола. Таким образом, галоперидол в дозе 2 мг/кг вызывал достоверные изменения активности КПН в отделах гипоталамо-гипофизарно-надпочечниковой системы. При этом повышение активности в гипоталамусе наблюдалось уже через 0,5 часа, в гипофизе – через 0,5 и 4 часа, в надпочечниках – через 4 и 72 часа после инъекции. При введении галоперидола отмечается повышение уровня ПОМК в промежуточной доле гипофиза [103] и усиление секреции гормонов гипофиза [49, 98, 273, 287]. Сопоставление этих данных с результатами нашей работы позволяет предположить, что КПН участвует в реализации эффекта галоперидола.
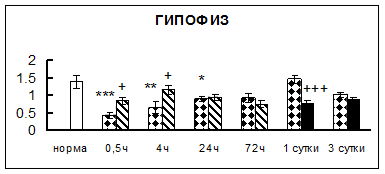  
 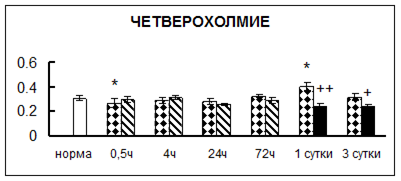 
Рис. 2. Активность КП Н в тканях крыс при введении галоперидола (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
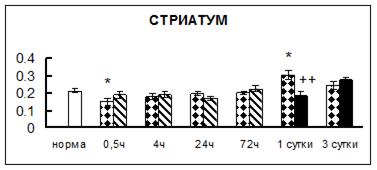   
 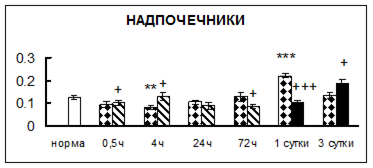   
Рис. 2 (продолжение). Активность КП Н в тканях крыс при введении галоперидола.
Наибольшие изменения активности фермента обнаружены в надпочечниках (в 2,2 раза), в гипоталамусе (в 2 раза), в гипофизе и семенниках (в 1,9 раза) по сравнению с контролем. В стриатуме наблюдалось снижение активности карбоксипептидазы Н через сутки после воздействия на 37%, в мозжечке – на 36%, в четверохолмии – на 40%, в гиппокампе – на 30% относительно контрольной группы. По сравнению с однократным введением галоперидола хроническое воздействие вызывало снижение активности КП Н в большинстве исследуемых отделах мозга. Карбоксипептидаза Н локализована преимущественно в везикулах секреторных клеток, в результате опустошения которых при хроническом воздействии галоперидола высвобождаются как пептиды, так и молекулы фермента. Следовательно, обнаруженное снижение активности КП Н может быть обусловлено уменьшением числа активных молекул фермента в секреторных везикулах.
Через трое суток после хронического воздействия зафиксировано уменьшение активности КП Н в отделах мозга (в четверохолмии – на 25%, в гиппокампе – в 3 раза) и повышение в периферических тканях (в надпочечниках – на 38%, в семенниках – на 33%) (рис. 2). Разнонаправленные изменения активности фермента могут быть связаны с эффектом отмены препарата и восстановлением эндокринных функций мозга.
Таким образом, через сутки после хронического воздействия наблюдалось понижение активности КП Н в большинстве исследуемых тканях, а через трое суток – разнонаправленные изменения в периферических тканях, четверохолмии и гиппокампе.
Дисперсионный анализ влияния времени после инъекции галоперидола выявил статистически значимые отличия в динамике изменений активности карбоксипептидазы Н в гипофизе, мозжечке, гиппокампе, надпочечниках и семенниках (табл. 4).
В гипофизе активность карбоксипептидазы Н через 0,5 часа после однократной инъекции галоперидола немного понижалась и оставалась на этом уровне до 24 часов; к 72 часам наблюдалось дальнейшее снижение активности фермента. После хронического введения препарата активность фермента незначительно снижалась относительно нормы.
Таблица 4. Дисперсионный анализ влияния времени после инъекции галоперидола на активность КП Н в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4
ч.
|
24
ч.
|
72
ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
2,36*
|
2
|
1,5
|
1,5
|
1,5
|
1
|
1,5
|
1,5
|
| Гипоталамус
|
1,34
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Четверохолмие
|
1,22
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Мозжечок
|
6,83***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Стриатум
|
1,77
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Гиппокамп
|
3,03**
|
2
|
2
|
1,5
|
1,5
|
2
|
1,5
|
1
|
| Большие полушария
|
1,80
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Надпочечники
|
3,93***
|
1,5
|
1
|
1,5
|
1
|
1
|
1
|
2
|
| Семенники
|
8,99***
|
1,5
|
1,5
|
1,5
|
1
|
1
|
2
|
3
|
Повышение активности КП Н в мозжечке происходило только через 3 суток после хронического введения галоперидола. В гиппокампе небольшое снижение активности фермента наблюдалось через 4 часа после инъекции препарата, которое сохранялось до 24 часов; к 72 часам активность КП Н повышалась до значений интактных животных. Хроническое введение диазепама вызывало снижение активности карбоксипептидазы Н в гиппокампе, причем через трое суток изменение было более выражено. В надпочечниках активность фермента немного понижалась через 0,5 часа, через 4 часа возвращалась к значениям нормы, через 24 часа опять понижалась и оставалась таковой до 72 часов после однократного введения диазепама. Хроническое воздействие вызывало понижение активности КП Н в надпочечниках через сутки и повышение через 3 суток. В семенниках небольшое понижение активности карбоксипептидазы Н происходило только через 24 часа после однократной инъекции галоперидола и сохранялось до 72 часов. После хронического введения препарата активность фермента в надпочечниках повышалась, причем через трое суток повышение было больше, чем через сутки.
Таким образом, наиболее значимые изменения активности карбоксипептидазы Н относительно интактных животных наблюдались при хроническом введении галоперидола.
Полученные данные о распределении активности ФМСФ-ингибируемой КП представлены в таблице 5.
Таблица 5. Активность ФМСФ-ингибируемой КП у интактных животных (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ± m, n = 7-8)
| Отделы мозга, органы
|
ФМСФ – ингибируемая КП, M±m
|
| Гипофиз
|
0,44±0,05
|
| Гипоталамус
|
0,15±0,01
|
| Четверохолмие
|
0,13±0,01
|
| Мозжечок
|
0,16±0,01
|
| Стриатум
|
0,14±0,01
|
| Гиппокамп
|
0,13±0,01
|
| Большие полушария
|
0,16±0,01
|
| Надпочечники
|
0,77±0,06
|
| Семенники
|
0,11±0,01
|
Максимальная активность ФМСФ-ингибируемой КП зарегистрирована в надпочечниках, в гипофизе активность ниже на 42%. В этих отделах синтезируются нейропептиды и гормоны пептидной природы. Активность в остальных отделах мозга приблизительно одинакова и составляет 20% от активности в надпочечниках. В семенниках активность исследуемого фермента в 4 раз ниже, чем в гипофизе.
3.2.2.1. Влияние однократного введения физраствора на активность ФМСФ-ингибируемой КП в тканях крыс
. Инъекция физиологического раствора вызывала повышение активности ФМСФ-ингибируемой КП во всех изученных тканях и отделах мозга (рис. 3). В гипофизе активность исследуемого фермента увеличивалась через 0,5 часа на 41%, через 24 часа на 48% и через 72 часа на 52% по сравнению с интактной группой. Введение физраствора вызывало повышение активности ФМСФ-ингибируемой КП в четверохолмии через все исследуемые промежутки времени примерно в 1,5 раза относительно нормы. Активность фермента в гипоталамусе возросла через 0,5, 4, 24 и 72 часа на 47, 40, 67 и 93% соответственно по сравнению с нормой. В мозжечке активность ФМСФ-ингибируемой КП повышалась через все исследуемые промежутки времени на 31, 37, 44 и 62% относительно интактных животных. Через 4 и 24 часа после инъекции физраствора наблюдалось повышение активности исследуемого фермента в гиппокампе на 46 и через 72 часа на 69% по отношению к норме. В надпочечниках активность ФМСФ-ингибируемой КП повышалась через 4, 24 и 72 часа на 30, 44 и 60% соответственно. В стриатуме активность фермента через 0,5 и 4 часа была на 36%, через 24 часа на 57%, через 72 часа на 93% больше, чем у интактной группы. Инъекция физиологического раствора вызывала повышение активности ФМСФ-ингибируемой КП в больших полушариях через все промежутки времени на 31, 37, 50 и 94% относительно нормы. В семенниках активность фермента была выше через 0,5, 4 и 72 часа после введения физраствора на 73, 45 и 36% соответственно, чем у интактных животных. Если рассматривать инъекцию физраствора как кратковременный стресс, то повышение активности ФМСФ-ингибируемой КП может быть связано с повышением уровня синтеза энкефалинов и эндорфинов при воздействии стресса [51].
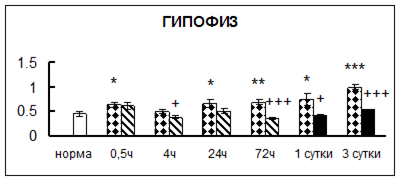 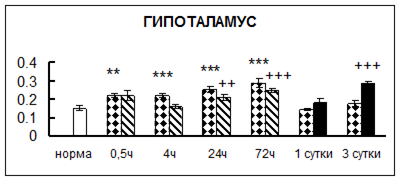  
Рис. 3. Активность ФМСФ-ингибируемой КП в тканях крыс при введении диазепама (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
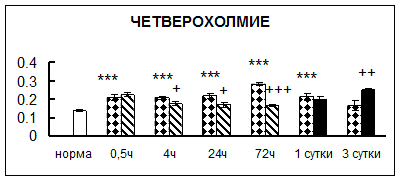   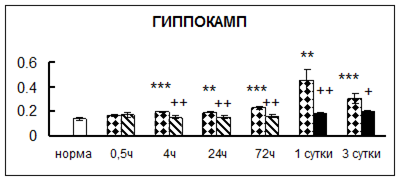 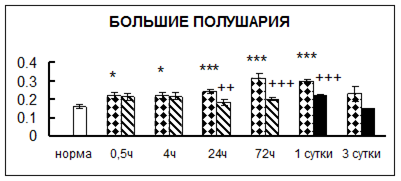  
Рис. 3 (продолжение). Активность ФМСФ-ингибируемой КП в тканях крыс при введении диазепама.
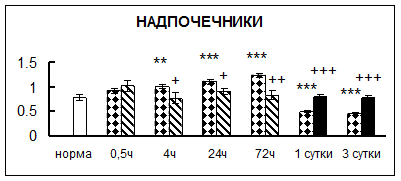   
Рис. 3 (продолжение). Активность ФМСФ-ингибируемой КП в тканях крыс при введении диазепама.
3.2.2.2. Влияние хронического введения физиологического раствора на активность ФМСФ-ингибируемой КП в тканях крыс. Хроническое введение физраствора приводило к повышению активности ФМСФ-КП через сутки после воздействия в гипофизе на 66%, в четверохолмии – на 61%, в мозжечке – в 2,7 раза, в гиппокампе – в 3,5 раза, в больших полушариях – на 87%, в семенниках – в 2 раза (рис. 3). В стриатуме и надпочечниках через сутки после воздействия наблюдалось понижение активности фермента в 2 и 1,6 раза соответственно относительно интактных животных. В гипоталамусе статистически значимых отличий не обнаружено.
Через трое суток после хронического введения физиологического раствора наблюдалось повышение активности ФМСФ-ингибируемой КП в гипофизе в 2,2 раза, в мозжечке – в 3 раза, в стриатуме – в 4,5 раза, в гиппокампе – в 2,3 раза, в семенниках – в 4 раза относительно интактных животных. В надпочечниках активность фермента понижалась на 40% по сравнению с нормой. В гипоталамусе, четверохолмии и больших полушариях через трое суток после воздействия активность ФМСФ-КП не отличалась от таковой у интактной группы.
Таким образом, хроническое введение физиологического раствора вызывало изменения активности ФМСФ-ингибируемой КП практически во всех исследуемых отделах мозга и тканях, что согласуется с данными об участии ФМСФ-КП в ответе организма на стресс [5]. Статистически значимая временная динамика изменения активности ФМСФ-ингибируемой КП наблюдалась во всех исследуемых тканях и отделах мозга (табл. 6).
В гипофизе наблюдалось небольшое повышение активности ФМСФ-ингибируемой КП через 0,5 часа, понижение через 4 часа и повышение до прежнего уровня через 24 часа, которое сохранялось до 72 часов после острого введения физиологического раствора. Хроническое воздействие вызывало постепенное повышение активности фермента в гипофизе в течение трех суток. Активность ФМСФ-КП в гипоталамусе, четверохолмии, больших полушариях, мозжечке, стриатуме и надпочечниках постепенно повышалась до 72 часов после однократной инъекции физраствора. Через сутки после хронического введения в гипоталамусе наблюдалось небольшое снижение, а через трое суток повышение активности относительно нормы. В четверохолмии хроническое воздействие физиологического раствора вызывало повышение активности ФМСФ-КП, причем наиболее выраженное через сутки. Активность фермента в мозжечке значительно повышалась относительно нормы после хронического введения физраствора. В стриатуме введение физраствора в течение 10 дней приводило к небольшому снижению активности ФМСФ-ингибируемой КП через сутки и повышению через трое суток. Однократная инъекция физиологического раствора вызывала небольшое повышение активности ФМСФ-КП в гиппокампе через 4 часа, которое сохранялось до 72 часов. Хроническое воздействие приводило к повышению активности фермента в гиппокампе и больших полушариях через 1 и 3 суток.
Таблица 6. Дисперсионный анализ влияния времени после инъекции физиологического раствора на активность ФМСФ-ингибируемой КП в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5
ч.
|
4
ч.
|
24
ч.
|
72
ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
4,11**
|
1
|
1,5
|
1
|
1,5
|
1,5
|
1,5
|
2
|
| Гипоталамус
|
6,55***
|
1,5
|
2,5
|
2,5-3,5
|
1; 3,5
|
4
|
1
|
1,5-2,5
|
| Четверохолмие
|
8,48***
|
1
|
2
|
2
|
2,5
|
3
|
1,5-2,5
|
1,5
|
| Мозжечок
|
16,60***
|
1
|
1,5
|
1,5
|
1,5
|
2
|
3
|
3
|
| Стриатум
|
21,75***
|
1,5
|
1,5-2,5
|
1,5-2,5
|
2,5
|
3
|
1
|
4
|
| Гиппокамп
|
7,40***
|
1
|
1
|
1,5
|
1,5
|
1,5
|
3
|
2,5
|
| Большие полушария
|
5,72***
|
1
|
1,5
|
1,5
|
1,5-2,5
|
3
|
2,5
|
1,5-2,5
|
| Надпочечники
|
12,74***
|
1,5
|
2,5
|
2,5-3,5
|
3,5
|
4
|
1
|
1
|
| Семенники
|
4,66**
|
1
|
1
|
1
|
1
|
1
|
1,5
|
2
|
В надпочечниках хроническое введение физраствора приводило к небольшому снижению активности ФМСФ-ингибируемой КП относительно нормы. Постепенное повышение активности фермента в течение трех суток происходило в семенниках после хронического воздействия физраствора.
Таким образом, однократная инъекция физиологического раствора приводила к повышению активности ФМСФ-ингибируемой КП, которое сохранялось в течение 72 часов. Значительное повышение активности фермента наблюдалось и при хроническом введении физраствора.
3.2.3. Активность ФМСФ-ингибируемой КП в тканях крыс при введении диазепама
3.2.3.1. Влияние однократного введения диазепама на активность ФМСФ-ингибируемой КП в тканях крыс
. Введение диазепама вызывало достоверные изменения активности ФМСФ-ингибируемой КП во всех изученных тканях (рис. 3). В гипофизе через 4 и 72 часа активность фермента была ниже на 24 и 49% соответственно, чем у контроля. Через 24 и 72 часа в гипоталамусе наблюдалось снижение активности ФМСФ-ингибируемой КП на 32 и 55% относительно соответствующих значений контрольных животных. Через 24 и 72 часа наблюдалось понижение активности по сравнению с контролем в мозжечке на 13 и 31% соответственно. В стриатуме активность ФМСФ-ингибируемой КП через 24 часа была ниже на 23% и через 72 часа – на 37%. Известно, что введение диазепама вызывает понижение уровня мет-энкефалина в стриатуме [237]. В наших исследованиях изменения активности КПН в стриатуме не были обнаружены, но произошло понижение активности ФМСФ-КП. Отсюда можно предположить, что ФМСФ-ингибируемая КП участвует в обмене энкефалинов в стриатуме, предшественники которых являются более предпочтительными субстратами для ФМСФ-ингибируемой КП [9, 26].
В больших полушариях через 24 и 72 часа наблюдалось понижение активности ФМСФ-ингибируемой КП на 25 и 35%. Соответственно на 15, 19 и 43% была ниже активность фермента в четверохолмии через 4, 24 и 72 часа после инъекции диазепама. В надпочечниках зафиксировано снижение активности ФМСФ-ингибируемой КП через 4, 24 и 72 часа на 25, 19 и 33% относительно соответствующих значений контроля. В гиппокампе снижение исследуемого параметра по сравнению с контрольными животными наблюдалось через 4 и 24 часа на 21% и через 72 часа на 27%.
Понижение активности фермента в семенниках через 0,5 часа после воздействия на 63% и через 72 часа на 33% может быть связано с увеличением уровня тестостерона под действием диазепама [48, 123].
Таким образом, понижение активности данного фермента может быть одним из механизмов снижения уровня ряда регуляторных пептидов при введении диазепама.
3.2.3.2. Влияние хронического введения диазепама на активность ФМСФ-ингибируемой КП в тканях крыс
. Через сутки после хроническое введение диазепама наблюдалось снижение активности ФМСФ-ингибируемой КП в гипофизе на 45%, в мозжечке на 58%, в гиппокампе в 2,5 раза, в больших полушариях на 30% по сравнению с контрольной группой (рис. 3). В стриатуме активность фермента через сутки после воздействия повышалась в 2,4 раза, в надпочечниках – на 67%, в семенниках – в 2,7 раза по отношению к контролю. В гипоталамусе и четверохолмии статистически значимых изменений не обнаружено.
Хроническое введение диазепама приводило к снижению активности ФМСФ-КП через трое суток после воздействия в гипофизе на 53%, в мозжечке на 45%, в стриатуме в 3 раза, в гиппокампе в 1,5 раза относительно контрольных животных (рис. 3). Повышение активности фермента зафиксировано в гипоталамусе на 70%, четверохолмии на 56% и надпочечниках на 65% по сравнению с контролем.
Таким образом, введение диазепама в течение 10 дней вызывало разнонаправленные изменения активности ФМСФ-ингибируемой КП во всех исследуемых отделах мозга и тканях относительно контрольных животных. Полученные данные позволяют предположить, что фермент участвует в обмене регуляторных пептидов при хроническом введении диазепама.
Дисперсионный анализ влияния времени после инъекции диазепама на активность ФМСФ-ингибируемой КП показал, что статистически значимая динамика изменения активности фермента наблюдалась в гипофизе, гипоталамусе, четверохолмии, мозжечке, гиппокампе и семенниках (табл. 7).
Таблица 7. Дисперсионный анализ влияния времени после инъекции диазепама на активность ФМСФ-ингибируемой КП в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4
ч.
|
24
ч.
|
72
ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
4,12**
|
1,5-2,5
|
3
|
1,5
|
1,5
|
1
|
1,5
|
2,5
|
| Гипоталамус
|
8,44***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Четверохолмие
|
11,49***
|
1
|
3,5
|
1,5
|
1,5
|
1,5
|
2,5
|
4
|
| Мозжечок
|
5,07***
|
1
|
2,5
|
1,5
|
1,5
|
1,5
|
1,5
|
3
|
| Стриатум
|
1,57
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Гиппокамп
|
2,27*
|
1
|
1,5
|
1,5
|
1,5
|
1,5
|
1,5
|
2
|
| Большие полушария
|
2,57
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Надпочечники
|
0,89
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Семенники
|
6,09***
|
1
|
1
|
1
|
1
|
1
|
2
|
2
|
В гипофизе наблюдалось повышение активности ФМСФ-ингибируемой КП через 0,5часа, и постепенное снижение до 72 часов после однократной инъекции диазепама. Хроническое введение препарата вызывало повышение активности фермента в гипоталамусе только через 3 суток. В четверохолмии активность ФМСФ-КП повышалась через 0,5 часа, через 4 часа понижалась и сохранялась на этом уровне до 72 часов после однократной инъекции диазепама. Хроническое введение препарата приводило к повышению активности фермента в четверохолмии, при этом наиболее выраженные изменения обнаружены через 3 суток. В мозжечке активность ФМСФ-КП повышалась через 0,5 часа, немного понижалась к 4 часам и оставалась таковой до 72 часов после однократной инъекции диазепама. Хроническое введение диазепама вызывало повышение активности фермента в течение трех суток. В гиппокампе наблюдалось небольшое повышение активности ФМСФ-ингибируемой КП через все промежутки времени после однократного введения диазепама и через сутки после хронического. Через 3 суток активность фермента в гиппокампе была выше, чем через сутки после хронического введения препарата. В семенниках активность ФМСФ-КП повышалась через 1 и 3 суток после хронического воздействия.
Таким образом, как однократное, так и хроническое введение диазепама вызывало повышение активности ФМСФ-ингибируемой КП относительно нормы.
3.2.4. Активность ФМСФ-ингибируемой КП в тканях крыс при введении галоперидола
3.2.4.1. Влияние однократного введения галоперидола на активность ФМСФ-ингибируемой КП в тканях крыс
. Введение галоперидола не влияло на активность ФМСФ-ингибируемой КП только в семенниках (рис. 4). В гипофизе, гипоталамусе и мозжечке активность понижалась через 4 часа после инъекции на 26, 24 и 14% соответственно относительно контроля. Повышение активности ФМСФ-ингибируемой КП через 0,5 часа на 29% и понижение через 4 и 72 часа на 20 и 29% соответственно наблюдалось в четверохолмии. В гиппокампе активность фермента повышалась через 0,5 часа и понижалась через 4 часа на 37% по сравнению с контрольной группой. Известно, что при введении галоперидола в гиппокампе и больших полушариях повышается уровень холецистокинина и вещества Р [324]. Не исключено, что ФМСФ-КП участвует в обмене этих пептидов при введении галоперидола. В стриатуме активность ФМСФ-ингибируемой КП через 0,5 часа была в 1,5 раза выше, чем у контроля, а через 4 и 24 часа ниже на 26 и 18 % соответственно. Известно, что однократная инъекция галоперидола приводит к увеличению уровня мет-энкефалина и нейротензина в стриатуме [211, 232, 261]. Кроме того, уровень нейротензина у больных шизофренией уменьшен, но восстанавливается после лечения галоперидолом [59, 92, 292]. Поскольку изменение активности КПН в этом отделе мозга не обнаружены, то можно предположить, что в процессинг регуляторных пептидов, синтезируемых в стриатуме при введении галоперидола, вовлечена ФМСФ-КП.
Активность ФМСФ-ингибируемой КП через 0,5 часа повышалась в больших полушариях на 43%, в надпочечниках на 63%, а через 24 часа понизилась на 21% относительно контрольных животных в обоих случаях. В надпочечниках синтезируется большое количество мет-энкефалина, предшественники которого являются более предпочтительными субстратами для ФМСФ-КП [26], поэтому можно предположить, что этот фермент вовлечен в обмен энкефалинов в надпочечниках при введении галоперидола.
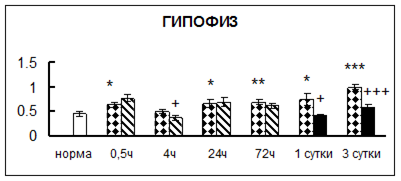 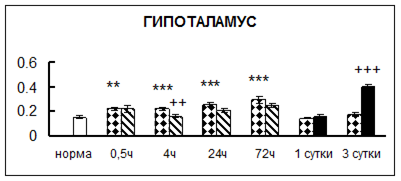 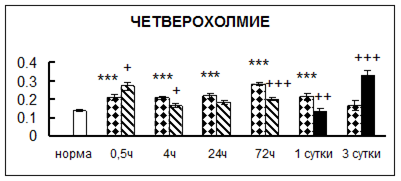   
Рис. 4. Активность ФМСФ-ингибируемой КП в тканях крыс при введении галоперидола (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
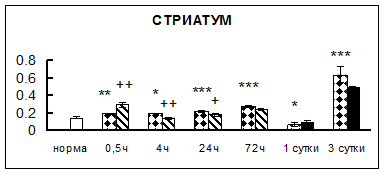   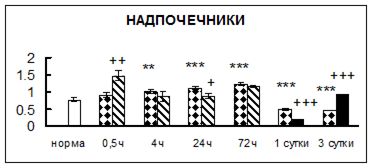 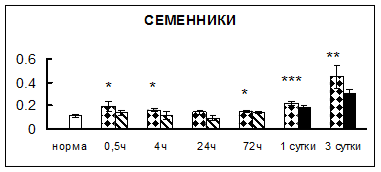  
Рис. 4 (продолжение). Активность ФМСФ-ингибируемой КП в тканях крыс при введении галоперидола.
3.2.4.2. Влияние хронического введения галоперидола на активность ФМСФ-ингибируемой КП в тканях крыс
. Хроническое введение галоперидола вызывало снижение активности ФМСФ-ингибируемой КП через сутки после воздействия в гипофизе на 44%, в четверохолмии на 38%, в мозжечке на 39%, в гиппокампе в 5 раз, в больших полушариях в 3,7 раза, в надпочечниках в 2,5 раза относительно контроля (рис. 4).
Через трое суток после введения галоперидола активность фермента снижалась в гипофизе на 42 % и стриатуме на 22% по сравнению с контрольной группой (рис. 4). Повышение активности ФМСФ-КП наблюдалось в гипоталамусе в 2,3 раза, в четверохолмии в 2 раза, в гиппокампе на 47%, в надпочечниках в 2 раза относительно контроля через трое суток после воздействия.
Таким образом, хроническое введение галоперидола приводило к снижению активности ФМСФ-ингибируемой КП через сутки после воздействия и разнонаправленным изменениям через трое суток. Можно предположить, что снижение активности фермента через сутки после воздействия связано с уменьшением числа активных молекул.
Через трое суток, то есть в период отмены препарата, происходит восстановление ферментативной системы и наблюдается повышение активности ФМСФ-КП.
Согласно дисперсионному анализу (табл. 8) достоверные изменения динамики активности ФМСФ-ингибируемой КП после введения галоперидола наблюдались во всех изученных отделах мозга и тканях.
В гипофизе активность ФМСФ-ингибируемой КП повышалась через 0,5ч, затем возвращалась к значениям интактных животных, незначительно увеличивалась к 24ч и оставалась на этом уровне до 72 часов. Галоперидол, вводимый в течение 10 дней, вызывал небольшое повышение активности фермента в гипофизе только через трое суток после воздействия.
Табл. 8. Дисперсионный анализ влияния времени после инъекции галоперидола на активность ФМСФ-ингибируемой КП в тканях самцов крыс (значения критерия Фишера FФ
, баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4 ч.
|
24 ч.
|
72 ч.
|
1 сут.
|
3 сут.
|
| Гипофиз
|
3,69***
|
1
|
2
|
1
|
1,5
|
1,5
|
1
|
1,5
|
| Гипоталамус
|
11,49***
|
1
|
1,5
|
1,5
|
1,5
|
2
|
1,5
|
3
|
| Четверохолмие
|
16,15***
|
1,5
|
4
|
1,5-2,5
|
1,5-2,5
|
3
|
1
|
4
|
| Мозжечок
|
11,44***
|
1
|
2
|
1,5
|
2
|
2
|
2
|
3
|
| Стриатум
|
29,95***
|
1,5
|
4
|
1,5
|
2,5
|
3,5
|
1
|
5
|
| Гиппокамп
|
14,41***
|
1,5
|
2
|
1,5
|
1,5
|
2
|
1
|
3
|
| Большие полушария
|
6,38***
|
1
|
3
|
1,5
|
1,5
|
2,5
|
1
|
1,5-2,5
|
| Надпочечники
|
9,47***
|
2
|
3
|
2
|
2
|
2,5
|
1
|
2,5
|
| Семенники
|
4,46***
|
1
|
1
|
1
|
1
|
1
|
1,5
|
2
|
В гипоталамусе через 0,5 часа после инъекции галоперидола активность ФМСФ-КП немного повышалась и сохранялась до 24 часов, к 72 часам наблюдалось дальнейшее повышение активности. При хроническом введении препарата активность фермента повышалась, при этом повышение активности через трое суток было более выраженным. Однократное введение галоперидола приводило к повышению активности ФМСФ-ингибируемой КП в четверохолмии через 0,5 часа, понижению через 4 часа и постепенному повышению до 72 часов. При остром введении галоперидола активность ФМСФ-КП в стриатуме значительно увеличивалась через 0,5 часа, через 4 часа снижалась до значений нормы и до 72 часов постепенно повышалась. В гиппокампе и надпочечниках через 0,5 часа после однократной инъекции галоперидола активность ФМСФ-КП повышалась, затем понижалась до значений нормы и оставалась таковой до 24 часов; к 72 часам наблюдалось повышение активности фермента. Хроническое воздействие приводило к небольшому снижению активности фермента в гиппокампе, стриатуме, четверохолмии и надпочечниках через сутки и повышению через трое суток относительно нормы. В мозжечке активность ФМСФ-ингибируемой КП увеличивалась через 0,5 часа после инъекции галоперидола, несколько снижалась к 4 часам, а к 24 часам возвращалась к уровню, зафиксированному через 0,5 часа, и оставалась таковой до 72 часов, а также через сутки после хронического введения. Через трое суток после хронического воздействия препарата повышение активности было больше, чем через сутки. В больших полушариях активность ФМСФ-ингибируемой КП повышалась через 0,5 часа после инъекции галоперидола, снижалась к 4 часам и повышалась через 72 часа. Хроническое воздействие приводило к повышению активности фермента только через трое суток после воздействия. Активность ФМСФ-ингибируемой КП в семенниках повышалась только после хронического введения галоперидола, при этом через трое суток изменения были более выражены. Таким образом, однократное введение галоперидола приводило к повышению активности ФМСФ-ингибируемой КП во всех отделах мозга, гипофизе и надпочечниках по сравнению с интактными животными. Хроническое воздействие приводило к повышению активности фермента в гипофизе, гипоталамусе, мозжечке, больших полушариях и семенниках и разнонаправленным изменениям в четверохолмии, стриатуме, гиппокампе и надпочечниках относительно нормы.
Данные о распределении активности КП М в тканях самцов крыс представлены в таблице 9.
Таблица 9. Активность КП М у интактных животных (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ± m, n = 7-8)
| Отделы мозга, органы
|
КП М M±m
|
| Гипоталамус
|
0,08±0,005
|
| Четверохолмие
|
0,11±0,007
|
| Мозжечок
|
0,08±0,007
|
| Стриатум
|
0,06±0,006
|
| Гиппокамп
|
0,05±0,005
|
| Большие полушария
|
0,096±0,009
|
КП М проявляла максимальную активность в четверохолмии и больших полушариях. Активность в гипоталамусе и мозжечке составляла 73% от активности в четверохолмии. В этих отделах мозга синтезируется большое количество регуляторных пептидов, в обмене которых возможно принимает участие КП М. В стриатуме и гиппокампе активность в 1,2 и 2 раза соответственно ниже, чем в гипоталамусе.
3.3.2. Активность карбоксипептидазы М в тканях крыс при введении физиологического раствора
3.3.2.1. Влияние однократного введения физраствора на активность карбоксипептидазы М в тканях крыс
. В гиппокампе активность карбоксипептидазы М повышалась через 0,5 и 72 часа после однократной инъекции физиологического раствора на 45 и 63% по сравнению с интактными животными (рис. 5). Активность фермента в гипоталамусе и мозжечке через 72 часа была выше на 48 и 23% соответственно относительно нормы. Поскольку в ответ на стрессовое воздействие в организме животных вырабатывается большое количество регуляторных пептидов [51], то не исключено, что повышение активности карбоксипептидазы М связано с ее участием в инактивации нейропептидов, синтезированных в ответ на данное воздействие. Инъекция физиологического раствора вызывала снижение активности КП М в стриатуме через 24 часа на 54%. Известно, что α-неоэндорфин, динорфин 1-13, широко представленные в стриатуме, в качестве С-концевой аминокислоты содержат лизин [28], следовательно, они могут выступать в качестве субстратов для КПМ [268]. Выявленное уменьшение активности КПМ, возможно приводит к замедлению деградации этих пептидов, обладающих способностью проявлять седативное действие [28].
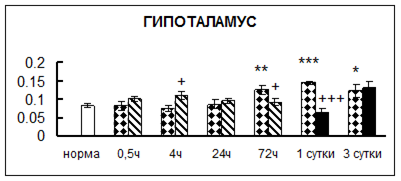 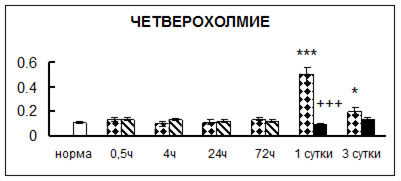  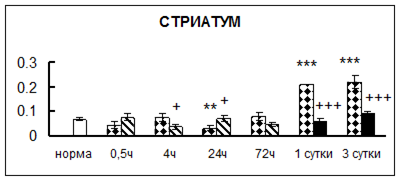  
Рис. 5. Активность карбоксипептидазы М в тканях крыс при введении диазепама (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
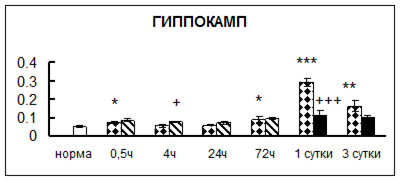 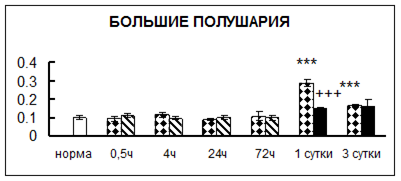  
Рис. 5 (продолжение). Активность карбоксипептидазы М в тканях крыс при введении диазепама.
Через сутки после введения наибольшие изменения обнаружены в гиппокампе – в 5,9 раза, в четверохолмии – в 4,7 раза, в стриатуме и больших полушариях – в 3 раза по сравнению с интактными животными. В гипоталамусе и мозжечке наблюдалось повышение активности фермента на 79% и 56% соответственно относительно нормы.
Через трое суток после хронического введения физраствора обнаружено повышение активности КП М в гипоталамусе – на 51%, в четверохолмии – на 12%, в мозжечке – в 2,8 раза, в стриатуме – в 3,4 раза, в гиппокампе – в 3,2 раза, в больших полушариях – на 71% по сравнению с интактной группой.
Таким образом, хроническое введение физиологического раствора вызывало повышение активности карбоксипептидазы М в отделах мозга, что может быть связано с необходимостью деградации биологически активных пептидов, секретируемых в ответ на длительный стресс.
Согласно дисперсионному анализу (табл. 10) достоверные изменения динамики активности КП М после введения физраствора обнаружены во всех исследованных тканях.
Таблица 10. Дисперсионный анализ влияния времени после инъекции физиологического раствора на активность КП М в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4 ч.
|
24 ч.
|
72 ч.
|
1 сут.
|
3 сут.
|
| Гипоталамус
|
3,46***
|
1,5
|
1,5
|
1
|
1,5
|
1,5
|
2
|
1,5
|
| Четверохолмие
|
19,99***
|
1
|
1
|
1
|
1
|
1
|
2
|
1
|
| Мозжечок
|
10,35***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Стриатум
|
10,11***
|
1
|
1
|
1
|
1
|
1
|
2
|
2
|
| Гиппокамп
|
19,30***
|
1
|
1
|
1
|
1
|
1,5
|
3
|
2
|
| Большие полушария
|
11,32***
|
1,5
|
1
|
1,5
|
1
|
1,5
|
3
|
2
|
В гипоталамусе к 4 часам после инъекции физиологического раствора наблюдалось небольшое понижение активности карбоксипептидазы М; через 24 часа активность фермента повышалась до уровня нормы. После хронического введения физраствора активность КП М повышалась через сутки после воздействия в четверохолмии и гипоталамусе, через трое суток в мозжечке и через 1 и 3 суток в стриатуме. В гиппокампе повышение активности фермента наблюдалось через 72 часа после инъекции физиологического раствора. Активность КП М в больших полушариях понижалась через 0,5 часа, через 4 часа повышалась до уровня нормы, снижалась через 24 часа и к 72 часам опять повышалась. Хроническое введение физраствора приводило к повышению активности фермента в гиппокампе и больших полушариях, при этом через сутки изменения были более выражены.
Таким образом, однократная инъекция физиологического раствора вызывала изменения активности карбоксипептидазы М в гипоталамусе, гиппокампе и больших полушариях. При хроническом воздействии активность фермента повышалась во всех изученных отделах мозга.
3.3.3.1. Влияние однократного введения диазепама на активность карбоксипептидазы М в тканях крыс
. На активность КП М в четверохолмии и больших полушариях введение диазепама не повлияло (рис. 5). Активность карбоксипептидазы М в мозжечке через 72 часа составляла 80% от контроля. В гипоталамусе через 4 часа после воздействия активность исследуемого фермента увеличивалась на 49%, а через 72 часа уменьшалась на 25% по сравнению с контрольными животными. Обнаруженное снижение активности фермента через 72 часа в мозжечке и гипоталамусе может быть обусловлено уменьшением числа активных молекул фермента. Снижение активности КП М в стриатуме наблюдалось через 4 часа на 53% и увеличение через 24 часа в 2,3 раза по отношению к контролю. В гиппокампе активность была достоверно выше, чем у контрольной группы, на 42 % через 4 часа после однократной инъекции диазепама. Таким образом, изменение активности КПМ обнаружено в тех отделах мозга, где эндогенный лиганд бензодиазепиновых рецепторов – ингибитор связывания диазепама (DBI) и бензодиазепиновые рецепторы присутствуют в высоких концентрациях [2, 113]. Известно, что на С-конце DBI и его производных присутствует лизин [112]. Учитывая специфичность действия КПМ, можно предположить, что фермент, локализованный на внешней стороне плазматической мембраны [118], участвует в инактивации эндозепинов путем отщепления лизина. DBI является анксиогенным пептидом, который повышает агрессивность животных [8, 118]. Обнаруженное увеличение активности КПМ может привести к снижению уровня этого пептида путем его инактивации. Следовательно, седативное действие диазепама может проявляться через увеличение уровня седативных пептидов и понижение уровня проконфликтных за счет действия КПМ.
3.3.3.2. Влияние хронического введения диазепама на активность карбоксипептидазы
M в тканях крыс. Хроническое введение диазепама вызывало снижение активности КП М во всех исследуемых отделах мозга через сутки после воздействия (рис. 5). Наибольшие изменения активности фермента зафиксированы в четверохолмии (в 5,9 раза) и стриатуме (в 3,6 раза). В гипоталамусе активность карбоксипептидазы М через сутки после хронического введения диазепама снижалась на 57%, в мозжечке – на 36%, в гиппокампе – на 62%, в больших полушариях – на 48% относительно контроля.
Через трое суток после введения диазепама активность фермента снижалась только в мозжечке и стриатуме в 2,2 и 2,4 раза соответственно по сравнению с контрольными животными.
В ответ на хроническое введение диазепама из клетки секретируются как пептиды так и ферменты их обмена. Возможно, что снижение активности карбоксипептидазы М через сутки после хронического воздействия может быть связано с уменьшением количества активных молекул фермента в связи с преобладанием процессов их деградации над синтезом. Через трое суток снижение активности КП М наблюдалось только в отделах с высоким содержанием регуляторных пептидов. Можно предположить, что для восстановления пептидергической системы мозжечка и стриатума необходим более длительный промежуток времени.
Достоверные отличия влияния времени на активность КП М при введении диазепама обнаружены в гипоталамусе и гиппокампе (табл. 11). В этих отделах наблюдалось небольшое повышение активности карбоксипептидазы М в течение 72 часов после однократной инъекции диазепама. При хроническом введении препарата активность фермента повышалась в гипоталамусе через трое суток, в гиппокампе через 1 и 3 сутки после воздействия по сравнению с интактной группой.
Таблица 11. Дисперсионный анализ влияния времени после инъекции диазепама на активность КП М в тканях самцов крыс (значения критерия Фишера FФ
и баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4 ч.
|
24 ч.
|
72 ч.
|
1 сут.
|
3 сут.
|
| Гипоталамус
|
3,03**
|
1
|
1,5
|
1,5
|
1,5
|
1,5
|
1
|
2
|
| Четверохолмие
|
1,56
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Мозжечок
|
0,74
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Стриатум
|
1,75
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| Гиппокамп
|
2,71*
|
1
|
1,5
|
1,5
|
1,5
|
1,5
|
2
|
1,5
|
| Большие полушария
|
2,99
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
3.3.4. Активность карбоксипептидазы М в тканях крыс при введении галоперидола
3.3.4.1. Влияние однократного введения галоперидола на активность карбоксипептидазы М в тканях крыс. Введение галоперидола увеличивало активность КП М в гипоталамусе через 4 часа после воздействия на 97%, через 24 часа на 51% относительно контрольной группы (рис. 6). В четверохолмии и гиппокампе активность через 4 часа была выше, чем у контроля, на 97 и 86% соответственно. Увеличение активности фермента в 2,3 раза по сравнению с контрольными животными наблюдалось в стриатуме через 24 часа после инъекции. В больших полушариях активность КП М была выше, чем у контроля, через 0,5 часа на 58% и через 24 часа на 44%. Повышение активности фермента в мозжечке наблюдалось через 4 и 72 часа после введения галоперидола на 30 и 20% соответственно. Эти данные согласуются со сведениями о том, что под влиянием галоперидола увеличивается уровень многих нейропептидов [69, 117, 129, 314]. Вероятно, увеличение активности КП М связано с инактивацией большого количества пептидов, секретируемых из клетки в ответ на данное воздействие.
 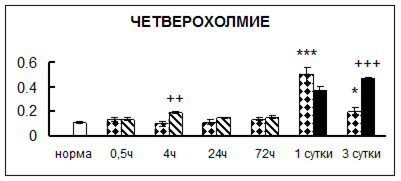 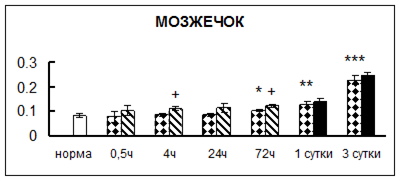   
Рис. 6. Активность карбоксипептидазы М в тканях крыс при введении галоперидола (по оси Y – активность фермента в нмоль субстрата образовавшегося за 1 мин инкубации в пересчете на 1 мг белка) (M ± m; n = 5÷6; * – р < 0,05, ** – р < 0,01, *** – р < 0,001 относительно нормы; + – р < 0,05, ++ – р < 0,01, +++ – р < 0,001 относительно контроля).
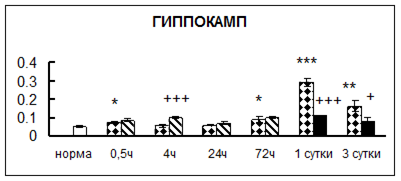 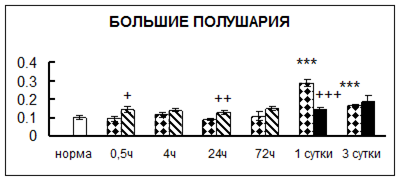  
Рис. 6 (продолжение). Активность карбоксипептидазы М в тканях крыс при введении галоперидола.
3.3.4.2. Влияние хронического введения галоперидола на активность карбоксипептидазы М в тканях крыс
. Через сутки после хронического введения галоперидола активность карбоксипептидазы М снижалась в гиппокампе – в 2,8 раза, в больших полушариях – в 2 раза, в стриатуме – в 1,8 раза относительно контроля (рис. 6).
Хроническое введение галоперидола вызывало повышение активности фермента через трое суток после воздействия в четверохолмии – в 3,8 раза, в гипоталамусе – в 2,3 раза, в стриатуме – в 1,9 раза по сравнению с контролем (рис. 6). В гиппокампе активность КП М снижалась в 2,2 раза относительно контрольной группы.
Длительное воздействие могло привести к уменьшению числа активных молекул фермента, чем и объясняется снижение активности КП М в отделах с высокой концентрацией дофаминовых рецепторов. Восстановление и даже повышение активности фермента через трое суток после воздействия может быть связано с восстановлением ферментативной системы после отмены препарата.
Дисперсионный анализ влияния времени после инъекции галоперидола на активность КП М показал, что статистически значимая динамика изменения активности фермента наблюдается во всех исследованных отделах мозга (табл. 12).
Таблица 12. Дисперсионный анализ влияния времени после инъекции галоперидола на активность КП М в тканях самцов крыс (значения критерия Фишера FФ
, баллы экспериментальных (временных) подгрупп).
| Ткань
|
FФ
|
Временные подгруппы
|
| норма
|
0,5 ч.
|
4 ч.
|
24 ч.
|
72 ч.
|
1 сут.
|
3 сут.
|
| Гипоталамус
|
12,33***
|
1
|
1,5
|
2
|
1,5
|
1,5
|
2
|
3
|
| Четверохолмие
|
42,21***
|
1
|
1,5
|
2
|
1,5
|
1,5
|
3
|
4
|
| Мозжечок
|
7,26***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Стриатум
|
31,11***
|
1
|
1
|
1
|
1
|
1
|
1
|
2
|
| Гиппокамп
|
2,41**
|
1
|
1,5
|
1,5
|
1,5
|
2
|
1,5
|
1,5
|
| Большие полушария
|
2,40**
|
1
|
1,5
|
1,5
|
1,5
|
1,5
|
1,5
|
2
|
В гипоталамусе и четверохолмии через 0,5 часа после однократной инъекции галоперидола активность КП М немного повышалась, через 4 часа она была достоверно выше, чем у интактных животных, а через 24 часа возвращалась к уровню, зафиксированному через 0,5 часа, и сохранялась на этом уровне до 72 часов. Галоперидол, вводимый в течение 10 дней, вызывал повышение активности фермента в гипоталамусе и четверохолмии, через сутки изменения были более выраженными. В мозжечке и стриатуме изменение активности наблюдалось только через 3 суток после хронического введения препарата. Однократная инъекция галоперидола немного повышала активность КП М в гиппокампе в течение 24 часов. Такое же повышение активности наблюдалось в гиппокампе и при хроническом воздействии. Через 72 часа активность КП М в этом отделе мозга была достоверно выше, чем у интактной группы. В больших полушариях небольшое повышение активности фермента наблюдалось в течение 72 часов после однократной инъекции галоперидола и через сутки после хронического воздействия. Через трое суток активность карбоксипептидазы М в больших полушариях была достоверно выше относительно нормы.
Таким образом, введение галоперидола, особенно в течение 10 дней, вызывало повышение активности карбоксипептидазы М во всех изученных отелах мозга.
Для выяснения механизма действия психолептиков на активность основных карбоксипептидаз в отделах мозга и органах самцов крыс in vivo было исследовано влияние данных препаратов in vitro (таблицы 13-15).
Исходя из полученных данных, можно сделать вывод, что ни один из препаратов не влияет на активность исследуемых ферментов. Другими словами, прямое влияние диазепама и галоперидола на молекулы КП Н, КП М и ФМСФ-ингибируемой КП, по-видимому, исключено.
Вместе с тем, в опытах in vivo активность ферментов изменялась при введении психолептиков. Следовательно, влияние галоперидола и диазепама in vivo на активность КП Н, КП М и ФМСФ-ингибируемой КП опосредуется какими-то внутриклеточными механизмами.
Табл. 13. Активность ФМСФ-ингибируемой КП in vitro в отделах мозга и органах самцов крыс при введении психолептиков (M ± m; n = 6÷7).
| Отделы мозга и органы
|
Интактные животные
|
Диазепам
|
Галоперидол
|
| Гипофиз
|
0,24±0,03
|
0,28±0,09
|
0,37±0,08
|
| Гипоталамус
|
0,18±0,01
|
0,15±0,02
|
0,19±0,02
|
| Четверохолмие
|
0,21±0,02
|
0,18±0,01
|
0,19±0,01
|
| Мозжечок
|
0,24±0,01
|
0,24±0,01
|
0,21±0,01
|
| Стриатум
|
0,15±0,02
|
0,16±0,01
|
0,14±0,01
|
| Гиппокамп
|
0,17±0,01
|
0,19±0,01
|
0,20±0,01
|
| Большие полушария
|
0,22±0,02
|
0,22±0,01
|
0,22±0,02
|
| Надпочечники
|
0,65±0,09
|
0,53±0,06
|
0,64±0,08
|
| Семенники
|
0,07±0,01
|
0,10±0,01
|
0,08±0,01
|
Табл. 14. Активность карбоксипептидазы Н in vitro в отделах мозга и органах самцов крыс при введении психолептиков (M ± m; n = 6÷7).
| Отделы мозга и органы
|
Интактные животные
|
Диазепам
|
Галоперидол
|
| Гипофиз
|
0,76±0,11
|
0,86±0,16
|
0,81±0,09
|
| Гипоталамус
|
0,23±0,01
|
0,18±0,02
|
0,18±0,02
|
| Четверохолмие
|
0,21±0,01
|
0,20±0,01
|
0,21±0,01
|
| Мозжечок
|
0,12±0,01
|
0,12±0,01
|
0,12±0,01
|
| Стриатум
|
0,16±0,01
|
0,15±0,01
|
0,12±0,01
|
| Гиппокамп
|
0,20±0,01
|
0,18±0,02
|
0,22±0,01
|
| Большие полушария
|
0,19±0,01
|
0,17±0,01
|
0,19±0,01
|
| Надпочечники
|
0,10±0,01
|
0,05±0,02
|
0,09±0,01
|
| Семенники
|
0,03±0,01
|
0,03±0,01
|
0,03±0,01
|
Табл. 15. Активность карбоксипептидазы М in vitro в отделах мозга и органах самцов крыс при введении психолептиков (M ± m; n = 6÷7).
| Отделы мозга и органы
|
Интактные животные
|
Диазепам
|
Галоперидол
|
| Гипоталамус
|
0,084±0,019
|
0,111±0,012
|
0,104±0,015
|
| Четверохолмие
|
0,113±0,007
|
0,112±0,007
|
0,110±0,006
|
| Мозжечок
|
0,088±0,010
|
0,069±0,006
|
0,080±0,010
|
| Стриатум
|
0,087±0,015
|
0,073±0,013
|
0,066±0,013
|
| Гиппокамп
|
0,082±0,010
|
0,069±0,009
|
0,068±0,007
|
| Большие полушария
|
0,136±0,012
|
0,115±0,008
|
0,139±0,011
|
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время одной из наиболее актуальных проблем в современной медицине является профилактика и лечения психических заболеваний. Успешное решение данной проблемы возможно лишь в сочетании с изучением молекулярно-биохимических механизмов, лежащих в основе развития патологии нервной системы.
Известно, что развитие патологических процессов происходит в связи с нарушением процессов передачи информации между клетками [2, 4, 8, 40, 50], поэтому в психофармакологии используют препараты, действующие на медиаторные системы, в частности, галоперидол - антагонист дофаминергической и диазепам – агонист ГАМК-ергической систем [39, 163, 310]. Установлено при этом, что введение психолептиков существенно изменяет уровень ряда биологически активных пептидов [67, 95, 164, 193, 243, 228, 263, 324]. Однако механизмы взаимодействия медиаторных и пептидергических систем до сих пор остаются неизученными.
Содержание биологически активных пептидов зависит от активности ферментов, участвующих в их обмене [21, 30]. Изучение содержания уровня того или иного нейропептида в тканях не дает достаточно точных представлений о динамических процессах, происходящих в пептидергической системе при введении психолептиков. Более информативным является изучение процессов синтеза и утилизации нейропептидов [12, 21]. Поэтому изучение активности КП Н, ФМСФ-КП и КП М при воздействии галоперидола и диазепама представляет значительный интерес, как для уточнения биологической роли самих ферментов, так и для понимания роли регуляторных пептидов в механизмах действия психолептиков.
Максимальная активность КП Н обнаружена в отделах мозга и тканях с высоким уровнем нейропептидов, а именно, в гипофизе, где синтезируются пептидные гормоны, а также в гипоталамусе, четверохолмии, стриатуме - отделах лимбической системы, в которых обнаружено высокое содержание эндорфинов и вещества Р [55, 84, 201, 278, 279]. Низкая активность фермента выявлена в надпочечниках и гонадах. Полученные нами данные об уровне и распределении активности КП H в мозге и тканях крыс соответствуют литературным данным [137, 148, 149].
Региональное и тканевое распределение фермента соответствует литературным данным о содержании регуляторных пептидов в нервной системе [201], что хорошо согласуется с данными о вовлечении КП Н в процессинг нейропептидов [149, 175, 181, 247, 259, 282, 283].
Наибольшая активность ФМСФ-ингибируемой КП обнаружена в гипофизе и надпочечниках, т.е. в органах, связанных с образованием регуляторных пептидов и гормонов пептидной природы. Нужно отметить, что в гипофизе активность фермента значительно выше, чем в отделах центральной нервной системы. Поскольку в гипофизе синтезируются пептидные гормоны, то, не исключено, что ФМСФ-ингибируемая КП может участвовать в процессинге предшественников этих гормонов. Однако, в гипоталамусе и стриатуме, отделах мозга с наиболее высоким уровнем нейропептидов [201], активность ФМСФ-ингибируемой КП не высока.
Обнаружено, что в гипофизе активность КП Н существенно выше активности ФМСФ-ингибируемой КП, тогда как в надпочечниках, в которых синтезируются преимущественно энкефалины, наблюдается обратное соотношение. Возможно, это различие связано с различной субстратной специфичностью данных ферментов [9]. Так, в гипофизе синтезируются в основном пептидные гормоны, в проформах которых перед остатком основной аминокислоты находится остаток аминокислоты с коротким алифатическим радикалом (аланин, глицин) [55]. В надпочечниках же синтезируются преимущественно энкефалины, в которых предпоследними являются остатки лейцина и метионина [55]. Сопоставляя субстратную специфичность и аминокислотную последовательность регуляторных пептидов можно придти к выводу, что предпочтительным субстратом для КП Н будут предшественники пептидных гормонов, а для ФМСФ-ингибируемой КП предшественники лей- и мет-энкефалинов, с чем, возможно, и связан более высокий уровень активности ФМСФ-ингибируемой КП в надпочечниках.
Максимальный уровень активности КП М у интактных животных наблюдался в четверохолмии, больших полушариях, мозжечке и гипоталамусе. В этих отделах мозга синтезируется большое количество регуляторных пептидов, в обмене которых возможно принимает участие этот фермент.
Однократное введение физиологического раствора вызывало уменьшение активности КП Н в гипофизе через все исследуемые промежутки времени. Активность исследуемого фермента снижалась через 0,5 часа в гипоталамусе, стриатуме и мозжечке. Вероятно, это связано с особенностями воздействия внутрибрюшинной инъекции физраствора, при которой в организм поступает дополнительное количество жидкости. Понижение активности КП Н может способствовать ускорению высвобождения жидкости из организма благодаря уменьшению образования вазопрессина [41].
Инъекция физиологического раствора вызывала достоверное повышение активности ФМСФ-ингибируемой КП во всех изученных тканях и отделах мозга: в гипофизе – через 0,5, 24 и 72 часа; в четверохолмии, мозжечке, стриатуме, больших полушариях и гипоталамусе – через все исследуемые промежутки времени; в надпочечниках и гиппокампе – через 4, 24 и 72 часа; в семенниках – через 0,5, 4 и 72 часа после воздействия. Если рассматривать инъекцию физраствора как кратковременный стресс, то повышение активности ФМСФ-ингибируемой КП может быть связано с повышением уровня синтеза энкефалинов и эндорфинов при воздействии стресса [51].
Активность карбоксипептидазы М в гиппокампе повышалась через 0,5 и 72 часа после однократной инъекции физиологического раствора по сравнению с интактными животными. Активность фермента в гипоталамусе и мозжечке через 72 часа была выше, чем в норме. Поскольку в ответ на стрессовое воздействие в организме животных вырабатывается большое количество регуляторных пептидов [51], то не исключено, что повышение активности карбоксипептидазы М связано с ее участием в инактивации нейропептидов, синтезированных в ответ на данное воздействие. Введение физраствора приводило к снижению активности КП М в стриатуме через 24 часа после воздействия. Известно, что α-неоэндорфин, динорфин 1-13, широко представленные в стриатуме, в качестве С-концевой аминокислоты содержат лизин [55], следовательно, они могут выступать в качестве субстратов для КП М [118, 271, 301]. Выявленное уменьшение активности КП М, возможно, приводит к замедлению разрушения этих пептидов, обладающих способностью проявлять седативное действие [41, 55].
При хроническом введении физиологического раствора активность КП Н увеличивалась через сутки после воздействия в гипоталамусе, четверохолмии, мозжечке, стриатуме, надпочечниках и семенниках относительно интактных животных. Через трое суток после хронического воздействия наблюдалось понижение активности исследуемого фермента в гипоталамусе и повышение активности в мозжечке, гиппокампе и семенниках по сравнению с нормой.
Хроническое введение физраствора приводило к повышению активности ФМСФ-КП через сутки после воздействия в гипофизе, четверохолмии, мозжечке, гиппокампе, больших полушариях и семенниках. В стриатуме и надпочечниках через сутки после воздействия наблюдалось понижение активности фермента относительно интактных животных. Через трое суток после хронического введения физиологического раствора наблюдалось повышение активности ФМСФ-ингибируемой КП в гипофизе, мозжечке, стриатуме, гиппокампе и семенниках относительно интактных животных. В надпочечниках активность фермента понижалась по сравнению с нормой.
Повышение активности карбоксипептидазы М во всех исследуемых отделах мозга наблюдалось через 1 и 3 суток после хронического воздействия физиологического раствора. Через сутки после введения наибольшие изменения обнаружены в гиппокампе, четверохолмии, стриатуме и больших полушариях, а также в гипоталамусе и мозжечке по сравнению с интактными животными. Через трое суток после хронического введения физраствора обнаружено повышение активности КП М в гипоталамусе, четверохолмии, мозжечке, стриатуме, гиппокампе и больших полушариях по сравнению с интактной группой.
Таким образом, введение физиологического раствора в течение 10 дней можно рассматривать в качестве стресса для животных. В связи с этим обнаруженное изменение активности основных карбоксипептидаз согласуется с данными об участии исследуемых ферментов в ответе организма на стресс [5].
Изучение активности КП Н, ФМСФ-ингибируемой КП и КП М у самцов крыс при однократном введении диазепама показало, что активность ФМСФ-ингибируемой КП достоверно изменялась во всех исследуемых органах и тканях, в то время как активность КП Н не изменялась только в стриатуме. Изменения активности КП М были обнаружены в гипоталамусе, мозжечке, стриатуме и гиппокампе.
Введение диазепама приводило к значительному уменьшению активности КП Н в гипофизе через 24 и 72 часа, гипоталамусе через 4, 24 и 72часа и надпочечниках через 72 часа, что согласуется с представлениями о стресс-протективном действии диазепама [51] путем ингибирования гипоталамо-гипофизарно-надпочечниковой системы и уменьшения секреции и образования АКТГ при его введении [263, 290]. При этом необходимо отметить, что изменения в гипоталамусе наступали раньше, чем в гипофизе.
Инъекция диазепама понижала активность КП Н в четверохолмии, больших полушариях, мозжечке и гиппокампе через 4, 24 и 72 часа относительно соответствующих значений контроля. При этом наибольшие изменения зафиксированы в больших полушариях и гиппокампе (в 1,3-1,4 раза), в отделах с высоким содержанием холецистокининов и вовлекающихся в развитие эмоциональных реакций и невротических состояний [24]. На основе полученных данных можно предположить, что уменьшение уровня холецистокининов под действием бензодиазепинов [24] вызвано снижением активности КПН. Кроме того, по данным ряда ученых [126, 285] вещество Р вовлекается в модуляцию стресса и его уровень повышен у пациентов с депрессивными расстройствами. Понижение уровня этого пептида в гиппокампе при введении диазепама [95] можно быть связано с понижением активности КПН. В семенниках активность КП Н снижалась через 72 часа после инъекции диазепама. В половых железах самцов синтезируются энкефалины, холецистокинины и другие биологически активные пептиды [195, 260], в обмене которых участвует карбоксипептидаза Н, поэтому снижение активности фермента может влиять на уровень пептидов в семенниках.
Активность ФМСФ-ингибируемой КП после инъекции диазепама изменялась подобно активности КП Н: уменьшалась в гипофизе через 4 и 72 часа; в гипоталамусе, мозжечке, стриатуме и больших полушариях через 24 и 72часа; в гиппокампе, четверохолмии и надпочечниках через 4, 24 и 72 часа после воздействия. Обнаруженное нами снижение активности ФМСФ-ингибируемой КП позволяет предположить ее участие в обмене регуляторных пептидов при введении диазепама.
Имеются данные о понижении уровня мет-энкефалина в стриатуме при однократном введении диазепама [237]. В наших исследованиях изменения активности КП Н в этом отделе мозга не были обнаружены, но произошло понижение активности ФМСФ-ингибируемой КП. Отсюда можно предположить, что ФМСФ-ингибируемая КП участвует в обмене энкефалинов в стриатуме, предшественники которых являются более предпочтительными субстратами для ФМСФ-ингибируемой КП [9, 26].
Понижение активности фермента в семенниках через 0,5 и 72 часа после воздействия может быть связано с увеличением уровня тестостерона под действием диазепама [48, 123].
Активность карбоксипептидазы М снижалась в мозжечке через 72 часа после острого воздействия диазепама. В гипоталамусе через 4 часа после воздействия активность исследуемого фермента увеличивалась, а через 72 часа уменьшалась по сравнению с контрольными животными. Обнаруженное снижение активности фермента через 72 часа в мозжечке и гипоталамусе может быть обусловлено уменьшением числа активных молекул фермента. Снижение активности КП М в стриатуме наблюдалось через 4 часа и увеличение через 24 часа по отношению к контролю. В гиппокампе активность фермента была достоверно выше, чем у контрольной группы, через 4 часа после однократной инъекции диазепама. Таким образом, изменение активности КПМ обнаружено в тех отделах мозга, где эндогенный лиганд бензодиазепиновых рецепторов – ингибитор связывания диазепама (DBI) и бензодиазепиновые рецепторы присутствуют в высоких концентрациях [2, 113]. Известно, что на С-конце DBI и его производных присутствует лизин [112]. Учитывая специфичность действия КПМ, можно предположить, что фермент, локализованный на внешней стороне плазматической мембраны [118], участвует в инактивации эндозепинов путем отщепления лизина. DBI является анксиогенным пептидом, который повышает агрессивность животных [8, 118]. Обнаруженное увеличение активности КПМ может привести к снижению уровня этого пептида путем его инактивации. Следовательно, седативное действие диазепама может проявляться через увеличение уровня седативных пептидов и понижение уровня проконфликтных за счет действия КПМ.
Хроническое введение диазепама приводило к снижению активности КП Н и КП М и разнонаправленным изменениям ФМСФ-КП в изученных отделах мозга и периферических органах крыс.
Введение диазепама в течение 10 дней вызывало снижение активности КП Н в гипофизе, гипоталамусе, четверохолмии, мозжечке, стриатуме через сутки после воздействия. Наибольшее понижение активности фермента в этот период обнаружены в периферических тканях: в надпочечниках и семенниках относительно контрольной группы. Таким образом, хроническое введение диазепама приводило к таким же изменениям активности КП Н, как и при остром воздействии препарата. Диазепам, вводимый в течение 10 дней, вызывал ингибирование гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной систем, а также отделов, отвечающих за двигательную активность животных. Через трое суток после хронического введения диазепама снижение активности КП Н обнаружено в отделах с высоким содержанием опиоидных пептидов: в гиппокампе и надпочечниках. Следовательно, хроническое введение диазепама вызывало наибольшие изменения активности карбоксипептидазы Н через сутки после воздействия.
Снижение активности ФМСФ-ингибируемой КП через сутки после хроническое введение диазепама наблюдалось в гипофизе, мозжечке, гиппокампе и больших полушариях по сравнению с контрольной группой. Активность фермента через сутки после воздействия повышалась в стриатуме, надпочечниках и семенниках.
Хроническое введение диазепама приводило к снижению активности ФМСФ-КП через трое суток после воздействия в гипофизе, мозжечке, стриатуме и гиппокампе относительно контрольных животных. Повышение активности фермента зафиксировано в гипоталамусе, четверохолмии и надпочечниках по сравнению с контролем.
Таким образом, в отличие от действия однократной инъекции диазепама хроническое введение препарата приводило к разнонаправленным изменениям активности ФМСФ-ингибируемой КП во всех исследуемых отделах мозга и тканях относительно контрольных животных. Кроме того, диазепам, вводимый в течение 10 дней, вызывал снижение активности КП Н и разнонаправленные изменения активности ФМСФ-КП. Возможно, что подобное отличие в изменении активности этих ферментов связано с разной ролью исследуемых карбоксипептидаз в различных отделах мозга и периферических органах, что согласуется с данными, полученными другими исследователями [26].
Хроническое введение диазепама вызывало снижение активности КП М во всех исследуемых отделах мозга через сутки после воздействия. Наибольшие изменения активности фермента зафиксированы в четверохолмии и стриатуме. Через трое суток после введения диазепама активность фермента снижалась только в мозжечке и стриатуме по сравнению с контрольными животными.
В ответ на хроническое введение диазепама из клетки секретируются как пептиды, так и ферменты их обмена. Возможно, что снижение активности карбоксипептидазы М через сутки после хронического воздействия может быть связано с уменьшением количества активных молекул фермента в связи с преобладанием процессов их деградации над синтезом. Через трое суток снижение активности КП М наблюдалось только в отделах с высоким содержанием регуляторных пептидов. Можно предположить, что для восстановления пептидергической системы мозжечка и стриатума необходим более длительный промежуток времени.
Суммируя все вышеизложенное можно предложить, что активация ГАМК-ергической системы при введении диазепама приводит к изменению уровня регуляторных пептидов путем изменения активности изученных карбоксипептидаз.
Однократное введение галоперидола вызывала понижение активности КП Н, повышение КП М и разнонаправленные изменения ФМСФ-ингибируемой КП.
Галоперидол в дозе 2 мг/кг вызывал достоверные изменения активности КП Н в отделах гипоталамо-гипофизарно-надпочечниковой системы. При этом повышение ферментативной активности в гипоталамусе наблюдалось уже через 0,5 часа, в гипофизе – через 0,5 и 4 часа, в надпочечниках – через 4 и 72 часа после инъекции. При введении галоперидола отмечалось повышение уровня ПОМК в промежуточной доле гипофиза [103] и усиление секреции гормонов гипофиза [50, 198, 273, 287]. Сопоставление этих данных с результатами нашей работы позволяет предположить, что КП Н участвует в реализации эффекта галоперидола.
В мозжечке активность фермента через 0,5 часа была выше, чем у контрольной группы. Известно, что при введении галоперидола крысы становятся вялыми, особенно в течение 30 минут после инъекции [36]. Этот эффект может быть вызван повышением скорости образования динорфина, обладающего седативным действием, при участии КП Н.
Достоверное снижение активности КП Н по отношению к контролю наблюдалось в семенниках через 24 и 72 часа после воздействия. Инъекция галоперидола вызывает повышение секреции гонадотропина [273, 276], влияющего на уровень половых стероидов, которые в свою очередь снижают активность карбоксипептидазы Н [47].
Активность ФМСФ-ингибируемой КП значительно повышалась в стриатуме через 0,5 часа после воздействия. Согласно данным ряда исследователей [211, 232, 261] однократная инъекция галоперидола приводит к увеличению уровня мет-энкефалина и нейротензина в стриатуме. Кроме того, уровень нейротензина у больных шизофренией уменьшен, но восстанавливается после лечения галоперидолом [59, 92, 292]. Поскольку изменение активности КПН в этом отделе мозга не обнаружены, то можно предположить, что в процессинг регуляторных пептидов, синтезируемых в стриатуме при введении галоперидола, вовлечена ФМСФ-ингибируемая КП. Однако через 4 и 24 часа после внутрибрюшинного введения галоперидола наблюдалось небольшое, но достоверное снижение активности фермента по отношению к контрольной группе животных, что, возможно, является результатом действия компенсаторных механизмов, направленных на нормализацию функционального состояния пептидергических систем стриатума. Повышение активности ФМСФ-ингибируемой КП через 0,5 часа и понижение через 4 и 72 часа наблюдалось в четверохолмии. Однонаправленные изменения (повышение активности фермента через 0,5 и понижение через 4 или 24 часа) наблюдались в эмоциогенных структурах: гиппокампе и больших полушариях. Известно, что при введении галоперидола в гиппокампе и больших полушариях повышается уровень холецистокинина и вещества Р [294, 334]. Не исключено, что ФМСФ-ингибируемая КП участвует в обмене этих пептидов. В отличие от КП Н активность ФМСФ-ингибируемой КП понижалась в гипофизе, гипоталамусе и мозжечке через 4 часа после воздействия. Отмеченное понижение активности ФМСФ-КП в отделах мозга через 4 и 24 часа после введения галоперидола может быть обусловлено уменьшением числа активных молекул фермента. Активность фермента через 0,5 часа после введения галоперидола повышалась в надпочечниках, а через 24 часа понизилась. В надпочечниках синтезируется большое количество мет-энкефалинов, предшественники которых являются более предпочтительными субстратами для ФМСФ-КП, поэтому можно предположить, что этот фермент вовлечен в обмен энкефалинов в надпочечниках.
Введение галоперидола увеличивало активность КП М в гипоталамусе через 4 и 24 часа после воздействия. В четверохолмии и гиппокампе через 4 часа после инъекции, в мозжечке – через 4 и 72 часа, а в больших полушариях – через 0,5 и 24 часа активность фермента была выше, чем у контроля. Увеличение активности фермента в стриатуме наблюдалось только через 24 часа после инъекции. Поскольку под влиянием галоперидола увеличивается уровень многих нейропептидов [69, 117, 129, 314], то не исключено, что повышение активности фермента связано с участием его в деградации большого количества нейропептидов, синтезированных в ответ на данное воздействие.
Таким образом, ингибирование дофаминергической системы галоперидолом вызывало повышение активности КП Н в гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной системе и мозжечке. Активность ФМСФ-ингибируемой КП повышалась через 0,5 и понижалась через 4, 24 и 72 часа во всех тканях (искл. семенники). Повышение активности КП М наблюдалось во всех изученных отделах. Интересно отметить, что через 0,5 часа после инъекции галоперидола активность ферментов синтеза регуляторных пептидов (КП Н и ФМСФ-ингибируемой КП) увеличилась, а через 4 часа наблюдались разнонаправленные изменения активности изученных карбоксипептидаз. Это явление может быть следствием различия в субстратной специфичности КП Н и ФМСФ-ингибируемой КП [26].
Хроническое воздействие галоперидола вызывало снижение активности изучаемых ферментов через сутки после воздействия и разнонаправленные изменения через трое суток.
Также как и при однократном введении галоперидола хроническое воздействие вызывало снижение активности КП Н через сутки после воздействия, но данное изменение зафиксировано во всех исследованных отделах мозга и тканях за исключением больших полушарий. Через трое суток после хронического воздействия зафиксировано уменьшение активности КП Н в отделах мозга (четверохолмии и гиппокампе) и повышение в периферических тканях (надпочечниках и семенниках). Таким образом, хроническое введение галоперидола приводило к более выраженным изменениям активности фермента, которые сохранялись в течение трех суток в отделах с высоким содержанием регуляторных пептидов и дофаминовых рецепторов [70, 101].
В отличие от однократной инъекции галоперидола хроническое введение препарата вызывало снижение активности ФМСФ-ингибируемой КП через сутки после воздействия в гипофизе, четверохолмии, мозжечке, гиппокампе, больших полушариях и надпочечниках относительно контроля. Через трое суток после введения галоперидола активность фермента снижалась в гипофизе и стриатуме по сравнению с контрольной группой. Повышение активности ФМСФ-КП наблюдалось в гипоталамусе, четверохолмии, гиппокампе и надпочечниках относительно контроля через трое суток после воздействия. Таким образом, изменения ФМСФ-ингибируемой КП носили более продолжительный характер по сравнению с ФМСФ-ингибируемой КП. Следовательно, можно предположить, что ФМСФ-КП играет более важную роль в обеспечении долгосрочных эффектов галоперидола и его побочных действий.
Через сутки после хронического введения галоперидола активность карбоксипептидазы М снижалась в гиппокампе, больших полушариях и стриатуме относительно контроля. Хроническое введение галоперидола вызывало повышение активности фермента через трое суток после воздействия в четверохолмии, гипоталамусе, стриатуме и повышение в гиппокампе по сравнению с контролем.
Таким образом, хроническое введение галоперидола вызывало сходные изменения активности ФМСФ-ингибируемой КП, КП М и КП Н: снижение через сутки после воздействия и разнонаправленные изменения через трое суток. Можно предположить, что снижение активности ферментов через сутки после воздействия связано с уменьшением числа активных молекул. Через трое суток, то есть в период отмены препарата, происходит восстановление ферментативной системы и наблюдается повышение активности исследуемых карбоксипептидаз.
Для более полного понимания биологической роли ФМСФ-ингибируемой КП, которая является менее изученным ферментом по сравнению с карбоксипептидазами Н и М, был проведен корреляционный анализ (табл. 16-19).
Согласно данным корреляционного анализа при однократном введении диазепама наблюдалась достоверная положительная корреляция между ФМСФ-ингибируемой КП и КП М в гипоталамусе и четверохолмии, между КП Н и КП М в больших полушариях (табл. 16). Возможно, что изменение интенсивности синтеза нейропептидов под действием КП Н и ФМСФ-ингибируемой КП влечет за собой соответствующее изменение скорости их инактивации при участии КП М.
Таблица 16. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самцов крыс при однократном введении диазепама (* - р<0,05, ** - р<0,01, *** - р<0,001).
| |
ФМСФ-КП и
КП Н
|
ФМСФ-КП и
КП М
|
КП Н и КП М
|
| Гипофиз
|
0,14(25)
|
|
|
| Гипоталамус
|
0,16(25)
|
0,56**(25)
|
0,13(25)
|
| Четверохолмие
|
0,05(25)
|
0,72***(25)
|
0,15(25)
|
| Мозжечок
|
0,14(25)
|
0,35(25)
|
0,20(25)
|
| Стриатум
|
0,25(25)
|
0,16(25)
|
0,17(25)
|
| Гиппокамп
|
0,26(30)
|
0,33(30)
|
-0,14(32)
|
| Большие полушария
|
0,22(31)
|
0,34(33)
|
0,42*(31)
|
| Надпочечники
|
-0,13(30)
|
|
|
| Семенники
|
0,08(27)
|
|
|
Положительная корреляция активности ферментов при хроническом введении диазепама наблюдалась в большем количестве изучаемых отделов по сравнению с однократной инъекцией (табл. 17). Так, положительная корреляция между карбоксипептидазой Н и ФМСФ-ингибируемой КП наблюдалась в мозжечке, гиппокампе и семенниках; между ФМСФ-КП и КП М – в гипоталамусе, мозжечке, стриатуме; между КП Н и КП М – в четверохолмии и мозжечке.
В этих отделах обнаружена высокая концентрация эндозепинов [113]. Положительная корреляция изменения активности ферментов в данных отделах при введении диазепама может быть связана с их участием в обмене DBI и его производных, уровень которых изменяется при введении диазепама.
Корреляционный анализ активности ферментов при введении галоперидола показал статистически значимое сходство между КП Н, ФМСФ-ингибируемой КП и КП М (табл. 18) в гипоталамусе, мозжечке и больших полушариях. Возможно, однонаправленное действие данных ферментов в отделах, отвечающих за двигательную активность, вызывает изменение уровня регуляторных пептидов и нарушает выполнение двигательных программ при введении галоперидола.
Таблица 17. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самцов крыс при хроническом введении диазепама (* - р<0,05, ** - р<0,01, *** - р<0,001).
| |
ФМСФ-КП и
КП Н
|
ФМСФ-КП и
КП М
|
КП Н и КП М
|
| Гипофиз
|
0,37(19)
|
|
|
| Гипоталамус
|
0,29(21)
|
0,65**(20)
|
0,28(20)
|
| Четверохолмие
|
-0,11(21)
|
0,26(21)
|
0,50*(21)
|
| Мозжечок
|
0,76***(21)
|
0,46*(20)
|
0,68***(20)
|
| Стриатум
|
0,34(21)
|
0,49*(20)
|
-0,01(20)
|
| Гиппокамп
|
0,52*(20)
|
0,20(20)
|
0,22(20)
|
| Большие полушария
|
0,11(18)
|
0,21(19)
|
-0,42(18)
|
| Надпочечники
|
-0,27(19)
|
|
|
| Семенники
|
0,53*(15)
|
|
|
Таблица 18. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самцов крыс при однократном введении галоперидола (* - р<0,05, ** - р<0,01, *** - р<0,001).
| |
ФМСФ-КП и
КП Н
|
ФМСФ-КП и
КП М
|
КП Н и КП М
|
| Гипофиз
|
-0,21(24)
|
|
|
| Гипоталамус
|
0,56**(29)
|
0,39**(28)
|
0,37(28)
|
| Четверохолмие
|
0,19(29)
|
0,27(29)
|
0,30(30)
|
| Мозжечок
|
0,52**(28)
|
0,66***(28)
|
0,38*(28)
|
| Стриатум
|
0,12(29)
|
-0,05(28)
|
0,22(29)
|
| Гиппокамп
|
0,33(29)
|
0,33(29)
|
0,33(29)
|
| Большие полушария
|
0,38*(29)
|
0,49**(30)
|
0,38*(29)
|
| Надпочечники
|
-0,09(25)
|
|
|
| Семенники
|
0,38(25)
|
|
|
При хроническом введении галоперидола наблюдалась положительная корреляция между КП Н, КП М и ФМСФ-ингибируемой КП в мозжечке и стриатуме (табл. 19) – отделах с высоким содержанием регуляторных пептидов и дофаминовых рецепторов. В гипоталамусе, четверохолмии, мозжечке и стриатуме обнаружена корреляция между ФМСФ-КП и карбоксипептидазой М. Так как КП М участвует в деградации пептидов, то можно предположить, что ФМСФ-ингибируемая КП принимает участие в синтезе пептидов, секретируемых из клеток при введении галоперидола. Возможно, что нарушение деятельности пептидергической системы при хроническом введении галоперидола связано с однонаправленными изменениями активности изучаемых карбоксипептидаз.
Таблица 19. Коэффициенты корреляции между активностью основных КП в тканях и отделах мозга самцов крыс при хроническом введении галоперидола (* - р<0,05, ** - р<0,01, *** - р<0,001).
| |
ФМСФ-КП и
КП Н
|
ФМСФ-КП и
КП М
|
КП Н и КП М
|
| Гипофиз
|
0,41(12)
|
|
|
| Гипоталамус
|
0,05(13)
|
0,84**(11)
|
-0,15(14)
|
| Четверохолмие
|
0,03(15)
|
0,59*(14)
|
-0,44(14)
|
| Мозжечок
|
0,86***(15)
|
0,89***(14)
|
0,69**(15)
|
| Стриатум
|
0,60*(15)
|
0,82***(15)
|
0,42(14)
|
| Гиппокамп
|
-0,41(14)
|
0,49(12)
|
-0,14(13)
|
| Большие полушария
|
0,07(14)
|
0,50(14)
|
-0,34(14)
|
| Надпочечники
|
0,41(11)
|
|
|
| Семенники
|
0,42(13)
|
|
|
Таким образом, введение психолептиков приводило к изменению активности ФМСФ-ингибируемой КП, КП Н и КП М в большинстве изученных органах и отделах мозга.
Известно, что карбоксипептидаза Н участвует в процессинге предшественников АКТГ, энкефалинов, холецистокинина, вещества Р, нейротензина и многих других биологически активных пептидов [103, 128, 147, 175]. Анализ аминокислотной последовательности данных пептидов и субстратной специфичности ФМСФ-ингибируемой КП позволяет предположить, что данная карбоксипептидаза наряду с КП Н может вовлекаться в процессинг предшественников этих регуляторных пептидов [26]. Карбоксипептидаза М, являясь мембраносвязанным эктоферментом, может принимать участие в инактивации биологически активных пептидов [118]. Таким образом, одним из механизмов изменения уровня биологически активных пептидов психолептиками может быть изменение активности ферментов их обмена – КП Н, ФМСФ-КП и КП М.
В последнее время широко обсуждаются вопросы участия нейропептидов в развитии эндогенных психических заболеваний [120, 173, 174]. Кроме того, биологически активные пептиды участвуют в процессах формирования памяти, оказывают седативное, анксиогенное, анальгетическое, гипотермическое и ряд других действий [41]. В связи с этим данные пептиды могут участвовать в проявлении основных и побочных действиях транквилизаторов и антипсихотиков. Хроническое введение обоих психолептиков приводило к более выраженным изменениям активности исследуемых карбоксипептидаз по сравнению с острым. В клинической практике при лечении психических заболеваний применяют длительную терапию психолептиками. Поэтому можно предположить, что только длительное воздействие психолептиков приводит к значительному изменению функционирования пептидергической системы мозга и реализации лечебного эффекта препаратов. Несмотря на различный механизм действия препаратов, наиболее сильное влияние обоих психолептиков на активность КП Н наблюдалось в железах (гипофизе, гипоталамусе, надпочечниках и семенниках), а ФМСФ-ингибируемой КП – в отделах мозга. Исходя из распределения исследуемых ферментов в тканях крыс, можно предположить, что в железах ведущую роль в обмене регуляторных пептидов играет КП Н, а в отделах мозга – ФМСФ-КП. При этом необходимо отметить, что изменения активности ФМСФ-КП и КП М наблюдались во всех исследуемых тканях при введении обоих психолептиков. Изменения активности КП Н при введении диазепама обнаружены в большем числе отделов по сравнению с галоперидолом. Другими словами, в региональном отношении отличия между диазепамом и галоперидолом наблюдались только для КП Н. Полученные результаты согласуются с представлениями об антистрессорном действии диазепама и вовлечении КП Н в развитие стрессорной реакции [5, 50].
Весьма важным является вопрос о механизмах изменения активности основных карбоксипептидаз под влиянием психолептиков. В структуре гена КП Н обнаружен целый ряд тканеспецифичных регуляторных участков, через которые осуществляется регуляция скорости транскрипции гена фермента [190, 191, 304]. В структуре генов различных ферментов обмена нейропептидов, обнаружены, например, участки связывания тиреоидных гормонов [304], стероидных гормонов [157], участки связывания цАМФ – внутриклеточного посредника, отвечающего за быстрое включение/выключение генов [324], участки связывания инициирующих и других регуляторных белков [190]. Возможно, что активность КП Н при введении психолептиков регулируется на уровне экспрессии гена. Подтверждением этого можно считать способность стероидов, таких как глюкокортикоиды, андрогены и прогестины, влиять на уровень экспрессии генов. Известно, что введение экзогенных глюкокортикоидов изменяет уровень адренокортикотропина, β-эндорфина, энкефалинов и других секретируемых пептидов гипофиза [275], в образовании которых участвует карбоксипептидаза Н [149, 175, 247]. Добавление глюкокортикоидов в культуру AtT-20 клеток гипофиза снижает уровень мРНК прокарбоксипептидазы Н [277]. Снижение активности фермента при введении дексаметазона и гидрокортизона in vivo происходит, по-видимому, за счёт снижения синтеза мРНК прокарбоксипептидазы Н, а не за счёт изменения активности уже существующих активных молекул фермента. Поскольку введение диазепама приводит к снижению уровня кортикостероидов [263], а синтез мРНК КПН может регулироваться стероидными гормонами, то можно предположить, что активность фермента регулируется на уровне экспрессии гена.
Аналогичные механизмы регуляции можно предположить для ФМСФ-КП и КП М.
Галоперидол может ингибировать обусловленную глюкокортикоидами транскрипцию генов. Этот эффект зависит от уменьшения притока Са2+
и/или ингибирования некоторых Са2+
-зависимых ферментов, например, фосфолипазы С [75]. Поскольку синтез мРНК КПН может регулироваться глюкокортикоидами, то антипсихотические препараты могут ингибировать транскрипцию гена фермента.
Известно также, что изменение деятельности дофаминергической системы влияет на уровень G-белков в тканях крыс. Так, активация Д2
-рецепторов бромокриптином увеличивает уровень мРНК GI
- и GO
-белков и уменьшает уровень мРНК GS
-белка; блокада этих рецепторов галоперидолом приводит к обратному эффекту: увеличению GS
- и уменьшению GI
- и GO
-белков в промежуточной доле гипофиза [276]. Хроническое потребление галоперидола вызывает увеличение уровня GS
- и GI
-белков в гиппокампе и уменьшение GO
- и GI
-белков в стриатуме крыс [296].
Существуют данные о повышении концентрации каталитической субъединицы цАМФ-зависимой киназы в стриатуме мышей после однократной инъекции галоперидола [321]. Поэтому, не исключено, что во влиянии нейролептиков на активность исследуемых карбоксипептидаз могут быть задействованы цАМФ-зависимые механизмы.
Как уже было сказано, активация дофаминовой системы приводит к понижению внутриклеточного уровня Ca2+
[34, 317]. Ca2+
оказывает влияние на выброс содержимого секреторных везикул [80]. Ионы Ca2+
непосредственно не влияют на активность КП Н [123, 242], но в ее составе имеется участок для связывания данных ионов, которые способствуют агрегации КП Н и связыванию ее с мембраной [305]. Возможно, что биологическая роль растворимой и мембраносвязанной КП Н различна [14, 19]. Предполагают, что обе формы участвуют в процессинге, но мембраносвязанная, наряду с этим, способна принимать участие в сортировке пептидов [293]. Кроме того, имеются сведения о том, что активность прогормонконвертазы – фермента, участвующего в процессинге проКП Н, регулируется ионами Ca2+
[144]. Изложенное выше позволяет предположить, что воздействие галоперидола на активность КП Н может быть опосредовано изменениями внутриклеточной концентрации ионов Ca2+
. Это может приводить как к изменению уровня активности фермента, так и к изменению соотношения растворимой и мембраносвязанной форм, что в свою очередь влияет на процессинг и сортировку биологически активных пептидов. Возможно, что аналогичный механизм будет действовать и в отношении ФМСФ-КП, так как для нее также обнаружена мембраносвязанная форма.
Кроме того, синтез мРНК КП Н и прогормонконвертаз стимулируется инсулином [146], фактором роста нервов [204]. Таким образом, активность КП Н может регулироваться на уровне экспрессии гена различными эндогенными веществами, содержание которых при введении психолептиков изменяется.
Диазепам и галоперидол непосредственно не влияют на активность исследуемых карбоксипептидаз, так как в проведенных нами опытах in vitro психолептики в концентрациях, соответствующих дозам при введении in vivo не влияли на активность КП Н, ФМСФ-КП и КП М.
Таким образом, вероятно, активность КП Н, ФМСФ-КП и КП М регулируется на уровне экспрессии гена. Однако наличие существенных изменений в активности изучаемых ферментов уже через 0,5 часа после воздействия указывает на возможность и других способов регуляции активности фермента: на уровне процессинга проформы ферментов, который осуществляется активируемыми ионами Са2+
эндопептидазами, а также регуляция активности зрелой формы фермента за счет конформационных изменений молекулы, и как следствие, изменение свойств активного центра фермента.
Таким образом, полученные нами данные свидетельствуют о том, что активность основных карбоксипептидаз регулируется психолептиками. Изменение активности КП Н, ФМСФ-КП и КП М может влиять на уровень регуляторных пептидов в мозге и плазме крови, а через них – на функционирование других систем организма и вовлекаться в механизмы основного и побочного действия психолептиков на организм.
1. Изменение активности ФМСФ-ингибируемой карбоксипептидазы и карбоксипептидазы М обнаружены во всех изученных органах и отделах мозга при введении галоперидола и диазепама. Активность карбоксипептидазы Н изменялась в большем числе отделов при введении диазепама, чем галоперидола. Хроническое воздействие приводило к более выраженным изменениям активности исследуемых карбоксипептидаз по сравнению с острым.
2. Наибольшие изменения активности карбоксипептидазы Н при введении психолептиков обнаружены в железах, ФМСФ-ингибируемой карбокси-пептидазы – в отделах мозга.
3. Однократное введение диазепама приводило к снижению активности ФМСФ-ингибируемой карбоксипептидазы и карбоксипептидазы Н (за исключением стриатума) во всех изученных тканях. Разнонаправленные изменения активности карбоксипептидазы М после инъекции диазепама отмечены в гипоталамусе, стриатуме, мозжечке и гиппокампе.
4. Острое воздействие галоперидола повышало активность карбокси-пептидазы Н в гипоталамо-гипофизарно-надпочечниковой системе и мозжечке и понижало в семенниках. Разнонаправленные изменения активности ФМСФ-ингибируемой карбоксипептидазы после однократной инъекции галоперидола наблюдались во всех изученных тканях за исключением семенников. Введение галоперидола увеличивало активность карбоксипептидазы М во всех отделах мозга.
5. Хроническое введение диазепама приводило к снижению активности карбоксипептидазы Н (исключение: большие полушария) и карбокси-пептидазы М и разнонаправленным изменениям ФМСФ-ингибируемой карбоксипептидазы во всех изученных тканях. Галоперидол вызывал снижение активности карбоксипептидазы Н, М и ФМСФ-ингибируемой карбокси-пептидазы через сутки после хроническое воздействия и разнонаправленные изменения через трое суток в изученных тканях.
6. Активность исследуемых карбоксипептидаз не изменялась in vitro при действии психолептиков.
7. Полученные в работе данные расширяют наши представления о роли пептидергических систем организма в механизмах действия психолептиков.
1. Андреева Ю.А., Кудрин В.С., Раевский К.С. Изучение влияния 17β-эстрадиола на эффекты галоперидола у крыс линии Вистар // Эксп. и клин. фарм. – 2002. – Т. 65, № 6. – С. 10-13.
2. Аничков С.В. Нейрофармакология: (Руководство) / АМН СССР. – Л.: Медицина, 1982. – 384 с.
3. Арашунян Э.Б., Щетинин Е.В. Стриатные дофаминергическин механизмы и специфическая активность антидепрессантов // Эксп. и клин. фарм. – 1994. – Т. 57, № 3. – С. 60-64.
4. Балашов А.М. Перспективы психофармакологии: научные разработки фармацевтических компаний (анализ открытых публикаций) // Психиатрия и психофармакотерапия. – 2005. – Т. 7, №1. – С. 35-36.
5. Бардинова Ж.С. Влияние стресса на активность карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла: Автореф. дис. … канд. биол. наук. – СПб., 2004. – 20 с.
6. Беляев Н.А., Генгин М.Т., Годына С.В., Калихевич В.Н., Панченко Л.Ф. Активность энкефалинконвертазы в отделах мозга крыс при алкогольной интоксикации // Вопр. мед. химии. – 1988. – Т. 34, № 4. – С. 118-122.
7. Бондоренко Н.А. Избирательное влияние нейролептиков на дофаминзависимое нарушение поведения крыс в тесте экстраполяционного избавления // Бюл. экс. биол. - 1990. - № 11. – С. 506-508.
8. Вакулина О.П. Эндогенные пептидные лиганды бензодиазепиновых рецепторов // Успехи современной биологии. – 1992. – Т. 112, № 4. – С. 591-599.
9. Вернигора А.Н., Генгин М.Т. Выделение, частичная очистка, характеристика и тканевое распределение фенилметилсульфонилфторид-ингибируемой карбоксипептидазы кошки // Биохимия. – 2003. – Т.68, вып 1. – С. 96-102.
10.Вернигора А.Н., Генгин М.Т. Механизмы регуляции активности и биологическая роль карбоксипептидазы Н – фермента процессинга нейропептидов // Биохимия. – 1995. – Т. 60, № 12. – С. 1491-1497.
11.Вернигора А.Н., Генгин М.Т. Основные (Отщепляющие остатки аргинина и лизина) металлокарбоксипептидазы тканей млекопитающих: структура, свойства и функции // Укр. биохим. журн. – 1998. – Т. 70, № 4. – С. 16-24.
12.Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и роль в обмене нейропептидов // Биохимия. – 1996. – Т. 61, № 5. – С. 771-785.
13.Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Влияние этанола, диазепама и резерпина на активность ангиотензинпревращающего фермента и карбоксипептидазы N в норме и при стрессе // Вопр. мед. химии. – 1996. – Т. 42, № 2. – С. 127-130.
14.Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Множественность молеку-лярных форм растворимых карбоксипептидазо-В-подобных ферментов головного мозга кошки // Укр. биохим. журн. – 1993. – Т. 65, № 4. – С. 17-21.
15.Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Очистка и физико-химические свойства растворимой карбоксипептидазы Н из серого вещества головного мозга кошки // Биохимия. – 1992. – Т. 57, № 11. – С. 1712-1719.
16.Вернигора А.Н., Генгин М.Т., Салдаев Д.А., Щетинина Н.В. Распределение активности фенилметилсульфонилфторидингибируемой карбоксипептидазы в нервной ткани котов // Нейрохимия – 1997. – Т. 14, № 4. – С. 423-425.
17.Вернигора А.Н., Мухина Е.С., Балыкова Н.В., Генгин М.Т. Влияние хронического потребления этанола на активность основных карбоксипептидаз в отделах мозга пренатально алкоголизированных крыс // Нейрохимия. – 2003. – Т. 20, № 1. – С. 56-59.
18.Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние внутрибрюшинного введения физиологического раствора на поведение крыс в тесте “открытое поле” и активность ферментов обмена нейропептидов // Физиол. журн. – 1995. – Т. 81, № 12. – С. 121-125.
19.Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние глюкокортикоидов на активность растворимой и мембраносвязанной форм карбоксипептидазы Н in vivo // Укр. биохим. журн. – 1995. – Т. 67, № 6. – С. 99-104.
20.Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние диазепама на активность карбоксипептидазы Н и ангиотензинпревращающего фермента в отделах мозга крыс с различной эмоциональностью в норме и при стрессе // Физиол. журн. им. Сеченова. – 1994. – Т. 80, № 12. – С. 108-113.
21.Вернигора А.Н, Никишин Н.Н, Генгин М.Т. Протеолитические ферменты и регуляция уровня активности нейропептидов // Биохимия. – 1995. – Т. 60, № 10. – С.1575-1579.
22.Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Частичная характеристика фенилметилсульфонилфторидингибируемой карбокси-пептидазы из головного мозга кошки // Биохимия. – 1995. – Т. 60, № 11. – С. 1860-1866.
23.Вернигора А.Н., Щетинина Н.В., Генгин М.Т. Распределение активности ФМСФ-ингибируемой карбоксипептидазы в тканях и отделах головного мозга ежа европейского (Erinaceus europaeus) // Укр. биохим. журн. – 1996. – Т. 68, № 5. – С. 118-121.
24.Воронина Т.А., Середенин С.Б. Перспективы поиска новых анксиолитиков // Эксп. и клин. фармакология – 2002. – Т. 65, № 5. – С. 4-17.
25.Генгин М.Т. Новая КП нервной ткани. Региональное распределение и некоторые физико-химические свойства // Нервная система. – Л. – ЛГУ. – 1991.- С. 29-30.
26.Генгин М.Т. Особенности структурно-функциональной организации и физико-химические свойства нелизосомальных пептидгидролаз мозга животных: Дис. … д-ра биол. наук. – М., 2002. – 330 с.
27.Генгин М.Т., Вернигора А.Н. Ферменты процессинга опиоидных пептидов и методы определения их активности // Укр. биохим. журн. – 1994. – Т.66. - №2. – С.3-17.
28.Генгин М.Т., Вернигора А.Н., Никишин Н.Н., Керимов В.Ю. Эффект эмоционального стресса на активность карбоксипептидазы Н в отделах головного мозга крыс с различной к нему устойчивостью // Вопр. мед. химии.– 1995.– Т.41, № 4.– С.8-9.
29.Генгин М.Т., Вернигора А.Н., Никишин Н.Н., Щетинина Н.В. Активность карбоксипептидазы N и ангиотензинпревращающего фермента в сыворотке крови крыс в норме и при эмоциональном стрессе // Укр. биохим. журн. – 1994. – Т. 66, № 2. – С. 139-142.
30.Гомазков О.А. Функциональная биохимия регуляторных пептидов. – М.: Наука, 1993. – 160с.
31.Гомазков О.А., Панфилов А.Д., Комиссарова Н.В., Ростовцев А.П. Влияние длительного потребления этанола на физиологическое состояние и изменения активности пептидаз мозга у мурицидных (агрессивных) крыс // Журн. высш. нервн. деят. – 1992. – Т. 42, № 4. – С. 771-778.
32.Гомазков О.А., Панфилов А.Д., Ростовцев А.П., Комиссарова Н.В., Фомин В.В., Григорьянц О.О. Регионарная активность энкефалин- и ангиотензин II-образующих пептидаз мозга у крыс с различным влечением к этанолу // Вопр. мед. химии. – 1991. – Т. 37, № 4. – С. 33-37.
33.Ерошенко Т.М. Физиологические свойства регуляторных пептидов // Итоги науки и техн. ВИНИТИ. Сер. физиол. чел. жив. – 1989. – № 51. – С. 1-164.
34.Ивков Н.Н. Изучение механизмов нейролептического действия производных фенотиазинового ряда: Автореф. дис. … д-ра мед. наук. – М., 1995.
35.Колосова Н.Г., Петракова Г.М. Влияние галоперидола на трансмембранный потенциал и вязкость липидов мембран тимоцитов // Эксп. и клин. фармакология. – 2001. – Т. 64, № 5. – С. 60-62.
36.Коста Е., Фратта В., Хонг Дж.С., Морони Ф., Янг Х.-Ю.Т. Взаимодействие между энкефалинэргическими и другими нейронными системами // Эндорфины / Коста Э., Трабукки М. – М.: Мир, 1981. – С.217-227.
37.Лакин Г.Ф. Биометрия. – М.: Высш. шк., 1990. – 352 с.
38.Малин Д.И. Побочное действие психотропных средств. – М.: Вузовская книга, 2000. – 208 с.
39.Машковский М.Д. Лекарственные средства: В 2 т. Т.1. – 14-е изд., перераб., испр. и доп. – М.: ООО «Издательство Новая волна»: Издатель С.Б. Дивов, 2002. – 540 с.
40.Механизм действия анксиолитических, противосудорожных и снотворных средств / Андронати С.А., Яворский А.С., Чепелов В.М. и др. – Киев: Наук. думка, 1988. – 256 с.
41.Нейрохимия / Под ред. Ашмарина И.П., Стукалова П.В. – М.: Изд-во Института биомед. химии РАМН, 1996. – 470 с.
42.Новицкий В.В., Рязанцева Н.В. Структурно-метаболитические особенности мембраны эритроцитов у больных параноидальной шизофренией в условиях психофармакотерапии // Эксп. и клин. фармакология. – 2002. – Т. 65, № 6. – С. 19-22.
43.Оболенская Н.Е. Некоторые особенности образования нейропептидов // Успехи совр. биол. – 1989. – Т. 108, № 3(5). – С. 337-341.
44.Позднев В.Ф., Варламов О.Л., Григорьянц О.О., Гомазков О.А. Новый флюорогенный субстрат карбоксипептидазы H – о-кумароил-фенилаланил-аланил-аргинин // Биоорган. химия. – 1994. – Т. 20, № 4. – С. 406-412.
45.Полтавченко Г.М. Влияние диазепама и 6
N-циклогексиладенозина на уровень диазепамсвязывающего ингибитора в структурах гиппокампа на фоне иммобилизационного стресса // Бюллетень экспериментальной биологии и медицины. - 1990. – Т. 110, № 8. – С. 166-167.
46.Ростовцев А.П., Григорьянц О.О., Гомазков О.А. Субстраты для исследования энкефалинобразующей карбоксипептидазы в мозге и надпочечниках крысы // Вопр. мед. химии. – 1988. – Т. 34, № 1. – С. 126-129.
47.Салдаев Д.А. Активность основных карбоксипептидаз в тканях мышей при введении тестостерона и прогестерона: Автореф. дис. … канд. биол. наук – СПб., 2001. – 20 с.
48.Салиева Р.М., Яновский К., Ратсак Р. и др. Пептид, вызывающий дельта-сон, как фактор, повышающий содержание вещества Р в гипоталамусе и устойчивость крыс к эмоциональному стрессу // Ж. высш. нервн. деятельность. – 1991. – Т. 41, № 3. – С. 558- 563.
49.Сергеев П.В., Шимановский Н.Л. Рецепторы физиологически активных веществ. – М.: Медицина, 1987. – 400 с.
50.Середенин С.Б., Бледнов Ю.А. Влияние феназепама на содержание АКТГ в плазме крови инбредных мышей при стрессовых воздействиях // Бюлл. экспер. биол. и мед. – 1986. – Т. 102, № 12. – С. 724- 726.
51. Слепушкин В.Д., Золоев Г.К., Виноградов В.А., Титов М.И. Нейропептиды, их роль в физиологии и патологии / Томск.- Изд-во Томского ун-та. – 1988. – 143с.
52.Смулевич А.Б., Иванов С.В., Дробижев М.Ю. Бензодиазепины: история и современное состояние проблемы // Журнал неврологии и психиатрии. – 1998. № 8. – С. 4-13.
53.Щетинина Н.В., Вернигора А.Н., Генгин М.Т. Активность основных карбоксипептидаз у крыс разного пола // Укр. биохим. журн. – 1997. – Т. 70, № 3. – С. 110-113.
54.Щетинина Н.В., Вернигора А.Н., Генгин М.Т., Фирстова Н.В. Тканевое и региональное распределение активности фенилметилсульфонил-фторидинигибируемой карбоксипептидазы и других карбоксипептидаз у крыс // Укр. биохим. журн. – 1997. – Т. 70, № 3. – С. 23-28.
55.Физиологически активные пептиды. Справочное руководство. Сост. Гомазков О.А.- М.: ИПГМ.- 1995.- 143 с.
56.Янг Х.-Ю.Т., Хонг Дж.С., Фратта В., Коста Е. Энкефалины мозга крыс. Распределение и биосинтез // Эндорфины / Коста Э., Трабукки М. – М.: Мир, 1981. – С.155-164.
57.Abood M.E., Eberwine J.H., Erdelyi E., Evans C.J. Brain. Regulation of both preproenkephalin mRNA and its derived opioids by haloperidol—a method for measurement of peptides and mRNA in the same tissue extract // Res. Mol. Brain. Res. – 1990. – V. 8, № 3. – Р. 243-248.
58.Adams M.R., Brandon E.P., Chartoff E.H., Idzerda R.L., Dorsa D.M., McKnight G.S. Loss of haloperidol induced gene expression and catalepsy in protein kinase A-deficient mice // Neurobiology. – 1997. – V. 94. – Р. 12157-12161.
59.Adams M.R., Dobie D.J., Merchant K.M., Unis A., Dorsa D.M. EEDQ reduces the striatal neurotensin mRNA response to haloperidol // Peptides. – 1997. – V. 18, № 4. – Р. 527-535.
60.Alcalde L., Tonacchera M., Costagliola S., Jaraquemada D., Pujol Borrell R., Ludgate M. Cloning of candidate autoantigen carboxypeptidase H from a human islet library: sequence identity with human brain CPH // J. Autoimmunity. – 1996. – V. 9, № 4. – P. 525-528.
61.Alho H., Bovolin P., Jenkins D., Guidotti A., Costa E. Cellular and subcellular localization of an octadecaneuropeptide derived from diazepam binding inhibitor: immunohistochemical studies in the rat brain // J. Chem. Neuroanat. – 1989. – V. 2, № 6. – Р. 301-318.
62.Alho H., Fremeau R.T., Tiedge H., Wilcox J., Bovolin P., Brosius J., Roberts J.L., Costa E. Diazepam binding inhibitor gene expression: location in brain and peripheral tissues of rat // Proc. Natl. Acad. Sci. USA. – 1988. – V. 85, № 18. – Р. 7018-7022.
63.Alho H., Harjuntausta T., Schultz R., Peltohuikko M. Immunohistochemistry of Diazepam Binding Inhibitor (Dbi) in the Central-Nervous-System and Peripheral Organs - Its Possible Role as an Endogenous Regulator of Different Types of Benzodiazepine Receptors // Neuropharmacology. – 1991. – V. 30, № 12B. – Р. 1381-1382.
64.Andreassen O.A., Finsen B., Ostergaard K., Sorensen J.C., West M.J., Jorgensen H.A. The relationship between oral dyskinesias produced by long-term haloperidol treatment, the density of striatal preproenkephalin messenger RNA and enkephalin peptide, and the number of striatal neurons expressing preproenkephalin messenger RNA in rats // Neuroscience. – 1999. – V. 88, № 1. – Р. 27-35.
65.Andreassen O.A., Finsen B., Ostergaard K., West M.J., Jorgensen HA. Reduced number of striatal neurons expressing preprosomatostatin mRNA in rats with oral dyskinesias after long-term haloperidol administration // Neurosci. Lett. – 2000. – V. 279, № 1. – Р. 21-24.
66.Angulo J.A. Involvement of dopamine D1 and D2 receptors in the regulation of proenkephalin mRNA abundance in the striatum and accumbens of the rat brain // J. Neurochem. – 1992. – № 58. – Р. 1104-1109.
67.Angulo J.A., Christoph G.R., Manning R.W., Burkhart B.A., Davis L.G. Reduction of dopamine receptor activity differentially alters striatal neuropeptide mRNA levels // Adv. Exp. Med. Biol. – 1987. – № 221. – Р. 385-391.
68.Apiquian R., Fresan A., De La Fuente-Sandoval C., Ulloa R.E., Nicolini H. Survey on schizophrenia treatment in Mexico: perception and antipsychotic prescription patterns. // BMC Psychiatry. – 2004. – V. 4, № 1. – Р. 12.
69.Autelitano D.J., Clements J.A., Nikolaidis I., Canny B.J., Funder J.W. Concomitant dopaminergic and glucocorticoid control of pituitary proopiomelanocortin messenger ribonucleic acid and beta-endorphin levels // Endocrinology. – 1987. – V. 121, № 5. – Р. 1689-1696.
70.Autelitano D.J., Snyder L., Sealfon S.C., Roberts J.L. Dopamine D2-receptor messenger RNA is differentially regulated by dopaminergic agents in rat anterior and neurointermediate pituitary // Mol. Cell. Endocrinol. – 1989. – V. 67, № 1. – Р. 101-105.
71.Azaryan A.V., Hook V.Y.H. Distinct properties of prohormone thiol protease compared to cathepsin B, cathepsin L, and cathepsin H - evidence for Ptp as a novel cysteine protease // Arch. Biochem. Biophys. – 1994. – V. 314, № 1. – P. 171-177.
72.Ball J.A., Ghatei M.A., Sekiya K., Krausz T., Bloom S.R. Diazepam binding inhibitor-like immunoreactivity(51-70): distribution in human brain, spinal cord and peripheral tissues // Brain. Res. – 1989. – V. 479, № 2. – Р. 300-305.
73.Bannon M., Lee J.-M., Giraud P., Young A., Affolter H.-U., Bonner T. Dopamine antagonist haloperidol decreases substance P, substance K, and preprotachykinin mRNAs in rat striatonigral neurons // J. Biol. Chem. – 1986. – V. 261, № 15. – P. 6640-6642.
74.Barnard E.A., Skolnick P., Olsen R.W. Subtypes of gamma-aminobutyric acid (A) receptors: classification on the basis of subunit structure and receptor function // Pharmacological Reviews. – 1998. - № 50. – Р. 291-313.
75.Basta-Kaim A., Budziszewska B., Jaworska-Feil L., Tetich M., Leskiewicz M., Kubera M., Lason W. Chlorpromazine inhibits the glucocorticoid receptor-mediated gene transcription in a calcium-dependent manner // Neuropharmacology. – 2002. – V. 43, № 6. – Р. 1035-1043.
76.Beatty D.M., Morris S.J., Chronwall B.M. Heterogeneity in POMC expression among explanted melanotropes decreases with time in culture and bromocriptine treatment // Peptides. – 1998. – V. 19, № 4. – Р. 659-665.
77.Berkovich A., McPhie P., Campagnone M., Guidotti A., Hensley P. A natural processing product of rat diazepam binding inhibitor, triakontatetraneuropeptide (diazepam binding inhibitor 17-50) contains an alpha-helix, which allows discrimination between benzodiazepine binding site subtypes // Mol. Pharmacol. – 1990. – V. 37, № 2. – Р. 164-172.
78.Berrettini W.H., Rubinow D.R., Nurnberger J.I. Jr., Simmons-Alling S., Post R.M., Gershon E.S. CSF substance P immunoreactivity in affective disorders // Biol. Psychiatry. – 1985. – V. – 20, № 9. – Р. 965-970.
79.Binder E.B., Kinkead B., Owens M.J., Nemeroff1 C.B. Neurotensin and Dopamine Interactions // Pharmacological reviews. – 2001. – V. 53, № 4. – Р. 453-486.
80.Biologically active peptides: design, synthesis and utilization / W.V.Williams, D.B.Weiner, Eds. – Lancaster: Technomic, 1993. – 360 p.
81.Birch N.P., Rodriguez C., Dixon J.E., Mezey E. Distribution of carboxypeptidase H messenger RNA in rat brain using in situ hybridization histochemistry: implications for neuropeptide biosynthesis // Brain Res. Mol. Brain Res. – 1990. – V. 7, № 1. – P. 53-59.
82.Blanc D., Cupo A., Castanas E., Bourhim N., Giraud P., Bannon M.J., Eiden L.E. Influence of acute, subchronic and chronic treatment with neuroleptic (haloperidol) on enkephalins and their precursors in the striatum of rat brain // Neuropeptides. – 1985. – V. 5, № 4-6. – Р. 567-570.
83.Blasquez C., Jegou S., Feuilloley M., Rosier A., Vandesande F., Vaudry H. Visualization of gamma-aminobutyric acid A receptors on proopiomelanocortin-producing neurons in the rat hypothalamus // Endocrinology. – 1994. – V. 135, № 6. – Р. 2759-2764.
84.Blum A.I. Interactions of ligands with the opiate receptors of brain membrans regulations by ions and nucleotids // Proc. Nat. Acad. Sci. US. – 1978. – V.75. – P.1713-1717.
85.Bolden-Watson C., Watson M.A., Murray K.D., Isackson P.J., Richelson E. J. Haloperidol but not clozapine increases neurotensin receptor mRNA levels in rat substantia nigra // Neurochem. – 1993. – V. 61, № 3. – Р. 1141-1143.
86.Bondy C.A., Whitnall M.H., Brady L.S. Regulation of carboxypeptidase H gene expression in magnocellular neurons: response to osmotic stimulation // Mol. Endocrinol. – 1989. – V. 3, № 12. – P. 2086-2092.
87.Bormann J. Electrophysiological characterization of diazepam binding inhibitor (DBI) on GABAA receptors // Neuropharmacology. – 1991. – № 12B. – Р. 1387-1389.
88.Boudarine M., Yegorov O., Sterling-Dubrovsky A., Devi L.A., Berman Y. Developmental changes in opioid peptides and their receptors in Cpe(fat)/Cpe(fat) mice lacking peptide processing enzyme carboxypeptidase E // J. Pharmacol. Exp. Ther. – 2002. – V. 303, № 3. – Р. 1317-1324.
89.Bouras C., Schulz P., Constantinidis J., Tissot R. Differential effects of acute and chronic administration of haloperidol on substance P and enkephalins in diverse rat brain areas // Neuropsychobiology. – 1986. – V. 16, № 4. – Р. 169-174.
90.Bourgoin S., Artaud F., Cesselin F., Glowinski J., Hamon M. Local and remote effects of intra-caudate administration of GABA-related drugs on Met-enkephalin release in the basal ganglia // Brain. Res. – 1985. – V. 361, № 1-2. – Р. 361-372.
91.Bovolin P., Schlichting J., Miyata M., Ferrarese C., Guidotti A., Alho H. Distribution and characterization of diazepam binding inhibitor (DBI) in peripheral tissues of rat // Regul. Pept. – 1990. – V. 29, № 2-3. – Р. 267-281.
92.Breslin N.A., Suddath R.L., Bissette G., Nemeroff C.B., Lowrimore P., Weinberger D.R. CSF concentrations of neurotensin in schizophrenia: an investigation of clinical and biochemical correlates // Schizophr. Res. – 1994. – V. 12. – Р. 35-41.
93.Britton K.T., Akwa Y., Spina M.G., Koob G.F. Neuropeptide Y blocks anxiogenic-like behavioral action of corticotropin-releasing factor in an operant conflict test and elevated plus maze // Peptides. – 2000. – V. 21, № 1. – Р. 37-44.
94.Britton K.T., Southerland S. Naloxone blocks ‘anxiolytic’ effects of neuropeptide Y // Peptides. – 2001. – V. 22, № 4. – Р. 607-612.
95.Brodin E., Rosen A., Schott E., Brodin K. Effects of Sequential Removal of Rats from a Group Cage, and of Individual Housing of Rats, on Substance P, Cholecystokinin and Somatostatin Levels in the Periaqueductal Gray and Limbic Regions // NEUROPEPTIDES. – 1994. – V. 26, № 4. – Р. 253-260.
96.Burgi B., Lichtensteiger W., Schlumpf M. J Diazepam-binding inhibitor/acyl-CoA-binding protein mRNA and peripheral benzodiazepine receptor mRNA in endocrine and immune tissues after prenatal diazepam exposure of male and female rats // Endocrinol. – 2000. – V. 166, № 1. – Р. 163-171.
97.Caboche J., Vernier P., Rogard M., Besson M.J. Haloperidol increases PPE mRNA levels in the caudal part of the nucleus accumbens in the rat // Neuroreport. – 1993. – V. 4, № 5. – Р. 551-554.
98.Canonico P.L., Valdenegro C.A., Macleod R.M. The inhibition of phosphatidylinositol turnover: a possible postreceptor mechanism for the prolactin secretion-inhibiting effect of dopamine // Endocrinology. – 1983. – № 113. – Р. 7–14.
99.Carter R.B. Differentiating Analgesic and Non-Analgesic Drug Activities on Rat Hot Plate - Effect of Behavioral End-Point // PAIN. – 1991. – V. 47, № 2. – Р. 211-220.
100. Cavallaro S., Korneyev A., Guidotti A., Costa E. Diazepam binding inhibitor (DBI) – processing product, acting at the mitochondrial DBI receptor, mediate adrenocorticotropic hormone-induced steroidogenesis in rat adrenal gland // Proc. Nat. Acad. Sci. USA. – 1992. – V. 89, № 22. – P. 10598-10602.
101. Cavallotti C., Frati A., Cavallotti D., Tranquilli Leali F.M. Dopaminergic receptors in rat dura mater: pharmacological characteristics // Clin. Exp. Pharmacol. Physiol. – 2004. – V. 31, № 3. – Р. 190-194.
102. Che F.Y., Yan L., Li H., Mzhavia N., Devi L.A., Fricker L.D. Identification of peptides from brain and pituitary of Cpe(fat)/Cpe(fat) mice // Proc. Natl. Acad. Sci. USA. – 2001. – V. 98, № 17. – Р. 9971-9976.
103. Chen C.L., Dionne F.T., Roberts J.L. Regulation of the pro-opiomelanocortin mRNA levels in rat pituitary by dopaminergic compounds // Proc. Natl. Acad. Sci. USA. – 1983. – V. 80, № 8. – Р. 2211-2215.
104. Chesselet M.F., Hook V.Y. Carboxypeptidase H-like immunoreactivity in the striatum of cats and monkeys // Regul. Pept. – 1988. – V. 20, № 2. – P. 151-159.
105. Chowdrey H.S., Larsen P.J., Harbuz M.S., Lightman S.L., Jessop D.S. Endogenous substance P inhibits the expression of corticotropin-releasing hormone during a chronic inflammatory stress // Life Sci. - 1995. – V. 57, № 22. – Р. 2021-2029.
106. Chretien M., Seidah N.G. Precursor polyproteins in endocrine and neuroendo-crine systems // Int. J. Peptide Protein Res. – 1984. – N 23. – P. 335-341.
107. Christopoulos A. Allosteric binding sites on cell-surface receptors: Novel target for drug discovery // Nat. Rev. Drug. Discov. – 2002. – V. 1. – P. 198–210.
108. Compere V., Li S., Leprince J., Tonon M.C., Vaudry H., Pelletier G. Effect of intracerebroventricular administration of the octadecaneuropeptide on the expression of pro-opiomelanocortin, neuropeptide Y and corticotropin-releasing hormone mRNAs in rat hypothalamus // J. Neuroendocrinol. – 2003. – V. 15, № 2. – Р. 197-203.
109. Compere V., Li S., Leprince J., Tonon M.C., Vaudry H., Pelletier G. In vivo action of a new octadecaneuropeptide (ODN) antagonist on gonadotropin-releasing hormone gene expression in the male rat brain // Neuroscience. – 2004. – V. 125, № 2. – Р. 411-415.
110. Cool D.R., Normant E., Shen F.S., Chen H.C., Pannell L., Zhang Y., Loh Y.P. Carboxypeptidase E is a regulated secretory pathway sorting receptor: genetic obliteration leads to endocrine disorders in Cpe(Fat) mice // Cell. – 1997. – V. 88, № 1. P. 73-83.
111. Copland A.M., Balfour D.J. The effects of diazepam on brain 5-HT and 5-HIAA in stressed and unstressed rats // Pharmacol. Biochem. Behav. – 1987. – № 27. – Р. 619-624.
112. Corda M.G., Ferrari M., Guidotti A., Konkel D., Costa E. Isolation, purification and partial sequence of a neuropeptide (diazepam-binding inhibitor) precursor of an anxiogenic putative ligand for benzodiazepine recognition site // Neurosci. Lett. – 1984. – № 47. – Р. 310-324.
113. Costa E., Guidotti A. Diazepam binding inhibitor (DBI): - a peptide with multiple biological actions // Life Sci. – 1991. – V. 49, № 5. – P. 325-344.
114. Davidson H.W., Hutton J.C. The insulin-secretory-granule carboxypeptidase H. Purification and demonstration of involvement in proinsulin processing // Biochem. J. – 1987. – V. 245, № 2. – P. 575-582.
115. De Gandarias J.M., Ramirez M., Zulaica J., Casis L. Aminopeptidase (arylamidase) activity in discrete areas of the rat brain: sex differences // Horm. Metab. Res. – 1989. – V. 5, № 21. – P. 285-286.
116. De Saint-Vis B., Cupillard L., Pandrau-Garcia D., Ho S., Renard N., Grouard G., Duvert V., Thomas X., Galizzi J., Banchereau J. et al. Distribution of carboxypeptidase M on lymphoid and myeloid cells parallels the other zinc-dependent proteases CD10 and CD13. // Blood – 1995. – V. 86, № 3. – Р. 1098-1105.
117. Decker K.P., Roy-Byrne P.P., Merchant K.M. Effect of muscimol on haloperidol-induced alteration of neurotensin gene expression in the striatum and nucleus accumbens in the rat // Brain. Res. – 1995. – V. 691, № 1-2. – Р. 9-17.
118. Deddish P.A., Skidgel R.A., Kriho V.B., Li X.Y., Becker R.P., Erdos E.G. Carboxypeptidase M in Madin-Darby canine kidney cells. Evidence that carboxypeptidase M has a phosphatidylinositol glycan anchor // J. Biol. Chem. – 1990. – V. 265, № 25. – P. 15083-15089.
119. Delfs J.M., Yu L., Ellison G.D., Reisine T., Chesselet M.F. Regulation of mu-opioid receptor mRNA in rat globus pallidus: effects of enkephalin increases induced by short- and long-term haloperidol administration // J. Neurochem. – 1994. – V. 63, № 2. – Р. 777-780.
120. De Wied D., Sigling H.O. Neuropeptides involved in the pathophysiology of schizophrenia and major depression // Neurotox. Res. – 2002. – V. 4, № 5-6. – Р. 453-468.
121. Doble A. New insights into the mechanism of action of hypnotics // Journal of Psychopharmacology. – 1999. – V. 13, № 1. – Р. 11-20.
122. Dochetry K., Hutton J.C. Carboxypeptidase activity in the insulin secretory granule // FEBS Lett. – 1983. – V. 162, № 1. – P. 137-141.
123. Dong E., Matsumoto K., Watanabe H. Diazepam binding inhibitor (DBI) reduces testosterone and estradiol levels in vivo // Life Sci. – 2002. – V. 70, № 11. – Р. 1317-1323.
124. Do-Rego J.L., Mensah-Nyagan A.G., Beaujean D., Leprince J., Tonon M.C., Luu-The V., Pelletier G., Vaudry H. The octadecaneuropeptide ODN stimulates neurosteroid biosynthesis through activation of central-type benzodiazepine receptors // J. Neurochem. – 2001. – V. 76, № 1. – Р. 128-138.
125. Duka T., Wuster M., Herz A. Rapid changes in enkephalin levels in rat striatum and hypothalamus induced by diazepam // Naunyn. Schmiedebergs. Arch. Pharmacol. – 1979. – V. 309, № 1. – Р. 1-5.
126. Ebner K., Rupniak N.М., Saria A., Singewald N. Substance P in the medial amygdala: Emotional stress-sensitive release and modulation of anxiety-related behavior in rats // PNAS. – 2004. – V. 101, № 12. – Р. 4280-4285.
127. Eipper B.A, Green C.B, Mains R.E. Expression of prohormone processing enzymes in neuroendocrine and non neuroendocrine cells // Monogr. Natl. Cancer. Inst. – 1992. – № 13, P. 163-168.
128. Fan X., Olson S.J., Johnson M.D. Immunohistochemical localization and comparison of carboxypeptidases D, E and Z,  -MSH, ACTH and MIB-1 between human anterior and corticotroph cell “basophil invasion” of the posterior pituitary // J. Histochem. Cytochem. – 2001. – № 49. – Р. 783-790. -MSH, ACTH and MIB-1 between human anterior and corticotroph cell “basophil invasion” of the posterior pituitary // J. Histochem. Cytochem. – 2001. – № 49. – Р. 783-790.
129. Farah J.M., Malcolm D.S., Mueller G.P. Dopaminergic inhibition of pituitary beta-endorphin-like immunoreactivity secretion in the rat // Endocrinology. – 1982. – V. 110, № 2. – Р. 657-659.
130. Fass D.M., Takimoto K., Mains R.E., Levitan E.S. Tonic Dopamine Inhibition of L-Type Ca2+ Channel Activity Reduces 1D Ca2+ Channel Gene Expression // The Journal of Neuroscience. – 1999. – V. 19, № 9. – Р. 3345-3352.
131. Ferrarese C., Mennini T., Pecora N., Pierpaoli C., Frigo M., Marzorati C., Gobbi M., Bizzi A., Codegoni A., Garattini S., Frattola L. Diazepam binding inhibitor (DBI) increases after acute stress in rat // Neuropharmacology. – 1991. – № 30. – Р. 1445-1452.
132. Ferrarese C., Vaccarino F., Alho H., Mellstrom B., Costa E., Guidotti A. Subcellular location and neuronal release of diazepam binding inhibitor // J. Neurochem. – 1987. – V. 48, № 4. – Р. 1093-1102.
133. Ferrero P., Costa E., Conti-Tronconi B., Guidotti A. A diazepam binding inhibitor (DBI)-like neuropeptide is detected in human brain // Brain. Res. – 1986. – V. 399, № 1. – Р. 136-142.
134. Fiedorek F.T., Parkinson D. Carboxypeptidase H processing and secretion in rat clonal beta-cell lines // Endocrinology. – 1992. –V. 131, № 3. – P. 1054-1062.
135. Fox C.A., Mansour A., Watson S.J. The effects of haloperidol on dopamine receptor gene expression // Jr. Exp. Neurol. – 1994. – V. 130, № 2. – Р. 288-303.
136. Fricker L.D. Activation and membrane binding of carboxypeptidase E // J. Cell. Biochem. – 1988. – № 38. – P. 279-289.
137. Fricker L.D. Carboxypeptidase E // Ann. Rev. Physiol. – 1988. – № 50. – P. 309-321.
138. Fricker L.D., Adelman J.P., Douglass J., Thompson R.C., Strandmann R.P., Hutton J. Isolation and sequence analysis of cDNA for rat carboxypeptidase E [EC 3.4.17.10], a neuropeptide processing enzyme // Mol. Endocrinol. – 1989. – V. 3, № 4. – P. 666-673.
139. Fricker L.D., Berman Y.L., Leiter E.H., Devi L.A. Carboxypeptidase E activity is deficient in mice with the fat mutation. Effect on peptide processing // J. Biol. Chem. – 1996. – V. 271, № 48. – Р. 30619-30624.
140. Fricker L.D., Das B., Angeletti R.H. Identification of the pH-dependent membrane anchor of carboxypeptidase E (EC 3.4.17.10) // J. Biol. Chem. – 1990. – V. 265, № 5. – P. 2476-2482.
141. Fricker L.D., Das B., Klein R.S., Greene D., Jung Y.K. Regulation of carboxypeptidase E (enkephalin convertase) // NIDA Res. Monogr. – 1991. – № 111. – P. 171-187.
142. Fricker L.D., Devi L. Comparison of a spectrophotometric, a fluorometric, and a novel radiometric assay for carboxypeptidase E (EC 3.4.17.10) and other carboxypeptidase B-like enzymes // Anal. Biochem. – 1990. – V. 184, № 1. – Р. 21-27.
143. Fricker L.D., Herwert E. Comparision of a carboxypeptidase E-like enzyme in human, mouse, Xenopus, shark and Aplysia neural tissue // Brain Res. – 1988. – V. 453, № 1-2. – P. 281-286.
144. Fricker L.D., Plummer T.H.Jr., Snyder S.H. Enkephalin convertase: potent, selective and irreversible inhibitors // Biochem. Biophys. Res. Commun. – 1983. – V. 11, № 3. – P. 994-1000.
145. Fricker L.D., Reaves B.J., Das B., Dannies P.S. Comparison of the regulation of carboxypeptidase E and prolactin in GH4
C1 cells, a rat pituitary cell line // Neuroendocrinology. – 1990. – V. 51, № 6. – P. 658-663.
146. Fricker L.D., Rigual R.J., Diliberto E.J.Jr., Viveros O.H. Reflex splanchnic nerve stimulation increases levels of carboxypeptidase E mRNA and enzy-matic activity in the rat adrenal medulla // J. Neurochem. – 1990. – V. 55, N 2. – P. 461-467.
147. Fricker L.D., Snyder S.H. Enkephalin convertase: purification and charasterization of a specific enkephalin-synthesizing carboxypeptidase localized to adrenall chromaffin granules // Proc. Natl. Acad. Sci. USA. – 1982. – № 79. – P. 3886-3890.
148. Fricker L.D., Snyder S.H. Purification and characterization of enkephalin convertase, an enkephaline-synthesizing carboxypeptidase // J. Biol. Chem. – 1983. – V. 258, № 18. – P. 10950-10955.
149. Fricker L.D., Supattapone S., Snyder S.H. Enkephalin convertase: a specific enkephalin synthesizing carboxypeptidase in adrenal chromaffin granules, brain and pituitary gland // Life Sci. – 1982. – № 31. – P. 1841- 1844.
150. Gandolfo P., Patte C., Thoumas J.L., Leprince J., Vaudry H., Tonon M.C. The endozepine ODN stimulates [3H]thymidine incorporation in cultured rat astrocytes // Neuropharmacology. – 1999. – V. 38, № 5. – Р. 725-732.
151. Garcia de Yebenes E., Li S., Pelletier G. Regulation of proopiomelanocortin gene expression by endogenous ligands of the GABAA receptor complex as evaluated by in situ hybridization in the rat pars intermedia // Brain. Res. – 1997. – V. 750, № 1-2. – Р. 277-284.
152. Gavish M., Bachman I., Shoukrun R., Katz Y., Veenman L., Weisinger G., Weizman A. Enigma of the Peripheral Benzodiazepine Receptor // PHARMACOLOGICAL REVIEWS. – 1999. – V. 51, № 4. – Р. 629-650.
153. George S.R., Kertesz M. Dopamine receptors regulate Met-enkephalin content in pituitary // Brain. Res. – 1985. – V. 334, № 1. – Р. 187-189.
154. George S.R., Kertesz M. Met-enkephalin concentrations in striatum respond reciprocally to alterations in dopamine neurotransmission // Peptides. – 1987. – V. 8, № 3. – Р. 487-492.
155. Givalois L., Grinevich V., Li S., Garcia-De-Yebenes E., Pelletier G. The octadecaneuropeptide-induced response of corticotropin-releasing hormone messenger RNA levels is mediated by GABA(A) receptors and modulated by endogenous steroids // Neuroscience. – 1998. – V. 85, № 2. – Р. 557-567.
156. Givalois L., Li S., Pelletier G. Differential involvement of adrenal and gonadal steroids in anterior and intermediate pituitary pro-opiomelanocortin mRNA expression induced by the endogenous benzodiazepine, octadecaneuropeptide, in adult male rats // J. Endocrinol. – 1999. – V. 161, № 2. – Р. 307-316.
157. Gregg D., Goedken E., Gaikin M., Wendell D., Gorski J. Decreased expression of carboxypeptidase E protein is correlated to estrogen-induction of rat pituitary tumors // Mol. Cell. Endocrinol. – 1996. – V. 117, N 2. – P. 219-225.
158. Grigoriants O., Devi L., Fricker L.D. Dopamine antagonist haloperidol increases carboxypeptidase E mRNA in rat neurointermediate pituitary but not in various other rat tissues. // Molecular brain research. – 1993. – V. 19, № 1-2. – Р. 161-164.
159. Guest P.C., Arden S.D., Rutherford N.G., Hutton J.C. The posttranslational processing and intracellular sorting of carboxypeptidase H in the islets of Langerhans // Mol. Cell. Endocrinol. – 1995. – 113, № 1, P. 99-108.
160. Guest P.C., Ravazzola M., Davidson H.W., Orci L., Hutton J.C. Molecular heterogeneity and cellular localization of carboxypeptidase H in the islets of Langerhans // Endocrinology. – 1991. – V. 129, № 2. – P. 734-740.
161. Guest P.C., Rhodes C.J., Hutton J.C. Regulation of the biosynthesis of insulin secretory granule proteins. Coordinate translational control is exerted on some, but not all, granule К. matrix constituents // Biochem. J. – 1989. – 257, № 2. – P. 431-437.
162. Guimaraes V.M., Zuardi A.W., Del Bel E.A., Guimaraes F.S. Cannabidiol increases Fos expression in the nucleus accumbens but not in the dorsal striatum // Life Sci. – 2004. – V. 75, № 5. – Р. 633-638.
163. Haefely W.E. Central action of benzodiazepines: general introduction // British Journal of Psychiatry. – 1978. – № 133. – Р. 231-238.
164. Hagino Y., Okuwa M., Moroji T. Effects of ceruletide and haloperidol on the hypothalamo-pituitary beta-endorphin system and brain beta-endorphin catchword in the rat: with special reference to effects of ceruletide in chronically haloperidol-treated rats // Neuropeptides. – 1991. – V. 18, № 1. – Р. 1-14.
165. Ham J., Smyth D.G. Beta-endorphin processing in pituitary and brain is sensitive to haloperidol stimulation // Neuropeptides. – 1985. – V. 5, № 4-6. – Р. 497-500.
166. Harmar A. J. Neuropeptides // Transm. Mol. In the brain. – 1987. – N 2. – P. 17-26.
167. Heimer L., Alheid G.F., Zaborsky L. Basal ganglia / Paxinos G, ed // The rat nervous system, V. 1, Forebrain and midbrain. – New York, 1985. – Р. 37-86.
168. Herman Z.S., Huzarska M., Kmieciak-Kolada K., Kowalski J. Chronic treatment with chlorpromazine, thioridazine or haloperidol increases striatal enkephalins and their release from rat brain // Psychopharmacology (Berl). – 1991. – V. 104, № 1. – Р. 106-112.
169. Herpfer I, Lieb K. Substance P and Substance P receptor antagonists in the pathogenesis and treatment of affective disorders // World J. Biol. Psychiatry. – 2003. – V. 4, № 2. – P. 56-63.
170. Holloway C.D., Kenyon C.J., Dowie L.J., Corrie J.E., Gray C.E., Fraser R. Effect of the benzodiazepines diazepam, des-N-methyldiazepam and midazolam on corticosteroid biosynthesis in bovine adrenocortical cells in vitro: Location of site of action // J. Steroid. Biochem. – 1989. – № 33. – Р. 219-225.
171. Hollt V., Bergmann M. Effects of acute and chronic haloperidol treatment on the concentrations of immunoreactive beta-endorphin in plasma, pituitary and brain of rats // Neuropharmacology. – 1982. – V. 21, № 2. – Р. 147-154.
172. Hollt V., Haarmann I., Seizinger B.R., Herz A. Chronic haloperidol treatment increases the level of in vitro translatable messenger ribonucleic acid coding for the beta-endorphin/adrenocorticotropin precursor proopiomelanocortin in the pars intermedia of the rat pituitary // Endocrinology. – 1982. – V. 110, № 6. – Р. 1885-1891.
173. Holmes A., Heilig M., Rupniak N.M., Steckler T., Griebel G. Neuropeptide systems as novel therapeutic targets for depression and anxiety disorders // Trends. Pharmacol. Sci. – 2003. – V. 24, № 11. – Р. 580-588.
174. Holsboer F. The role of peptides in treatment of psychiatric disorders // J. Neural. Transm. Suppl. – 2003. – V. 64. – P. 17-34.
175. Hook V.Y.H. Carboxypeptidase B-like activity for the processing of enkephalin precursors in the membrane component of bovine adrenomedullary chromaffin granules // Neuropeptides. – 1984. – V. 4, № 2. – P. 117-126.
176. Hook V.Y.H., Affolter H.U. Identification of zymogen and mature forms of human carboxypeptidase H. A processing enzyme for the synthesis of peptide hormones // FEBS Lett. – 1988. –V. 238, № 2. – P. 338-342.
177. Hook V.Y.H., Affolter H.U., Palkovits M. Carboxypeptidase H in the hypothalamo-neurohypophysal system: evidence for processing of a prohormone-processing enzyme during axonal transport // J. Neurosci. – 1990. – V. 10, № 10. – P. 3219-3226.
178. Hook V.Y.H., Eiden L.E. (Met)-enkephalin and carboxypeptidase processing enzyme are co-released from chromaffin cells by cholinergic stimulation // Biochem. Biophys. Res. Commun. – 1985. – № 128. – P. 563-570.
179. Hook V.Y.H., Eiden L.E. Two peptidases that convert 125
J-Lys-Arg-(Met)-enkephalin and 125
J-enkephalin-Arg6
, respectively, to 125
J-(Met)-enkephalin in bovine adrenal medullary chromaffin granules // FEBS Lett – 1984. – V. 172, № 2. – P. 212-218.
180. Hook V.Y.H., LaGamma E.F. Product inhibit of carboxypeptidase H // J. Biol. Chem. – 1987. – V. 262, № 26. – P. 12583-12588.
181. Hook V.Y.H., Loh Y.P. Carboxypeptidase B-like converting enzyme activity in secretory granules of rat pituitary // Proc. Natl. Acad. Sci. USA. – 1984. – N 81. – P. 2776-2780.
182. Hooper N.M. Angiotensin converting enzyme: implications from molecular biology for its physiological functions // Int. J. Biochem. – 1991. – V. 23, № 7-8. – P. 641-647.
183. Houdi A.A., Van Loon G.R. Haloperidol-induced increase in striatal concentration of the tripeptide, Tyr-Gly-Gly, provides an index of increased enkephalin release in vivo // J. Neurochem. – 1990. – V. 54, № 4. – Р. 1360-1366.
184. Hsueh W.A. Proteases in hormon production and metabolism // Int. Symp. “Proteases: Potent Role in Health and Disease” (Wursburg, 1982): Proc. – New York, London, 1984. – P. 141-151
185. Inoue A., Seto M., Sugita S., Hide I., Hirose T., Koga N., Kikuchi T., Nakata Y. Differential effects on D2 dopamine receptor and prolactin gene expression by haloperidol and aripiprazole in the rat pituitary // Brain. Res. Mol. Brain. Res. – 1998. – V. 55, № 2. – Р. 285-292.
186. Irminger J.C., Verchere C.B., Halban P.A. Carboxypeptidase E is not a sorting receptor for proinsulin // Mol. Biol. Cell. – 1997. – № 8. – P. 1786-1786.
187. Jaber M., Tison F., Fournier M., Bloch B. Differential influence of haloperidol and sulpiride on dopamine-receptors and peptide messenger-RNA levels in the rat striatum and pituitary // Brain. Res. Mol. Brain Res. – 1994. – V. 23, № 1-2. – P. 14-20.
188. Jacobi J.M., Lloyd H.M., Meares J.D. Nuclear diameter in the anterior pituitary gland of the rat: effects of estrogen, bromocriptine, and haloperidol // J. Histochem. Cytochem. – 1982. – V. 30, № 7. – Р. 677-681.
189. Johansson G.B., Skidgel R.A. Carboxypeptidase M (cpm) converts epidermal growthfactor (EGF) to Des-Arg53-EGF // FASEB J. – 1994. – V. 8, № 5. – P. 930-935.
190. Jung Y.K., Kunczt C.J., Pearson R.K., Dixon J.E., Fricker L.D. Structural characterization of the rat carboxypeptidase-E gene // Mol. Endocrinol. – 1991. – V. 5, № 9. – Р. 1257-1268.
191. Jung Y.K., Kunczt C.J., Pearson R.K., Fricker L.D., Dixon J.E. Expression of the rat carboxypeptidase-E gene in neuroendocrine and nonneuroendocrine cell lines // Mol. Endocrinol. – 1992. – V. 6, № 12. – P. 2027-2037.
192. Katsura M., Mohri Y., Shuto K., Tsujimura A., Ukai M., Ohkuma S. Psychological stress, but not physical stress, causes increase in diazepam binding inhibitor (DBI) mRNA expression in mouse brains // Brain. Res. Mol. Brain. Res. – 2002. – V. 104, № 1. – Р. 103-109.
193. Khalil R.H., Soliman M.R. Diazepam alters caffeine-induced effects on beta-endorphin levels in specific rat brain regions // Life Sci. – 1997. – V. 61, № 25. – Р. 2485-2490.
194. Khan R.M., Soliman M.R. Effects of benzodiazepine agonist, antagonist and inverse agonist on ethanol-induced changes in beta-endorphin levels in specific rat brain regions // Pharmacology. – 1993. – V. 47, № 6. – Р. 337-343.
195. Kilpatrick D.L., Howells R.D., Noe M., Bailey L.C., Udenfriend S. Expression of preproenkephalin-like mRNA and its peptide products in mammalian testis and ovary // Proc. Natl. Acad. Sci. USA. – 1985. – V. 82, № 21. – Р. 7467-7469.
196. Khanna A.S., Waisman D.M. Metabolism and intracellular proces¬sing of pro-tein hormones // Hormon. Act. – 1988. – N 1. – P. 117-132.
197. Klein R.S., Das B., Fricker L.D. Secretion of carboxypeptidase E from cultured astrocytes and from AtT-20 cells, a neuroendocrine cell line: implications for neuropeptide biosynthesis // J. Neurochem. – 1992 – V. 58, № 6. – P. 2011-2018.
198. Klein R.S., Fricker L.D. Heterogeneous expression of carboxypeptidase E and proenkephalin mRNAs by cultured astrocytes // Brain. Res. – 1992. – V. 569, № 2. – Р. 300-310.
199. Konkoy C.S., Oakes M.G., Davis T.P. Chronic treatment with neuroleptics alters neutral endopeptidase 24.11 activity in rat brain regions // Peptides. – 1993. – V. 14, № 5. – Р. 1017-1020.
200. Konkoy C.S., Waters S.M., Davis T.P. Subchronic haloperidol administration decreases aminopeptidase N activity and [Met5]enkephalin metabolism in rat striatum and cortex // Eur. J. Pharmacol. – 1996. – V. 297, № 1-2. – Р. 47-51.
201. Krieger D.T. Brain peptides: what, where, and why? // Science. – 1983. – V. 222, № 4627. – P. 971-985.
202. Krueger K.E., Papadopoulos V. Peripheral-type benzodiazepine receptors mediate translocation of cholesterol from outer to inner mitochondrial membranes in adrenocortical cells // J. Biol. Chem. – 1990. – № 265. – Р. 15015-15022.
203. Lacourse K.A., Friis-Hansen L., Samuelson L.C., Rehfeld J.F. Altered processing of procholecystokinin in carboxypeptidase E-deficient fat mice: differential synthesis in neurons and endocrine cells // FEBS Lett. – 1998. – V. 436, № 1. – Р. 61-66.
204. Laslop A., Tschernitz C. Effects of nerve growth factor on the biosynthesis of chromogranin A and B, secretogranin II and carboxypeptidase H in rat PC12 cells // Neuroscience. – 1992. – V. 49, N 2. – P. 443-450.
205. Law A.J., Hutchinson L.J., Burnet P.W., Harrison P.J. Antipsychotics increase microtubule-associated protein 2 mRNA but not spinophilin mRNA in rat hippocampus and cortex. // J. Neurosci. Res. – 2004. – V. 76, № 3. – Р. 376-382.
206. Leprince J., Oulyadi H., Vaudry D., Masmoudi O., Gandolfo P., Patte C., Costentin J., Fauchere J.L., Davoust D., Vaudry H., Tonon M.C. Synthesis, conformational analysis and biological activity of cyclic analogs of the octadecaneuropeptide ODN. Design of a potent endozepine antagonist // Eur. J. Biochem. – 2001. – V. 268, № 23. – Р. 6045-6057.
207. Li S., Givalois L., Pelletier G. Involvement of neurosteroids in the effect of the endogenous benzodiazepine receptor ligand octadecaneuropeptide (ODN) on gonadotropin-releasing hormone gene expression in rat brain // J. Neuroendocrinol. – 1997. – V. 9, № 3. – Р. 229-233.
208. Li S., Pelletier G. Dopamine regulation of gonadotropin-releasing hormone (GnRH) gene expression in the female rat brain // Neurosci. Lett. – 1992. – V. 146, № 2. – Р. 207-210.
209. Lihrmann I., Plaquevent J.C., Tostivint H., Raijmakers R., Tonon M.C., Conlon J.M., Vaudry H. Frog Diazepam-Binding Inhibitor - Peptide Sequence, cDNA Cloning, and Expression in the Brain // Proceedings of the national academy of sciences of the USA. – 1994. – V. 91, № 15. – Р. 6899-6903.
210. Lindefors N. Amphetamine and haloperidol modulate preprotachykinin A mRNA expression in rat nucleus accumbens and caudate-putamen // Brain. Res. Mol. Brain. Res. – 1992. – V. 13, № 1-2. Р. 151-154.
211. Llorens-Cortes C., Zini S., Gros C., Schwartz J.C. Dopaminergic regulation of enkephalin release // J. Neurochem. – 1991. – V. 56, № 4. – Р 1368-1375.
212. Loeffler J.P., Demeneix B.A., Kley N.A., Hollt V. Dopamine inhibition of proopiomelanocortin gene expression in the intermediate lobe of the pituitary. Interactions with corticotropin-releasing factor and the beta-adrenergic receptors and the adenylate cyclase system // Neuroendocrinology. – 1988. – V. 47, № 2. – Р. 95-101.
213. Loeffler J.P., Demeneix B.A., Pittius C.W., Kley N., Haegele K.D., Hollt V. GABA differentially regulates the gene expression of proopiomelanocortin in rat intermediate and anterior pituitary // Peptides. – 1986. – V. 7, № 2. – Р. 253-258.
214. Loeffler J.P., Kley N., Pittius C.W., Almeida O.F., Hollt V. In vivo and in vitro studies of GABAergic inhibition of prolactin biosynthesis // Neuroendocrinology. – 1986. – V. 43, № 4. – Р. 504-510.
215. Loh Y.P., Birch N.P., Castro M.G. Pro-opiomelanocortin and pro-vasopressin converting enzyme in pituitary secretory vesicles // Biochimie. – 1988 . – V. 70, № 1. – P. 11-16.
216. Loh Y.P., Snell C.R., Cool D.R. Receptor mediated targeting of hormones to secretory granules, role of carboxypeptidase E // Trends Endocrinol. Met. – 1997. – V. 8, № 4. P. 130-137.
217. Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. – 1951. – V. 193, № 1. – P. 265-275.
218. Luddens H., Korpi E.R. Biological function of GABAA/benzodiazepine receptor heterogeneity // J. Psychiatr. Res. – 1995. – V. 29, № 2. – P. 77-79.
219. Lynch D.R., Braas K.M., Hutton J.C., Snyder S.H. Carboxypeptidase E (CPE) immunocytochemical localization in the rat central nervous system and pituitary gland // J. Neurosci. – 1990. – V. 10, № 5. – P. 1592-1599.
220. Lynch D.R., Venable J.C., Snyder S.H. Enkephalin convertase in the heart: similar disposition to atrial natriuretic factor // Endocrinology. – 1990. – V. 122, № 6. – P. 2683-2691.
221. MacCumber M.W., Snyder S.H., Ross C.A. Carboxypeptidase E (enkephalin convertase): mRNA distribution in rat brain by in situ hybridization // J. Neurosci. – 1990. – V. 10, № 8. – P. 2850-2860.
222. Maddalena D.J., Johnston G.A. Prediction of receptor peoperties and binding affinity of ligands to benzodiazepine-GABAA receptors using artiticial neural networks // J. Med. Chem. – 1995. – V. 38, № 4. – P. 715-724.
223. Mains R.E., Eipper B.A. Secretion and regulation of two biosyntetic enzyme activities, peptidyl-glycine a-amidating monooxygenase and a carboxypeptidase, by mouse pituitary corticotropic tumor cells // Endocrinology. – 1984. – V. 115, N 5. – P. 1683-1690.
224. Mannisto P.T., Laakso M.L., Jarvinen A., Rago L. Effects of Central and Peripheral Type Benzodiazepine Ligands on Growth-Hormone and Gonadotropin-Secretion in Male-Rats // Pharmacology s toxicology. – 1992. – V. 71, № 1. – Р. 75-80.
225. Manser E., Fernandez D., Loo L., Goh P.Y., Monfries C., Hall C., Lim L. Human carboxypeptidase E. Isolation and characterization of the cDNA, sequence conservation, expression and processing in vitro // Biochem. J. – 1990. – V. 267, № 2. – P. 517-525.
226. Marcus M.M., Nomikos G.G., Malmerfelt A., Zachrisson O., Lindefors N., Svensson T.H. Effect of chronic antipsychotic drug treatment on preprosomatostatin and preprotachykinin A mRNA levels in the medial prefrontal cortex, the nucleus accumbens and the caudate putamen of the rat // Brain. Res. Mol. Brain. Res. – 1997. – V. 45, № 2. – Р. 275-282.
227. Marksteiner J., Saria A., Miller C.H., Krause J.E. Differential increases of neurokinin B- and enkephalin-like immunoreactivities and their mRNAs after chronic haloperidol treatment in the rat // Neurosci Lett. – 1992. – V. 148, № 1-2. – Р. 55-59.
228. Matsumoto Y., Okamura H., Ichitani Y., Yanaihara N., Nakajima T., Ibata Y. Immunocytochemical Survey of Haloperidol-Induced Immunoreactive Changes of (Met)Enkephalin-Arg6
-Gly7
-Leu8
in the Rat Forebrain // Brain research bulletin. – 1992. – V. 28, № 5. – Р. 683-695.
229. Meador-Woodruff J.H., Pellerito B., Bronstein D., Lin H.L., Ling N., Akil H. Differential effects of haloperidol on the rat pituitary: decreased biosynthesis, processing and release of anterior lobe pro-opiomelanocortin // Neuroendocrinology. – 1990. – V. 51, № 3. – Р. 294-303.
230. Merchant K.M. c-fos antisense oligonucleotide specifically attenuates haloperidol-induced increases in neurotensin/neuromedin N mRNA expression in rat dorsal striatum // Mol. Cell. Neurosci. – 1994. – V. 5, № 4. – Р. 336-344.
231. Merchant K.M., Dobner P.R., Dorsa D.M. Differential effects of haloperidol and clozapine on neurotensin gene transcription in rat neostriatum // J. Neurosci. – 1992. – V. 12, № 2. – Р. 652-663.
232. Merchant K.M., Miller M.A. Coexpression of neurotensin and c-fos mRNAs in rat neostriatal neurons following acute haloperidol // Brain. Res. Mol. Brain. Res. – 1994. – V. 23, № 3. – Р. 271-277.
233. Merchant K.M., Miller M.A., Ashleigh E.A., Dorsa D.M. Haloperidol rapidly increases the number of neurotensin mRNA-expressing neurons in neostriatum of the rat brain // Brain. Res. – 1991. – V. 540, № 1-2. – Р. 311-314.
234. Mijnster M.J., Schotte A., Docter G.J., Voorn P. Effects of risperidone and haloperidol on tachykinin and opioid precursor peptide mRNA levels in the caudate-putamen and nucleus accumbens of the rat // Synapse. – 1998. – V. 28, № 4. – Р. 302-312.
235. Mikkelsen J.D. The KCNQ channel activator retigabine blocks haloperidol-induced c-Fos expression in the striatum of the rat // Neurosci. Lett. – 2004. – V. 362, № 3. – Р. 240-243.
236. Millington W.R., O’Donohue T.L., Mueller G.P. Dopaminergic agents selectively alter the post-translational processing of beta-endorphin in the intermediate pituitary of the rat // J. Pharmacol. Exp. Ther. – 1987. – V. 243, № 1. – Р. 160-170.
237. Mitchell V., Beauvillain J.C., Mazzuca M. GABAergic afferents modulate proenkephalin mRNA expression in the guinea pig hypothalamic magnocellular dorsal nucleus // Neurosci. Lett. – 1992. – V. 144, № 1-2. – Р. 189-194.
238. Morl F., Groschel M., Leemhuis J., Meyer D.K. Intrinsic GABA neurons inhibit proenkephalin gene expression in slice cultures of rat neostriatum // Eur. J. Neurosci. – 2002. – V. 15, № 7. – Р. 1115-1124.
239. Morris B., Hollt V., Herz A. Dopaminergic regulation of striatal proenkephalin mRNA and prodynorphin mRNA: contrasting effects of D1
and D2
antagonists // Neuroscience. – 1988. – № 25. – Р. 525-532.
240. Morton D.B. The occurrence and function of proteolytic enzymes in the reproductive tract of mammals // Proteinases in Mammalian Cells and Tissue/Barrett A.J. (ed.). – Amsterdam: Elsevier/North Holland Biomedical Press, 1977. – P. 445-500.
241. Nagae A., Deddish P.A., Becker R.P., Anderson C.H., Abe M., Tan F., Skidgel R.A., Erdos E.G. Carboxypeptidase M in brain and peripheral nerves // J. Neurochem. – 1992. – V. 59, № 6. – P. 2201-2212.
242. Nalamachu S.R., Song L.X., Fricker L.D. Regulation of carboxypeptidase E – effect of Ca2+
on enzyme-activity and stability // J. Biol. Chem. – 1994. – 269, № 15. – P. 11192-11195.
243. Nemeroff C.B. Neurotensin: perchance an endogenous neuroleptic? // Biol. Psychiatry. – 1980. – V. 15. – Р. 283-302.
244. Nemeroff C.B., Kilts C.D., Levant B., Bissette G. Campbell-A Baldessarini-RJ Effects of the Isomers of N-Normal-Propylnorapomorphine and Haloperidol on Regional Concentrations of Neurotensin in Rat-Brain // Neuropsychopharmacology. – 1991. – V. 4, № 1. – Р. 27-33.
245. Nickells R.W., Schlamp C.L., Newton A.C., Williams D.S. Gene expression of the neuropeptide-processing enzyme carboxypeptidase E in rat photoreceptor cells // J. Neurochem. – 1993. – V. 61, № 5. –Р. 1891-1900.
246. Nillni E.A., Xie W., Mulcahy L., Sanchez V.C., Wetsel W.C. Deficiencies in pro-thyrotropin-releasing hormone processing and abnormalities in thermoregulation in Cpefat/fat mice // J. Biol. Chem. – 2002. – V. 277, № 50. – Р. 48587-48595.
247. Norenberg U., Richter D. Processing of the oxytocin precursor: isolation of an exopeptidase from neurosecretory granules of bovine pituitaries // Biochem. Biophys. Res. Commun. – 1988. – V. 156, № 2. – P. 898-904.
248. Novas M.L., Medina J.H., Calvo D., De Robertis E. Increase of peripheral type benzodiazepine binding sites in kidney and olfactory bulb in acutely stressed rats // Eur. J. Pharmacol. – 1987. – № 135. – Р. 243-246.
249. Nutt D.J., Malizia A.L. New insights into the role of the GABAA—benzodiazepine receptor in psychiatric disorder // The British Journal of Psychiatry. – 2001. – № 179. – Р. 390-396.
250. Obuchowicz E., Turchan J. Influence of typical and atypical antipsychotics on neuropeptide Y-like immunoreactivity and NPY mRNA expression in rat striatum // Neuropeptides. – 1998. – V. 32, № 5. – Р. 473-480.
251. Ortego J., Escribano J., Crabb J., Coca Prados M. Identification of a neuropeptide and neuropeptide processing enzymes in aqueous humor confers neuroendocrine features to the human ocular ciliary epithelium // J. Neurochem. – 1996. – V. 66, № 2. – P. 787-796.
252. Owens G.P., Sinha A.K., Sikela J.M., Hahn W.E. Sequence and expression of the murine diazepam binding inhibitor // Brain. Res. Mol. Brain. Res. – 1989. – V. 6, № 2-3. – Р. 101-108.
253. Oyarce A.M., Hand T.A., Mains R.E., Eipper B.A. Dopaminergic regulation of secretory granule associated proteins in rat intermediate pituitary // J. Neurochem. – 1996. – V. 67, № 1. – P. 229-241.
254. Parikh V., Terry A.V., Khan M.M., Mahadik S.P. Modulation of nerve growth factor and choline acetyltransferase expression in rat hippocampus after chronic exposure to haloperidol, risperidone, and olanzapine // Psychopharmacology (Berl). – 2004. – V. 172, № 4. – Р. 365-374.
255. Parkinson D. Carboxypeptidase H in bovine pituitary gland: soluble forms are not processed at the C-terminus // Mol. Cell. Endocrinol. – 1992. – V. 86, № 3. – P. 221-233.
256. Parlow J.L., Costache I., Avery N., Turner K. Single-dose haloperidol for the prophylaxis of postoperative nausea and vomiting after intrathecal morphine // Anesth. Analg. – 2004. – V. 98, № 4. – Р. 1072-1076.
257. Patterson T.A., Schulteins G., Alvarado M.C., Martinez J.L.-J.R., Bennet E.L., Rossenzweig M.R., Hruby V.Y. Influence of opioid peptides on learningand memory process in the chick // Behav.-Neurosci. – 1989. – V. 103, № 2. – P. 429-437.
258. Pelletier G. Regulation of proopiomelanocortin gene expression in rat brain and pituitary as studied by in situ hybridization // Ann NY Acad. Sci. – 1993. – № 680. – Р. 246-259.
259. Perloff M.D., Kream R.M., Beinfeld M.C. Reduced levels of substance P in the brains of Cpe(Fat)/Cpe(Fat) Mice // Peptides. – 1998. – V. 19, №6. – P. 1115-1117.
260. Persson H., Rehfeld J.F., Ericsson A., Schalling M., Pelto-Huikko M., Hökfelt T. Transient expression of the cholecystokinin gene in male germ cells and accumulation of the peptide in the acrosomal granule: possible role of cholecystokinin in fertilization // Proc. Natl. Acad. Sci. USA. – 1989. – V. 86, № 16. – P. 6166-6170.
261. Pillot C., Ortiz J., Héron A., Ridray S., Schwartz J.C., Arrang J.M. Ciproxifan, a Histamine H3
-receptor antagonist/inverse agonist, potentiates neurochemical and behavioral effects of haloperidol in the rat // The Journal of Neuroscience. – 2002. – V. 22, № 16. – P. 7272-7280.
262. Pilowsky L.S., Ring H., Shine P.J., Battersby M., Lader M. Rapid Tranquilization - A Survey of Emergency Prescribing in a General Psychiatric-Hospital // British journal of psychiatry. – 1992. – V. 160, № 6. – Р. 831-835.
263. Pivac N., Fericic D. Inhibitory Effect of Diazepam on the Activity of the Hypothalamic-Pituitary-Adrenal Axis in Female Rats // Journal of neural transmission-general section. – 1993. – V. 92, № 2-3. – Р. 173-186.
264. Polc P. Involvement of endogenous benzodiazepine receptor ligands in brain disorders: therapeutic for benzodiazepine antagonists? // Med. Hypotheses. – 1995. V. 44, № 6. – P. 439-446.
265. Porcelli G., Raffaelli R., Sacchi A., Volpe A.R., Miani C. Localization and characterization of human salivary kininases // Agents Actions Suppl. – 1992. – V. 38, № 1. – P. 401-406.
266. Powers C.A. Dopamine receptor blockade increases glandular kallikrein-like activity in the neurointermediate lobe of the rat pituitary // Biochem. Biophys. Res. Commun. – 1985. – V. 127, № 2. – Р. 668-672.
267. Prevett M.C., Lammartsma A.A., Brooks D.J., CunnighamV.I. et al. Benzodiazepine- GABAA receptor binding during absence seizures // Epilepsia. – 1995. V. 36, № 6. – P. 592-599.
268. Pritchett D.B., Roberts J.L. Dopamine regulates expression of the glandular-type kallikrein gene at the transcriptional level in the pituitary // Proc. Natl. Acad. Sci. USA. – 1987. – V. 84, № 16. – Р. 5545-5549.
269. Radke J.M., Owens M.J., Ritchie J.C., Nemeroff C.B. Atypical antipsychotic drugs selectively increase neurotensin efflux in dopamine terminal regions // Neurobiology. – 1998. – V. 95, № 19. – Р. 11462-11464.
270. Rago L., Adojaan A., Pokk P. The effect of stress on 3 benzodiazepine receptor in rat blood platelets and lymphocytes: The effect of non-benzodiazepine tranquilizers // Molecular. Pharmacology of Receptors. – 1989. – V. 3. – Р. 4-16.
271. Regoli D. Toward a new anti-inflammatory and analgesic agent // PNAS. – 2000. – V. 97, № 14. – Р. 7676-7677.
272. Reimer S., Hollt V. GABAergic regulation of striatal opioid gene expression // Brain. Res. Mol. Brain. Res. – 1991. - № 1. – Р. 49-54.
273. Reymond M.J., Speciale S.G., Porter J.C. Dopamine in plasma of lateral and medial hypophysial portal vessels: evidence for regional variation in the release of hypothalamic dopamine into hypophysial portal blood // Endocrinology. – 1983. – № 112. – Р. 1958–1963.
274. Reznika S., Salafiaa С., Lageb J., Frickerc L. Localization of Carboxypeptidases E and в in the Human Placenta and Umbilical Cord // Journal of Histochemistry and Cytochemistry. – 1998. – V. 46. – Р. 1359-1368.
275. Rivier C., Rivier J., Vale W. Stress-induced inhibition of reproductive func-tions: role of endogenous CRF // Science. – 1986. – N 231. – P. 607–610.
276. Rocca P., Bellone G., Benna P., Bergamaso B., Ravizza L., Ferrero P. Peripheral-type benzodiazepine receptor and diazepam binding inhibitor-like immunoreactivity distribution in human peripheral blood mononuclear cells // Jmmunopharmacology. – 1993. – V. 25, № 2. – P. 163-178.
277. Rodriguez C., Brayton K.A., Brownstein M., Dixon J.E. Rat preprocarboxypeptidase H. Cloning, characterization, and sequence of the cDNA and regulation of the mRNA by corticotropin releasing factor // J. Biol. Chem. – 1989. – V. 264, № 10. – P. 5988-5995.
278. Rossier J., Barres E., Hutton J.C., Ricknell R.J. Radiometric assay for carboxypeptidase H (EC 3.4.17.10) and other carboxypeptidase B-like enzymes // Anal. Biochem. – 1989. – V. 178, № 1. – P. 27-31.
279. Rossier J., Battenberg E., Piffman Q. et al. Hypothalamic enkephalin neurons may regulate the neurohypophysis // Nature. – 1979. – V.277. – P.653-655.
280. Roth W.W., Mackin R.B., Spiess J., Goodman R.H., Noe B.D. Primary structure and tissue distribution of anglerfish carboxypeptidase H // Mol. Cell. Endocrinol. – 1991. – V. 78, № 3. – P. 171-178.
281. Roubert C., Spielewoy C., Soubrie P., Hamon M., Giros B., Betancur C. Altered neurotensin mrna expression in mice lacking the dopamine transporter // Neuroscience. – 2004. – V. 123, № 2. – Р. 537-546.
282. Rouille Y., Chauvet J., Acher R. Partial conversion of vasopressinyl-Gly-Lys-Arg into pharmacologically active vasopressin through secretory granule carboxypeptidase E and alpha-amidating processing enzymes // Biochem. Int. – 1992. – V. 26, № 4. – P. 739-746.
283. Rovere C., Viale A., Nahon J., Kitabgi P. Impaired processing of brain proneurotensin and promelanin concentrating hormone in obese fat/fat mice // Endocrinology. – 1996. – V. 137, № 7. – P. 2954-2958.
284. Sands S.A., Dickerson D.S., Morris S.J., Chronwall B.M. Dopamine D2 receptor stimulation alters G-protein expression in rat pituitary intermediate lobe melanotropes // Endocrine. – 1997. – V. 6, № 3. – Р. 325-333.
285. Santarelli L., Gobbi G., Debs P.C., Sibille E.L., Blier P., Hen R., Heath M. Genetic and pharmacological disruption of neurokinin 1 receptor function decreases anxiety-related behaviors and increases serotonergic function // PNAS. – 2001. – V. 98, № 4. – Р. 1912-1917.
286. Schalling M., Friberg K., Riederert P. et al. Analysis of expression of cholecystokinin in dopamine cells in the ventral mesencephalon of several species and in humans with schizophrenia // Neurobiology. – 1991. – V. 87. – P. 8427-8431.
287. Schettini G., Cronin M.J., Macleod R.M. Adenosine 3’,5’-monophosphate (cAMP) and calcium-calmodulin interrelation in the control of prolactin secretion: evidence for dopamine inhibition of cAMP accumulation and prolactin release after calcium mobilization // Endocrinology. – 1983. – № 112. – Р. 1801–1807.
288. Schlamp C.L., Nickells R.W. Light and dark cause a shift in the spatial ex-pression of a neuropeptide processing enzyme in the rat retina // J. Neurosci. – 1996. – V. 16, N 7. – P. 2164-2171.
289. Schremmerdanninger E., Offner A., Siebeck M., Roscher A. B1 Bradykinin Receptors and Carboxypeptidase-M Are Both Up-Regulated in the Aorta of Pigs After LPS Infusion // Biochemical and biophysical research communications. – 1998. – V. 243, № 1. – Р. 246-252.
290. Schuckit M.A., Hauger R., Klein J.L. Adrenocorticotropin Hormone Response to Diazepam in Healthy-Young Men // Biological psychiatry. – 1992. – V. 31, № 7. – Р. 661-669.
291. Seidah N.G., Chretien M. Proprotein and prohormone convertases of the subtilisin family – recent developments and future perspectives // Trends Endocrinol. Met. – 1992. – 3, № 4. – P. 133-140.
292. Sharma R.P., Janicak P.G., Bissette G., Nemeroff C.B. CSF neurotensin concentrations and antipsychotic treatment in schizophrenia and schizoaffective disorders // Am. J. Psychiatry. – 1997. – V. 154. – Р. 1019-1021.
293. Shen F.S., Loh Y.P. Intracellular Misrouting and Abnormal Secretion of Adrenocorticotropin and Growth Hormone in Cpe (Fat) Mice Associated with a Carboxypeptidase E Mutation // Proc. Nat. Acad. Sci. USA. – 1997. – V. 94, № 10. – P. 5314-5319.
294. Shibata K., Haverstick D.M., Bannon M.J. Tachykinin gene expression in rat limbic nuclei: modulation by dopamine antagonists // J. Pharmacol. Exp. Ther. – 1990. – V. 255, № 1. – Р. 388-392.
295. Shimamori Y., Kumagai Y., Watanabe Y., Fujimoto Y. Human placental carboxypeptidase M is anchored by a glycosyl-phosphatidylinositol moiety // Biochem. Int. – 1990. – V. 20, № 3. – P. 607-613.
296. Shin C.J., Kim Y.S., Park J.B., Juhnn Y.S. Changes in G protein levels in the hippocampus and the striatum of rat brain after chronic treatment with haloperidol and sulpiride // Neuropharmacology. – 1995. – V. 34, № 10. – Р. 1335-1338.
297. Silberring J., Lason W., Przewlocka B., Przewlocki R. Enkephalin convertase in the rat spinal cord // Neuropeptides. – 1986. – V. 8, № 4. – P. 367-376.
298. Sivam S.P., Hong J.S. GABAergic regulation of enkephalin in rat striatum: alterations in Met5-enkephalin level, precursor content and preproenkephalin messenger RNA abundance // J. Pharmacol. Exp. Ther. – 1986. – V. 237, № 1. – Р. 326-331.
299. Sivam S.P., Strunk C., Smith D.R., Hong J.S. Proenkephalin-A gene regulation in the rat striatum: influence of lithium and haloperidol // Mol. Pharmacol. – 1986. – V. 30, № 2. – Р. 186-191.
300. Skidgel R., McGwire G., Li X. Membrane anchoring and release of carboxypeptidase M: implications for extracellular hydrolysis of peptide hormones. // Immunopharmacology – 1996. – V. 32, № 1-3. – Р. 48-52.
301. Skidgel R.A., Davis R.M., Tan F. Human carboxypeptidase M. Purification and characterization of a membrane-bound carboxypeptidase that cleaves peptide hormones // J. Biol. Chem. – 1989. – V. 264, № 4. – P. 2236-2241.
302. Skidgel R.A., Johnson A.R., Erdos E.G. Hydrolisys of opioid hexapeptides by carboxypeptidase N. Presence of carboxypeptidase in cell membranes // Biochem. Pharmacol. – 1984. – V. 33, № 21. – P. 3471-3478.
303. Skidgel R.A., Tan F.L., Deddish P.A., Li X.Y. Structure, function and membrane anchoring of carboxypeptidase M // Biomed. Biochim. Acta. – 1991. – V. 50, № 4-6. – P. 815-820.
304. Smith D.R., Pallen C.J., Murphy D., Lim L. Pituitary-specific transcriptional initiation sites of the rat carboxypeptidase-H gene and the influence of thyroid hormone status // Mol. Endocrinol. – 1992. – V. 6, № 5. – P. 713-722.
305. Song L.X., Fricker L.D. Calcium and pH dependent aggregation of carboxypeptidase E // J. Biol. Chem. – 1995. – 270, № 14. – P. 7963-7967.
306. Song L.X., Fricker L.D. The pro region is not required for the expression or intracellular routeing of carboxypeptidase E // Biochemical Journal. – 1997. – V. 323, № 4. – P. 265-271.
307. Srinivasan S., Bunch D.O., Feng Y., Rodriguiz R.M., Li M., Ravenell R.L., Luo G.X., Arimura A., Fricker L.D., Eddy E.M., Wetsel W.C. Deficits in reproduction and pro-gonadotropin-releasing hormone processing in male Cpefat mice // Endocrinology. – 2004. – V. 145, № 4. – Р. 2023-2034.
308. Stack G., Fricker L.D., Snyder S.H. A sensitive radiometric assay for enkephalin convertase and for carboxypeptidase B-like enzymes // Life Sci. – 1984. – № 34. – P. 113-121.
309. Steiner D.F. The biosynthesis of biologically active peptides: a perspective // Peptide Biosynthesis and Processing (Fricker L.D., ed.).- CRC Press, Boca Raton, Florida, 1991. – P. 1-16.
310. Strange P.G. Pathology and drug action in schizophrenia: insights from molecular biology // Essays Biochem. – 1998. – V. 33. – P. 105-116.
311. Supattapone S., Fricker L.D., Snyder S.H. Purification and characterization of membrane-bound enkephalin-forming carboxypeptidase, “enkephalin convertase” // J. Neurochem. – 1984. – V. 42, № 4. – P. 1017-1023.
312. Suzuki E., Shintani F., Kanba S., Asai M., Nakaki T. Induction of interleukin-1 beta and interleukin-1 receptor antagonist mRNA by chronic treatment with various psychotropics in widespread area of rat brain // Neurosci. Lett. – 1996. – V. 215, № 3. – Р. 201-204.
313. Svensson A., Carlsson M.L., Carlsson A. Crucial role of the accumbens nucleus in the neurotransmitter interactions regulating motor control in mice // J. Neural. Transm. Gen. Sect. – 1995. – № 101. – Р. 127-148.
314. Sweep C.G., Boersma C.J., Wiegant V.M. Effects of chronic treatment with haloperidol and bromocriptine on the processing of beta-endorphin to gamma- and alpha-endorphin in discrete regions of the rat pituitary gland and brain // Neuropharmacology. – 1990. – V. 29, № 1. – Р. 61-68.
315. Tan F., Chan S.J., Steiner D.F., Schilling J.W., Skidgel R.A. Molecular cloning and sequencing of the cDNA for human membrane-bound carboxypeptidase M. Comparison with carboxypeptidases A, B, H, and N // J. Biol. Chem. – 1989. – V. 264, № 22. – P. 13165-13170.
316. Tanaka M., Tsuda A., Yokoo H., Yoshida M., Mizoguchi K., Shimizu T. Psychological stress-induced Increases in Noradrenaline Release in Rat-Brain Regions Are Attenuated by Diazepam, But Not by Morphine // Pharmacology biochemistry and behavior. – 1991. – V. 39, № 1. – Р. 191-195.
317. Tang F., Costa E., Schwartz J.P. Increase of proenkephalin mRNA and enkephalin content of rat striatum after daily injection of haloperidol for 2 to 3 weeks // Proc. Natl. Acad. Sci. USA. – 1983. – V. 80, № 12. – Р. 3841-3844.
318. Thiele E.A, Eipper B.A. Effect of secretagogues on components of the secretory system in AtT 20 cells // Endocrinology. – 1990. – V. 126, N 2. – P. 809-817.
319. Tong Y., Pelletier G. Role of dopamine in the regulation of proopiomelanocortin (POMC) mRNA levels in the arcuate nucleus and pituitary gland of the female rat as studied by in situ hybridization // Brain. Res. Mol. Brain. Res. – 1992. – V. 15, № 1-2. – Р. 27-32.
320. Tong Y., Toranzo D., Pelletier G. Localization of Diazepam-Binding Inhibitor (Dbi) Messenger-RNA in the Rat-Brain by High-Resolution Insitu Hybridization // Neuropeptides. – 1991. – V. 20, № 1. – Р. 33-40.
321. Turalba A.V., Leite-Morris K.A., Kaplan G.B. Antipsychotics regulate cyclic AMP-dependent protein kinase and phosphorylated cyclic AMP response element-binding protein in striatal and cortical brain regions in mice // Neurosci. Lett. – 2004. – V. 357, № 1. – Р. 53-57.
322. Vallar L., Meldolesi J. Mechanisms of signal transduction at the dopamine D2 receptor // Trends. Pharmacol. Sci. – 1989. – V. 10, № 2. – Р. 74-77.
323. Van Ree J.M., Gaffori O., De Wied D. In rats, the behavioral profile of CCK-8 related peptides resembles that of antipsychotic agents // Eur. J. Pharmacol. – 1983. – V. 93, № 1-2. – Р. 63-78.18-21
324. Vargas M.A., Bourdais J., Sanchez S., Uriostegui B., Moreno E., Josephbravo P., Charli J.L. Multiple hypothalamic factors regulate pyroglutamyl peptidase-II in Cultures of adenohypophyseal cells - role of the cAMP pathway // J. Neuroendocrinol. – 1998. – V. 10, N 3. – P. 199-206.
325. Vetulani J. Pharmacological receptors: the membrane receptors for neurotransmitters and drugs // Acta. Physiol. Pol. – 1988. – V. 39, № 2. – Р. 81-97.
326. Wallace E.F., Evans C.J., Jurik, S.M., Mettord I.N., Barchas J.D. Carboxypeptidase B activity from adrenal medulla - is it involved in the processing of proenkephalin // Life Sci. – 1982. – 31, № 16-17. – P. 1793-1796.
327. Wang H., Li S., Givalois L., Pelletier G. Influence of adrenal glands on the modulation of prolactin gene expression by the endogenous benzodiazepine ligand octadecaneuropeptide in the male rat pituitary gland // J. Neuroendocrinol. – 1998. – V. 10, № 3. – Р. 193-198.
328. Wang Y., Goldman-Rakic P.S. D2 receptor regulation of synaptic burst firing in prefrontal cortical pyramidal neurons // Proc. Natl. Acad. Sci. USA. – 2004. – V. 101, № 14. – Р. 5093-5098.
329. Waters S.M., Rounseville M.P., Davis T.P. Effect of dopaminergic drugs on processing and degradative neuropeptidase mRNA in rat frontal cortex and caudate-putamen // Brain. Res. – 1997. – V. 754, № 1-2. – Р. 28-34.
330. Wilson M.A., Biscardi R., Smith M.D., Wilson S.P. Effects of benzodiazepine agonist exposure on corticotropin-releasing factor content and hormonal stress responses: divergent responses in male and ovariectomized female rats // J. Pharmacol. Exp. Ther. – 1996. – V. 278, № 3. – Р. 1073-1082.
331. Xu J.H., Liu H.C., Zhang Y.P. 4-Aminopyridine Induced Rage Reaction in Mice // ACTA PHARMACOLOGICA SINICA. – 1991. – V. 12, № 2. – Р. 155-159.
332. Yoshikawa K., Hong J.S. The enkephalin system in the rat anterior pituitary: regulation by gonadal steroid hormones and psychotropic drugs // Endocrinology. – 1983. – V. 113, № 4. – Р. 1218-1227.
333. Yoshioka S., Fujiwara H., Yamada S., Nakayma T., Higuchi T., Inoue T., Mori T., Maeda M. Membrane-Bound Carboxypeptidase-M Is Expressed on Human Ovarian Follicles and Corpora-Lutea of Menstrual-Cycle and Early-Pregnancy // Molecular Human Reproduction. – 1998. – V. 4, № 7. – P. 709-717.
334. Zachrisson O., Nomikos G.G., Marcus M.M., Svensson T.H., Lindefors N. Effects of antipsychotic drugs on cholecystokinin and preprotachykinin (substance P) mRNA expression in the rat hippocampal formation // Eur. Neuropsychopharmacol. – 2000. – V. 10, № 5. – Р. 355-363.
335. Zahm D.S., Williams E.S., Poulad D., Krause J.E. Temporal dissociation of neurotensin/neuromedin N mRNA expression in topographically separate subsets of rat striatal neurons following administration of haloperidol // Brain. Res. Mol. Brain Res. – 1996. – V. 42, № 1. – Р. 71-78.
336. Zetler G. Analgesia and ptosis caused by caerulein and cholecystokinin octapeptide (CCK-8) // Neuropharmacology. – 1980. – V. 19, № 5. – Р. 415-422.
|