| 1.
Товарные и определяющие технологию свойства метанола, области применения в химической технологии.
Метанол представляет собой бесцветную жидкость (т. кип. 64,70
С, т. пл. - 97,80
С, плотность 0,79 г/см3
, теплота испарения 263 ккал/кг, критическая температура 2400
С) с запахом, подобным запаху этилового спирта. Он горюч, дает с воздухом взрывоопасные смеси (6 – 34,7 % объемн.) температура воспламенения его паров в воздухе 5350
С. Теплота растворения в воде при бесконечном разбавлении 64,4 ккал/кг. Смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и мнгими другими жидкостями, но не смешивается с алифатическими углеводородами С некоторыми органическими жидкостями (например, с ацетоном, бензолом, дихлорэтаном) образует азеотропные смеси.
Метанол представляет собой большую опасность из-за своей высокой токсичности. Является сильным нервным и сосудистым ядом кумулятивного действия; обладает также слабым наркотическим действием. Предельно допустимая концентрация паров метилового спирта в воздухе производственных помещений 50 мг/м3
.
В химической промышленности метанол применяется в качестве полупродукта для многих промышленных синтезов. В наибольших количествах метанол используется для получения формальдегида, а также в качестве метилирующего агента в производстве таких важных продуктов, как диметилтерефталат, метилметакрилат, некоторые пестициды.
В нефтеперерабатывающей промышленности метиловый спирт служит селективным растворителем для очистки бензинов от меркаптанов и азеотропным реагентом при выделении толуола ректификацией. В смеси с этиленгликолем метиловый спирт применяется для экстракции толуола из бензинов.
Также метанол применяется для производства карбамидных смол, уксусной кислоты, синтетических каучуков, поливинилового спирта и ацеталей, антифризов, денатурирующих добавок. Значительно возрос интерес к метанолу как к важному и экономически эффективному сырью для получения водорода и синтез-газа, которые широко применяют в металлургии, в производстве аммиака. Существенно расширяется использование метанола для очистки сточных вод от вредных соединений азота, для производства кормового белка. В последнее время предполагается, что метанол найдет широкое применение в качестве источника энергии, газового топлива для тепловых электростанций моторного топлива и как компонент автомобильных бензинов. Благодаря добавке метанола улучшаются антиденотационные свойства бензинов, повышается КПД двигателя и уменьшается содержание вредных веществ в выхлопных газах.
2. Сырьевые источники получения метанола. Перспективы использования различных видов сырья.
Раньше метанол получали сухой перегонкой древесины (древесный спирт), но этот метод полностью вытеснен синтезом из окиси углерода и водорода, который осуществлен в крупных масштабах во всех передовых странах. Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2
, СО2
, СО, может изменить структуру сырьевой базы производства метанола и таким образом неудобный для транспортирования уголь будет превращен в удобный для хранения, транспортирования и использования метанол. Перспективным способом получения метанолы является неполное окисления метана и его гомологов.
3.
Современные промышленные способы получения метанола.
а) Синтез метанола из оксида углерода и водорода осуществляют чаще всего на промышленных установках при 20 – 35 МПа, 370 – 4200
С и объемной скорости
10 000 – 35 000 ч-1
(время контакта 10 – 40 с). В этих условиях фактическая степень конверсии составляет 10 – 20 %. Более высокой температуре соответствуют более высокие давление и объемная скорость.
В последнее время с целью снижения энергетических затрат разработаны и реализованы в промышленности способы синтеза метанола при более низких давлениях (5 – 10 МПа) и температуре (300 – 3500
С). Этого удалось достичь путем применения новых, более активных гетерогенных катализаторов и улучшения очистки синтез-газа от сернистых соединений, дезактивирующих эти катализаторы.
б) Из метана метиловый спирт получают при высоком давлении и большом избытке метана в газовой смеси. Для того, чтобы основным продуктом окисления метана был метанол, необходимо давление 106 атм. и темпреатура реакции 3400
С. В этих условиях и соотношении метан : кислород = 9 : 1 степень окисления метана составляет 22 %, причем 17 % прореагировавшего метана превращается в спирт, 0,75 % - в формальдегид, а остальное количество полностью окисляется до двуокиси углерода и воды.
Гомологи метана окисляются легче, но при окислении их образуется много побочных продуктов, что затрудняет их разделение.
Таким образом, наиболее удобным и экономичным является способ получения метанола из окиси углерода и водорода.
4.
Физико-химические свойства системы, положенной в основу процесса получения метанола из синтез-газа.
Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
СО + 2Н2
↔ СН3
ОН + 90,8 кДж (1)
СО2
+ 3Н2
↔ СН3
ОН + 49,6 кДж (2)
Эти реакции экзотермичны и протекают с уменьшением объема. Из этого следует, что для достижения максимальных значений выхода метанола и степени превращения синтез-газа необходимо проведение процесса при низких температурах и высоких давлениях.
Константа уравнения (1) может быть вычислена по уравнению:

В табл. 1 приведены значения констант равновесия реакции (1) при различных давлениях и температурах:
| Константа равновесия К
|
Температура, 0
С
|
Мольная доля СН3
ОН,
|
| 1 атм
|
100 атм
|
300 атм
|
| 0,34
0,0011
0,000018
|
200
300
400
|
12·10-4
5·10-4
8· 10-6
|
0,95
0,66
0,07
|
0,98
0,85
0,33
|
Как видно, степень превращения смеси СО + 2Н2
в метанол (степень конверсии) увеличивается с повышением давления и уменьшается с повышением температуры. Однако для увеличения скорости реакции необходимо повышение температуры. При этом, выбирая оптимальный температурный режим, необходимо учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров. Эти реакции обусловливают бесполезный расход синтез-газа и удорожают очистку метанола.
Оптимальный интервал температур, соответствующих наибольшему выходу продукта, определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Процессы низкого давления (5 – 10 МПа) на медьсодержащих катализаторах осуществляют при температуре 220 – 2800
С. Для цинк-хромового катализатора характерны более высокие давление (20 – 30 МПа) и температуры (350 – 4000
С). В промышленных синтезах высокого давления повышение давления ограничено величиной 40 МПа, так как выше этого значения ускоряются побочные реакции и, кроме того, увеличение затрат на компрессию газа ухудшают экономические показатели процесса. В синтезах низкого давления повышение давления ограничено термической стабильностью медных катализаторов.
5.
Промышленный синтез метилового спирта включает три основные стадии:
1) получение смеси окиси углерода и водорода (синтез-газ);
2) получение метилового спирта-сырца;
3) выделение и очистка метилового спирта.
Рассмотрим технологическую схему производства метанола при низком давлении.
Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4
: Н2
О : СО2
= 1 : 3,3 : 0,24. Смесь направляется в трубчатый конвектор 5, где на никелевом катализаторе происходит паро-углекислотная конверсия при 850 – 8700
С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках. Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280 – 2900
С. Затем теплоту газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35 – 400
С. Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до температуры 220 – 2300
С. Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов. Теплоту реакционной смеси используют в теплообменниках 11, 12 для подогрева поступающего в колонну газа. Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращают на синтез, продувочные и танковые газы передают на сжигание в трубчатую печь.
Вследствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата.
Конструкция и изготовление реакторов для проведения процесса при низком давлении проще благодаря более мягким условиям синтеза. При этом применяют реакторы как шахтные, так и трубчатые. В реакторах для синтеза при низком давлении особое внимание уделяется теплосъему, так как медьсодержащие катализаторы чувствительны к колебаниям температуры. В шахтных реакторах температурный режим регулируют с помощъю байпасов, холодный газ вводят через специальные распределительные устройства. В трубчатых реакторах катализатор находится в трубках, охлаждаемых кипящей водой. Температуру катализатора поддерживают постоянной по всей длине реактора с помощью регуляторов давления, причем перегревы катализатора практически исключены. Выгрузка отработанноготкатализатора протекает тоже достаточно просто – путем снятия колосниковых решеток. Диаметр реакторов достигает 6 м при длине 8 – 16 м.
6.
Расчет материального баланса процесса получения метанола, интенсивности работы катализатора, часовой производительности установки (вариант 1.1).
В результате процесса происходят следующие процессы:
1) СО + 2Н2
= СН3
ОН + Q
2) СО + 3Н2
= СН4
+ Н2
О
3) 2СО + 2Н2
= СН4
+ СО2
4) 2СО = СО2
+ С
5) СО + Н2
= НСНО
6) 2СН3
ОН = (СН3
)2
О + Н2
О
7) СН3
ОН + Н2
= СН4
+ Н2
О
Данные для расчета:
1. Рабочий объем катализатора – 24 м3
.
2. Расход окиси углерода и метанола на побочные продукты:
СО СН3
О
Реакция 2 – 3,8 Реакция 6 – 1,9
Реакция 3 – 4,1 Реакция 7 – 0,5
Реакция 4 – 2,5
Реакция 5 – 0,7
Температура Т = 643 К
Давление Р = 36,5 МПа
Объемная скорость 
Мольное соотношение Н2
: СО = 6,2 : 1
3. База для расчета – 1 час работы установки.
Решение:
1. Рассчитаем объем синтез-газа, подаваемый за 1 час в реактор.
Пересчитаем объем газа из нормальных условий в условия реактора:
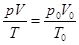
где р, V, Т – соответственно давление, объем при данной температуре,
р0
, V0
– давление и объем при нормальных условиях.
Отсюда
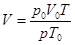

Тогда учитывая объем катализатора, объем синтез-газа будет равен:
 м3
/ч м3
/ч
2. Зная мольные отношения, определим массы Н2
и СО2
, подаваемые в реактор за 1 час.
Зная, что при нормальных условиях 1 моль любого газа занимает объем 22,4 л (0, 224 м3
), определим количество молей водорода и оксида углерода:
 моль моль
Тогда количества молей газов составят:
 моль/ч моль/ч
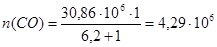 моль/ч моль/ч
Массовый расход водорода составит
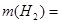 26,57 · 106
· 2 = 53,14 · 106
г/ч = 53,14 · 103
кг/ч 26,57 · 106
· 2 = 53,14 · 106
г/ч = 53,14 · 103
кг/ч
 4,29 · 106
· 28 = 120 · 106
г/ч = 120 · 103
кг/ч 4,29 · 106
· 28 = 120 · 106
г/ч = 120 · 103
кг/ч
3. Расход окиси углерода на побочные и прямую реакции составит:
На реакцию 2 m (СО) = 120000 · 0,038 = 4560 кг/ч
На реакцию 3 m (СО) = 120000 · 0,041 = 4920 кг/ч
На реакцию 4 m (СО) = 120000 · 0,025 = 3000 кг/ч
На реакцию 5 m (СО) = 120000 · 0,007 = 840 кг/ч
Тогда на прямую реакцию будет израсходовано СО:
m (СО) = 120000 - 4560 – 4920 – 3000 – 840 = 106 680 кг/ч
4. Рассчитаем массу метанола исходя из уравнения реакции (1):

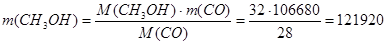 кг/ч кг/ч
5. Рассчитаем массу метанола, реагирующего по побочным реакциям и метанола, полученного в виде продукта:
На реакцию 6 m(СН3
ОН) = 121 920 · 0,019 = 2316,5 кг/ч
На реакцию 7 m(СН3
ОН) = 121 920 · 0,005 = 609,6 кг/ч
Тогда в качестве продукта будет получено метанола:
m(СН3
ОН) = 121920 – 2316,5 - 609,6 = 118993,9 кг/ч
6.Проведем балансовые расчеты по основной и побочным реакциям:
Реакция 1:
Расход водорода составит:
 кг/ч кг/ч
Реакция 2:
Расход водорода составит:
 977,1 кг/ч 977,1 кг/ч
будет получено метана:
 кг/ч кг/ч
будет получено воды:
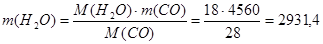
Реакция 3:
Расход водорода составит:
 кг/ч кг/ч
Будет получено метана:
 кг/ч кг/ч
Будет получено диоксида углерода:
 кг/ч кг/ч
Реакция 4:
Будет получено диоксида углерода:
 кг/ч кг/ч
Будет получено углерода:
 кг/ч кг/ч
Реакция 5:
Израсходовано водорода:
 кг/ч кг/ч
Будет получено формальдегида:
 кг/ч кг/ч
Реакция 6:
Будет получено диметилового эфира:
 кг/ч кг/ч
Будет получено воды:
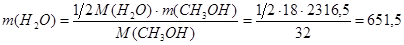 кг/ч кг/ч
Реакция 7:
Будет израсходовано водорода:
 кг/ч кг/ч
Будет получено метана:
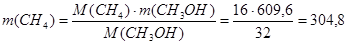 кг/ кг/
Будет получено воды:
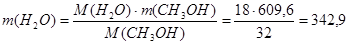 кг/ч кг/ч
Масса непрореагировавшеговодорода составит:
m(Н2
) = 53 140 – 15 240 – 977,1 – 351,4 – 60 – 38,1 = 36 473,4 кг/ч
7. Результаты расчетов сведем в таблицу материального баланса:
| Компонент
|
Загрузка, кг/ч
|
Не вступило в реакцию, кг/ч
|
Продукты реакции, кг/ч
|
| СО
Н2
СН3
ОН
СН4
СО2
Н2
О
НСНО
С
(СН3
)2
О
|
120 000
53 140
|
36473,4
|
118 993,9
4316,2
6222,8
3925,8
900
642,9
1665
|
| Итого:
|
173140
|
36473,4
|
136666,6
|
Составим баланс по метанолу:
| Приход
|
кг/ч
|
т/сут
|
Расход
|
кг/ч
|
т/сут
|
| Синтез-газ,
в т. ч.
Н2
СО
|
53 140
120 000
|
1275,36
2880
|
СН3
ОН
(СН3
)2
О
Н2
О
СН4
СО2
НСНО
С
Н2
|
118 993,9
1 665
3 925,8
4 316,2
6 222,8
900
642,9
36473,4
|
2855,85
39,96
94,22
103,59
149,35
21,6
15,43
875,36
|
| ИТОГО
|
173 140
|
4155,36
|
ИТОГО
|
173 140
|
4155,36
|
2) Селективность – доля (или процент) превращенного сырья, израсходованная на образование целевого продукта:

Так как в реактор поступает 120 000 кг/ч оксида углерода, а на образование метанола израсходуется 106 680 кг/ч СО, то селективность процесса составит:
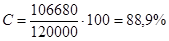
Так как расход водорода на основную реакцию составит 15 240 кг/ч, то селективность по водороду составит:
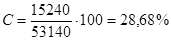
3) Расходный коэффициент - расход сырья на получение одной тонны целевого продукта. Расходный коэффициент с учетом селективности рассчитывается по уравнению:

Таким образом, расходный коэффициент оксида углерода на получение 1 тонны метанола составит:
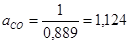 т/т т/т
Суммарные потери водорода в % масс. на всех стадиях будет равна:
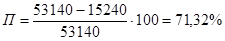
Расходный коэффициент по водороду с учетом потерь составит:
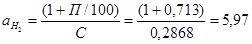 т/т т/т
4) Конверсия исходного сырья – количество превращенного сырья, отнесенное к загрузке реактора, выраженное в процентах или долях единицы. Конверсия характеризует степень превращения сырья в целевые и побочные продукты и, в конечном счете, количество сырья, подлежащего рециркуляции. Конверсию определяем по формуле:

где  - количество компонента А в загрузке реактора, кг/ч - количество компонента А в загрузке реактора, кг/ч
 - количество компонента А в продуктах реакции, кг/ч. - количество компонента А в продуктах реакции, кг/ч.
Конверсия по оксиду углерода СО составит:

Конверсия по водороду составит:

|