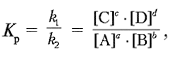Курсовая работа: Прикладные аспекты темы Скорость химической реакции и катализ на уроках химии в средней школе
|
Название: Прикладные аспекты темы Скорость химической реакции и катализ на уроках химии в средней школе Раздел: Рефераты по педагогике Тип: курсовая работа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Курсовая работа По теме «Прикладные аспекты темы «Скорость химической реакции и катализ» на уроках химии в средней школе» Содержание Глава 1. Состояние изучаемого вопроса в современной российской школе 1.1. Урок № 1 «Закономерности течения химических реакций» 1.1.1. Скорость химической реакции 1.1.2. Термохимические уравнения 1.2. Практическая работа «Действие катализаторов» 1.3. Практическая работа «Влияние условий на скорость химических реакций» 1.4. Практическая работа «Химическое равновесие и условия его смещения» Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» 2.1. Вводная часть (применение и основные сведения) 2.3. Характеристика целевого продукта 2.4. Химическая схема процесса Глава 3. Тесты и задачи прикладного характера 3.4. Решение производственных задач по теме «Химическое равновесие» В современных условиях одной из самых актуальных проблем методики преподавания химии в школе становится обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой жизни, демонстрации прикладного характера химических знаний. Для того чтобы сохранить познавательный интерес учащихся, нужно убедить их в действенности химических знаний, сформировать личную потребность в овладении учебным материалом. Этому могут способствовать специально составленные задания, которые кроме собственно контролирующих вопросов содержат информацию прикладного характера, полезную в быту. [1] В этой связи весьма актуальным является тема данной курсовой работы – изучение прикладных аспектов темы «Скорость химической реакции и катализ» на уроках химии в средней школе. Глава 1. Состояние изучаемого вопроса в современной российской школе Для осознанного понимания химических процессов огромное значение имеет представление о химической кинетике и равновесии. Эти вопросы всегда были самыми сложными не только для учащихся, но и для учителей. Учебный материал темы поделен на 6 уроков, поскольку давно известно, что на одном уроке нельзя ознакомить учащихся более чем с двумя понятиями. План изучения темы 1. Скорость химических реакций. 2. Зависимость скорости реакции от внешних факторов. 3. Влияние температуры на скорость реакции. 4. Катализ. 5-6. Химическое равновесие и его смещение. Преподавание темы «Закономерности течения химических реакций. Скорость химической реакции и катализ» начинается с 9 класса, первого полугодия. При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 8 - 9 класс под редакцией Н. С. Ахметова. Дидактическим материалом служит книга по химии для 8 - 9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 9 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 9 классе на изучение закономерностей протекания химических реакции отводится 6 ч [3, 4]. 1.1 Урок № 1 «Закономерности течения химических реакци й» Знать: энергетику химических превращений; закон Гесса; зависимость скорости химической реакции от температуры, концентрации, площади соприкосновения реагирующих веществ, природы реагирующих веществ, участия катализаторов и ингибиторов; правило Вант-Гоффа; принцип Ле Шателье; условия смещения химического равновесия. Уметь: на конкретных примерам разъяснять зависимость скорости химических реакций от различных факторов и смещение химического равновесия в зависимости от условий течения реакций; использовать понятия скорости химической реакции, теплот образования и сгорания при решении расчетных задач. Основные понятия: тепловой эффект, термохимическое уравнение, экзотермические и эндотермические реакции, энтальпия, энергия активации, теплоты образования и сгорания веществ, энтропия, химическое равновесие, реакции обратимые и необратимые, реакции прямые и обратные, равновесные концентрации, константа химического равновесия, скорость химической реакции, катализатор, ингибитор, каталитическая реакция [2]. Контрольные вопросы 1. От каких факторов зависит скорость реакции? 2. Что называют скоростью химической реакции? 3. По каким формулам можно рассчитать величину скорости реакции? 4. Как формулируют закон действия масс? 5. Как читается правило Вант-Гоффа? 6. Почему при повышении температуры скорость реакции возрастает? 7. Какие вещества называют катализаторами, а какие ингибиторами? 8. Что называют кинетическим уравнением реакции? 9. Что называют энергией активации? 10. Какие реакции называют обратимыми и какие необратимыми? 11. Что называют химическим равновесием? 12. Что называют константой равновесия? 13. Что называют смещением химического равновесия? 14. Как читается принцип Ле Шателье?15. Почему любая химическая реакция сопровождается тепловым эффектом? 16. Какие реакции называют экзотермическими, а какие эндотермическими? 17. Сформулируйте закон Гесса и следствия из него. 1.1.1 Скорость химической реакции Скорость химической реакции u – физическая величина.
где С1 – начальная концентрация одного из реагирующих веществ в момент времени t1 , С2 – концентрация в момент времени t2 , t1 – начальное время, t2 – время окончания реакции. Поскольку значение скорости реакции не может быть отрицательным, то в случае получения отрицательного значения берем его математический модуль. Единицы измерения величин: С – моль/л, t – с (секунда), u – моль/(л•с). Скорость химической реакции зависит: от природы реагирующих веществ; от концентрации реагентов; от температуры; от поверхности соприкосновения реагирующих веществ (для гетерогенных систем); от участия катализатора или ингибитора. Для реакции А + В = С u = k[A]•[B], где k – константа скорости, [A] – концентрация вещества А, [В] – концентрация вещества В. Если в реакции в отдельном столкновении участвуют а молекул А и b молекул В, т. е. аА + bВ = С, то выражение u = k•[A]а •[B]b называют законом действующих масс. (Показатели степени а и b часто не равны стехиометрическим коэффициентам вследствие сложного механизма реакции.) При повышении температуры на каждые 10° скорость реакции возрастает в 2–4 раза (правило Вант-Гоффа):
где u2 – скорость реакции при температуре t2 , u1 – скорость реакции при температуре t1 , g – температурный коэффициент, он принимает значения от 2 до 4. Скорость реакции обратно пропорциональна времени:
Алгоритмы по теме «Скорость химической реакции» Алгоритм 1. Вычисление скорости химической реакции. Задача. Вычислите среднюю скорость химической реакции, если через 20 с от начала реакции концентрация веществ составляла 0,05 моль/л, а через 40 с – 0,04 моль/л.
Алгоритм 2. Зависимость скорости химической реакции от концентрации реагентов Задача. Как изменится скорость химической реакции 2СО + О2
Алгоритм 3. Зависимость скорости реакции от температуры Задача. Во сколько раз увеличится скорость химической реакции при повышении температуры от 300 до 350 °С, если температурный коэффициент равен 2?
Задачи для самоконтроля 1. Как изменится скорость реакции 2Fe + 3Cl2
если давление системы увеличить в 5 раз? Ответ. Увеличится в 125 раз. 2. Скорость реакции при охлаждении от 80 до 60 °С уменьшилась в 4 раза. Найти температурный коэффициент скорости реакции. Ответ. 2. 3. Реакция при 50 °С протекает за 2 мин 15 с. За какое время закончится эта реакция при t = 70 °C, если температурный коэффициент равен 3? Ответ. 15 с. 1.1.2 Термохимические уравнения В термохимических уравнениях в отличие от химических указывается тепловой эффект химической реакции и между левой и правой частями уравнения принято ставить знак равенства (=). Тепловой эффект Q измеряется в килоджоулях (кДж), в случае экзотермических реакций он положителен, а в случае эндотермических реакций отрицателен. Энтальпия (DН) – величина, характеризующая внутреннюю энергию вещества, обратная по знаку тепловому эффекту, имеет размерность кДж на моль (кДж/моль). Две возможные формы записи термохимического уравнения: 2Н2 (г.) + О2 (г.) = 2Н2 О (г.) + 483,6 кДж Н2
(г.) + 1/2О2
(г.) = Н2
О (г.), Закон Гесса: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
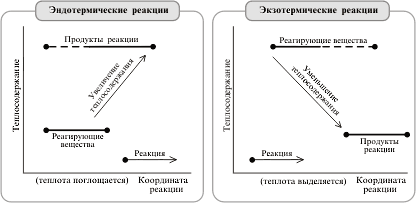
При химической реакции теплота выделяется или поглощается. Реакции, протекающие с выделением теплоты, называются экзотермическими реакциями, а сопровождающиеся поглощением теплоты – эндотермическими.
Эндотермические и экзотермические реакции Алгоритм 4. Вычисление теплового эффекта реакции по известному термохимическому уравнению
Задача. По термохимическому уравнению N2 (г.) + О2 (г.) = 2NО (г.) – 180,7 кДж вычислите, сколько поглотится теплоты при вступлении в реакцию 5,6 л азота (н. у.). Алгоритм 5. Составление термохимического уравнения Задача. При сжигании 3 г магния выделилось 75,15 кДж теплоты. Составьте термохимическое уравнение реакции горения магния.
Алгоритм 6. Вычисление теплоты сгорания вещества Задача. По термохимическому уравнению реакции 2СО (г.) + О2 (г.) = 2СО2 (г.) + 566,5 кДж вычислите теплоту сгорания оксида углерода(II).
Алгоритм 7. Вычисление теплоты образования вещества
Задача. При сжигании 93 г белого фосфора выделилось 2322 кДж теплоты. Рассчитайте теплоту образования оксида фосфора(V). Алгоритм 8. Вычисление теплового эффекта реакции по закону Гесса Задача. Вычислите тепловой эффект реакции Fe2
O3
+ 2Al если теплота образования оксида железа(III) составляет +821,5 кДж/моль, а теплота образования оксида алюминия +1675,7 кДж/моль (теплота образования простого вещества равна нулю).
Задания для самоконтроля 1. Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты. Ответ. CaCO3
= CaO + CO2
2. Сколько теплоты выделится при полном сгорании 1 м3 смеси, состоящей из 30% (по объему) этилена и 70% ацетилена, если при сгорании 1 моль этих веществ выделяется соответственно 1400 и 1305 кДж? Ответ. 59 531 кДж. 3. Вычислите теплоту сгорания ацетилена С2 Н2 , если теплота образования углекислого газа 393,5 кДж/моль, водяного пара – 242 кДж/моль, ацетилена – 226,8 кДж/моль. Ответ. 1604,4 кДж. Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде: aA + bB = cC + dD, скорость прямой реакции uпр определяется из соотношения:
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В. Концентрации веществ А и В уменьшаются, и, следовательно, скорость прямой реакции понижается. Появление в системе продуктов С и в означает возможность протекания обратного процесса, скорость которого uобр математически выражается следующим образом:
По мере накопления в системе веществ С и в скорость обратного процесса непрерывно возрастает до выравнивания скоростей прямой и обратной реакций: uпр = uобр . Подобное состояние системы называется химическим равновесием. Соотношение между концентрациями при равновесии выражается формулой:
где Kp – константа равновесия, [A], [B], [C], [D] – равновесные концентрации веществ. Величина константы химического равновесия зависит от природы реагирующих веществ и от температуры. Если Kp > 1, то uпр > uобр , если Kp < 1, то uпр < uобр . Смещение равновесия в зависимости от изменения условий определяется универсальным принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие, выражающееся в изменении концентрации, температуры или давления, то равновесие смещается в направлении, способствующем ослаблению этого воздействия. Пример 1 . Почему лакмус (HInd) в кислой среде (избыток H3 О+ ) – красный, а в щелочной (избыток гидратированного ОН– , рН > 7) – cиний? Решение Уравнение диссоциации индикатора можно представить в виде: HInd В состоянии химического равновесия:
1) При избытке в растворе гидратированного Н+ (кислая среда, рН < 7) Кр < 1. Химическое равновесие сдвигается в сторону обратной реакции, т. е. в растворе накапливаются недиссоциированные молекулы индикатора красного цвета. 2) Избыток ОН– (щелочная среда, рН > 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр > 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind– . Пример 2 . Вывести математическое выражение Кр для реакции: 2SO2 + O2 = 2SO3 + Q. Используя численное значение Кр и принцип Ле Шателье, объяснить, как можно предсказать сдвиг равновесия вправо. Решение
Сместить равновесие вправо можно с помощью следующих воздействий. 1) Увеличить концентрацию реагирующих веществ. Такое воздействие можно описать неравенством:
Число молекул SO2 и O2 в единице объема увеличивается, столкновения между ними становятся чаще и концентрация SO3 тоже возрастает. 2) Уменьшить концентрацию продукта реакции. При уменьшении концентрации (отводе) SO3 результат подобен предыдущему. Новые порции исходных веществ будут реагировать для компенсации удаляемого продукта. 3) Понизить температуру. Прямая реакция – экзотермическая, поэтому для сдвига равновесия вправо систему следует охлаждать. Потерянное тепло будет восполняться вследствие усиления прямой реакции. (Наоборот, повышение температуры вызовет сдвиг равновесия влево.) 4) Повысить давление. Исходные вещества – газообразные, продукт – жидкое вещество (в виде пара). Прямая реакция идет с уменьшением объема, следовательно, увеличивая давление, мы смещаем равновесие вправо, а уменьшая – влево. Если бы реакция шла без изменения объема, то изменение давления не влияло бы на равновесие. 5) Использование катализатора не вызывает смещения равновесия. Катализатор, заметно влияющий на скорость химической реакции, равно ускоряет обе реакции – прямую и обратную. Алгоритм 9. Использование принципа Ле Шателье
Задание. При определенных условиях реакция хлороводорода с кислородом является обратимой: 4НСl (г.) + O2
(г.) Какое влияние на равновесное состояние системы окажут: а) увеличение давления; б) повышение температуры; в) увеличение концентрации кислорода; г) введение катализатора? Алгоритм 10. Вычисление константы равновесия реакции Задача. Вычислите константу равновесия для реакции СО2
+ Н2
если равновесная концентрация углекислого газа равна 0,02 моль/л, водорода – 0,005 моль/л, а угарного газа и воды – по 0,01 моль/л.
Алгоритм 11. Вычисление исходных концентраций веществ Задача. Обратимая реакция выражается уравнением 2SO2
+ O2
Известны равновесные концентрации: для оксида серы(IV) – 0,0002 моль/л, для кислорода – 0,004 моль/л, для оксида серы(VI) – 0,003 моль/л. Найдите исходные концентрации кислорода и сернистого газа.
Задания для самоконтроля 1. Уравнение реакции Н2
+ I2
Даны равновесные концентрации: водорода – 0,004 моль/л, йода – 0,25 моль/л, йодоводорода – 0,08 моль/л. Вычислить исходные концентрации водорода и йода и константу равновесия. Ответ. [H2 ] = 0,044 моль/л, [I2 ] = 0,29 моль/л, К = 6,4. 2. Как изменится давление к моменту наступления равновесия в реакции N2
+ 3Н2
Ответ. Уменьшится в 1,05 раза. 3. В какую сторону сместится равновесие реакций: 2H2
S N2
O4
CO + H2
O (г.) а) при понижении температуры; б) при повышении давления? Ответ. Смещение равновесия в реакциях: а) при понижении температуры: 2Н2
S N2
O4
CO + H2
O (г.) б) при повышении давления: 2Н2
S N2
O4
CO + H2
O (г.) 1.2 Практическая работа «Действие катализаторов » Цели. Повторить и обобщить понятия о катализе, катализаторах, сущности их действия в определенной среде, ингибиторах и промоторах. Оборудование и реактивы. Лучина, спиртовка, спички, шпатель, стеклянная палочка, штатив с пробирками, санитарная склянка; растворы пероксида водорода, гидроксида тетраамминмеди(II) [Сu(NH3 )4 ](OH)2 , Na2 SO3 , MnCl2 , CoCl2 , BaCl2 , соляной кислоты (разб.), оксид железа(III) Fe2 O3 , ацетон (диметилкетон). Катализ – явление увеличения скорости химических реакций за счет присутствия определенных веществ (катализаторов). Катализаторы – вещества, изменяющие скорость реакции, но сами к концу процесса остающиеся неизменными по составу и массе. Ускорение процесса – катализ. Схему катализа можно представить в таком виде:
Здесь А и В – реагирующие вещества, К – катализатор, АК – промежуточное соединение, АВ – продукт реакции. Замедление процесса – ингибирование. Существует два вида катализа – гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты реакции и катализатор составляют одну фазу (газовую или жидкую), поверхность раздела отсутствует. Особый случай гомогенного катализа – автокатализ (ускорение процесса одним из продуктов реакции). Например, в кислой среде скорость реакции перманганата калия с сульфитом калия возрастает за счет образования ионов Mn2+ :
Многие реакции в растворах ускоряются ионами H3
O+
(pH < 7) и ОН-
(pH > 7): гидролиз крахмала, омыление эфиров, гидролиз сахарозы и др. Ионы
Особенность гетерогенного катализа состоит в том, что катализатор (обычно твердое вещество) находится в ином фазовом состоянии, чем реагенты и продукты. Реакция на поверхности твердого вещества идет за счет координационных связей с участием электронных пар, не участвующих в образовании связей внутри веществ. В результате внутренние связи ослабевают, и молекулы либо разрушаются, либо образуют активные радикалы. Чем лучше адсорбируются реагенты на поверхности твердого вещества и чем слабее удерживаются продукты реакции, тем выше каталитическая активность этого вещества. Не вся поверхность гетерогенного катализатора проявляет каталитическую активность. Активные центры занимают лишь часть поверхности.
Применение каталитических методов сжигания топлива позволит в два раза поднять коэффициент его использования (сейчас 0,45) и тем самым решить вопрос обеспечения большой химии углеводородным сырьем.
1.3 Практическая работа «Влияние условий на скорость химических реакций» Цели. Повторить понятия о скорости химических реакций и влияющих на нее факторах. Оборудование и реактивы. Держатель для пробирок, спиртовка, спички, водяная баня, штатив с химическими пробирками, санитарная склянка; цинк (гранулы), железо (пористое восстановленное), HCl (разб., 1:2), железо (стружки), СН3 СООН (разб., 1:2), H2 SO4 (разб., 1:5), H2 SO4 (разб., 1:10) [5]. Факторы, влияющие на скорость химических реакций
1.4 Практическая работа «Химическое равновесие и условия его смещения » Цель. Закрепить понятия о химическом равновесии и условиях его смещения. Оборудование и реактивы. Спиртовка, спички, водяная баня, газоотводная трубка-капилляр, штатив с пробирками, держатель для пробирок, санитарная склянка; хлорид натрия (р-р) и хлорид натрия (крист.), карбонат натрия (р-р) и карбонат натрия (крист.), известковая вода (Са(ОН)2 ), лакмус (p-p), метилоранж (р-р), едкий натр (р-р), H2 SO4 (разб.), H2 SO4 (конц.).
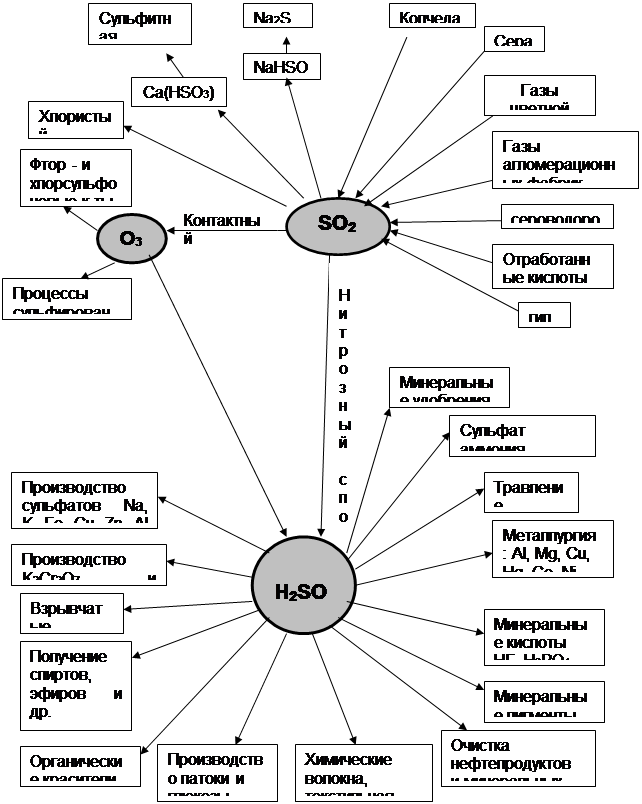
Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 Вводная часть (применение и основные сведения) Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260 – 336,5°С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д. Наиболее важные области применения серной кислоты отражены на схеме 1. [6] В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Первой стадией сернокислотного производства является получение диоксида серы при сжигании сернистого сырья. После очистки SO2 (особенно в контактном методе) ее окисляют до SO3 , который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы. В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид. Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2 , высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2 . Кроме того, выпускают также более чистую контактную кислоту, чистый олеум, химически чистую и реактивную серную кислоту. Широко применяется обжиг колчедана в кипящем слое и сжигание серы в циклонной печи, увеличивается использование тепла, выделяющегося на различных стадиях производства серной кислоты. Повышается производительность башенных сернокислотных систем в результате поддержания оптимального технологического режима; интенсивность башенных систем достигает 250 кг/м3 в сутки. Освоен контактно-башенный процесс производства, при котором расход HNO3 составляет 6–7 кг на 1 тонну H2 SO4 . В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом. В качестве катализаторов контактного процесса применяется термически стойкая ванадиевая контактная масса (в виде гранул и колец) с пониженной температурой зажигания. Проведены работы по освоению процесса окисления SO2 в кипящем слое катализатора. Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO2 на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов. Схема 1. Применение серной кислоты
Внедряется процесс конденсации H2 SO4 , заменяющий абсорбцию серного ангидрида. Также для производства серной кислоты используют ангидрид или безводный сульфат кальция CaSO4 , гипс или двуводную соль CaSO4 ×2H2 O и фосфогипс, представляющий собой отход производства концентрированных фосфорных удобрений (смесь гипса, соединений фтора, окислов фосфора, SO2 и других примесей). В нитрозном способе катализатором служат оксиды азота. Окисление SO2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ называют башенным. Обжиговый газ обрабатывается серной кислотой, в которой растворены окислы азота. Сернистый ангидрид обжигового газа поглощается нитрозой, и затем окисляется окислами азота по реакции: SO2 + N2 O3 + H2 O = H2 SO4 + 2NO. Образующийся NO плохо растворим в нитрозе и выделяется, а затем частично окисляется кислородом до NO2 . Смесь NO и NO2 вновь поглощается H2 SO4 . Промышленность выпускает три вида товарной серной кислоты: башенная кислота (С = 75%, tкрист = -29,5 °С); контактная кислота (С = 92,5%, tкрист = -22,0 °С); Олеум (С = 20% своб. SO3 , tкрист = +2 °С) [7, 8]. Традиционными источниками являются сера и железный (серный) колчедан. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы. В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. Из-за низкой концентрации SO2 в отходящих газах тепловых электростанций и металлургических заводов их переработка пока еще не всегда осуществима [7]. 2.3 Характеристика целевого продукта Серная кислота может существовать как самостоятельное химическое соединение H2 SO4 , а также в виде соединений с водой H2 SO4 ×H2 O, H2 SO4 ×2H2 O, H2 SO4 ×4H2 O и с триоксидом серы H2 SO4 ×SO3 , H2 SO4 ×2SO3 . В технике серной кислотой называют и безводную H2 SO4 и ее водные растворы (это смесь H2 O, SO3 и соединений H2 SO4 ×nH2 O) и растворы триоксида серы в безводной H2 SO4 – олеум (смесь H2 SO4 и соединенийH2 SO4 ×nSO3 ). Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава. Безводная 100%-ная кислота имеет сравнительно высокую температуру кристаллизации 10,7 °С. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела низкую температуру кристаллизации. Промышленность выпускает 3 вида товарной серной кислоты.
Серная кислота и вода образуют азеотропную смесь состава 98,3% H2 SO4 и 1,7% H2 O с максимальной температурой кипения (336,5°С). Состав находящихся в равновесии жидкой и паровой фаз для кислоты азеотропной концентрации одинаков; у более разбавленных растворов кислоты в паровой фазе преобладают пары воды, в паровой фазе над олеумом высока равновесная концентрация SO3 . Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Особенно жадно серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду у других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду как таковую, а водород и кислород в сочетании Н : О = 2. Дерево и другие растительные и животные ткани, содержащие целлюлозу (С6 Н10 О5 ), крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу вызывает ожоги [7-12]. 1.Сжигание серы При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция: S + O2 = SO2 (1) с выделением очень большого количества теплоты: изменение Н=-362,4 кДж/моль, или в пересчете на единицу массы 362,4/32 = 11,325 кДж/т = 11325 кДж/кг S. Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6 °С; теплота испарения составляет 288 кДж/кг. Теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей – форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата (рис. 1). Обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты. Если воздух берут в стехиометрическом количестве, т.е. на каждый моль серы 1 моль кислорода, то при полном сгорании серы концентрация будет равна объемной доле кислорода в воздухе С(SO2 max ) = 21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит ~ 1500 °С. В практических условиях выше 1300 °С разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14% SO2 . 2. Контактное окисление SO2 в SO3 Контактное окисление диоксида серы является типичным примером гетерогенного окислительного экзотермического катализа. Реакция окисления диоксида серы SO2 + 0,5 O2 = SO3 (2) характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2 O5 (ванадиевая контактная масса). Каталитическую активность в этой реакции проявляют и другие соединения, но платиновые катализаторы чувствительны даже к следам As, Se, Cl2 b др. Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. Нижним температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от вида катализатора и состава газа 400 – 440°С. Верхний температурный предел составляет 600 – 650°С и определяется тем, что выше этих температур происходит перестройка структуры катализатора, и он теряет свою активность. В диапазоне 400 – 600°С процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась. Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом (рис. 1). Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками. Одна из важнейших задач, стоящих перед сернокислотной промышленностью, - увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами. Один из наиболее рациональных методов решения этой задачи, - метод двойного контактирования и двойной абсорбции (ДКДА). Для смещения равновесия вправо и увеличения выхода процесса, а также для увеличения скорости процесса процесс проводят по этому методу. Реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3 . В оставшемся реакционном газе соотношение O2 :SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном-двух слоях катализатора достигают 95% степени превращения оставшегося SO2 . Суммарная степень превращения SO2 составляет в таком процессе 99,5% - 99,8 %. Последняя стадия производства серной кислоты контактным способом – абсорбция SO3 из газовой смеси и превращение его в серную кислоту. nSO3 + H2 O = H2 SO4 + (n-1)SO3 + Q (3) если n > 1, то получается олеум (раствор SO3 в H2 SO4 ) если n = 1 , то получается моногидрат (98,3% H2 SO4 ) если n < 1, то получается разбавленная серная кислота При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. В качестве абсорбента нельзя использовать такие растворы, над поверхностью которых велико парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде, т.е. с образованием сернокислотного тумана: SO3( г ) + H2 O( г ) ®H2 SO4( г ) ® H2 SO4( туман ) ; Q > 0 Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу. Оптимальным абсорбентом является 98,3%-ная серная кислота (моногидрат). Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3 . Протекающий при этом процесс можно условно описать уравнением реакции: SO3 + nH2 SO4 + H2 O = (n+1) H2 SO4 Для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100°С. Однако в процессе абсорбции SO3 происходит закрепление кислоты и в силу экзотермичности реакции увеличивается температура. Поэтому абсорбцию ведут так, чтобы концентрация H2 SO4 при однократном прохождении абсорбера повышалась только на 1-1,5%, закрепившуюся серную кислоту разбавляют в сборнике до 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая циркуляцию (рис. 2) [7 - 12].
Глава 3. Тесты и задачи прикладного характера 3.1 Тесты типа «А» 1. Равновесие реакции 2Н2 S (г.) + 3О2 (г.) = 2Н2 О (г.) + 2SO2 (г.) при повышении давления смещается: а) вправо; + б) влево; в) давление не влияет на равновесие. 2. Вещество, ускоряющее ход реакции, но при этом не расходующееся: а) ингибитор; б) катализатор; + в) индикатор. 3. Повышение температуры в реакции 2Н2 + О2 = 2Н2 О + Q кДж сказывается следующим образом: а) не оказывает влияния; б) смещает равновесие вправо; в) смещает равновесие влево. + 4. Натрий энергичнее реагирует с водой, чем железо, поскольку: а) натрий – газообразный элемент; б) натрий – катализатор этой реакции; в) натрий – ингибитор этой реакции; г) натрий – щелочной металл. + 5. Реакцию, протекающую с поглощением тепла, называют: экзотермической; 3) реакцией разложения; реакцией соединения; 4) эндотермической. + 6. Реакцию, уравнение которой 2H2 O + 2Na = 2NaOH + H2 + Q, относят к реакциям: замещения, экзотермическим; + разложения, экзотермическим; присоединения, эндотермическим; обмена, эндотермическим. 7. Реакцию, уравнение которой 3H2 +N2 Û 2NH3 + Q, относят к реакциям: 1) обратимым, экзотермическим; + 2) необратимым, экзотермическим; 3) обратимым, эндотермическим; 4) необратимым, эндотермическим. 8. В ходе химических реакций тепловая энергия реакционной системы: не изменяется; поглощается; выделяется; может поглощаться или выделяться. + 9. С наибольшей скоростью при комнатной температуре протекает реакция взаимодействия: углерода с кислородом; железа с раствором уксусной кислоты; железа с соляной кислотой; растворов гидроксида натрия и серной кислоты. + 10. Какое из перечисленных условий не повлияет на смещение равновесия в системе: 2SO2 + O2 Û 2SО3 + Q? введение катализатора; + повышение давления; повышение концентрации кислорода; повышение температуры 11 – 12. Реакция, сопровождающаяся 11. выделением теплоты 12. поглощением теплоты называется обратимой 3) прямой эндотермической (12+) 4) экзотермической (11+) 13. При протекании химической реакции теплота поглощается или выделяется + обязательно поглощается обязательно выделяется условие недостаточно для однозначного ответа 14 - 15. Скорость реакции А(г) + В(г) ® ... увеличивается при 14. 1) понижении концентрации А повышении концентрации В + охлаждении понижении давления 15. 1) нагревании 3) добавлении инертного газа 2) повышение давления + 4) охлаждении 16. Состояние химического равновесия характеризуется изменением химической природы продуктов постоянством концентраций веществ + повышением температуры понижением давления 17. Состояние химического равновесия означает, что все реагенты исчезли, полностью образовались продукты все реагенты сохранились, полностью образовались продукты часть реагентов исчезла, частично образовались продукты + часть реагентов исчезла, но продукты не образовались 18. Способ, смещающий равновесие реакции CО2( r ) + 2SО3(г) ÛCS2(г) + 4О2(г) – Qвправо (®), — это увеличение концентрации О2 увеличение концентрации CS2 повышение температуры + повышение давления 19. Способ, смещающий равновесие реакции 2NH3(г) + 3CuO( T ) Û 3Cu( T ) + N2(г) + 3Н2 О(ж) + Qвправо (®), — это увеличение концентрации азота повышение температуры понижение давления повышение давления + 20. Способ, смещающий равновесие гомогенной реакции 2SO2 + О2 Û 2SO3 вправо (®), — это уменьшение концентрации SO2 уменьшение концентрации кислорода уменьшение концентрации продукта + понижение давления 21. Способ, смещающий равновесие гомогенной реакции РСl3 + Сl2 Û РС15 влево (¬), — это уменьшение концентрации продукта увеличение концентрации хлора уменьшение концентрации хлора + увеличение концентрации РС13 22. При повышении давления равновесие реакции S( T ) + 2HIÛI2 + H2 сместится вправо 3) не сместится + сместится влево 4) не знаю 23. При понижении давления равновесие реакции СO2 + Н2 Û СО + Н2 O(Ж) сместится влево + 3) не сместится сместится вправо 4) не знаю 24. При охлаждении равновесие реакции Н2 + SÛH2 S + Q сместится влево 3) не сместится сместится вправо + 4) не знаю 25. При нагревании равновесие реакции N2 + O2 Û 2NO – Q сместится вправо + 3) не сместится сместится влево 4) не знаю 26. Равновесие в гетерогенной системе СаО(т) + СО2(г) ÛСаСО3(т) + Q сместится влево (¬) при добавлении СаО 3) сжатии добавлении СаСО3 + 4) нагревании + 27. Скорость прямой реакции N2 + 3H2 Û 2NH3 + Q возрастает при: 1) увеличении концентрации азота; + 2) уменьшении концентрации азота; 3) увеличение концентрации аммиака; 4) уменьшение концентрации аммиака; + 28. При повышении температуры равновесие эндотермической химической реакции смещается в сторону: 1) продуктов реакции; + 2) исходных веществ; 3) эндотермической реакции; 4) экзотермической реакции. + 29. Какой из факторов не оказывает влияния на скорость химической реакции в растворах: 1) концентрация веществ; 2) использование катализатора; 3) использование индикатора; + 4) объем реакционного сосуда. + 30. Для увеличения выхода аммиака по уравнению реакции N2 + 3H2 Û 2NH3 + Q необходимо одновременно: 1) повысить температуру, понизить давление; 2) повысить давление, понизить температуру; + 3) повысить давление и температуру; 4) понизить давление и температуру. 31. Скорость химической реакции между металлом и серой не зависит от: 1) температуры; 2) площади поверхности соприкосновения веществ; 3) давления; + 4) природы металла. 32. С наименьшей скоростью протекает реакция между: 1) железным гвоздем и 4%-ным раствором CuSO4 ; + 2) железной стружкой и 4%-ным раствором CuSO4 ; 3) железным гвоздем и 10%-ным раствором CuSO4 ; 2) железной стружкой и 10%-ным раствором CuSO4 ; 33. Химическое равновесие в системе СО2(г) + С(т) Û 2СО(г) – 173 кДж смещается в сторону продукта реакции при: 1) повышении давления; 2) повышении температуры; + 3) понижении температуры; 4) использовании катализаторов. [13 – 15] 3.2 Тесты типа «В» 1. Скорость химической реакции характеризует: изменение количеств веществ за единицу времени в единице объема или единице площади; + время, за которое заканчивается химическая реакция; число структурных единиц вещества, вступивших в химическую реакцию; движение молекул или ионов реагирующих веществ относительно друг друга. 2. Скорость химической реакции между медью и азотной кислотой зависит от: массы меди; объема кислоты; концентрации кислоты; + объема колбы. 3. Скорость химической реакции между цинком и кислотой зависит от: понижения давления; природы кислоты; + повышения давления; присутствия индикатора. 4. При увеличении температуры на 30 °С скорость реакции возрастает в 8 раз. Чему равен температурный коэффициент реакции? 1) 8; 2) 2; + 3) 3; 4) 4. 5. С большей скоростью идет взаимодействие соляной кислоты с: 1) Сu; 2) Fe; 3) Mg; 4) Zn. + 6. Скорость химической реакции горения угля в кислороде уменьшается при: увеличении концентрации кислорода; повышении температуры; понижении температуры; + повышении давления. 7. Молекулы оксида азота (IV) (бурого цвета) могут в определенных условиях димеризоваться, образовав бесцветную жидкость N2 O4 : 2NO2 ÛN2 O4 + 55 кДж/моль. Чтобы оксид азота (IV) максимально перевести в бесцветный димер, необходимо систему: охладить; + нагреть; подвергнуть облучению солнечным светом; выдерживать при комнатной температуре длительное время. 8. Химическое равновесие в системе C4 H10(г) ÛC4 H8(г) + H2(г) – Q можно сместить в сторону продуктов реакции: повышением температуры и повышением давления; повышением температуры и понижением давления; + понижением температуры и повышением давления; понижением температуры и понижением давления. 9 – 12. Процесс 9. 2РС13 = 2Р + 3С12 - Q 11. NH4 C1 = NH3 = НС1 + Q 4Cr + 3O2 = 2Cr2 03 + Q 12. C + 2S = CS2 – Q называется эндотермической реакцией соединения (12+) экзотермической реакцией разложения (11+) экзотермической реакцией соединения (10+) эндотермической реакцией разложения (9+) 13 - 16. Процесс 13. С + СuО = СО + Сu – Q 14. Na2 S + H2 O = NaHS + NaOH – Q 15. CdO + H2 S = CdS + H2 O + Q 16. 2KI + C12 = I2 ¯ + 2KC1 + Q называется экзотермической реакцией замещения (15+) экзотермической реакцией обмена (14+) эндотермической реакцией замещения (12+) эндотермической реакцией обмена (13+) 17. Скорость реакции 2Н2 O2 ® 2Н2 O + О2 будет выше, если использовать 3% -и раствор Н2 О2 и катализатор 30% -и раствор Н2 О2 и катализатор + 3% -и раствор Н2 О2 без катализатора 30%-и раствор Н2 О2 без катализатора 18. Скорость реакции Мn + кислота ® соль + Н2 будет выше при использовании кислоты НСl и охлаждения кислоты HF и нагревания + кислоты НСl и нагревания кислоты HF и охлаждения 19. Для гомогенной реакции А + В ® ... при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет в 1)2 раза 2)3 раза 3)6 раз 4) 9 раз + 20. Скорость реакции Н2(г) + I2(г) ® 2HI понизится в 16 раз при одновременном уменьшении молярных концентраций реагентов в 1) 2 раза 2) 4 раза + 3) 8 раз 4) 16 раз 21. Скорость реакции N2 + О2 ® 2NO при уменьшении давления системы в 4 раза понизится в 1) 4 раза 2) 8 раз 3)16 раз + 4) 32 раза 22. Скорость реакции СО2 + Н2 ® СО + Н2 О при увеличении молярных концентраций в 3 раза (СО2 ) и в 2 раза (Н2 ) возрастет в 1)2 раза 2) 3 раза 3) 5 раз 4) 6 раз + 23—24. Скорость реакции 23. С(Т) + О2 ® СО2 24. С(Т) + 2Сl2 ® ССl4 при V = const и увеличении количества реагентов в 4 раза возрастет в 1) 4 раза (23+) 2) 8 раз 3) 16 раз (24+) 4) 32 раза 25. В гомогенной реакции 4НС1 + О2 Û 2С12 + 2Н2 О при повышении давления равновесие сместится 1) влево 2) вправо + 3) не сместится 4) не знаю 26. В гомогенной реакции 2H2 S +3О2 Û 2SO2 + 2Н2 О при понижении давления равновесие сместится 1) влево + 2) вправо 3) не сместится 4) не знаю 27. Доменный процесс Fe2 O3 + 3СО Û2Fe + 3СО2 сопровождается экзо-эффектом, следовательно, при охлаждении выход продуктов увеличивается + 3) не изменяется уменьшается 4) не знаю 28. Гашение извести СаО сопровождается выделением энергии в форме теплоты, следовательно, при нагревании выход продукта увеличивается 3) не изменяется уменьшается + 4) не знаю 29. Выход продукта реакции СаS(т) + 2О2 Û СаSO4(т) + Q можно увеличить добавлением CaS + 3) введением катализатора нагреванием 4) повышением давления 30. Во сколько раз увеличивается скорость химической реакции при повышении температуры на 20 °С, если температурный коэффициент равен 3: 1) в 3 раза; 2) в 6 раз; 3) в 9 раз; + 4) в 90 раз 31. В каком случае повышение давления и понижение температуры в системе приводит к повышению выхода продукта реакции: 1) 2H2 O Û 2H2 + O2 – Q 2) N2 + 3H2 Û 2NH3 + Q + 3) H2 + I2 Û 2HI – Q 4) N2 + O2 Û 2NO – Q 32. Как повлияет на скорость реакции СаО + СО2 ®CaCO3 увеличение давления углекислого газа в 3 раза: 1) скорость увеличится в 3 раза; + 2) скорость уменьшится в 9 раз; 3) скорость уменьшится в 3 раза; 4) скорость не изменится. 33. Химическое равновесие в системе 2NO(г) + O2(г) Û 2NО2(г) + Q смещается в сторону продукта реакции при: 1) повышении давления; + 2) повышении температуры; 3) понижении температуры; + 4) использовании катализаторов. 34. Растворение железа в соляной кислоте будет замедляться при: 1) увеличении концентрации кислоты; 2) раздроблении железа; 3) разбавлении кислоты; + 4) повышении температуры. 35. Химическое равновесие в системе H2 O(ж) + SO2(г) ÛH2 SО3(р-р) + Qсмещается в сторону исходных веществ при: 1) повышении давления; 2) повышении температуры; + 3) понижении температуры; 4) перемешивании. [13 – 15] 3.3 Тесты типа «С» 1. Не оказывает воздействия на реакции, протекающие в твердой фазе, следующий фактор: а) концентрация реагентов; + б) температура; в) природа реагирующих веществ; г) степень измельчения реагентов. 2. Увеличение температуры проведения реакции: влияет на ее скорость, так как теплота не может быть признаком превращения веществ; увеличивает скорость реакции, так как увеличивается число эффективных соударений молекул; + повышает скорость реакции, так как увеличивается число упругих соударений молекул; не влияет на скорость реакции, так как в равной мере увеличивается число эффективных и упругих соударений молекул. 3. Замедлить гидролиз сульфата меди возможно добавлением: 1) ВаС12 ; 2) КОН; 3) H2 SO4 ; + 4) Н2 О. 4. При растворении нитрата калия температура смеси понижается, следовательно, процесс растворения сопровождается эндо-эффектом + 3) нулевым тепловым эффектом экзо-эффектом 4) не знаю 5. Скорость реакции 2А ® ... выше в том случае, где концентрация А, равная вначале 0,3 моль/л, через 40 с составит 0,01 моль/л + 3) 0,03 моль/л 0,02 моль/л 4) 0,04 моль/л 6. Скорости реакции А + В ®D выше в том случае, где через 30 с масса (в граммах) продукта равна 1) 11 2) 23 3) 47 4) 62 + Cxbnfnm!!!7 – 9. При взаимодействии Н2 с Сl2 , Вr2 и I2 в сосудах одинакового объема через 27 с образуется 7. по 0,04 моль продукта 8. по 25 г продукта 9. 18,25 г НС1, 40,5 г НВr и 64 г HI следовательно, скорость реакции выше для I2 3) одинакова (7+ 8+ 9+) выше для С12 4) выше для Вг2 10. Скорость реакции Fe + Н2 SO4 (разб.) ®FeSO4 + Н2 будет наибольшей при использовании порошка Fe, 15% -го раствора H2 SO4 стружек Fe, 1,5%-го раствора H2 SO4 порошка Fe, 1,5 % -го раствора H2 SO4 стружек Fe, 15% -го раствора H2 SO4 + 11. Скорость реакции с температурным коэффициентом 2 при 10 °С равна 2 моль/(л • с), а ее численное значение при 30 °С составит 1) 2 2) 4 3) 6 4) 8 + 12. Для увеличения скорости реакции в 64 раза (температурный коэффициент 4) необходимо повысить температуру на 1) 10°С 2) 20°С 3) 30°С + 4) 40°С 13. При одновременном повышении давления и охлаждении смещение равновесия в гомогенной реакции N2 + 3Н2 Û 2NH3 + Q будет однонаправленным 1) влево 2) вправо + 3) не будет 4) не знаю 14. При одновременном понижении давления и температуры в гомогенной реакции С(т) + 2N2 OÛ СО2 + 2N2 + Qвыход продуктов увеличится + 3) не изменится уменьшится 4) не знаю 15. Катализатор AlCl3 увеличивает скорость: 1) любой химической реакции между органическими веществами; 2) некоторых реакций между органическими веществами; + 3) любой химической реакции между неорганическими веществами; 4) некоторых химических реакций между неорганическими веществами. 16. Во сколько раз изменится скорость реакции 2А + В = 2С, если концентрацию вещества А уменьшить в 2 раза: 1) увеличится в 4 раза; 2) уменьшиться в 2 раза; 3) уменьшится в 4 раза; + 4) увеличится в 2 раза. 17. С наименьшей скоростью при комнатной температуре протекает взаимодействие между: 1) цинком и разбавленной серной кислотой; 2) магнием и разбавленной серной кислотой; 3) железом и кислородом; + 4) раствором карбоната натрия и соляной кислотой. [13 – 15] 3.4 Решение производственных задач по теме «Химическое равновесие » Цель. Создание условий для активного, сознательного, творческого применения на практике полученных знаний и умений. Задачи. Выявление качества усвоения теоретического материала по теме «Химическая кинетика». Создание условий для применения учащимися ранее полученных знаний в новой ситуации. Расширение кругозора учащихся. ХОД УРОКА Постановка цели урока. Формулировка темы Учитель. Здравствуйте, ребята! Рада вас приветствовать сегодня на уроке. Hа предыдущих занятиях мы с вами изучали законы химической кинетики – одного из важнейших разделов химии. Напомните мне, пожалуйста, что же изучает химическая кинетика? (Ответ. Скорость химической реакции.) Где на практике могут быть вами использованы знания законов химической кинетики? (Ответ. Знание законов химической кинетики позволяет предсказать время прохождения той или иной реакции.) Если реакция обратимая, можем ли мы с вами повлиять на выход продукта, увеличив или уменьшив его? (Ответ. Да.) Знание какого закона или принципа позволит нам это сделать? (Ответ. Прицип Ле Шателье.) Пользуясь этим принципом, мы теоретически можем предсказать, в какую сторону сместится равновесие при изменении того или иного условия проведения реакции. А как вы думаете, на конкретном производстве достаточно ли будет только теоретических прогнозов, не подкрепленных расчетами? (Ответ. Hет. Необходимо более точно знать время прохождения реакции и предполагаемый выход продукта.) Хорошо. Чтобы быть грамотными специалистами, нам необходимо с вами этому научиться. И тема нашего урока – «Химическое равновесие. Решение производственных задач». Учитель. Представим себе, что мы – расчетная лаборатория химической кинетики. В нашу лабораторию поступил запрос от руководства завода «Хлорин» по производству хлора. Обратите внимание на запрос (на столах перед каждым учеником). В расчетную лабораторию химической кинетики от руководства химического завода по производству хлора. Для производства хлора на заводе используется метод Дикона, заключающийся в окислении хлороводорода кислородом воздуха:
В настоящее время при высокой температуре и умеренном давлении равновесие в реакционной системе устанавливается при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л, [O2 ] = 0,3 моль/л, [H2 O] = 0,1 моль/л, [Cl2 ] = 0,1 моль/л. 1. Дайте полную характеристику этой реакции. 2. Оцените эффективность производства хлора при данных условиях. 3. Определите, какие внешние факторы необходимо изменить, чтобы увеличить выход хлора (ответ обоснуйте теоретически). 4. Производственные мощности позволяют: а) увеличить общее давление в системе в 3 раза; б) повысить температуру в системе на 20 градусов, если температурные коэффициенты прямой и обратной реакций равны 2,9 и 3,7 соответственно. Определите, приведут ли данные изменения внешних факторов к увеличению выхода хлора. Ответ подтвердите расчетами.
Области применения хлора Немного поясню ситуацию: на этот завод пришел новый коммерческий директор. Он изучил условия производства, подсчитал затраты на энергоресурсы и пришел к выводу о неэффективности производства. Поэтому руководство завода обратилось к нам с просьбой подтвердить правильность вывода о неэффективности производства при данных условиях расчетами и предложить способы увеличения выхода продукта. Прочитайте, пожалуйста, текст запроса. Наша задача – составить полный отчет по данному запросу, подтвердив все предположения расчетами. Решение производственной задачи Учитель. Начнем с характеристики реакции. В тетради делаем записи. 1. Характеристика реакции. Запишем уравнение данной реакции и по известному нам плану охарактеризуем ее. (План на столе перед каждым учеником – приложение 2. Ребята составляют характеристику реакции в тетради.) Ответ: А. Это реакция неполного окисления хлороводорода. Б. Это окислительно-восстановительная реакция. Ион хлора – восстановитель, кислород – окислитель. В. Это гомогенная реакция, т.к. все участвующие в ней вещества – газы. Г. Это обратимая реакция. Формула для расчета константы равновесия имеет вид: Кр
= Д. Реакция экзотермическая. Е. Реакция каталитическая (катализаторы – хлорид меди(II) и хлорид железа(III).) Мы ответили на первый пункт запроса. Переходим к следующему пункту запроса. 2. Оценка эффективности производства. Давайте подумаем, какой фактор позволит нам оценить эффективность производства. (Ответ. Константа равновесия.) Как константа равновесия связана с эффективностью производства? (Ответ. Чем выше значение константы равновесия, тем выше содержание в реакционной смеси продуктов реакции, тем эффективнее производство.) Нам нужно рассчитать константу равновесия. Формула для расчета нами уже составлена, воспользуемся ею (один ученик рассчитывает константу у доски): Кр
= Вывод (формулируют учащиеся). Поскольку значение константы равновесия меньше 1, значит, производство малоэффективно. (Учащиеся записывают в тетрадь.) Учитель. Итак, вывод нового коммерческого директора оказался верным – производственные затраты не окупаются вследствие малого выхода продукта реакции. Переходим к следующему пункту запроса. 3. Факторы, влияющие на повышение эффективности производства. Данная реакция обратимая. Какие факторы влияют на смещение равновесия? (Ответ. Температура, давление, концентрации исходных веществ и продуктов реакции.) Подумайте, в какую сторону нужно сместить равновесие реакции, чтобы повысить эффективность производства, и как нужно изменить перечисленные факторы, чтобы равновесие реакции сместилось в нужную нам сторону. (Ответ. Поскольку необходимый нам продукт реакции – хлор – образуется в результате прямой реакции, значит, равновесие нужно сместить вправо. Тогда повысится эффективность производства. Для этого: а) давление необходимо повысить (прямая реакция идет с уменьшением давления); б) температуру понизить (прямая реакция – экзотермическая); в) концентрации исходных веществ увеличить; г) концентрации продуктов реакции уменьшить (например, осушить при помощи серной кислоты).) Переходим к четвертому пункту запроса. Расчетная часть. Химическое равновесие характеризуется равенством скоростей прямой и обратной реакций. Если изменить одно из внешних условий (давление или температуру), происходит смещение равновесия. Следовательно, нарушается равенство скоростей прямой и обратной реакций. Наша задача – расчетами доказать нарушение этого равенства. Рассмотрим сначала воздействие давления на смещение равновесия. Какой закон химической кинетики определяет зависимость скорости химической реакции от давления? (Ответ. Поскольку давление находится в прямо пропорциональной зависимости от концентрации реагирующих веществ, то для расчетов можно применить закон действующих масс.) (Учащиеся дают формулировку закона.) Давайте запишем выражение закона действующих масс для прямой и обратной реакций для начальных условий и после изменения давления. Страничку тетради учащиеся делят пополам на две колонки: в первой колонке производят расчеты для прямой реакции, во второй – для обратной.
Учитель. Проверяем результаты расчетов и делаем вывод. Один ученик записывает результаты расчетов на доске и формулирует вывод, который все остальные записывают в тетрадь. Вывод. В результате увеличения давления в три раза скорость прямой реакции будет превосходить скорость обратной реакции в три раза, что приведет к смещению равновесия вправо и увеличению выхода продукта реакции. Учитель. Производственные мощности завода позволяют увеличить температуру на 20 градусов. Используя принцип Ле Шателье, ответьте, пожалуйста, приведет ли это к увеличению выхода продукта. (Ответ. Hет, т.к. прямая реакция – экзотермическая и увеличение температуры приведет к ее замедлению.) Давайте проверим это расчетами. Какое правило нам поможет в этом? (Ответ. Правило Вант-Гоффа.) Учащиеся формулируют правило. Один ученик записывает на доске его выражение и рассчитывает изменение скорости для прямой и обратной реакций после повышения температуры на 20 градусов: uпр1 /uпр = 2,92 = 8,41, uобр1 /uобр = 3,72 = 13,69. Учащиеся формулируют вывод и записывают его в тетрадь. Вывод. Повышение температуры на 20 градусов на данном производстве нецелесообразно, т.к. приводит к снижению выхода продукта (после повышения температуры скорость обратной реакции превышает скорость прямой реакции в 1,6 раза). Учитель. Ребята, на уроке мы с вами составили ответ на запрос химического производства. Подумайте, знания каких законов помогли нам это сделать. (Ответ. Принцип Ле Шателье, закон действующих масс, правило Вант-Гоффа.) Каков же главный итог нашего урока? Чему вы научились? (Ответ. Научились применять полученные ранее знания на практике. Узнали, что изученные нами законы химической кинетики применимы на конкретных химических производствах и позволяют оценить эффективность производства.) Домашнее задание. Выполнить задания 1–4, приведенные ниже.
Реакция 2NO + Cl2
протекает с выделением теплоты. Определите, в сторону какой реакции сместится равновесие, если общее давление в системе понизить в 4 раза и одновременно повысить температуру на 40 градусов (температурные коэффициенты прямой и обратной реакций равны 2 и 5 соответственно).
Реакция между газами протекает по уравнению: 4А + В В какую сторону сместится равновесие этой реакции, если давление увеличить в 3 раза и одновременно повысить температуру на 20 градусов? Температурные коэффициенты прямой и обратной реакций равны 2,9 и 3,7 соответственно.
Сместится ли равновесие обратимой газофазной реакции А + В при понижении давления в 2 раза и одновременном понижении температуры на 25 градусов, если температурные коэффициенты прямой и обратной реакций соответственно равны 3,0 и 2,1?
При состоянии равновесия системы N2
+ 3H2
концентрации реагирующих веществ были следующими (моль/л): [N2 ] = 0,3, [H2 ] = 0,9, [NH3 ] = 0,4. Рассчитайте, как изменятся скорости прямой и обратной реакций, если давление в системе увеличить в 5 раз. В каком направлении сместится равновесие? [5, 16] Анализ результатов проведенной работы приводит к следующим выводам: Закономерности протекания химических реакций, в том числе и обратимых, используются почти везде, например, в промышленности; Естественно, на этих производствах образуются отходы, которые загрязняют окружающую среду; Рациональное сочетание условий протекания реакций (в абсолюте – создание замкнутых, циклических процессов) приводит к сокращению выбросов в окружающую среду. Можно привести множество примеров использования основных закономерностей протекания химических реакций в производствах. В узких рамках школьной программы отражены лишь 1 – 2 конкретных примера, хотя, на мой взгляд, изучение химии с прикладных позиций поможет привить ученикам устойчивый интерес к овладению данной дисциплиной. 1. О. В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47. 2. Ахметов Н. С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18. 3. Ахметов Н. С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г. 4. Рудзитис Г. Е., Фельдман Р. Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992. 5. Материалы сайта www.1september.ru 6. О. С. Габриелян, Н. П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г. 7. Малинин К. М. Технология серной кислоты и серы. М., Л., 1994. 8. Васильев Б. Г., Отвагина М. И. Технология серной кислоты. М., 1985. 9. Отвагина М. И., Явор В. И., Сретенская Н. С., Шарифов М. Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4. 10. Резницкий И. Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4. 11. Березина Л. Т., Борисова С. И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12. 12. Громов А. П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12. 13. Лидин Р. А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70. 14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А. А. Каверина, Д. Ю. Добротин, М. Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51. 15. Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н. С. Ахметов, Н. В. Богомолова и др. М.: Дрофа, 1999. с. 430-438 16. Р. П. Суровцева, С. В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г. |