Лекция на тему:”Термодинамические потенциалы”
План:
1.Группа потенциалов “EFGH”, имеющих размерность энергии.
2.Зависимость термодинамических потенциалов от числа частиц. Энтропия как термодинамический потенциал.
3.Термодинамические потенциалы многокомпонентных систем.
4.Практическая реализация метода термодинамических потенциалов (на примере задачи химического равновесия).
1.
Один из основных методов современной термодинамики является метод термодинамических потенциалов. Этот метод возник, во многом, благодаря использованию потенциалов в классической механике, где его изменение связывалось с производимой работой, а сам потенциал является энергетической характеристикой термодинамической системы. Исторически сложилось так, что введенные первоначально термодинамические потенциалы также имели размерность энергии, что и определило их название.
Упомянутая группа включает следующие системы:
- внутренняя энергия 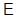 ; ;
- свободная энергия или потенциал Гельмгольца 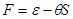 ; ;
- термодинамический потенциал Гиббса  ; ;
- энтальпия 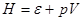 . .
Потенциальность внутренней энергии 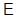 была показано в предыдущей теме. Из нее следует потенциальность остальных величин. была показано в предыдущей теме. Из нее следует потенциальность остальных величин.
Дифференциалы термодинамических потенциалов принимает вид:

Из соотношений (3.1) видно, что соответствующие термодинамические потенциалы характеризуют одну и ту же термодинамическую систему при различных способах …. описания (способах задания состояния термодинамической системы). Так, для адиабатически изолированной системы, описываемой в переменных 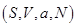 удобно в качестве термодинамического потенциала использовать внутреннюю энергию удобно в качестве термодинамического потенциала использовать внутреннюю энергию  .Тогда параметры системы, термодинамически сопряженные к потенциалам, определяются из соотношений: .Тогда параметры системы, термодинамически сопряженные к потенциалам, определяются из соотношений:
 , , 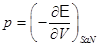 , , 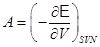 , , 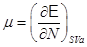 (3.2) (3.2)
Если в качестве способа описания используется “система в термостате”, задаваемая переменными 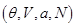 , наиболее удобно использовать в качестве потенциала свободную энергию , наиболее удобно использовать в качестве потенциала свободную энергию 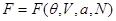 . Соответственно, для параметров системы получим: . Соответственно, для параметров системы получим:
 , , 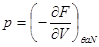 , , 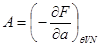 , , 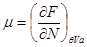 (3.3) (3.3)
Далее, выберем в качестве способа описания модель “системы под поршнем”. В этих случаях функции состояния образуют набор (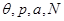 ), а в качестве термодинамического потенциала используется потенциал Гиббса G. Тогда параметры системы определяются из выражений: ), а в качестве термодинамического потенциала используется потенциал Гиббса G. Тогда параметры системы определяются из выражений:
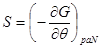 , , 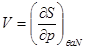 , , 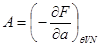 , , 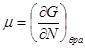 (3.4) (3.4)
И в случае “адиабатической системы над поршнем”, заданной функциями состояния 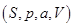 роль термодинамического потенциала играет энтальпия H. Тогда параметры системы принимают вид: роль термодинамического потенциала играет энтальпия H. Тогда параметры системы принимают вид:
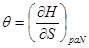 , , 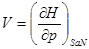 , , 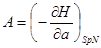 , , 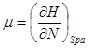 (3.5) (3.5)
Из того, что соотношения (3.1) задают полные дифференциалы термодинамических потенциалов, мы можем приравнивать их вторые производные.
Например, 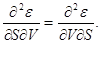 Учитывая, что Учитывая, что
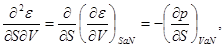 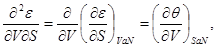
получаем
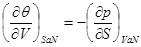 (3.6а) (3.6а)
Аналогично для остальных параметров системы, связанных с термодинамическим потенциалом 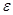 , запишем: , запишем:
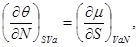 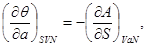 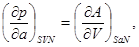
 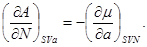 (3.6б-е) (3.6б-е)
Подобные тождества можно записать и для других наборов параметров термодинамического состояния системы на основе потенциальности соответствующих термодинамических функций  . .
Так, для “системы в термостате” c потенциалом 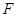 , имеем: , имеем:
 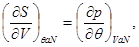 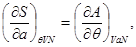 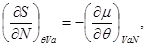
(3.7)
 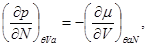 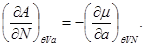
Для системы “над поршнем” с потенциалом Гиббса 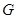 будут справедливы равенства: будут справедливы равенства:
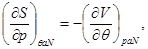  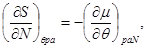
(3.8)
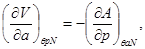 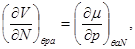 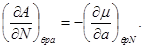
И, наконец, для системы с адиабатическим поршнем с потенциалом H, получим:
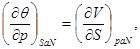  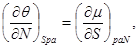
(3.9)
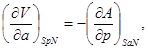  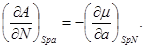
Равенства вида (3.6) – (3.9) получили название термодинамических тождеств и в ряде случаев оказываются удобными для практических расчетов.
Использование термодинамических потенциалов позволяет достаточно просто определить работу системы  и тепловой эффект и тепловой эффект 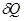 . .
Так, из соотношений (3.1) следует:
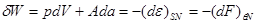 (3.10) (3.10)
Из первой части равенства следует известное положение о том, что работа теплоизолированной системы ( ) производится за счет убыли ее внутренней энергии. Второе равенство означает, что свободная энергия ) производится за счет убыли ее внутренней энергии. Второе равенство означает, что свободная энергия 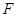 есть та часть внутренней энергии есть та часть внутренней энергии 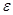 , которая при изотермическом процессе , которая при изотермическом процессе  целиком переходит в работу (соответственно “оставшуюся” часть внутренней энергии целиком переходит в работу (соответственно “оставшуюся” часть внутренней энергии 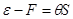 иногда называют связанной энергией). иногда называют связанной энергией).
Количество теплоты 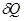 можно представить в виде: можно представить в виде:
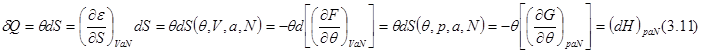 Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении ( Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении (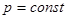 ), выделяемое количество теплоты равно изменению энтальпии. ), выделяемое количество теплоты равно изменению энтальпии.
Выражение (3.11), с учетом второго начала термодинамики (2.7) позволяет определить теплоемкость:
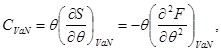 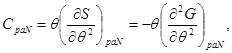
(3.12)
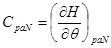
Все термодинамические потенциалы типа энергии обладают свойством аддитивности. Поэтому можно записать:
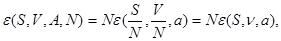
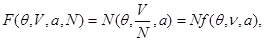 (3.13) (3.13)
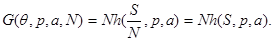
Легко видеть, что потенциал Гиббса содержит только один аддитивный параметр  , т.е. удельный потенциал Гиббса , т.е. удельный потенциал Гиббса 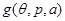 от от не зависит. Тогда из (3.4) следует: не зависит. Тогда из (3.4) следует:
 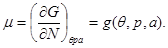 (3.14) (3.14)
То есть химический потенциал есть удельный потенциал Гиббса, и имеет место равенство
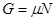 (3.15) (3.15)
Термодинамические потенциалы (3.1) связаны между собой прямыми соотношениями, позволяющими совершать переход от одних потенциалов к другим. Например, выразим все термодинамические потенциалы через внутреннюю энергию.
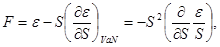
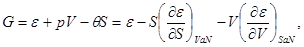 (3.16) (3.16)
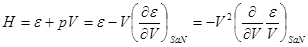
При этом мы получили все термодинамические потенциалы как функции (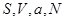 ). Для того, чтобы выразить их в других переменных, используют процедуру пере…. ). Для того, чтобы выразить их в других переменных, используют процедуру пере….
Пусть задано давление 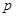 в переменных ( в переменных (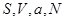 ): ):
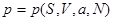 (3.17) (3.17)
Запишем последнее выражение в виде уравнения состояния, т.е. найдем вид
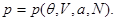
Легко видеть, что если состояние задано в переменных (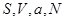 ), то термодинамическим потенциалом является внутренняя энергия ), то термодинамическим потенциалом является внутренняя энергия 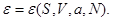 В силу (3.2) найдем В силу (3.2) найдем
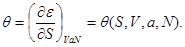 (3.18) (3.18)
Рассматривая (3.18) как уравнение относительно S, находим его решение:
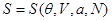 (3.19) (3.19)
Подставляя (3.19) в (3.17) получаем
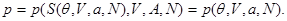 (3.20) (3.20)
То есть от переменных (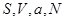 ) мы перешли к переменным ( ) мы перешли к переменным ( ). ).
2.
Вторая группа термодинамических потенциалов возникает в том случае, если в качестве термодинамических переменных, помимо рассмотренных выше, включен химический потенциал  . Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений: . Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений:
 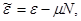  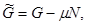 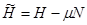 (3.21) (3.21)
Соответственно дифференциалы потенциалов (3.21) имеют вид:
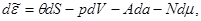 (3.22а) (3.22а)
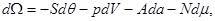 (3.22б) (3.22б)
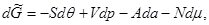 (3.22в) (3.22в)
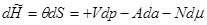 (3.22г) (3.22г)
Также как и для термодинамических потенциалов первой группы, для потенциалов (3.21) можно построить термодинамические тождества, найти выражения параметров термодинамической системы и т.д.
Рассмотрим характерные соотношения для “потенциала омега” 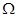 , выражающий квазисвободную энергию, и использующийся на практике наиболее часто среди остальных потенциалов группы (3.22). , выражающий квазисвободную энергию, и использующийся на практике наиболее часто среди остальных потенциалов группы (3.22).
Потенциал 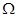 задается в переменных ( задается в переменных (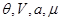 ), описывающих термодинамическую систему с воображаемыми стенками. Параметры системы в этом случае определяются из соотношений: ), описывающих термодинамическую систему с воображаемыми стенками. Параметры системы в этом случае определяются из соотношений:
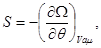 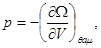  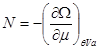 (3.23) (3.23)
Термодинамические тождества, следующие из потенциальности 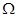 , имеют вид: , имеют вид:
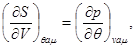 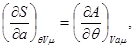 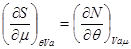
(3.24)
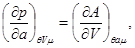 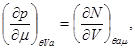 
Достаточно интересными являются аддитивные свойства термодинамических потенциалов второй группы. Поскольку в этом случае число частиц не входит в число параметров системы, то в качестве аддитивного параметра используют объем. Тогда для потенциала 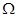 получаем: получаем:
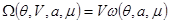 (3.25) (3.25)
Здесь 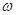 - удельный потенциал - удельный потенциал 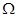 на 1 на 1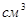 . Учитывая (3.23), получаем: . Учитывая (3.23), получаем:
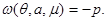 , соответственно, , соответственно,  (3.26) (3.26)
Справедливость (3.26) можно доказать и на основе (3.15):
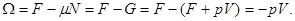
Потенциал 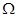 также может быть использован для пересчета термодинамических функций, записанных в виде также может быть использован для пересчета термодинамических функций, записанных в виде 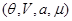 к виду к виду  . Для этого соотношение (3.23) для N: . Для этого соотношение (3.23) для N:
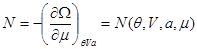
разрешается относительно  : : 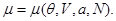
В качестве термодинамических потенциалов могут выступать не только энергетические характеристики системы, но и любые другие величины, входящие в соотношение (3.1). В качестве важного примера рассмотрим энтропию как термодинамический потенциал. Исходное дифференциальное соотношение для энтропии следует из обобщенной записи I и II начал термодинамики:
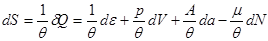 (3.27) (3.27)
Таким образом, энтропия является термодинамическим потенциалом для системы, заданной параметрами 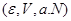 . Другие параметры системы имеют вид: . Другие параметры системы имеют вид:
 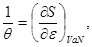  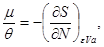 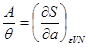 (3.28) (3.28)
Разрешая первое из соотношений (3.28) относительно 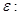 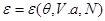 возможен переход от переменных возможен переход от переменных 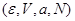 к переменным к переменным   . .
Аддитивные свойства энтропии приводят к известным соотношениям:
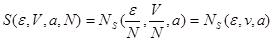 (3.29) (3.29)
Перейдем к определению термодинамических потенциалов на основе заданных макроскопических состояний термодинамической системы. Положим для упрощения вычислений отсутствие внешних полей (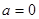 ). Это не снижает общности результатов, поскольку при ). Это не снижает общности результатов, поскольку при 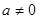 в результирующих выражениях просто появляются дополнительные системы. в результирующих выражениях просто появляются дополнительные системы.
В качестве примера найдем выражения свободной энергии, используя в качестве исходных уравнение состояния, калорическое уравнение состояния и особенности поведения системы при 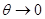 . Учитывая (3.3) и (3.12), находим: . Учитывая (3.3) и (3.12), находим:
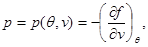 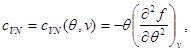 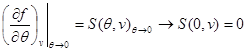 (3.30) (3.30)
Проинтегрируем второе уравнение системы (3.30) с учетом граничного условия при 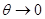 : :
 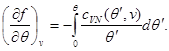
Тогда система (3.30) принимает вид:
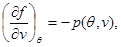  (3.31) (3.31)
Решение системы (3.31) позволяет найти удельную свободную энергию в виде
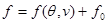 (3.32) (3.32)
Начало  отсчета удельной свободной энергии также может быть найдено из условий при отсчета удельной свободной энергии также может быть найдено из условий при  : :
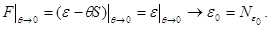
Тогда (3.32) принимает вид:
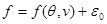 , (3.33а) , (3.33а)
а выражение всей свободной энергии системы с точностью до аддитивной постоянной принимает вид:
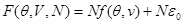 (3.34) (3.34)
Тогда реакция системы на включение внешнего поля задается дополнительным уравнением состояния, которое в зависимости от набора переменных состояния имеет вид:
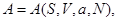 или или 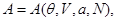  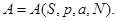 (3.35) (3.35)
Тогда изменение соответствующего термодинамического потенциала, связанное с включением нуля от нуля до 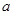 , определяется из выражений : , определяется из выражений :
 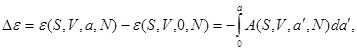
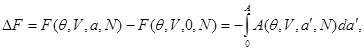 (3.36) (3.36)

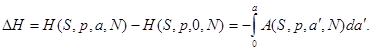
Таким образом, задание термодинамического потенциала в макроскопической теории возможно только на основе использования заданных уравнений термодинамического состояния, которые в свою очередь, сами получаются на основе задания термодинамических потенциалов. Разорвать этот “замкнутый круг” можно только на основе микроскопической теории, в которой состояние системы задается на основе функций распределения с учетом статистических особенностей.
3.
Обобщим полученные результаты на случай многокомпонентных систем. Это обобщение осуществляется путем замены параметра  множеством множеством 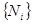 . Рассмотрим сказанное на конкретных примерах. . Рассмотрим сказанное на конкретных примерах.
Положим, что термодинамическое состояние системы задано параметрами 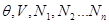 , т.е. мы рассматриваем систему в термостате, состоящую из нескольких компонентов, число частиц в которых равно , т.е. мы рассматриваем систему в термостате, состоящую из нескольких компонентов, число частиц в которых равно  Свободная энергия, являющаяся в этом описании термодинамическим потенциалом, имеет вид: Свободная энергия, являющаяся в этом описании термодинамическим потенциалом, имеет вид:
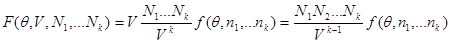 (3.37) (3.37)
В качестве аддитивного параметра в (3.37) введены не число частиц, а объем системы V. Тогда через 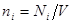 обозначена плотность системы. Функция обозначена плотность системы. Функция  является неаддитивной функцией неаддитивных аргументов. Это достаточно удобно, поскольку при разбиении системы на части функция является неаддитивной функцией неаддитивных аргументов. Это достаточно удобно, поскольку при разбиении системы на части функция 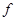 не изменится для каждой части. не изменится для каждой части.
Тогда для параметров термодинамической системы можно записать:
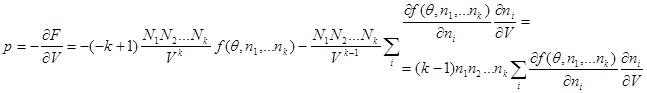
Учитывая, что 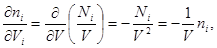 имеем имеем
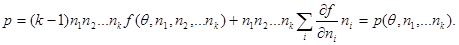 (3.38) (3.38)
Для химического потенциала отдельного компонента запишем:
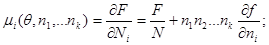 (3.39) (3.39)
Существуют и другие способы учета аддитивных свойств свободной энергии. Введем относительные плотности чисел частиц каждой из компонент:
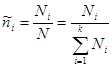 , (3.40) , (3.40)
не зависящие от объема системы V. Здесь 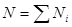 - общее число частиц в системе. Тогда - общее число частиц в системе. Тогда
 (3.41) (3.41)
Выражение химического потенциала в этом случае принимает более сложный вид:
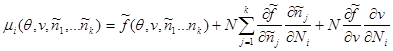
Вычислим производные 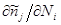 и и  и подставим их в последнее выражение: и подставим их в последнее выражение:
 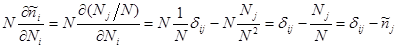
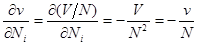
Тогда
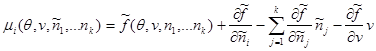 (3.42) (3.42)
Выражение для давления, напротив упростится:
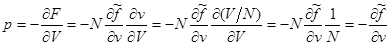 (3.43) (3.43)
Аналогичные соотношения могут быть получены и для потенциала Гиббса. Так, если в качестве аддитивного параметра задан объем, то с учетом (3.37) и (3.38) запишем:
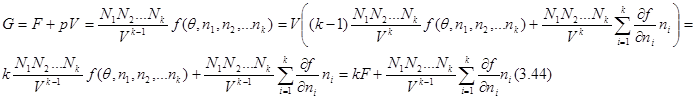 это же выражение может быть получено из (3.юю), которое в случае многих частиц принимает вид: это же выражение может быть получено из (3.юю), которое в случае многих частиц принимает вид:
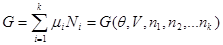 (3.45) (3.45)
Подставляя в (3.45) выражение(3.39), находим:

что полностью совпадает с (3.44).
Для того, чтобы перейти к традиционной записи потенциала Гиббса (через переменные состояния (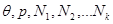 )) необходимо разрешить уравнение (3.38): )) необходимо разрешить уравнение (3.38):
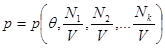
Относительно объема V и подставить результат в (3.44) или (3.45):

Если в качестве аддитивного параметра задано полное число частиц в системе N, то потенциал Гиббса с учетом (3.42) принимает следующий вид:
 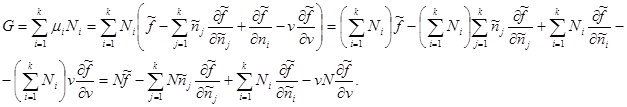
Зная вид удельных величин: 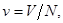 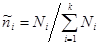 ,получим: ,получим:
 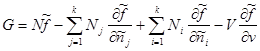 . .
В последнем выражении суммирование по j
заменим на суммирование по i
. Тогда второе и третье слагаемые в сумме дают нуль. Тогда для потенциала Гиббса окончательно получим:
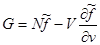 . (3.46) . (3.46)
Это же соотношение может быть получено и другим способом (из (3.41) и (3.43)):
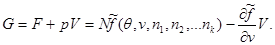
Далее рассмотрим многокомпонентную систему “под поршнем”, состояние которой описывается параметрами (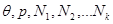 ). Роль термодинамического потенциала в этом случае играет потенциал Гиббса: ). Роль термодинамического потенциала в этом случае играет потенциал Гиббса:
 (3.47) (3.47)
Тогда для химического потенциала каждой из компонент получим:
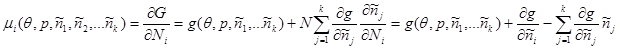 (3.48) (3.48)
При выводе (3.48) выполнены преобразования, аналогичные использованным при выводе (3.42), с помощью воображаемых стенок. Параметры состояния системы образуют набор (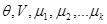 ). ).
Роль термодинамического потенциала играет потенциал 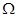 , который принимает вид: , который принимает вид:
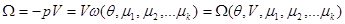 (3.49) (3.49)
Как видно из (3.49), единственным аддитивным параметром в данном случае является объем системы V.
Определим некоторые термодинамические параметры такой системы. Число частиц в данном случае определяется из соотношения:
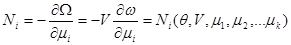 (3.50) (3.50)
Для свободной энергии F
и потенциала Гиббса G
можно записать:
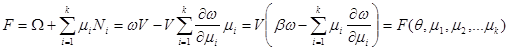 (3.51) (3.51)
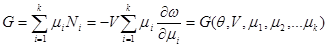 (3.52) (3.52)
Таким образом, соотношения для термодинамических потенциалов и параметров в случае многокомпонентных систем видоизменяются только за счет необходимости учета числа частиц (или химических потенциалов) каждой компоненты. При этом сама идея метода термодинамических потенциалов и расчетов, проводимых на его основе, остается неизменной.
4.
В качестве примера использования метода термодинамических потенциалов рассмотрим задачу химического равновесия. Найдем условия химического равновесия в смеси трех веществ, вступающих реакцию. Дополнительно предположим, что исходные продукты реакции является разреженными газами(это позволяет не учитывать межмолекулярные взаимодобывания), а в системе поддерживаются постоянные температура и давление  , , 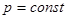 (такой процесс наиболее просто реализовать практически, поэтому условие постоянства давления и температуры создаются в промышленных установках для химической реакции ). (такой процесс наиболее просто реализовать практически, поэтому условие постоянства давления и температуры создаются в промышленных установках для химической реакции ).
Условие равновесия термодинамической системы в зависимости от способа ее описания определяются максимальной энтропией системы или минимальной энергией системы (подробнее см. Базаров Термодинамика). Тогда можно получить следующие условия равновесия системы:
1. Состояние равновесия адиабатически изолированной термодинамической системы, заданной параметрами (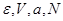 ), характеризуется максимумом энтропии: ), характеризуется максимумом энтропии:
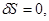  (3.53а) (3.53а)
Второе выражение в (3.53а) характеризует устойчивость равновесного состояния.
2. Состояние равновесия изохорно-изотермической системы, заданное параметрами ( ), характеризуется минимумом свободной энергии. Условие равновесия в этом случае принимает вид: ), характеризуется минимумом свободной энергии. Условие равновесия в этом случае принимает вид:
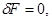 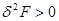 (3.53б) (3.53б)
3. Равновесие изобарно-изотермической системы, задаваемой параметрами (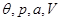 ), характеризуется условиями: ), характеризуется условиями:
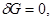 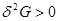 (3.53в) (3.53в)
4. Для системы в термостате с переменным числом частиц, определенной параметрами (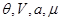 ), условия равновесия характеризуется минимумами потенциала ), условия равновесия характеризуется минимумами потенциала 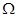 : :
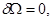  (3.53г) (3.53г)
Перейдем к использованию химического равновесия в нашем случае.
В общем случае уравнение химической реакции записывается в виде:
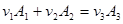 (3.54) (3.54)
Здесь 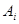 - символы химических веществ, - символы химических веществ, 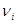 - так называемые, стехиометрические числа. Так, для реакции - так называемые, стехиометрические числа. Так, для реакции
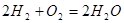
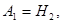 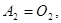 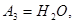  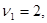 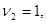 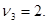
Поскольку в качестве параметров системы выбраны давление и температура, которые положены постоянными. Удобно в качестве состояния термодинамического потенциала рассмотреть потенциал Гиббса G
. Тогда условие равновесия системы будет заключаться в требовании постоянства потенциала G
:
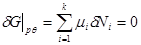 (3.55) (3.55)
Поскольку мы рассматриваем трехкомпонентную систему, положим 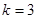 . Кроме того, учитывая (3.54), можно записать уравнение баланса для числа частиц ( . Кроме того, учитывая (3.54), можно записать уравнение баланса для числа частиц (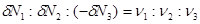 ): ):
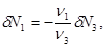 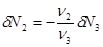 (3.56) (3.56)
Вводя химические потенциалы для каждой из компонент: 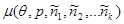 и учитывая сделанные допущения, находим: и учитывая сделанные допущения, находим:
 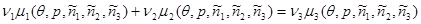 (3.57) (3.57)
Уравнение (3.57) было впервые получено Гиббсом в 1876г. и является искомым уравнением химического равновесия. Легко заметить, сравнивая (3.57) и (3.54), что уравнение химического равновесия получается из уравнения химической реакции путем простой замены символов реагирующих веществ на их химические потенциалы. Этот прием может быть использован и при записи уравнения химического равновесия для произвольной реакции.
В общем случае решение уравнения (3.57) даже для трех компонент является достаточно загруженным . Это связанно, во-первых, с тем, что даже для однокомпонентной системы получить явные выражения для химического потенциала весьма затруднительно. Во-вторых, относительные концентрации 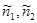 и и  не являются малыми величинами. То есть невозможно выполнить по ним разложение в ряд. Это еще сильнее усложняет задачу решения уравнения химического равновесия. не являются малыми величинами. То есть невозможно выполнить по ним разложение в ряд. Это еще сильнее усложняет задачу решения уравнения химического равновесия.
Физически отмеченные трудности объясняются необходимостью учета перестройки электронных оболочек атомов, вступающих в реакцию. Это приводит к определенным сложностям микроскопического описания , что сказывается и при макроскопическом подходе.
Поскольку мы условились ограничится исследованием разреженности газа, то можно воспользоваться моделью идеального газа. Будем считать, что все реагирующие компоненты являются идеальными газами, заполняющими общий объем и создающие давление p
. В этом случае любым взаимодействием (кроме химических реакций) между компонентами смеси газов можно пренебречь. Это позволяет допустить, что химический потенциал i
-го компонента зависит только от параметров этого же компонента.
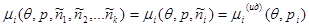 (3.58) (3.58)
Здесь 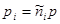 - парциальное давление i
-го компонента, причем: - парциальное давление i
-го компонента, причем:
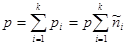
С учетом (3.58) условие равновесия трехкомпонентной системы (3.57) примет вид:
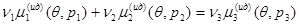 (3.59) (3.59)
Для дальнейшего анализа воспользуемся уравнением состояния идеального газа, которое запишем в виде:
 (3.60) (3.60)
Здесь через 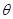 , как и ранее, обозначается термодинамическая температура , как и ранее, обозначается термодинамическая температура 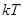 . Тогда известная из школы запись . Тогда известная из школы запись 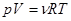 принимает вид: принимает вид:  , что и записано в (3.60). , что и записано в (3.60).
Тогда для каждого компонента смеси получим:
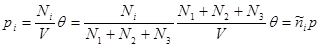 (3.61) (3.61)
Определим вид выражения химического потенциала идеального газа. Как следует из (2.22), химический потенциал имеет вид:
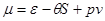 (3.62) (3.62)
Учитывая уравнение (3.60), которое можно записать в виде 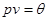 , задача определения химического потенциала сводится к определению удельной энтропии и удельной внутренней энергии. , задача определения химического потенциала сводится к определению удельной энтропии и удельной внутренней энергии.
Система уравнений для удельной энтропии следует из термодинамических тождеств (3.8) и выражения теплоемкости (3.12):
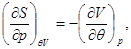 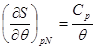
Учитывая уравнение состояния (3.60) и переходя к удельным характеристикам, имеем:
 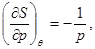 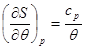 (3.63) (3.63)
Решение (3.63) имеет вид:
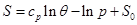
Система уравнений для удельной внутренней энергии идеального газа следует из (2.23):
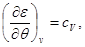 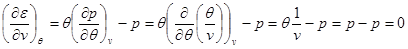
Решение этой системы запишется в виде:
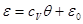
Подставляя (3.64) - (3.65) в (3.66) и учитывая уравнение состояния идеального газа, получаем:
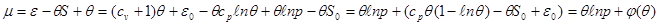 (3.66) (3.66)
Для смеси идеальных газов выражение (3.66) принимает вид:
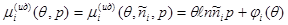
Подставляя (3.67) в (3.59), получаем:

Выполняя преобразования, запишем:


Выполняя потенцирование в последнем выражении, имеем:
 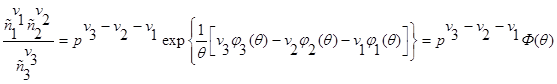 (3.68) (3.68)
Соотношение (3.68) получило название закона действующих масс. Величина 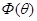 является функцией только температуры и получила название компоненты химической реакции. является функцией только температуры и получила название компоненты химической реакции.
Таким образом химическое равновесие и направление химической реакции определяется величиной давления и температуры.
|