| Самостоятельная работа № 1
Вариант № 8
1.Вывести аналитическую зависимость теплового эффекта (Дж) реакции от температуры Т:

Стандартный тепловой эффект  и уравнение зависимости и уравнение зависимости  из приложения 1. из приложения 1.
2.Вычислить тепловой эффект при температуре Т=500 К.
3.Построить графики зависимости:

 и и  - в том интервале температур, для которого справедливо выведенное уравнение зависимости - в том интервале температур, для которого справедливо выведенное уравнение зависимости 
4.Определить графически  как как  при при  и сравнить полученный результат с рассчитанным по формуле и сравнить полученный результат с рассчитанным по формуле 
Решение.
Таблица 1
| Вещество
|


|
 , Дж/моль∙К , Дж/моль∙К
|
Температурный интервал
|
| 
|

|

|
| 
|
-601,49
|
48,98
|
3,14
|
-11,44
|
298…3000
|
| 
|
-241,8
|
30,0
|
10,71
|
0,33
|
298…2500
|
| 
|
-924,6
|
46,99
|
102,85
|
-
|
298…541
|
| 
|
-
|
78,98
|
13,85
|
-11,11
|
298…541
|
| 
|
-
|
46,99
|
102,85
|
-
|
298…2500
|
| 
|
-16,9
|
31,99
|
-89
|
-11,11
|
298…2500
|
| 
|
81,3
|
|
-
|
-
|
-
|
Из данных, приведенных в таблице, получаем:


  




Проверяем 
С учетом последнего выражения найдем  интегрированием уравнения Кирхгофа в пределах от 298 до Т (Т £ 1000): интегрированием уравнения Кирхгофа в пределах от 298 до Т (Т £ 1000):

Результаты расчетов по уравнениям представлены в табл. 2.
Таблица 2
| T, К
|
 , Дж/К , Дж/К
|
 , Дж/К , Дж/К
|
 , Дж/К , Дж/К
|
 , Дж , Дж
|
| 300
|
70,791
|
77,760
|
-6,969
|
81060
|
| 325
|
72,963
|
80,331
|
-7,368
|
80880
|
| 350
|
74,758
|
82,903
|
-8,145
|
80690
|
| 375
|
76,273
|
85,474
|
-9,201
|
80470
|
| 400
|
77,576
|
88,046
|
-10,47
|
80220
|
| 425
|
78,715
|
90,618
|
-11,903
|
79440
|
| 450
|
79,726
|
93,189
|
-14,74
|
79620
|
| 475
|
80,635
|
95,761
|
-15,126
|
79260
|
| 500
|
81,461
|
98,332
|
-16,871
|
78860
|
| 525
|
82,222
|
100,90
|
-18,678
|
78410
|
| 541
|
82,667
|
102,55
|
-19,883
|
77920
|
На рис. 1 и 2 представлено изменение  ; ;  и и  в зависимости от температуры, а также определение в зависимости от температуры, а также определение  при Т1 = 310 К. при Т1 = 310 К.
Строим графики зависимостей:


 и и 

Определяем графически , как , как  при при  и сравниваем полученный результат с рассчитанным по формуле и сравниваем полученный результат с рассчитанным по формуле


по модулю 
Самостоятельная работа № 2
Вариант № 8
В таблице 1 для некоторого чистого вещества 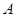 приведены молекулярная масса приведены молекулярная масса  (кг/кмоль), плотности в твердом и жидком состояниях ( (кг/кмоль), плотности в твердом и жидком состояниях (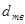 и и  в кг/м3
) при температуре трехфазного равновесия (тройная точка), и экспериментальные данные [2] по упругости паров над твердым и жидким веществом при разных температурах. Необходимо: в кг/м3
) при температуре трехфазного равновесия (тройная точка), и экспериментальные данные [2] по упругости паров над твердым и жидким веществом при разных температурах. Необходимо:
1) по графикам зависимостей  от от  или аналитически рассчитать численные значения постоянных коэффициентов в интегральных уравнениях Клаузиуса — Клапейрона или аналитически рассчитать численные значения постоянных коэффициентов в интегральных уравнениях Клаузиуса — Клапейрона

2) вычислить средние для исследованных интервалов температур теплоты испарения, возгонки и плавления; определить координаты тройной точки (параметры трехфазного равновесия);
3) вычислить величину  , характеризующую наклон линии фазового равновесия " , характеризующую наклон линии фазового равновесия " " в тройной точке; " в тройной точке;
4) построить диаграмму фазовых равновесий вещества;
5) вычислить температуру плавления вещества при заданном внешнем давлении Р (Па) и оценить нормальную температуру кипения;
6) рассчитать изменение внутренней энергии, энтальпии, свободных энергий Гиббса и Гельмгольца для процесса равновесной возгонки 1 моля вещества при температуре тройного равновесия.
Таблица 1
| Вариант
|
Твёрдое состояние
|
Жидкое состояние
|
Условия
|
| 
|

|

|

|
| 8
|
276,6
278,2
279,2
280,2
281,4
|
1413
1706
1879
2066
2372
|
277,2
279,2
281,4
283,2
285,2
288,7
|
1826
2082
2372
2626
2932
3279
|
 ; ;
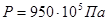 ; ;
 ; ;

|
Решение:
1. Интегрирование уравнения Клаузиуса — Клапейрона в предположении постоянства теплот испарения и возгонки  , ,  дает выражения: дает выражения:

потенцирование, которых приводит к зависимости в явном виде давлений насыщенных паров от температуры:

Графики линейных зависимостей  от от  представлены на рис. 3 по данным, приведенным в табл. 5. представлены на рис. 3 по данным, приведенным в табл. 5.
По положению прямых на рис. 3 возможно графическое определение постоянных А и В в уравнениях  . После чего теплоты испарения и возгонки можно определить из соотношений: . После чего теплоты испарения и возгонки можно определить из соотношений:  и и  . Такие расчеты связаны с ошибками из-за достаточно произвольного проведения прямых линий по экспериментальным точкам. . Такие расчеты связаны с ошибками из-за достаточно произвольного проведения прямых линий по экспериментальным точкам.
Для более точного аналитического расчета параметров уравнения Клаузиуса — Клапейрона воспользуемся методом наименьших квадратов. Постоянные А и В уравнения  , где , где  и и  , можно рассчитать из известных соотношений: , можно рассчитать из известных соотношений:
Таблица 5
| Равновесие твёрдое вещество — газ
|
| 
|

|

|

|

|

|

|

|
| 1
|
1413
|
7,2535
|
276,6
|
0,00361
|
1,300×10–
5
|
0,0261
|
1421
|
| 2
|
1706
|
7,4419
|
278,2
|
0,00359
|
1,288×10–
5
|
0,0267
|
1687
|
| 3
|
1879
|
7,5385
|
279,2
|
0,00358
|
1,281×10–
5
|
0,0271
|
1877
|
| 4
|
2066
|
7,6334
|
280,2
|
0,00356
|
1,267×10–
5
|
0,0274
|
2086
|
| 5
|
2372
|
7,7715
|
281,4
|
0,00355
|
1,260×10–
5
|
0,0279
|
2365
|
| n = 5
|
|
37,6388
|
|
0,01789
|
6,396∙10–5
|
0,1352
|
|
Равновесие жидкость — газ
| i
|

|

|

|

|

|

|

|
| 1
|
1826
|
7,50988
|
277,2
|
0,00360
|
1,296×10–
5
|
0,0270
|
1836,324
|
| 2
|
2082
|
7,64108
|
279,2
|
0,00358
|
1,281×10–5
|
0,0273
|
2071,554
|
| 3
|
2372
|
7,77148
|
281,4
|
0,00355
|
1,260×10–5
|
0,0275
|
2360,579
|
| 4
|
2626
|
7,87321
|
283,2
|
0,00353
|
1,246×10–5
|
0,0277
|
2622,843
|
| 5
|
2932
|
7,98344
|
285,2
|
0,00350
|
1,225×10–5
|
0,0279
|
2943,963
|
| 6
|
3279
|
8,09529
|
288,7
|
0,00346
|
1,197×10–5
|
0,0281
|
3589,551
|
| n = 6
|
|
46,874
|
|
0,02122
|
7,511×10–5
|
0,1655
|
|






где n — число измерений. При использовании данных таблицы получим:

2. Из полученных уравнений рассчитываем среднюю теплоту испарения и возгонки:

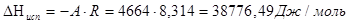 . .
Теплоту плавления вещества в тройной точке найдем по закону Гесса:
DНпл = DНвозг – DНисп = 68716,04−38776,49=29939,55 Дж/моль.
3. Вычислим dT/dp в тройной точке из уравнения:


Координаты тройной точки определяем совместным решением уравнений:
Ттр.т = 281 К; Ртр.т = 2289,5 Н/м2
.

4. На рис. 4 приведены кривые зависимостей давлений насыщенного пара от температуры для твердого и жидкого вещества, рассчитанные по уравнениям . Эти линии определяют параметры фазовых равновесий «тв ® газ» и «ж ® газ». При имеющейся информации линию фазовых равновесий «тв ® ж» проводим с учетом углового коэффициента этой линии в тройной точке
 , ,
который считается независящим от давления (температуры). Получается практически вертикальная линия с неуловимым наклоном вправо. На диаграмме представлены исходные экспериментальные данные.
5. Температуру плавления вещества при давлении  вычислим по формуле: вычислим по формуле:

Отсюда 

Рис. 2. Температурная зависимость давлений насыщенного пара для твердого и жидкого вещества
Нормальную температуру кипения вещества оценим, подставив в уравнение  . Получим . Получим

6. Изменение термодинамических функций для процесса равновесной возгонки 1 моля вещества при условиях трехфазного равновесия составят:
| Энергии Гиббса
|

|
| Энергии Гельмгольца
|

|
| Энтальпии
|

|
| Внутренней энергии
|

|
Самостоятельная работа № 3
Вариант № 8
1. Выразить  и и через равновесное число молей продукта х, если исходные вещества А и В взяты в стехиометрических количествах при общем давлении равновесной газовой смеси Р и температуре Т, К; через равновесное число молей продукта х, если исходные вещества А и В взяты в стехиометрических количествах при общем давлении равновесной газовой смеси Р и температуре Т, К;
2. Рассчитать  и и  при 300 К, если при 300 К, если 
3. Вычислить равновесное количество вещества С при давлении в равновесной системе  и рассчитайте степень превращения вещества А и В. и рассчитайте степень превращения вещества А и В.
A + B = 3C
Решение:
1) , что говорит о том, что смесь неравновесная , что говорит о том, что смесь неравновесная

Равновесные парциальные давления определим по закону Дальтона:
 ; ;
 ; ;

где  - общее давление. Закон действующих масс для данной реакции запишется так: - общее давление. Закон действующих масс для данной реакции запишется так:

Константу  находим из соотношения: находим из соотношения:

2) Расчет  и и  при заданной температуре, давлении и известном значении х при заданной температуре, давлении и известном значении х


3) При изменении давления изменяется параметр х, температура остаётся неизменной, значение  не меняется. не меняется.

 молей молей
Равновесное количество вещества равно:
 молей молей
Рассчитаем степень превращения веществ А и В:
 
 , условие выполнено. , условие выполнено.
Самостоятельная работа №4
Вариант № 8
Гетерогенная реакция между веществами А и В (табл. 1) протекает при постоянной температуре Т;
1) определите стандартное сродство веществ А и В при 298 К; веществ А и В при 298 К;
2) вычислите константы равновесия  и и  при температуре Т; при температуре Т;
3) определите количество прореагировавшего твёрдого вещества А, если объём системы V м3
, а исходное давление газа В равно Р1
, объёмом твердой фазы можно пренебречь;
4) определите изменение энергии Гиббса, для начала реакции, если исходное давление газообразных веществ В и С соответственно равны Р2
и Р3
, реакция протекает при температуре Т, К идеально обратимо.
Таблица 1
| Реакция
|
Т, К
|
 Па Па
|
 Па Па
|
 Па Па
|
 м3 м3
|
| 
|
773
|
10
|
705
|
800
|
2
|
Решение:

1) Вычисление стандартного сродства  веществ А и В при 298 К; веществ А и В при 298 К;




2)Вычисление констант равновесия  и и  при температуре 773 К. при температуре 773 К.


 
| Вещество
|


|
 , Дж/моль∙К , Дж/моль∙К
|
Температурный интервал
|
| 
|

|

|
| 
|
0
|
16,86
|
4,77
|
– 8,54
|
298…2500
|
| 
|
0
|
31,46
|
3,39
|
– 3,77
|
298…3000
|
| 
|
-110,53
|
28,41
|
4,10
|
– 0,46
|
298…2500
|
| 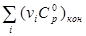
|
-
|
28,41
|
4,10
|
– 0,46
|
298…2500
|
| 
|
-
|
48,32
|
8,16
|
12,31
|
298…2500
|
| 
|
-9,47
|
– 19,91
|
–4,06
|
–12,77
|
298…2500
|







Константу равновесия  можно найти из соотношения: можно найти из соотношения:

3)Определение количества прореагировавшего твёрдого углерода, если объём системы  м3
, а исходное давление газа м3
, а исходное давление газа  равно равно  Па Па
 , что говорит о том, что смесь неравновесная , что говорит о том, что смесь неравновесная

 , ,

Равновесные парциальные давления определим по закону Дальтона:
 ; ;
 ; ;
где  - общее давление. Закон действующих масс для данной реакции запишется так: - общее давление. Закон действующих масс для данной реакции запишется так:


С учетом того, что углерода расходуется в 2 раза больше, чем кислорода, то количество прореагировавшего углерода составит 0,005 молей.
4) Определение изменения энергии Гиббса для начала реакции

Самостоятельная работа № 5
Вариант 8
Зависимость константы равновесия реакции от температуры (табл. 9) выражается уравнением  коэффициенты a, b, c и в приведены в табл. 1, давление выражено в Паскалях: коэффициенты a, b, c и в приведены в табл. 1, давление выражено в Паскалях:
1. определите константу равновесия реакции при Т, К;
2. постройте график зависимости  в интервале температур от (Т – 100) до (Т + 100) К; в интервале температур от (Т – 100) до (Т + 100) К;
3. укажите, как изменяется константа равновесия при повышении температуры;
4. определите тепловой эффект реакции  при Т, К; при Т, К;
5. сопоставьте тепловой эффект, вычисленный в п. 4, с тепловым эффектом, вычисленным по закону Кирхгофа при температуре Т, К;
6. определите стандартное сродство реагирующих веществ при температуре Т, К.
| Реакция (А)
|
К
|
Т, К
|
| 
|

|
500
|
Таблица 1
| a
|
b
|
c
|
d
|
| – 4600
|
0,623
|
– 0,001 02
|
17,776
|
Решение:
1)Определение константы равновесия при 500 К.
Заменяем десятичный логарифм натуральным, для чего умножаем обе части уравнения на  . .

Подставляем значение Т в полученное уравнение:

2)Построение графика зависимости  в интервале температур от 400 до 600 К; в интервале температур от 400 до 600 К;
| 
|

|

|

|

|

|
| 400
|
7,489
|
475
|
9,724
|
550
|
10,558
|
| 425
|
8,156
|
500
|
9,747
|
575
|
10,908
|
| 450
|
8,747
|
525
|
10,173
|
600
|
11,228
|
3) Константа равновесия при повышении температуры увеличивается. Принимаем Т=1000К и повторяем расчет. Функция экспоненты в степени х является возрастающей, значит чем больше значение логарифма функции, тем больше сама функция.

4)Определение стандартного теплового эффекта при Т=500К



5)Сопоставление теплового эффекта, вычисленного в п. 4, с тепловым эффектом, вычисленным по закону Кирхгофа при температуре 500 К;
Сначала вычисляем стандартный тепловой эффект при 298 К.
 
Вычисление теплоёмкостей конечных и исходных продуктов реакции. Значения  и и  взяты из приложения 1 методического пособия. взяты из приложения 1 методического пособия.

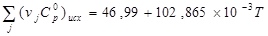




Небольшая разница возникает из-за погрешности вычисления.
6) Вычисление стандартного сродства  веществ А и В при 500 К; веществ А и В при 500 К;

Самостоятельная работа №7
Вариант № 8
Вычислите константу равновесия Кр реакции при заданной температуре Т. Для расчета воспользоваться методом Темкина — Шварцмана и прил. 1 и 2.
| Реакция
|
Т, К
|
| 
|
400
|
Воспользуемся формулой:



| Вещество
|
 , Дж/моль∙К , Дж/моль∙К
|
| 
|

|

|

|
| 
|
5,75
|
175,11
|
—
|
– 57,85
|
| 
|
28,41
|
4,10
|
– 0,46
|
—
|
| 
|
22,47
|
201,80
|
—
|
– 63,50
|
| 
|
22,47
|
201,80
|
—
|
– 63,50
|
| 
|
34,16
|
179,21
|
– 0,46
|
– 57,85
|
| 
|
−11,69
|
22,59
|
– 0,46
|
– 5,65
|


|