| Ненасыщенные спирты.Фенолы. Хиноны.
К ненасыщенным относятся спирты с двойной углерод-углеродной связью (1,2); с тройной углерод-углеродной связью (3); фенолы (4).

Спирты с двойной углерод-углеродной связью бывают винильного (CH2
=CH-OH) и аллильного типа (CH2
=CH-CH2
-OH; CH2
=CHCH2
CH2
OH).
Виниловый спирт в свободном состоянии не существует. он, как и другие ненасыщенные спирты с гидроксилом при углероде с двойной связью, в момент образования очень быстро изомеризуется в альдегид или кетон (правило Эльтекова):
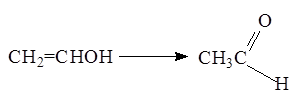
Однако, известен его полимер – поливиниловый спирт, получаемый гидролизом поливинилацетата. На его основе получают синтетическое волокно (винол) и лекарственные препараты.
Аллиловый спирт – устойчивое соединение, которое получают гидролизом хлористого аллила (продукт хлорирования пропилена) в водном растворе щелочи:
CH2
=CHCH2
Cl + H2
0 ® CH2
=CHCH2
OH
Аллиловый спирт по месту двойной связи присоединяет водород, галогены, галогенводородные кислоты.
аллиловый спирт вступает в реакции нуклеофильного замещения (sn
1
) с большей скоростью, чем трет-бутиловый спирт. Фактор, приводящий к стабилизации аллильного катиона, называют резонансным эффектом. Катион может быть изображен двумя одинаковыми способами с идентичным расположением атомов, но различным распределением электронов:

Реальный аллильный катион может считаться гибридом обеих структур. Аллильный катион также может быть представлен структурой, содержащей частичные связи:
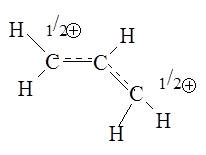
Поскольку положительный заряд распределен между двумя атомами углерода, нуклеофильное замещение в аллильных системах часто сопровождается аллильной перегруппировкой, смысл которой состоит в том, что нуклеофил связывается с любым из атомов углерода, имеющих положительный заряд в промежуточно образующемся аллильном катионе.
Особое место в органической химии занимают фенолы:

Нумерацию начинают от углеродного атома, связанного с гидроксилом. Многие фенолы сохраняют тривиальные названия:
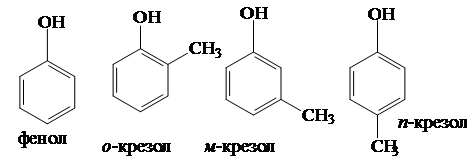
Способы получения фенолов
1. Коксование каменного угля
2. Хлорный метод

3. Способ Рашига

4.Сульфонатный способ

5. Кумольный метод
Метод включает две стадии: окисление изопропилбензола (кумола) кислородом воздуха до гидропероксида и его кислотное разложение:

6.Окислительные методы
Один из них основан на переработке циклогексана:
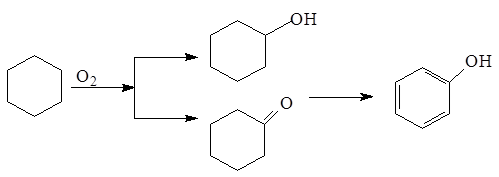
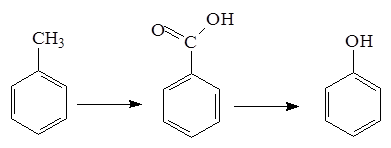
7. Действие на первичные ароматические амины азотистой кислоты.
В качестве промежуточных продуктов в этом процессе получаются ароматические диазосоединения:

Химические свойства фенолов
1.
реакции по гидроксильной группе
Фенолы, так же, как и алифатические спирты, обладают кислыми свойствами, т.е. способны образовывать соли - феноляты. Однако они более сильные кислоты и поэтому могут взаимодействовать не только со щелочными металлами (натрий, литий, калий), но и со щелочами и карбонатами:
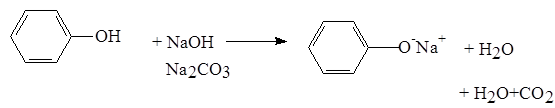
Высокая кислотность фенола связана с акцепторным свойством бензольного кольца (эффект сопряжения):
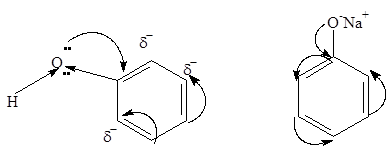
Феноляты легко взаимодействуют с галогеналканами и галогенангидридами:

Фенол способен взаимодействовать с галогенангидридами и ангидридами кислот:
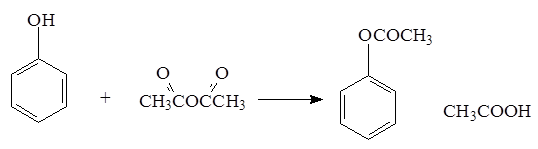
2.
Реакции по бензольному кольцу
Гидроксил является электронодонорной группой и активирует орто- и пара-положения в реакциях электрофильного замещения:

1. Галогенирование

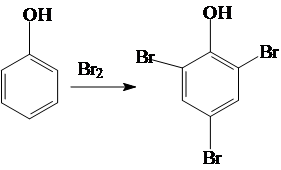
2. Нитрование

Пикриновую кислоту (2,4,6-тринитротолуол) получают через стадию сульфирования:
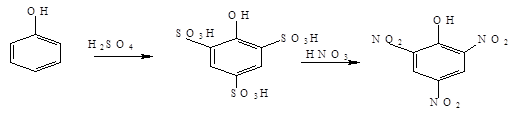
3.
Сульфирование
Сульфирование фенола в зависимости от температуры протекает в орто- или пара-положение:

4. Алкилирование и ацилирование по Фриделю-Крафтсу
Фенолы образуют с хлористым алюминием неактивные соли ArOAlCl2
, поэтому для алкилирования фенолов в качестве катализаторов применяют протонные кислоты или металлооксидные катализаторы кислотного типа. Это позволяет использовать в качестве алкилирующих агентов только спирты и алкены:

Алкилирование протекает последовательно с образованием моно-, ди- и триалкилфенолов. Одновременно происходит кислотнокатализируемая перегруппировка с миграцией алкильных групп:
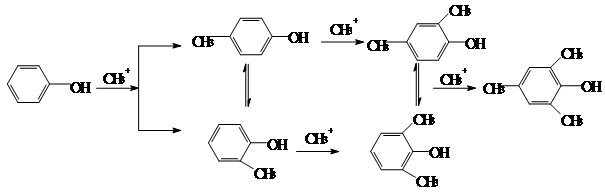
Фенолы реагируют с весьма слабыми электрофилами (альдегиды) в присутствии кислот или оснований:
+
 
|