Томский межвузовский центр дистанционного образования
Томский государственный университет
систем управления и радиоэлектроники (ТУСУР)
Кафедра промышленной электроники (ПрЭ)
Контрольная работа №1
по дисциплине «Химия»
Примеры решения задач по курсу химии
Выполнил:
студент ТМЦДО
специальности 200700
2005г
1. Закончите уравнения реакций:
P2
O5
+Ca(OH)2
=
Sn+O2
=
SnCl4
+NaOH=
Sn(OH)4
+NaOH=
[Mg(OH)]2
CO3
+HCl=
Ge+O2
=
Al+NH3
=
AlH3
+O2
=
SiH4
→T
SiH4
+O2
=
Какие реакции можно использовать в технологии получения плёнок (каких), составить ионные уравнения реакций (где возможно).
Решение:
P2
O5
+3Ca(OH)2
= Ca3
(PO4
) 2
+ 3H2
O
Sn+O2
= SnO2
SnCl4
+4NaOH= 4NaCl+Sn(OH)4
Sn(OH)4
+4NaOH= Na4
SnO4
+4H2
O
[Mg(OH)]2
CO3
+4HCl=2MgCl2
+CO2
+3H2
O


Ge+O2
= GeO2
2Al+2NH3
=2AlH3
+N2
2AlH3
+O2
=Al2
O3
+3H2
O
SiH4
→T
Si+2H2
SiH4
+2O2
=SiO2
+2H2
O
2. При растворении в соляной кислоте 5,4 г сплава алюминия с цинком объём выделившегося водорода, приведённый к н. у. составил 3,8 л. Какой процентный состав сплава?
Решение:
Пусть х – масса алюминия в сплаве, тогда:
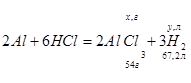
Находим V(H2
), выделившийся при реакции Al с HCl:
x, г(Al) – y, л(H2
)
54 г(Al) – 67,2 л(H2
)
y = (67,2*x)/5,4 л.

Находим V(H2
), выделившийся при реакции Zn с HCl:
z = ((5,4 г - x)*22,4)/65
Общий V(H2
) при реакции сплава с HCl = 3,8 л, следовательно:
z + y = 3,8 (л), тогда находим массу Al:
(67,2 * x)/54+((5,4-x)*22,4)/64=3,8 (л).
22,4*(3x/54+(5,4-x)/64)=3,8
(22,4*46x+97,2)/1152=3,8
46x+97,2=3,8*1152/22,4
46x+97,2=195,4
46x=98,2
x = 2,14 (г) – масса алюминия.
Находим m (Zn):
5,4 – 2,14 = 3,26 (г)
W(Al) = (2,14/5,4)*100% = 39,6%
W(Zn) = (3,26/5,4)*100% = 60,4%
Ответ: состав сплава: 39,6% Al и 60,4% Zn.
3. Вычислить изменение энергии Гиббса для химической реакции:
4CO(
Г
)
+2SO2(
Г
)
=S2(T)
+4CO2(
Г
)
,
при 25о
С по стандартным значениям энтальпий образования и абсолютных энтропий. Реакция проводится между чистыми веществами:
 
 
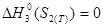 
 
На основании вычисленной энергии Гиббса сделать вывод о возможности реакции? Измениться ли направление процесса при повышении температуры до 100о
Какую роль при этом играют энтальпийный и энтропийный факторы?
Решение
:
4СO(
r
)
+2SO2(
r
)
=S2(
T
)
+4CO2(
r
)
Найдём изменения энтальпии:

Найдём изменение энтропии:
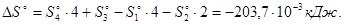
Зависимость энергии Гиббса реакции описывается уравнением

при стандартной температуре t=250
C (T=298 K):

1) При t=1000
C (T=373 K):

При стандартной температуре значение ( ) )  свидетельствует о том что реакция смещается вправо, в сторону продуктов реакции, при свидетельствует о том что реакция смещается вправо, в сторону продуктов реакции, при  ( ( ) )  но т. к. но т. к.  менее электроотрицательнее, то процесс смещения идет в право в меньшей степени. А если менее электроотрицательнее, то процесс смещения идет в право в меньшей степени. А если  было бы >0 то реакция изменила бы направление в обратную сторону. было бы >0 то реакция изменила бы направление в обратную сторону.
Энтропийный и энтальпийный факторы определяют направление реакций, если энтропия не меняется  , то фактором, определяющим направление реакции, служит энтальпия, если , то фактором, определяющим направление реакции, служит энтальпия, если  то и то и то это идет процесс с выделением тепла. Если же то это идет процесс с выделением тепла. Если же 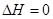 , то система может перейти только в состоянии с большей энтропией , то система может перейти только в состоянии с большей энтропией  , из-за знака минус , из-за знака минус   изменение энергии Гиббса изменение энергии Гиббса  . .
4. Исходя из теплот реакций окисления As2
O3
кислородом и озоном
As2
O3
+O2
= As2
O5
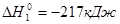
3As2
O3
+2O3
= 3As2
O5

Вычислить теплоту образования озона из молекулярного кислорода
3/2O2
→O3.
Решение:
Первое уравнение умножим на 3:
3As2
O3
+3O2
=3As2
O5
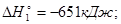
3As2
O3
+2O3
=3As2
O5
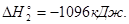
Вычтем из первого уравнения второе:
3O2
=2O3
или 3/2О2
=О3.

- процесс самопроизвольно протекать не может.
5. Константа равновесия реакции FeO(
T
)
+CO«Fe(
T
)
+CO2
при некоторой температуре равна 0,5. Найти равновесные концентрации CO и CO2
, если начальные концентрации этих веществ составляли: [CO]=0,05 моль/л, [CO2
]=0,01 моль/л.
Решение
:
FeO(T)
+CO  Fe(T)
+CO2 Fe(T)
+CO2
К=0,5.
Начальные концентрации [CO]=0,05моль/л; [CO2
]=0,01моль/л.
По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции, примем изменение концентрации [СО] до равновесия равному Х моль/л тогда в момент равновесия его концентрация станет 0,05-Х, а у СО2
увеличится на Х, т.е. будет 0,01+Х. Коэффициенты в уравнении одинаковы n(CO)=n(CO2
). Для момента равновесия  концентрации взяты равновесны. концентрации взяты равновесны.
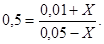
0,025-0,5Х=0,01+Х или 1,5Х=0,015
т. е. Х=n=0,01моль/л отсюда в момент равновесия:
[CO2
]1
=0,01+0,01=0,02моль/л
[CO]1
=0,05-0,01=0,04моль/л
Ответ: [CO2
]=0,02моль/л; [CO]=0,04моль/л.
6. В состоянии равновесия системы CO2
+H2
=CO+H2
O(Г)
реакционная смесь имела объёмный состав: 22% CO2
, 42% H2
, 17% CO, 20% H2
O. Вычислить Kp
и Kc
для этой реакции при 1900 К и давлении 98501 Па.
Решение:
Для вычисления константы равновесия Kp
воспользуемся парциальными давлениями реагирующих веществ:

Определим парциальные давления реагирующих веществ:


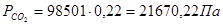

Определяем Kp
:

Между Kp
и Kc
существует следующая взаимосвязь:

где  - разность между числом молей газообразных веществ продуктов реакции и исходных веществ: - разность между числом молей газообразных веществ продуктов реакции и исходных веществ:
 =2-2=0, следовательно: =2-2=0, следовательно:  . .
Ответ: Kp
= Kc
= 0,37.
7. Постройте диаграмму состояния систем висмут-теллур по следующим данным:
| Bi, вес % |
100 |
93 |
80 |
60 |
52 |
30 |
15 |
0 |
| Температура появления кристаллов, о
С |
271 |
250 |
400 |
540 |
570 |
480 |
398 |
430 |
По построенной диаграмме:
а) Определите тип диаграммы и её особенности;
б) Примените правило фаз Гиббса для всех полей, линий и характерных точек на этой диаграмме;
в) Постройте кривые охлаждения для сплавов, содержащих 0, 20, 15, 52, 80 и 100% висмута.
Сформулируйте правило фаз Гиббса, что называется фазой, компонентом, эвтектикой?
Решение:
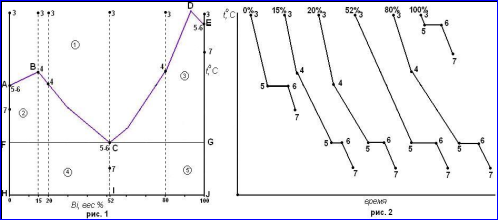
Данная диаграмма представляет собой диаграмму плавкости. В точках А и Е системы инвариантны. Правило фаз для них выглядит как: С = 1 – 2 + 1 = 0. При температурах выше t(A) и t(E) чистые компоненты находятся в расплаве (С = 1 – 1 + 1 = При температурах ниже t(A) и t(E) в твёрдом состоянии (С = 1 – 1 + 1 = 1).
Точка А характеризует температуру плавления Te, точка E характеризует температуру плавления Bi.
Линия ABCDE – линия ликвидуса.
Линия FCG – линия эвтектики, линия солидуса.
Линия AH – линия солидуса Te.
Линия EJ – линия солидуса Bi.
Линия ABC – расплав, насыщенный Te.
Линия CDE – расплав, насыщенный Bi.
Точка С – расплав, насыщенный Te и Bi.
Линии ликвидуса и солидуса делят диаграмму на несколько полей: 1- ненасыщенный расплав Bi и Te (С = 2 – 1 + 1 = 2); 2 – расплав компонентов Bi и Te и кристаллы Te (С = 2 – 2 + 1 = 1); 3 – расплав компонентов Bi и Te и кристаллы Bi (С = 2 – 2 + 1 = 1); 4 и 5 - кристаллы Bi и Te (С = 2 – 2 + 1 = 1).
Кривые охлаждения построены на рисунке 2. Все пробы, одинаковые по массе, но разные по концентрации, характеризуются точкой 3. Температурные остановки 5-6 на кривых охлаждения при 0 и 100% Bi указывают на то, что чистые компоненты кристаллизуются при постоянной температуре t(A) и t(E) (С = 1 – 2 + 1 = 0). Участки 3-5 и 6-7 соответствуют охлаждению чистых компонентов в жидком и твёрдом состояниях соответственно (С = 1 – 1 + 1 = 1). Кривые охлаждения 15, 20 и 80%: участок 3-4 отвечает охлаждению состава (С = 2 – 1 + 1 = 2). Точке 4 соответствует температура начала кристаллизации одного из компонентов (15, 20% - Te, 80% - Bi). За счёт выделяющейся теплоты кристаллизации в точке 4 наблюдается излом, но температура кристаллизации расплава не сохраняется постоянной, так как его состав непрерывно меняется, а число степеней свободы равно 1 (С = 2 – 2 + 1 = 1). На участке 4-5 в системе продолжается кристаллизация Te (15 и 20%) и Bi (80%) и каждой температуре соответствует определённый состав насыщенного расплава, который постепенно меняется до эвтектического. Расплав, соответствующий точке 5 становится насыщенным относительно обоих компонентов (точка Cна диаграмме), начинается кристаллизация эвтектики, состоящей из кристаллов Te и Bi. Число степеней свободы уменьшается до нуля (С = 2 – 3 + 1 = 0) и температура остаётся постоянной до полного затвердевания смеси (участок 5-6). Продолжительность температурной остановки тем больше, чем ближе состав исходного расплава к составу эвтектики. Участок 6-7 соответствует охлаждению двухфазной системы в твёрдом состоянии (С = 2 – 2 + 1 = 1).
Правило фаз Гиббса – в равновесной системе, на которую из внешних факторов оказывают влияние только температура и давления, число степеней свободы равно числу компонентов минус число фаз плюс два.
Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствие внешнего поля сил одинаковыми химическими, физическими и термодинамическими свойствами во всех своих точках.
Компонентом называют индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из неё и существовать самостоятельно.
Эвтектика – есть смесь из нескольких (двух или более) компонентов, имеющая определённую характерную структуру, и дающая при температуре своего плавления расплав – раствор, насыщенный относительно всех компонентов, входящих в состав.
8. Возможно ли существование однокомпонентной системы, состоящей из четырёх фаз? Как доказать?
Решение:
Для однокомпонентной системы правило фаз Гиббса принимает вид:
C = 1 – Ф + 2 = 3 – Ф.
Если минимальное число степеней свободы равно нулю (система инвариантна), то Ф = 3. Значит, в равновесной однокомпонентной системе могут существовать максимально три фазы (т, ж, г).
|