Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра
: «Технология органического и нефтехимического синтеза»
Курсовая работа
по курсу:
«Теория химических процессов органического синтеза»
Самара
2006 г.
Задание №1
При взаимодействии мезитилена со спиртом получена реакционная масса следующего состава (% масс.): - мезитилен – 10,39, АО-40 – 62,25, м-ксилол – 2,23, тетраметилбензол – 14,15, исходный спирт – 7,98. Вычислить степень конверсии реагентов, селективность процесса по каждому из продуктов реакции в расчете на каждый реагент и выход на пропущенное сырье каждого из продуктов реакции в расчете на один реагент.
Решение:
наиболее вероятная схема превращений:


Составим таблицу распределения мол. долей исх. вещества:
| Компонент
|
% масс.
|
М
|
G
|
Кол-во мол. исх. в-ва
|
| мезитилен
|
спирт
|
| мезитилен
|
10,39
|
120
|
0,0866
|
b
1
=
0.0866 |
0 |
| 4-гидроси
|
7,98
|
235
|
0,0340
|
b
2
=
0 |
d
1
=
0,0340 |
| АО-40
|
62,25
|
771
|
0,0807
|
b3
=
0.0807 |
d2
=
0,2422 |
| м-ксилол
|
2,23
|
109
|
0,0205
|
b4
=
0.0205 |
0 |
| ТМБ
|
14,15
|
134
|
0,1056
|
b5
=
0.1056 |
0 |
Степень конверсии мезитилена определяется по формуле:

Степень конверсии спирта:
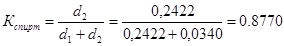 . .
Селективность продуктов в расчете на мезитилен рассчитывается по формуле:  , по спирту: , по спирту:  . Результаты расчетов приведены в табл. 1. . Результаты расчетов приведены в табл. 1.
Таблица 1
| Компонент
|
Селективность
|
| по мезитилену
|
по спирту
|
| АО-40
|
0,3904
|
1
|
| м-ксилол
|
0,0989
|
| ТМБ
|
0,5106
|
Проверка:  , , 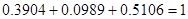 . .
Выход продуктов на пропущенное сырье в расчете на пропилен рассчитывается по формуле:  , в расчете на спирт: , в расчете на спирт:  . Результаты представлены в табл. 2: . Результаты представлены в табл. 2:
Таблица 2
| Продукт/Пропущенное сырье
|
мезитилен
|
спирт
|
| АО-40
|
0,2752
|
0,8770
|
| м-ксилол
|
0,0697
|
0
|
| ТМБ
|
0,3599
|
0
|
Задание № 2
Решение:
Схема реакции представлена на рис. 1:

Рис. 1. Дегидрирование н-
бутана.
Схема реактора представлена на рис. 2.

Рис. 2. Схема теплового баланса реактора
Тепло, входящее в реактор, определяется по формуле:
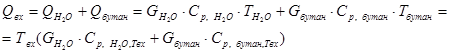 , (1) здесь: , (1) здесь:
 , ,
 , ,
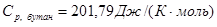 - определено для Т = 800К
из логарифмического полиномиального уравнения, полученного по табличным данным; - определено для Т = 800К
из логарифмического полиномиального уравнения, полученного по табличным данным;
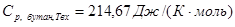 определено для Твх
из логарифмического полиномиального уравнения для Ср
н
-пентана с помощью функции «Поиск решения» программы «MicrosoftExcel»; определено для Твх
из логарифмического полиномиального уравнения для Ср
н
-пентана с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 - для 1000К определено по табличным данным; - для 1000К определено по табличным данным;
 - определено для Твх
из полиномиального уравнения для Ср
воды с помощью функции «Поиск решения» программы «MicrosoftExcel»; - определено для Твх
из полиномиального уравнения для Ср
воды с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 , , 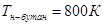 , ,

С помощью функции «Поиск решения» программы «MicrosoftExcel» методом наименьших квадратов определено значение Твх
= 966К
.

Энтальпия реакции при данной Твх
:
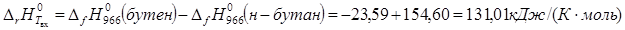
Теплота реакции определяется величиной энтальпии реакции, массового расхода реагента, степенью конверсии реагента.
Рассмотрим, когда степень конверсии  . .
 , ,
Согласно уравнению теплового баланса:


Здесь:  , ,
 - определено для Твых
из логарифмического полиномиального уравнения с помощью функции «Поиск решения» программы «MicrosoftExcel»; - определено для Твых
из логарифмического полиномиального уравнения с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 , ,
 - определено для Твых
из логарифмического полиномиального уравнения для Ср
н
-бутана с помощью функции «Поиск решения» программы «MicrosoftExcel»; - определено для Твых
из логарифмического полиномиального уравнения для Ср
н
-бутана с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 , ,
 - определено для Твых
из логарифмического полиномиального уравнения для Ср
бутена с помощью функции «Поиск решения» программы «MicrosoftExcel»; - определено для Твых
из логарифмического полиномиального уравнения для Ср
бутена с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 - определено для Твых
из логарифмического полиномиального уравнения с помощью функции «Поиск решения» программы «MicrosoftExcel»; - определено для Твых
из логарифмического полиномиального уравнения с помощью функции «Поиск решения» программы «MicrosoftExcel»;
 , ,
С помощью функции «Поиск решения» программы «MicrosoftExcel» методом наименьших квадратов определено значение Твых
= 931К
.
Аналогично определяем значения Твых
для различных значений степени конверсии. Полученные значения представлены в таблице 3.
Таблица 3
| α
|
Твых
|
| 0,1
|
34
|
| 0,2
|
45
|
| 0,4
|
66
|
| 0,6
|
88
|
Графическая зависимость перепада температур на входе и выходе от степени конверсии представлена на рисунке 3.

Рис. 3. Зависимость адиабатического перепада температур от степени конверсии
Выводы
Как видно, характерной особенностью процесса является линейное увеличение адиабатического перепада температур в зоне реактора при увеличении степени конверсии исходного вещества. Это обуславливает некоторые технологические особенности промышленного процесса дегидрирования н-
бутана.
Реактор процесса дегидрирования представляет собой колонну, снабженную провальными тарелками. Реакционная смесь подается вниз колонны и пары поднимаются через тарелки, проходя слой катализатора. При этом, как ясно видно из результатов расчетов, реакционная смесь охлаждается, и процесс дегидрирования замедляется. Во избежание подобного вверх колонны подается подогретый катализатор, регенерированный в регенераторе. Более горячий катализатор контактирует с частично прореагировавшей смесью, и наоборот, чем достигается выравнивание скоростей реакции по всему объему. На регенерацию закоксованный катализатор поступает, стекая по десорберу, где его отдувают от углеводородов азотом.
Таким образом, за счет дополнительного подогрева регенерированного катализатора и подачи его вверх колонны реактора достигается выравнивание температуры процесса.
Задание №1
Выполнить полный количественный анализ процесса пиролиза изопентана с образованием метана и изобутилена.
Дать анализ зависимостей равновесной степени конверсии изопентана и состава равновесной смеси от варьируемых параметров.
Аргументировать технологические особенности промышленных процессов пиролиза углеводородов и конструктивные особенности реакторов пиролиза.
Решение:
Проведем предварительный расчет процесса. Для этого необходимо ввести допущение, что побочных реакций не протекает, селективность процесса по целевому продукту 100%, то есть упрощенная схема реакции имеет вид:

Для определения параметров процесса необходимо определить термодинамические данные веществ, участвующих в реакции:
Для изопентана:
| Т, К
|
∆Н, кДж/моль
|
S,Дж/моль*К
|
| 298
|
-154,47
|
343,59
|
| 300
|
-154,68
|
344,34
|
| 400
|
-163,64
|
383,34
|
| 500
|
-171,00
|
420,74
|
| 600
|
-176,86
|
456,39
|
| 700
|
-181,33
|
490,28
|
| 800
|
-184,64
|
522,37
|
| 900
|
-186,82
|
552,79
|
| 1000
|
-188,03
|
581,62
|
Для изобутилена:
| Т, К
|
∆Н, кДж/моль
|
S,Дж/моль*К
|
| 298
|
-16,90
|
293,59
|
| 300
|
-17,03
|
294,18
|
| 400
|
-22,72
|
322,92
|
| 500
|
-27,61
|
349,87
|
| 600
|
-31,71
|
375,26
|
| 700
|
-35,02
|
399,15
|
| 800
|
-37,66
|
421,66
|
| 900
|
-39,62
|
442,96
|
| 1000
|
-40,96
|
463,13
|
Для метана:
| Т, К
|
∆Н, кДж/моль
|
S,Дж/моль*К
|
| 298
|
-74,85
|
186,27
|
| 300
|
-74,89
|
186,52
|
| 400
|
-77,95
|
197,44
|
| 500
|
-80,75
|
207,15
|
| 600
|
-83,26
|
216,15
|
| 700
|
-85,35
|
224,68
|
| 800
|
-87,11
|
232,80
|
| 900
|
-88,49
|
240,58
|
| 1000
|
-89,54
|
248,03
|
Для воды, которая служит инертным разбавителем в данном процессе:
| Т, К
|
∆Н, кДж/моль
|
S,Дж/моль*К
|
| 298
|
-241,84
|
188,74
|
| 300
|
-241,84
|
188,95
|
| 400
|
-242,84
|
198,70
|
| 500
|
-243,84
|
206,48
|
| 600
|
-244,76
|
212,97
|
| 700
|
-245,64
|
218,66
|
| 800
|
-246,48
|
223,76
|
| 900
|
-247,19
|
228,36
|
| 1000
|
-247,86
|
232,67
|
На основании полученных результатов определяем для температурного диапазона термодинамические параметры процесса, константу равновесия и степень конверсии реагентов:


 , ,
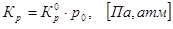
| Т, К
|
 ,Дж/моль ,Дж/моль
|
 ,
Дж/К моль ,
Дж/К моль
|
Кр
0
|
Кр
, кПа
|
| 298
|
62718,16
|
136,27
|
0,0001
|
0,01
|
| 300
|
62760,00
|
136,36
|
0,0002
|
0,02
|
| 400
|
62969,20
|
137,03
|
0,0860
|
8,71
|
| 500
|
62634,48
|
136,27
|
3,7567
|
380,65
|
| 600
|
61881,36
|
135,02
|
46,2817
|
4689,49
|
| 700
|
60960,88
|
133,55
|
267,4475
|
27099,12
|
| 800
|
59873,04
|
132,09
|
978,1709
|
99113,17
|
| 900
|
58701,52
|
130,75
|
2647,6177
|
268269,87
|
| 1000
|
57530,00
|
129,54
|
5772,6704
|
584915,83
|
Для данного процесса степень конверсии рассчитывается по формуле:

Рассчитаем равновесную степень конверсии при давлении 1 атм, отсутствии инертных разбавителей. Результаты расчетов приведены в таблице:
| Т, К
|
х
|
| 298
|
0,01
|
| 300
|
0,01
|
| 400
|
0,28
|
| 500
|
0,89
|
| 600
|
0,99
|
| 700
|
1,00
|
| 800
|
1,00
|
| 900
|
1,00
|
| 1000
|
1,00
|
График зависимости представлен на рисунке:

Как видно, для ведения процесса подходит температура в интервале от 600 до 800К.
Состав равновесной смеси при изменении температуры ведения процесса представлен в таблице:
| Т, К
|
Мол. доля в равновесной смеси
|
| изопентан
|
изобутилен
|
метан
|
вода
|
| 298
|
0,9772
|
0,0114
|
0,0114
|
0,0000
|
| 300
|
0,9753
|
0,0124
|
0,0124
|
0,0000
|
| 400
|
0,5608
|
0,2196
|
0,2196
|
0,0000
|
| 500
|
0,0589
|
0,4705
|
0,4705
|
0,0000
|
| 600
|
0,0053
|
0,4973
|
0,4973
|
0,0000
|
| 700
|
0,0009
|
0,4995
|
0,4995
|
0,0000
|
| 800
|
0,0003
|
0,4999
|
0,4999
|
0,0000
|
| 900
|
0,0001
|
0,5000
|
0,5000
|
0,0000
|
| 1000
|
0,0000
|
0,5000
|
0,5000
|
0,0000
|
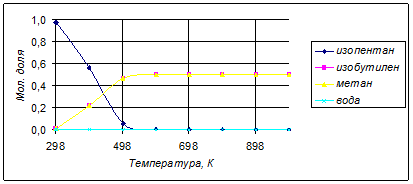
Поскольку процесс идет с повышением числа молей газа, имеет смысл создавать вакуум. Рассчитаем для диапазона давлений 0,1-1,2 атм и интервала температур 600-800К и отсутствии инертных разбавителей равновесную степень конверсии реагента:
| Р, атм
|
Р, кПа
|
х (Т=600K)
|
х (Т=700K)
|
х (Т=800K)
|
| 0,1
|
10,1325
|
0,9989
|
0,9998
|
0,9999
|
| 0,2
|
20,2650
|
0,9978
|
0,9996
|
0,9999
|
| 0,3
|
30,3975
|
0,9968
|
0,9994
|
0,9998
|
| 0,4
|
40,5300
|
0,9957
|
0,9993
|
0,9998
|
| 0,5
|
50,6625
|
0,9946
|
0,9991
|
0,9997
|
| 0,6
|
60,7950
|
0,9936
|
0,9989
|
0,9997
|
| 0,7
|
70,9275
|
0,9925
|
0,9987
|
0,9996
|
| 0,8
|
81,0600
|
0,9915
|
0,9985
|
0,9996
|
| 0,9
|
91,1925
|
0,9904
|
0,9983
|
0,9995
|
| 1
|
101,3250
|
0,9894
|
0,9981
|
0,9995
|
| 1,1
|
111,4575
|
0,9883
|
0,9979
|
0,9994
|
| 1,2
|
121,5900
|
0,9873
|
0,9978
|
0,9994
|

Зависимость состава равновесной смеси от давления при температуре 800К показана в таблице:
| Мол. доля в равновесной смеси
|
| Р, атм
|
изопентан
|
изобутилен
|
метан
|
вода
|
| 0,1
|
0,0000
|
0,5000
|
0,5000
|
0,0000
|
| 0,2
|
0,0001
|
0,5000
|
0,5000
|
0,0000
|
| 0,3
|
0,0001
|
0,5000
|
0,5000
|
0,0000
|
| 0,4
|
0,0001
|
0,4999
|
0,4999
|
0,0000
|
| 0,5
|
0,0001
|
0,4999
|
0,4999
|
0,0000
|
| 0,6
|
0,0002
|
0,4999
|
0,4999
|
0,0000
|
| 0,7
|
0,0002
|
0,4999
|
0,4999
|
0,0000
|
| 0,8
|
0,0002
|
0,4999
|
0,4999
|
0,0000
|
| 0,9
|
0,0002
|
0,4999
|
0,4999
|
0,0000
|
| 1
|
0,0003
|
0,4999
|
0,4999
|
0,0000
|
| 1,1
|
0,0003
|
0,4999
|
0,4999
|
0,0000
|
| 1,2
|
0,0003
|
0,4998
|
0,4998
|
0,0000
|

Однако проводить процесс при вакууме опасно, в связи с высокой взрывоопасностью. Гораздо удобнее применять для ведения процесса инертные разбавители.
Рассчитаем зависимость равновесной степени конверсии от степени разбавления водой – инертным разбавителем при 800К, 700К, 600К и пониженном давлении 0,5атм. Результаты расчетов приведены в таблице.
| n
|
х (Т=600K)
|
х (Т=700K)
|
х (Т=800K)
|
| 0
|
0,9946
|
0,9991
|
0,9997
|
| 1
|
0,9964
|
0,9994
|
0,9998
|
| 5
|
0,9985
|
0,9997
|
0,9999
|
| 10
|
0,9991
|
0,9998
|
1,0000
|
| 15
|
0,9994
|
0,9999
|
1,0000
|
| 20
|
0,9995
|
0,9999
|
1,0000
|
| 25
|
0,9996
|
0,9999
|
1,0000
|
| 30
|
0,9997
|
0,9999
|
1,0000
|
| 35
|
0,9997
|
0,9999
|
1,0000
|
| 40
|
0,9997
|
1,0000
|
1,0000
|
| 45
|
0,9998
|
1,0000
|
1,0000
|
| 50
|
0,9998
|
1,0000
|
1,0000
|

Рассчитаем зависимость равновесной степени конверсии от степени разбавления водой – инертным разбавителем при 800К, 700К, 600К и пониженном давлении 1атм. Результаты расчетов приведены в таблице.
| n
|
х (t=600K)
|
х (t=700K)
|
х (t=800K)
|
| 0
|
0,9894
|
0,9981
|
0,9995
|
| 1
|
0,9929
|
0,9988
|
0,9997
|
| 5
|
0,9969
|
0,9995
|
0,9999
|
| 10
|
0,9982
|
0,9997
|
0,9999
|
| 15
|
0,9987
|
0,9998
|
0,9999
|
| 20
|
0,9990
|
0,9998
|
1,0000
|
| 25
|
0,9992
|
0,9999
|
1,0000
|
| 30
|
0,9993
|
0,9999
|
1,0000
|
| 35
|
0,9994
|
0,9999
|
1,0000
|
| 40
|
0,9995
|
0,9999
|
1,0000
|
| 45
|
0,9995
|
0,9999
|
1,0000
|
| 50
|
0,9996
|
0,9999
|
1,0000
|

Таким образом, термодинамический анализ показал, что для достижения максимальной степени конверсии реагента процесс пиролиза изопентана проводится при температуре 700-800К, пониженном давлении около 0,5 атм или степени разбавления водой 25-30 моль Н2
О
/моль изопентана.
Лабораторная работа №3
При исчерпывающем жидкофазном алкилировании фенола изобутиленом получена реакционная масса, состав которой определяется равновесием реакций позиционной изомеризации и переалкилирования в системе, представленной фенолом, 2-ТБФ, 1,4-диТБФ, 2,6-диТБФ, 2,4,6-триТБФ.
Решение:
Выбираем независимые реакции в системе.
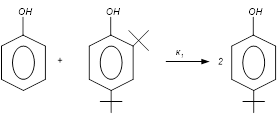

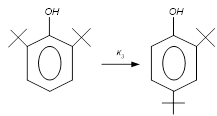

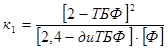 , ,  , ,
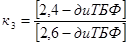 , , 

Обозначим за неизвестную концентрацию  : :
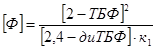 , ,
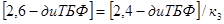 , ,
 , ,
 , ,
 , откуда: , откуда:

|