Доклад на тему:
Двойной электрический слой
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает двойной электрический слой (ДЭС) - тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. Возникновение заряда на границе двух фаз относится к одному из видов поверхностных явлений.
Для изобарно-изотермического процесса в отсутствие физико-химических взаимодействий (dT=0, dp=0, dni
=0) из уравнения (3.1) получим:
dG£sdB + jdq (1)
В условиях равновесия, когда dG=0,
sdB + jdq = 0, (2)
из уравнения (7.2) несложными преобразованиями можно выразить удельный заряд поверхности qB
:
qB
= -(d
s/d
j)T,
p,
n.
(3)
Заряд поверхности, который возникает самопроизвольно, вызван стремлением к уменьшению поверхностного натяжения.
Возникновение ДЭС на границе раздела характерно для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
1. Существуют два пути образования ДЭС
: 1) избирательная адсорбция поверхностью твердой частицы ионов из дисперсионной среды (электролита), 2) ионизация поверхностных молекул твердой частицы.
Поверхность твердого тела адсорбирует ионы определенного знака. Эти ионы называются потенциалопределяющими
. К ним из раствора притягиваются ионы противоположного знака – противоионы
. Возникает двойной электрический слой.
При смешивании солей нитрата серебра и хлорида калия должен выпадать осадок хлорида серебра по уравнению:
AgNO3
+ KCl = AgCl¯ + KNO3
Однако в присутствии избытка хлорида калия осадка не наблюдается, т.к. в растворе образуются коллоиды, имеющие следующее строение:
[n
AgCl×m
Cl-
×(m-x
)K+
]x-
×x
K+
.
При этомCl-
- потенциал определяющие ионы, K+
- противоионы.
При избытке нитрата серебра образуются коллоидные частицы состава:
[n
AgCl×m
Ag+
×(m-x
)NO3
-
]+
×
×x
NO3
-
.
На поверхности твердой фазы AgCl адсорбируются ионы, находящиеся в избытке, из тех которые могут достраивать кристаллическую решетку (Ag+
или Cl-
). Твердая фаза образует ядро
коллоидной частицы
. Коллоидная частица имеет заряд адсорбированных потенциал определяющих ионов, частично скомпенсированный противоионами. Вокруг коллоидной частицы в диффузном слое находятся противоионы, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу (рис.1).

Рис.1.
Строение коллоидных мицелл.
Потенциалопределяющими ионами, в зависимости от рН среды, могут так же быть ионы Н+
и ОН-
.
Второй путь образования ДЭС - ионизация поверхностных молекул твердых фазы, наблюдается при образовании гидрозолей металлов, например переход ионов серебра в раствор:
[n
Ag×m
Ag+
×(m-x
)NO3
-
]x+
×x
NO3
-
.
Другим примером может быть образование золя серы:
[n
S×m
HS-
×(m-x
)H+
]x-
×x
H+
.
2. ДЭС принято рассматривать как своеобразный конденсатор
, внутренняя обкладка которого с потенциалом j формируется из потенциалопределяющих ионов (1), а внешняя из противоионов (2).
Существует несколько теорий образования ДЭС. Простейшая из них – модель плоского конденсатора Гельмгольца, согласно которой потенциалобразующий слой и слой противоионов расположены на молекулярном расстоянии друг от друга. Взаимодействие между слоями осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно (рис.2 а).
В теории Гуи и Чепмена учитывается тепловое движение и взаимное отталкивание противоионов, которые рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое. Потенциал экспоненциально снижается по мере удаления от поверхности (рис 10б).
Согласно теории Штерна (рис 2в) часть противоионов находится в плотном слое Гельмгольца, другая - в диффузном слое. В плотной части двойного слоя ионы удерживаются за счет электростатических сил и сил специфической адсорбции (некулоновскими силами). Диффузное строение двойного электрического слоя возникает в результате как теплового движения ионов и молекул растворителя, так и в результате взаимного отталкивания одноименных ионов. Таким образом, слой потенциалопределяющих ионов не полностью скомпенсирован в плотном слое. В отличие от противоионов плотного слоя, ионы диффузионного слоя не закреплены и способны перемещаться в пределах диффузионного слоя, который в свою очередь состоит из внутреннего и внешнего слоев.

Рис.2
. Модели строение ДЭС: а
– Гельмгольца;, б
– Гуи и Чепмена; в
– Штерна: 1 – потенциалобразующий слой ионов
; 2, 3 – противоионы в адсорбционном и диффузном слое
; δ – толщина адсорбционного слоя
.
Толщина плотной части ДЭС определяется размерами противоинов и зависит от концентрации электролита (С).
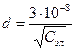 см (4) см (4)
Потенциал ДЭС (j) снижается по мере удаления от поверхности твердого тела. В плотном слое – линейно. В диффузном слое снижение потенциала происходит экспоненциально.
3. ДЭС на поверхности коллоидной частицы, следуя ее форме, как правило, сферический. Относительное перемещение заряженных частиц и жидкости происходит не по границе твердого тела с жидкостью, а за пределами этой границы по плоскости скольжения, которая проходит по диффузионной части двойного слоя. При движении частиц дисперсной фазы часть жидкости, на поверхности твердой частицы до границы скольжения, перемещается вместе с твердой частицей. Эта часть жидкости на поверхности твердой фазы является неподвижной.
Потенциал на границе скольжения, расположенной в диффузном слое, называют электрокинетическим, или дзета-потенциалом (z). Этот потенциал является важной характеристикой ДЭС, он определяет возможность и скорость относительного перемещения дисперсной фазы и дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей и разрушение дисперсных систем электролитами. Значение z-потенциала можно определить по скорости движения коллоидных частиц и по скорости движения жидкости. Знак z-потенциала определяется знаком заряда потенциалобразующего слоя.
По скорости движения коллоидных частиц:
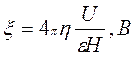 (5) (5)
где ή - вязкость, ε - диэлектрическая проницаемость, U – скорость электрофоретического переноса (на основании измерений), Н – градиент потенциала внешнего поля, равный Е/L (Е-разность электродных потенциалов, L-расстояние между электродами).
По скорости движения жидкости:
 В, (6) В, (6)
где λ – удельная электрическая проводимость золя, ύ – объемная скорость (объем жидкости, перенесенный через пористую мембрану за единицу времени), I-сила тока, при которой проводится осмос.
Изменение z-потенциала зависит от свойств среды и наличия в ней противоионов. Увеличение их концентрации приводит к сжатию диффузного слоя и снижению z-потенциала. Когда все противоионы будут находиться в адсорбционном слое, происходит полная компенсация потенциалобразующего слоя, z-потенциала становится равным нулю, это изоэлектрическая точка (z=0).
Добавление многовалентных катионов, например Fe3+
, может привести к адсорбции противоионов в сверх эквивалентных количествах. В этих условиях произойдет перезарядка поверхности и изменение знака z-потенциала (рис.3).

Рис. 3
. Изменение потенциала ДЭС при перезарядке золя: 1- падение потенциала до перезарядки; 2- то же после перезарядки; значения потенциалов до: ψ0
-, ψ1
0
-, -ζ ; после перезарядки: ψ, ψ1
, +ζ.
|