Курсовая работа: Исследование кинетики реакции хлорирования бензола
|
Название: Исследование кинетики реакции хлорирования бензола Раздел: Рефераты по химии Тип: курсовая работа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Департамент науки и образования РФ Московская государственная академия тонкой химической технологии Домашняя работа "Исследование кинетики реакции хлорирования бензола" Выполнила студентка группы БМ-54 Климук А.И. Проверил проф. Темкин О.Н. Москва, 2005 ОПРЕДЕЛЕНИЕ ТЕКУЩИХ КОНЦЕНТРАЦИЙ ВЕЩЕСТВ ОПРЕДЕЛЕНИЕ ПОРЯДКОВ РЕАКЦИИ ПО КОМПОНЕНТАМ НАХОЖДЕНИЕ ВИДА ЗАВИСИМОСТИ ТЕКУЩИХ КОНЦЕНТРАЦИЙ ОТ ВРЕМЕНИ ОПРЕДЕЛЕНИЕ ПОРЯДКОВ РЕАКЦИЙ МЕТОДОМ НАЧАЛЬНЫХ СКОРОСТЕЙ ОПРЕДЕЛЕНИЕ ВИДА КИНЕТИЧЕСКОЙ МОДЕЛИ ИНТЕГРАЛЬНЫМ МЕТОДОМ ОПРЕДЕЛЕНИЕ ЗНАЧЕНИЯ КОНСТАНТЫ СКОРОСТИ МЕТОДОМ НАИМЕНЬШИХ КВАДРАТОВ СТАТИСТИЧЕСКАЯ ОБРАБОТКА ПОЛУЧЕННОЙ КИНЕТИЧЕСКОЙ МОДЕЛИ ФОРМУЛЫ ДЛЯ РАСЧЕТА СТАТИСТИКИ (٭ ) Расчет дисперсии воспроизводимости Расчет дисперсии неадекватности Критерий Фишера. Анализ коэффициентов Расчет дисперсии остаточной Подбор подходящего механизма реакции СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ Определение текущих концентраций веществПо закону сохранения вещества:
где аi - стехиометрические коэффициенты соответствующих веществ в уравнении реакции; Сi - концентрации соответствующих веществ. Концентрация хлора (С2) поддерживается постоянной, поэтому имеем следующую таблицу значений текущих концентраций бензола (С1) и хлорбензола (С3):
Продолжение таблицы.
Определение порядков реакции по компонентамДля нахождения порядков реакции можно использовать разные методы. Воспользуемся, например, методом начальных скоростей. Для этого необходимо найти начальные скорости. С этой целью проведем статистическую обработку экспериментальных данных для выявления вида зависимости текущих концентраций веществ от времени. Затем, продифференцировав по времени, получим выражение для скорости реакции. Нахождение вида зависимости текущих концентраций от времениЭкспериментальные данные по текущим концентрациям приведены для продукта реакции – хлорбензола (С3), поэтому поиск модели будем проводить на их основе. Рассмотрим первые три опыта, т. к. они отвечают требованию воспроизводимости. Опишем зависимость концентрации хлорбензола (С3) от времени полиномом 1 степени: Y= B0+B1t Матрица Х:
Матрица Хт:
Перемножив матрицы (ХтХ) - 1Хт и матрицу средних значений концентраций С3 по повторяющимся опытам, получим значения коэффициентов уравнения полинома. Матрица В:
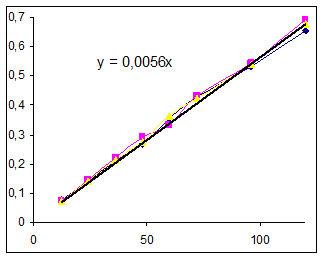
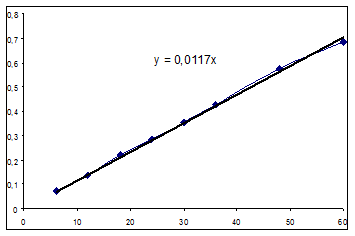
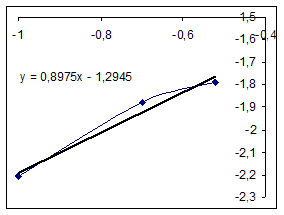
Все коэффициенты уравнения значимы, модель адекватна. Y=0.012624+0.005562 Проверим графически соответствие модели экспериментальным данным. Для этого построим кривые зависимости текущих концентраций от времени и с помощью линии тренда найдем вид уравнения. Данные для построения графиков.
Константы в выражении, полученном графически, сравнимы с расчетными в уравнении полинома. Значения начальных скоростей примерно одинаковы. За истинные будем принимать расчетные значения. Значение начальной скорости в рассматриваемом опыте: R0=0,0056 (моль/(л ч)). Определим выражения для скоростей реакций по остальным опытам. Рассчитанное выражение для зависимости концентрации хлорбензола от времени разобранным выше матричным методом: Y= 0.012624+0.005134t
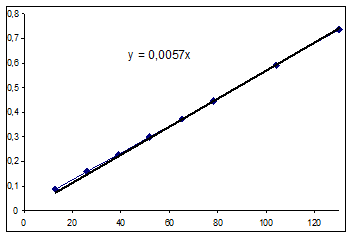
По уравнению кривой, построенной по экспериментальным данным, и расчетному выражению значения начальной скорости близки. Примем как более точное расчетное значение: R0=0,0051 (моль/(л ч)). Определение выражения для скорости матричным методом. Для этого получим выражение для зависимости концентрации от времени и продифференцируем его по времени.
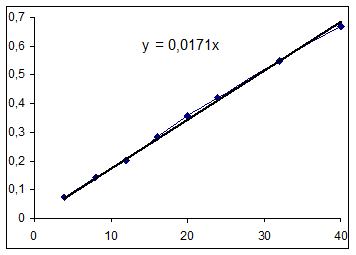
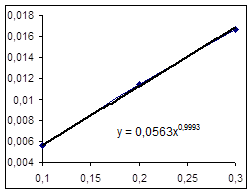
Рассчитанное выражение для зависимости концентрации от времени: Y =0.013948+0.003627t Найдем графическое выражение. Экспериментальные данные:
Значения начальных скоростей по графику и расчетное одного порядка, примем расчетное значение за истинное: R=0,0036 (моль/(л ч)). Определение выражения для зависимости текущей концентрации от времени матричным методом. Матрица Х:
Продолжение.
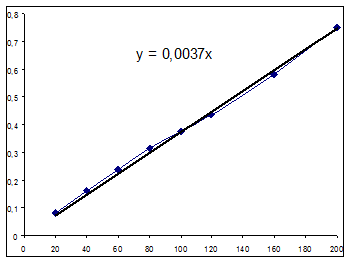
Уравнение зависимости выглядит следующим образом: Y =0.037746+0.00153t Определение графическим способом. Экспериментальные данные:
Значение начальной скорости: R=0,0015 (моль/(л ч)). Нахождение вида зависимости концентрации от времени матричным способом. Матрица Х:
Графический метод. Экспериментальные данные:
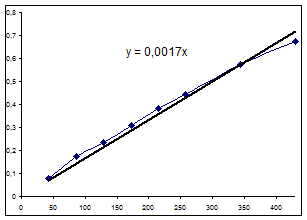
Выражение, полученное матричным методом: Y= 0.008006+0.011508t Значение начальной скорости: R=0,0115 (моль/(л ч)). Расчет матричным методом. Матрица Х:
Уравнение будет выглядеть: Y=0 .011139+0.016717t Графический метод. Экспериментальные данные:
Значение начальной скорости: R=0,0167 (моль/(л ч)). Определение порядков реакций методом начальных скоростейМетод заключается в том, что строят графические зависимости LgR0=f(LgC0) или/и R0=f(C0) для опытов, где значения концентраций других компонентов, кроме исследуемого, одинаковы.
Зависимость LgR0=f(LgC01) Зависимость R0=f(C01)
Порядок по компоненту А1 (бензолу) принимаем равным 1, т. к.1,2 примерно равно 1. Определение порядка по катализатору.
Зависимость R0=f(Ck) Зависимость LgR0=f(LgCk)
Порядок по катализатору примем равным 1. Порядок по хлору определять не будем, т. к. его концентрацию поддерживают постоянной. Скорость реакции от него не будет зависеть. Таким образом, вид кинетического уравнения для нашей реакции выглядит следующим образом: R= kC1Ck∑ Определение вида кинетической модели интегральным методомУравнение реакции: C6H6(A1) + Cl2(A2) = C6H6Cl(A3) + HCl(A4) d [A3] /dt = r = k [A1] [A2] = - в [A1] /dt Проинтегрируем по t: - òd [A1] / [A1] = òk [A2] dt ln [A1] 0 – ln [A1] = k [A2] t, т. к. концентрация хлора (А2) постоянна, выносим ее за знак интеграла.
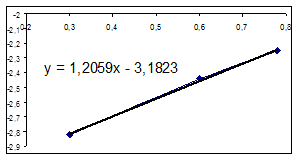
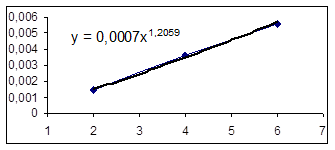
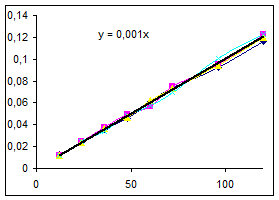
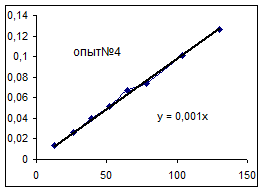
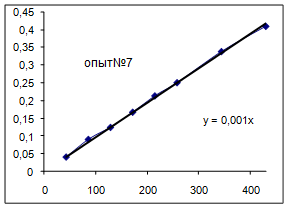
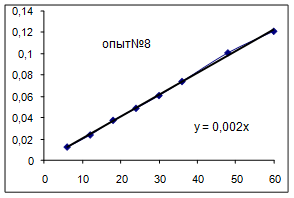
Ln([A1] 0/ [A1]) = k [A2] t, обозначим k [A2] º Кнабл. Определим графически значение Кнабл по всем опытам.
Как видно из уравнений прямых на диаграммах, значение Кнабл для всех опытов, кроме последних двух, одинаково и равно 0,001. Значит, в последних двух опытах действует какой-то другой параметр системы. Причем явно видно, что от концентрации хлора Кнабл совсем не зависит, т. к. для всех первых 7 опытов значение константы одинаково, но значение начальной концентрации хлора разное. Если предположить, что в кинетическом уравнении вместо [A2] стоит суммарная концентрация катализатора, то тенденция в изменении Кнабл выглядит закономерной:
Определение значения константы скорости методом наименьших квадратовМетод заключается в следующем: R = k•C1•Ck∑ можно представить в виде уравнения прямой: у = Вх, где y=R, B=k, x=C1•Ck∑. Домножая правую и левую часть уравнения у = Вх на х, получим квадратичное уравнение ух = Вх2. Значение константы вычислим как: В = ух / х2. №опыта
Среднее значение константы скорости по методу наименьших квадратов равно k=0,00917 [л/(моль•ч)]. Причем при умножении на Ск∑ значение константы, рассчитанное по методу наименьших квадратов, примерно совпадает со значением Кнабл, рассчитанным интегральным методом. Статистическая обработка полученной кинетической моделиR = k•C1•Ck∑ Для наилучшей обработки полученной модели проведем преобразование вида функции, т. к. зависимость скорости реакции от времени постоянна и для первых 3 опытов равна 0,0056. Скорость реакции получилась константа в результате дифференцирования по времени функции зависимости концентрации продукта реакции (хлорбензола) от времени. 1/С1= k•Ck/R № опыта
Продолжение.
Обозначим Ck/R = Х, 1/С1 = У. Вычисления проводим, как описано выше. Ковариационная матрица:
Полученная матрица коэффициента содержит 1 ячейку, где В= 0,0099.Т. е. значение константы скорости получили равным 0,0099 [л/(моль•ч)]. где k= 0,01 [л/(моль•ч)]. Статистическую обработку проводят по воспроизводимым опытам. Значение дисперсии воспроизводимости Sвоспр= 1,41907∙10-7 Значение дисперсии неадекватности Sнеад= 3,14∙10-9; Значение остаточной дисперсии Sост= 1,87∙10-9. Критерий Фишера F= 3,1; табличное значение Ft= 3,2 для f1= 7, f2= 16. F<Ft – модель адекватна. Формулы для расчета статистики (٭ )Расчет дисперсии воспроизводимостиПредварительно считают дисперсию для каждого отдельного опыта: Su2= (∑(yui-yсред) 2) /f, где f2 = l-1 – число степеней свободы дисперсии воспроизводимости с учетом того, что 1 степень свободы потрачена на вычисление среднего значения; l – число повторяющихся воспроизводимых опытов. Среднее значение дисперсии воспроизводимости по всем опытам: Sy2= ∑ Su2/n, где n – число последовательных опытов. В нашем случае l= 3, n= 8. Расчет дисперсии неадекватностиS2неад= l∙(∑(yuрасч - yсред) 2) /(n-m) где m – число коэффициентов модели. n-m = f1 – число степеней свободы дисперсии неадекватности. Критерий ФишераF = S2неад / Sy2 Значение критерия Фишера расчетное сравнивают с табличным значением для соответствующих f1 и f2. Если F<Ft, то модель адекватна и производят дальнейший расчет значимости коэффициентов уравнения модели по критерию Стьюдента. Если модель неадекватна, то рассматривают другую модель. Анализ коэффициентовПроизводят оценку точности определения коэффициентов и анализ их значимости. Дисперсия коэффициентов: Sbj2= CjiSy2 где Сji – диагональные элементы ковариационной матрицы. Критерий Стьюдента: tj = |bj| / √ Sbj2 Полученное значение критерия сравнивают с некоторым критическим значением, которое находят по таблице для числа степеней свободы f2. Если tj больше критического, то соответствующий коэффициент незначим и может быть исключен из уравнения. После исключения какого-то коэффициента анализ адекватности повторяют. Расчет дисперсии остаточнойSoc2= (∑∑(yui – ycp) 2) / (nl – m) Подбор подходящего механизма реакцииДопустим, что реализуется следующий механизм нуклеофильного замещения SN2: Cl2 + FeCl3 → FeCl4 - + Cl+, k1 C6H6 + Cl+ → C6H5Cl + H+, k2 H+ + FeCl4-↔ FeCl3 + HCl, k3 Кинетическое уравнение для механизма SN2 выглядит следующим образом: R = в [C6H5Cl] / dt = k2 [C6H6] [Cl+], Скорость реакции по SN2 зависит от концентрации начального субстрата и нуклеофила. В качестве нуклеофила выступает частица Cl+.Т. к. концентрация хлора поддерживается постоянной, то ограничивающим фактором для количества образованной частицы Cl+ будет концентрация катализатора.Т. е. частиц Cl+ не может образоваться больше, чем присутствует в системе катализатора.Т. к. катализатор не образуется и не расходуется в системе, то в кинетическое уравнение войдет его суммарная концентрация. Таким образом, получаем следующее кинетическое уравнение: R = k2 [C6H6] [FeCl3] ∑, где [C6H6] = С1, [FeCl3] = Ск. Первая стадия является лимитирующей. Вид кинетического уравнения совпадает с выведенным по расчетам, значит, наш механизм является подходящим для описания эксперимента. Список используемой литературы1. К.Ю. Одинцов, Л.Г. Брук, О.Н. Темкин, "Статистическая обработка результатов кинетических исследований". – М.: МИТХТ, 2000, 52с. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||