|
Любая термодинамически разрешенная реакция, в которой происходит незначительное перемещение ядер (близость минимумов энергетических термов) и мало изменяются электронные состояния (принцип наименьшего движения), и молекулярность которой не превышает 2, имеет шанс быть согласованным процессом, элементарной стадией. Однако, для того, чтобы величина  была небольшой и реакция протекала с измеряемой скоростью, необходимо выполнение двух требований, вытекающих из квантово-химической теории. Эффективное взаимодействие двух частиц с достаточно низкой величиной барьера может происходить в случае, когда симметрия перекрывающихся молекулярных орбиталей (МО) будет одинаковой, а энергии этих МО будут близки. Например, бимолекулярная реакция (27) была небольшой и реакция протекала с измеряемой скоростью, необходимо выполнение двух требований, вытекающих из квантово-химической теории. Эффективное взаимодействие двух частиц с достаточно низкой величиной барьера может происходить в случае, когда симметрия перекрывающихся молекулярных орбиталей (МО) будет одинаковой, а энергии этих МО будут близки. Например, бимолекулярная реакция (27)
H2
+ I2
= 2HI (27)
с небольшим изменением координат ядер и валентных оболочек не является элементарным процессом (ЭС), поскольку запрещена по симметрии граничных МО. Рассмотрим подробнее некоторые квантово-химические подходы к проблеме реакционной способности.
Теория возмущений в приближении граничных МО
Из правила БЭП следует, что знание энергетического состояния исходных
и конечных
продуктов позволяет оценивать кинетические характеристики ЭС (вероятность реализации элементарного акта). Метод возмущения МО (МВМО), оперируя только граничными занятыми и свободными МО (ВЗМО, НСМО) и зарядами (на атомах в молекулах и на атомных орбиталях в МО) в исходных
реагентах, позволяет в ряде случаев предсказать вероятность, направление и эффективность
взаимодействия двух реагентов.
Чем эффективнее взаимодействие, тем ниже Еакт
и тем выше вероятность согласованного (элементарного) акта.
Если энергии граничных орбиталей c
1
и c
2
близки, то энергия взаимодействия определяется резонансным (обменным) интегралом b
12
 (28) (28)
где H
– гамильтониан системы, t
– элемент объема, в котором происходит перекрывание орбиталей. Величина b
12
в этом случае определяет и величину расщепления новых МО Y
1
и Y
2
или энергию стабилизации e = b
12
.

Если энергии c
1
и c
2
различаются сильно, то величина e
определяется не только b
12
, а зависит и от разности энергий c
1
и c
2
по уравнению (29):
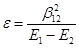 (29) (29)
где Е
1
и Е
2
– энергии низшей и высшей МО

Чем больше величина e
, тем стабильнее образующийся аддукт, тем ниже Еакт
его образования.
МВМО не дает оценки Е
переходного состояния и Еакт
. Рассчитывается лишь разница между полной электронной энергией реагирующей системы Е
и энергиями исходных реагентов  и и 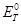 (малое возмущение): (малое возмущение):
 DЕ
= Е
– DЕ
= Е
–  – – 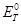 , (30) , (30)
справедливое только для начальных участков координаты реакции. Только на больших расстояниях между реагентами не происходит смешения МО, нет межмолекулярного отталкивания и можно говорить о чистых МО исходных реагентов. Вместе с тем, такое приближение позволяет оценить наиболее вероятный путь реакции.
Энергию возмущения DЕ
при взаимодействии реагентов S
и Т
(S
и Т
– молекулы или активные центры в молекулах) рассчитывают по уравнению (31):
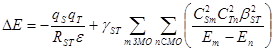 (31) (31)
В случае только двух граничных МО (например, молекул донора и акцептора) уравнение упрощается (32):
 (32) (32)
В уравнениях (31, 32) qS
и qT
– эффективные заряды на центрах S
и Т
, RST
– расстояние между центрами в ходе взаимодействия, e
– диэлектрическая проницаемость среды. Таким образом, первый член (возмущение 1го
порядка) отражает энергию кулоновского взаимодействия. Второй член (возмущение 2го
порядка) определяет энергию орбитального перекрывания и включает: g
ST
– коэффициент, учитывающий заселенность электронами орбиталей c
1
и c
2
,  и и 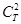 – квадраты коэффициентов при атомных орбиталях центров S
и Т
волновой функции граничных МО c
1
и c
2
, – квадраты коэффициентов при атомных орбиталях центров S
и Т
волновой функции граничных МО c
1
и c
2
, 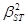 – квадрат обменного интеграла, Е
1
и Е
2
– энергии орбиталей c
1
и c
2
. Разные случаи заселенности орбиталей c
1
и c
2
реагирующих частиц и коэффициент g
ST
приведены ниже: – квадрат обменного интеграла, Е
1
и Е
2
– энергии орбиталей c
1
и c
2
. Разные случаи заселенности орбиталей c
1
и c
2
реагирующих частиц и коэффициент g
ST
приведены ниже:
| Число электронов на
граничных орбиталях
|
g
ST
|
| 2 + 2, 0 + 0
|
0 (нет перекрывания)
|
| 2 + 1, 1 + 0
|
1
|
| 2 + 0, 1 + 1
|
2 (самое сильное перекрывание)
|
Если Е
1
– Е
2
в знаменателе уравнения (32) мало, заселенность g
ST
равна 1 и 2, симметрия орбиталей одинакова (b
12
> 0), геометрия орбиталей удобна для перекрывания (коэффициенты CS
и CT
имеют большие значения в одинаковых областях пространства) и второй член существенно больше первого, можно говорить об орбитально-контролируемой реакции
.
Если Е
1
– Е
2
величина большая, второй член становится небольшим даже при больших CS
и CT
. Если при этом qS
и qT
также велики, говорят о зарядово-контролируемой реакции
. Эти простые оценки полуэмпирическими методами МО ЛКАО позволяют определить (без расчетов ППЭ), в каком направлении (по каким центрам) пойдет та или другая реакция и можно ли ожидать высокой скорости от выбранной элементарной стадии. Естественно, что все соображения об оценке энергии DЕ
относятся только к элементарным стадиям.
Предположим, что донорная молекула, типичный нуклеофил SCN–
реагирует с акцептором, имеющим НСМО. Если энергии ВЗМО донора (c
1
) и НСМО акцептора (c
2
) близки, реакция будет орбитально-контролируемой. Такая реакция будет протекать между молекулой акцептора и тем центром нуклеофила (донора), который обладает наивысшей плотностью заряда (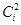 ) на граничных орбиталях донора. Высшая занятая МО нуклеофила SCN–
Y
2
имеет вид: ) на граничных орбиталях донора. Высшая занятая МО нуклеофила SCN–
Y
2
имеет вид:
Y
2
= 0.74j
S
+ 0.33j
C
– 0.59j
N
 = 0.55 = 0.55  = 0.35 = 0.35  > > 
Поэтому реакция с акцептором пойдет через атом S
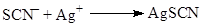 (33) (33)
Если орбиталь акцептора лежит высоко и Е
1
– Е
2
велика, реакция контролируется зарядовым взаимодействием. В этом случае, первый (кулоновский) член в уравнении (32) будет больше для того центра нуклеофила, у которого выше qi
. Для расчета qS
и qN
необходимо учесть коэффициент 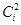 при этих центрах на всех орбиталях, т.е. кроме y
2
нужно учесть и НЗМО y
1 при этих центрах на всех орбиталях, т.е. кроме y
2
нужно учесть и НЗМО y
1
y
1
= 0.33j
S
+ 0.59j
C
+ 0.74j
N
qi
рассчитывается по уравнению 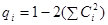
qS
= 1 – 2(0.332
+ 0.742
) = – 0.313
qN
= 1 – 2(0.592
+ 0.742
) = – 0.7914
т.е. в анионе  на атоме N эффективный отрицательный заряд выше |qN
| > |qS
| (заряд на атоме С, q
С
» 0.1). Таким образом, в условиях кулоновского контроля нуклеофил SCN–
будет взаимодействовать с акцептором атомом азота на атоме N эффективный отрицательный заряд выше |qN
| > |qS
| (заряд на атоме С, q
С
» 0.1). Таким образом, в условиях кулоновского контроля нуклеофил SCN–
будет взаимодействовать с акцептором атомом азота
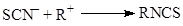 (34) (34)
МВМО дал теоретическое объяснение ряду эмпирических правил и обобщений. В 1958 г Арланд, Чатт и Дэвис предложили классификацию комплексов металлов, разделив их на две группы (а) и (б). К группе (а) были отнесены ионы металлов (в наиболее распространенных степенях окисления), которые образуют наиболее устойчивые комплексы с лигандами, имеющими донорные атомы N, O, F. К группе (б) они отнесли ионы, образующие наиболее стабильные комплексы с лигандами, содержащими донорные атомы элементов третьего и последующих периодов (P, S, Cl, Br, J). Так, например, устойчивость галогенидных комплексов Zn2+
(группа (а)) и Hg2+
(группа (б)) меняется в следующих рядах:
Zn2+
F–
>> Cl–
> Br–
> I–
Hg2+
I–
> Br–
> Cl–
>> F–
При переходе к Hg2+
происходит обращение ряда устойчивости по сравнению с “обычным” рядом (Zn2+
), согласующимся с простыми электростатическими представлениями.
Очевидно, что в случае первой группы ионов определяющим является зарядовый, а в случае второй группы ионов – орбитальный фактор. Аналогичные объяснения получили правило взаимодействия жестких и мягких кислот и оснований (Пирсон, 1963) и правило Корнблюма.
В терминах теории Пирсона взаимодействие жестких частиц (кислот и оснований, акцепторов и доноров) соответствует зарядовому контролю, взаимодействие мягких частиц – орбитальному контролю. Степень жесткости и мягкости акцептора (A) и донора (D
) можно оценивать по различным критериям. Приведем величины орбитальных электроотрицательностей En
(A
) Em
(D
) (в эВ) по Клопману:
| Акцепторы: (кислоты)
|
Al3+
|
Mg2+
|
Cr3+
|
Fe2+
|
H+
|
Na+
|
Cu2+
|
Zn2+
|
Cu+
|
Hg2+
|
| 6
|
2.42
|
2.06
|
0.69
|
0.42
|
0.0
|
-0.55
|
-1.0
|
-2.3
|
-4.6
|
| Доноры:
(основания)
|
F–
|
H2
O
|
OH–
|
Br–
|
CN–
|
SH–
|
I–
|
H–
|
| -12.18
|
-10.7
|
-10.45
|
-9.2
|
-8.78
|
-8.59
|
-8.31
|
-7.37
|
В приведенной таблице самая жесткая кислота – Al3+
, самое жесткое основание – F–
. Самая мягкая кислота – Hg2+
, самое мягкое основание – H–
.
Орбитальная симметрия и правила отбора
Общие правила отбора ЭС по симметрии МО в реагирующей системе с циклическим многоцентровым переходным состоянием сформулировали Р.Вудворд и Р.Хоффман – правила сохранения орбитальной симметрии в ходе согласованных реакций.
Если заполненные связывающие МО реагентов коррелируют по симметрии (имеют одинаковую симметрию) с заполненными связывающими МО продуктов реакции, такая реакция будет идти согласованно термически (как ЭС). В ходе такой реакции симметрия взаимодействующих орбиталей сохраняется вдоль координаты реакции по ППЭ. Если такой корреляции нет, согласованная реакция пойдет только фотохимически.
В простых молекулах анализ симметрии граничных орбиталей позволяет сделать заключение о возможности согласованной ЭС. Например, симметрии занятой s-МО молекулы Н2
и свободной s*-МО молекулы I2
не позволяют реализоваться циклическому переходному состоянию

Это же касается и разрыхляющей s*-МО H2
и высшей занятой s-МО I2
. Граничные ВЗМО и НСМО двух молекул этилена имеют разную симметрию и не могут образовать 4-членного переходного состояния при протекании ЭС

Занятая p-МО одной молекулы этилена
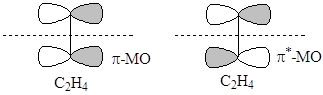
не может перекрываться синхронно со свободной p*-МО второй молекулы. Симметрия этих МО различна (относительно плоскости, проходящей перпендикулярно связи С-С через ее центр). В реакции бутадиена с этиленом, НСМО C4
H6
(p1
*-C4
H6
) имеет одинаковую симметрию с ВЗМО C2
H4
и процесс протекает по согласованному 6-центровому механизму
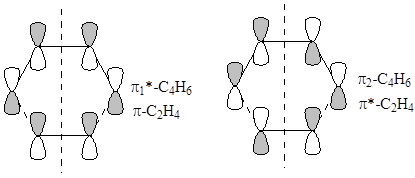
Аналогично и для перекрывания p*-C2
H4
и НЗМО C4
H6
(p2
-C4
H6
).
Запрещенными по симметрии как элементарные стадии являются реакции присоединения молекул H2
, Cl2
, HCl, HF, HCN к кратным связям олефинов и алкинов (через 4-членное циклическое переходное состояние).
Реакции нуклеофильного и электрофильного присоединения и замещения, протекающие через линейные переходные состояния разрешены по симметрии. Участие переходных металлов (d-орбитали и d-электроны) в ЭС снимает запреты по симметрии и делает реакции согласованного присоединения по кратным связям металлосодержащих фрагментов разрешенными ЭС.
 , ,  , ,  , , 
Разрешены по симметрии орбиталей также реакции присоединения молекул НХ к координированным атомом металла алкенам.
Правило сохранения 16-18 электронной оболочки Толмена в элементарных стадиях
Уже давно было отмечено (Сиджвик, 1929), что в стабильных комплексных соединениях общее количество электронов вокруг атома металла равно числу электронов ближайшего инертного газа. Это число электронов было названо эффективным атомным номером (ЭАН). В случае d
-металлов число электронов в валентной оболочке металла, связанного с лигандами, должно быть равно 18 (d10
s2
p6
). Такая оболочка и считается устойчивой. Например, Ni(CO)4
: Ni0
d10
, CO – 2-х электронный лиганд. Следовательно, 10 + 8 = 18. Для расчета числа электронов в комплексе металла необходимо сложить число электронов в валентной оболочке атома металла (или иона) и число электронов, предоставляемых нейтральными лигандами (или анионами). Для этого используют ковалентную
и ионную
модели химической связи. В первом случае комплекс включает ионы Mn
+
, X–
и нейтральные лиганды L, а во втором – атомы металла, нейтральные группы X (гомолитический разрыв связи M–X) и нейтральные лиганды L. Например, в комплексе HMn(CO)5
в валентной оболочке Mn имеем для ионной модели:
H–
(2 эл) + Mn+
(6 эл) + 5CO (10 эл) = 18 эл.
для ковалентной модели:
H· (1 эл) + Mn0
(7 эл) + 5CO (10 эл) = 18 эл.
В таблице 2.1 приведены некоторые лиганды, их обозначения и количества электронов, предоставляемых металлу в рамках ковалентной и ионной моделей.
Таблица 2.1
| Лиганды
|
Символ лиганда
|
Ковалентная модель
|
Ионная
модель
|
| Me, Ph, H, Cl, OH, CN
|
X
|
1 эл
|
2 эл
|
| CO, NH3
, H2
O, PR3
, R2
S
|
L
|
2 эл
|
2 эл
|
| C2
H4
|
L
|
2 эл
|
2 эл
|
| H2
|
L
|
2 эл
|
2 эл
|
| 
|
LX
|
3 эл
|
4 эл
|
| h3
–C3
H5
|
LX
|
3 эл
|
4 эл
|
| h3
–C5
H5
|
L2
X
|
5 эл
|
6 эл
|
| h3
–C6
H6
|
L3
|
6 эл
|
6 эл
|
В координационной химии достаточно много исключений из правила 18 электронной оболочки (в основном, в случае металлоорганических комплексов): Ni(C5
H5
)2
– 20 электронов, W(CH3
)6
– 12 электронов. Тем не менее обобщение большого экспериментального материала позволило Толмену сформулировать следующее правило:
интермедиаты, образующиеся в реакциях комплексных и металлоорганических соединений, обычно имеют 18- или 16-электронные оболочки. Именно такие интермедиаты существуют в заметных количествах.
Таким образом, в стадиях с участием d
-металлов, которые рассматриваются как элементарные, число валентных электронов должно меняться на 2 единицы (18®16®18 и т.д.). Комплексы, имеющие в валентной оболочке 16 электронов, естественно, более реакционноспособны в реакциях замещения лигандов, поскольку в этом случае возможен ассоциативный механизм замещения:
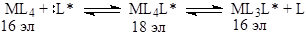
Например, Rh(acac)(C2
H4
)2
(16 эл) обменивает этилен (13
C2
H4
) по ассоциативному механизму с константой скорости ³ 104
сек–1
(25о
С, Р = 1 атм), а (C5
H5
)Rh(C2
H4
)2
(18 эл) обменивает этилен по диссоциативному механизму с константой скорости ~ 4×10–10
сек–1
.
Из трех вариантов механизма внедрения молекулы СО по связи СН3
–Mn вариант (1) согласно правилу Толмена наименее вероятен:

При наличии p-аллильных, p-циклопентадиенильных и p-инденильных лигандов ассоциативный механизм для 18-электронных комплексов в ряде случаев оказывается возможным без перехода к 20-электронным оболочкам за счет изменения типа координации h-лиганда (переход от h5
- к h3
-типу, от h3
- к h1
-типу):

18 эл. 18 эл.
(h5
-C5
H5
)M (h3
-C5
H5
)ML
Правило устойчивой 18-электронной оболочки применимо и к кластерам металлов. Более общим для кластеров металлов является правило Уэйда для расчета “магических” чисел – кластерных валентных электронов.
Топологические правила отбора
Эти эвристические правила отвечают на вопрос о вероятных структурах переходных состояний, т.е. о возможной топологии перераспределения связей и неподеленных пар в ходе ЭС.
Под топологией перераспределения связей понимается структура графа, который получается при наложении графов, изображающих рвущиеся и образующиеся связи. Любую химическую реакцию можно представить графически, если удалить группы и атомы, не участвующие в изменении связей. Так, реакцию Дильса-Альдера можно представить графическим уравнением (35), которое описывает перераспределение связей
 (35) (35)
G
1
G
2
Такое уравнение называют символьным или базовой реакцией.
Далее можно удалить связи, остающиеся неизменными, в результате чего получается уравнение (36), отражающее тип реакции
:
 (36) (36)
G
3
G
4
Наложение графов G3
и G4
дает граф G5
,

G
5
называемый идентификатором топологии (ИТ) или топологией категории реакции. ИТ отражает топологию перераспределения связей и упрощенно представляет топологию переходного состояния (в данном случае циклическую). Если предполагают одновременный разрыв и (или) образование кратных связей, тогда в графах G3
, G4
и G5
возникают кратные ребра, образующие дополнительные циклы в ИТ. Проведенный анализ различных баз стадий и органических реакций показал, что среди стадий, которые можно достаточно обоснованно отнести к ЭС, практически не встречается стадий со смешанными (линейно-циклическими) или более сложными (полициклическими) ИТ.
Таким образом, анализ топологической структуры (ИТ) можно использовать для отбора элементарных стадий, т.е. реакций, которые с топологической точки зрения имеют высокий шанс быть элементарными:
Стадии, переходные состояния которых не имеют простой топологии (циклической или линейной), не рассматриваются как элементарные.
Если в ходе реакции одновременно (синхронно) разрываются (или образуются) кратные связи, будем изображать их двумя (или тремя) дугами при изображении типа реакции
:
 (37) (37)
 ИТ: ИТ:  (38) (38)
В рамках изложенных представлений реакцию (37) не следует рассматривать как согласованный элементарный акт.
К топологическим правилам можно отнести также эвристическое правило, касающееся числа рвущихся и образующихся связей в ходе элементарной реакции. Анализ элементарных стадий с этой точки зрения показал, что в подавляющем большинстве случаев разница |
D
q
| числа рвущихся и образующихся связей не превышает 1
|Dq
| £ 1,
независимо от знака DH
0
элементарной стадии. Согласно этому правилу реакция (37) также не является элементарной (|Dq
| = 2).
Заключение
Сформулируем набор правил для отбора термодинамически разрешенных термических ЭС. Элементарными реакциями, в первом приближении, можно считать реакции, для которых:
- молекулярность прямой и обратной реакций меньше или равна 2 (m
£ 2);
- число рвущихся связей не отличается от числа образующихся более, чем на 1 (правило компенсации связей |Dq
| £ 1);
- занятые граничные орбитали реагентов коррелируют по симметрии с занятыми граничными орбиталями продуктов (граничные орбитали донора и акцептора имеют одинаковую симметрию);
- топология перераспределения связей (топологическая структура переходного состояния) является линейной или циклической.
Принцип наименьшего движения можно рассматривать как дополнительное правило самого общего характера.
Вопросы для самоконтроля
1) Назвать основные законы, правила и принципы в теории элементарных стадий.
2) Перечислить правила отбора ЭС.
3) Рассчитать число электронов в валентной оболочке металла в соединениях: K2
ReH9
, Mn2
(CO)10
, (h3
–C3
H5
)NiCl(PR3
)2
, Na2
PtCl6
, OsO4
, NºOsCl3
,
(h6
–C6
H6
)2
Cr, HNiL4
+
, K4
Pd(CN)4
.
4) Определить, может ли реакция

быть элементарной стадией.
5) Определить, какая из двух реакций пойдет быстрее и во сколько раз (298К):
 ∆H1
0
= – 48.1 кДж/моль ∆H1
0
= – 48.1 кДж/моль
 ∆H2
0
= –36.3 кДж/моль ∆H2
0
= –36.3 кДж/моль
Литература для углубленного изучения
1. Гаммет Л., Основы физической органической химии, М., Мир, 1972.
2. Денисов Е.Т., Саркисов О.М., Лихтенштейн Г.И., Химическая кинетика, М., Химия, 2000, 566 с.
3. Хоффман Р., Механизмы химических реакций, М., Химия, 1979.
4. Клопман Г., Общая теория возмущений и ее применение к химической реакционной способности, в кн.: “Реакционная способность и пути реакций”, под. ред. Клопмана Г., М., Мир, 1977, с. 64.
5. Вудворд Р., Хоффман Р., Сохранение орбитальной симметрии, М., Мир, 1971.
6. Temkin O.N., Zeigarnik A.V., Bonchev D.G. Chemical Reaction Networks. A Graph-Theoretical Approach. CRC Press, Boca Raton, 1996, 286 p.
|