Основы формальной кинетики. Понятия и определения
1) Вещества - участники реакции подразделяют на реагенты и продукты.
2) В любой момент времени они строго связаны материальным балансом.
3) Цель кинетического описания химической реакции состоит в количественном прогнозе концентраций всех реагентов и продуктов в любой момент времени от начала превращения до установления равновесия в системе. Основа материального баланса - стехиометрическое уравнение.
4) Ему строго подчиняются все приращения количеств реагентов и продуктов, и на его основе определяется материальный баланс веществ на любой глубине превращения. Количества веществ принято измерять в молях (ni). При необходимости через них выражают иные массовые характеристики системы.

2) Материальный баланс реагентов и продуктов на любой глубине превращения учитывается в виде термодинамической координаты реакции (синонимы: степень завершённости, глубина превращения - по IUPAC):
 (1.1) (1.1)
3) Через координату реакции z вводятся понятия скорости реакции v или r (от англ. rate). Принято различать:
- скорость реакции в реакционной системе v,
- скорость реакции, отнесённую к единице объёма реакционной системы r.
Отсюда вытекают некоторые важные определения.
4) Скорость химической реакции в исследуемой системе это первая производная координаты реакции по времени
 . (1.2) . (1.2)
5) При изменении объёма реакционной системы эта формула обретает вид:
 . (1.3) . (1.3)
6) Скорость химической реакции, отнесённая к единице объёма, - переменная уже более универсальная. Обычно её и называют скоростью реакции:
 . (1.4) . (1.4)
7) Скорость реакции, отнесённую к единице объёма, можно представить также в виде:
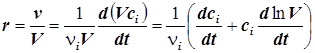 . (1.5) . (1.5)
8) Скорость реакции, протекающей в статическом реакторе (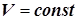 ), удобно выразить через мольные концентрации (ci
), и формула (1.3) принимает вид: ), удобно выразить через мольные концентрации (ci
), и формула (1.3) принимает вид:
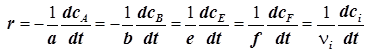 . (1.6) . (1.6)
9) Типичные концентрационные функции исчерпания продукта и накопления реагента (кинетические кривые) имеют вид монотонно изменяющихся зависимостей, которые асимптотически приближаются к некоторому определённому пределу. Содержание каждого реагента в системе уменьшается, и содержание каждого продукта увеличивается. В статическом реакторе это выражается в том, что с течением времени концентрации реагентов увеличиваются, а концентрации продуктов уменьшаются. Графики кривых расходования и накопления приводятся на рис.1.
10) При протекании некоторых сложных реакций концентрации отдельных веществ-участников реакции могут изменяться и более сложным образом, в том числе и с признаками периодических изменений системы во времени, например, так, как показано на рисунке справа. Кинетика таких процессов является результатом наложения нескольких простых стадий...(рис.2)
   CA,
B
CE,
F CA,
B
CE,
F
    
Кривая
расходования Кривая
реагента накопления
продукта
0 t 0 t
|

Рис. 1
Рис. 2
Гипотеза и определения (по Вант-Гоффу):
11) Простейшие химические превращения (элементарные стадии любого сложной реакции) могут быть лишь мономолекулярными, бимолекулярными и тримолекулярными реакциями. Очевидная причина этих ограничений состоит в том, что для протекания химической реакции необходимо пространственное сближение реагирующих молекул в пространстве. Наиболее велика вероятность сближения двух частиц в пространстве. Одновременное сближение сразу трёх частиц уже намного менее вероятно, а одновременной встречи большего числа частиц уже столь незначительна, что не имеет никакого значения для протекания стадий химического превращения.
Для протекания элементарного акта химического превращения необходимо, чтобы система взаимодействующих частиц преодолела некоторое промежуточное активированное состояние. В этом нестабильном состоянии энергия увеличена по сравнению и с исходным, и с конечным состояниями реагирующих частиц. Стадия активации играет центральную роль во всём превращении.
Очень часто молекулы и активируются, и превращаются в продукты настолько быстро, что весь процесс протекает предельно компактно - практически за время соударения частиц. В этом случае число актов превращения за определённый интервал времени пропорционально числу столкновений между молекулами. Так возникают би- и тримолекулярные реакции, и это соответственно ведёт к реакциям второго и третьего порядка. Число столкновений определяется произведением чисел сталкивающихся частиц.
Нередко бывает и так, что основная стадия превращения в продукт либо сравнительно немного, либо значительно запаздывает за предшествующей стадией активации, происходящей во время соударения.
12) Основной закон химической кинетики - закон действующих масс - закон Гульдберга-Вааге: Скорость всякой простой реакции описывается уравнением степенного вида:
 , или , или  . (1.7) . (1.7)
Для реакций, протекающих в газовой фазе концентрации веществ – участников реакции удобно заменить пропорциональными им парциальными давлениями:
 . (1.8) . (1.8)
Важно! Продукты каждой элементарной стадии не являются её «действующими массами».
12.1) Простая реакция и её кинетические параметры, как-то:
-порядок реакции (показатель степени при концентрации), и порядки по отдельным реагентам: n,m, порядок суммарный: N=n+m.
-константа скорости k , представляющая собою удельную скорость. Она равна скорости при единичных концентрациях реагентов.
12.2) Возможные порядки простых (элементарных) реакций и их молекулярности: по Вант-Гоффу бывают: - 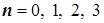 , ,
12.3) Сложные реакции являются наложением простых стадий. Следует различать:
- суммарный процесс и составляющие его
- элементарные реакции.
Суммарные порядки сложных реакций могут быть:
-целыми,
-кратными половине, т.е. 1/2, 3/2, ...
-дробными, даже отрицательными,... и вообще
-произвольными.
Наблюдаемые произвольные порядки сложных реакций всё же обычно не более 3-4.
Последний порядок численно уже «запредельный» и является прямым свидетельством сложного механизма реакции, включающего последовательные стадии.
Кинетические кривые участников сложной реакции могут внешне быть похожи на аналогичные зависимости в простых реакциях, но могут иметь и значительно более сложную форму, в том числе, иметь признаки периодичности (рис.2).
Периодические химические процессы во времена Вант-Гоффа и Аррениуса не были известны, и первой реакцией такого типа стала открытая лишь в самом начале 1950-х годов реакция Белоусова.
13) Кинетическое уравнение (при постоянном объёме реагирующей системы)
Для химической реакции вида  составляется дифференциальное уравнение, называемое кинетическим уравнением. В качестве переменной можно использовать концентрацию любого из реагентов или продуктов. Все они связаны условием материального баланса, и потому получаем: составляется дифференциальное уравнение, называемое кинетическим уравнением. В качестве переменной можно использовать концентрацию любого из реагентов или продуктов. Все они связаны условием материального баланса, и потому получаем:
 . (1.9) . (1.9)
Отсюда выбираются наиболее удобные переменные. Так скорость всегда можно выразить через концентрацию лишь одного из реагентов, или одного из продуктов, а именно:
 . (1.10) . (1.10)
Эти выражения записаны здесь на чисто формальном основании закона действующих масс. Оба выражения не являются линейно независимыми и связаны между собой уравнениями материального баланса (см. уравнение для числа пробегов реакции). На основе материального баланса все концентрации заменяются единой переменной, и это даёт возможность разделить переменные в кинетическом уравнении. Результатом его интегрирования являются зависимости концентраций всех участников от времени. Выбор конкретной переменной для разделения переменных и интегрирования уравнения зависит лишь от соображений удобства и в первую очередь от имеющихся в распоряжении исследователя экспериментальных данных.
Химический элементарный акт в теориях активации
- активация и квазиравновесие (детальное равновесие),
- активационная схема по Аррениусу и Вант-Гоффу:
Формальные аргументы при обосновании уравнения Аррениуса основаны на том, что в равновесной системе константа равновесия с одной стороны подчиняется уравнению изобары (или изохоры) Вант-Гоффа, и в то же время она есть отношение констант скоростей элементарных взаимообратных стадий. Следовательно, температурная зависимость константы скорости должна быть подобна термодинамическому уравнению изохоры Вант-Гоффа.
Активационное уравнение Аррениуса
1.1. Вывод уравнения активации по Вант-Гоффу:
Из уравнения изохоры Вант-Гоффа для обратимой реакции, содержащей прямую и обратную стадии  , получаем , получаем
 (5.1) (5.1)
Для отдельных стадий:  (5.2) (5.2)
1.2.Вывод уравнения активации по Аррениусу:
Реакция  рассматривается как состоящая из двух гипотетических стадий. На первой устанавливается равновесие между исходными и активными частицами. На второй протекает собственно превращение активных частиц в продукт. рассматривается как состоящая из двух гипотетических стадий. На первой устанавливается равновесие между исходными и активными частицами. На второй протекает собственно превращение активных частиц в продукт.
 (5.3) (5.3)
Обозначим  и получаем активационное уравнение Аррениуса: и получаем активационное уравнение Аррениуса:
 . (5.4) . (5.4)
Последнее выражение получается, если принять простейшее допущение и считать энергию активации постоянной и не зависящей от температуры. Это справедливо для небольших интервалов температуры. В большинстве приложений уравнение Аррениуса является основой экспериментального определения активационных параметров химической реакции. Простейший способ – графический. Аррениусовскими координатами называют переменные (1/T; lnk ). В этих переменных экспериментальные данные ложатся на прямолинейный график: Рис.10.
Угловой коэффициент этой линейной функции в нормальных случаях отрицателен и даёт возможность определить энергию активации. Самый смысл энергии активации говорит о том, что эта величина по знаку должна быть положительна. Если всё же наклон прямой в аррениусовских координатах окажется положительным, то это означает отрицательный знак кажущейся энергии активации, и это прямое указание на сложный механизм реакции, и такое усложнение может иметь место уже в самом элементарном акте. Подобная ситуация наблюдается у тримолекулярных реакций...
2) Молекулярные модели химического элементарного акта
2.1. Теория Активных Соударений (ТАС)
2.1.1. Число двойных соударений между одинаковыми частицами
Одна частица в единицу времени пробежит «цилиндр соударения» (рис.), в котором затронет любую частицу, центр которой в него попадает, и его объём выражается через среднюю скорость частицы u и её диаметр :
 (5.6) (5.6)
Число частиц в этом цилиндре пропорционально его объёму и мольной концентрации. С ними-то и сталкивается одна частица. Полное же число столкновений в единичном объёме Z’ должно бы быть равно половине от произведения числа соударений одной частицы на число всех частиц в объёме (удобно выразить его через мольную концентрацию), но, согласно газокинетической теории Максвелла, истинное число соударений Z превышает Z’ в 21/2 раз из-за ломаного характера траектории, увеличивающего вероятность встреч частиц в пространстве. Необходимые формулы имеют вид:

 (5.7) (5.7)
Примечание: Неискушённый читатель вправе удивиться столь простому и решительному способу подсчёта числа столкновений частиц – ведь, всякое соударение изменяет вектор скорости, и реальная траектория это ломаная линия. Однако учтём, что при упругом ударе изменяется лишь направление, а не модуль вектора скорости, и поэтому длина ломаной траектории, образуемой за единицу времени, остаётся равной линейной скорости частицы. Это подобно тому, как длина столярной складной линейки суммируется из её отдельных сегментов. Полезно отметить, что и уточнение числа соударений за счёт учёта постоянной смены ориентации движений, носит формальный характер, не меняя существа дела. Добавим, что газокинетический диаметр частиц понятие до известной степени условное и вводится для упрощения модели.
2.1.2. Число соударений между разными частицами (частицы вида 1 и частицы вида 2)
В формулу средней скорости следует подставить усреднённый диаметр и приведённую массу, и также нет необходимости уменьшать число соударений вдвое. Все прочие соображения те же самые... Поэтому при наличии всех сомножителей со слегка изменённым смыслом численный множитель возрастёт вдвое... Действительно, получаем
 (5.8) (5.8)
2.1.3. Число «горячих» частиц одного вида равно  , откуда получаем: , откуда получаем:
1) число «горячих» соударений между молекулами одного вида
 (5.9) (5.9)
2) число «горячих» соударений между молекулами разных видов
 (5.10) (5.10)
2.1.4. Бимолекулярные элементарные акты. Два различных случая
1) Реагируют одинаковые частицы:
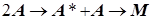 (M- частицы продукта ) (M- частицы продукта )
Скорость первой стадии это число «горячих» частиц, образующихся в единицу времени, и, согласно стехиометрии, оно равно числу активных соударений. Это означает:
 (5.11) (5.11)
2) Реагируют различные частицы:
 (M – частицы продукта) (M – частицы продукта)
 (5.12) (5.12)
Получена та же формула, что и для реакции одинаковых частиц. Здесь эмпирический поправочный множитель p называется стерическим фактором. Он характеризует отклонение от теоретического значения под влиянием любых факторов. Принято считать, что он возникает из-за поправок на вероятность встречи молекул своими активными регионами – теми, где находятся их реакционные центры.
Комментарий. Элементарные сведения из молекулярно-кинетической теории:
Средние скорости частиц идеального газа и их пропорция в распределении Максвелла:
  и и
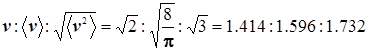
(скорости: наиболее вероятная, средняя арифметическая, среднеквадратичная ). В принципе-то их отличия несущественны, и строго говоря, неважно, какую из них использует читатель .... Всё равно в приложениях далее появляется эмпирический поправочный стерический фактор, который обычно на многие порядки может отличатся от единицы...
(Распределение Максвелла см. в учебниках Даниэльса и Олберти или Ерёмина...
Превосходное изложение, без спешки и коварных сокращений, немного старомодное и добропорядочное, ну- прямо-таки, как Шерлок Холмс в исполнении Василия Ливанова, читатель найдёт в обстоятельной книге Мелвин-Хьюза...).
|