| Курсовая работа
“Подготовка и конденсация воды”
Одесса 2010
Введение
В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул. Полярность молекул воды, характеризуемая дипольным моментом, определяет большую энергию взаимного притяжения молекул воды (ориентационное взаимодействие) при температуре 10…30 С и соответственно большую теплоту фазового перехода при парообразовании, высокую теплоемкость и теплопроводность. Значение диэлектрической постоянной воды, также зависящей от дипольного момента, определяет своеобразие свойств воды как растворителя.
При нагреве воды на поверхностях нагрева образуются твердые отложения накипеобразующих солей. При испарении воды в пар переходят коррозионно-активные газы, которые способствуют разрушению поверхности охлаждения и генерируют новые вещества, образующие отложения из продуктов коррозии.
Надежность работы энергетического оборудования на станции непосредственно связана с качеством подпиточной воды котлов. Правильно рассчитанный, смонтированный и эксплуатируемый комплекс водоподготовки, дополненный химической программой коррекции котловой воды, является необходимым условием долговечной и экономичной работы любого котлоагрегата.
В условиях эксплуатации энергетического оборудования на ТЭС или АЭС при организации водного режима необходимо создавать условия, при которых обеспечиваются минимальные значения скорости коррозии и снижение накипных отложений. Отложения могут образовываться из примесей, поступающих в воду теплоэнергетических установок от внешних и от внутренних источников.
Исходные данные
Исходной водой является вода Бассейны Ингула со следующим химическим составом:
-биогенные компоненты:
 =1,66 мг/л;; =1,66 мг/л;;
NO2+=0,030 мг/л;
NO3+=0,11 мг/л;
Fe=0,11 мг/л;
P=0,060мг/л;
Si=5,9 мг/л;
-окисляемость:
БО=28,4 мгО2/л;
ПО=7,8мгО2/л;
-главные ионы:
HCO3-=294,7 мг/л;
SO42-=67,8 мг/л;
Cl-=55,7 мг/л;
Ca2+=92,3 мг/л;
Mg2+=15,9 мг/л;
Na++K+=38,5мг/л;
-Жо=5,9 мг-экв/л;
Блоки: 210МВт 6шт.
Таблица 1
| Общая концентрация
|
Электро
провод
ность, χ=Сλf
мкСм/см
|
| Молекуля
рная масса "М"
|
Эквива
лентная масса "Э"
|
Обозначения
|
Исх. концентрация
|
Скорректированная концентрация
|
| [H] мг/кг
|
[C]мг-экв/кг
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
| 40,08
|
20,04
|
Ca2+
|
51,8
|
2,585
|
51,8
|
2,585
|
0,0013
|
0,005
|
110,67
|
| 24,03
|
12,01
|
Mg2+
|
10,8
|
0,899
|
10,8
|
0,899
|
0,0004
|
0,001
|
40,8
|
| 23
|
23
|
Na+
|
6,4
|
0,278
|
11,884
|
0,517
|
0,0005
|
0,001
|
23,84
|
| 1
|
1
|
H+
|
| Сумма Kt
|
3,762
|
4,001
|
| 17
|
17
|
OH-
|
| 61
|
61
|
HCO3-
|
199,7
|
3,274
|
199,7
|
3,274
|
0,0033
|
0,020
|
134,18
|
| 60
|
30
|
CO32-
|
| 96
|
48
|
SO42-
|
17,3
|
0,360
|
17,3
|
0,360
|
0,0002
|
0,002
|
20,75
|
| 35,46
|
35,46
|
Cl-
|
13,0
|
0,367
|
13,0
|
0,367
|
0,0004
|
0,001
|
25,78
|
| Сумма An
|
4,001
|
4,001
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4-,мг/л
|
0,60
|
моль/л
|
0,006
|
| NO2-, мг/л
|
0,02
|
f’
|
0,921
|
| NO3-, мг/л
|
0,11
|
f“
|
0,720
|
| Fe, мг/л
|
0,10
|
CО2ф,моль/л
|
0,00002
|
| P, мг/л
|
0,04
|
СО2р,моль/л
|
0,00016
|
| Si, мг/л
|
0,00
|
рНф
|
8,59
|
| БО, мгО2/л
|
10,7
|
рНр
|
7,75
|
| ПО, мгО2/л
|
4,00
|
Ис
|
0,84
|
| Жо, мг-экв/л
|
3,7
|
Жо-расчетное значение, мг-экв/л
|
3,48
|
| СС,мг/л
|
СС, расчетное значение мг/л
|
304,48
|
| Электропроводность,Сf,мкСм/см
|
356,02
|
Расчёт и корректировка исходного состава воды
Для начала найдём эквивалентные массы ионов:
Э = М/Z,
где М- молярная масса иона;
Z- заряд иона.
Э(Са2+) = 40,08/2 = 20,04 г-экв;
Эквиваленты остальных ионов считаются аналогично.
Расчет начинаем с анионного состава воды:
[С] = [Н]/Э,
где [Н]- концентрация иона, выраженная в мг/л,
Э- эквивалент иона.
С(HCO3-) =3,274мг-экв/кг;
С(SO42-) = 0,360мг-экв/кг;
C(Cl-) = 0,367 мг-экв/кг.
Σ An = 4,001мг-экв/кг.
Рассчитаем катионный состав воды:
С(Са2+) = 2,585мг-экв/кг;
С(Mg2+) = 0,899мг-экв/кг;
С(Na+) = 0,278мг-экв/кг;
Σ Kt = 3,762мг-экв/кг.
Правильность определения концентраций катионов и анионов, т.е. солей, образованных эквивалентным количеством ионов, проверяют на основании закона электронейтральности по уравнению:
Σ Kt=ΣAn.
При несоблюдении этого условия, следует скорректировать состав воды. Это достигается путём добавления натрия Na+.
Т.о. закон электронейтральности соблюдается.
Пересчитаем значения концентраций примесей в другие виды концентраций: [N]= [Н]/(М.1000), моль/л;
Пересчёт остальных концентраций осуществляется аналогично.
[С]= [Н]/104,%
Ионная сила раствора равна полусумме произведений молярных концентраций на квадраты их зарядов.
μ = 0,5 
Коэффициент активности – функция ионной силы раствора:
lg f' = -0.5Zi2  , ,
f = 10 , ,
Концентрация в природных водах недиссоциированных молекул Н2СО3 составляет обычно лишь доли процента от общего количества свободной углекислоты, под которым понимают сумму Н2СО3+ СО2.
Равновесное значение суммы Н2СО3+ СО2, моль/кг
Н2СО3+ СО2 =  , ,
и рН – равновесное

Таблица 2
| Молекуляр-
|
Эквивалент-
|
Обозначения
|
Концентрации после коагуляции
|
Электропровод-
|
| ная масса "М"
|
ная масса "Э"
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
ность, мкСм/см
|
| 40.08
|
20.04
|
Ca2+
|
51.800
|
2.585
|
0.0013
|
0.005
|
109.97
|
| 24.03
|
12.01
|
Mg2+
|
10.800
|
0.899
|
0.0004
|
0.001
|
40.54
|
| 23
|
23
|
Na+
|
11.884
|
0.517
|
0.0005
|
0.001
|
|
| 1
|
1
|
H+
|
| Сумма Kt
|
4.001
|
| 17
|
17
|
OH-
|
| 61
|
61
|
HCO3-
|
169.200
|
2.774
|
0.003
|
0.017
|
113.50
|
| 60
|
30
|
CO32-
|
| 96
|
48
|
SO42-
|
41.300
|
0.860
|
0.000
|
0.000
|
49.23
|
| 35.46
|
35.46
|
Cl-
|
13.000
|
0.367
|
0.000
|
0.001
|
25.74
|
| Сумма An
|
4.001
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4+, мг/л
|
0.300
|
моль/л
|
0.006
|
| NO2-, мг/л
|
0.011
|
f'
|
0.920
|
| NO3-, мг/л
|
0.055
|
f''
|
0.715
|
| Fe, мг/л
|
0.030
|
СО2 моль/л
|
0.0005
|
| P, мг/л
|
0.022
|
pH
|
7.153
|
| Si, мг/л
|
0.000
|
Жо - расчетное значение, мг-экв/л
|
3.484
|
| БО, мгО2/л
|
5.350
|
CC, расчетное значение мг/л
|
297.984
|
| ПО, мгО2/л
|
2.000
|
Электропроводность, СfмкСм/см
|
362.783
|
| Dk,мг-экв/л
|
0.500
|
Вывод: Величина pH имеет оптимальное значение, т.к. входит в интервал 5,5-7,5. Бикарбонатная щелочность увеличилась на дозу коагулянта, а содержание сульфатов увеличилось.
Коагуляция исходной воды
В данном случае, в качестве коагулянта использовался сернокислый алюминий Al2(SO4)3.
Доза добавляемого коагулянта:
Dk = 0,07.ПО = 0,12.8,1 = 0,972мг-экв/л.
Т.к. Dk>0,5 принимаем это значение равное 0,5 мг-экв/л.
Оптимальное значение рН при коагуляции с сернокислым алюминием находится в интервале 5,5 – 7,5. Значение величины рН среды при коагуляции оказывает влияние на скорость и полноту гидролиза.
При коагуляции в обрабатываемой воде увеличивается содержание сульфатов, но уменьшается бикарбонатная щелочность на дозу коагулянта. Катионный состав воды не меняется.
Таблица 3
| Молекуляр-
|
Эквивалент-
|
Обозначения
|
Концентрации(С СаСl2,Ca=HCO3)
|
После гидратного известкования
|
Электропровод-
|
| ная масса "М"
|
ная масса "Э"
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
ность,мкСм/см
|
| 40,08
|
20,04
|
Ca2+
|
65,606
|
3,274
|
0,0016
|
0,0066
|
31,088
|
1,551
|
0,0008
|
0,0031
|
69,44
|
| 24,03
|
12,01
|
Mg2+
|
10,8
|
0,899
|
0,0004
|
0,0011
|
7,782
|
0,648
|
0,0003
|
0,0008
|
30,74
|
| 23
|
23
|
Na+
|
11,884
|
0,517
|
0,0005
|
0,0012
|
11,884
|
0,517
|
0,0005
|
0,0012
|
24,11
|
| 1
|
1
|
H+
|
| Сумма Kt
|
4,69
|
2,716
|
| 17
|
17
|
OH-
|
5,100
|
0,300
|
0,0003
|
0,0005
|
55,4
|
| 61
|
61
|
HCO3-
|
199,7
|
3,274
|
0,0033
|
0,02
|
19,215
|
0,315
|
0,0003
|
0,0019
|
13,05
|
| 60
|
30
|
CO32-
|
5,550
|
0,185
|
0,0001
|
0,0006
|
9,65
|
| 96
|
48
|
SO42-
|
17,3
|
0,360
|
0,0002
|
0,0017
|
41,3
|
0,860
|
0,0004
|
0,0041
|
51,8
|
| 35,46
|
35,46
|
Cl-
|
37,43
|
21,056
|
0,0011
|
0,0037
|
37,43
|
1,056
|
0,0011
|
0,0037
|
75,06
|
| Сумма An
|
4,69
|
2,716
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4+, мг/л
|
0,3
|
моль/л
|
0,004
|
| NO2-, мг/л
|
0,011
|
f'
|
0,931
|
| NO3-, мг/л
|
0,055
|
f''
|
0,752
|
| Fe, мг/л
|
0,33
|
СО2 моль/л
|
0,0005
|
| P, мг/л
|
0,022
|
pH
|
10,446
|
| Si, мг/л
|
0
|
Жо - расчетное значение, мг-экв/л
|
2,199
|
| БО, мгО2/л
|
5,35
|
CC, расчетное значение мг/л
|
154,249
|
| ПО, мгО2/л
|
2
|
Электропроводность, СfмкСм/см
|
329,249
|
| Dk,мг-экв/л
|
0,5
|
| Dи,мг-экв/л
|
3,78
|
| Иизв,мг-экв/л
|
0,300
|
| DCaCl2,мг-экв/л
|
-0,689
|
| Mg2+max
|
0,596
|
Коагуляция с известкованием исходной воды (гидратный режим)
Гидратный режим известкования благоприятен для удаления магния, соединений железа, кремния и для осветления воды.
Для расчёта данной таблицы использовали коагулянт – сернокислое железо FeSO4 и гашёную известь Са(ОН)2. Оптимальное значение рН находится в интервале 9 – 10,5. Доза коагулянта Dk = 0,5 мг-экв/л.
Т.к. воды относятся к III группе и являются щелочными, т.е содержание ионов НСО3- находится в избытке по сравнению с остаточной жесткостью, то известкование в этом случае является нецелесообразным. Воду из III группы переводят в I путем добавления CaCl2 эквивалентно содержанию HCO3-.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост =  мг-экв/л. мг-экв/л.
Используя закон электронейтральности, находим остаточную концентрацию ионов Са2+:
Концентрация сульфатов увеличивается на дозу коагулянта.
Таблица 4
| Молекуляр-
|
Эквивалент-
|
Обозначения
|
Концентрации(С СаСl2,Ca=HCO3)
|
После бикарбонатного известкования
|
Электропровод-
|
| ная масса "М"
|
ная масса "Э"
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
ность, мкСм/см
|
| 40,08
|
20,04
|
Ca2+
|
51,8
|
2,585
|
0,0013
|
0,0052
|
21,443
|
1,07
|
0,0005
|
0,0021
|
48,48
|
| 24,03
|
12,01
|
Mg2+
|
10,8
|
0,899
|
0,0004
|
0,0011
|
10,8
|
0,899
|
0,0004
|
0,0011
|
43,17
|
| 23
|
23
|
Na+
|
11,884
|
0,517
|
0,0005
|
0,0012
|
11,884
|
0,517
|
0,0005
|
0,0012
|
24,18
|
| 1
|
1
|
H+
|
| Сумма Kt
|
4,001
|
2,486
|
| 17
|
17
|
OH-
|
1,190
|
0,070
|
0,0001
|
0,0001
|
12,97
|
| 61
|
61
|
HCO3
-
|
199,7
|
3,274
|
0,0033
|
0,02
|
23,485
|
0,385
|
0,0004
|
0,0023
|
16,0
|
| 60
|
30
|
CO3
2-
|
3,450
|
0,115
|
0,0001
|
0,0003
|
6,07
|
| 96
|
48
|
SO4
2-
|
17,3
|
0,36
|
0,0002
|
0,0017
|
41,3
|
0,86
|
0,0004
|
0,0041
|
52,42
|
| 35,46
|
35,46
|
Cl-
|
37,43
|
1,056
|
0,0011
|
0,0037
|
37,43
|
1,056
|
0,0011
|
0,0037
|
75,28
|
| Сумма An
|
4,69
|
2,486
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4
+
, мг/л
|
0,3
|
моль/л
|
0,004
|
| NO2
-
, мг/л
|
0,011
|
f'
|
0,934
|
| NO3
-
, мг/л
|
0,055
|
f''
|
0,761
|
| Fe, мг/л
|
0,03
|
СО2
моль/л
|
0,0005
|
| P, мг/л
|
0,022
|
pH
|
9,816
|
| Si, мг/л
|
0
|
Жо - расчетное значение, мг-экв/л
|
1,969
|
| БО, мгО2
/л
|
5,35
|
CC, расчетное значение мг/л
|
149,792
|
| ПО, мгО2
/л
|
2,0
|
Электропроводность, СfмкСм/см
|
278,574
|
| Dk,мг-экв/л
|
0,5
|
| Dи,мг-экв/л
|
3,481
|
| Иизв,мг-экв/л
|
0,07
|
| DCaCl2,мг-экв/л
|
0
|
Коагуляция и известкование исходной воды (карбонатный режим)
В качестве коагулянта используется сернокислое железо, доза которого Dk = 0,5 мг-экв/л.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост =  мг-экв/л. мг-экв/л.
Концентрацию магния не изменяется.
Остаточная концентрация кальция рассчитывается из закона электронейтральности (концентрация ионов магния и натрия не изменяется):
Карбонатный режим применяют: 1) когда вынужденно приходится использовать в качестве коагулянта сернокислый алюминий; 2) при необходимости исключить выделение магниевых соединений, чтобы в случае соблюдения определённых гидравлических условий получать при известковании крупнокристаллический осадок. При карбонатном режиме несколько уменьшается расход извести (по сравнению с гидратным режимом).
Таблица 5
| Молекуляр-
|
Эквивалент-
|
Обозначения
|
Концентрации(С СаСl2,Ca=HCO3)
|
После известкования и содирования
|
Электропровод-
|
| ная масса "М"
|
ная масса "Э"
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
ность,мкСм/см
|
| 40,08
|
20,04
|
Ca2+
|
65,606
|
3,274
|
0,0016
|
0,0066
|
1,922
|
0,096
|
0,00005
|
0,0002
|
4,54
|
| 24,03
|
12,01
|
Mg2+
|
10,8
|
0,899
|
0,0004
|
0,0011
|
5,185
|
0,432
|
0,0002
|
0,0005
|
21,64
|
| 23
|
23
|
Na+
|
11,884
|
0,517
|
0,0005
|
0,0012
|
11,884
|
2,238
|
0,0005
|
0,0012
|
105,89
|
| 1
|
1
|
H+
|
| Сумма Kt
|
4,69
|
8,199
|
| 17
|
17
|
OH-
|
5,950
|
0,350
|
0,0004
|
0,0006
|
65,54
|
| 61
|
61
|
HCO3-
|
199,7
|
3,274
|
0,0033
|
0,02
|
12,200
|
0,200
|
0,0002
|
0,0012
|
8,4
|
| 60
|
30
|
CO32-
|
9,000
|
0,300
|
0,0002
|
0,0009
|
16,53
|
| 96
|
48
|
SO42-
|
17,3
|
0,36
|
0,0002
|
0,0017
|
41,3
|
0,86
|
0,0004
|
0,0041
|
54,74
|
| 35,46
|
35,46
|
Cl-
|
37,43
|
1,056
|
0,0011
|
0,0037
|
37,43
|
1,056
|
0,0011
|
0,0037
|
76,1
|
| Сумма An
|
4,69
|
2,766
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4+, мг/л
|
0,3
|
моль/л
|
0,003
|
| NO2-, мг/л
|
0,011
|
f'
|
0,944
|
| NO3-, мг/л
|
0,055
|
f''
|
0,795
|
| Fe, мг/л
|
0,030
|
СО2 моль/л
|
0,0005
|
| P, мг/л
|
0,022
|
pH
|
10,519
|
| Si, мг/л
|
0
|
Жо - расчетное значение, мг-экв/л
|
0,528
|
| БО, мгО2/л
|
5,35
|
CC, расчетное значение мг/л
|
158,519
|
| ПО, мгО2/л
|
42,0
|
Электропроводность, СfмкСм/см
|
353,369
|
| Dk,мг-экв/л
|
0,5
|
| Dи,мг-экв/л
|
3,948
|
| Иизв,мг-экв/л
|
0,350
|
| Dс,мг-экв/л
|
1,722
|
| DCaCl2,мг-экв/л
|
-0,689
|
| Mg2+max
|
0,403
|
| Са2+мах
|
0,088
|
Коагуляция с известкованием и содированием исходной воды
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Происходящие при известково-содовом умягчении основные химические процессы описываются следующими уравнениями:
а2СО3 → 2 Nа+ + СО32-;
Са(ОН)2 → Са2+ +2ОН-;
СО2 + 2ОН- → СО32- + Н2О;
Н+ + ОН- → Н2О
НСО3- → Н+ + СО32-
НСО3- + ОН- = СО32- + Н2О;
Са2+ + СО32- → СаСО3↓;
Мg2+ + 2ОН- → Мg(ОН)2↓.
Приняв значение ОН- определяем остаточную концентрацию ионов кальция и магния. Концентрация сульфатов увеличивается на дозу коагулянта.
Т.о. остаточную концентрацию натрия определяем из закона электронейтральности.
Таблица 6
| Молекуляр-
|
Эквивалент-
|
Обозначения
|
Концентрации(С СаСl2,Ca=HCO3)
|
После известкования с обескремниванием
|
Электропровод-
|
| ная масса "М"
|
ная масса "Э"
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
[H] мг/кг
|
[C] мг-экв/кг
|
[N] моль/кг
|
%
|
ность, мкСм/см
|
| 40,08
|
20,04
|
Ca2+
|
65,606
|
3,274
|
0,0016
|
0,0066
|
33,328
|
1,663
|
0,00108
|
0,0033
|
74,53
|
| 24,03
|
12,01
|
Mg2+
|
108
|
0,899
|
0,0004
|
0,0011
|
6,440
|
0,536
|
0,0003
|
0,0006
|
25,46
|
| 23
|
23
|
Na+
|
11,884
|
0,517
|
0,0005
|
0,0012
|
11,884
|
0,517
|
0,0005
|
0,0012
|
24,12
|
| 1
|
1
|
H+
|
| Сумма Kt
|
4,69
|
0,276
|
| 17
|
17
|
OH-
|
5,100
|
0,300
|
0,0003
|
0,0005
|
55,42
|
| 61
|
61
|
HCO3-
|
1997
|
3,274
|
0,0033
|
0,02
|
23,485
|
0,385
|
0,0004
|
0,0023
|
15,96
|
| 60
|
30
|
CO32-
|
3,450
|
0,115
|
0,0001
|
0,0003
|
6,00
|
| 96
|
48
|
SO42-
|
17,3
|
0,36
|
0,00202
|
0,0017
|
41,3
|
0,86
|
0,0004
|
0,0041
|
51,85
|
| 35,46
|
35,46
|
Cl-
|
37,43
|
1,056
|
0,0011
|
0,0037
|
37,43
|
1,056
|
0,0011
|
0,0037
|
75,08
|
| Сумма An
|
4,69
|
2,716
|
| Обозначения
|
Значения
|
Обозначения и расчетные формулы
|
Значения
|
| NH4+, мг/л
|
0,3
|
моль/л
|
0,004
|
| NO2-, мг/л
|
0,011
|
f'
|
0,932
|
| NO3-, мг/л
|
0,055
|
f''
|
0,753
|
| Fe, мг/л
|
0,03
|
СО2 моль/л
|
0,00052
|
| P, мг/л
|
0,022
|
pH
|
10,446
|
| Si, мг/л
|
0
|
Жо - расчетное значение, мг-экв/л
|
2,199
|
| БО, мгО2/л
|
5,35
|
CC, расчетное значение мг/л
|
157,317
|
| ПО, мгО2/л
|
2,0
|
Электропроводность, СfмкСм/см
|
328,418
|
| Dk,мг-экв/л
|
0,5
|
| Dи,мг-экв/л
|
3,711
|
| Иизв,мг-экв/л
|
0,300
|
| DCaCl2,мг-экв/л
|
0,689
|
| Mg2+max
|
0,493
|
Вывод: Для данных вод с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальной схемой предочистки является К+Иг+Ф и К+Иб+Ф.
Коагуляция с известкованием и магнезиальным обескремниванием исходной воды
Основным из числа методов магнезиального обескремнивания воды является метод обескремнивания каустическим магнезитом. Одновременно с обескремниванием воды проводят её известкование и коагуляцию.
Известкование при магнезиальном обескремнивании производится для того, чтобы снизить щёлочность воды и создать должную величину рН. При рН<10удаление кремнекислых соединений будет затруднено из-за недостаточной диссоциации Н2SiО3. Кроме того, вследствие низкой концентрации в воде ионов ОН- обескремнивающий реагент будет взаимодействовать с бикарбонат-ионами исходной воды, свободной угольной кислотой, а также введённым в воду коагулянтом:
МgО + Н2О → Мg(ОН)2 → Мg2+ + 2ОН-;
ОН- + Н+ → Н2О;
НСО3- → СО32- + Н+;
СО2 + Н2О → Н2СО3 → Н+ + НСО3- → 2 Н+ + СО32-;
СО32- + Са2+ → СаСО3↓;
2 ОН- + Fе2+ → Fе(ОН)2.
Экспериментальные данные подтверждают, что обескремнивание наиболее эффективно происходит в узком интервале величин рН=10,1 – 10,3, достигая в отдельных случаях 10,4. Оптимум рН несколько различен для разных вод.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
При расчёте данной таблицы использовали коагулянт FeSO4, доза которого Dk = 0,5 мг-экв/л, остаточную концентрацию кальция определяем из закона электронейтральности.
Таблица 7
| Обозначение
|
Ед. изм.
|
Числ. Знач.
|
| N
|
МВт
|
210
|
| Qдв=(Q01+Q02+Q03+Q04+Q05)
|
т/ч
|
215.6
|
| Q01=nrD1
|
т/ч
|
126.63
|
| Q02
|
т/ч
|
25
|
| Q03=0,12*0,15*0,7*n*N
|
т/ч
|
42.34
|
| Q04=nr1D1z
|
т/ч
|
2.01
|
| Q05=0,1*(Q01+Q02+Q03+Q04)
|
т/ч
|
19.6
|
| D1
|
т/ч
|
670
|
| n
|
шт
|
6
|
| r
|
доли
|
0.03
|
| X1
|
доли
|
0.05
|
| X
|
доли
|
0.02
|
| r1
|
доли
|
0.03
|
| z
|
доли
|
0.1
|
| Qдвб=(1+X) (1+X1)*Qдв
|
т/ч
|
446,29
|
Вывод: Количество воды, поступающей в осветлители на обработку известью и другими реагентами составляет Qдвб=446,9 т/ч.
Расчет производительности ВПУ
Производительность ВПУ по обессоленной воде:
 , ,
где  - потеря суммарной паропроизводительности парогенераторов, т/ч: - потеря суммарной паропроизводительности парогенераторов, т/ч:
 , ,
r – доля потери пара и конденсата в контуре блока;
n=6 - количество энергоблоков на станции;
 - паропроизводительность парогенератора, т/ч; - паропроизводительность парогенератора, т/ч;
 - дополнительная производительность установки, зависящая от мощности блока, т/ч; - дополнительная производительность установки, зависящая от мощности блока, т/ч;
 - дополнительная производительность ВПУ, связанная с возможной потерей конденсата при разогреве мазута, т/ч. Для АЭС - дополнительная производительность ВПУ, связанная с возможной потерей конденсата при разогреве мазута, т/ч. Для АЭС  =0; =0;
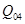 - потери пара конденсата, которые возникают в теплосетях, т/ч: - потери пара конденсата, которые возникают в теплосетях, т/ч:
 , ,
z – доля потери конденсата в подогревателях воды тепловых сетей;
r1 – доля отбора пара на подогрев воды в тепловых сетях;
 - дополнительная производительность для компенсации отпуска воды на другие объекты, т/ч: - дополнительная производительность для компенсации отпуска воды на другие объекты, т/ч:

Количество исходной воды, поступающей в осветлитель, т/ч:

х - доля потери воды с продувкой воды (при обезвоживании шлама и возврате фугата в осветлитель х=0);
х1 - доля потери на собственные нужды.
Таблица 8
| Расчет оборотной системы охлаждения
|
| Обознач.
|
Ед. изм.
|
Исх. вода
|
ОСО 1
|
+H2SO4
|
ОСО 2
|
+H2SO4
|
OCO 3
|
| Ca2+
|
мг-экв/л
|
5,87
|
Нецелесообразно, т.к концентрация HCO3- в исходной воде превышает нормированное значение 3 мг-экв/л
|
5,87
|
39,09
|
5,87
|
41,36
|
| Mg2+
|
мг-экв/л
|
2,96
|
2,96
|
19,75
|
2,96
|
20,89
|
| Na+
|
мг-экв/л
|
3,82
|
3,82
|
25,43
|
3,82
|
26,91
|
| ∑Кt
|
мг-экв/л
|
12,65
|
12,65
|
84,27
|
12,65
|
89,16
|
| OH-
|
мг-экв/л
|
0
|
0
|
0
|
0
|
0
|
| HCO3-
|
мг-экв/л
|
5,09
|
0,45
|
3,00
|
0,45
|
6,00
|
| Cl-
|
мг-экв/л
|
3,56
|
3,56
|
23,69
|
3,56
|
25,07
|
| SO42-
|
мг-экв/л
|
4,00
|
8,64
|
57,58
|
8,64
|
58,10
|
| ∑An
|
мг-экв/л
|
12,65
|
12,65
|
84,27
|
12,65
|
89,16
|
| µ
|
моль/л
|
0,01907
|
0,14249
|
0,14934
|
| f'
|
0,8696305
|
0,72942858
|
0,72549367
|
| f"
|
0,571925
|
0,28309428
|
0,27703492
|
| СО2р
|
моль/л
|
0,00061
|
0,00049
|
0,00201
|
| pHр
|
7,3260001
|
7,11390278
|
6,80012363
|
| Dк
|
4,64149119
|
4,24
|
| p1
|
1,2
|
1,2
|
| p2
|
0,05
|
0,05
|
| p3
|
0,1619375
|
0,1483932
|
| ∆t
|
°С
|
10
|
| К
|
0,12
|
| Ку
|
6,6620463
|
7,0485945
|
| Dпг
|
т/ч
|
6160
|
6160
|
| n
|
шт
|
3
|
6
|
| r
|
кДж/кг
|
2424,34
|
2424,34
|
| Dn
|
т/ч
|
18480
|
18480
|
| Dk
|
т/ч
|
11088
|
11088
|
| D3
|
т/ч
|
1731,5256
|
1586,70235
|
| D3
|
т/год
|
12120679,6
|
11106916,4
|
| D2
|
т/ч
|
534,627723
|
534,627723
|
| D2
|
т/год
|
3742394,06
|
3742394,06
|
| D1
|
т/ч
|
12831,0654
|
12831,0654
|
| D1
|
т/год
|
89817457,5
|
89817457,5
|
| Do
|
т/ч
|
1069255,45
|
1069255,45
|
| Добавочная вода
|
15097,2187
|
14952,3954
|
| Ca2+*f''*SO42-*f"
|
4,51E-05
|
4,61E-05
|
| ПРCaSO4
|
2,50E-05
|
2,50E-05
|
| -80,41826
|
-84,43813
|
| Обознач.
|
Ед. изм.
|
Исх. вода
|
Изв г.р.
|
+H2SO4
|
ОСО 4
|
Изв б.р.
|
+H2SO4
|
ОСО 4
|
Изв с.
|
+H2SO4
|
| Ca2+
|
мг-экв/л
|
5,87
|
3,62
|
3,62
|
60,78
|
1,07
|
1,07
|
26,75
|
0,10
|
0,10
|
| Mg2+
|
мг-экв/л
|
2,96
|
0,65
|
0,65
|
10,89
|
2,96
|
2,96
|
74,10
|
0,43
|
0,43
|
| Na+
|
мг-экв/л
|
3,82
|
3,82
|
3,82
|
64,16
|
3,82
|
3,82
|
95,44
|
7,60
|
7,60
|
| ∑Кt
|
мг-экв/л
|
12,65
|
8,08
|
8,08
|
135,829
|
7,85
|
7,85
|
196,29
|
8,13
|
8,13
|
| OH-
|
мг-экв/л
|
0
|
0,30
|
0,00
|
0,00
|
0,07
|
0,00
|
0,00
|
0,35
|
0,00
|
| HCO3-
|
мг-экв/л
|
5,09
|
0,50
|
0,36
|
6,00
|
0,50
|
0,24
|
6,00
|
0,50
|
0,24
|
| Cl-
|
мг-экв/л
|
3,56
|
2,78
|
2,78
|
46,72
|
2,78
|
2,78
|
69,49
|
2,78
|
2,78
|
| SO42-
|
мг-экв/л
|
4,00
|
4,50
|
4,95
|
82,11
|
4,50
|
4,83
|
120,80
|
4,50
|
5,11
|
| ∑An
|
мг-экв/л
|
12,65
|
8,08
|
8,08
|
135,83
|
7,85
|
7,85
|
196,29
|
8,13
|
8,13
|
| µ
|
моль/л
|
0,01907
|
0,21322
|
0,307
|
| f'
|
0,8696305
|
0,6951114
|
0,663
|
| f"
|
0,571925
|
0,2334628
|
0,1935
|
| СО2р
|
моль/л
|
0,00061
|
0,00229
|
0,00076
|
| pHр
|
7,326
|
6,726
|
7,187021
|
| Dк
|
0,44
|
0,33
|
0,61
|
| p1
|
1,2
|
1,2
|
| p2
|
0,05
|
0,05
|
| p3
|
0,026
|
0
|
| ∆t
|
°С
|
10
|
| К
|
0,12
|
| Ку
|
16,807
|
25
|
| Dпг
|
т/ч
|
6160
|
6160
|
| n
|
шт
|
3
|
3
|
| r
|
кДж/кг
|
2424,34
|
2424,34
|
| Dn
|
т/ч
|
18480
|
18480
|
| Dk
|
т/ч
|
11088
|
11088
|
| D3
|
т/ч
|
277,1124
|
0
|
| D3
|
т/год
|
1939786,7
|
0
|
| D2
|
т/ч
|
534,62772
|
534,628
|
| D2
|
т/год
|
3742394,1
|
3742394,1
|
| D1
|
т/ч
|
12831,065
|
12831,065
|
| D1
|
т/год
|
89817457,5
|
89817457
|
| Do
|
т/ч
|
1069255,4
|
1069255,4
|
| Добавочная вода
|
13642,805
|
13365,693
|
| Ca2+*f''*SO42-*f"
|
6,88E-05
|
3,03E-05
|
| ПРCaSO4
|
2,50E-05
|
2,50E-05
|
| 16,81
|
25
|
Вывод: оптимальным является режим с минимальной величиной продувки, в данном случае - бикарбонатный режим известкования и известкование с содированием.
Оборотные системы охлаждения (ОСО)
Расчет потерь воды в ОСО
В результате циркуляции по замкнутому циклу в системе охлаждения часть оборотной воды выводится из системы вследствие испарения  , часть выносится из градирни в виде капельного уноса , часть выносится из градирни в виде капельного уноса  и, наконец, еще одна ее часть выводится из системы в виде продувки или на технологические нужды и, наконец, еще одна ее часть выводится из системы в виде продувки или на технологические нужды  . .
Коэффициент концентрирования не выпадающих в осадок солей:
 , ,

где к – зависит от температуры воздуха,
∆t - охлаждение воды в градирне, принимается 5-10 . .
 выбирается в зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для неё: выбирается в зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для неё:
 =0,05. =0,05.
 задаемся в каждом случае отдельно. задаемся в каждом случае отдельно.
ОСО1
Т.к. концентрация НСО3- в исходной воде больше 3 мг-экв/л, расчет не производится, т.к. система является нецелесообразной
ОСО2
Для предупреждения выпадения гипса необходимо выдерживать такое неравенство:
Ca2+ <  . .
Где, CaSO4 = 2,5 10-5 (моль/кг)2.
Доза серной кислоты:

Рассчитываем 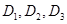 для данной системы охлаждения: для данной системы охлаждения:
   . .
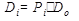
ОСО3
Добавляем оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок 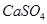 : :
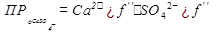 <2,5·10-5 <2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем 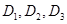 для данной системы охлаждения: для данной системы охлаждения:
Доза серной кислоты:

ОСО4
Добавляем оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок 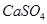 : :
 <2,5·10-5 <2,5·10-5
(табличное значение),значит не выпадет.
Добавляем известь и серную кислоту, проверяем, выпадет ли в осадок  . .
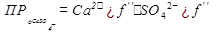 <2,5·10-5 <2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем 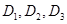 для данной системы охлаждения: для данной системы охлаждения:
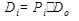
Таблица 9
| Поверочный расчёт производительности осветлителя
|
| 4 осветлителя 250-И
|
| Обознач.
|
Ед. изм.
|
Числ. Знач.
|
| Qр
|
т/ч
|
253.46
|
| Fкс
|
м2
|
53,00
|
| Vo
|
мм/с
|
1,33
|
| Co
|
мг/л
|
0,109
|
| П
|
м
|
3
|
| aс
|
0,907
|
| Hc
|
м
|
2,3
|
| aк
|
%
|
6,17
|
| Dк
|
мг-экв/л
|
0,567
|
| Э
|
36
|
| ГДПбв
|
мг/л
|
330,94
|
| ГДП
|
мг/л
|
11
|
| ГДПнк
|
мг/л
|
-140,15
|
| ГДПк
|
мг/л
|
460
|
| Vy
|
мм/с
|
2,15
|
| t
|
°C
|
20
|
Вывод: т.к.,(|898.2- 250*4|/898.2)*100= 11.34 % выбранные осветлители 250-И подходят по производительности.
Поверочный расчет осветлителя
Выбор осветлителя: необходимо выбирать не менее двух одинаковых осветлителей (т.к. обязательно нужен резервный на случай выхода из строя одного из осветлителей) и не более трех, т.к. на их обслуживание идут большие экономические затраты.
Выбираем 4 осветлителя 250-И.
Производительность осветлителя,  : :
 . .
где 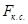 - площадь поперечного сечения зоны контактной среды, - площадь поперечного сечения зоны контактной среды,  : :
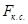 =11 =11 , ,
 - расчетная скорость восходящего движения воды на выходе из контактной зоны осветлителя, - расчетная скорость восходящего движения воды на выходе из контактной зоны осветлителя,  : :
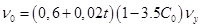 : :
где  - условная скорость свободного осаждения шлама, мм/с (находим по - условная скорость свободного осаждения шлама, мм/с (находим по 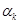 ): ):
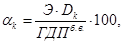
где  - доза коагулянта, мг-экв/л, - доза коагулянта, мг-экв/л,
Э – эквивалент коагулянта,
t – температура воды в интервале  С; С;
 - объемная концентрация шлама в зоне контактной среды осветлителя, мл/мл: - объемная концентрация шлама в зоне контактной среды осветлителя, мл/мл:
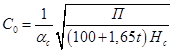 , ,
где П – прозрачность воды по кресту, см:
П=300 , ,
 =1 (по диаметру осветлителя), =1 (по диаметру осветлителя),
Приведенная высота зоны контактной среды осветлителя, м:
 =1,8 м, =1,8 м,
 - суммарное количество грубодисперсных примесей, поступающих в осветлитель и образующихся в нем, мг/л. - суммарное количество грубодисперсных примесей, поступающих в осветлитель и образующихся в нем, мг/л.
Выбранный осветлитель 250-И подходит нам по производительности.
Выводы: Для данной исходной воды с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальным является гидратный режим известкования (стр 31[1]), при котором величина продувки имеет минимальное значение и затраты на реагенты меньшие.
Список использованной литературы
1. Кишневский В.А. Современные методы обработки воды в энергетике: Учебное пособие. - Одесса: ОГПУ,1999-196 с.
2. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: Процессы и аппараты: Учеб. пособие для вузов.-М.: Энергоатомиздат,1990-272с.
3. Кульский Л.А., Строкач П.П. Технология очистки природных вод.-Киев: Вища школа. Головное изд-во,1981.-328 с.
4. Стерман Л.С. и др.Тепловые и атомные электростанции: Учебник для вузов.- М.: Энергоиздат,1982.-456 с., ил.
|