Показа́тель преломле́ния
вещества — величина, равная отношению фазовых скоростей света (электромагнитных волн) в вакууме и в данной среде 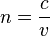 . Также о показателе преломления иногда говорят для любых других волн, например, звуковых, хотя в таких случаях, как последний, определение, конечно, приходится как-то[источник не указан 135 дней
]
модифицировать. . Также о показателе преломления иногда говорят для любых других волн, например, звуковых, хотя в таких случаях, как последний, определение, конечно, приходится как-то[источник не указан 135 дней
]
модифицировать.
Поляриметрия
— методы исследования излучения, основанные на измерении:
- степени поляризации излучения (света, радиоволн)
- оптической активности веществ или их растворов
Осмоти́ческая концентра́ция
— суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя).
Осмо́ль
— единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном кг. растворителя одного моль неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Температу́ра плавле́ния и отвердева́ния
— температура, при которой твёрдое кристаллическоетело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температу́ра кипе́ния
, точка кипения
— температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения.
Согласно уравнению Клапейрона — Клаузиуса с ростом давления температура кипения увеличивается. Предельной температурой кипения является критическая температура вещества.
Флуориметрия
(люминесцентный анализ) — определение концентрации вещества по интенсивности флуоресценции, возникающей при облучении вещества ультрафиолетовыми лучами. При соответствующих условиях этим путём можно обнаружить наличие ничтожных количеств вещества. Люминесцентный анализ делится на макроанализ — при наблюдении невооруженным глазом, и микроанализ, когда наблюдение производится при помощи микроскопа.
Атомно-эмиссионная спектроскопия (спектрометрия)
, АЭС
или атомно-эмиссионный спектральный анализ — совокупность методов элементного анализа, основанных на изучении спектров испускания свободных атомов и ионов в газовой фазе (см.
группу методов оптической спектроскопии). Обычно эмиссионные спектры регистрируют в наиболее удобной оптической области длин волн от ~200 до ~1000 нм. (Для регистрации спектров в области <200 нм требуется применение вакуумной спектроскопии, чтобы избавиться от поглощения коротковолнового излучения воздухом. Для регистрации спектров в области >1000 нм требуются специальные инфракрасные или микроволновые детекторы.)
АЭС — способ определения элементного состава вещества по оптическим линейчатым спектрам излучения атомов и ионов анализируемой пробы, возбуждаемым в источниках света. В качестве источников света для атомно-эмиссионного анализа используют пламя горелки или различные виды плазмы, включая плазму электрической искры или дуги, плазму лазерной искры, индуктивно-связанную плазму, тлеющий разряд и др.
АЭС — самый распространённый экспрессный высокочувствительный метод идентификации и количественного определения элементов примесей в газообразных, жидких и твердых веществах, в том числе и в высокочистых. Он широко применяется в различных областях науки и техники для контроля промышленного производства, поисках и переработке полезных ископаемых, в биологических, медицинских и экологических исследованиях и т.д. Важным достоинством АЭС по сравнению с другими оптическими спектральными, а также многими химическими и физико-химическими методами анализа, являются возможности бесконтактного, экспрессного, одновременного количественного определения большого числа элементов в широком интервалеконцентраций с приемлемой точностью при использовании малой массы пробы.
АТОМНО-АБСОРБЦИОННЫЙ АНАЛИЗ (атомно-абсорбц. спектрометрия), метод количеств. элементного анализа по атомным спектрам поглощения (абсорбции). Через слой атомных паровпробы, получаемых с помощью атомизатора (см. ниже), пропускают излучение в диапазоне 190-850 нм. В результате поглощения квантов света атомы переходят в возбужденные энергетич. состояния. Этим переходам в атомных спектрах соответствуют т. наз. резонансные линии, характерные для данного элемента. Согласно закону Бугера-Ламберта-Бера (см. Абсорбционная спектроскопия), мерой концентрации элемента служит оптич. плотность A = lg(I0
/I), где I0
и I-интенсивности излучения от источника соответственно до и после прохождения через поглощающий слой.
Тонкослойная хроматография (ТСХ
) является планарной разновидностью жидкостной хроматографии, в которой подвижная фаза (ПФ) движется в пористой среде слоя адсорбента.Варианты тонкослойной хроматографии
Самым простым вариантом планарной хроматографии является бумажная хроматография, когда разделение производят с использованием специальной бумаги.
Для разделения используются пластины на основе оксида алюминия и силикагеля. Наиболее распространены пластины на основе силикагеля. Оксид алюминия и силикагель, как правило, размещается на стеклянной, металлической или пластиковой основе. В ряде случаев к сорбенту добавляется флуоресцентный индикатор синего или зелёного цвета.
Газовая хроматография
— разновидность хроматографии, метод разделения летучих компонентов, при котором подвижной фазой служит инертный газ (газ-носитель), протекающий через неподвижную фазу с большой поверхностью. В качестве подвижной фазы используют водород, гелий, азот, аргон, углекислый газ. Газ-носитель не реагирует с неподвижной фазой и разделяемыми веществами.
Различают газо-твёрдофазную и газо-жидкостную хроматографию. В первом случае неподвижной фазой является твёрдый носитель (силикагель, уголь, оксид алюминия), во втором — жидкость, нанесённая на поверхность инертного носителя.
Разделение основано на различиях в летучести и растворимости (или адсорбируемости) компонентов разделяемой смеси.
Принцип жидкостной хроматографии
состоит в разделении компонентов смеси, основанный на различии в равновесном распределении их между двумя несмешивающимися фазами, одна из которых неподвижна, а другая подвижна.
Жидкостная хроматография как метод была открыта в 1903русским учёным Михаилом Цветом, который использовал для разделения растительных пигментов на их составляющие колонки, заполненные порошком мела. Предложенный Цветом метод жидкостной хроматографии был незаслуженно забыт и почти не применялся более 30 лет.
|