Федеральное агентство по образованию Российской Федерации
Новокузнецкий филиал-институт государственного образовательного учреждения высшего профессионального образования
«Кемеровский государственный университет»
Кафедра экономики
КУРСОВАЯ РАБОТА
ПО КУРСУ «ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОГРЕССИВНЫХ ТЕХНОЛОГИЙ»
Энергия, энтропия, энергетика. Идеи И. Пригожина и их значение для современной науки
Новокузнецк 2009
Реферат
Энергия, энтропия и энергетика. Идеи И. Пригожина и их значение для современной науки, специальность ЭПЗ-07, Новокузнецк, 2009 г., курсовая работа, пояснительная записка 26 стр., 8 источников, 1 приложение.
ЭНЕРГИЯ, ПОНЯТИЕ ЭНТРОПИИ, СТАТИСТИЧЕСКИЙ СМЫСЛ ПОНЯТИЯ ЭНТРОПИИ, ТЕРМОДИНАМИКА И ЭНТРОПИЯ, ТЕРМОДИНАМИКА НЕРАВНОВЕСНЫХ ПРОЦЕССОВ И ЭНТРОПИЯ, ЭНЕРГЕТИКА, ЭЛЕКТРОЭНЕРГЕТИКА, ТЕПЛОЭНЕРГЕТИКА, ЯДЕРНАЯ ЭНЕРГЕТИКА, ГИДРОЭНЕРГЕТИКА, ИДЕИ И. ПРИГОЖИНА И ИХ ЗНАЧЕНИЕ ДЛЯ СОВРЕМЕННОЙ НАУКИ
Объектом исследования является энергия, энергетика и энтропия.
Предмет исследования – виды энергетики, формы энергии, энтропия в термодинамике и термодинамике неравновесных процессов, исследования И. Пигожина.
Цель работы – выявить значение энергии, энтропии и энергетики. Рассмотреть идеи И. Пригожина и обозначить их значение для современной науки
В процессе работы были изучены теоретические аспекты энтропии, энергии и энергетики, рассмотрены виды энергетики и энтропии.
В результате исследования была выявлена роль энергии, энтропии и энергетики в физических процессах и науке; значение идей И. Пригожина.
Содержание
ВВЕДЕНИЕ
Энергия
Понятие энтропии. Статистический смысл понятия энтропии
Термодинамика и энтропия
Термодинамика неравновесных процессов и энтропия
Энергетика
Электроэнергетика
Теплоэнергетика
Ядерная энергетика
Гидроэнергетика
Идеи И. Пригожина и их значение для современной науки
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ
Введение
Предметом работы является энергия, энтропия и энергетика. Целью данной работы является изучение энтропии, энергии, энергетики; рассмотрение равновесия в живой природе и изучение идей И. Пригожина. Поставленная цель, ставит решение следующих задач: рассмотрения понятия энтропии, энергии, энергетики статистического смысла данного понятия, энтропии как меры степени неопределенности; ознакомление с видами энергии и энергетики; изучение идей И. Пригожина и выявить их значение для современной науки.
Данная тема актуальна, так как трудно найти понятия более общие для всех наук (не только естественных) и, вместе с тем, иногда носящих оттенок загадочности, чем энтропия, энергия и энергетика. Энергия - не только одно из чаще всего обсуждаемых сегодня понятий; помимо своего основного физического (а в более широком смысле - естественнонаучного) содержания, оно имеет многочисленные экономические, технические, политические и иные аспекты.
Человечеству нужна энергия, причем потребности в ней увеличиваются с каждым годом. Вместе с тем запасы традиционных природных топлив (нефти, угля, газа и др.) конечны. Конечны также и запасы ядерного топлива - урана и тория, из которого можно получать в реакторах-размножителях плутоний. Практически неисчерпаемы запасы термоядерного топлива - водорода, однако управляемые термоядерные реакции пока не освоены и неизвестно, когда они будут использованы для промышленного получения энергии в чистом виде, т.е. без участия в этом процессе реакторов деления. Остаются два пути: строгая экономия при расходовании энергоресурсов и использование нетрадиционных возобновляемых источников энергии.
Отчасти это связано с самими названиями. Если бы не звучное название “энтропия” осталась бы с момента первого рождения всего лишь “интегралом Клаузиуса”, вряд ли она бы не рождалась вновь и вновь в разных областях науки под одним именем. Кроме того, ее первооткрыватель Клаузиузус, первым же положил начало применению введенного им для, казалось бы узкоспециальных термодинамических целей понятия к глобальным космологическим проблемам (тепловая смерть Вселенной). С тех пор энтропия многократно фигурировала в оставшихся навсегда знаменитыми спорах. В настоящее время универсальный характер этого понятия общепризнан и она плодотворно используется во многих областях.
Энергия
Энергия (от греч. enйrgeia — действие, деятельность), общая количественная мера движения и взаимодействия всех видов материи. Вследствие существования закона сохранения энергии понятие энергии связывает воедино все явления природы. Энергия в природе не возникает из ничего и не исчезает; она только может переходить из одной формы в другую. В соответствии с различными формами движения материи рассматривают различные формы энергии: механическую, электромагнитную, ядерную и др. Это подразделение до известной степени условно. Так, химическая энергия складывается из кинетической энергии движения электронов и электрической энергии взаимодействия электронов друг с другом и с атомными ядрами. Внутренняя энергия равна сумме кинетической энергии хаотического движения молекул относительно центра масс тел и потенциальных энергии взаимодействия молекул друг с другом. Энергия системы однозначно зависит от параметров, характеризующих состояние системы. В случае непрерывной среды или поля вводятся понятия плотности энергии, т. е. энергия в единице объема, и плотности потока энергии, равной произведению плотности энергии на скорость ее перемещения.
В относительности теории показывается, что энергия тела Е неразрывно связана с его массой Т соотношением Е = Тс2, где с — скорость света в вакууме. Согласно классической физике, энергия любой системы меняется непрерывно и может принимать любые значения. Согласно квантовой теории, энергия микрочастиц, движение которых происходит в ограниченной области пространства (например, электронов в атомах), принимает дискретный ряд значений. Атомы излучают электромагнитную энергию в виде дискретных порций — световых квантов, или фотонов.
Энергия измеряется в тех же единицах, что и работа: в системе СГС — в эргах, в Международной системе единиц (СИ) — в джоулях; в атомной и ядерной физике и в физике элементарных частиц обычно применяется внесистемная единица — электрон-вольт. [1, 32-34]
Понятие энтропии. Статистический смысл понятия энтропии
Энтропия (от греч. entropia - поворот, превращение) - мера неупорядоченности больших систем. Впервые понятие "энтропия" введено в XIX в. в результате анализа работы тепловых машин, где энтропия характеризует ту часть энергии, которая рассеивается в пространстве, не совершая полезной работы (отсюда определение: энтропия - мера обесценивания энергии). Затем было установлено, что энтропия характеризует вероятность определенного состояния любой физической системы среди множества возможных ее состояний. В закрытых физических системах все самопроизвольные процессы направлены к достижению более вероятных состояний, т. е. к максимуму энтропии . В равновесном состоянии, когда этот максимум достигается, никакие направленные процессы невозможны. Отсюда возникла гипотеза о тепловой смерти Вселенной. Однако распространение на всю Вселенную законов, установленных для закрытых систем, не имеет убедительных научных оснований. В XX в. понятие " энтропия " оказалось плодотворным для исследования биосистем, а также процессов передачи и обработки информации. Эволюция в целом и развитие каждого организма происходит благодаря тому, что биосистемы, будучи открытыми, питаются энергией из окружающего мира. Но при этом биопроцессы протекают таким образом, что связанные с ними "производство энтропии " минимально. Это служит важным руководящим принципом и при разработке современных технологических процессов, при проектировании технических систем. Количественная мера информации формально совпадает с "отрицательно определенной " энтропией. Но глубокое понимание соответствия энтропии физической и информационной остается одной из кардинальных недостаточно исследованных проблем современной науки. Ее решение послужит одним из важных факторов становления нового научно-технического мышления.[2, 48-49]
Энтропия широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; в теории информации как мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Эти трактовки имеют глубокую внутреннюю связь. Например, на основе представлений об информационной энтропии можно вывести все важнейшие положения статистической физики.
Понятие энтропия, как показал впервые энтропию Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии, и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
Энтропия, характеризуя вероятность осуществления данного состояния системы, согласно (1) является мерой его неупорядоченности. Изменение энтропии DS обусловлено как изменением р, V и Т, так и процессами, протекающими при р, Т = const и связанными с превращением веществ, включая изменение их агрегатного состояния, растворение и химическое взаимодействие.
Изотермическое сжатие вещества приводит к уменьшению, а изотермическое расширение и нагревание - к увеличению его Энтропия, что соответствует уравнениям, вытекающим из первого и второго начал термодинамики:
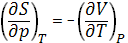 (1); (1);
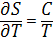 (3) (3)
В соответствии с (3) энтропия измеряется в кал/(моль· К) (энтропийная единица - э. е.) и дж/(моль·К). При расчётах обычно применяют значения Энтропия в стандартном состоянии, чаще всего при 298,15 К (25 °С), т. е. S0298.
Энтропия увеличивается при переходе вещества в состояние с большей энергией. в S сублимации > DS парообразования >> DS плавления >DS полиморфного превращения. Например, энтропия воды в кристаллическом состоянии равна 11,5, в жидком - 16,75, в газообразном - 45,11 э. е.
Чем выше твёрдость вещества, тем меньше его энтропия; так, энтропия алмаза (0,57 э. е.) вдвое меньше энтропии графита (1,37 э. е.). Карбиды, бориды и другие очень твёрдые вещества характеризуются небольшой Энтропия аморфного тела несколько больше энтропии кристаллического. Возрастание степени дисперсности системы также приводит к некоторому увеличению её энтропии.
Энтропия возрастает по мере усложнения молекулы вещества; так, для газов N2О, N2O3 и N2O5 Энтропия составляет соответственно 52,6; 73,4 и 85,0 э. е. При одной и той же молекулярной массе энтропия разветвленных углеводородов меньше энтропии неразветвлённых; энтропия циклоалкана (циклана) меньше энтропии соответствующего ему алкена.
Энтропия простых веществ и соединений (например, хлоридов ACIn), а также её изменения при плавлении и парообразовании являются периодическими функциями порядкового номера соответствующего элемента. Периодичность изменения энтропии для сходных химических реакций типа 1/n Акрист + 1/2Сl2газ = 1/n ACln крист практически не проявляется. В совокупности веществ-аналогов, например АСl4газ (А - С, Si, Ge, Sn, Pb) энтропия изменяется закономерно. Сходство веществ (N2 и СО; CdCl2 и ZnCl2; Ag2Se и Ag2Te; ВаСОз и BaSiO3; PbWO4 и РЬМоО4) проявляется в близости их энтропии. Выявление закономерности изменения энтропии в рядах подобных веществ, обусловленного различиями в их строении и составе, позволило разработать методы приближённого расчёта энтропии.
Знак изменения энтропии при химической реакции DS х. р. определяется знаком изменения объёма системы DV х. р.; однако возможны процессы (изомеризация, циклизация), в которых DS х. р. № 0, хотя DV х. р. » 0. В соответствии с уравнением DG = DН - ТDS (G - гиббсова энергия, Н - энтальпия) знак и абсолютное значение DS х. р. важны для суждения о влиянии температуры на равновесие химическое. Возможны самопроизвольные экзотермические. процессы (DG < 0, DH < 0), протекающие с уменьшением энтропии (DS < 0). Такие процессы распространены, в частности, при растворении (например, комплексообразование), что свидетельствует о важности химических взаимодействий между участвующими в них веществами.[3, 157-163]
Термодинамика и энтропия.
Так, для термодинамической системы, совершающей квазистатический (бесконечно медленно) циклический процесс, в котором система последовательно получает малые количества теплоты dQ при соответствующих значениях абсолютной температуры Т, интеграл от «приведенного» количества теплоты dQ/ Т по всему циклу равен нулю
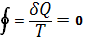 т.н. равенство Клаузиуса т.н. равенство Клаузиуса
Это равенство, эквивалентное второму началу термодинамики для равновесных процессов, Клаузиус получил, рассматривая произвольный циклический процесс как сумму очень большого, в пределе бесконечного, числа элементарных обратимых Карно циклов. Математически равенство Клаузиуса необходимо и достаточно для того, чтобы выражение
dS = dQ/T (1)
представляло собой полный дифференциал функции состояния S, названное «энтропия» (дифференциальное определение энтропии). Разность энтропии системы в двух произвольных состояниях А и В (заданных, например, значениями температур и объемов) равна
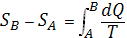 (2) (2)
(интегральное определение энтропии). Интегрирование здесь ведется вдоль пути любого квазистатического процесса, связывающего состояния А и В, при этом, согласно равенству Клаузиуса, приращение энтропии DS = SB - SA не зависит от пути интегрирования.
Т. о., из второго начала термодинамики следует, что существует однозначная функция состояния S, которая при квазистатических адиабатных процессах (dQ = 0) остаётся постоянной. Процессы, в которых энтропия остаётся постоянной, называются изоэнтропийными. Примером может служить процесс, широко используемый для получения низких температур, - адиабатное размагничивание. При изотермических процессах изменение энтропии равно отношению сообщенной системе теплоты к абсолютной температуре. Например, изменение энтропии при испарении жидкости равно отношению теплоты испарения к температуре испарения при условии равновесия жидкости с её насыщенным паром.
Согласно первому началу термодинамики (закону сохранения энергии), dQ = dU+pdV, т. е. сообщаемое системе количество теплоты равно сумме приращения внутренней энергии dU и совершаемой системой работы pdV, где р - давление, V - объём системы. С учётом первого начала термодинамики дифференциальное определение энтропии принимает вид
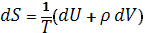 (3) (3)
откуда следует, что при выборе в качестве независимых переменных внутренней энергии U и объёма V частные производные Энтропия связаны с абсолютной температурой и давлением соотношениями:
 (4) и (4) и  (5) (5)
Эти выражения представляют собой уравнения состояния системы (первое - калорическое, второе - термическое). Уравнение (4) лежит в основе определения абсолютной температуры.
Формула (2) определяет энтропию лишь с точностью до аддитивной постоянной (т. е. оставляет начало отсчёта энтропии произвольным). Абсолютное значение энтропии позволяет установить третье начало термодинамики, или Нернста теорему: при стремлении абсолютной температуры к нулю разность DS для любого вещества стремится к нулю независимо от внешних параметров. Поэтому: энтропия всех веществ при абсолютном нуле температуры можно принять равной нулю (эту формулировку теоремы Нернста предложил в 1911 М. Планк). Основываясь на ней, за начальную точку отсчёта энтропии принимают 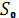 = 0 при Т = 0. = 0 при Т = 0.
Важность понятия энтропии для анализа необратимых (неравновесных) процессов: также была показана впервые Клаузиусом. Для необратимых процессов интеграл от приведённой теплоты dQ / Т по замкнутому пути всегда отрицателен
(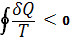 , т. н. неравенство Клаузиуса). , т. н. неравенство Клаузиуса).
Это неравенство - следствие теоремы Карно: кпд частично или полностью необратимого циклического процесса всегда меньше, чем кпд обратимого цикла. Из неравенства Клаузиуса вытекает, что
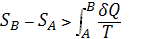 6) 6)
поэтому энтропия адиабатически изолированной системы при необратимых процессах может только возрастать.
Т. о., энтропия определяет характер процессов в адиабатической системе: возможны только такие процессы, при которых энтропия либо остаётся неизменной (обратимые процессы), либо возрастает (необратимые процессы). При этом не обязательно, чтобы возрастала энтропия каждого из тел, участвующего в процессе. Увеличивается общая сумма энтропии тел, в которых процесс вызвал изменения.
Термодинамика неравновесных процессов и энтропия
Термодинамика неравновесных процессов, раздел физики, изучающий неравновесные процессы (диффузию, вязкость, термоэлектрические явления и др.) на основе общих законов термодинамики. Для количественного изучения неравновесных процессов, в частности определения их скоростей в зависимости от внешних условий, составляются уравнения баланса массы, импульса, энергии, а также энтропии для элементарных объемов системы, и эти уравнения исследуются совместно с уравнениями рассматриваемых процессов. Термодинамика неравновесных процессов — теоретическая основа исследования открытых систем, в т. ч. живых существ.
Термодинамическому равновесию адиабатической системы соответствует состояние с максимумом энтропии может иметь не один, а несколько максимумов, при этом система будет иметь несколько состояний равновесия. Равновесие, которому соответствует наибольший максимум энтропии, называется абсолютно устойчивым (стабильным). Из условия максимальности энтропии адиабатические системы в состоянии равновесия вытекает важное следствие: температура всех частей системы в состоянии равновесия одинакова.
Понятие «Энтропия» применимо и к термодинамически неравновесным состояниям, если отклонения от термодинамического равновесия невелики и можно ввести представление о локальном термодинамическом равновесии в малых, но ещё макроскопических объёмах. Такие состояния можно охарактеризовать термодинамическими параметрами (температурой, давлением и т. д.), слабо зависящими от пространственных координат и времени, а энтропия термодинамически неравновесного состояния определить как энтропию равновесного состояния, характеризующегося теми же значениями параметров. В целом энтропия неравновесной системы равна сумме энтропии её частей, находящихся в локальном равновесии.
Термодинамика неравновесных процессов позволяет более детально, чем классическая термодинамика, исследовать процесс возрастания энтропии и вычислить количество энтропии, образующейся в единице объёма в единицу времени вследствие отклонения системы от термодинамического равновесия - производство энтропии. Производство энтропии всегда положительно и математически выражается квадратичной формой от градиентов термодинамических параметров (температуры, гидродинамической скорости или концентраций компонентов смеси) с коэффициентами, называемыми кинетическими (см. Онсагера теорема).
Статистическая физика связывает энтропию с вероятностью осуществления данного макроскопического состояния системы. Энтропия определяется через логарифм статистического веса W данного равновесного состояния
S= k ln W (E, N), (7)
где k - Больцмана постоянная, W (E, N) - число квантовомеханических уровней в узком интервале энергии DЕ вблизи значения энергии Е системы из N частиц. Впервые связь энтропии с вероятностью состояния системы была установлена Л. Больцманом в 1872: возрастание энтропии системы обусловлено её переходом из менее вероятного состояния в более вероятное. Иными словами, эволюция замкнутой системы осуществляется в направлении наиболее вероятного распределения энергии по отдельным подсистемам. [4, 147]
В отличие от термодинамики статистическая физика рассматривает особый класс процессов - флуктуации, при которых система переходит из более вероятного состояния в менее вероятное, и её энтропия уменьшается. Наличие флуктуаций показывает, что закон возрастания энтропии выполняется только в среднем для достаточно большого промежутка времени.
Энтропия в статистической физике тесно связана с информационной энтропией, которая служит мерой неопределённости сообщений данного источника (сообщения описываются множеством величин х1, x2,..., xn, которые могут быть, например, словами какого-либо языка, и соответствующих вероятностей p1, p2,..., pn появления величин x1, x2,..., xn в сообщении). Для определённого (дискретного) статистического распределения вероятностей рк информационной энтропией называют величину
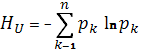
при условии
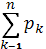 (8) (8)
Значение Ни равно нулю, если какое-либо из pk равно 1, а остальные - нулю, т. е. неопределённость в информации отсутствует. Энтропия принимает наибольшее значение, когда pk равны между собой и неопределённость в информации максимальна. Информационная энтропия, как и термодинамическая, обладает свойством аддитивности (энтропия нескольких сообщений равна сумме энтропии отдельных сообщений). К. Шеннон показал, что энтропия источника информации определяет критическое значение скорости «помехоустойчивой» передачи информации по конкретному каналу связи. Из вероятностной трактовки информационной энтропии могут быть выведены основные распределения статистической физики: каноническое распределение Гиббса, которое соответствует максимальному значению информационной энтропии при заданной средней энергии, и большое каноническое распределение Гиббса - при заданных средней энергии и числа частиц в системе. [3, 214]
Энергетика
Энергетика:
1) энергетическая наука — наука о закономерностях процессов и явлений, прямо или косвенно связанных с получением, преобразованием, передачей, распределением и использованием различных видов энергии, о совершенствовании методов прогнозирования и эксплуатации энергетических систем, повышении кпд энергетических установок и уменьшении их экологического влияния на природу.
2) Энергосистема — топливно-энергетический комплекс страны, область народного хозяйства, охватывающая энергетические ресурсы, выработку, преобразование, передачу и использование различных видов энергии. Ведущая область энергетики — электроэнергетика. В энергосистему входят системы электроэнергетические, снабжения различными видами топлива (продукцией нефтедобывающей, газовой, угольной, торфяной и сланцевой промышленности), ядерной энергетики, обычно объединяемые в масштабах страны в Единую энергетическую систему.[7, 90]
Энергетика включает в себя ряд отраслей:
электроэнергетика;
тепловая электроэнергетика;
ядерная энергетика;
гидроэлектроэнергетика;
теплоэнергетика;
добыча, переработка энергоресурсов;
газовая промышленность;
угольная промышленность;
нефтяная промышленность.
Электроэнергетика
Электроэнергетика
— ведущая составляющая часть энергетики, обеспечивающая электрификацию хозяйства страны на основе рационального производства и распределения электроэнергии. Электроэнергетика имеет важное значение в хозяйстве любой промышленно развитой страны, что объясняется такими преимуществами электроэнергии перед энергией других видов, как относительная лёгкость передачи на большие расстояния, распределения между потребителями, а также преобразования в другие виды энергии (механическую, тепловую, химическую, световую и др.). Отличительной чертой электроэнергии является одновременность её генерирования и потребления.[6, 63]
Основная часть электроэнергии вырабатывается крупными электростанциями:
тепловыми (ТЭС):
конденсационными (КЭС),
теплофикационными (ТЭЦ),
атомными (АЭС);
гидравлическими (ГЭС):
гидравлическими (ГЭС),
гидроаккумулирующими (ГАЭС).
Совокупность электростанций, электрических и тепловых сетей, соединенных между собой и связанных общностью режима в непрерывном процессе производства, преобразования и распределения электрической и тепловой энергии при общем управлении этим режимом образует энергетическую систему. Совокупность электрического оборудования объектов энергосистемы называется электрической частью энергосистемы.
В электроэнергетике рассматриваются процессы генерации, передачи, распределения электроэнергии и потребления электроэнергии.
Теплоэнергетика
Теплоэнергетика, отрасль энергетики, занимающаяся преобразованием теплоты в др. виды энергии, главным образом в механическую и электрическую. Для генерирования механической энергии за счёт теплоты служат теплосиловые установки; полученная в этих установках механическая энергия используется для привода рабочих машин (металлообрабатывающих станков, автомобилей, конвейеров и т. д.) или электромеханических генераторов, с помощью которых вырабатывается электроэнергия. Установки, в которых преобразование теплоты в электроэнергию осуществляется без электромеханических генераторов, называются установками прямого преобразования энергии. К ним относят магнитогидродинамические генераторы, термоэлектрические генераторы, термоэмиссионные преобразователи энергии. [6, 94]
Ядерная энергетика
Ядерная энергетика, отрасль энергетики, использующая ядерную энергию (атомную энергию) в целях электрификации и теплофикации; область науки и техники, разрабатывающая и использующая на практике методы и средства преобразования ядерной энергии в тепловую и электрическую. Основу Ядерная энергетика составляют атомные электростанции (АЭС). Источником энергии на АЭС служит ядерный реактор, в котором протекает управляемая цепная реакция деления ядер тяжёлых элементов, преимущественно 235U и 239Pu. При делении ядер урана и плутония выделяется тепловая энергия, которая преобразуется затем в электрическую так же, как на обычных тепловых электростанциях. При истощении запасов органического топлива (угля, нефти, газа, торфа) использование ядерного топлива - пока единственно реальный путь надёжного обеспечения человечества необходимой ему энергией. Рост потребления и производства электроэнергии приводит к тому, что в некоторых странах мира уже ощущается нехватка органического топлива и всё большее число развитых стран начинает зависеть от импорта энергоресурсов. Истощение или недостаток топливных энергоресурсов, удорожание их добычи и транспортирования стали одними из причин так называемого «энергетического кризиса» 70-х гг. 20 в. Поэтому в ряде стран ведутся интенсивные работы по освоению новых высокоэффективных методов получения электроэнергии за счёт использования других источников, и в первую очередь ядерной энергии. [7, 56-57]
Гидроэнергетика
Гидроэнергетика
, раздел энергетики, связанный с использованием потенциальной энергии водных ресурсов.
Важной экономической особенностью гидроэнергетических ресурсов является их вечная возобновляемость, не требующая в дальнейшем дополнительных капиталовложений. Электроэнергия, вырабатываемая на ГЭС, в среднем почти в 4 раза дешевле электроэнергии, получаемой от тепловых электростанций. Поэтому использованию гидроэнергетических ресурсов придаётся особое значение при размещении электроёмких производств. Отсутствие необходимости в топливе и более простая технология выработки электроэнергии приводят к тому, что затраты труда на единицу мощности на ГЭС почти в 10 раз меньше, чем на тепловых электростанциях (с учётом добычи топлива и его транспортирования). Высокая производительность труда на ГЭС является одной из основных её экономических особенностей и имеет важнейшее значение при решении задач энергетического строительства в малообжитых и особенно в удалённых районах Севера страны.
ГЭС являются мобильными энергетическими установками, выгодно отличающимися от паротурбинных тепловых электростанций в области регулирования частоты, покрытия растущих пиковых нагрузок, маневрирования мощностью в период ночного снижения нагрузок и в роли аварийного резерва системы. Это особенно важно для энергосистем Европейской части СССР, где электропотребление в течение суток характеризуется большой неравномерностью. [7, 101-102]
Идеи И. Пригожина и их значение для современной науки
Пригожин Илья Романович (25 января 1917, Москва — 28 мая 2003, Брюссель), бельгийский физик и физико-химик русского происхождения, лауреат Нобелевской премии по химии 1977 «за работы по термодинамике необратимых процессов, особенно за теорию диссипативных структур». В Бельгию был привезен родителями из России в раннем детстве.
Яркий представитель брюссельской школы термодинамики необратимых процессов, основанной Теофилом де Донде, Пригожин со студенческих лет принял активное участие в создании термодинамики необратимых процессов. В 1947 он ввел понятие производства энтропии и по-новому сформулировал второе начало термодинамики, распространив его на так называемые открытые системы, обменивающиеся с внешней средой веществом и энергией. В 1947 показал, что в стационарном состоянии при фиксированных внешних параметрах скорость производства энтропии в термодинамической системе минимальна и что для необратимых процессов скорость производства энтропии в открытой системе стремится к минимуму. В 1959-69 г вывел соотношения взаимности Л. Онсагера из кинетических уравнений и термодинамические соотношения для неравновесного газа.
Основная масса его работ посвящена неравновесной термодинамике и статистической механике необратимых процессов. Одно из главных достижений заключалось в том, что было показано существование неравновесных термодинамических систем, которые при определённых условиях, поглощая массу и энергию из окружающего пространства, могут совершать качественный скачок к усложнению (Диссипативные структуры). Причём такой скачок не может быть предсказан, исходя из классических законов статистики. Такие системы позже были названы его именем. Расчёт таких систем стал возможен благодаря его работам, выполненным в 1947 году.
Доказал одну из основных теорем термодинамики неравновесных процессов о минимуме производства энтропии в открытой системе.
Пригожина теорема, доказанная И.Р. Пригожиным (1947) теорема термодинамики неравновесных процессов: при внешних условиях, препятствующих достижению системой равновесного состояния, стационарное состояние системы соответствует минимальному производству энтропии.
Принципы термодинамики были сформулированы в середине XIX в., после изобретения паровой машины, когда взаимодействие тепловой, электрической и механической работы привлекло к себе значительный интерес. Согласно одной из версий первого начала термодинамики, представляющего собой принцип сохранения энергии, в любой закрытой системе энергия не исчезает и не возникает, а переходит из одной формы в другую. Второе начало термодинамики (принцип энтропии) описывает тенденцию систем переходить из состояния большего к состоянию меньшего порядка. Энтропия - это мера беспорядочности, или разупорядоченности, системы. Чем больше разупорядоченность, тем выше энтропия. В XIX в. американский математик и физик Джозайя Уиллард Гиббс разработал теорию статистической термодинамики для обратимых систем в условии равновесия. Теофил де Дондер, профессор Пригожин в Свободном университете и основатель Брюссельской школы термодинамики, сформулировал теорию неравновесных необратимых систем.
Пригожина больше всего интересовали в термодинамике неравновесные специфически открытые системы, в которых либо материя, либо энергия, либо и то и другое обмениваются с внешней средой в реакциях. При этом количество материи и энергии либо количество материи или количество энергии со временем увеличивается или уменьшается. Чтобы объяснить поведение систем, далеких от равновесия, Пригожин сформулировал теорию диссипативных структур. Считая, что неравновесность может служить источником организации и порядка, он представил диссипативные структуры в терминах математической модели с зависимыми от времени нелинейными функциями, которые описывают способность систем обмениваться материей и энергией с внешней средой и спонтанно себя рестабилизировать. Ставший теперь классическим пример диссипативной структуры в физической химии известен как нестабильность Бенарда. Такая структура возникает, когда слои легкоподвижной жидкой среды подогреваются снизу. При достаточно высоких температурных градиентах тепло передается через эту среду, как обычно, и большое число молекул в жидкости образуют специфические геометрические формы, напоминающие живые клетки. [8]
Заключение
Неоспорима роль энергии в поддержании и дальнейшем развитии цивилизации. В современном обществе трудно найти хотя бы одну область человеческой деятельности, которая не требовала бы - прямо или косвенно - больше энергии, чем ее могут дать мускулы человека. В соответствии с различными формами движения материи рассматривают различные формы энергии: механическую, электромагнитную, ядерную и др. Это подразделение до известной степени условно. Так, химическая энергия складывается из кинетической энергии движения электронов и электрической энергии взаимодействия электронов друг с другом и с атомными ядрами.
Энтропия как физическая переменная первично возникла из задач описания тепловых процессов. Впоследствии она стала широко использоваться во всех областях науки. Понятие энтропия, как показал впервые энтропию Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии, и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
В современном мире все большее значение в управлении организацией отдается прогнозированию. Любая организация в процессе своей деятельности сталкивается с различными рисками, которые в большей или меньшей степени влияют на ее состояние. Многочисленны примеры ситуаций, связанных с социальными, технологическими, экономическими, политическими, экологическими и другими рисками. Именно в таких ситуациях обычно и необходимо прогнозирование. Известны различные виды критериев, используемых в теории принятия решений в условиях неопределенности (риска). Из-за противоречивости решений, получаемых по различным критериям, очевидна необходимость применения энтропии.
Яркий представитель брюссельской школы термодинамики необратимых процессов, основанной Теофилом де Донде, Пригожин со студенческих лет принял активное участие в создании термодинамики необратимых процессов. Одно из главных достижений заключалось в том, что было показано существование неравновесных термодинамических систем, которые при определённых условиях, поглощая массу и энергию из окружающего пространства, могут совершать качественный скачок к усложнению (Диссипативные структуры).
Список литературы
1. Аугуста Голдин. Океаны энергии. - Пер. с англ. - М.: Знание, 1998. - 144 с.
2. Баланчевадзе В. И., Барановский А. И. и др.; Под ред. А. Ф. Дьякова. Энергетика сегодня и завтра. - М.: Энергоатомиздат, 1999. - 344 с.
3. Юдасин Л. С.. Энергетика: проблемы и надежды. - М.: Просвещение, 2000. - 207с.
4. Шамбадаль П. Развитие и приложения понятия энтропии . М.: Наука, 2007 .
5. Поплавский Р.П. Депон Максвелла и соотношения между информацией и энтропией // УФН. 1999. Т. 128. Вып. 1
6. Кириллин В. А. Энергетика. Главные проблемы: В вопросах и ответах. - М.: Знание, 1990. - 128 с.
7. Энергетические ресурсы мира/ Под ред. П.С.Непорожнего, В.И. Попкова. - М.: Энергоатомиздат, 1995. - 232 с.
8. http://mirslovarei.com/content_fil/PRIGOZHIN-ILJA-ROMANOVICH-R-1917-15828.html
Приложение
Задача №1
Уклон участка дороги равен 1 м на 20 м пути. Спускаясь под уклон при выключенном двигателе, автомобиль движется равномерно со скорость 60 км/ч. Определите мощность двигателя автомобиля, поднимающего по этому уклону с той же скоростью. Масса автомобиля 1,5 т.
Дано:
h=1 м
S=20 м
V=60 км/ч=16,667м/с
m=1500 кг
Найти:
Р - ?
Решение:
Мощность определяем по формуле:
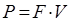
Так как скорость постоянная, то ускорение автомобиля равно 0. Тогда сила, действующая на автомобиль, будет равна:
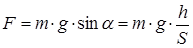
Получаем:
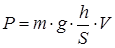

Ответ
: Р =12262,5 Вт
Задача №2
Вычислить давление 1 моль молекул газа, занимающего при температуре 300єК объем 1 л.
Дано:
Т=300 єК
V=1 л=0,001 м3
υ=1 моль
Найти:
Р - ?
Решение:
Используем формулу Клапейрона-Менделеева:

где - R=8,314 Дж/(моль*єК) – универсальная газовая постоянная.
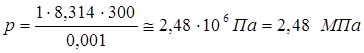
Ответ:
Р = 2,48 МПа.
Задача №3
Средняя кинетическая энергия поступательного движения молекул газа при температуре 5000єК равна 1,6∙10-23
Дж. Какова эта энергия при температуре -273єС и 1000єС?
Дано:
Т1
=5000єК
Е1
=1,6∙10-23
Дж
t2
=-273єС
t3
=1000єС
Найти:
Е2
, Е3
- ?
Решение:
Средняя кинетическая энергия поступательного движения N молекул газа определяется по формуле:

Так как для данного числа молекул газа N их энергия зависит только от температуры, то:
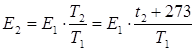
Получим:
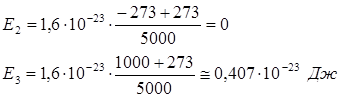
Ответ
: Е2
=0; Е3
=0,407∙10-23
Дж.
Задача №4.
Даны два шарика массой 1г. Какой заряд нужно сообщить каждому шарику, чтобы сила взаимного отталкивания снарядов на шариках уравновесила гравитационную притяжения шариков?
Дано:
m=0,001 кг
ε0
=8,85∙10-12
Ф/м
G=6,67∙10-11
Н∙м2
∙кг-2
Найти
:
q - ?
Решение:
Кулоновская сила электростатического притяжения зарядов определяется по формуле:
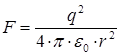
r – расстояние между шариками с зарядом q.
Гравитационная сила взаимодействия шариков определяется по формуле:
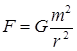
В состоянии равновесия получим:
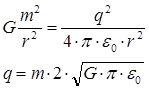
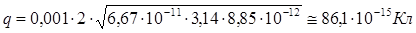
Ответ:
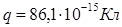 . .
Задача №5
Проводник длиной 0,1м находится в однородном магнитном поле с индукцией 20 мТл. Определить силу, действующую на проводник, если сила тока в нем 3А, а угол между направлением тока и магнитной индукцией 30є.
Дано:
l=0,1 м
I=3 А
B=20∙10-6
Тл
α=30є
Найти:
FА
- ?
Решение:
Сила Ампера, действующая на проводник, определяется по формуле:
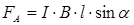
α – угол между векторами dl (направление тока) и В.
Получим:
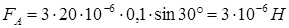
Ответ:
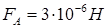 . .
Задача №6
Жесткость пружина рессоры вагона 481 кН/м. Масса вагона с грузом 64т. Вагон имеет четыре рессоры. При какой скорости вагон начнет сильно раскачиваться вследствие толчков на стыках рельс, если длина рельс 12,8м?
Дано:
k=481∙103
Н/м
m=64000 кг
l =12,8 м
Найти:
V - ?
Решение:
Рассмотри колебание рессор как колебания пружинного маятника, циклическая частота колебания которого равна для каждой рессоры:
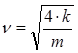
Тогда скорость, при которой вагон начнет сильно раскачиваться вследствие толчков на стыках рельс равна:
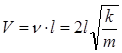
Получим:

Ответ: 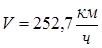 . .
Задача №7
На мыльную пленку (n=1,3) падает нормально пучок лучей белого света. Какова минимальная толщина пленки, если в отраженном свете она представляется красной (λ=7000Е)?
Дано:
n=1,3
λ=7000Е=7∙10-7 м
i=90є
Найти:
d - ?
Решение:
Минимальную толщину пленки определим из выражения:

Ответ: 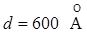 . .
Задача №8
Для улучшения цвета белья на фабриках-прачечных его обрабатывают 0,3-% раствором ультрамарина в воде. Рассчитать теоретический расход ультрамарина для обработки 1 т белья, если расход раствора 0,6 л на 1 кг белья.
Дано:
n=0,3%
Gр
=0,6 л/кг
M=1000 кг
Найти:
mультр
- ?
Решение:
Определим массу раствора, исходя из того, что плотность низконцентрированного раствора равна плотности воды ρ=1 кг/л:
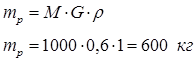
По заданной массовой концентрации n=0,03% получим теоретический массовый расход ультрамарина для обработки 1 т белья:
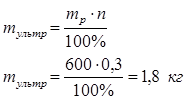
Ответ:
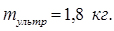
Задача №9
Вычислите эквивалент Н3
РО4
в реакциях с КОН при образовании следующих солей: КН2
РО4
, К2
НРО4
, К3
РО4
.
Решение
Запишем соответствующие реакции:
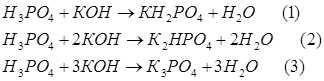
Эквиваленты Н3
РО4
определим по формуле:
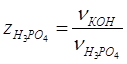
По стехиометрическим коэффициентам реакций получим:
для реакции (1): 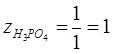 ; ;
для реакции (2): 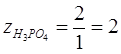 ; ;
для реакции (3): 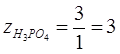 . .
Задача №10
Вычислите РН 0,35%-ного раствора NaOH, считая α=1 и ρ=1 г/мл.
Решение
Известно, что для комнатной температуры воды 22°С концентрация ионов водорода [H+
] равна 10-7
моль/л. При α=1 и ρ=1 г/мл и концентрации 0,35% концентрация ионов водорода составит 0,9965·10-7
моль/л. Тогда водородный показатель раствора будет равен:
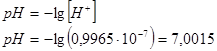
Так как концентрация раствора очень низкая, то показатель рН=7,0015 очень близок к нейтральному положению равному 7.
|