Реферат на тему
«Арены. Толуол.»
Выполнил
Проверила:
2002 г.
План:
| 1. Арены |
Стр. 3 |
| 2. Толуол – формула, строение. |
Стр. 4 |
| 3. Физические свойства. |
Стр. 5 |
| 4. Химические свойства |
Стр. 6 |
| 5. Получение |
Стр. 9 |
| 6. Применение |
Стр. 10 |
7. Список литературы
|
Стр. 11 |
1. Арены.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Общая формула класса: Cn
H2n-6
.Простейшими представителями класса являются бензол и толуол:
Многоядерные арены: нафталин С10
Н8
, антрацен С14
Н10
и др.Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp2
-гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит
4n+2
p-электронов (n
– целое число).
2. Толуол – формула, строение. Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH3
).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6
Н6
. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
 |
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами: Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2
- гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости. Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2
- гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая - ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
 |
 С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля
, в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом. С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля
, в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом.3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
| Название |
Формула |
t°.пл.,
°C |
t°.кип.,
°C |
d4
20
|
| Бензол |
C6
H6
|
+5,5 |
80,1 |
0,8790 |
| Толуол (метилбензол) |
С6
Н5
СH3
|
-95,0 |
110,6 |
0,8669 |
| Этилбензол |
С6
Н5
С2
H5
|
-95,0 |
136,2 |
0,8670 |
| Ксилол (диметилбензол) |
С6
Н4
(СH3
)2
|
| орто- |
-25,18 |
144,41 |
0,8802 |
| мета- |
-47,87 |
139,10 |
0,8642 |
| пара- |
13,26 |
138,35 |
0,8611 |
| Пропилбензол |
С6
Н5
(CH2
)2
CH3
|
-99,0 |
159,20 |
0,8610 |
| Кумол (изопропилбензол) |
C6
H5
CH(CH3
)2
|
-96,0 |
152,39 |
0,8618 |
| Стирол (винилбензол) |
С6
Н5
CH=СН2
|
-30,6 |
145,2 |
0,9060 |
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
 Реакции в ароматическом кольце.
Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола. Реакции в ароматическом кольце.
Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.
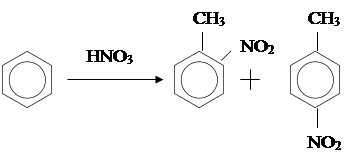
1) Нитрирование:
1-Метил-2-нитробензол 1-Метил-4-нитробензол
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи.
Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
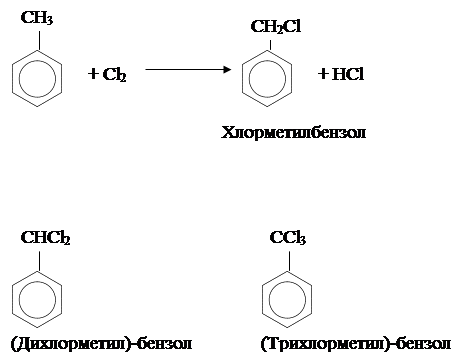 Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения. Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
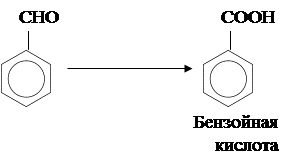
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
5. Получение.
Известны следующие способы получения ароматических углеводородов.
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
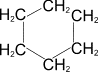
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
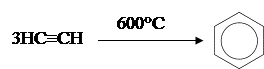 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский). 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
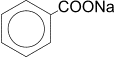
 4) Сплавление солей ароматических кислот со щелочью или натронной известью. 4) Сплавление солей ароматических кислот со щелочью или натронной известью.

6. Применение.
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Список литературы:
1. М. Фримантл – «Химия в действии»
2. CD-Informatica – «Химия для всех»
3. О.С. Габриелян – «Химия 10 класс»
4. Infinity – «Органическая химия: арены»
|