| Ульяновский Институт Повышения Квалификации и Переподготовки Работников Образования
Кафедра Естествознания
Реферат
слушателя курсов повышения
квалификации группы Х – 1
учителя химии
МОУ Большеключищенской средней школы
Ульяновского района
Ульяновской области
Петровой Марии Петровны
по теме: Подготовка к ЕГЭ по вопросу А25
Реакции ионного обмена
Научный руководитель: заведующий
кафедрой естествознания
кандидат химических наук, доцент
Ахметов М. А.
Ульяновск 2009
Содержание
Введение
. 3
Основные положения электролитической диссоциации.
6
Механизм электролитической диссоциации ионных веществ
. 6
Сила электролитов. 7
Механизм электролитической диссоциации полярных веществ
. 8
Сильные электролиты
.. 8
Слабые электролиты
.. 8
Неэлектролиты
.. 9
Условия протекания реакций ионного обмена до конца
. 11
Алгоритм составления ионных уравнений реакций
. 12
Тест 1
. 13
Ответы к тесту 1
. 16
Тест 2
. 17
Ответы к тесту 2
. 21
Список литературы
.. 23
Для формирования знаний о реакциях ионного обмена необходимо повторить опорные темы: «Кислоты, соли, основания», «Химические свойства классов неорганических соединений», «Растворение, растворы».
Изучение теории электролитической диссоциации позволяет углубить и расширить знания о реакции, дифференцировать особенности протекания обменных и окислительно-восстановительных реакций. Учащиеся приобретают умения составлять ионные и ионно-электронные уравнения реакций, распознавать реакции обмена электролитов. Особое внимание уделяется на проблемное изучение этих реакций, механизмов и закономерностей их протекания. В центре изучения реакций электролитов - обменные реакции.
Реакции ионного обмена являются еще более абстрактными по сравнению с привычными молекулярными. Вследствие этого путь их познания должен быть следующим: краткое ионное уравнение, полное ионное уравнение - уравнение в молекулярной форме - опыт.
Рассмотрим методы формирования знаний о реакциях ионного обмена в свете теории о кислотно- основных взаимодействиях.
Большинство реакций ионного обмена в водных растворах могут быть рассмотрены в свете представлений о кислотно-основных взаимодействиях.
С позиции протолитической теории кислоты представляют собой частицы (ионы, молекулы), способные отдавать протон (доноры протонов), а основания - частицы, способные присоединять протон (акцепторы протонов).
Для обучения школьников умению анализировать ход реакций необходимо применять наиболее понятные им эмпирические правила:
1. Реакции обмена в водных растворах протекают в направлении образования слабого электролита, нерастворимого или малорастворимого вещества, газообразного продукта.
2. Сильные кислоты вытесняют слабые из растворов из растворов солей. Более тяжелые и менее летучие кислоты вытесняют из растворов солей менее тяжелые и более летучие. Равновесие в этих случаях смещено в сторону образования боле слабой или более летучей кислоты.
3. Сильные основания вытесняют из растворов солей более слабые основания.
4. Сильные электролиты в разбавленных растворах имеют практически одинаковую степень диссоциации и диссоциируют необратимо. Средние и слабые отличаются степенью диссоциации и диссоциируют обратимо.
Реакции ионного обмена в водных средах, по сути, обратимы. Необходимое условие необратимости - удаление хотя бы одного из продуктов реакции. В случае, когда в состав исходных веществ и продуктов реакции входят слабые электролиты, реакции обмена всегда обратимы и можно говорить лишь о смещении равновесия в сторону более слабого электролита.
Растворы всех веществ можно разделить на две группы: электролиты
-проводят электрический ток, неэлектролиты
-проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2
SO4
и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl).
К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза.
Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении. Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.
Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус . Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности.
Уравнение диссоциации можно записать следующим образом:
| NaCl 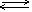 Na+
+ Cl- Na+
+ Cl-
|
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
| 1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией). Зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).a4. Степень электролитической диссоциации (a = n / N 0<a<1).
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Схема электролитической диссоциации.
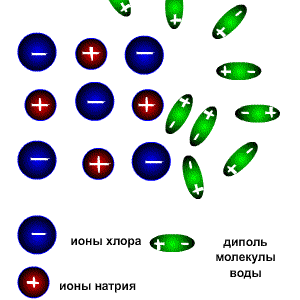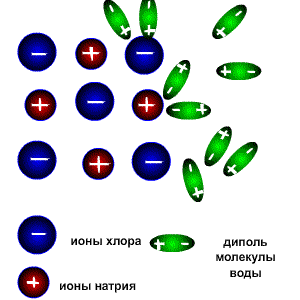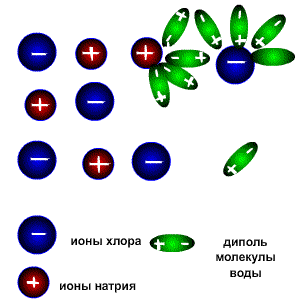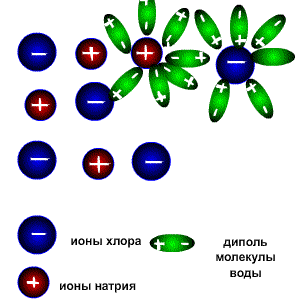
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Сила электролитов.
Силу электролитов можно охарактеризовать с помощью степени диссоциации.
Степень диссоциации электролита-это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор.
Степень диссоциации потенциальных электролитов изменяется в пределах 0< α ≤1( значение α=0 относится к неэлектролитам).
Степень диссоциации возрастает при увеличении разбавления раствора, а также при повышении температуры ( повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы.)
Сила электролитов в водном растворе определяется их степенью диссоциации при постоянной концентрации и температуре. К сильным электролитам относятся относятся вещества степень диссоциации которых близка к 1. К ним относятся хорошо растворимые щёлочи, соли, кислоты.
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4
, H2
SO4
,HNO3
) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2
,Sr(OH)2
,Ca(OH)2
). В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3
COOH, C2
H5
COOH и др.);
2) некоторые неорганические кислоты (H2
CO3
, H2
S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3
(PO4
)2
; Cu(OH)2
; Al(OH)3
; NH4
OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
СH3
COOH « CH3
COO-
+ H+
Cu(OH)2
« [CuOH]+
+ OH-
(первая ступень)
[CuOH]+
« Cu2+
+ OH-
(вторая ступень)
H2
CO3
« H+
+ HCO-
(первая ступень)
HCO3
-
« H+
+ CO3
2-
(вторая ступень)
Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Степень диссоциации. Константа диссоциации.
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита. Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
a = n / N
= 0,3 – условная граница деления на сильные и слабые электролиты (a выражается в долях единицы или в % )
Константа диссоциации (KD
) - отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул. Она является константой равновесия процесса электролитической диссоциации; характеризует способность вещества распадаться на ионы: чем выше KD
, тем больше концентрация ионов в растворе.
 Условия протекания реакций ионного обмена до конца
: Условия протекания реакций ионного обмена до конца
:
|
|
Алгоритм составления ионных уравнений реакций
.

l. Лампочка прибора для испытания веществ на электропроводность не загорится при погружении электродов в:
а) водный раствор щелочи;
б) расплав соли;
в) концентрированную кислоту;
г) дистиллированную воду.
2. Какой вклад в химическую науку сделал С. Арреннус:
а) сформулировал основные положения теории электролитической диссоциации;
б) выдвинул идею о гидратации ионов в растворе;
в) экспериментально определил размер некоторых ионов в растворе;
г) рассчитал степени диссоциации электролитов.
3. Какое утверждение неверно:
а) катионы движутся в растворе упорядоченно;
б) катионы заряжены положительно;
в) некоторые катионы окрашены;
г) некоторые катионы ядовиты.
4. Соединениям с какой связью соответствует последовательность процессов: ориентация молекул — гидратация — диссоциации:
а) с ковалентной полярной;
б) с ковалентной неполярной;
в) с ионной;
г) с металлической.
5. Степень диссоциации электролитов зависит:
а) от температуры;
б) от давления;
в) от гидратации;
г) от концентрации.
6. Что называется гидратацией:
а) процесс растворения вещества в воде;
б) реакция обмена, в которой участвует вода;
в) процесс взаимодействия атомов или ионов с молекулами воды;
г) процесс распада воды на ионы.
7. Какое число молекул воды имеют гидратированные ионы:
а) постоянное;
б) переменное;
в) постоянное или переменное;
г) вообще не имеют молекул воды.
8. Атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов превращаются в ионы. Какой заряд могут иметь эти ионы:
а) положительный или отрицательный;
б) только отрицательный;
в) только положительный;
г) не имеют заряда.
9. К какому полюсу источника тока двигаются отрицательно заряженные ионы:
а) к катиону;
б) к аноду;
в) к катоду;
г) к аниону.
10). Какие ионы определяют общие свойства кислот:
а) анионы кислорода;
б) катионы водорода;
в) анионы кислотного остатка;
г) ионы не влияют на общие свойства кислот.
11. Как называется электролит NH4
NO3
(NH4
+
+ NO3
-
):
а) кислота;
б) основание;
г) оксид;
в) соль.
12. Какие ионы не могут находиться в растворе одновременно:
а) H+
и СО3
2-
;
б) Ва2+
и ОН-
;
в) Н+
и N03
-
;
г) Na+
и SO4
2-
. .
13. Процесс диссоциации сульфата магния можно выразить уравнением:
  а) MgSO4
Mg+2
+ SO4
-2
; а) MgSO4
Mg+2
+ SO4
-2
;
  б)MgSO4
Mg2+
+ SO4
2-; б)MgSO4
Mg2+
+ SO4
2-;
  в) MgSО4
Mg+2
+ 4SO2-
; в) MgSО4
Mg+2
+ 4SO2-
;
  г) MgSO4
Mg+2
+ SO4
-1
. г) MgSO4
Mg+2
+ SO4
-1
.
14. Какая из данных кислот является летучей:
а) серная;
б) кремниевая;
в) соляная;
г) ортофосфорная.
15. Какая из данных кислот является нестабильной:
а) серная;
б) ортофосфорная;
в) кремниевая;
г) угольная.
16. Какая формула отражает состав кислой соли:
а) CuSO4
;
б) Mg(HSO4
)2
;
в) (CuOH)2
CO;
г) АlOНС12
.
l 7. Назовите тип соли NaHCO3
:
а) средняя;
б) основная;
в) кислая;
г) незамещенная.
18. При диссоциации вещества в водном растворе образовались ионы Na+
, Н+
и SO4
2-
. Это вещество:
а) средняя соль;
б) кислота;
в) основание;
г) кислая соль.
19. Какой ученый, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при этом водород, так же как и некоторые другие металлы, вытесняет ртуть и cеребро из их солей:
а) В.Нернст;
б) И. А. Каблуков;
в) В.А. Кистяковский;
г) Н.Н.Бекетов.
20. При диссоциации какого вещества образуется больше всего
видов ионов:
а) хлорид кальция;
б) соляная кислота;
в) сульфат алюминия;
г) угольная кислота.
21.Наличие в растворе ионов ... определяет малиновую окраску
индикатора фенолфталеина.
22.При комнатной температуре из 150 молекул электролита на ионы
распались 90. Степень электролитической диссоциации равна ... %.
23.Сила электролита зависит от … .
Ответы к тесту 1
:
1 г;
2 а;
3 г;
4 в;
5 г;
6 в;
7 б;
8 а;
9 б;
10 б;
11 г;
12 а;
13 б;
14 в;
15 г;
16 б;
17 в;
18 г;
19 г;
20 в;
21 Наличие в растворе ионов гидроксогруппы
OH
-
определяет малиновую окраску индикатора фенолфталеина;
22 При комнатной температуре из 150 молекул электролита на ионы распалось 90. Степень электролитической диссоциации равна 60%. Решение:
α = 90/150 = 0,6 (или 60%);
23 Сила электролита зависит от степени электролитической диссоциации.
1. Растворы каких веществ реагируют между собой с образованием воды:
а) гидроксид натрия и нитрат калия;
б) карбонат натрия и азотная кислота;
в) нитрат меди(II) и гидроксид натрия;
г) гидроксид кальция и азотная кислота.
2. Сокращенное ионное уравнение
2Н+
+ СО3
2-
= Н2
О + СО2
соответствует реакции между:
а) газообразными водородом и угольной кислотой;
б) карбонатом кальция и серной кислотой;
в) карбонатом калия и серной кислотой;
г) растворами угольной и серной кислот.
3. Если к раствору сульфата алюминия прилить раствор щелочи, то образуется:
а) желтый осадок;
б) осадка не образуется;
в) белый осадок;
г) розовый осадок.
 4. Сокращенное ионное уравнение Zn2+
+ S2-
= ZnS2-
соответствует реакции между: 4. Сокращенное ионное уравнение Zn2+
+ S2-
= ZnS2-
соответствует реакции между:
а) карбонатом цинка и раствором серной кислоты;
б) хлоридом цинка и раствором сульфида натрия;
в) гидроксидом цинка и сероводородной кислотой;
г) гидроксидом цинка и газообразным сероводородом.
5. Реакцию нейтрализации можно отнести:
а) к реакциям обмена;
б) к реакциям отщепления;
в) к реакциям присоединения;
г) к реакциям замещения.
6. При взаимодействии азотной кислоты с гидроксидом кадий образуются:
а) соль и вода;
б) соль и водород;
в) соль и углекислый газ;
г) новая кислота и новая соль.
7. С каким металлом концентрированная серная кислота не взаимодействует:
а) с цинком;
б) с медью;
в) с кальцием;
г) с железом;
8. Какой цвет имеет раствор хлорида кобальта (П):
а) голубой;
б) зеленый;
в) белый;
г) красно-бурый.
9. В результате взаимодействия образца природного мрамора с раствором соляной кислоты образуется:
а) газ;
б) вода;
в) осадок;
г) вещества друг с другом не взаимодействуют.
10. Составьте полное и сокращенное ионное уравнения реакции между гидроксидом кальция и соляной кислотой. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях соответственно равны:
а) 8 и 6;
б) 10 и 6;
в) 12 и 6;
г) 12 и 3.
11. Вычислите количество вещества, выпадающего в осадок при сливании раствора, содержащего 0,2 моль сульфата меди (II), и раствора, содержащего 0,3 моль гидроксида калия:
а) 0,1 моль;
б) 0,15 моль;
в) 0,2 моль;
г) 0,3 моль.
12. Определите степень окисления хлора в хлорноватистой кислоте НСlO:
а) +1;
б) +2;
в) +3;
г) +4.
13. Атомарный кислород в реакции горения выступает в качестве:
а) как окислителя, так и восстановителя;
б) восстановителя;
в) окислителя;
г) правильного ответа нет.
14. Чему будет равна степень окисления меди в ее хлориде (П)?
ЗСuС12
+ 2А1 = 2А1С13
+ 3Cu
а) +3;
б) +1;
в) 0;
г) +2.
15. Как изменится степень окисления азота в результате данной реакции?
10 HNO3
+ 8Na = 8NaNO3
+ NH4
NO3
+ 3H2
O
а) с 0 до +5;
б) с +5 до +2;
в) с +2 до 0;
г) с +5 до -3.
16. Расставьте коэффициенты в схеме реакции:
 H2
S + HNO3
S + NO + Н2
О H2
S + HNO3
S + NO + Н2
О
Коэффициент перед формулой восстановителя равен:
а) 3;
б) 4;
в) 2;
г) 1.
17. Математической характеристикой среды является:
а) константа диссоциации;
б) водородный показатель;
в) гидроксидный показатель;
г) молярная концентрация.
18. Значение водородного показателя рН в чистой воде:
а) = 7;
б) < 7;
в) > 7;
г) = -7.
19. Гидролиз по аниону характеризует соли:
а) образованные сильной кислотой и сильным основанием;
б)образованные сильной кислотой и слабым основанием;
в)образованные слабой кислотой и сильным основанием;
г) образованные слабой кислотой и слабым основанием.
20. Какую среду будет иметь раствор цианистого калия:
а) рН = 7;
б) рН < 7;
в)рН>7;
г)рН = -7.
21.Амфотерность гидроксида цинка можно доказать с помощью
раствора ... и ....
22.Электролитическая диссоциация в спирте и воде будет ...
23.Соль образована слабой кислотой и слабым основанием, среда
раствора ...
Ответы к тесту 2
:
1 г
2 в
3 в
4 б
5 а
6 а
7 г
8 б
9 а
10 г
11 в
12 а
13 в
14 г
15 г
16 а
17 б
18 а
19 в
20 в
21 Амфотерность гидроксида цинка можно доказать с помощью раствора кислоты
и щелочи
;
22 Электролитическая диссоциация в спирте и воде будет отсутствовать
23 Соль образована слабой кислотой и слабым основанием, среда раствора определяется соотношением величин констант диссоциации продуктов гидролиза
.
1. Габриелян О. С., Остроумов И. Г.
Химия. 10 класс: Методическое пособие. - М: Дрофа, 2001. - 160 с.
2. Габриелян О. С., Лысова Г. Г.
Химия. 11 класс: Учебник для общеобразовательных учреждений. - М: Дрофа, 2001. - 368 с.: ил.
3. Габриелян О. С., Решетов П. В., Остроумов И. Г. и др.
Готовимся к единому государственному экзамену: Химия/ – М.: Дрофа, 2003. – 136 с.
4. Гара Н. Н., Зуева М. Ю.
Химия. Задачи и упражнения. 8 - 9 кл.: Учебное пособие для общеобразовательных учреждений. - М: Дрофа, 2002. - 224 с.: ил.
5. Единый государственный экзамен.
2001.: Тестовые задания: Химия. / М. Г. Минин, Н. С. Михайлова, В. Ф. Гридаев и другие; Министерство образования РФ. - М: Просвещение, 2001. - 47 с.: ил.
6. Зуева М. В., Гара Н. Н.
Контрольные и проверочные работы по химии. 8 - 9 класс. Методическое пособие. - 5 - е изд., перераб. и доп. - М: Дрофа, 2002. - 224 с.: ил.
7. Суровцева Р. П., Гузей Л. С.
Химия. 8 - 9 кл.: Контрольные работы к учебникам Л. С. Гузея, В. В. Сорокина, Р. П. Суровцевой " Химия 8 " и " Химия 9 ". - М: Дрофа, 2001. - 192 с.
8. Тесты по химии. 10 - 11 классы.:
Учебно - Методическое пособие. / Р. П. Суровцева, Л. С. Гузей, Н. И. Останий, А. О. Татур. - 5 - е изд., стереотип. - М.: Дрофа, 2001. - 112 с.
9. Химия. 10 класс
: Учебник для общеобразовательных учреждений. / О. С. Габриелян, Ф. Н. Маскакев, С. Ю. Пономарёв, В. И. Теренин; Под ред. В. И. Теренина. - 2 - е изд., перераб. и доп. - М: Дрофа, 2001. - 304 с.: ил.
10. Химия:
Большой справочник для школьников и поступаюдщих в вузы/ Е. А. Алферова, Н. С. Ахметов, Н. В. Богомалова и др. - 2-е изд. - М.: Дрофа, 1999. - 784 с.
11. Хомченко Г. П.
Химия (для подготовительных отделений). Учебник. - 3-е изд., испр. - М.: Высш. шк., 1993. - 368 с., ил.
12. Хомченко Г. П., Хомченко И. Г.
Задачи по химии для поступающих в вузы: Учеб. пособие. - 2-е изд., исправ. и доп. - М.: Высш. шк., 1993. - 302 с.
|