Реферат: Методические материалы к программе дисциплины химия
|
Название: Методические материалы к программе дисциплины химия Раздел: Остальные рефераты Тип: реферат |
| МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ К ПРОГРАММЕ
Дисциплины ХИМИЯ ____________________________________________________________________ Для студентов специальностей 022300 «Физическая культура и спорт» и 022500 «Физическая культура для лиц с отклонениями в состоянии здоровья (Адаптивная физическая культура)»
1. Цель и задачи дисциплины Основной целью курса является формирование теоретической базы для освоения биохимии, нормальной физиологии, а также формирование общекультурной компоненты в области естественных наук. Задачи дисциплины: формирование у студентов современных представлений о строении и свойствах химических веществ, закономерностях протекания химических процессов, освоение на этой основе определенных биохимических знаний, развитие химического и биохимического мышления. 2. Место дисциплины в учебном процессе и требования к знаниям и умениям специалиста. После изучения курса химии студенты должны иметь представление о возможности применения фундаментальных законов химии для объяснения свойств и поведения сложных многоатомных систем, включая биологические объекты; свойствах атомов, ядер атомов и элементарных частиц; химических методах исследования; современных достижениях в области естественных наук; знать и уметь использовать полученные знания о химических системах: дисперсных, растворах, электрохимических, каталитических; реакционной способности веществ; методах химической идентификации веществ; энергетике и кинетике химических процессов; основах органической химии, свойствах полимеров и биополимеров. 3. Содержание дисциплины Введение. Цели и задачи химии, важность химических знаний в освоении профессии и общекультурного уровня специалиста. Классификация химических соединений . Органические, неорганические, координационные соединения. Правила химической номенклатуры. Теория строения атомов и молекул. Реакционная способность веществ . Периодический закон и периодическая система элементов. Взаимосвязь структуры и реакционной способности молекул. Кислотно-основные и окислительно-восстановительные свойства веществ. Химическая связь. Комплементарность. Важнейшие реакции и их механизмы, реакции качественного анализа, химический, физико-химический и физический анализ, важнейшие кинетические закономерности. Химические системы. Характеристика систем. Понятие дисперсности, фазы, фазового равновесия и фазового перехода. Дисперсные системы. Теория растворов. Основы теории электролитической диссоциации и протолитической теории. Кислотно-основное титрование, рН растворов, буферные растворы, основы количественного анализа. Электрохимические системы. Катализаторы и каталитические системы. Полимеры и олигомеры. Химическая термодинамика и кинетика. Энергетика химических процессов, законы термодинамики, термохимии, аналитические зависимости между термодинамическими потенциалами, химическое и фазовое равновесие, скорость реакции и методы ее регулирования, колебательные реакции. Химия биологически активных молекул . Аминокислоты. Пептиды. Белки. Моно-, ди- и полисахариды, липиды и нуклеиновые кислоты. Номенклатура. Биологическая роль и основные химические свойства. 4. Рекомендуемая литература а) основная литература 1. Общая химия. Биофизическая химия. Химия биогенных элементов. / Под ред. Ершова Ю.А. - М.:Высшая школа,1993, - 560с. 2. Слесарев В.И. Химия: Основы химии живого. - СПб.: Химиздат, 2000, - 768 с. б) дополнительная литература 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия: учебник для студ. мед. ин-тов. - М.: Медицина, 1985, - 480с. 2. Ушкалова В.Н., Кадочникова Г.Д., Петрова Ю.Ю., Маркова С.В.. Химия. Практикум. Учебное пособие. - Сургут. Издательство Сургутского университета, 2000, - 250 с. 3. Ушкалова В.Н. Химия. Часть 1. Общие вопросы неорганической, органической и физической химии. Учебное пособие. - Тюмень, 1995, - 477 с. 4. Ушкалова В.Н. Часть 2. Химия компонентов клетки. Учебное пособие. -Тюмень, 1996, - 220с. 5. Вопросы к зачету 1. Классификация и номенклатура неорганических соединений: бинарные соединения, кислоты, основания и соли. 2. Классификация и номенклатура органических соединений: Гомологический ряд предельных углеводородов. Правила выбора и нумерации атомов родоначальной структуры. Старшинство характеристических групп. Основные правила номенклатуры органических соединений. 3. Строение атома. Понятия массовое число, атомный номер, изотопы и изотопное содержание элементов. Относительная атомная масса. Электронное строение атома. Принцип неопределенности Гейзенберга. Понятие электронных орбиталей. Характеристики электрона (квантовые числа). Электронная конфигурация элемента и правила ее определения. Электронные и электронно-графические формулы. Понятие о валентных электронах. 4. Периодическая система элементов. Характеристики периодов и групп периодической таблицы. Понятие о валентных электронах, s-, p- и d-элементах. Периодические свойства элементов. Изменение эффективных радиусов атомов, энергии ионизации, металлических свойств и электроотрицательности в периодах и группах элементов с увеличением атомного номера. 5. Химическая связь. Природа химической связи. Электронная теория валентности. Ионная и ковалентная связи. Понятие о водородных связях. Понятие о молекулярных орбиталях, σ- и π-связях. Гибридные атомные орбитали. Образование и симметрия (пространственное строение) sp-, sp2 - и sp3 - гибридных орбиталей. 6. Электронное и пространственное строение органических соединений углерода: этана, этена, этина и бензола. Понятие о делокализованных орбиталях. Электронное и пространственное строение молекул аммиака и хлорида алюминия. Понятие координационных связей, доноров и акцепторов электронной пары. Электронное строение соединения NH3 AℓCℓ3 . 7. Изомерия органических соединений. Типы изомеров. Примеры структурных и пространственных изомеров органических молекул. 8. Окислительно-восстановительные реакции, их основные типы. Окислители и восстановители. Правила подбора стехиометрических коэффициентов методом электронного баланса. 9. Понятие раствора, фазы, растворителя и растворенного вещества. Способы выражения концентрации растворов. Коллигативные свойства растворов. Понижение давления пара над раствором: физический смысл и количественный расчет. Закон Рауля. Изменение температуры кипения и замерзания растворов. Использование криоскопии и эбулиоскопии для определения молекулярной массы растворенного вещества. Осмотическое давление: физический смысл и количественный расчет. Уравнение Вант-Гоффа. 10. Растворы электролитов. Понятия о сильных и слабых электролитах. Закон разбавления Оствальда. Понятие кислот и оснований. Их свойства и характерные реакции. Степень диссоциации и константа диссоциации кислот. Ионное произведение воды. Водородный показатель рН. Шкала рН. Понятие о буферных растворах. 11. Аминокислоты белков. Понятие о незаменимых и заменимых аминокислотах. Оптическая изомерия аминокислот. Кислотно-основные свойства α-аминокислот: взаимодействие с сильными кислотами и основаниями, образование цвиттер-иона (внутренней соли). Понятие об амфотерности. Принципиальная схема образования ди- и полипептидов. Пептидная связь. Номенклатура пептидов. Белки. Уровни организации белковых молекул. Денатурация и ренатурация белков. 12. Моносахариды (монозы). Нахождение в природе. Биологическая роль. Основные представители. Изомерия моноз. Внутримолекулярная циклизация глюкозы. Образование фуранозных и пиранозных структур. Наиболее устойчивая форма глюкозы. Мутаротация. Дисахариды (биозы). Химизм образования. Важнейшие представители. Биологическая роль. Полисахариды (полиозы). Особенности строения и биологическое значение крахмала, гликогена, целлюлозы. 13. Образование нуклеозидов и нуклеотидов. Структура АТФ и ее биологическая роль. Структура и биологическая роль ДНК и РНК. 14. Липиды. Классификация и номенклатура. Схема образования и гидролиза триацилглицеринов. Поверхностная активность и биологическая роль омыляемых липидов. 6. Типовые задачи для подготовки к зачету 1. Задачи на перерасчет концентрации растворов Необходимые формулы: Массовая доля: Ппроцентная концентрация: Молярная концентрация: Нормальность: Моляльность: Титр раствора: Пример задачи: Рассчитайте молярную, нормальную и моляльную концентрации 12% раствора серной кислоты плотностью r = 1.08 г/мл. Решение:
В задачах этого типа всегда принимают: Vр-ра = 1 л = 1000 мл . Масса этого раствора mр-ра
= r
р-ра
.
Vр-ра
= 1.08 .
1000 = 1080 Массу растворенного вещества найдем из формулы (2): mр.в.
= Масса 1 моля серной кислоты равна: Мр.в. =2 . 1 + 32 + 4 . 16 = 98 г/моль .
Поскольку молекула серной кислоты диссоциирует с выделением двух ионов водорода, то f экв. = ½, значит СН =СМ / f экв. = 2.64 моль/л.
Ответ: 1.32 моль/л , 2.64 моль/л , 1.39 моль/кг.
Задачи для самостоятельного решения: 1. Рассчитайте массовую долю и молярную концентрацию 2.64 н. раствора серной кислоты с плотностью 1,08 г/мл. 2. Рассчитайте молярную концентрацию и молярную долю раствора, содержащего 240 г гидроксида натрия в 1 кг воды (rр-ра = 1,2 г/мл).
В задачах этого типа предлагается изменить концентрацию раствора посредством добавления либо упаривания растворителя, либо добавления растворенного вещества. При этом образуется новый раствор в другом количестве и другой концентрации, но с тем же количеством растворенного вещества, либо растворителя. Для решения применяют формулы (1 – 9), применяя их последовательно к исходному и конечному раствору. Пример задачи: Сколько воды необходимо прибавить к 100 мл 20%-го раствора хлорида натрия (ρр-ра = 1.152 г/мл), чтобы получить 15% - й раствор? Решение:
Из условия задачи очевидно, что масса растворенного вещества в исходном и конечном растворах одинакова. m1р-ра
= r
1р-ра
.
V1р-ра
= 1.152 .
100 = 115.2 mр.в.
= m2р-ра
= m2р-ра – m1р-ра = 153,6 – 115.2 = 38.4 г = mводы , поскольку плотность воды равна 1 г/мл, то Vводы = 38.4 мл Ответ: 38.4 мл Задачи для самостоятельного решения: 1. Сколько граммов бромида натрия следует прибавить к 100 г 3%-го раствора той же соли для получения 10% - го раствора? 2. 10 мл 0,5М водного раствора нитрата натрия разбавили водой до 100 мл. Определите молярную концентрацию полученного раствора. 3. Определение рН раствора РН растворов определяется по формуле: рН= - lg (СН + ) рН растворов сильных кислот (азотной, соляной, серной) с нормальной концентрацией СН определяют по формуле: рН = – lg (СН ) рН растворов гидроксидов щелочных и щелочноземельных металлов с нормальной концентрацией СН определяют по формуле: рН = 14 + lg (СН ) рН растворов слабых кислот с концентрацией СМ
определяют исходя из значения их константы кислотности и степени диссоциации:
Пример задачи: Рассчитайте значение рН 0.01 М раствора цианистоводородной кислоты. Константа диссоциации КНС N = 4 . 10-10 . Решение:
Рассчитаем степень диссоциации кислоты заданной концентрации: СН + = СН . α = 0.000002 моль/л, рН= - lg(СН + ) = - lg(0.000002) = 5.7. Ответ: 5.7 Задачи для самостоятельного решения: Концентрация ионов водорода в растворе муравьиной кислоты с концентрацией
Осмотическое давление раствора равно: P осм. = 1000 . СМ . R . T , Па
Пример задачи: Рассчитайте, при какой температуре осмотическое давление раствора, содержащего в 100 мл раствора 7 г глицерина (С3 Н8 О3 ), составит 1750 кПа. Решение:
Рассчитаем молярную массу глицерина и молярную концентрацию раствора: Мр.в. = 3 . 12 + 8 . 1 + 3 . 16 = 92 г/моль ,
Ответ:
Задача для самостоятельного решения: Осмотическое давление раствора, в 0.1 л которого содержится 7 г глицерина, равно 1750 кПа при 4 0 С. Вычислите молекулярную массу глицерина.
р = ро – Δр
Пример задачи: Рассчитайте давление насыщенного пара над раствором, содержащим 3 г глюкозы в 50 г воды при 70 0 С, если давление насыщенного пара воды в этих условиях 31.2 кПа. Решение:
Рассчитаем молярную массу растворителя и растворенного вещества: Мр.в. = 1 . 39 + 1 . 16 + 1 . 1 = 180 г/моль , Мр-ля = 2 . 1 + 1 . 16 = 18 г/моль ,
р = ро – Δр = 31200 – 187.2 = 31013 Па = 31кПа Ответ: 31 кПа
Задача для самостоятельного решения: Давление водяного пара при 70 0 С равно 31.2 кПа. Давление пара раствора, содержащего в 100 г воды 3 г неэлектролита при той же температуре, равно 31013 Па. Вычислите молекулярную массу растворенного вещества.
Пример задачи:
Раствор, содержащий 10 г неэлектролита в 300 г воды, замерзает при Решение:
Поскольку вода замерзает при 00
С,
Ответ: 92 г/моль Задачи для самостоятельного решения: 1. Раствор, содержащий 10 г глицерина С3 Н8 О3 в 300 г воды, замерзает при –0.6740 С. Вычислите криоскопическую константу воды, зная, что чистая вода замерзает при 00 С. 2. Сколько граммов глицерина (молярная масса 92 г/моль) следует растворить |
 (4)
(4)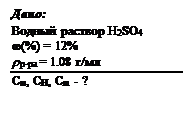 Решение:
Решение:
 Решение:
Решение:
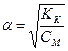
 Решение:
Решение:
 , теперь найдем концентрацию ионов водорода и рН, учитывая, что для этой кислоты СМ
= СН
:
, теперь найдем концентрацию ионов водорода и рН, учитывая, что для этой кислоты СМ
= СН
: 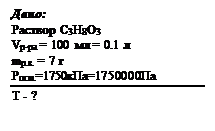 Решение:
Решение:
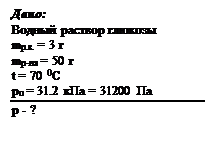 Решение:
Решение:
 Решение:
Решение: