| Министерство образования Российской Федерации
Кемеровский технологический институт пищевой промышленности
Кафедра технологии жиров, биохимии и микробиологии
ОСНОВЫ БИОТЕХНОЛОГИИ
Методические указания к выполнению лабораторных работ для студентов специальностей 270900 - “Технология мяса и мясных продуктов” и 271100 - “Технология молока и молочных продуктов” дневной и заочной форм обучения
Кемерово 2004
Составители:
ст. преп. Кригер О.В.
доц. Габинская О.С.
Рассмотрены на заседании кафедры,
Протокол № 9 от 20 июня 2004 г.
Рекомендованы к печати методической комиссией технологического факультета, протокол № 13 от 24 июня 2004 г.
Приведена принципиальная схема биотехнологического производства, рассмотрены способы получения лимонной кислоты, белковых препаратов, представлены вопросы для самопроверки и список рекомендуемой литературы для каждой темы.
Ó Кемеровский технологический институт
пищевой промышленности, 2004
Введение
Дисциплиной «Основы биотехнологии» предусматривается изучение основных направлений развития современной биотехнологии, различных этапов биотехнологического процесса, вклада биотехнологии в решение проблем пищевой промышленности, медицины, сельского хозяйства, окружающей среды.
Развитие биотехнологии обусловлено не только прогрессом наук, но и социально-экономическими потребностями общества. Такие актуальные проблемы как дефицит чистой воды, пищевых веществ, загрязнение окружающей среды, недостаток сырьевых и энергетических ресурсов не могут быть решены традиционными методами, и поэтому возникает необходимость в разработке и широком внедрении принципиально новых технологий.
Перспективность внедрения биотехнологических процессов в производство обусловлена их компактностью, крупномасштабностью, высоким уровнем автоматизации и высокой производительностью труда.
Основная цель преподавания дисциплины - формирование у студентов теоретических знаний о методах получения полезных для человека веществ и продуктов питания в управляемых условиях, используя микроорганизмы, клетки животных и растений или изолированные из клеток биологические структуры.
В задачи изучения дисциплины входит рассмотрение способов получения биологических объектов с заданными свойствами, выбора и подготовки сырья для биотехнологического производства, методов культивирования, выделения, очистки и модификации целевых продуктов. Кроме того, предусматривается ознакомление с принципами промышленного производства органических кислот, микробного белка, ферментов, биосинтеза витаминов, аминокислот. Будут даны основные сведения об экологических проблемах промышленной биотехнологии.
В результате изучения дисциплины студенты должны:
- знать
– задачи биотехнологии; основные термины биотехнологии; типовую схему биотехнологических производств; способы культивирования продуцентов; применение микроорганизмов-продуцентов для получения белковых препаратов, пищевых кислот, аминокислот, витаминов, ферментных препаратов с целью использования в перерабатывающей промышленности; использование биотехнологии в охране окружающей среды.
- Уметь
– пользоваться основной, дополнительной и справочной литературой по вопросам биотехнологии, терминами биотехнологии; получать посевной материал из чистых культур микроорганизмов; составлять типовую схему биотехнологического производства; осуществлять анализ продуктов биотехнологического производства.
ЛАБОРАТОРНАЯ РАБОТА № 1
Тема: Типовая схема биотехнологического производства.
Цель работы: Ознакомиться с основными стадиями биотехнологического производства. Изучить основные направления развития биотехнологии.
Краткие теоретические положения
Биотехнология
- это наука, разрабатывающая способы производства практически важных веществ и продуктов питания с использованием живых организмов и методы конструирования новых организмов с заданными свойствами. Биотехнология – междисциплинарная область, возникшая на стыке биологических, химических и технических наук.
Современная биотехнология использует достижения наук биологического цикла, так как базируется на глубоком знании характеристик микроорганизмов, их строении, физиологии, биохимии, генетике, взаимоотношениях в ассоциациях.
На развитие биотехнологии непосредственно влияют химия, физика, математика, механика, которые связаны с кинетикой процессов, влиянием на процессы различных внешних факторов, массо- и энергопереносом. Успехи машиностроения, электроники, автоматики позволили создать новую аппаратуру и автоматизировать биотехнологические процессы.
Связь с экономическими науками обусловлена постоянной конкуренцией с альтернативными технологиями (химической, сельскохозяйственной).
Основные направления в биотехнологии
:
1. Создание новых биологически активных веществ и лекарственных препаратов для
медицины.
Антибиотики
– специфические продукты жизнедеятельности, обладающие высокой физиологической активностью по отношению к определенным группам микроорганизмов и к злокачественным опухолям, избирательно задерживающие их рост или полностью подавляющие развитие. Всего известно около 5000 антибиотиков, но не все из них допущены для применения в медицине. Это связано с токсичностью существующих антибиотиков, аллергическими реакциями, вызываемыми ими, нарастанием устойчивости патогенных микроорганизмов к применяемым препаратам и др. Поэтому происходит поиск новых антибиотиков по средствам испытания новых продуцентов, химической модификации, клеточной и генетической инженерии.
Гормоны.
Биотехнология предоставляет медицине новые пути получения ценных гормональных препаратов. Раньше гормоны получали из органов и тканей животных и человека. Требовалось много материала для получения небольшого количества продукта. В настоящее время с применением генноинженерных штаммов получают гормон роста (соматотропин), инсулин (регулирует уровень глюкозы в крови), кортизон (гормон надпочечников) и другие гормоны. Это позволяет снизить стоимость препаратов и получать их в больших количествах.
Интерфероны – выделяются клетками человека и животных в ответ на инфицирование вирусами. Они обладают антивирусной активностью. До введения методов генной инженерии интерфероны получали из донорской крови – до 1 мкг неочищенного интерферона из 1 л крови, т.е. примерно одну дозу для инъекции. В настоящее время интерфероны успешно получают с применением генноинженерных штаммов Escherichia coli, дрожжей, культивируемых клеток насекомых и млекопитающих. Интерфероны используются для лечения болезней, вызываемых вирусами герпеса, гепатитов и др.
Рекомбинантные вакцины и вакцины-антигены.
Вакцинация – один из основных способов борьбы с инфекционными заболеваниями. Путем всеобщей вакцинации ликвидирована натуральная оспа, ограничено распространение бешенства, полиомиелита, желтой лихорадки. Большое экономическое значение имеет разработка вакцин против болезней сельскохозяйственных животных (нпр, ящура). Традиционные вакцинные препараты изготовляют на основе ослабленных или инактивированных возбудителей болезней. Современные биотехнологические разработки предусматривают создание рекомбинантных вакцин и вакцин-антигенов. Вакцины обоих типов основаны на генноинженерном подходе.
Ферменты медицинского назначения.
Многообразно применение ферментных препаратов в медицине. Их используют для растворения тромбов, лечения наследственных заболеваний, освобождения организма от токсических веществ и др.
2.Создание микробиологических средств защиты растений от болезней и вредителей, бактериальных удобрений, новых высокопродуктивных сортов и гибридов сельскохозяйственных растений.
Биотехнологические пути защиты растений от болезней и вредителей включают:
- выведение сортов растений, устойчивых к неблагоприятным факторам;
- химические средства борьбы с сорняками, грызунами, насекомыми, фитопатогенными грибами, бактериями, вирусами;
- биологические средства борьбы с вредителями, использование их естественных врагов и паразитов, а также токсических продуктов, образуемых живыми организмами.
Наряду с защитой растений ставится задача повышения продуктивности сельскохозяйственных культур, их пищевой (кормовой) ценности, создания сортов растений, растущих на засоленных почвах, в засушливых и заболоченных районах.
3.Создание ценных кормовых добавок для повышения продуктивности животноводства.
Для повышения продуктивности животных нужен полноценный корм. Биотехнологическая промышленность выпускает кормовой белок на базе различных микроорганизмов – бактерий, грибов, дрожжей, водорослей. Богатая белками биомасса микроорганизмов с высокой эффективностью усваивается сельскохозяйственными животными.
Большое значение для животноводства имеет обогащение растительных кормов микробным белком. Для этого широко используются твердофазные процессы.
4.Создание новых технологий получения хозяйственно ценных продуктов для использования в пищевых и других отраслях промышленности.
Аминокислоты
(цистеин, метионин, лизин, глутамат) – повышение питательной ценности пищи, усиление аромата мясных, рыбных, грибных изделий.
Олигопептиды
(аспартам, тауматин, монеллин) – низкокалорийные, очень сладкие вещества.
Ферменты:
· b-Галактозидаза - производство безлактозного молока, освобождение молочной сыворотки от лактозы, приготовление мороженого;
· Микробные протеазы – сыроварение, ускорение созревания теста, производство крекеров;
· Фицин, трипсин, бромеланин – ускорение маринования рыбы, удаление мяса с костей;
· Липазы – придание специфического аромата сыру, шоколаду, молочным продуктам, улучшение качества взбитых яичных белков;
· Глюкозооксидаза в сочетании с каталазой – удаление кислорода из сухого молока, кофе, пива, майонеза, лимонных, апельсиновых и виноградных соков.
Витамины
(А, В1
, В2
, В6
, В12
, С, D, Е) – повышение питательной ценности пищевых продуктов, антиоксиданты.
Органические кислоты
(уксусная, бензойная, молочная, глюконовая, лимонная) – консерванты, ароматизаторы.
5. Создание эффективной технологии переработки и очистки промышленных и бытовых отходов.
Важной составной частью современной биотехнологии является очистка воды от загрязнений, а также утилизация различных промышленных и бытовых отходов. Методы такой очистки основаны на использовании специфических биологических сообществ, носящих название активного ила
, для глубокой утилизации как органических, так и неорганических загрязнений, оставшихся в воде после других видов очистки.
Биотехнологические производства являются весьма перспективными, что обусловлено их компактностью, крупномасштабностью, высоким уровнем автоматизации и высокой производительностью труда.
Процессы биотехнологических производств разнообразны, но все они имеют пять общих основных стадий, которые различаются по целям и принципам их достижения. Общая биотехнологическая схема производства продуктов микробного синтеза приведена на рис. 1.
1) Получение посевного материала
. Посевной материал представляет собой чистую культуру микроорганизмов-продуцентов, размноженную в лабораторных условиях при оптимальном составе питательной среды и режиме выращивания. Культуры микроорганизмов-продуцентов заводы получают из коллекций в пробирках на агаризованных питательных средах или в ампулах. Чистая культура микроорганизма может постоянно или по мере необходимости использоваться в производстве. Сначала культуру размножают в лаборатории, затем в цехе чистых культур и инокуляции, далее направляют на культивирование.
2) Приготовление питательной среды –
включает смешивание компонентов и стерилизацию.
Основу питательных сред для культивирования микроорганизмов составляют источники углерода. Существуют микроорганизмы, способные потреблять углерод только из высокомолекулярных соединений, например белков и пептидов, в то же время многие бактерии и дрожжи утилизируют простейшие углеродосодержащие соединения - метан, этанол, углекислоту. Кроме углерода клетки микроорганизмов нуждаются в источниках азота, фосфора, макро- и микроэлементов. Вещества этого рода находятся в питательных средах в виде солей, в некоторых случаях азот и фосфор могут усваиваться из органических источников, например автолизатов и гидролизатов микробного или животного происхождения.
Смешивание питательных веществ проводится в реакторах с мешалкой. Растворимые компоненты среды предварительно растворяют в воде. Нерастворимые компоненты (например, кукурузную, соевую муку, мел) – суспензируют. Составление среды считается завершенным, если в результате произведено тщательное измельчение ее твердых компонентов.
Завершающий этап приготовления питательной среды – стерилизация. Наиболее широкое распространение получила термическая стерилизация. Важнейшей проблемой при этом является сохранение питательных свойств среды, так как большинство субстратов, особенно углеводы, оказываются термически нестабильными. Некоторые субстраты не требуют стерилизации, так как сами обладают асептическим действием: метанол, этанол, уксусная кислота и др.
|   Продуцент Продуцент
|
Подготовка инокулята
|
Питательная среда
|
|  
|
| 
|
Культивирование
|
| 
|
|   
|
Разделение
|
| 
|
|    Культуральная жидкость Культуральная жидкость
|
Клетки
|
| 
|
|  
|
Биомасса убитых клеток
|
Биомасса живых клеток
|
|        Дезинтеграция Дезинтеграция
убитых клеток
|
| Выделение и очистка метаболитов
|
| 
|
|  
|
Концентрирование
|
| 
|
|   
|
Стабилизация продукта
|
| Обезвоживание
|

| Сухой продукт
|
Жидкий продукт
|
 Хранение Хранение
 Применение Применение
Рис. 1. Многостадийная биотехнологическая схема производства
продуктов микробного синтеза.
3) Ферментация
(культивирование) - это вся совокупность последовательных операций от внесения в заранее приготовленную и стерилизованную питательную среду инокулята (посевного материала) до завершения процессов роста и биосинтеза вследствие исчерпывания питательных веществ среды. Существует два типа ферментаций: получение биомассы микроорганизмов и получение ценных веществ, возникающих в ходе
роста или на последующих стадиях развития культуры.
4) Выделение целевого продукта.
Стадия выделения и очистки продукта существенно зависит от того, накапливается продукт в клетках или он выделяется в культуральную жидкость, или же продуктом является сама клеточная масса. Разделение биомассы и культуральной жидкости - сепарация
- осуществляется несколькими методами (флотация, фильтрация, центрифугирование). Если целевой продукт содержится в самих клетках
, то проводят разрушение клеток - дезинтеграцию - физическими, химическими и химико-ферментативными способами.
Выделение продукта из культуральной жидкости или гомогената
разрушенных клеток проводят путем его осаждения, экстракции или адсор-бции. Затем выделенный продукт концентрируют
ультрафильтрацией, выпариванием или обратным осмосом. После стабилизации продукта в зависимости от того, каким должен быть конечный продукт: сухим или жидким, его обезвоживают или сразу упаковывают и отправляют на хранение и далее - потребителю.
Контрольные вопросы
1.
Что такое биотехнология?
2.
В чем заключается взаимосвязь биотехнологии с другими науками?
3.
Каковы основные направления развития биотехнологии?
4.
Перечислите основные стадии биотехнологического производства.
5.
Что такое посевной материал?
6.
Как готовят посевной материал в производственных условиях?
7.
Какие компоненты входят в состав питательных сред?
8.
Что такое ферментация?
9.
Какими методами осуществляется разделение биомассы от культуральной жидкости?
10.
В каком случае необходима дезинтеграция клеток?
11.
Какие способы концентрирования продукта Вам известны?
Список рекомендуемой литературы
1. Под ред. Егорова Н.С., Самуилова В.Д. Биотехнология. Проблемы и перспективы.- М.: Высшая школа, 1987.- 160 с.
2. Под ред. Егорова Н.С., Самуилова В.Д. Биотехнология. Микробиологическое производство биологически активных веществ и препаратов.- М.: Высшая школа, 1987.- 142 с.
3. Габинская О.С. Основы биотехнологии. Кемерово, 1996.- 54 с.
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема: Принципы составления питательных сред в биотехнологическом производстве. Особенности роста микроорганизмов на питательных средах различного состава
Цель работы: Ознакомиться с основными принципами составления питательных сред для культивирования микроорганизмов. Изучить потребности микроорганизмов в источниках питания.
Посуда, материалы, оборудование, реактивы
:
колбы с ватными пробками на 250 мл – 6; стеклянные палочки – 6; пипетки градуированные на 5 мл – 3, на 1мл – 6; цилиндры мерные на 250 мл – 1, на 100 мл – 1; воронки 6; стеклянные стаканчики на 50 мл – 6; фильтры бумажные складчатые; фильтровальная бумага. Весы электронные; рефрактометр; иономер; термостат; реактивы для приготовления питательных сред. Культура гриба Aspergillus niger, спиртовка, бактериологическая петля, карандаш по стеклу.
Краткие теоретические положения
Питательная среда обеспечивает жизнедеятельность, рост и развитие микроорганизмов, эффективный синтез целевого продукта. Неотъемлемой частью питательной среды служит вода, все процессы жизнедеятельности протекают только в водной среде.
Питательные среды могут иметь неопределенный состав, то есть включать биогенные добавки - мясной экстракт, кукурузную муку, морские водоросли и т.д. Подобные среды обычно готовят на водопроводной воде. Применяют также среды, приготовленные из чистых химических соединений в заранее определенных соотношениях - синтетические среды
. Смесь веществ, как правило, вносят в дистиллированную воду. С экономической точки зрения выгодно употребление природного, более дешевого сырья. Однако применение синтетических сред позволяет изучить физиолого-биохимические свойства микроорганизмов и оптимизировать состав среды. Компромиссным вариантом является использование полусинтетических сред
, в состав которых вместе с химически чистыми соединениями входят биогенные добавки.
Состав среды определяется потребностями микроорганизмов в соединениях, необходимых для биосинтеза и получения энергии. Конструктивные и метаболические процессы у микроорганизмов крайне разнообразны, поэтому столь же разнообразны их потребности в питательных веществах.
Питательные среды для культивирования микроорганизмов содержат большое количество необходимых компонентов, основным из которых считают тот, который служит микроорганизмам источником углерода и энергии. Это вещество или смесь веществ называется субстратом
, а все остальные - вспомогательными веществами
.
Так как микроорганизмы способны ассимилировать любое органическое соединение, потенциальными ресурсами для биотехнологии могут служить все мировые запасы органических веществ. При выборе сырья необходимо учитывать его влияние на себестоимость готового продукта, доступность, методы получения, свойства и качественные характеристики.
Потребность микроорганизма в тех или иных соединениях определяется особенностями данного вида. В самом приближенном виде физиологические потребности микроорганизмов в питательных веществах можно выявить, определив химический состав микробной клетки: обычно содержание углерода находится в пределах 45-55%, азота – 6-14, К – 0,5-2, Р – 1-3, Mg – 0,1-1, S – 0,02-1, Ca – 1%.
Источники углерода
Легкодоступными считаются сахара
: глюкоза, сахароза, лактоза. За ними следуют многоатомные спирты
: глицерин, маннит и др. Далее следуют полисахариды
: целлюлоза, гемицеллюлоза, крахмал, которые могут быть источниками углерода либо после превращения их в усвояемые микроорганизмами моно- и низкомолекулярные олигосахариды, либо микроорганизмы должны иметь набор ферментов, гидролизующих эти вещества (Aspergillus, Bacillus, Penicillium и др.).
На практике встречается большое количество микроорганизмов, которые успешно утилизируют органические кислоты
, особенно в анаэробных условиях.
Низкомолекулярные спирты
: метанол и этанол - относятся к числу перспективных видов сырья. Многие дрожжи родов Candida, Hansenula и др. способны ассимилировать этанол. Дрожжи родов Pichia, Candida и др. и бактерии рода Flavobacterium используют в качестве единственного источника углерода метанол.
Некоторые виды микроорганизмов используют в качестве источника углерода и энергии н-алканы
и некоторые фракции нефти
. Особенностью углеводородов является их низкая растворимость в воде, поэтому только незначительная часть микроорганизмов способна ассимилировать углеводороды.
Источники азота
Азот может содержаться в форме неорганических
солей или кислот. Большинство дрожжей хорошо усваивает аммиачные соли, а также аммиак из водного раствора, потребность в нитратах испытывают только некоторые виды дрожжей. Источником азота могут служить и органические
соединения: аминокислоты, мочевина и т.д., которые легко усваиваются микроорганизмами.
Известно, что бактерии более требовательны к источникам азота, чем грибы, актиномицеты и дрожжи.
Источники фосфора
Фосфор является важнейшим компонентом клетки, он входит в состав АТФ, АДФ, АМФ и обеспечивает нормальное течение энергетического обмена в клетке, а также синтез белков и нуклеиновых кислот и др. биохимических превращений. Фосфор вносится в среду в виде солей фосфорной кислоты.
Вода
Вода должна отвечать требованиям ГОСТ (чистая, бесцветная, без привкуса, запаха и осадка).
Источники витаминов и микроэлементов
Потребность у микроорганизмов в этих соединениях различна, тем не менее, практически все микроорганизмы лучше растут в присутствии витаминов. Эффективной добавкой к питательным средам оказался кукурузный экстракт благодаря наличию в нем витаминов, аминокислот и минеральных элементов в легко ассимилируемых формах. В рецептуры сред включают также дрожжевой автолизат, дрожжевой экстракт, сок картофеля, молочную сыворотку, экстракт солодовых ростков и др. продукты.
Микроэлементы в состав питательных сред вводят в микродозах, в противном случае они оказывают ингибирующее действие на микроорганизмы.
Итак, состав питательной среды для каждого микроорганизма устанавливают экспериментально.
Задача специалиста, оптимизирующего состав среды для конкретного вида микроорганизма, - выбрать такие источники углерода, азота, фосфора и др. веществ, которые наиболее оправданы в экономическом и экологическом отношениях.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
П е р в о е з а н я т и е
1. Подготовка питательной среды.
2. Определение содержания сухих веществ в питательной среде.
3. Определение рН питательной среды.
4. Подготовка посевной суспензии и засев питательной среды.
5. Установка колб в термостат.
Подготовка питательной среды
Среду заданного состава (табл. 1) готовят в колбах на 250 мл. Все компоненты растворяют в небольшом количестве водопроводной воды, затем объем доводят до 100 мл водопрводной водой. Колбы со средой закрывают ватными пробками.
Определение рН питательной среды
В стеклянный стаканчик отбирают 25 мл содержимого каждой из колб и с помощью иономера определяют рН среды.
Таблица 2.1
Варианты питательных сред
| Компоненты,
|
Вариант
|
| на 100 мл среды
|
1
|
2
|
3
|
4
|
5
|
6
|
| Сахароза, г
|
-
|
3
|
-
|
-
|
-
|
-
|
| Глюкоза, г
|
3
|
-
|
-
|
3
|
6
|
3
|
| Лактоза, г
|
-
|
-
|
3
|
-
|
-
|
-
|
| Na NO3
(20% р-р), мл
|
5
|
5
|
5
|
5
|
10
|
5
|
| KH2
PO4
(10% р-р), мл
|
2
|
2
|
2
|
2
|
4
|
2
|
| KСl (5% р-р), мл
|
1
|
1
|
1
|
1
|
2
|
1
|
| MgSO4
×7H2
O (1% р-р), мл
|
1
|
1
|
1
|
1
|
2
|
1
|
| FeSO4
×7H2
O (1% р-р), мл
СаО ( 10 % р-р ), мл
Витамины
РН
|
1
0,3
-
6,5-6,8
|
1
0,3
-
6,5-6,8
|
1
0,3
-
6,5-6,8
|
1
0,3
+
6,5-6,8
|
2
0,6
-
6,5-6,8
|
1
0,3
-
4
|
Определение содержания сухих веществ в питательной среде
Определение проводят с помощью рефрактометра. Перед началом работы рефрактометр проверяют по дистиллированной воде, при этом пунктирная линия, нанесенная на окуляр, должна совместиться с границей света и тени на нулевой отметке шкалы, значение при этом составляет 1,333.
Затем на призмы с помощью стеклянной палочки наносят несколько капель исследуемой жидкости. Верхнюю призму опускают и плотно прижимают к нижней. После этого перемещают окуляр вдоль прорези, пока граница света и тени не совместится с пунктирной линией. По шкале прибора отмечают деление, через которое проходит граница светотени. После определения поверхность призмы протирают фильтровальной бумагой и промывают дистиллированной водой.
Подготовка посевной суспензии и засев питательной среды
Для получения посевной суспензии в пробирку с чистой культурой гриба-продуцента вблизи пламени спиртовки наливают 9 мл стерильной воды. Бактериологической петлей осторожно соскребают слой, содержащий споры, до образования суспензии.
Засев питательной среды производят стерильными пипетками. Из пробирки отбирают по 1 мл суспензии и количественно переносят в каждую колбу с питательной средой. Колбы закрывают ватными пробками.
Установка колб в термостат
Каждую колбу подписывают (группа, фамилия, вариант среды) и устанавливают в термостат на 7 суток при температуре 27°С.
В т о р о е з а н я т и е
1. Отделение биомассы гриба.
2. Определение массы сухого мицелия.
3. Определение содержания сухих веществ в культуральной жидкости.
4. Определение рН в культуральной жидкости.
Отделение биомассы гриба
На аналитических весах взвешивают пустые бумажные фильтры, предварительно высушенные до постоянной массы (вес записывают), и вставляют в воронки. Колбу открывают, и содержимое фильтруют через фильтр. Отделенная от культуральной жидкости биомасса гриба является материалом для определения массы сухого мицелия. После фильтрования замеряют объем культуральной жидкости и доводят до 100 мл дистиллированной водой.
Определение массы сухого мицелия
Фильтры с биомассой гриба помещают в сушильный шкаф при температуре 130°С на 40 мин (до полного высушивания). Затем фильтры переносят в эксикатор для охлаждения на 10-15 мин, после чего взвешивают на аналитических весах. Разность между массой фильтра с сухим мицелием и массой пустого фильтра является массой сухого мицелия (Х), образовавшегося за период культивирования гриба в термостате:
Х = Мм
- Мф
, (2.1)
где Х –
масса сухого мицелия, г; Мф
- масса пустого фильтра, г; Мм
- масса фильтра с высушенным мицелием, г.
Определение содержания сухих веществ в культуральной жидкости
Определение проводят с помощью рефрактометра (см. занятие 1).
Определение рН в культуральной жидкости
рН фильтрата определяют с помощью иономера (см. занятие 1).
Отношение прироста биомассы гриба к количеству потребленного субстрата называют экономическим коэффициентом.
На основании полученных данных для каждого варианта рассчитывают экономический коэффициент
(Y) по формуле:
|  Y = Y =
|
Х
-Хо
S-So
|
, (2.2)
|
где Y
– экономический коэффициент; Х
- масса сухого мицелия, г; Хо
- масса посевного материала, г; S
- концентрация сухих веществ в питательной среде, %; Sо
- концентрация сухих веществ в культуральной жидкости, %.
Так как Хо
часто бывает пренебрегаемо мало, то
|  Y = Y =
|
Х
S-So
|
,
(2.3)
|
Таким образом, экономический коэффициент или выход биомассы показывает массу клеток продуцента на единицу субстрата.
Общая скорость
роста микроорганизма-продуцента (V) характеризуется абсолютным приростом биомассы за единицу времени:
|  V = V =
|
Х-Х0
t2
-t1
|
, (2.4)
|
где V
- общая скорость роста, г/сут; Х0
- масса посевного материала, г; Х
- конечная концентрация биомассы, г; t2
-t1
- время культивирования, сут.
Полученные результаты вносят в таблицу 2. На основании полученных данных делают вывод о физиолого-биохимических особенностях гриба Aspergillus niger и выбирают оптимальный состав среды.
Таблица 2.2
Журнал наблюдений
| №
п/п
|
РН
|
Содержание
сухих веществ, %
|
Масса сухого
|
Экономи-ческий
|
Общая скорость
|
| до
|
после
|
до
|
после
|
мицелия,
|
коэффи-
|
роста,
|
| культивирования
|
культивирования
|
г/100 мл
|
циент
|
г/сутки
|
Контрольные вопросы:
1. Что такое субстрат?
2. Какие источники углерода используют в биотехнологическом производстве?
3. Какие источники азота усваиваются микроорганизмами?
4.
Как вносится фосфор в питательную среду?
5.
Каким образом в питательные среды вводят источники витаминов и микроэлементов?
6.
Как определяют содержание сухих веществ в питательной среде?
Список рекомендуемой литературы
1. Бекер М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология.- М.: Агропромиздат, 1990.- с.96-108.
2. Габинская О.С. Основы биотехнологии: Учебное пособие.- Кемерово: КемТИПП, 1996.-54 с.
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема: Получение лимонной кислоты путем культивирования плесневого гриба поверхностным способом на жидкой питательной среде
Цель работы: Ознакомиться с методами поверхностного культивирования на жидких питательных средах. Изучить способность плесневого гриба к продуцированию лимонной кислоты на жидких питательных средах различного состава.
Посуда, материалы, оборудование, реактивы
:
колбы объемом 250 мл с ватными пробками – 5; стеклянные палочки – 5; пипетки градуированные на 5 мл – 3, на 1мл – 5; цилиндры мерные на 250 мл – 1, на 100 мл – 1; воронки диаметром 10-15 см - 5; стеклянные стаканчики на 50 мл – 5; бюретка для титрования на 25 мл. Фильтры складчатые - 5; фильтровальная бумага; спиртовка; бактериологическая петля; карандаш по стеклу. Весы электронные; рефрактометр; иономер; термостат; магнитная мешалка; сушильный шкаф. Реактивы: меласса 21,2 %, сахароза, растворы солей - NH4
Cl, KH2
PO4
, ZnSO4,
10% K4
[Fe(CN)6
], 0,1 н раствор NaOH, фенолфталеин, пробирки с чистой культурой Aspergillus niger - 2, пробирки со стерильной водой -2.
Краткие теоретические положения
Лимонная кислота впервые была выделена из сока лимона и перекристаллизована Шееле. В лимонах содержится 7-9% этой кислоты; в Италии и Испании до сих пор ее получают из лимонов, но на 99% ее продукция основана на микробиологическом синтезе.
Способность грибов образовывать лимонную кислоту при росте на средах с углеводами впервые была установлена немецким ученым Вемером в 1893 г.
Большая часть лимонной кислоты (70%) используется в пищевой промышленности, около 12% в фармацевтической промышленности и около 18% - для технических целей. Использование лимонной кислоты в пищевой промышленности обусловлено ее хорошей растворимостью, низкой токсичностью и приятным кислым вкусом. Лимонную кислоту используют при приготовлении безалкогольных напитков, мармелада, вафель, пастилы, некоторых сортов колбас и сыра, для получения сгущенного молока. Лимонная кислота сохраняет естественный вкус и аромат мяса в замороженном виде при длительном хранении. Применение находят и побочные продукты ферментации:
мицелий грибов и культуральная жидкость. Мицелий высушивают и используют как сырье или добавляют к удобрениям. В культуральной жидкости обнаружены гидролитические ферменты пектиназа, протеаза, целлюлаза.
Для получения лимонной кислоты используют грибы родов Aspergillus, Penicillium, Mucor, и др.
В настоящее время основными продуцентами лимонной кислоты являются различные штаммы гриба Aspergillus niger, которые отличаются большой скоростью роста, легкостью культивирования и высоким выходом лимонной кислоты к массе окисляемого углевода.
Лимонная кислота - обычный метаболит цикла трикарбоновых кислот, в небольшом количестве присутствует в клетках разных микроорганизмов. Некоторые грибы (в первую очередь A. niger) способны синтезировать огромное количество этой кислоты. Сверхсинтез
лимонной кислоты происходит при лимитировании роста грибов-продуцентов минеральными компонентами среды и одновременном избыточном содержании источника углерода.
В условиях лимитирования роста гриба недостатком одного или нескольких минеральных компонентов (Fe, Mn, N, Р или S) после полного поглощения из среды дефицитного элемента он прекращает расти, однако продолжает потреблять имеющийся в среде источник углерода. При этом в клетках гриба начинает накапливаться лимонная кислота, которая в дальнейшем выделяется в среду. В процессе ферментации можно выделить две фазы: 1) активного роста гриба и 2) интенсивного кислотообразования, рост мицелия в этот период становится незначительным.
В настоящее время получение лимонной кислоты биотехнологическими способами широко применяется в промышленности. Разработаны технологии получения лимонной кислоты как поверхностным
, так и глубинным
способами. Основной питательной средой в обоих случаях служит меласса - отход сахарного производства, она содержит 48-50% сахара. Для хорошего роста и развития гриба среда должна содержать минеральные соли: NH4
Cl, KH2
PO4
, ZnSO4
.
В мелассе содержатся соли тяжелых металлов, угнетающие рост гриба и образование лимонной кислоты. Для осаждения этих солей к мелассе добавляют желтую кровяную соль K4
[Fe(CN)6
].
Поверхностное культивирование
осуществляется в алюминиевых или выполненных из нержавеющей стали больших кюветах. Стерильную питательную среду заливают в чистые стерильные кюветы слоем 8-12 см. Посевной материал вносят в виде суспензии и распределяют по всей поверхности среды. По окончании процесса культивирования лимонную кислоту выделяют из культуральной жидкости. Различают три основных способа ведения процесса: бессменный, сменный и доливной.
При бессменном способе
рост и кислотообразование гриба происходят на одной и той же питательной среде, содержащей минеральные соли и источник углерода.
Сменный способ
культивирования часто называют методом готовых пленок. Пленку гриба выращивают на питательной среде, содержащей минеральные соли и углевод. По окончании роста гриба питательный раствор из под пленки сливают, пленку промывают стерильной водой и под нее подводят новую среду для кислотообразования, содержащую углевод, но лишенную минеральных соединений.
Способ долива –
через 6-7 сут от начала цикла, когда содержание сахара снизится до 3-4%, подливают свежий раствор мелассы (без питательных солей) в количестве 30-35% начального объема. В результате продолжительность ферментации увеличивается от 8-9 до 12 сут.
Глубинное культивирование
– этот метод производства лимонной кислоты имеет ряд преимуществ по сравнению с методом поверхностного культивирования: эффективное использование производственных площадей, увеличение масштабности производства, механизация и автоматизация технологических процессов получения кислоты.
Однако при сравнении технологии и экономичности поверхностного и глубинного способов получения лимонной кислоты предпочтение отдают первому методу, так как при его применении себестоимость продукта и расход электроэнергии значительно ниже.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
П е р в о е з а н я т и е
1. Подготовка питательной среды.
2. Определение рН питательной среды.
3. Определение титруемой кислотности питательной среды.
4. Определение содержания углеводов в питательной среде.
5. Приготовление посевной суспензии и засев питательной среды.
6. Установка колб в термостат.
Подготовка питательной среды
Для производства лимонной кислоты оптимальное количество углерода в питательной среде - 16-17%. Составы питательных сред представлены в таблице 3.1
Компоненты питательной среды выбранного варианта поместить в колбу на 250 мл и довести объем питательной среды до 125 мл водопроводной водой. Содержимое кипятить на плитке в течение 10-15 мин, затем охладить, отлить 25 мл в мерный стакан (для исследований), а оставшуюся часть (100 мл) закрыть ватной пробкой.
Определение рН питательной среды
Определение производят с помощью иономера.
Определение титруемой кислотности питательной среды
Пипеткой отбирают 5 мл питательной среды в стакан емкостью 50 мл и разбавляют 5 мл дистиллированной воды. Добавляют 2-3 капли фенолфталеина и титруют 0,1 н раствором NaOH до слабо-розового окрашивания. Если подготовленный для титрования раствор имеет окраску, мутный, в этом случае определение титруемой кислотности проводят потенциометрическим методом с использованием иономера. Для этого пипеткой отбирают 2 мл питательной среды в стакан емкостью 50 мл, добавляют 15 мл дистиллированной воды, опускают электроды и титруют 0,1 н раствором NaOH со скоростью 1-2 капли в секунду при непрерывном перемешивании.
Таблица 3.1
Варианты питательных сред
|             № варианта № варианта
|
Источник углерода в среде
Меласса сахароза
Сахар,% р-р, мл % р-р, мл
|
Кол-во добавленной воды, мл
|
 Кол-во добавленных солевых растворов, мл Кол-во добавленных солевых растворов, мл
Смешан.р-в 10% р-р 10% р-р 10% р-р 1% р-р
1% KH2
PO4
: 1% K2
[Fe(CN)6
] KH2
PO4
NH4
Cl ZnSO4
NH4
Cl: 1% ZnSO4
1:1:1
|
| 1.
|
17
|
125
|
-
|
-
|
-
|
0,65
|
1,5
|
-
|
-
|
-
|
| 2.
|
8,5
|
62,5
|
-
|
-
|
62,5
|
0,32
|
0,75
|
-
|
-
|
-
|
| 3.
|
8,5
|
62,5
|
8,5
|
10,6
|
62,5
|
0,65
|
0,75
|
-
|
-
|
-
|
| 4.
|
-
|
-
|
8,5
|
10,6
|
125
|
-
|
-
|
1,56
|
2,3
|
0,02
|
| 5.
|
-
|
-
|
17
|
21,2
|
125
|
-
|
-
|
3,1
|
4,7
|
0,04
|
Таблица 3.2
Журнал наблюдений
|  № №
варианта
|
рН
|
Содержание сухих в-в, %
|
Кол-во щелочи пошедшее на титрование, мл
|
Масса сухого мицелия, г
|
Содержание
лимонной кислоты
|
Выход лимонной к-ты, % от
|
Продуц. способ-ть мицелия,
|
| до
|
после
|
до
|
после
|
до
|
после
|

|
 Х, % С, г Х, % С, г
|
потреб. сухих в-в
|
г/г
|
| культивирования
|
культивирования
|
культивирования
|

Окончание титрования определяют по шкале иономера при достижении рН=7,0. Записывают количество щелочи, пошедшей на титрование (А1
). Это значение понадобится для расчетов на следующем занятии.
Определение содержания сухих веществ в питательной среде
Определение проводят с помощью рефрактометра. Перед началом работы рефрактометр проверяют по дистиллированной воде, при этом пунктирная линия, нанесенная на окуляр, должна совместиться с границей света и тени на нулевой отметке шкалы, значение при этом составляет 1,333.
Затем на призмы с помощью стеклянной палочки наносят несколько капель исследуемой жидкости. Верхнюю призму опускают и плотно прижимают к нижней. После этого перемещают окуляр вдоль прорези, пока граница света и тени не совместится с пунктирной линией. По шкале прибора отмечают деление, через которое проходит граница светотени.
После определения поверхность призмы протирают фильтровальной бумагой и промывают дистиллированной водой.
Приготовление посевной суспензии и засев питательной среды
Для получения посевной суспензии в пробирку с чистой культурой гриба-продуцента вблизи пламени спиртовки наливают 9 мл стерильной воды. Бактериологической петлей осторожно соскребают слой, содержащий споры, до образования суспензии.
Засев питательной среды производят стерильными пипетками. Из пробирки отбирают по 1 мл суспензии и количественно переносят в каждую колбу с питательной средой. Колбы закрывают ватными пробками.
Установка колб в термостат
Каждую колбу подписывают (группа, фамилия, вариант среды) и устанавливают в термостат на 7 суток при температуре 32°С.
В т о р о е з а н я т и е
1. Отделение мицелия гриба от культуральной жидкости.
2. Определение рН культуральной жидкости.
3. Определение титруемой кислотности культуральной жидкости и расчет выхода лимонной кислоты.
4. Определение содержания сухих веществ в культуральной жидкости и расчет выхода лимонной кислоты от потребленных сухих веществ.
5. Определение массы сухого мицелия и его продуцирующей способности.
Отделение биомассы гриба от культуральной жидкости
На аналитических весах взвешивают бумажный фильтр, (вес записывают) и вставляют в воронки. Колбу открывают, и содержимое фильтруют через фильтр. Отделенная от культуральной жидкости биомасса гриба является материалом для определения массы сухого мицелия. Объем культуральной жидкости (V) замеряют цилиндром и доводят до 100 мл дистиллированной водой.
Определение рН культуральной жидкости
Определение рН проводят с помощью иономера.
Определение титруемой кислотности культуральной жидкости
Определение проводят так же, как и на первом занятии. Содержание лимонной кислоты (X) вычисляют по формуле:
|  X = X =
|
(A2
- A1
)
×
P
×
100
V
|
,
(3.1)
|
где Х
– содержание лимонной кислоты, %; V -
объем культуральной жидкости, взятый для титрования, мл (V = 5 мл при титровании с фенолфталеином, V = 2 мл при титровании с иономером); А2
- количество 0,1 н раствора NaOH, пошедшее на титрование культуральной жидкости, мл; А1
- количество 0,1 раствора NaOH, пошедшее на титрование питательной среды, мл; Р
- фактор щелочи по лимонной кислоте (1 мл 0,1 н раствора NaOH соответствует 0,007 г лимонной кислоты).
Расчет количества синтезированной лимонной кислоты
Количество лимонной кислоты (С), синтезированной грибом, в культуральной жидкости рассчитывают по формуле:
|  С = V
× С = V
×
|
Х
100
|
,
(3.2)
|
где С
– количество лимонной кислоты, г; V -
объем культуральной жидкости, мл; Х
- содержание лимонной кислоты, г.
Определение содержания сухих веществ в культуральной жидкости
Определение проводят с помощью рефрактометра. Количество потребленных в процессе культивирования сухих веществ (В) будет равно:
В = В1
– (В2
– С)
, (3.3)
где В –
количество потребленных сухих веществ, %; В1
- содержание сухих веществ в питательной среде, %; В2
- содержание углеводов в культуральной жидкости, %; С –
количество лимонной кислоты, г.
Выход лимонной кислоты (W) в процентах от потребляемых сухих веществ (B) рассчитывают по формуле:
|  W = W =
|
C
×
100
B
|
,
(3.4)
|
где W –
выход лимонной кислоты, %; В -
количество потребляемых в процессе культивирования сухих веществ, %; С - количество лимонной кислоты, г.
Определение массы сухого мицелия гриба и его продуцирующей способности.
Фильтры с биомассой гриба помещают в сушильный шкаф при температуре 130°С на 40 минут, сушат до постоянной массы, охлаждают в эксикаторе и взвешивают на аналитических весах. Массу сухого мицелия (Б) рассчитывают по формуле:
Б = Мм
- Мф
, (3.5)
где Б
– масса сухого мицелия, г; Мф
- масса пустого фильтра, г; Мм
- масса фильтра с высушенным мицелием, г.
Продуцирующая способность мицелия (П) - это количество лимонной кислоты, синтезируемое за цикл выращивания 1 г биомассы продуцента. Bычисляют по формуле:
|  П = П =
|
C
Б
|
,
(3.6)
|
где П
- продуцирующая способность мицелия, г/г; С
- количество лимонной кислоты, г; Б
- масса сухого мицелия, г.
Результаты исследований вносят в таблицу 3.2.
На основании полученных результатов делают вывод о способности гриба Aspergillus niger продуцировать лимонную кислоту и выбирают оптимальный состав среды для получения лимонной кислоты.
Контрольные вопросы
1. Какие микроорганизмы являются продуцентами лимонной кислоты?
2. В каких условиях осуществляется сверхсинтез лимонной кислоты?
3. Какими способами получают лимонную кислоту?
4. Как осуществляют поверхностное культивирование?
5. В чем сущность потенциометрического метода титрования?
Список рекомендуемой литературы
1. Воробьева Л.И. Промышленная микробиология: Учеб. Пособие.- М.: Изд-во МГУ, 1989.294 с.
2. Промышленная микробиология/Под ред. Н.С. Егорова.- М.: Высш.шк.,1989.-688 с.
ЛАБОРАТОРНАЯ РАБОТА № 4
Тема: Получение белковых препаратов путем культивирования гриба Penicillium roqueforti на жидкой питательной среде.
Цель работы: Ознакомится с особенностями получения микробной биомассы на различных субстратах. Изучить способность плесневого гриба к продуцированию белка на молочной сыворотке.
Посуда, материалы, оборудование, реактивы:
колбы объемом 250 мл с ватными пробками – 6; стеклянные палочки – 5; пипетки градуированные на 10 мл – 6, на 1мл – 6; цилиндры мерные на 100 мл – 6; воронки диапметром 10-15 см - 6; стеклянные стаканчики на 50 мл – 6; мерные колбы на 50 мл -6; фильтры бумажные складчатые - 6; фильтровальная бумага; плотные фильтры – 6; кобы конические на 100 мл – 6; микробюретка – 1; бюретка для титрования на 25 мл – 1; стерильные пипетки на 1 мл – 2; спиртовка, бактериологическая петля, карандаш по стеклу. Весы электронные; рефрактометр; иономер; фотоэлектроколориметр; термостат. Реактивы: молочная сыворотка, 0,1 н раствор NaOH, фенолфталеин, тимолфталеин, 1 н раствор NaOH, суспезия фосфата меди, йодит калия, крахмал, 0,01 р-р тиосульфата натрия, уксусная кислота (конц.), 2,5 % р-р сульфосалициловой кислоты, прбирки с чистой культурой Penicillium roqueforti - 2, пробирки со стерильной водой – 2.
Краткие теоретические положения
В настоящее время наиболее дефицитным компонентом пищи является белок, особенно белок высокой питательной ценности. Основным путем снижения и ликвидации этого дефицита является производство биомассы с помощью микробного синтеза. Микробиологическое производство белка не требует посевных площадей, не зависит от климатических и погодных условий, поддается точному планированию и высокому уровню автоматизации, позволяет получать продукцию стандартного качества.
Для целей микробного синтеза белка могут быть использованы те микроорганизмы, которые обладают способностью под воздействием состава питательной среды и физико-химических условий культивирования синтезировать в повышенных количествах преимущественно те соединения, которые являются целевым (основным) продуктом данного производства. Эффективность того или иного микроорганизма-продуцента для производственных целей определяется, с одной стороны, скоростью его роста, с другой - степенью использования питательных веществ. Большое значение при этом имеют также морфологические особенности продуцента (размеры клеток, способность выделяться из среды при использовании различных технологических приемов и др.).
В качестве сырья и субстратов для получения микробной биомассы в разных странах используют углеводороды
или углеводсодержащее сырье
. Для крупномасштабных процессов больше пригодны углеводороды: н-алканы, природный газ, как наиболее дешевое и доступное сырье. Получение белка одноклеточных возможно также на различных углеводсодержащих отходах промышленности и сельского хозяйства: мелассе, молочной сыворотке, отходах производства крахмала, гидролизатах древесины, сульфитных щелоках и для производства белковых продуктов чаще всего используют дрожжи Candida.
Углеводороды
н-Алканы
– насыщенные с прямой цепью углеводороды, называют парафинами. Для получения белка используют углеводороды с длиной углеродной цепи С9
– С18
, получаемые из нефти и керосина. Окислять углеводороды способны многие микроорганизмы: бактерии, актиномицеты, дрожжи, микроскопические грибы. Наибольшее значение имеют аспорогенные дрожжи Candida, Rhodotorula, Torulopsis.
Метан
– самый дешевый вид сырья для производства белка. Метан используют только бактерии, и их культивирование связано с рядом трудностей: взрывоопасность (метан образует с кислородом взрывоопасную смесь), низкая растворимость метана в культуральной жидкости, медленный рост микроорганизмов и их повышенная потребность в кислороде. К облигатным метанотрофам относят бактерии родов Methylobacter, Methylococcus, Methylomonas.
Углеводсодержащие субстраты
Целлюлоза.
Перспективно получение биомассы микроорганизмов на ферментативных гидролизатах целлюлозосодержащего сырья - отходах деревообрабатывающей промышленности и сельского хозяйства. Затруднением для промышленной реализации такого процесса является то, что в целлюлозосодержащем сырье имеется лигнин, затрудняющий проникновение в субстрат фермента целлюлазы. Кроме того, сырье нуждается в обработке, позволяющей понизить содержание в нем кристаллической формы целлюлозы и перевести ее в аморфное состояние, после чего ферментативный гидролиз значительно ускоряется. На большинстве гидролизных заводов внедрены продуктивные штаммы кормовых дрожжей Candida scottii и Candida tropicalis.
Меласса –
побочный продукт производства сахара из сахарного тростника и сахарной свеклы, богатый углеводами, ценными органическими и минеральными веществами, аминокислотами, витаминами. Содержание сахарозы до 60%.
Молочная сыворотка
- очень богата различными биологически активными соединениями, она содержит в среднем 70-80% лактозы, 7-15% белковых веществ, 2-8% жира, 8-10% минеральных солей. Кроме того, молочная сыворотка имеет в своем составе значительное количество витаминов, гормонов, органических кислот, микро- и ультрамикроэлементы.
Наличие в молочной сыворотке легко усвояемых многими видами микроорганизмов источников углеродов, а также различных ростовых факторов выдвигает ее в ряд наиболее ценных питательных сред для получения продуктов микробного синтеза. Большое значение имеет и то обстоятельство, что применение молочной сыворотки не требует специальной сложной подготовки, а культуральная жидкость после выращивания микроорганизмов может быть использована в пищевых и кормовых целях без обработки.
При всестороннем использовании микробной массы, полученной на молочной сыворотке, была выявлена ее высокая технологическая и экономичность для мясного и молочного животноводства, птицеводства и целого ряда других направлений.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
П е р в о е з а н я т и е
1. Определение рН питательной среды.
2. Определение титруемой кислотности питательной среды.
3. Определение содержания сухих веществ в питательной среде.
4. Определение аминного азота.
5. Приготовление посевной суспензии и засев питательной среды.
7. Установка колб на качалки.
Определение рН питательной среды
Проводят с помощью иономера.
Определение титруемой кислотности питательной среды
В колбу на 100 мл отбирают 10 мл молочной сыворотки, добавляют 20 мл дистиллированной воды, 3-4 капли фенолфталеина и оттитровывают 0,1 н раствором NaOH до слабо-розовой окраски.
Титруемую кислотность питательной среды (К), в градусах Тернера, рассчитывают по формуле:
К = V1
× 10 ,
(4.1)
где К –
титруемая кислотность, °Т; V1
- объем 0,1 н раствора NaOH мл, пошедшего на титрование 10 мл питательной среды; 10 - коэффициент пересчета на 100 мл питательной среды.
Определение содержания сухих веществ в питательной среде
Проводят с помощью рефрактометра.
Определение аминного азота питательной среды йодометрическим
методом
В мерную колбу объемом 50 мл пипеткой вносят 10 мл молочной сыворотки, добавляют 3-4 капли тимолфталеина и по каплям 1 н раствор NaOH до появления бледно-голубой окраски. К слабощелочному раствору из цилиндра при помешивании приливают 30 мл суспензии фосфата меди, содержимое колбы доводят водой до метки, перемешивают и фильтруют через плотный фильтр. Фильтрат должен быть совершенно прозрачным. 10 мл фильтрата пипеткой переносят в коническую колбу, добавляют 0,5 мл уксусной кислоты, 1 г йодида калия и перемешивают. Выделившийся йод титруют из микробюретки 0,01 н раствором тиосульфата натрия, прибавляя в конце титрования 1-2 капли раствора крахмала. Окончание титрования определяют по исчезновению синей окраски.
Количество аминного азота (Х) вычисляют по формуле:
|  X = X =
|
а
× 0,28 V
× 10
× 100
50
|
,
(4.2)
|
где Х –
количество аминного азота, мг/100 мл; а -
количество 0,01 н раствора тиосульфата натрия, пошедшее на титрование, мл; V
- объем исследуемой жидкости, взятый на анализ, мл.
Приготовление посевной суспензии и засев питательной среды
Проводят так же, как и в предыдущих работах.
Установка колб в термостат
Каждую колбу подписывают (группа, фамилия, продолжительность культивирования) и устанавливают в термостат на 3, 5, 7 суток при температуре 25-27°С.
В т о р о е з а н я т и е
1. Определение прироста биомассы гриба-продуцента.
2. Определение рН культуральной жидкости.
3. Определение титруемой кислотности культуральной жидкости.
4. Определение содержания сухих веществ в культуральной жидкости.
5. Определение аминного азота в культуральной жидкости.
6. Определение белка в биомассе колориметрическим методом.
8. Заполнение журнала наблюдений.
Определение прироста биомассы гриба-продуцента
На аналитических весах взвешивают предварительно высушенные до постоянной массы фильтры. Содержимое колб фильтруют через фильтр, при этом выросшую биомассу гриба шпателем переносят на фильтр. Биомассу на фильтре сушат в сушильном шкафу при температуре 130°С в течение 1 часа. Высушенные таким образом фильтры с биомассой охлаждают в эксикаторе и взвешивают на аналитических весах. Массу сухого мицелия (В), г, рассчитывают по формуле:
В = В2
- В1
,
(4.3)
где В1
- масса пустого фильтра, г; В2
- масса фильтра с биомассой, г.
Определение рН культуральной жидкости
Проводят с помощью иономера.
Определение титруемой кислотности культуральной жидкости
В колбу на 100 мл отбирают 10 мл отфильтрованной жидкости, добавляют 20 мл дистиллированной воды, 3-4 капли фенолфталеина и оттитровывают 0,1 н раствором NaOH до слабо-розового окрашивания. Кислотность рассчитывают так же, как и на первом занятии.
Определение содержания сухих веществ в культуральной жидкости
Проводят с помощью рефрактометра.
Определение аминного азота в культуральной жидкости
Проводят йодометрическим методом (см. первое занятие).
Определение белка колориметрическим методом
Около 0,5 г исследуемого измельченного в муку образца взвешивают на аналитических весах с точностью до + 0,001г и помещают в коническую колбу вместимостью 250 см3
, снабженную пробкой. В колбу добавляют пипеткой 50см3
раствора гидроксида натрия концентрацией 0,1 моль/дм3
. Колбу закрывают пробкой и встряхивают на механическом встряхивателе в течение 15 мин. Затем вытяжку центрифугируют 10 мин. при частоте вращения 6000 мин-1
. 5 см3
прозрачного центрифугата пипеткой переносят в мерную колбу на 50см3
и содержимое колбы доводят до метки сульфосалициловой кислотой. Параллельно готовят контрольный образец. Для этого 5см3
дистиллированной воды переносят в мерную колбу на 50см3
и содержимое колбы доводят до метки сульфосалициловой кислотой.
При нефелометрическом анализе получение точных результатов зависит от порядка и скорости смешивания растворов. Поэтому после добавления сульфосалициловой кислоты колбы быстро переворачивают 2-3 раза (не более), растворы наливают в кюветы с толщиной слоя 5мм и измеряют величину оптической плотности растворов при длине волны 550 нм. Замеры следует проводить сразу после добавления кислоты, т.к. частицы белка быстро агрегируют. По величине оптической плотности белковой вытяжки определяют массовую долю белка с помощью калибровочного графика (рис.4.1).
Массовую долю белка (Х, %) рассчитывают по формуле:
Б
·100
Х=---------- ,
(4.4)
1000
·
n
где
Б
-содержание белка в навеске, мг; n - навеска, взятая на определение, г.
 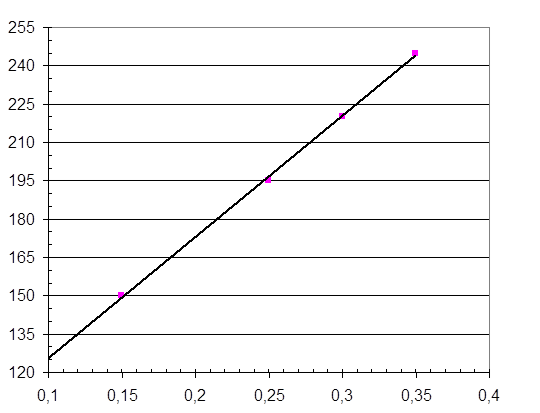
Рис. 4.1 Калибровочный график для определения белка
Заполнение журнала наблюдений
Результаты исследований вносят в таблицу 4. На основании данных таблицы построить графики прироста биомассы (рис. 4.2.) и накопления белка в биомассе (рис. 4.3) в процессе культивирования гриба-продуцента.
На основании полученных результатов делают вывод о способности гриба Penicillium roqueforti продуцировать белок на молочной сыворотке, и определяют, на какие сутки происходит максимальный прирост биомассы и накопление белка.
Контрольные вопросы
1. Какие требования предъявляются к микроорганизмам-продуцентам?
2.Почему молочная сыворотка часто используется в качестве питательной среды?
3.
В чем сущность определения белка колориметрическим методом?
4.
Как определить массу сухого мицелия?
Список рекомендуемой литературы
1. Промышленная микробиология: Учеб. Пособие для вузов/ З.А. Аркадьева, А.М. Безбородов, И.Н. Блохина и др.; Под ред. Н.С. Егорова.- М.: Высш. Шк., 1989.- 688 с.
2. Воробьева Л.И. Техническая микробиология: Учеб. Пособие.- М.: Изд-во Моск. Ун-та, 1987.- 168 с.
Таблица 4
| Сутки
|
РН
|
Титруемая кислотность, ° Т
|
Прирост
|
Аминный азот
|
Экономический
|
Содержание
|
Сухие в-ва, %
|
|  выращивания выращивания
|
до
|
после
|
до
|
после
|
биомассы, г
|
до
|
после
|
коф-т
|
белка, % на сухие в-ва
|
до после
|
| культивирования
|
культивирования
|
культивирования
|
культивирования
|
В, г М, %
t, сутки t, сутки
Рис. 4.1. Прирост биомассы в процессе культивирования Рис. 4.2. Накопление белка в биомассе
гриба-продуцента в процессе культивирования гриба-продуцента
СОДЕРЖАНИЕ
Введение
……………………………………………………………….. 3
Лабораторные работы
………………………………………………… 4
| 1.
|
ТИПОВАЯ СХЕМА БИОТЕХНОЛОГИЧЕСКОГО ПРОИЗВОДСТВА …………………….………………………….
Основные направления в биотехнологии ……………………….
Основные стадии биотехнологического производства ………..
Контрольные вопросы ……………………………………………
Список рекомендуемой литературы …………………………….
|
4
4
7
9
9
|
| 2.
|
ПРИНЦИПЫ СОСТАВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД В БИОТЕХНОЛОГИЧЕСКОМ ПРОИЗВОДСТВЕ. ОСОБЕННОСТИ РОСТА МИКРООРГАНИЗМОВ НА ПИТАТЕЛЬНЫХ СРЕДАХ РАЗЛИЧНОГО СОСТАВА………………………………………………………...
Порядок выполнения работы ……………………………………
Первое занятие……………………………………………………
Второе занятие …………………………………………………..
Контрольные вопросы …………………………………………..
Список рекомендуемой литературы ……………………………
|
10
12
12
14
15
15
|
| 3.
|
ПОЛУЧЕНИЕ ЛИМОННОЙ КИСЛОТЫ ПУТЕМ КУЛЬТИВИРОВАНИЯ ПЛЕСНЕВОГО ГРИБА ПОВЕРХНОСТНЫМ СПОСОБОМ НА ЖИДКОЙ ПИТАТЕЛЬНОЙ СРЕДЕ …………………………………………
Порядок выполнения работы ……………………………………
Первое занятие……………………………………………………
Второе занятие …………………………………………………..
Контрольные вопросы …………………………………………..
Список рекомендуемой литературы ……………………………
|
16
18
18
20
22
22
|
| 4.
|
ПОЛУЧЕНИЕ БЕЛКОВЫХ ПРЕПАРАТОВ ПУТЕМ КУЛЬТИВИРОВАНИЯ ГРИБА Penicillium roqueforti НА ЖИДКОЙ ПИТАТЕЛЬНОЙ СРЕДЕ …………………………….
Порядок выполнения работы ……………………………………
Первое занятие……………………………………………………
Второе занятие …………………………………………………..
Контрольные вопросы …………………………………………..
Список рекомендуемой литературы…………………………….
|
23
25
25
26
28
28
|
Подписано в печать 3.09.04 г. Формат 60х84/16.
Отпечатано на ризографе. Уч.-изд. л. 2. Тираж 250 экз.
Заказ №
Кемеровский технологический институт пищевой промышленности,
650056, г. Кемерово, б-р Строителей, 47
Отпечатано в лаборатории множительной техники КемТИППа,
650010, г. Кемерово, ул. Красноармейская, 52.
|