| Кластерная система химических элементов
Хорошавин Лев Борисович
Докт. техн. наук
Реферат
Разработана кластерная восемнадцатигрупповая система химических элементов до
N
220, в основу которой положен кластерный принцип строения электронных оболочек элементов с сохранением известной зависимости их свойств от атомной массы. Кластерная система химических элементов позволит изучать изменение свойств элементов не только по периодам и группам в Периодической системе элементов, но и дополнительно по кластерам химических элементов, определять прогнозные свойства новых элементов и создавать новые кластерные материалы и изделия.
Существующая длиннопериодная Периодическая система химических элементов Д.И.Менделеева исследована крайне недостаточно. Хотя и существуют более 500 производных систем от Периодической системы, но все они до сих пор не систематизированы, не проанализированы и недостаточно практически используются [1].
Автором для разработки новых систем химических элементов использовано два фундаментальных положения:
1. Строгой неизменности существующей Периодической системы химических элементов Д.И.Менделеева, недопустимости внесения в нее каких-либо изменений, кроме добавления новых элементов. Главная особенность Периодической системы – неизвестность впередистоящих до водорода элементов и последних элементов. Можно предполагать, что до водорода могут стоять элементарные частицы, объединенные в кластеры-изотопические мультиплеты, с массой и зарядом менее 1 с уменьшающимися размерами в данное время до иокточастиц -10-24
м, а в конце – бесконечное количество новых элементов с переходом их количества в новое качество по волновым функциям. Это предположение основано на том, что в данное время известно только около 5% материи, а 95% материи неизвестна до сих пор – в этой темной материи может быть всё, в т.ч. и новые элементы с новой структурой и новой периодичностью.
Следовательно, Периодическая система химических элементов Д.И.Менделеева бесконечна в начале системы до водорода и в конце с определенными условиями стабильности новых элементов.
2. Целесообразности разработок новых производных систем элементов для исследования взаимосвязи между свойствами элементов, прогнозирования новых элементов и решения конкретных практических задач. Для этих целей авторами создан ряд новых производных систем химических элементов, в т.ч. и с разделением элементов на нечетные и четные по атомным номерам [2-12].
Два положения о неизменности Периодической системы химических элементов Д.И.Менделеева и целесообразности разработок новых производных систем элементов полностью соответствуют объективным диалектическим законам познания Природного мира.
Известна зависимость свойств элементов от их атомной массы и электронной конфигурации в Периодической системе химических элементов Д.И.Менделеева по периодам и группам. Предлагается дополнительно
рассматривать изменение свойств элементов по их кластерам (группировкам), основанным на количестве внешних электронов в каждой электронной конфигурации с целью:
- определить зависимости изменения свойств элементов в каждом кластере и между ними от четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml
) и спинового (ms
);
- рассчитывать прогнозные свойства новых элементов на основе кластеров и электронных ячеек для их экспериментальной проверки;
- создать новые кластерные материалы и изделия по микро-, нано- и пикотехнологиям.
Постановка задачи в данной работе – определить кластеры химических элементов по количеству внешних электронов в каждой электронной конфигурации s-, p-, d-, f-, g-элементов (орбитальному квантовому числу l) при неизменности порядка их атомных масс и атомных номеров, равных количеству протонов в ядре и, соответственно, электронов в оболочках. Систематизировать кластеры химических элементов, определить электронные ячейки в кластерной системе элементов и изучить свойства ячеек.
Ранее авторами статьи установлены кластеры (группировки) химических элементов по структуре их внешних электронных оболочек и количеству в них внешних электронов [13].
Химическое взаимодействие элементов определяется преимущественно внешними электронами элементов, т.е. их количеством и структурой внешних электронных оболочек элементов. Также строение внешних электронных оболочек и связанные с ними большинство химических и физических свойств элементов определяются электромагнитным взаимодействием электронов с ядром – в основном кулоновскими силами и в меньшей степени друг с другом.
Количество внешних электронов и структура оболочек изменяются по группам элементов с определенным их чередованием в виде группировок, названных кластерами элементов.
Известно, что относительно небольшие группы частиц, объединенных теми или иными силами, относительно слабыми, называются кластерами (кластер, англ. cluster – группировка, скопление, сгусток, связка, пучок, группа атомов или других структурных элементов, агрегаты и др.). Виды кластеров многочисленны: нанокластеры (группировки, агрегаты ионов, атомов, молекул и отдельных частиц), металлические, магнитные, молекулярные, углеродные, водные, кластеры благородных газов и др.
Кластеры химических элементов –
это группировки элементов с одинаковой электронной конфигурацией, с одинаковым интервалом изменения количества внешних электронов и границами между ними, определенными постоянным количеством внешних элементов в каждой группировке.
Кластерная система химических элементов
(табл.1) основана на их разделении на s, p, d, f, g-элементы и кластеры.
Таблица 1. Кластерная система химических элементов
| Атомная масса –
Удельная атомная масса –
Распределение внешних электронов -
|
6,94 3
2,31 Li
литий
2s1
1
|
-Атомный номер
- Название элемента
- Количество внешних электронов
|
Количество элементов в одном кластере:
|
2-ð s-элементы
6-ð p-элементы
10-ð d-элементы
14-ð f-элементы
18-ð g-элементы
|
| Ряды
|
Группы элементов
|
| I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
| 1
|
1,0 1
1,0 H
водород
1s1
1
|
4,0 2
2,0 He
гелий
1s2
2
|
6,94 3
2,31 Li
литий
2s1
1
|
9,01 4
2,25 Be
бериллий
2s2
2
|
10,81 5
2,16 B
бор
2s2
2p1
3
|
12,01 6
2,0 C
углерод
2s2
2p2
4
|
14,00 7
2,0 N
азот
2s2
2p3
5
|
15,99 8
1,99 О
кислород
2s2
2p4
6
|
18,99 9
2,99 F
фтор
2s2
2p5
7
|
| 2
|
39,09
19
2,05 К
калий
4s1
1
|
40,07
20
2,0 Са
кальций
4s2
2
|
44,95
21
2,14 Sc
скандий
3d1
4s2
3
|
47,88 2
2
2,17 Ti
титан
3d2
4s2
4
|
50,94
23
2,21 V
ванадий
3d3
4s2
5
|
51,99 24
2,16 Cr
хром
3d4
4s2
6
|
54,93 25
2,19 Mn
марганец
3d5
4s2
7
|
55,84 26
2,14 Fe
железо
3d6
4s2
8
|
58,93 27
2,18 С
o
кобальт
3d7
4s2
9
|
| 3
|
85,47 37
2,31 Rb
рубидий
5s1
1
|
87,62 38
2,0 Sr
стронций
5s2
2
|
88,90 39
2,27 Y
иттрий
4d1
5s2
3
|
91,22 40
2,28 Zr
цирконий
4d2
5s2
4
|
92,90 41
2,26 Nb
ниобий
4d4
5s1
5
|
95,94 42
2,28 Mo
молибден
4d5
5s1
6
|
97,90 43
2,27 Tc
технеций
4d5
5s2
7
|
101,07 44
2,29 Ru
рутений
4d7
5s1
8
|
102,9
4
5
2,28 Rh
родий
4d8
5s1
9
|
| 4
|
132,9 55
2,41 Cs
цезий
6s1
1
|
137,32 56
2,45 Ba
барий
6s2
2
|
138,95 57
2,43 La
лантан
5d1
6s2
3
|
140,12 58
2,41 Ce
церий
4f1
5d1
6s2
4
|
140,9 59
2,38 Pr
празеодим
4f3
6s2
5
|
144,24 60
2,40 Nd
неодим
4f4
6s2
6
|
145,0 61
2,45 Pm
прометий
4f5
6s2
7
|
150,4 62
2,42 Sm
самарий
4f6
6s2
8
|
151,96 63
2,41 Eu
европий
4f7
6s2
9
|
| 5
|
180,94 73
2,47 Ta
тантал
5d3
6s2
5
|
183,85 74
2,48 W
вольфрам
5d4
6s2
6
|
186,2 75
2,48 Re
рений
5d5
6s2
7
|
190,2 76
2,50 Os
осми
5d6
6s2
8
|
192,22 77
2,49 Ir
иридий
5d7
6s2
9
|
195,09 78
2,50 Р
t
платина
5d8
6s2
10
|
196,96 79
2,50 Au
золото
5d10
6s1
11
|
200,59 80
2,50 Hg
ртуть
5d10
6s2
12
|
204,38 81
2,52 Tl
таллий
6s2
6p1
3
|
| 6
|
231,03 91
2,53 Pa
протактиний
5f2
6d1
7s2
5
|
238,02 92
2,58 U
уран
5f3
6d1
7s2
6
|
237,04 93
2,54 Np
нептуний
5f4
6d1
7s2
7
|
244,06 94
2,59 Pu
плутоний
4f1
5d1
6s2
4
|
243,06 95
2,55 Am
америций
5f7
7s2
9
|
247,07 96
2,57 Cm
кюрий
5
f
7
6
d1
7
s2
10
|
247,07 97
2,54 Bk
берклий
5f8
6d1
7s2
11
|
251,08 98
2,56 Cf
калифорний
5f1
0
7s2
12
|
252,08 9
9
2,54 Es
эйнштейн
5f1
1
7s2
13
|
| 7
|
266,0 109
2,44 Mt
мейтнерий
6d7
7s2
9
|
267,14 110
2,42 Ds
дармштадтий
6d8
7s2
10
|
268,14 111
2,41 -
6d10
7s1
11
|
269,15 112
2,40 -
6d10
7s2
12
|
270,15 113
2,39 -
7s2
7p1
3
|
271,16 11
4
2,37 -
7s2
7p2
4
|
272,16 11
5
2,36 -
7s2
7p3
4
|
273,17
11
6
2,35 -
7s2
7p4
5
|
274,17 117
2,34 -
7s2
7p5
7
|
| 8
|
284,42 127
2,23 -
9
|
285,25 128
2,22 -
10
|
286,26 129
2,22 -
11
|
287,27 130
2,20 -
12
|
131
-
13
|
132
-
14
|
133
-
15
|
134
-
16
|
135
-
17
|
| 9
|
145
-
9
|
146
-
10
|
147
-
11
|
148
-
12
|
149
-
13
|
150
-
14
|
151
-
15
|
152
-
16
|
153
-
3
|
| 10
|
163
-
3
|
164
-
4
|
165
-
5
|
166
-
6
|
167
-
7
|
168
-
8
|
169
-
1
|
170
-
2
|
171
-
3
|
| 11
|
181
-
13
|
182
-
14
|
183
-
15
|
184
-
16
|
185
-
17
|
186
-
18
|
87
-
19
|
88
-
20
|
189
-
3
|
| 12
|
199
-
13
|
200
-
14
|
201
-
15
|
202
-
16
|
203
-
3
|
204
-
4
|
205
-
5
|
206
-
6
|
207
-
7
|
| 13
|
217
-
7
|
218
-
8
|
219
-
1
|
220
-
2
|
-
|
-
|
-
|
-
|
-
|
| 14
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
Продолжение таблицы 1
| Ряды
|
Группы элементов
|
| X
|
XI
|
XII
|
XIII
|
XIV
|
XV
|
XVI
|
XVII
|
XVIII
|
| 1
|
20,17 1
0
2,01 Ne
неон
2s2
2p6
8
|
22,99 11
2,09 Na
натрий
3s1
1
|
6,94 12
2,02 Mg
магний
3s2
2
|
26,98 13
2,07 Al
алюминий
3s2
3p1 3
|
28,08 14
2,0 Si
кремний
3s2
2p2
4
|
30,97 15
2,06 P
фосфор
3s2
3p3
5
|
32,06 16
2,0 S
сера
3s2
3p4
6
|
35,45 17
2,08 Cl
хлор
3s2
3p5
7
|
39,94 18
2,21 Ar
аргон
3s2
3p6
8
|
| 2
|
58,34 28
2,08 Ni
никель
3d8
4s2
10
|
63,54 2
9
2,19 С
u
медь
3d10
4s1
11
|
65,39 30
2,17 Zn
цинк
3d10
4s2
12
|
69,72 31
2,24 Ga
галлий
4s2
4p1
3
|
72,61 32
2,26 Ge
германий
4s2
4p2
4
|
74,92 33
2,27 As
мышьяк
4s2
4p3
5
|
78,96 34
2,32 Se
селен
4s2
4p4
6
|
79,90 3
5
2,28 Br
бром
4s2
4p5
7
|
83,8 36
2,32 К
r
криптон
3s2
4p6
8
|
| 3
|
106,4 46
2,31 Pd
палладий
4d10
5s0
10
|
107,86 47
2,29 Ag
серебро
4d10
5s1
11
|
112,41 48
2,34 Cd
кадмий
4d10
5s2
12
|
114,81 49
2,34 In
индий
5s2
5p1
3
|
118,71 50
2,37 Sn
олово
5s2
5p2
4
|
121,75 51
2,38 Sb
сурьма
5s2
5p3
5
|
127,6 52
2,45 Te
теллур
5s2
5p4
6
|
126,9 53
2,39 I
йод
5s2
5p5
7
|
131,29 54
2,43 Xe
ксенон
5s2
5p6
8
|
| 4
|
157,25 64
2,45 Gd
гадолиний
4f7
5d1
6s10
|
153,92 65
2,36 Tb
тербий
4f9
6s2
11
|
162,5 66
2,46 Dy
диспрозий
4f1
0
6s2
12
|
164,93 67
2,46 Ho
гольмий
4f1
1
6s2
13
|
167,26 68
2,46 Er
эрбий
4f12
6s2
14
|
168,93 69
2,44 Tm
тулий
4f13
6s2
15
|
173,04 70
2,47 Yb
иттербий
4f14
6s2
16
|
174,97 71
2,46 Lu
лютеций
5d1
6s2
3
|
178,49 72
2,47 Hf
гафний
5d2
6s2
4
|
| 5
|
207,2 82
2,52 Pb
свинец
6s2
6p2
4
|
208,98 83
2,51 Bi
висмут
6s2
6p3
5
|
208,98 84
2,48 Po
полоний
6s2
6p4
6
|
209,98 85
2,47 At
астат
6s2
6p5
7
|
221,01 86
2,58 Rn
радон
6s2
6p2
8
|
223,02 87
2,56 Fr
франций
7s1
1
|
226,02 88
2,56 Ra
радий
7s2
2
|
227,02 89
2,55 Ac
актиний
6d1
7s2
3
|
232,03 90
2,57 Th
торий
6d2
7s2
4
|
| 6
|
257,09100
2,57 Fm
фермий
4f12
7s2
14
|
258,09 101
2,55 Md
менделеевий
5
f
3
6
d1
7
s2
15
|
259,1 102
2,54 No
нобелий
5f14
7s2
16
|
260,1 103
2,52 Lr
лоуренсий
6d1
7s2
3
|
261,11 104
2,51 Rf
резерфордийий
6d2
7s2
4
|
262,11 105
2,49 Db
дубний
6d3
7s2
5
|
263,12 106
2,48 Sg
сиборгий
6d4
7s2
6
|
264,1 107
2,46 Bh
борий
6d5
7s2
7
|
265,13 108
2,45 Hs
хассий
6d6
7s2
8
|
| 7
|
275,18118
2,33 -
7s2
7p6
8
|
276,18 11
9
2,32 -
8s1
1
|
277,19 1
20
2,30 -
8s2
2
|
278,19 1
21
2,29 -
3
|
279,2 1
22
2,28 -
4
|
280,2 1
23
2,27 -
5
|
281,21 1
24
2,26 -
6
|
282,22 1
25
2,25 -
7
|
283,23 1
26
2,24 -
8
|
| 8
|
1
36
-
18
|
1
37
-
19
|
1
38
-
20
|
1
39
-
3
|
1
40
-
4
|
1
41
-
5
|
142
-
6
|
1
43
-
7
|
1
44
-
8
|
| 9
|
1
54
-
4
|
1
55
-
5
|
1
56
-
6
|
1
57
-
7
|
1
58
-
8
|
15
9
-
9
|
1
60
-
10
|
1
61
-
11
|
162
-
12
|
| 10
|
1
72
-
4
|
1
73
-
5
|
1
74
-
6
|
1
75
-
6
|
1
76
-
8
|
1
77
-
9
|
1
78
-
10
|
17
9
-
11
|
1
80
-
12
|
| 11
|
19
0
-
4
|
191
-
5
|
192
-
6
|
193
-
7
|
194
-
8
|
195
-
9
|
196
-
10
|
197
-
11
|
198
-
12
|
| 12
|
2
08
-
8
|
2
09
-
9
|
21
0
-
10
|
2
11
-
11
|
212
-
12
|
213
-
3
|
214
-
4
|
215
-
5
|
216
-
6
|
| 13
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| 14
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
Таблица 2. Разделение химических элементов на
s
,
p
,
d
,
f
,
g
-элементы и кластеры
в кластерной системе химических элементов
| s-
элементы
|
p-
элементы
|
d-
элементы
|
f-
элементы
|
g-
элементы
|
| Но-мер
|
Сим-вол
|
К-во внешних электронов
|
Но-мер
|
Сим-вол
|
К-во внешних электронов
|
Но-мер
|
Сим-вол
|
К-во внешних электронов
|
Но-мер
|
Сим-вол
|
К-во внешних электронов
|
Но-мер
|
Сим-вол
|
К-во внешних электронов
|
| 1
|
H
|
1
|
5
|
B
|
3
|
21
|
Sc
|
3
|
57
|
La
|
3
|
121
|
-
|
3
|
| 2
|
He
|
2
|
6
|
C
|
4
|
22
|
Ti
|
4
|
58
|
Ce
|
4
|
122
|
-
|
4
|
| 3
|
Li
|
1
|
7
|
N
|
5
|
23
|
V
|
5
|
59
|
Pr
|
5
|
123
|
-
|
5
|
| 4
|
Be
|
2
|
8
|
O
|
6
|
24
|
Cr
|
6
|
60
|
Nd
|
6
|
124
|
-
|
6
|
| 11
|
Na
|
1
|
9
|
F
|
7
|
25
|
Mn
|
7
|
61
|
Pm
|
7
|
125
|
-
|
7
|
| 12
|
Mg
|
2
|
10
|
Ne
|
8
|
26
|
Fe
|
8
|
62
|
Sm
|
8
|
126
|
-
|
8
|
| 19
|
K
|
1
|
13
|
Al
|
3
|
27
|
Co
|
9
|
63
|
Eu
|
9
|
127
|
-
|
9
|
| 20
|
Ca
|
2
|
14
|
Si
|
4
|
28
|
Ni
|
10
|
64
|
Gd
|
10
|
128
|
-
|
10
|
| 37
|
Rb
|
1
|
15
|
P
|
5
|
29
|
Cu
|
11
|
65
|
Tb
|
11
|
129
|
-
|
11
|
| 38
|
Sr
|
2
|
16
|
S
|
6
|
30
|
Zn
|
12
|
66
|
Dy
|
12
|
130
|
-
|
12
|
| 55
|
Cs
|
1
|
17
|
Cl
|
7
|
39
|
Y
|
3
|
67
|
Ho
|
13
|
131
|
-
|
13
|
| 56
|
Ba
|
2
|
18
|
Ar
|
8
|
40
|
Zr
|
4
|
68
|
Er
|
14
|
132
|
-
|
14
|
| 87
|
Fr
|
1
|
31
|
Ga
|
3
|
41
|
Nb
|
5
|
69
|
Tm
|
15
|
133
|
-
|
15
|
| 88
|
Ra
|
2
|
32
|
Ge
|
4
|
42
|
Mo
|
6
|
70
|
Yb
|
16
|
134
|
-
|
16
|
| 119
|
-
|
1
|
33
|
As
|
5
|
43
|
Tc
|
7
|
89
|
Ac
|
3
|
135
|
-
|
17
|
| 120
|
-
|
2
|
34
|
Se
|
6
|
44
|
Ru
|
8
|
90
|
Th
|
4
|
136
|
-
|
18
|
| 169
|
-
|
1
|
35
|
Br
|
7
|
45
|
Rh
|
9
|
91
|
Pa
|
5
|
137
|
-
|
19
|
| 170
|
-
|
2
|
36
|
Kr
|
8
|
46
|
Pd
|
10
|
92
|
U
|
6
|
138
|
-
|
20
|
| 219
|
-
|
1
|
49
|
In
|
3
|
47
|
Ag
|
11
|
93
|
Np
|
7
|
171
|
-
|
3
|
| 220
|
-
|
2
|
50
|
Sn
|
4
|
48
|
Cd
|
12
|
94
|
Pu
|
8
|
172
|
-
|
4
|
| 10 кластеров
|
51
|
Sb
|
5
|
71
|
Lu
|
3
|
95
|
Am
|
9
|
173
|
-
|
5
|
| 52
|
Te
|
6
|
72
|
Hf
|
4
|
96
|
Cm
|
10
|
174
|
-
|
6
|
| 53
|
I
|
7
|
73
|
Ta
|
5
|
97
|
Bk
|
11
|
175
|
-
|
7
|
| 54
|
Xe
|
8
|
74
|
W
|
6
|
98
|
Cf
|
12
|
176
|
-
|
8
|
| 81
|
Tl
|
3
|
75
|
Re
|
7
|
99
|
Es
|
13
|
177
|
-
|
9
|
| 82
|
Pb
|
4
|
76
|
Os
|
8
|
100
|
Fm
|
14
|
178
|
-
|
10
|
| 83
|
Bi
|
5
|
77
|
Ir
|
9
|
101
|
Md
|
15
|
179
|
-
|
11
|
| 84
|
Po
|
6
|
78
|
Pt
|
10
|
102
|
No
|
16
|
180
|
-
|
12
|
| 85
|
At
|
7
|
79
|
Au
|
11
|
139
|
-
|
3
|
181
|
-
|
13
|
| 86
|
Rn
|
8
|
80
|
Hg
|
12
|
140
|
-
|
4
|
182
|
-
|
14
|
| 113
|
-
|
3
|
103
|
Lr
|
3
|
141
|
-
|
5
|
183
|
-
|
15
|
| 114
|
-
|
4
|
104
|
Rf
|
4
|
142
|
-
|
6
|
184
|
-
|
16
|
| 115
|
-
|
5
|
105
|
Db
|
5
|
143
|
-
|
7
|
185
|
-
|
17
|
| 116
|
-
|
6
|
106
|
Sg
|
6
|
144
|
-
|
8
|
186
|
-
|
18
|
| 117
|
-
|
7
|
107
|
Bh
|
7
|
145
|
-
|
9
|
187
|
-
|
19
|
| 118
|
-
|
8
|
108
|
Hs
|
8
|
146
|
-
|
10
|
188
|
-
|
20
|
| 163
|
-
|
3
|
109
|
Mt
|
9
|
147
|
-
|
11
|
2 кластера
|
| 164
|
-
|
4
|
110
|
Ds
|
10
|
148
|
-
|
12
|
| 165
|
-
|
5
|
111
|
-
|
11
|
149
|
-
|
13
|
| 166
|
-
|
6
|
112
|
-
|
12
|
150
|
-
|
14
|
| 167
|
-
|
7
|
153
|
-
|
3
|
151
|
-
|
15
|
| 168
|
-
|
8
|
154
|
-
|
4
|
152
|
-
|
16
|
| 213
|
-
|
3
|
155
|
-
|
5
|
189
|
-
|
3
|
| 214
|
-
|
4
|
156
|
-
|
6
|
190
|
-
|
4
|
| 215
|
-
|
5
|
157
|
-
|
7
|
191
|
-
|
5
|
| 216
|
-
|
6
|
158
|
-
|
8
|
192
|
-
|
6
|
| 217
|
-
|
7
|
159
|
-
|
9
|
193
|
-
|
7
|
| 218
|
-
|
8
|
160
|
-
|
10
|
194
|
-
|
8
|
| 8 кластеров
|
161
|
-
|
11
|
195
|
-
|
9
|
| 162
|
-
|
12
|
196
|
-
|
10
|
| 203
|
-
|
3
|
197
|
-
|
11
|
| 204
|
-
|
4
|
198
|
-
|
12
|
| 205
|
-
|
5
|
199
|
-
|
13
|
| 206
|
-
|
6
|
200
|
-
|
14
|
| 207
|
-
|
7
|
201
|
-
|
15
|
| 208
|
-
|
8
|
202
|
-
|
16
|
| 209
|
-
|
9
|
4 кластера
|
| 210
|
-
|
10
|
| 211
|
-
|
11
|
| 212
|
-
|
12
|
| 6 кластеров
|
| Итого: s - 20
|
p - 48
|
d - 60
|
f - 56
|
g - 36
|
| Всего: 220 элементов
|
|
Так, в кластерной системе внешние электроны образуют в s-, p-,d-,f-, g-элементах следующие кластеры (табл.2, рис.1):
| - по 2 -s-элементов,
- по 6 –р-элементов,
- по 10 -d-элементов
|
- по 14 –f-элементов,
- по 18-g-элементов.
|
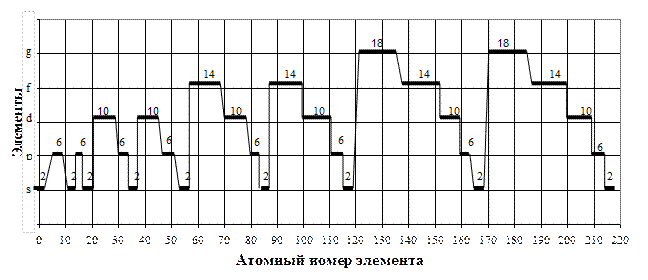
Рис.2. Распределение s-, p-, d-, f-, g-элементов и кластеров по атомным номерам в кластерной системе химических элементов. Цифра – количество элементов в кластере:2,6,10,14,18 с разностью между ними по 4 элемента и парностью по 2 элемента
При этом разность между каждым кластером равна 4 элементам (2-6-10-14-18) и парностью по 2 элемента.
В каждом элементе количество внешних электронов изменяется так:
- в s – элементах внешние электроны изменяются от 1 до 2;
| - в р -элементах -3-8;
- в в -элементах -3-12;
|
- в f –элементах – 3-16;
-в g –элементах – 3-20;
|
Количество пар элементов в s-,p-,d-,f-,g-группах и кластеров элементов в кластерной системе приведено в табл.3
Таблица 3. Количество пар элементов
s
-,
p
-,
d
-,
f
-,
g
-группах и кластеров в кластерной системе
| Группы элементов
|
Общее количество элементов
|
Количество пар элементов
|
Количество кластеров элементов
|
| s – элементы
|
20
|
10
|
10
|
| р – элементы
|
48
|
24
|
8
|
| d – элементы
|
60
|
30
|
6
|
| f – элементы
|
56
|
28
|
4
|
| g – элементы
|
36
|
18
|
2
|
| Всего:
|
220
|
110
|
30
|
В системе количество пар нечетных - четных элементов сначала возрастает в группах от s
–
элементов к d –
элементам, а затем снижается к g – элементам. Количество кластеров уменьшается от s к g- элементам.
Границы кластеров элементов повторяются через определенное количество атомных номеров N:
- по первичной разности ∆Nп
между конечным номером Nк
одного кластера и начальным номером Nн
другого кластера по группам s-,p-,d-,f-,g-элементов - ∆Nп
= Nк
- Nн
;
- по вторичной разность ∆Nв
между первичной разностью соседних кластеров - ∆Nв
=∆Nп1
-∆Nп2
(Табл.4)
Таблица 4. Первичная и вторичная разность между
кластерами элементов
| s-элементы
|
p-элементы
|
d-элементы
|
f-элементы
|
g-элементы
|
| Nк
-Nн
|
∆Nп
|
∆Nв
|
Nк
-Nн
|
∆Nп
|
∆Nв
|
Nк
-Nн
|
∆Nп
|
∆Nв
|
Nк
-Nн
|
∆Nп
|
∆Nв
|
Nк
-Nн
|
∆Nп
|
∆Nв
|
| 2-3
|
1
|
-
|
10-13
|
3
|
-
|
30-39
|
9
|
-
|
70-89
|
19
|
-
|
138-171
|
33
|
0
|
| 4-11
|
7
|
6
|
18-31
|
13
|
10
|
48-71
|
23
|
14
|
102-139
|
37
|
18
|
188-
|
| 12-19
|
7
|
0
|
36-49
|
13
|
0
|
80-103
|
23
|
0
|
152-189
|
37
|
0
|
| 20-37
|
17
|
10
|
54-81
|
27
|
14
|
112-153
|
41
|
18
|
202-
|
| 38-55
|
17
|
0
|
86-113
|
27
|
0
|
162-203
|
41
|
0
|
| 56-87
|
31
|
14
|
118-163
|
45
|
18
|
212-
|
| 88-119
|
31
|
0
|
168-213
|
45
|
0
|
| 120-169
|
49
|
18
|
218-
|
| 170-219
|
49
|
0
|
| 220-
|
Примечание. Исходные данные табл.2, жирным шрифтом – прогнозные данные. Nк
, Nн
- атомные номера элементов соответственно конечного и начального кластера; ∆Nп
- первичная разность между кластерами; ∆Nв
- вторичная разность между первичной разностью соседних кластеров. Так, например, ∆Nп
=∆Nк
-∆Nн
=[2-3]=1; ∆Nв
=7-1=6 и т.д.
Обращают на себя внимание двойственная однотипность первичной разности элементов ∆Nп
между кластерами и строгая последовательность изменения вторичной разности ∆Nв
: 6-0-10-0-14-0-18-0. Эти закономерности позволили привести прогнозные данные по группам s-,p-,d-,f-,g-элементов и количеству внешних электронов до №220 (табл.1,2, рис.2)
При этом количество внешних электронов в системе распределяется одинаково по отдельным областям.
В дальнейшем целесообразно исследовать изменение свойств химических элементов по кластерам с целью познания и созидания новых химических соединений и веществ – новых кластерных материалов и изделий.
Действительно, если фундаментальным принципом построения Периодической системы элементов является выделение в ней периодов (горизонтального ряда) и групп (вертикальные столбцы) элементов с изучением изменения в них свойств элементов, то в кластерной системе (производной от Периодической системы) рассматриваются кластеры элементов. При этом Периодическая система носит расчетный характер по периодам и группам, а кластерная система – тоже расчетный характер по кластерам элементов и электронным ячейкам.
В данное время известно 118 элементов. В кластерной системе содержится пока 220 элементов, в т.ч. 20-s-элементов, 48-р-элементов, 60-d-элементов, 56-f элементов и 36-g-элементов.
Известно, что любой элемент в Периодической системе имеет свойства, промежуточные между свойствами соседних с ним элементов по горизонтали, вертикали, и диагонали [14].
Кластерная система химических элементов имеет одинаковую, ячеистую, электронную структуру - разность между количеством электронов любых близлежащих элементов в разных частях системы одинакова. Так, в любых электронных ячейках 2х2 элемента разность между количеством электронов, равного атомному номеру элемента, всегда равна (рис.2,а):
| - по горизонтали – 1
- по вертикали - 18
|
- по диагонали сверху виз – 19;
- по диагонали снизу вверх – 17.
|
Аналогично изменяется количество электронов в любых электронных ячейках 3х3, 4х4 и т.д. в разных частях системы (рис.2,б).
Следовательно, кластерная система химических элементов имеет ячеистую структуру, состоящую из одинаковых электронных ячеек. Свойства электронных ячеек следующие (рис.1,в):
 а б в а б в
Рис.2.
Электронные ячейки кластерной
системы химических элементов
- противоположные стороны электронных ячеек всегда равна между собой: А=С; D=B; а=с; d=b. Поэтому и сумма или разность противоположных сторон ячеек равна между собой А±С=D±B; а±с=d±b;
- суммы диагональных номеров элементов (количество электронов) всегда равна между собой : Е1
=Н+Х; F1
=R+L; Е1
= F1
; е1
=0+х; f1
=S+P; е1
= f1
;
- сумма или разность диагональных номеров элементов равна сумме или разности соответствующих сторон треугольников в ячейках – их общей гипотенузе:
Е=А± B=D±С; е=а±b=d±с; Е=D±А=С±B; f=d±а=с±b;
- сумма диагоналей, поделена на 2, равна вертикальным сторонам ячеек: (Е+F)/2=B=D;
- разность диагоналей ячеек, поделена на 2, равна горизонтальным сторонам ячеек: (Е-F)/2=A=C;
- каждый атомный номер элемента, т.е. количество электронов у элемента, равен сумме двух противоположных диагональных элементов с минусом другого диагонального элемента: Х= (R+L)-H; О=(M+J)-H; S=(R+O)-M; Р=(О+L)-J и т.д.
Поэтому, зная свойства любых трех соседних элементов в прямоугольной ячейке можно по формуле Х=(R+L)-H определить свойства четвертого (нового) элемента.
Эти закономерности электронных ячеек при постановке электронов в ячейки, являются точными и могут быть использованы для расчета электронов новых элементов без поправочных коэффициентов.
Однако, при постановке в ячейки вместо электронов различных свойств элементов (атомной массы, атомных радиусов, плотности и др.) для расчета свойств новых элементов в закономерности ячеек требуется введение поправочных коэффициентов. Это вероятно, обусловлено неодинаковой удельной атомной массой в элементах (атомная масса элемента приходящаяся на 1 электрон) и недостаточной объективностью существующих показателей свойств элементов (в разных справочниках свойства элементов различны).
Другой особенностью кластерной системы химических элементов является то, что все элементы в ней связаны по парам, т.е все они парные – нечетные с четными. Парность (двоичность) элементов наглядно подтверждается в s-,p-,d-,f-,g-группах, в которых все элементы располагаются по парам: H с He, Li с Be, B с C,N с O и т.д. Это положение широко распространено в Природном и техногенном мире.
В данной работе использовано положение геохимии о распространенности и устойчивости нечетных и четных элементов в земной коре и метеоритах.
Д.И.Менделеев первым отметил сложение вещества земной коры в основном легкими элементами по Fe включительно, а элементы, стоящие в Периодической системе после Fe , в сумме составляют лишь доли процента. «Наибольшим распространением в Природе пользуются элементы лишь малого атомного веса» (1895 г.).
При этом четные элементы более устойчивы, чем нечетные, что определяется структурой ядер и электронных оболочек. Это положение подтверждается в геохимии правилом Оддо-Гаркинса, которые установили сильное преобладание четных элементов над нечетными на Земле и в метеоритах, возраст которых составляет 4,5 млрд.лет. Так, в земной коре четные элементы составляют 86,5% общей массы коры. В железных метеоритах четные элементы составляют 92,22%, а в каменных – 97,69% [2].
Правило Оддо-Гаркинса проявляется и в составе двух главнейших магм Земли: в кислой магме присутствуют преимущественно нечетные элементы: H(1), Li93), B(5), F(9), Na(11), Cl(17), K(19), а в основной магме преобладают четные элементы: Mg(12), Ca(20), Ti(22), Cr(24), Fe(26), Ni(28). В скобках приведены порядковые номера элементов в Периодической системе элементов Д.И.Менделеева, которые неизменны. В целом распространенность элементов и их устойчивость уменьшается от более легких к более тяжелым почти по экспоненциальному закону, различному для элементов с нечетными и четными атомными номерами.
Кроме того, в работе использовано положение диалектики о том, что раздвоение единого целого является сущностью теории познания [15]. Для этого Периодическая система элементов Д.И.Менделеева была разделена на нечетные и четные элементы с определением по отдельности их свойств с использованием компьютерной программы искусственного интеллекта [3,4]. Установлены следующие зависимости изменения свойств нечетных и четных элементов:
1. Атомный радиус.
Общей закономерностью является уменьшение атомного радиуса в ряду s > p < в < f–элементов. При этом у четных элементов атомный радиус меньше, чем у нечетных (кроме р-элементов). Средний атомный радиус нечетных и четных элементов следующий (пм):
элементы нечетные четные
s – 203,12 176,00
p – 132,77 144,72
d – 148,05 142,20
f – 178,33
176,20
среднее: 165,56 159,78
2. Плотность.
В целом плотность в ряду s > p > в > f–элементов имеет тенденцию к возрастанию, особенно у четных элементов.
3. Температура плавления элементов.
В целом температура плавления элементов в ряду s > p > в > f возрастает, особенно у четных элементов.
4. Температура плавления оксидов.
Наиболее высокую температуру плавления имеют четные s, p, d, f-элементы, особенно после №100.
Таким образом, в зависимости от электронного строения внешних оболочек свойства элементов в общем зависят скачкообразно, но с тенденцией уменьшения атомного радиуса, увеличения плотности и температуры плавления оксидов. Анализ этих данных показывает, что, например, для техногенных материалов – огнеупоров – целесообразно использовать оксиды из четных s, p и d-элементов до №56 – бария, а для сверхпроводников – четные элементы в кластерах [17-19].
В целом изучение кластерной системы химически элементов позволит дополнительно расширить определение взаимосвязи свойств существующих и прогнозных элементов с использованием впервые кластеров элементов и электронных ячеек с целью создания новых кластерных содинений, веществ, материалов и изделий: кластерных сверхпроводников, топливных элементов, кластерных огнеупоров, спецкерамики и др.
Создание кластерных изделий необходимо производить по микро-, нано- и пикотехнологиям с использованием компьютерных программ искусственного интеллекта.
Выводы
1. Приведена кластерная система химических элементов до атомного номера №220. В ней определены свойства кластерных элементов и электронных ячеек.
2. Использование кластеров химических элементов и электронных ячеек открывает новые возможности дополнительного изучения взаимосвязи свойств элементов, расчета прогнозных свойств новых элементов и создания новых кластерных материалов и изделий.
Литература
1. Волков А.И.
Строение атомов и Периодический закон/-М.: Новое знание,2006.-196с.
2. Хорошавин Л.Б.
Оптимальная область огнеупоров в Периодической системе химических элементов/. Объединенный научный журнал.2005, №5, с.64-70. Сайт: http://refractoriesl.narod.ru
3. Хорошавин Л.Б., Щербатский В.Б.
Исследование взаимосвязи между свойствами химических элементов на основе Периодического закона./. Объединенный научный журнал. 2005, №5, с.71-81. Сайт: http://refractoriesl.narod.ru
4. Хорошавин Л.Б., Щербатский В.Б.
Исследование зависимости свойств химических элементов от их электронного строения на основе Периодического закона/. Объединенный научный журнал. 2005, №11, с.62-76. . Сайт: http://refractoriesl.narod.ru
5. Хорошавин Л.Б., Щербатский В.Б.
Элементы, стоящие до Периодической системы химических элементов Д.И.Менделеева/. Объединенный научный журнал. 2005, №12, с.77-85. Сайт: http://refractoriesl.narod.ru
6. Хорошавин Л.Б., Щербатский В.Б
. Управление электронами – основа изменения свойств химических элементов, соединений и веществ/. Объединенный научный журнал. 2005, №20, с.71-81. . Сайт: http://refractoriesl.narod.ru
7. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В.
Компьютерная гибридная модель расчета свойств химических элементов/. Объединенный научный журнал. 2005, №20, с.81-86. . Сайт: http://refractoriesl.narod.ru
8. Хорошавин Л.Б., Щербатский В.Б.
Электронная технология огнеупоров на основе Периодического закона/Журнал «Новые огнеупоры». 2005, №10, с.75-83. Сайт: http://refractoriesl.narod.ru
9. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В.
Октайдная и десятичная системы химических элементов/. Объединенный научный журнал. 2005, №30, с.60-67. . Сайт: http://refractoriesl.narod.ru
10. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Никитина Н.Ю.
От систем химических элементов до нанотехнологии материалов и изделий/. Объединенный научный журнал. 2005, №32, с.67-76. . Сайт: http://refractoriesl.narod.ru
11. Хорошавин Л.Б.,
Щербатский В.Б. Якушина Е.В.
Сопоставление различных систем химических элементов/. Объединенный научный журнал. 2006, №3, с.88-100. . Сайт: http://refractoriesl.narod.ru
12. Хорошавин Л.Б.,
Щербатский В.Б. Якушина Е.В.
Ячеистая структура десятичной системы химических элементов/. Объединенный научный журнал. 2006, №9, с.64-72. . Сайт: http://refractoriesl.narod.ru
13. Хорошавин Л.Б.,
Щербатский В.Б.
Электронные ячейки и кластеры химических элементов./Объединенный научный журнал. 2008, №6, с.55-63. Сайт: http://refractoriesl.narod.ru
14. Егоров В.В.
Теоретические основы неорганической химии. СПб.: Изд-во «Лань», 2005.- 192с.
15. Хорошавин Л.Б.
Диалектика огнеупоров./ Л.Б.Хорошавин. Екатеринбург: Изд-во Екатеринбургская Ассоциация Малого бизнеса, 1999. -359с.
16. Хорошавин Л.Б., Щербатский В.Б.
Гармоничные кварки в электронах и протонах./Объединенный научный журнал. 2008, №10, с.51-53. Сайт: http://refractoriesl.narod.ru
17. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В.
Исследование свойств сверхпроводников на основе компьютерных программ/ Объединенный научный журнал. 2006, №24, с.62-69. . Сайт: http://refractoriesl.narod.ru
18. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В.
Мультиэлектрон – основа сверхпроводимости./ Объединенный научный журнал. 2007, №2, с.68-76. . Сайт: http://refractoriesl.narod.ru
19. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В., Дьячкова Т.В.
Мультиэлектронная теория сверхпроводимости./ Объединенный научный журнал. 2007, №17, с43-56. . Сайт: http://refractoriesl.narod.ru
20. Дерунов В.
Отзыв на мультиэлектронную теорию сверхпроводимости. . Сайт: http://refractoriesl.narod.ru

Уважаемая редакция!
 Прошу опубликовать мою статью: «Кластерная система химических элементов». Прошу опубликовать мою статью: «Кластерная система химических элементов».
С уважением Л.Б.Хорошавин
Тел. 8-922-13-33-862
|