| ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«МАТИ» - РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ
УНИВЕРСИТЕТ имени К.Э. ЦИОЛКОВСКОГО
Кафедра «Материаловедение и технология обработки материалов»
КУРСОВАЯ РАБОТА
по дисциплине «Термодинамика в материаловедении»
на тему: «Термодинамический анализ фазовых равновесий в двухкомпонентной системе с полиморфным компонентом
A, конгруэнтно плавящимся соединением
AB и инконгруэнтно плавящимся соединением
AB
3»
Выполнил: Алфёров М.О.
Группа: 4МТМ-3ДБ-019
Проверил: Дзунович ..
Москва-2010
Содержание:
- Характеристика фаз системы. Нонвариантные равновесия ………………….. 5
- Построение диаграммы состояния системы А-В ……………………………….. 6
- Построение диаграммы состояния системы А-В по процентному содержанию атомов компонента В ………………………………………......6
- Построение диаграммы состояния системы А-В по процентному содержанию (по массе) компонента В …………………………………….10
- Термодинамический анализ однокомпонентных систем ……………………….12
- Изменение свободных энергий Гиббса, в зависимости от
температуры, фаз компонента
A ………………………………………………12
- Изменение свободных энергий Гиббса, в зависимости от
температуры, фаз компонента
B ……………………………………………… 14
- Термодинамический анализ фазовых равновесий в двухкомпонентной
системе А-В при температурах 400°, 670°, 900° …………………………………. 16
- Построение концентрационной зависимости свободной
энергии Гиббса для системы А-В при температуре 900° ………………. 17
- Построение концентрационной зависимости свободной
энергии Гиббса для системы А-В при температуре 670° ……………….. 19
- Построение концентрационной зависимости свободной
энергии Гиббса для системы А-В при температуре 400° ………………...21
- Анализ фазовых превращений и определение количества фаз и структурных составляющих ………………………………………………………………………...23
- Кристаллизация и расчёт количества фаз и структурных
составляющих сплава
X
1
(12%
B
) ……..……………………………………..23
- Кристаллизация и расчёт количества фаз и структурных
составляющих сплава
X
2
(79%
B
) ………………………………………….. 26
- Кристаллизация и расчёт количества фаз и структурных
составляющих сплава
X
3
(93%
B
) ………………………………………….. 30
6. Построение графических зависимостей изменения относительного количества фаз и процентного содержания компонента В в фазах от температуры при охлаждении сплава 12 % (по массе) В из жидкого состояния …………………..33
- Построение зависимости изменения относительного
количества фаз сплава, содержащего 12 % (по массе)
компонента В, в зависимости от температуры …………………………. 33
- Построение зависимости изменения процентного содержания компонента В в фазах сплава, содержащего 12 % (по массе)
компонента В, в зависимости от температуры …………………………..36
7. Список литературы…………………………………………………………………….39
1 Характеристика фаз и компонентов системы. Нонвариантные равновесия
Данная двухкомпонентная система А-В состоит из двух компонентов:
A – полиморфный компонент с температурой плавления 1400°С и полиморфным превращением при температуре 900°С;
B – изоморфный компонент с температурой плавления 300°С;
Данная двухкомпонентная система А-В состоит из шести основных фаз:
L – жидкий раствор компонента А и В друг в друге с неограниченной растворимостью;
a - твердый раствор на основе низкотемпературной модификации компонента А; предельная растворимость компонента B в компоненте A
γ – твердый раствор на основе высокотемпературной модификации компонента B в компонете A;
АВ - промежуточная конгруэнтно плавящаяся фаза постоянного состава;
АВ3
- промежуточная инконгруэнтно плавящаяся фаза переменного состава
b – твердый раствор компонента А на основе компонета В ;
Нонвариантные равновесия:
1) Эвтектическое нонвариантное равновесие:
Температура эвтектического нонвариантного равновесия 550°С
Эвтектическая реакция: 
2) Перитектические нонвариантные равновесия:
Температура перитектического нонвариантного равновесия 700°С
Перитектическая реакция: 
Температура перитектического нонвариантного равновесия 400°С
Перитектическая реакция: 
3) Метатектическое нонвариантное равновесие:
Температура метатектического нонвариантного равновесия 650°С
Метатектическая реакция: 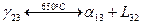
2 Построение диаграммы состояния системы А-В.
(в % атомных компонента В и % (по массе) компонента В)
Построение диаграммы состояния системы А-В по процентному содержанию атомов компонента В:
1) Выбираем масштаб для построения диаграммы:
- по оси абсцисс откладываем количество компонента В в процентах (от 0% до 100%);
- по оси ординат откладываем температуру в градусах Цельсия, начиная от 0°С;
2) Наносим температуру плавления полиморфного компонента А (1400°С), температуру его полиморфного превращения (900°С) и температуру плавления изоморфного компонента В (300°С);
3) Найдем и нанесем на диаграмму процентное содержание атомов компонента В в инконгруэнтно плавящихся соединениях постоянного состава АВ и АВ3:
- для фазы АВ процентное содержание атомов компонента В составляет 50 атомных %;
- для фазы АВ3
процентное содержание атомов компонента В составляет 75 атомных %;
4) Проводим изотермы, соответствующие четырем нонвариантным равновесиям и наносим на них точки, соответствующие составу фаз нонвариантных равновесий, описанных в пункте 1;
5) Наносим область гомогенности δ (твердого раствора на основе соединения АВ2
). Максимальная протяжённость данной области по условию составляет 8 атомных % В.
6) Соединяем линией ликвидуса точку А′, заданную температурой плавления полиморфного компонента А (1400°С), соответствующую фазовому составу 0 атомных % компонента В, точку на линии метатектического нонвариантного равновесия (20 атомных % компонента В) при температуре 650°С, точку на линии перитектического нонвариантного равновесия (40 атомных % компонента В) при температуре 550°С, точку, соответствующую эвтектическому нонвариантному равновесию (75 атомных % компонента В) при температуре 400°С, соответствующую соединению AB3
(50 атомных % B) при температуре 700°С, точку на линии перитектического нонвариантного равновесия p2
(90 атомных % компонента В)
7) Соединяем линией трансуса точку полиморфного превращения компонента А -  , определяемую температурой полиморфного превращения компонента А (1400°С) и фазовым составом равным 0 атомных % компонента В с точками метатектического нонвариантного равновесия при температуре 650°С и составами, соответствующими 5 атомным % компонента В – и 13 атомным % компонента В ; , определяемую температурой полиморфного превращения компонента А (1400°С) и фазовым составом равным 0 атомных % компонента В с точками метатектического нонвариантного равновесия при температуре 650°С и составами, соответствующими 5 атомным % компонента В – и 13 атомным % компонента В ;
8) Линией солидуса соединяем точку заданную температурой плавления полиморфного компонента A (1400°С) с фазовым составом 0 атомных % компонента В – A′ на линии метатектического нонвариантного равновесия (700°С) с фазовым составом компонента В равным 13 атомных %;
Линией солидуса соединяем точку a1
на линии перитектического нонвариантного равновесия (650°С) с фазовым составом 10 атомных % компонента В с точкой a2
на линии перитектического нонвариантного равновесия (550°С) с фазовым составом компонента В равным 10 атомных %;
Линией солидуса соединяем соответствующую соединению AB (50 атомных % B) при температуре 1500°С линии эвтектического нонвариантного равновесия (550°С) с фазовым составом компонента В равным 50 атомных % и точкой a3
на линии перитектического нонвариантного равновесия (700°С) с фазовым составом компонента B равным 75 атомных %;
9) Линией солидуса соединяем на линии перитектического нонвариантного равновесия (700°С) с фазовым составом 82 атомных % компонента В с точкой В′, заданную температурой плавления изоморфного компонента В (300°С), соответствующую фазовому составу 100 атомных % компонента В;
10) Линией сольвуса соединяем точку на линии перитектического нонвариантного равновесия (400°С) с фазовым составом 13 атомных % компонента В с точкой, определяемую фазовым составом компонента В равным 1 атомных % при температуре 0°С;
Построим диаграмму состояния системы А-В по процентному содержанию атомов компонента В (Рис. 1).
Рис1
Построение диаграммы состояния системы А-В по процентному содержанию (по массе) компонента В:
Построим диаграмму с учетом пересчета всех точек из % атомных компонента В в процент (по массе) компонента В. Построение произведем исходя из результатов, занесенных в таблицу 1.
Таблица 1.
Пересчет из % атомных компонента В в % (по массе) компонента В.
| В % ат. B
|
2
|
10
|
13
|
23
|
32
|
38
|
50
|
75
|
82
|
87
|
94
|
99
|
| В % (по массе) В
|
2
|
11
|
14
|
25
|
33
|
41
|
53
|
78
|
84
|
89
|
95
|
99
|
Для пересчета использовались следующие формулы и данные:
- формула перевода:
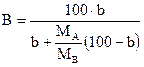 , ,
где В - % (по массе) компонента В,
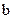 - % атомный В, - % атомный В,
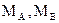 - атомные массы компонентов А и В соответственно. - атомные массы компонентов А и В соответственно.
- исходные данные:
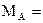 16 16
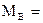 18 18
Строим диаграмму, на концентрационной оси указываем % по массе компонента В. (Рис. 2).
Рис2
3 Термодинамический анализ однокомпонентных систем
Построение кривых изменения свободных энергий Гиббса фаз в зависимости от температуры для компонентов А и В:
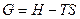
1. Энтропия всегда положительна и возрастает с увеличением температуры. Поэтому G с повышением температуры уменьшается и кривая G(T) обращена выпуклостью вверх.
2. Если компонент полиморфный, то в твердом состоянии существует по крайней мере 2 фазы и каждая из этих имеет свой термодинамический потенциал (свободную энергию) и они изменяются по своим законам.
3. Если сравнить температурные зависимости свободной энергии для двух фаз системы, то наклон кривых к оси температур будет различным из-за различия энтропий, поэтому кривые должны пересекаться и наклон кривых будет больше у той, у которой больше S.
Степень разупорядоченности частиц в жидкой фазе выше по сравнению со степенью разупорядоченности частиц в твердой фазе того же химического состава. Поэтому для однокомпонентной системы всегда выполняется неравенство:
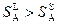 
Поэтому кривая G(T) для жидкой фазы снижается резче, чем для твердой фазы. Точка пересечения этих кривых соответствует температуре фазового превращения.
Изменение свободных энергий Гиббса, в зависимости от температуры, фаз компонента
A:
При построение кривых свободных энергий Гиббса учитываем, что компонент A является полиморфным. Точка пересечения кривой 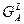 с кривой с кривой  должна проецироваться в точку, соответствующую температуре плавления должна проецироваться в точку, соответствующую температуре плавления 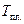 , равную 1400°С. А точка пересечения кривой , равную 1400°С. А точка пересечения кривой 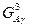 с кривой с кривой 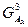 должна проецироваться в точку, соответствующую температуре полиморфного превращения должна проецироваться в точку, соответствующую температуре полиморфного превращения 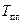 , равную 900°С. , равную 900°С.
Изменение свободных энергий Гиббса фаз от температуры для компонента A представлено на Рис. 3.
Рис3
Анализ энергий Гиббса для компонента
A при температурах 900°С 670°С и 400°С.
-
При 900°:
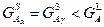
Термодинамически стабильными будут твердые фазы компонента A – 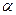 и и  . .
- При 670°:
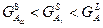
Термодинамически стабильными будут твердые фазы компонента A – 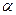
- При 400°:
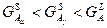
Термодинамически стабильной будет твердая фаза компонента A –  . .
Изменение свободных энергий Гиббса, в зависимости от температуры, фаз компонента
B:
При построение кривых свободных энергий Гиббса учитываем, что компонент B является изоморфным. Точка пересечения кривой 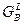 с кривой с кривой 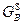 должна проецироваться в точку, соответствующую температуре фазового (плавления) должна проецироваться в точку, соответствующую температуре фазового (плавления) 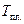 , равную 300°С. , равную 300°С.
Изменение свободных энергий Гиббса фаз от температуры для компонента B представлено на Рис. 4.
Анализ энергий Гиббса для компонента
B при температурах 900°С 670°С и 400°С.
-
При 900°:

Термодинамически стабильной будет жидкая фаза L.
- При 670°:

Термодинамически стабильной будет жидкая фаза L.
- При 400°:

Термодинамически стабильной будет твердая фаза B – β.
Рис4
4 Термодинамический анализ фазовых равновесий в двухкомпонентной системе А-В при температурах 550°, 700°, 900°
В системе существует 6 фаз:
A – полиморфный компонент с температурой плавления 1200°С и полиморфным превращением при температуре 900°С;
B – изоморфный компонент с температурой плавления 600°С;
Данная двухкомпонентная система А-В состоит из шести основных фаз:
L – жидкий раствор компонента А и В друг в друге с неограниченной растворимостью;
a - твердый раствор на основе низкотемпературной модификации компонента А; предельная растворимость компонента B в компоненте A составляет 8%, растворимость при комнатной температуре составляет 2%;
γ – твердый раствор на основе высокотемпературной модификации компонента А;
А2
В - промежуточная инконгруэнтно плавящаяся фаза постоянного состава;
АВ2
- промежуточная конгруэнтно плавящаяся фаза переменного состава, область гомогенности составляет 8%;
b – твердый раствор на основе высокотемпературной модификации компонента B; предельная растворимость компонента B в компоненте A составляет 76%, растворимость при комнатной температуре составляет 99%;
Для построения концентрационной зависимости свободной энергии Гиббса при любой температуре сначала проведем ось абсцисс(оси концентраций) и ось ординат (свободной энергии Гиббса). Нанесём свободные энергии Гиббса для фаз чистых компонентов А и В, сохраняя при этом их относительные величины.
Условием гетерофазного равновесия является равенство химических потенциалов:
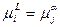
Что соответствует равенству первых производных термодинамического потенциала по концентрации, так как:
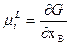
Построение концентрационной зависимости свободной энергии Гиббса для системы А-В при температуре 900°, при которой протекает перитектическая реакция:
 ; ; 
Кривая, изображающая зависимость свободной энергии Гиббса для жидкости, будет иметь два минимума, так как в системе присутствует конгруэнтно и инконгруэнтно правящиеся фазы.
1) Касательной к кривой, изображающей зависимость свободной энергии Гиббса , провести нельзя. , провести нельзя.
2) Так как , то кривые, изображающие зависимость свободной энергии Гиббса , то кривые, изображающие зависимость свободной энергии Гиббса 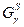 и и 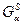 выходят из одной точки на оси ординат; выходят из одной точки на оси ординат;
3) Так как  , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса 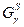 и и 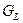 имеют общую касательную; имеют общую касательную;
4)Так как 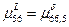 , то кривая, изображающая зависимость свободной энергии Гиббса , то кривая, изображающая зависимость свободной энергии Гиббса 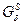 и и 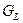 имеют общую касательную. имеют общую касательную.
5) Касательной к кривой, изображающей зависимость свободной энергии Гиббса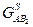 , провести нельзя. , провести нельзя.
6) Так как  , то кривая, изображающая зависимость свободной энергии Гиббса , то кривая, изображающая зависимость свободной энергии Гиббса 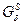 , ,  и и 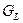 имеют общую касательную. имеют общую касательную.
Концентрационная зависимость свободной энергии Гиббса для системы А-В при температуре 900°С показана на рис.5 и представляет собой ломанную линию 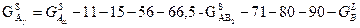 , состоящую из трёх прямых и пяти изогнутых линий, образуя при этом следующие фазовые области: , состоящую из трёх прямых и пяти изогнутых линий, образуя при этом следующие фазовые области:
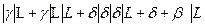
Концентрационная зависимость свободных энергий Гиббса при температуре 900° C представлена на рис.5
Рис5
Построение концентрационной зависимости свободной энергии Гиббса для системы А-В при температуре 750°С.
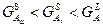 ; ; 
Кривая, изображающая зависимость свободной энергии Гиббса для жидкости, будет иметь три минимума, так как в системе присутствует конгруэнтно и инконгруэнтно правящиеся фазы.
1) Так как  , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса  и и 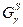 имеют общую касательную; имеют общую касательную;
2) Так как 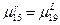 , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса 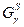 и и 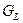 имеют общую касательную; имеют общую касательную;
3)Так как 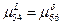 , то кривая, изображающая зависимость свободной энергии Гиббса , то кривая, изображающая зависимость свободной энергии Гиббса 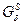 и и 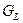 имеют общую касательную. имеют общую касательную.
5) Касательной к кривой, изображающей зависимость свободной энергии Гиббса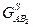 , провести нельзя. , провести нельзя.
6) Так как 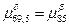 , то кривая, изображающая зависимость свободной энергии Гиббса , то кривая, изображающая зависимость свободной энергии Гиббса 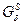 и и  имеют общую касательную. имеют общую касательную.
7) Так как 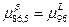 , то кривая, изображающая зависимость свободной энергии Гиббса , то кривая, изображающая зависимость свободной энергии Гиббса 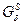 , ,  и и 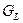 имеют общую касательную. имеют общую касательную.
Концентрационная зависимость свободной энергии Гиббса для системы А-В при температуре 750°С показана на рис.6 и представляет собой ломанную линию 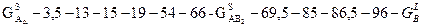 , состоящую из пяти прямых и семи изогнутых линий, образуя при этом следующие фазовые области: , состоящую из пяти прямых и семи изогнутых линий, образуя при этом следующие фазовые области:
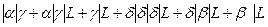
Концентрационная зависимость свободных энергий Гиббса при температуре 750° C представлена на рис.6
Рис6
Построение концентрационной зависимости свободной энергии Гиббса для системы А-В при температуре 550°:
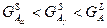 ; ; 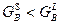
Кривая, изображающая зависимость свободной энергии Гиббса для жидкости, будет иметь два минимума, так как в системе присутствует конгруэнтно и инконгруэнтно правящиеся фазы.
1) Касательной к кривой, изображающей зависимость свободной энергии Гиббса  , провести нельзя. , провести нельзя.
2) Так как 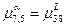 , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса 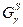 и и 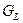 имеют общую касательную; имеют общую касательную;
3) Так как 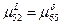 , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса  и и 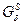 имеют общую касательную; имеют общую касательную;
4) Так как  , то кривые изображающие зависимость свободной энергии Гиббса , то кривые изображающие зависимость свободной энергии Гиббса 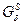 и и  имеют общую касательную; имеют общую касательную;
Концентрационная зависимость свободной энергии Гиббса для системы А-В при температуре 550°С показана на рис. 7 и представляет собой ломанную линию  , состоящую из трех прямых и пяти изогнутых линий, образуя при этом следующие фазовые области: , состоящую из трех прямых и пяти изогнутых линий, образуя при этом следующие фазовые области:
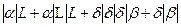
Концентрационная зависимость свободных энергий Гиббса при температуре 550° C представлена на рис.7
Рис7
5 Анализ фазовых превращений и определение количества фаз и структурных составляющих в сплавах 12%, 79%, 93%
I. Рассмотрим процессы фазовых превращений, проходящих при кристаллизации сплава 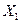 , содержащего 12% (по массе) компонента В, остальное А. , содержащего 12% (по массе) компонента В, остальное А.
1. До температуры 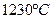 охлаждается жидкий раствор охлаждается жидкий раствор  состава 12% (по массе) компонента В, остальное А. состава 12% (по массе) компонента В, остальное А.
2. При температуре  жидкость становится насыщенной, и из неё начинают выделяться кристаллы жидкость становится насыщенной, и из неё начинают выделяться кристаллы  . Кристаллы . Кристаллы  продолжают выделяться до температуры продолжают выделяться до температуры 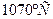 . Проводим дополнительную конноду . Проводим дополнительную конноду 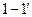 . Состав жидкости изменяется по линии ликвидуса от точки . Состав жидкости изменяется по линии ликвидуса от точки 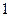 до точки n с концентрациями 5 и 12 % по массе компонента до точки n с концентрациями 5 и 12 % по массе компонента  соответственно. Состав выделяющихся кристаллов соответственно. Состав выделяющихся кристаллов  изменяется по линии солидуса от точки изменяется по линии солидуса от точки  до точки m с концентрациями 3 и 12 % по массе компонента до точки m с концентрациями 3 и 12 % по массе компонента  соответственно. Кристаллы соответственно. Кристаллы  выделяются по реакции: выделяются по реакции:
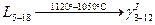
3. В интервале температур 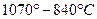 охлаждается однофазный сплав охлаждается однофазный сплав  , который не имеет фазовых превращений в данном интервале температур , который не имеет фазовых превращений в данном интервале температур
4. После охлаждения кристаллов  , происходит полиморфное превращение высокотемпературной модификации , происходит полиморфное превращение высокотемпературной модификации  в низкотемпературную модификацию в низкотемпературную модификацию 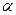 . Проведём дополнительную конноду . Проведём дополнительную конноду  . Состав . Состав  фазы изменяется по линии трансуса от точки 3 до точки m, с концентрациями 5 и 12 % по массе компонента B, остальное А. Состав фазы изменяется по линии трансуса от точки 3 до точки m, с концентрациями 5 и 12 % по массе компонента B, остальное А. Состав  фазы изменятся по линии трансуса от точки 3` до точки a1
, с концентрациями 0,5 и 4 % по массе компонента В. Процесс протекает до температуры фазы изменятся по линии трансуса от точки 3` до точки a1
, с концентрациями 0,5 и 4 % по массе компонента В. Процесс протекает до температуры 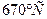 . Превращение протекает по следующей реакции: . Превращение протекает по следующей реакции:
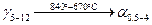
5. При температуре  жидкость жидкость  и кристаллы и кристаллы  принимают метатектический состав. При этом из твёрдого раствора принимают метатектический состав. При этом из твёрдого раствора  начинают образовываться кристаллы начинают образовываться кристаллы  и жидкость L: и жидкость L:
для полного расхода фаз 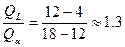
в нашем случае 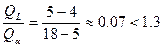 , следовательно в избытке L , следовательно в избытке L
Метатектическая реакция проходит следующим образом:

6. В интервале температур 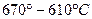 охлаждается однофазный сплав охлаждается однофазный сплав 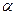 , который не имеет фазовых превращений в данном интервале температур. , который не имеет фазовых превращений в данном интервале температур.
7. При температуре  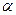 - твердый раствор становится насыщенным и при дальнейшем охлаждении до комнатной температуры, вследствие уменьшения растворимости в твёрдом состоянии. Проводим конноду - твердый раствор становится насыщенным и при дальнейшем охлаждении до комнатной температуры, вследствие уменьшения растворимости в твёрдом состоянии. Проводим конноду 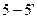 . Состав . Состав 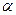 фазы изменяется по линии сольвуса от точки 5 до точки на оси концентраций фазы изменяется по линии сольвуса от точки 5 до точки на оси концентраций  , с концентрациями 5 и 2 % по массе компонента В соответственно. Из , с концентрациями 5 и 2 % по массе компонента В соответственно. Из 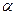 выделяются вторичные кристаллы выделяются вторичные кристаллы 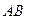 по реакции: по реакции:
6.1. Фазы: 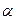 , ,  . .
6.2. Количества фаз:

7.1. Структурные составляющие: 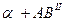
7.2. Количества структурных составляющих:
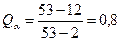
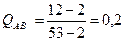
Рис8
II. Рассмотрим фазовые превращения в сплаве 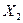 , содержащем 79% по массе компонента В, остальное А, при его охлаждении до комнатной температуры. , содержащем 79% по массе компонента В, остальное А, при его охлаждении до комнатной температуры.
1. До температуры 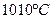 охлаждается жидкий раствор охлаждается жидкий раствор  состава 79% (по массе) компонента В, остальное А. состава 79% (по массе) компонента В, остальное А.
2. При температуре 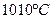 жидкость становится насыщенной, и из неё начинают выделяться кристаллы жидкость становится насыщенной, и из неё начинают выделяться кристаллы  . Кристаллы . Кристаллы  продолжают выделяться до температуры продолжают выделяться до температуры 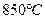 . Проводим дополнительную конноду . Проводим дополнительную конноду 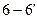 . Состав жидкости изменяется по линии ликвидуса от точки 6 до точки n с концентрациями 10 и 18 % по массе компонента . Состав жидкости изменяется по линии ликвидуса от точки 6 до точки n с концентрациями 10 и 18 % по массе компонента  соответственно. Состав выделяющихся кристаллов соответственно. Состав выделяющихся кристаллов  изменяется по линии солидуса от точки изменяется по линии солидуса от точки 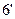 до точки m с концентрациями 6 и 12 % по массе компонента до точки m с концентрациями 6 и 12 % по массе компонента  соответственно. Кристаллы соответственно. Кристаллы  выделяются по реакции: выделяются по реакции:

3. В интервале температур 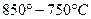 охлаждается однофазный сплав охлаждается однофазный сплав  , который не имеет фазовых превращений в данном интервале температур , который не имеет фазовых превращений в данном интервале температур
4. После охлаждения кристаллов  , происходит полиморфное превращение высокотемпературной модификации , происходит полиморфное превращение высокотемпературной модификации  в низкотемпературную модификацию в низкотемпературную модификацию 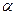 . Проведём дополнительную конноду . Проведём дополнительную конноду  . Состав . Состав  фазы изменяется по линии трансуса от точки 8 до точки m, с концентрациями 10 и 12 % по массе компонента B, остальное А. Состав фазы изменяется по линии трансуса от точки 8 до точки m, с концентрациями 10 и 12 % по массе компонента B, остальное А. Состав 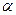 фазы изменятся по линии трансуса от точки 3` до точки a1
, с концентрациями 2 и 4 % по массе компонента В. Процесс протекает до температуры фазы изменятся по линии трансуса от точки 3` до точки a1
, с концентрациями 2 и 4 % по массе компонента В. Процесс протекает до температуры 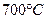 . Превращение протекает по следующей реакции: . Превращение протекает по следующей реакции:
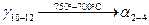
5. При температуре 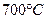 жидкость жидкость  и кристаллы и кристаллы  принимают метатектический состав. При этом из твёрдого раствора принимают метатектический состав. При этом из твёрдого раствора  начинают образовываться кристаллы начинают образовываться кристаллы 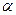 и жидкость L: и жидкость L:
для полного расхода фаз 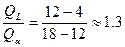
в нашем случае 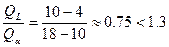 , следовательно в избытке L , следовательно в избытке L
Метатектическая реакция проходит следующим образом:
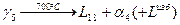
6. В интервале температур  из избыточной фазы L начинают образовываться кристаллы a. Состав жидкости изменяется по линии ликвидуса от точки n до точки p1
с концентрациями 18 и 35 % по массе компонента из избыточной фазы L начинают образовываться кристаллы a. Состав жидкости изменяется по линии ликвидуса от точки n до точки p1
с концентрациями 18 и 35 % по массе компонента  соответственно. Состав выделяющихся кристаллов соответственно. Состав выделяющихся кристаллов 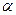 изменяется по линии солидуса от точки a1
до точки a2
с концентрациями 4 и 8 % по массе компонента изменяется по линии солидуса от точки a1
до точки a2
с концентрациями 4 и 8 % по массе компонента  соответственно. Кристаллы соответственно. Кристаллы 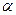 выделяются по реакции: выделяются по реакции:

7. При температуре 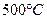 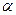 фаза и жидкость принимают перитектический состав. При протекании данной реакции происходит выделение кристаллов фаза и жидкость принимают перитектический состав. При протекании данной реакции происходит выделение кристаллов  . Эта реакция проходит с избытком твёрдой фазы: . Эта реакция проходит с избытком твёрдой фазы:
для полного расхода 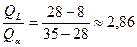
в нашем случае  , следовательно твёрдая фаза a в избытке. , следовательно твёрдая фаза a в избытке.
Реакция имеет следующий вид:
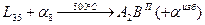
8. При дальнейшем охлаждении от температуры  и до комнатной температуры из и до комнатной температуры из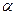 выделяются вторичные кристаллы выделяются вторичные кристаллы 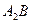 по реакции. Состав по реакции. Состав 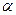 фазы изменяется по линии сольвуса от точки a2
до точки на оси концентраций фазы изменяется по линии сольвуса от точки a2
до точки на оси концентраций  , с концентрациями 8 и 2 % по массе компонента В соответственно. , с концентрациями 8 и 2 % по массе компонента В соответственно.
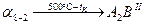
Рис9
7.1. Фазы: 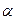 , , 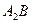 . .
7.2. Количества фаз:

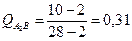
8.1.Структура: 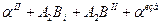
8.2. Количества структурных составляющих.


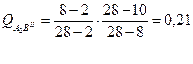
III. Рассмотрим фазовые превращения при охлаждении сплава 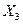 , содержащего 30% по массе компонента В, остальное А. , содержащего 30% по массе компонента В, остальное А.
1. До температуры 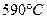 охлаждается однофазный жидкий раствор охлаждается однофазный жидкий раствор 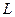 состава состава  (по массе) компонента В, остальное А. (по массе) компонента В, остальное А.
2. В интервале температур  из избыточной фазы L начинают образовываться кристаллы a. Проведём дополнительную конноду из избыточной фазы L начинают образовываться кристаллы a. Проведём дополнительную конноду 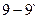 .Состав жидкости изменяется по линии ликвидуса от точки 9 до точки p1
с концентрациями 30 и 35 % по массе компонента .Состав жидкости изменяется по линии ликвидуса от точки 9 до точки p1
с концентрациями 30 и 35 % по массе компонента 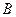 соответственно. Состав выделяющихся кристаллов соответственно. Состав выделяющихся кристаллов 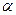 изменяется по линии солидуса от точки 9` до точки a2
с концентрациями 5 и 8 % по массе компонента изменяется по линии солидуса от точки 9` до точки a2
с концентрациями 5 и 8 % по массе компонента  соответственно. Кристаллы соответственно. Кристаллы 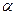 выделяются по реакции: выделяются по реакции:
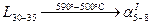
3. При температуре  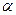 фаза и жидкость принимают перитектический состав. При протекании данной реакции происходит выделение кристаллов фаза и жидкость принимают перитектический состав. При протекании данной реакции происходит выделение кристаллов  . Эта реакция проходит с избытком жидкой фазы : . Эта реакция проходит с избытком жидкой фазы :
для полного расхода 
в нашем случае  , следовательно жидкая фаза в избытке. , следовательно жидкая фаза в избытке.
Реакция имеет следующий вид:

4. После завершения перитектической реакции, при температуре 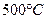 из избыточной жидкой фазы начинают выделяться кристаллы из избыточной жидкой фазы начинают выделяться кристаллы  . Кристаллы . Кристаллы  выделяются вплоть до температуры выделяются вплоть до температуры  . Состав жидкости изменяется по линии ликвидуса . Состав жидкости изменяется по линии ликвидуса 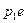 от 35 и 44 % по массе компонента от 35 и 44 % по массе компонента 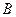 соответственно. Состав выделяющихся кристаллов постоянен (28 % по массе компонента соответственно. Состав выделяющихся кристаллов постоянен (28 % по массе компонента  ). Кристаллы ). Кристаллы 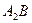 выделяются по реакции: выделяются по реакции:
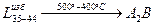
5. При достижении  жидкость принимает эвтектический состав и из неё выделяются кристаллы A2
B и d(AB2
). Реакция проходит с избытком A2
B: жидкость принимает эвтектический состав и из неё выделяются кристаллы A2
B и d(AB2
). Реакция проходит с избытком A2
B:
для полного расхода 
в нашем случае  , ,
Реакция имеет следующий вид:

6. После завершения эвтектической реакции идёт выделение вторичных кристаллов A2
B из  . Состав в меняется по линии ликвидуса от точки . Состав в меняется по линии ликвидуса от точки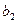 до точки до точки 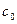 с концентрациями 58 и 60 % по массе В соответственно. Состав выделяющихся кристаллов постоянен (28 % по массе компонента с концентрациями 58 и 60 % по массе В соответственно. Состав выделяющихся кристаллов постоянен (28 % по массе компонента  ).Процесс идёт вплоть до комнатной температуры: ).Процесс идёт вплоть до комнатной температуры:

8.1. Фазы:  , A2
B , A2
B
8.2. Количества фаз:
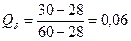

9.1. Структура: A2
B+(A2
B+δ)э
+A2
BII
9.2. Количества структурных составляющих:
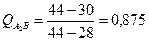


Рассчитаем количества структурных составляющих, исходя из того, что масса данного сплава равна 5 килограммам:
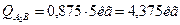
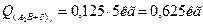
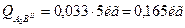
Рис10
6 Построение графических зависимостей изменения относительного количества фаз и процентного содержания компонента В в фазах
от температуры при охлаждении сплава 10 % (по массе) В
из жидкого состояния
Для построения графических зависимостей нанесем на диаграмму состояния системы А-В сплав содержащий 10 % (по массе) компонента В, смотри рис. 11.
Построение зависимости изменения относительного количества фаз сплава, содержащего 10 % (по массе) компонента В, в зависимости от температуры:
- до температуры 1010°С:
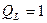 , ,
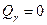 ; ;
- при температуре 950°С:
 , ,
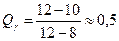 ; ;
- при температуре 850°С:
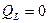 , ,
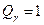 ; ;
- при температуре 750°С:
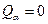 , ,
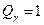 ; ;
- при температуре 730°С:
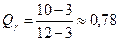 ; ;
 ; ;
- при температуре 700°С:
а) до начала метатектической реакции
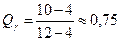 , ,
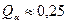
б) после завершения метатектической реакции
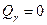


- при температуре 600°С:

 ; ;
- при температуре 500°С:
а) до начала перитектической реакции
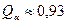 , ,
 ; ;
б) после завершения перитектической реакции
 , ,
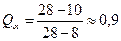 , ,
 ; ;
- при температуре 310°С:
 , ,
 ; ;
- при t°комн
:

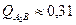
На рис. 11 показана зависимость изменения относительного количества фаз от температуры.
Рис11
Построение зависимости изменения процентного содержания компонента В в фазах сплава, содержащего 10 % (по массе) компонента В, в зависимости от температуры:
L – жидкий раствор компонентов А и В друг в друге с неограниченной растворимостью:
- до температуры 1010°С жидкость имеет состав равный 10 % компонента В,
- в интервале температур 1010°С ÷ 850°С жидкость L меняет свой состав по линии ликвидуса (6n) от 10 % В до 15 % В,
- При температуре 700°С жидкость участвует в метатектической реакции, после протекания которой жидкость в дальнейшем охлаждении до 500°С изменяет свой состав по линии ликвидуса (np1
) от 18 до 35 %B. По завершению реакции жидкость полностью кристаллизуется.
γ – твердый раствор на основе высокотемпературной модификации компонента А:
- появляется при температуре 1010°С. В интервале температур 1010°С - 850°С твердый раствор γ изменяет свой состав по линии солидуса (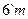 ) от 6% В до 10% В, ) от 6% В до 10% В,
- в интервале температур 850°С-750°С охлаждается и не изменяет свой состав;
- при температуре 750°С и до температуры 700°С из γ начинают выделяться кристаллы α. Состав γ изменяется по линии солидуса (8m) от 10% до 12% B;
- при температуре 700°С γ участвует в метатектической реакции, по завершению которой данная фаза полностью исчезает.
α – твердый раствор на основе низкотемпературной модификации компонента А:
- появляется при температуре 750°С. В интервале температур 750°С - 700°С твердый раствор α изменяет свой состав по линии трансуса (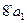 ) от 2% В до 4% В, ) от 2% В до 4% В,
- При температуре 700°С кристаллы α участвуют в метатектической реакции, после протекания которой α при дальнейшем охлаждении до 500°С изменяет свой состав по линии солидуса (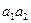 ) от 4 до 8 %B. ) от 4 до 8 %B.
- при температуре 500°С α участвует в перитектической реакции, после протекания которой α при дальнейшем охлаждении до комнатной температуры изменяет свой состав по линии сольвуса ( ) от 8 до 2% B. ) от 8 до 2% B.
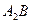 - промежуточное инконгруэнтно плавящееся соединение постоянного состава: - промежуточное инконгруэнтно плавящееся соединение постоянного состава:
- появляется при температуре 500°С в ходе перитектической реакции и в интервале температур 600°С ÷ 0°С имеет постоянный состав равный 28 % компонента В.
На рис. 12 показана зависимость изменения процентного содержания компонента В фазах от температуры.
Рис12
Список литературы:
- Осинцев О.Е. «Диаграммы состояния двойных и тройных систем. Фазовые равновесия в сплавах», М.: Машиностроение, 2009.
- Осинцев О.Е. Лекции по курсу «Термодинамика в материаловедении».
|