|
Пояснительная записка: 33 с., 5 рис., 2 табл., 7 источников.
Графические материалы: технологическая схема установки, сборочный чертеж аппарата, сборочные чертежи узлов, - всего 3 листа формата А1.
Тема проекта "Абсорбционная установка для поглощения двуокиси углерода из газовоздушной смеси. Разработать тарельчатый абсорбер, тип тарелок - ситчатые ".
Приведены теоретические основы и особенности процесса абсорбции, выполнены расчеты материального и теплового балансов процесса, выполнены технологические расчеты аппарата, определены его размеры, гидравлическое сопротивление, обоснован выбор материала для изготовления аппарата.
Расчетами на прочность и герметичность показана надежность работы запроектированного аппарата.
Ключевые слова: АППАРАТ, УСТАНОВКА, ДВУОКИСЬ УГЛЕРОДА, АБСОРБЕР, ТАРЕЛКА, РАСЧЁТ, ОПОРА.
СОДЕРЖАНИЕ
Введение 5
1. Теоретические основы разрабатываемого процесса. 6
Обоснование выбора конструкции аппарата и материалов
2.Технологические и проектные расчеты аппарата 10
2.1 Описание технологической схемы установки 10
2.2 Устройство и принцип работы аппарата 11
2.3 Материальные балансы и технологические расчеты 13
2.4 Конструктивные расчеты 23
2.5 Гидравлическое сопротивление аппарата 24
3. Прочностные расчеты аппарата 26
3.1 Расчет толщины стенки аппарата 26
3.2 Расчет толщины стенки крышки аппарата 28
3.3 Расчет и выбор опоры 30
Список литературы 33
Приложение А
Введение
В современной промышленности широкое применение нашли высокоэффективные технологические процессы с использованием агрегатов с большой единичной мощности, средств механизации и автоматизации.
Колонные аппараты являются основным типом массообменного оборудования химических, нефтехимических, пищевых, фармацевтических и других производств. В колонных аппаратах проводятся такие важнейшие массообменные процессы как абсорбция, адсорбция, десорбция, ректификация, экстракция и др.
Главным условием работы массообменных колонных аппаратов является эффективное взаимодействие фаз, которое определяется величиной создаваемой поверхности контакта фаз и гидродинамическими условиями их взаимодействия.
Для реализации этих функций необходимы глубокие знания техники и технологии, методик расчета технологического процесса и оборудования. Определяющая роль в этом принадлежит курсу “Процессы и аппараты химической технологии”, который базируется на фундаментальных законах естественных наук и составляет теоретическую базу химической технологии.
Курсовой проект является завершающим этапом изучения предмета. В период работы над курсовым проектом учащийся приобрел навыки самостоятельной работы по выполнению расчетов химической аппаратуры и графическому оформлению объектов проектирования, познакомился с действующей нормативно – технологической документацией, справочной литературой, приобрел навыки выбора аппаратуры и технико-экономических обоснований.
1. Теоретические основы разрабатываемого процесса.
Обоснование выбора конструкции аппарата и материалов

Абсорбцией называют процесс поглощения растворимого компонента газовой смеси жидким поглотителем. Абсорбция является типичным массообменным процессом, в котором поглощаемый компонент из газовой фазы переходит в жидкую фазу, растворяясь в ней частично или до полного насыщения. Движущей силой процесса абсорбции является разность парциальных давлений поглощаемого компонента в газовой фазе (рабочей концентрации) и в жидкой фазе (равновесной концентрации). Изменяя условия процесса (температуру и давление), можно влиять на скорость процесса и направление переноса
Основным законом, определяющим равновесие в системе газ – жидкость, является закон Генри, согласно которому парциальное давление компонента в газовой фазе в условиях равновесия пропорционально мольной концентрации этого компонента в жидкости. Коэффициент пропорциональности – коэффициент Генри – зависит от температуры, природы газа и растворителя. Растворимость газов в жидкостях возрастает с повышением давления и понижением температуры.
При абсорбции происходит контакт жидкости и газа. При этом масса одного из компонентов газовой фазы переносится в жидкую фазу и наоборот. Механизм процесса переноса массы сводится к молекулярной и турбулентной диффузии. При молекулярной диффузии, происходящей в неподвижной фазе и ламинарном потоке, перенос массы характеризуется коэффициентом диффузии. При турбулентной диффузии перенос вещества осуществляется движущимися частицами и определяется гидродинамическим состоянием потока, механизм переноса вещества через поверхность раздела фаз является кардинальным вопросом теории массопередачи и окончательно не решен. Предполагая, что диффузионные сопротивления в жидкой и газовой фазах обладают свойством аддитивности, можно записать основное уравнение массопередачи:
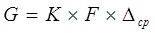 , (1.1) , (1.1)
где К – коэффициент массопередачи;
F
– площадь поверхности контакта фаз; Δср
– средняя движущая сила процесса.
Среднюю движущую силу процесса можно выразить через разность парциальных давлений поглощаемого компонента на входе и выходе из абсорбера Δрср
, разность молярных составов, разность относительных молярных составов, разность молярных концентраций. Так, при выражении движущей силы через парциальное давление на входе и выходе из абсорбера:
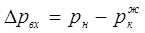 и и 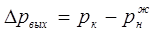 , (1.2) , (1.2)
где
p
н
и
p
к
– парциальное давление поглощаемого компонента в газе на входе и выходе из абсорбера;
p
к
ж
и
p
н
ж
- парциальное давление поглощаемого компонента в жидкости на выходе и входе в абсорбер.
Коэффициент массопередачи определяют в зависимости от способа выражения движущей силы процесса. Если движущую силу выражают через концентрации в газовой фазе, то уравнение для расчета К имеет вид:
  , (1.3) , (1.3)
Коэффициент массопередачи, отнесенный к концентрации жидкости, определяют из соотношения:
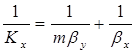 , (1.4) , (1.4)
Для приобретения полной версии работы перейдите по ссылке.
http://diplomrus.ru/raboti/29156/29156
 , (2.2) , (2.2)
 (2.3)
(2.3)
где ρ0
СО2
и ρ0
возд
– плотности поглощаемого газа и воздуха в нормальных условиях ( 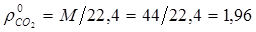 кг/м3
, кг/м3
, 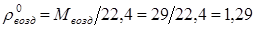 кг/м3
); МС
O
2
– мольная масса поглощаемого газа (для воздуха принимаем Мвозд
=29 кг/кмоль). кг/м3
); МС
O
2
– мольная масса поглощаемого газа (для воздуха принимаем Мвозд
=29 кг/кмоль).
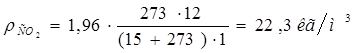
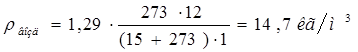
Массовый и объемный расходы поглощаемого газа на входе в абсорбер определяются по формулам [1]:
 (2.4) (2.4)
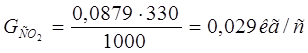
 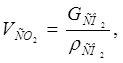 (2.5) (2.5)
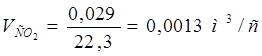 . .
Абсолютная мольная (объемная) доля поглощаемго компонента в исходной газовой смеси
определяются по формуле [1]:
 (2.6)
(2.6)
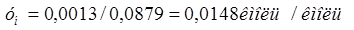
Плотность двухкомпонентной газовой смеси находится по формуле [1]:
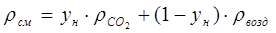 , (2.7) , (2.7)
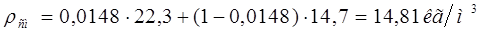
Массовые расходы исходной газовой смеси и воздуха (инертного носителя) определяются по формулам [1]:
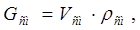 (2.8) (2.8)
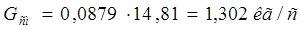
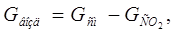 (2.9) (2.9)
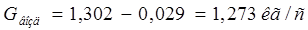
Относительная мольная и массовая доли поглощаемого компонента в исходной газовой смеси определяются по формулам [1]:
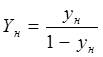 , (2.10) , (2.10)
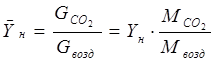 , (2.11) , (2.11)
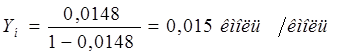
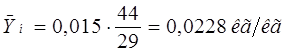
Массовые расходы абсорбированного и не поглощенного компонента в газовой смеси на выходе из аппарата находятся по формулам [1]:
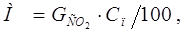
 (2.12) (2.12)
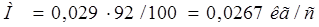
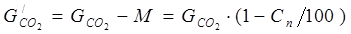 (2.13) (2.13)
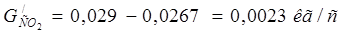
где Сп
– степень поглощения компонента.
Относительная массовая доля поглощаемого компонента в газовой смеси на выходе из аппарата определяется по формуле [1]:
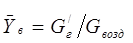 (2.14) (2.14)

Для построения равновесной и рабочей линий процесса абсорбции на  диаграмме нужно найти равновесную и рабочую относительные массовые доли поглощаемого компонента в жидкости на выходе из аппарата. диаграмме нужно найти равновесную и рабочую относительные массовые доли поглощаемого компонента в жидкости на выходе из аппарата.
Относительная мольная доля поглощаемого компонента в жидкости, находящейся в равновесии с исходной газовой смесью, определяется по зависимости, полученной на основе совместного решения уравнений, выражающих законы Генри и Дальтона [1]:
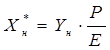 (2.15) (2.15)
где Е – коэффициент Генри, зависящий от температуры, свойств поглощаемого газа и абсорбента, имеющий размерность давления.
Для расчета можно предварительно принять температуру жидкости в нижней части колонны
t
н
=
t
и при этой температуре определяем соответствующее значение Е, Е =
0,91
×10
6
мм. рт. ст. [1].
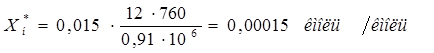
Равновесная относительная массовая доля поглощаемого компонента в жидкости на выходе из аппарата определяется по формуле [1]:
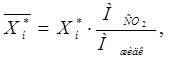 , (2.
1
6) , (2.
1
6)

где Мжидк
– мольная масса жидкого поглотителя – воды. Мжидк
=18 кг/кмоль.
При построении кривой равновесия следует учитывать, что растворение газов сопровождается выделением теплоты, вследствие чего повышается температура поглотителя и снижается растворимость газа.
Температура абсорбента в нижней части колонны с учетом дифференциальной теплоты растворения газа и концентрации поглощенного вещества определяется по формуле [1]:
 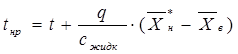 (2.17) (2.17)
  г
де
q
– дифференциальная теплота растворения газа,
q
= 450
кДж/кг [1]; сжидк
– теплоемкость
абсорбента, сжидк
=4,19×103
Дж/(кг×К), [1];
X
в
– начальная относительная массовая доля поглощаемого компонента в абсорбенте (так как на орошение колонны подается вода, не содержащая поглощаемого компонента,
X
в
=0). г
де
q
– дифференциальная теплота растворения газа,
q
= 450
кДж/кг [1]; сжидк
– теплоемкость
абсорбента, сжидк
=4,19×103
Дж/(кг×К), [1];
X
в
– начальная относительная массовая доля поглощаемого компонента в абсорбенте (так как на орошение колонны подается вода, не содержащая поглощаемого компонента,
X
в
=0).
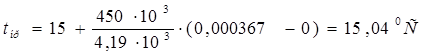
  Так как разность между
t
нр
и
t
составляет не более 1-2 0
С, условия протекания процесса можно считать изотермическими, а равновесная линия в этом случае будет представлять собой прямую, проходящую через точки с координатами (0;0) и ( Так как разность между
t
нр
и
t
составляет не более 1-2 0
С, условия протекания процесса можно считать изотермическими, а равновесная линия в этом случае будет представлять собой прямую, проходящую через точки с координатами (0;0) и (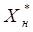 ; ;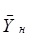 ) (рис. 2.3). ) (рис. 2.3).
     Рабочая относительная массовая доля Рабочая относительная массовая доля 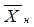 поглощаемого компонента в жидкости в нижней части колонны находится в заданном соотношении с равновесной относительной массовой долей поглощаемого компонента в жидкости в нижней части колонны находится в заданном соотношении с равновесной относительной массовой долей 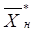 , и рабочая линия представляет собой прямую, проходящую через точки с координатами , и рабочая линия представляет собой прямую, проходящую через точки с координатами
(0; 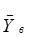 ) и ( ) и (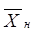 ; ;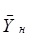 ) (рис. 2.3). ) (рис. 2.3).
 (2.18) (2.18)
где η – степень насыщения воды двуокисью углерода, η=90%.
Для приобретения полной версии работы перейдите по ссылке.
http://diplomrus.ru/raboti/29156/29156
Рисунок 2.3 – Рабочая (АВ)
 и равновесная (ОС) линии абсорбера и равновесная (ОС) линии абсорбера
Расход жидкого поглотителя определяется из уравнения материального баланса процесса абсорбции по поглощаемому компоненту. При составлении этого уравнения имеется в виду, что инертный газ и поглощающая жидкость не участвуют в процессе массообмена и их массовые расходы не изменяются по высоте аппарата.
Тогда:
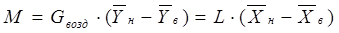 (2.19) (2.19)
Из этого уравнения определяется расход абсорбента по формуле [1]:
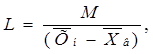
 (2.20) (2.20)

Движущую силу процесса абсорбции в данном случае удобно выражать разностью между рабочей и равновесной относительными массовыми концентрациями поглощаемого компонента в газовой фазе (рис. 2.3). Так как равновесная линия является прямой, средняя движущая сила процесса определяется по формуле [1]:
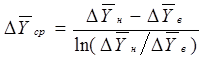 (2.21) (2.21)
где 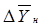 и
и
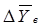 – движущие силы процесса внизу и вверху абсорбера соответственно;
– движущие силы процесса внизу и вверху абсорбера соответственно;
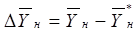 ; (2.22) ; (2.22)
 . (2.23) . (2.23)


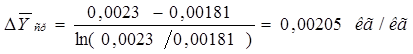
Число единиц переноса показывает, на сколько единиц изменяется концентрация поглощаемого вещества в фазе в расчете на единицу изменения движущей силы. Число единиц переноса для газовой фазы определяется по формуле [1]:
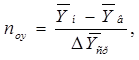 (2.24) (2.24)

 Согласно рекомендуемому порядку расчета далее необходимо определить значение коэффициентов молекулярной диффузии поглощаемого газа в газовой и жидкой фазах. Коэффициент молекулярной диффузии показывает, какое количество вещества диффундирует в единицу времени через единицу поверхности при изменении концентрации, равном единице, через единицы толщины слоя. Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую природную способность одного вещества проникать в среду другого. Величина коэффициента молекулярной диффузии определяется свойствами диффундирующего компонента и фазы, в которой он диффундирует, а также давлением и температурой. Согласно рекомендуемому порядку расчета далее необходимо определить значение коэффициентов молекулярной диффузии поглощаемого газа в газовой и жидкой фазах. Коэффициент молекулярной диффузии показывает, какое количество вещества диффундирует в единицу времени через единицу поверхности при изменении концентрации, равном единице, через единицы толщины слоя. Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую природную способность одного вещества проникать в среду другого. Величина коэффициента молекулярной диффузии определяется свойствами диффундирующего компонента и фазы, в которой он диффундирует, а также давлением и температурой.
При отсутствии экспериментальных данных значения коэффициентов диффузии приближенно можно найти по следующим уравнениям:
При диффузии газа в воздухе коэффициент диффузии можно рассчитать по формуле:
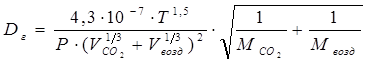 , (2.25) , (2.25)
где
D
г
– коэффициент диффузии, м2
/с; Т – абсолютная температура, К; Р – абсолютное давление, ат; М С
O
2
и Мвозд
– мольные массы аммиака и воздуха;
V
С
O
2
и
V
возд
– мольные объемы аммиака и воздуха, определяемые как сумма атомных объемов элементов, входящих в состав газа. (
V
С
O
2
=34,0 см3
/моль,
V
возд
=29,9 см3
/моль
[табл. А3, 1]).
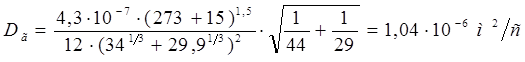 . .
Для приобретения полной версии работы перейдите по ссылке.
http://diplomrus.ru/raboti/29156/29156
Допускаемое внутреннее, избыточное давление определяется по формуле:
 , (3.5) , (3.5)
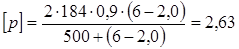 МПа. МПа.
Условие прочности имеет вид:
P < [р],
1,21 МПа <
2,63
МПа,
следовательно, условие прочности выполняется.
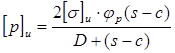 , (3.6) , (3.6)
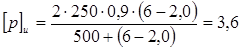 МПа. МПа.
1,82 МПа <
3,6
МПа,
следовательно, условие прочности выполняется.
 3.2 Расчет толщины стенки крышки аппарата 3.2 Расчет толщины стенки крышки аппарата

Рисунок 3.2 – Расчетная схема эллиптического днища корпуса
Номинальную толщину стенки днища (крышки), нагруженных внутренним избыточным давлением определим по формуле:
 , (3.7) , (3.7)
где R – радиус кривизны в вершине днища, для эллиптических
днищ R = D;
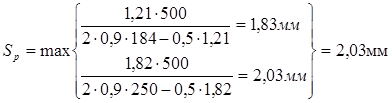
Исполнительную толщину стенки определим по формуле:
S = 0,00203+ 0,002 = 0,00403 м.
Толщина днища выбирается с учетом толщины сопрягаемой с ним обечайки, толщину днища принимаем S=0,006 м
Допускаемое внутреннее избыточное давление определим по формуле:
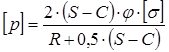 , ,
 (3.8) (3.8)
 (3.9) (3.9)
 МПа, МПа,
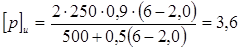 МПа, МПа,
что больше пробного, следовательно, условие прочности выполняется.
3.3 Расчет и выбор опоры
Определим нагрузку пустого аппарата на опору по формуле:
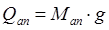 (3.10) (3.10)
где Mап
–
масса пустого аппарата;
 (3.11) (3.11)
где Мк
, Мдн
, Мкр
, Мт
, Моп
– соответственно массы корпуса, днища, крышки, тарелок и опоры.
1,05 – коэффициент, учитывающий массу неучтенных устройств (люков, штуцеров и т. п.).
Масса корпуса:
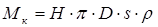 (3.12) (3.12)
где ρ – плотность материала корпуса ρ=7850кг/м3
;

Масса днища:
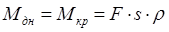 (3.13) (3.13)
где F
–
площадь внутренней поверхности эллиптического днища (крышки) F=0,31 м2
[табл. 16.4, 4]

Масса тарелок:
 (3.14) (3.14)
где 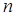 – общее число тарелок; – общее число тарелок;
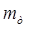 - масса одной тарелки, кг; согласно [7] масса ситчатой тарелки диаметром 500 мм составляет 10 кг: - масса одной тарелки, кг; согласно [7] масса ситчатой тарелки диаметром 500 мм составляет 10 кг:
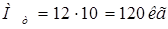
Массу опоры примем равной Моп
=60 кг
 . .
Тогда масса пустого аппарата:
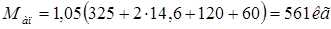
Определим нагрузку аппарата на опоры во время гидравлических испытаний по формуле:
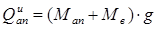 (3.15) (3.15)
где Мв
– масса загруженной в аппарат воды
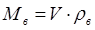 (3.16) (3.16)
где V – объем аппарата;
ρ – плотность воды (ρ=998 кг/м3
).
 (3.17) (3.17)

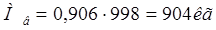
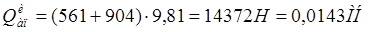
Исходя из Qmax
=Qап
и Qmin
=Qап
по таблицам 14.9, 14.10, и 14.11 [4] выбираем циллиндрическую опору 3-500-25-12,5-1000 (рис.4) согласно ОСТ 26-467-78 со следующими основными размерами:
Таблица 3.1 – Основные размеры цилиндрической опоры
| D1
=70
0
мм;
|
s4
³
0,5s2
=10 мм
|
| D2
=45
0
мм;
|
d=45 мм;
|
| DБ
=62
0
мм;
|
d1
=70 мм;
|
| s2
=20 мм;
|
d2
=28 мм;
|
| s1
=6 мм;
|
dБ
=24 мм (М24);
|
| s3
=12 мм;
|
zБ
=6 шт.;
|
Для приобретения полной версии работы перейдите по ссылке.
http://diplomrus.ru/raboti/29156/29156
Рисунок 3.3 - Опора цилиндрическая
 Список литературы Список литературы
1. Методические методические рекомендации и контрольные задания для самостоятельной работы по курсу «Процессы и оборудование химических производств». Часть 2 Массообменные процессы и оборудование / Сост.: А.П.Врагов, Я.Э.Михайловский.- Сумы: Изд-во СумГУ, 2002.
2. Основы конструирования и расчета химической аппаратуры. Лащинский А.А., Толчинский А.Р., Л., "Машиностроение", 1970 г., 752 стр. Табл. 476. Илл. 418. Библ. 218 назв.
3. Павлов К. Ф., Романков П. Г., Носков А. А. Примеры и задачи по курсу процессов и аппаратов химической технологии. Учебное пособие для вузов / Под ред. чл.-корр. АН СССР П. Г. Романкова. – 10-е изд., перераб. и доп. – Л.: Химия, 1987. – 576 с., ил.
4. Лащинский А. А. Конструирование сварных химических аппаратов: Справочник. – Л.: Машиностроение. Ленингр. отд – ние, 1981. – 382 с., ил.
5. Касаткин А. Г. Основные процессы и аппараты химической технологии. М., "Химия", 1973., 752с.
6. ГОСТ 14249 – 89 Сосуды и аппараты. Нормы и методы расчета на прочность.
7.
Основные процессы и аппараты химической технологии: Пособие по проектированию/ Г.С. Борисов, В.П. Брыков. Ю. И. Дытнерский и др. Под ред. Ю. И. Дытнерского, 2-е изд., перераб. и дополн. М.:Химия, 1991 – 496 с.
Приложение А
|

![]() (3.14)
(3.14)
![]() – общее число тарелок;
– общее число тарелок;
![]() - масса одной тарелки, кг; согласно [7] масса ситчатой тарелки диаметром 500 мм составляет 10 кг:
- масса одной тарелки, кг; согласно [7] масса ситчатой тарелки диаметром 500 мм составляет 10 кг:
![]()
 .
.
![]()
![]() (3.15)
(3.15)
![]() (3.16)
(3.16)
 (3.17)
(3.17)

![]()
![]()

 Список литературы
Список литературы




 , (1.3)
, (1.3)
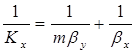 , (1.4)
, (1.4)
 , (2.2)
, (2.2)

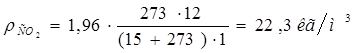
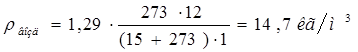
 (2.4)
(2.4)
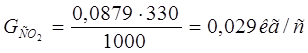

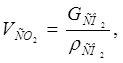 (2.5)
(2.5)
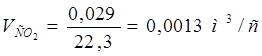 .
.
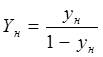 , (2.10)
, (2.10)
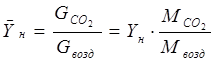 , (2.11)
, (2.11)
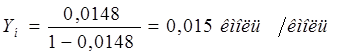
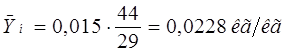
 (2.12)
(2.12)
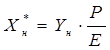 (2.15)
(2.15)
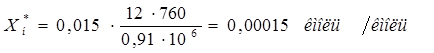
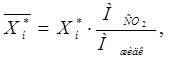 , (2.
1
6)
, (2.
1
6)


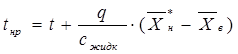 (2.17)
(2.17)
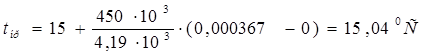
 и равновесная (ОС) линии абсорбера
и равновесная (ОС) линии абсорбера
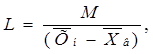
 (2.20)
(2.20)

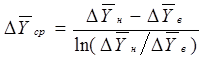 (2.21)
(2.21)
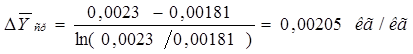
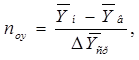 (2.24)
(2.24)

 Согласно рекомендуемому порядку расчета далее необходимо определить значение коэффициентов молекулярной диффузии поглощаемого газа в газовой и жидкой фазах. Коэффициент молекулярной диффузии показывает, какое количество вещества диффундирует в единицу времени через единицу поверхности при изменении концентрации, равном единице, через единицы толщины слоя. Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую природную способность одного вещества проникать в среду другого. Величина коэффициента молекулярной диффузии определяется свойствами диффундирующего компонента и фазы, в которой он диффундирует, а также давлением и температурой.
Согласно рекомендуемому порядку расчета далее необходимо определить значение коэффициентов молекулярной диффузии поглощаемого газа в газовой и жидкой фазах. Коэффициент молекулярной диффузии показывает, какое количество вещества диффундирует в единицу времени через единицу поверхности при изменении концентрации, равном единице, через единицы толщины слоя. Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую природную способность одного вещества проникать в среду другого. Величина коэффициента молекулярной диффузии определяется свойствами диффундирующего компонента и фазы, в которой он диффундирует, а также давлением и температурой.
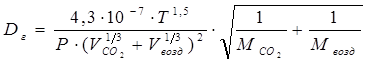 , (2.25)
, (2.25)
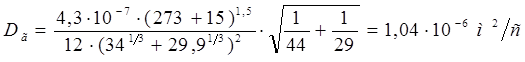 .
.
 , (3.5)
, (3.5)
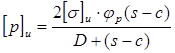 , (3.6)
, (3.6)
 3.2 Расчет толщины стенки крышки аппарата
3.2 Расчет толщины стенки крышки аппарата

 , (3.7)
, (3.7)
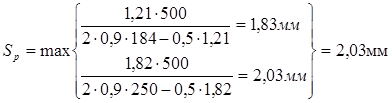
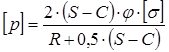 ,
,
 (3.8)
(3.8)