| Министерство образования РФ
Самарская государственная экономическая академия
Реферат (отработка семинара №7).
Первое начало термодинамики.
Выполнил: студент СГЭА факультета
систем управления группы М.О.-1
1 курса Манагаров Р.И.
Проверил: Мирошников Юрий Фёдорович
Самара 2002
Закон представляет формулировку принципа сохранения энергии для термодинамических
систем. Он формулируется следующим образом:
При переходе системы из состояния A в состояние B сумма работы и теплоты, полученных системой от окружающей среды, определяется только состояниями A и B; эта сумма не зависит от того, каким способом осуществляется переход из A в B
.
Это означает, что существует такая величина E
, характеризующая внутреннее состояние системы, что разность ее значений в состояниях A
и B
определяется соотношением
где (–L
) – работа, совершенная средой над системой, а Q
– количество тепла, полученное системой от окружающей среды (количество энергии, передаваемое системе термическим образом, т.е. в форме, отличной от работы).
Величина E
называется внутренней энергией
системы.
Для бесконечно малого изменения состояния
или, используя выражение для δ
L
,
Таким образом, изменение внутренней энергии системы равно сумме полученного тепла и совершенной над системой работы. (1)
Пример:
Рассмотрим систему, состоящую из определенного количества воды в сосуде. Энергию системы можно увеличить двумя путями. Первый: можно нагревать сосуд на огне. При этом объем воды почти не увеличивается, т.е. dV
= 0 и, следовательно, работа не производится. Второй путь: опустим в воду установку с вращающимися лопастями и путем трения увеличим температуру воды до того же значения, что и в первом случае. Конечные состояния системы и приращения ее энергии в обоих случаях одни и те же, но во втором случае увеличение энергии обусловлено работой.
Эквивалентность теплоты и механической работы становится особенно ясной, если рассмотреть циклический процесс. Так как начальное и конечное состояния цикла одинаковы, то изменение энергии равно нулю (E
A
= E
B
) и, следовательно,
т.е. работа, совершенная системой во время цикла, равна количеству теплоты, поглощенному системой. (4)
Теплота измеряется в единицах энергии – эргах, джоулях и калориях. Соотношение между джоулем и калорией имеет вид
Это – механический эквивалент теплоты
.
Величины Q
и L
не являются функциями состояния системы; они зависят от способа перехода из состояния А в В. Соответственно этому δ
Q
и δ
L
не являются полными дифференциалами. Это обстоятельство и отмечается использованием символа δ
, а не d. (1)
Применим первый закон к системам типа однородной жидкости, состояния которых определяются двумя из трех переменных P
, V
и T
. В этом случае любая функция состояния системы и, в частности, внутренняя энергия E
будет функцией двух переменных, выбранных в качестве независимых.
Чтобы избежать неправильного толкования того, какая переменная является независимой при вычислении частной производной, будем заключать символ частной производной в скобки и помещать внизу скобок ту величину, которая при частном дифференцировании остается постоянной. Таким образом,
означает частную производную E
по T
при постоянном V
; причем T
и V
взяты в качестве независимых переменных. Эта производная отличается от частной производной (∂ E
/∂ T
)P
, при взятии которой остается постоянным давление P
. (3)
Рассмотрим теперь бесконечно малый процесс, т.е. процесс, при котором независимые переменные изменяются на бесконечно малые величины. Для такого процесса 1-й закон термодинамики можно переписать в виде
Если в качестве независимых взять переменные T
и V
, то E
= E
(T
, V
) и, следовательно,
Соотношение принимает тогда вид:
| 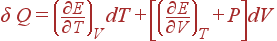
|
(7)
|
Если считать независимыми переменными T
и P
, то
и принимает вид
| 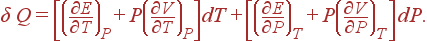
|
(8)
|
Теплоемкость тела определяется как отношение бесконечно малого количества поглощенной теплоты к бесконечно малому изменению температуры, вызванному этой теплотой.
Очевидно, что величина теплоемкости зависит от того, нагревается ли тело при постоянном объеме или при постоянном давлении. Обозначим символами c
V
и c
P
теплоемкости при постоянном объеме и при постоянном давлении соответственно. Поскольку при V
= const
, dV
= 0, то
| 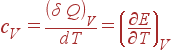
|
(9)
|
Подобным же образом из (8) получается выражение для c
P
:
| 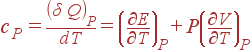
|
(10)
|
Второй член в формуле для c
P
связан со слагаемым PdV
, т.е. описывает эффеккт, оказываемый на теплоемкость работой, которую система совершает во время расширения. В (9) подобного члена нет, поскольку объем остается постоянным и работа не совершается. (1)
Во многих случаях удобно пользоваться понятием молярной теплоемкости. Молярной теплоемкостью
называется теплоемкость одного моля вещества. Молярные теплоемкости при постоянном V
и при постоянном P
определяются формулами (9) и (10), если вместо произвольного количества вещества взять 1 моль:
| 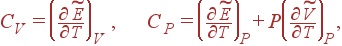
|
(11)
|
знак  сверху означает, что взят 1 моль вещества. (2) сверху означает, что взят 1 моль вещества. (2)
В случае газа можно конкретизировать зависимость внутренней энергии E
от переменных T
и V
, определяющих его состояние. В дальнейшем мы докажем, что энергия идеального газа определяется температурой T
и не зависит от объема V
: E
= E
(T
). Для реальных газов это утверждение выполняется приближенно. Для определения зависимости E
(T
) воспользуемся результатами опыта, согласно которым теплоемкость газов очень слабо зависит от температуры. Можно предположить, что для идеального газа она строго постоянна. Тогда интегрирование уравнения
| 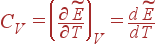
|
(12)
|
при условии C
V
= const
дает:
| 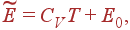
|
(13)
|
где E
0
– константа, представляющая энергию газа при абсолютном нуле.
Внутренняя энергия N
молей газа
| E
= N
(C
V
T
+E
0
) .
|
(14)
|
Для идеального газа 1-й закон термодинамики принимает вид
| 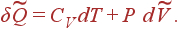
|
(15)
|
Из этого уравнения легко получить соотношение между молярными теплоемкостями C
V
и C
P
. Для этого перейдем от переменных T
и V
к переменным T
и P
. Это можно сделать, если взять дифференциалы от обеих частей уравнения состояния для 1 моля идеального газа
| 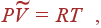
|
(16)
|
что дает
Выражая отсюда  и подставляя в (15), получаем и подставляя в (15), получаем
Отсюда можно легко найти C
P
. Поскольку при P
= const
дифференциал dP
= 0 , то
| 
|
(17)
|
т.е. разность между молярными теплоемкостями газа при постоянном давлении и при постоянном объеме равна газовой постоянной R
. (1)
Литература:
1.Мякишев Г.Я., Буховцев Б.Б. Физика 10 кл.
2.Шахмаев Н.М. Физика 10 кл.
3.Свитков Л.П. Термодинамика и молекулярная физика 1970г.
4.Билимович Б.Ф. Тепловые явления в технике1981г.
|