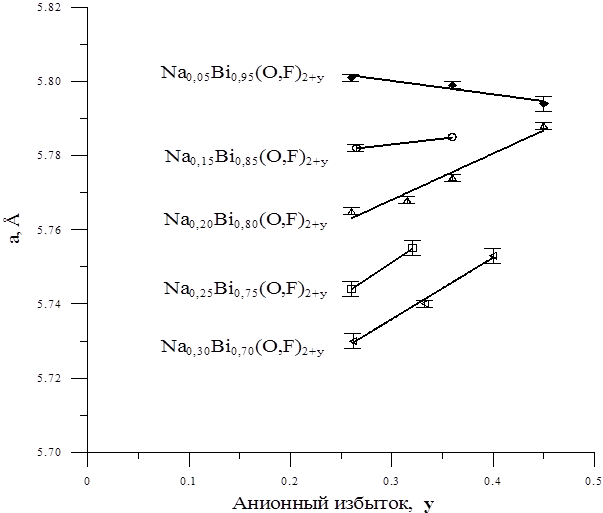Реферат: Изучение взаимодействия в системе NaF-Bi2O3-BiF3 при 600 и 650 градусах Цельсия
|
Название: Изучение взаимодействия в системе NaF-Bi2O3-BiF3 при 600 и 650 градусах Цельсия Раздел: Рефераты по химии Тип: реферат | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Московский государственный университет имени М.В. Ломоносова Химический факультет Изучение взаимодействия в системе NaF-Bi2 O3 -BiF3 при 600 и 650 ° С . Курсовая работа по неорганической химии студента 102 группы Домбровского Е.Н. Научные руководители: асп. 1 г/оСеров Т.В. к.х.н.Ардашникова Е.И. Преподаватель: к.х.н. Ардашникова Е.И. Москва 1999 год I Введение ......................................................................стр. 3 II Обзор литературы .................................................................. 5 1. Структура флюорита ........................................................... 5 2. Фторид натрия .................................................................... 6 2.1 Строение .................................................................... 6 2.2 Свойства .................................................................... 6 2.3 Получени е ................................................................... 7 3. Оксид висмута .................................................................... 8 3.1 Строение .................................................................... 8 3.2 Свойства ..................................................................... 10 3.3 Получени е .................................................................... 10 4. Фторид висмута ................................................................... 11 4.1 Строение ..................................................................... 11 4.2 Свойства ..................................................................... 12 4.3 Получение .................................................................... 12 5. Система BiF3 -Bi2 O3 .............................................................13 6. Система NaF-BiF3 ...............................................................16 7. Система NaF-Bi2 O3 .............................................................18 8. Система NaF-Bi2 O3 -BiF3 ..................................................... 19 III Экспериментальная часть ....................................................... 21 1. Исходные вещества ............................................................ 21 2. Получение BiF3 ..................................................................21 3. Приготовление образцов ..................................................... 22 4. Методы исследования ......................................................... 23 5. Основные результаты и их обсуждение ................................. 25 IV Выводы ................................................................................ 43 V Список литературы ................................................................. 44 Введение. Твердые электролиты представляют собой вещества, проводящие электрический ток в твердом состоянии, промежуточные в строении между твердыми кристаллическими телами с фиксированным положением каждого атома или иона и жидкими электролитами, в которых нет упорядоченной структуры и все частицы подвижны. Благодаря разупорядочению одной из подрешеток (катионной или анионной) такие вещества в определенном температурном интервале проявляют высокую ионную проводимость в твердом состоянии, что позволяет им находить широкое применение в хозяйстве: они используются как источники тока, топливные элементы [1], газовые сенсоры (например, фторпроводящие образцы системы SrF2 -LaF3 , легированные SrO, рекомендованы как перспективные сенсоры по кислороду [2]), генераторы кислорода (например, сложные оксидные кислородпроводящие образцы предложено использовать для отделения кислородаот других газов [3]), в качестве элементов памяти вычислительных устройств и в других областях. В последние десятилетия высокая проводимость по ионам фтора обнаружена у ряда неорганических фторидов. По своим свойствам они не уступают многимизвестным твердым электролитам.Их недостаточная изученность обусловлена в большой степени значительной химической активностью при высоких температурах, а также склонностью к пирогидролизу. Исследования в этой области привели к обнаружению в сложных фторидных системах, содержащих катионы Bi и щелочных металлов, фторпроводящих соединений и твердых растворов со структурой флюорита [4,5]. Их высокая проводимость объясняется легкой поляризуемостью катионов Bi3+ , что увеличивает подвижность фторид-ионов. Показано также, что замена части анионов фтора на кислород еще сильнее повышает проводимость за счет появления дополнительных вакансий в анионной подрешетке. К тому же оксофторидные материалы заметно лучше сохраняются на воздухе, тогда как чисто фторидные электролиты чрезвычайно склонны к гидролизу. Оксофториды висмута и калия, исследованные несколько лет назад [6], менее удобны в применении, чем с натрием вследствие их гигроскопичности. Поэтому, большой практический интерес представляет система Целью настоящей работы стало изучение взаимодействия в системе NaF-Bi2 O3 -BiF3 при температурах 600 и 650°С в областях, примыкающих к BiOF и b-BiOy F3-2y . 1. Структура флюорита. Структура флюорита (природный минерал CaF2 ) построена из кубических гранецентрированных элементарных ячеек (рис. 1). Параметр а = 5,462 Å[7]. Катионы занимают положения в вершинах куба и в центрах его граней. Куб из анионов вписан в большой куб из катионов. Таким образом катионы имеют КЧ = 8 (куб), а анионы КЧ = 4 (тетраэдр). Рис. 1. Структура флюорита. 2.1 Строение . Фторид натрия кристаллизуется в структуре типа NaCl. Пространственная группа Fm3m, параметр элементарной ячейки а = 4,634(4) Å[8]. Элементарная ячейка кубическая гранецентрированная (рис. 2). При размещении ионов одного сорта в вершины и центры граней элементарной ячейки ионы другого сорта занимают середины ребер и центр куба. Анионы и катионы в такой структуре имеют шестерную координацию. Координационный полиэдр – октаэдр. 2 .2 Свойства . Фторид натрия представляет собой белое кристаллическое вещество. Тпл = 997°С, Ткип = 1785°С. Df H°298 = -569 кДж/моль [9]. Хорошо растворим в воде (41,3 г/л воды [10]). Взаимодействует почти со всеми фторидами металлов III – VII групп и Be с образованием фторметаллатов натрия, например: 3NaF + AlF3
При растворении в HF, а также при взаимодействии с газообразным фтороводородом образует бифторид натрия NaHF2 : NaF + HF = NaHF2 . В природе NaF встречается в виде минерала виллиомита. 2.3 Получение . а) Нейтрализация плавиковой кислотой растворов NaOH или Na2 CO3 до слабокислой реакции: Na2 CO3 + 2HF = 2NaF + CO2 + H2 O. При упаривании выделяется безводный NaF. б) Термическое разложение бифторида натрия при температуре выше 270°С [10]:NaHF2
NaHF2 разлагается без плавления, в отличие от KHF2 . Для получения чистого NaF продажный препарат достаточно выдержать в течение нескольких часов в сушильном шкафу при температуре 150 – 200°С [11]. Рис. 2. Структура NaCl. 3.1 Свойства. Для оксида висмута (III) известны две стабильные (a и d) и две метастабильные (b и g) модификации (рис. 3) [12]. Стехиометрическая a-форма бледно-желтого цвета устойчива при стандартных условиях и вплоть до температуры 730°С. Имеет моноклинную решетку; пр. гр. Р21/с , параметры элементарной ячейки а = 5,848Å, b = 8,166 Å,c = 7,510Å, b = 113° [12]. При постепенном нагревании до 730°Сa-Bi2 O3 претерпевает полиморфный переход, теряя часть кислорода, и превращается в d-форму (формула Bi2 O3-x , где х = 0,045-0,37). Эта модификация оранжевого цвета характеризуется кубической решеткой с параметром а = 5,66 Å, пр. гр. Pn3m . Ярко-желтая g-форма отличается избытком кислорода (формула Bi2 O3+x ) и представляет собой твердый раствор кислорода в оксиде висмута. Решетка его также кубическая, но по сравнению с d-Bi2 O3 элементарная ячейка увеличена вдвое по всем трем направлениям. а = 10,76 Å[12] (10,2501(5) Å в [13]), пр. гр. I23 . Наиболее устойчива g-форма при высоких давлениях кислорода. Ее можно также стабилизировать легированием оксидами кремния или свинца в форме соединений M2 Bi24 O39 , где М = Si, Pb [12]. Получить ее можно при охлажденииd-модификации под давлением О2 . b-Bi2 O3 , также желтого цвета, можно получить нагреванием висмутита (BiO)2 CO3 или охлаждением d-формы до температуры около 640°С. При дальнейшем охлаждении она легко переходит в a-модификацию. b-Bi2 O3 кристаллизуется в тетрагональной сингонии, параметры элементарной ячейки: а = 3,85Å, с = 12,25 Å. Пр. гр. I4/mm . b-форма является аниондефицитной по отношению к формуле Bi2 O3 . В работе [14] масс-спектральным методом исследована область гомогенности оксида висмута (III) при 1070 К. Изучением равновесия "газ – твердая фаза" в платиновой ячейке установлено, что при этой температуре оксид висмута может иметь состав от Bi2 O2,8 до Bi2 O3,11 . Конгруэнтной сублимации при этой температуре отвечает состав Bi2 O2,92 ± 0,04 .
d-Bi2 O3 плавится при 825°С [12]. Для температуры кипения в [9] приводится значение 1890°С. Df H°298 (a-Bi2 O3 ) = – 577 кДж/моль [9]. Оксид висмута (III) нерастворим в воде и растворах щелочей. Кислотами переводится в соли висмута (III): Bi2 O3 (тв) + 6HCl(р) = 2BiCl3 (p) + 3H2 O. b-, g- и d-модификации оксида висмута являются анионными проводниками с незначительным вкладом электронной проводимости, тогда как a-Bi2 O3 – полупроводник [11]. 3.3 Получение. Наилучшим способом получения оксида висмута считается взаимодействие растворов солей висмута (III), например нитрата Bi(NO3 )3 или сульфата Bi2 (SO4 )3 , с избытком раствора щелочи: Bi(NO3 )3 + 3NaOH = Bi(OH)3 ¯ +3NaNO3 . В осадок выпадает гидроксид висмута, который затем обезвоживают прокаливанием: 2Bi(OH)3
4. Фторид висмута (III). 4.1 Строение. Трифторид висмута существует в виде двух полиморфных модификаций. Устойчивой при стандартных условиях является ромбическая модификация Параметры элементарной ячейки для первой из модификаций (по [15]): а = 6,565(7)Å, b = 7,016(7)Å, c = 4,841(5) Å. R-BiF3 изоструктурен фториду иттрия (пр. гр. Pnma , Z = 4). Атом Bi в R-BiF3 окружен восемью ближайшими атомами фтора на расстояниях 2,217 – 2,502 Ă, девятый атом фтора находится на расстоянии 3,100 Ă (рис. 3). Такое искажение координационной сферы атома висмута объясняется наличием стереохимически активной пары электронов на атоме висмута. Рис. 4. Окружение атома Bi в R-BiF3 . 4.2 Свойства. Фторид висмута на воздухе малоустойчив. Уже при комнатной температуре во влажном воздухе он начинает гидролизоваться, а при повышенных температурах пирогидролиз идет до конца по схеме: BiF3
+ H2
O Поэтому препараты фторида висмута следует хранить без доступа влаги – в эксикаторе над Р2 О5 . Температура плавления (в токе HF) составляет 757°С [16]. Температура кипения – 900°С [9]. Df H°298 (BiF3 ) = - 899кДж/моль [9]. 4.3 Получение. Основные способы получения чистого трифторида висмута сводятся к взаимодействию Bi2 O3 или Bi(OH)3 с сильными фторирующими агентами, в качестве которых были предложены SF4 , BrF3 [15] и др. В работе [17] было предложено обрабатывать оксид или гидроксид висмута концентрированной плавиковой кислотой в платиновой чашке при нагревании. Получающийся гидрат трифторида висмута затем дегидратируют в платиновых тиглях в токе сухого фтороводорода при 300°С. В той же работе [17] приведена еще одна методика. Трибромид висмута, получаемый прямым взаимодействием элементов, обрабатывают фторидом аммония в метанольном растворе по реакции: BiBr3 + 4NH4 F = NH4 BiF4 + 3NH4 Br. Выпавший осадок тетрафторвисмутата (III) аммония отделяют, промывают эфиром и сушат при 60°С. Прокаливая его при 300°С можно получить безводный BiF3 : NH4
BiF4
5. Система BiF3 -Bi2 O3 . Наиболее подробно данная система изучалась в [15,18]. Построена фазовая диаграмма (рис. 5). В области, богатой фторидом висмута образуется твердый раствор aсо структурой тисонита LaF3 с содержанием оксида 0,7 – 3,45 моль.% (0,02£y£0,1 в формуле BiOy F3-2y ). По мере увеличения доли Bi2 O3 параметры гексагональной ячейки изменяются следующим образом: а уменьшается от 7,076(7) Å до 7,053(7) Å, а "с" увеличивается от 7,313(7) Å до 7,338(7) Å. При содержании оксида 3,45 – 6 моль. % образуется ряд упорядоченных фаз со структурой, производной от тисонита. Индицирование их рентгенограмм затруднено вследствие близости их строения. На диаграмме (рис. 5) для легкости восприятия вся область составов 0,7 – 6 % Bi2 O3 изображена как твердый раствор a[15]. В области содержания оксида 20 – 33 мольных % образуется ряд упорядоченных фаз со структурой, производной от флюорита. В работе [15] перечислены их составы: 20; 21; 22,5; 25 и 33 моль. % Bi2 O3 и рассчитаны параметры элементарных ячеек,приведенные в таб. 1. В работе [19] уточнен состав последней из них – Bi7 F11 O5 (31,25 моль. % Bi2 O3 ). Эта фаза построена из упорядоченных колончатых кластеров [19]. При температурах 290 – 410°С все фазы претерпевают полиморфный переход (происходит разупорядочение), образуя анионизбыточный флюоритовый твердый раствор, т.н. b-фазу. Закалить ее, то есть получить при комнатной температуре авторам [15] не удалось. b-фаза – самое тугоплавкое соединение в системе: максимальная температура плавления составляет 995°С [15]. При эквимолярном соотношении Bi2 O3 и BiF3 образуется стехиометрический оксофторид BiOF, изоструктурный PbFCl. Соединение кристаллизуется в тетрагональной сингонии с параметрами элементарной ячейки а = 3,750(5) Å, с = 6,228(9) Å. Авторы [15] предполагают наличие полиморфного перехода BiOF в кубическую флюоритоподобную модификацию при 620°С. Таб. 1. Рентгенографические характеристики оксофторидных фаз висмута со структурой, производной от флюорита.
* по [15]. ** по [19]. В области содержания оксида висмута 60-68% при температурах выше 450°С образуется гексагональный твердый раствор g. Он имеет две модификации – g и g', обратимо переходящие одна в другую при 590-595°С. Для состава, содержащего 67 моль. % Bi2 O3 , закаленного от 650°С, в [15] приводятся параметры гексагональной решетки а = 8,33(1) Å, с = 19,03(1) Å. При мольной доле Bi2 O3 , равной 75%, образуется стехиометрическое соединение Bi7 O9 F3 (единственный из оксофторидов висмута желтого цвета). Для него известны как минимум два полиморфных перехода при температурах 505 и 565°С. В работе [20] это соединение изучено особенно подробно. Установлена его электропроводность, составляющая при 500Кs = 5·10-5 Ом-1 см-1 . Указано, что с повышением температуры электропроводность быстро растет. Показано также, что проводимость обеспечена практически в равной степени ионами фтора и кислорода. Структура соединения не описана. Из состава, содержащего 80 моль. % Bi2 O3 выше 515°С образуется соединение Bi3 O4 F. Проиндицировать его рентгенограммы авторам [15] не удалось, его структура также не определена. При температурах выше 620°С значительные количества (до примерно 14 моль. % при 790°С) фторида висмута растворяются в d-Bi2 O3 , стабилизируя его и образуя твердый раствор d-BiOy F3-2 y . Рис. 5. Фазовая диаграмма системы BiF3 -Bi2 O3 . 6. Система NaF-BiF3 . Подробное изучение сложных фторидов висмута и щелочных металлов проводилось неоднократно [4,5,15] (рис. 6). Соединение NaBiF4 впервые было получено авторами [21] отжигом соответствующей смеси NaF и BiF3 в платиновом тигле в атмосфере гелия при 450°С. Тетрафторвисмутат натрия изоструктурен гагариниту b-NaYF4 , параметры элементарной ячейки его гексагональной решетки: а = 6, 144 Å, с = 3,721 Å. По данным [15] соединение имеет узкую область гомогенности (от 49 до 51 моль. % BiF3 ), в пределах которой "а" увеличивается от 6,131(5) Å до 6,147(4) Å, а "с" уменьшается от 3,720(3) Å до 3,706(3) Å. При 450°С NaBiF4 претерпевает полиморфный переход, образуя кубический флюоритоподобный твердый раствор Na1-x Bix F1+2x . Впервые этот раствор был исследован в [4]. По данным [15] границы области гомогенности лежат в пределах 49 – 70 моль. % BiF3 . Для образцов, закаленных от 500°С, параметр элементарной ячейки растет от 5,686(4) Å для состава, содержащего 60% BiF3 , до 5,763(4) Å (70 моль. % BiF3 ). Образцы с долей BiF3 50 – 60 моль. % при закаливании дают две фазы: флюоритоподобный твердый раствор и NaBiF4 . Интересно, что соединения МBiF4 для М = К, Rb, Tl имеют структуру флюорита при любых температурах от комнатной до плавления [5]. Вещества были изучены в работе [5] в качестве анионных проводников. Получали образцы изотермическим отжигом при 550°С в течение 12 часов. Рис. 6. Фазовая диаграмма системы NaF-BiF3 . 7. Система NaF-Bi2 O3 . Данных по системе в литературе не обнаружено. 8. Система NaF-Bi2 O3 -BiF3 . Подробное исследование данной системы проведено в работе [11]. Изучено изотермическое сечение системы при температуре 450°С (рис. 7). Предложена схема триангуляции. Основным объектом изучения стала обширная область гомогенности флюоритоподобного твердого раствора, имеющая избыток анионов по отношению к формуле МХ2 , (названная Ф) на основе чисто фторидного раствора Na1-x Bix F1+2x . Область простирается в направлении b-BiOy F3-2y до содержания оксида висмута примерно 35 моль. %. Минимальное содержание NaF в Ф при данной температуре – около 13 моль. %. При более низком содержании NaF образцы двухфазны. Методом импедансной спектроскопии измерена проводимость образцов. По своим проводящим характеристикам эти вещества не уступают многим используемых твердых электролитов, а работать с ними можно при достаточно низких температурах. Поэтому авторы [11] предложили использовать эти вещества в качестве твердых анионпроводящих материалов. Началом исследования системы послужила работа [22]. В ней исследованы образцы разреза Bi2 O3 -NaBiF4 , закаленные от 400°С (рис. 8). Показано, что в треугольнике NaF-BiOF-NaBiF4 новых фаз не образуется, а разрезы NaF-BiOF и BiOF-NaBiF4 являются квазибинарными. Заметной области гомогенности (³3 моль. % Bi2 O3 ) на основе NaBiF4 не обнаружено. В работе [23] исследована каталитическая активность соединений NaBi3 O4 Г2 (где Г – F, Cl, Br) к избирательному окислению метана до высших углеводородов. Указано, что образцы данного состава, приготовленные твердофазным синтезом в платиновых ампулах при температурах 750 – 900°С из смесей Na2 O, NaГи BiOГ, были однофазными. Каталитические свойства образцов изучали при 600 – 750°С, причем фторидные образцы показали сравнительно худшие свойства. Фазы имеют слоистую структуру типа Силлена, параметры более подробно даны в материалах конгресса [24], которые найти не удалось. Рис.7. Схема изотермического сечения системы NaF-Bi2 O3 -BiF3 при 450°С. Экспериментальная часть. 1. Исходные вещества. В качестве исходных веществ использовались NaF и Bi2 O3 марки «чда», Bi(OH)3 марки «хч» и BiF3 , синтезированный нами. NaF предварительно обезвоживали при 200°С в течение суток [11]. Продажный препарат a-Bi2 O3 выдерживали 12 часов в сушильном шкафу при температуре 800°С до полного удаления следов влаги. Исходные вещества хранили в закрытых бюксах в эксикаторе над P2 O5 . Идентификация проводилась методом РФА. 2. Получение BiF3 . В качестве исходного препарата висмута был взят гидроксид. Вещество нагревали с концентрированной плавиковой кислотой в течение нескольких часов. В результате реакции: Bi(OH)3 + 3HF = BiF3 ·aq¯ + 3H2 O после упаривания оставался осадок гидратированного фторида висмута, который обезвоживали в токе сухого HF в течение 4 часов при температуре 350°С в приборе (рис. 8), состоящем из источника фтористого водорода (медная реторта с NaHF2 ), медной трубки, расположенной в ней никелевой лодочки с веществом и поглотительной системы, заполненной твердой щелочью. Идентификация безводного BiF3 была проведена методом РФА. Вещество также хранили в закрытом бюксе в эксикаторе над P2 O5 . Рис. 8. Прибор для обезвоживания гидратированного фторида висмута в токе газообразного HF. 3. Приготовление образцов. Образцы для изучения системы NaF-Bi2 O3 -BiF3 были приготовлены методом твердофазного синтеза. Навески исходных веществ, взятые в необходимых соотношениях (таб. 2), взвешивали на аналитических весах "Sartorius" с точностью 0,2 мг. Отпрессованные в таблетки образцы отжигали в запаянных медных ампулах, заполненных аргоном, с закаливанием путем опускания ампул в холодную воду. Условия отжигов приведены в таб. 3. Нумерация образцов, проставленная на рентгенограммах, является сквозной для нескольких работ лаборатории, соответствия номеров показаны в таб. 4. Таблица 2. Навески для приготовления образцов.
4. Методы исследования. Исследование фазового состава образцов было проведено методом рентгенофазового анализа (РФА). РФА проводили в камере-монохроматоре типа Гинье с эффективным сечением 228 мм, излучение Cu Ka 1 . Рентгенограммы некоторых образцов промеряли на компараторе с точностью 0,001 мм. Интенсивность линий определяли визуально по пятибалльной шкале. Индицирование методом подбора изоструктурного соединения и уточнение параметров элементарной ячейки методом наименьших квадратов проводили с использованием программ Powder. В качестве внутреннего стандарта при индицировании использовался германий (параметр кубической решетки типа алмаза – а = 5,658 Å[7]). Таблица 3. Условия отжигови результаты РФА.
* Дополнительный отжиг. Первое время соответствует первой температуре, второе – второй. Таблица 4. Соответствия нумераций образцов.
5. Основные результаты и их обсуждение. Результаты РФА всех синтезированных образцов приведены в таб. 3. По результатам РФА образцы №№ 1-6после шестичасового отжига при 600°С стали однофазными, тогда как при более низкой температуре (450°С) образцы № 1 и № 2 давали две фазы (Ф и твердый раствор на основе b-BiOy F3-2y ) [11]. Таким образом обнаружено расширение области гомогенности флюоритоподобного твердого раствора Ф по сравнению с 450°С [11] в направлении b-BiOy F3-2y (рис. 9). Образцы №№ 7, 8 и 9 после I отжига были многофазными. После II отжига образец № 8 содержал только фазу Ф, а №№ 7 и 9 – две фазы (для образца № 9 проведен визуальный РФА, результаты РФА для № 7 в таб. 5). Т.е. при дальнейшем повышении температуры область гомогенности Ф расширяется еще сильнее (рис. 9). Таблица 5. Рентгенографические данные для образца № 7(II).
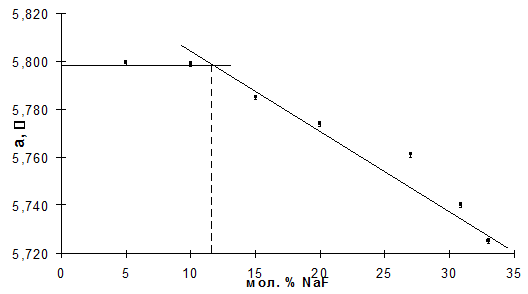
Рис. 9. Схема расположения образцов Результаты индицирования рентгенограмм образцов №№ 1, 4, 5, 7(II) и 8(II), лежащих на разрезах Nax Bi1-x (O,F)2.36 и Na0.05 Bi0.95 (O,F)2+y приведены в таблицах 6–10. Были рассчитаны параметры элементарной кубической ячейки фазы Ф, помещенные в таб. 11,12. Параметр элементарной ячейки кубической фазы Ф в образцах №№ 1 и 4 хорошо укладывается в линейную зависимость параметра от состава, полученную в [11] (рис. 10), тогда как параметр элементарной ячейки образца № 5 не лежит на этой прямой. Но параметр его ячейки в пределах ошибки совпадает с параметром четвертого образца. Границу твердого раствора Ф, таким образом, следует провести через точку пересечения двух линий, т.е. при мольной доле NaF, равной примерно 11%. При меньших же концентрациях NaF образцы, по-видимому, двухфазны. Состав твердого раствора Ф в них не изменяется и соответствует граничной концентрации. Вероятно, незначительное количество примесной фазы, присутствующая в образцах № 4 и 5, не дает рефлексов на рентгенограмме, т.к. чувствительность метода РФА не превышает 8 масс. %. Параметры элементарной кубической ячейки фазы Ф в образцах № 5, 7(II) и 8(II) (по разрезу Na0.05 Bi0.95 (O,F)2+y ) изменяются незначительно (толстая линия на графике, рис. 11), что в целом укладывается в общую закономерность – с уменьшением содержания натрия влияние анионного избытка на изменение параметра ослабевает [11] (рис. 11). Вероятно, это взаимное влияние катионов Na и внедренных анионов связано с возникновением ассоциатов Na и избыточных анионов. Образцы №№ 10 и 11 и после первого, и после повторного отжига (таб. 3) по данным визуального РФА были многофазными. В образцах присутствует фаза на основе моноклинного Bi7 F11 O5 [19], обозначенная М. Таким образом закалить предположительно кубический высокотемпературный твердый раствор на основе b-BiOy F3-2y [15] не удалось. Единственная фаза в образце № 14(II), а также одна из двух фаз в образцах № 7(I), № 14(I) и № 13(II), проиндицирована в моноклинной сингонии с параметрами, близкими к данным в [19] для фазы Bi7 F11 O5 . Результаты индицирования приведены в таб. 16, 17, 18 и 19 соответственно, параметры – в таб. 20. Параметры ее ячейки в образцах различаются, из чего следует, что на основе фазы Bi7 F11 O5 образуется твердый раствор М. Таблица 6. Результаты индицированиярентгенограммы фазы Ф в образце № 1. Сингония – кубическая. Параметр ячейки: а= 5.785(1) Å
Таблица 7. Результаты индицирования рентгенограммы фазы Ф в образце № 4. Сингония – кубическая. Параметр ячейки: а= 5.799(1) Å
Таблица 7. Результаты индицирования рентгенограммы фазы Ф в образце № 5. Сингония – кубическая. Параметр ячейки: а= 5.799(1) Å
Таблица 9. Результаты индицирования рентгенограммы фазы Ф в образце № 7(II). Сингония – кубическая. Параметр ячейки: а= 5.801(1) Å
Таблица 10. Результаты индицирования рентгенограммы фазы Ф в образце № 8(II). Сингония – кубическая. Параметр ячейки: а= 5.794(2) Å
Таблица 11. Параметры элементарных ячеек фазы Ф образцов разрезаNax Bi1-x (O,F)2.36 .
Таблица 12. Параметры элементарных ячеек фазы Ф образцов разрезаNa0.05 Bi0.95 (O,F)2+y .
Рис. 10. Параметры кубической элементарной ячейки фазы Ф разреза Nax Bi1-x (O,F)2,36 .
Рис. 11. Зависимости параметра кубической элементарной ячейки фазы Ф от анионного избытка Образец № 13(II) и № 14(I) содержали две фазы (таб. 13, 14), одна из которых – М, а другая – кубическая флюоритоподобная фаза. Образец № 13(I) содержал только одну кубическую фазу (таб. 15), а № 14(II) – только М (таб. 16). Можно сделать вывод о наличии области гомогенности кубической фазы со структурой флюорита, предположительно на основе высокотемпературного Образец № 12, состав которого соответствует формуле BiOF, уже после первого отжига (таб. 4) распался на несколько фаз. При дальнейших отжигах его фазовый состав практически не изменялся. На рентгенограммах видны рефлексы фазы М. Вероятно предполагавшийся в [15] полиморфный переход в кубическую модификацию при 620°С происходит с одновременным изменением состава и кубический b-BiOF не закаливается. Т.к. после дополнительного отжига в течение 17 часов при 500°С фазовый состав образца не изменился, можно предположить, что изменение состава необратимо или обратный процесс затруднен кинетически. Таблица 13. Результаты индицирования рентгенограммы фазы М в образце № 14(II). Сингония – моноклинная. Параметры ячейки: а= 13.57(2) Å b= 5.526(6) Å c= 9.179(7) Å b= 96.45(7)°
Таблица 14. Результаты индицирования рентгенограммы фазы М в образце № 7(II). Сингония – моноклинная. Параметры ячейки: а= 13.58(2) Å b= 5.525(5) Å c= 9.186(6) Å b= 96.48(7)°
Таблица 15. Результаты индицирования рентгенограммы фазы М в образце № 13(II). Сингония – моноклинная. Параметры ячейки: a= 13.52(1) Å, b= 5.543(2) Å, c= 9.165(5) Å, b= 96.47(5)°
Таблица 16. Результаты индицирования рентгенограммы фазы М в образце №14(I). Сингония – моноклинная. Параметры ячейки: a= 13.55(2)Å b= 5.529(4)Å c= 9.179(6)Å b= 96.49(6)°
Таблица 17. Параметры элементарной ячейки
Таблица 18. Рентгенографические данные для образца № 13(II).
Таблица 19. Рентгенографические данные для образца № 14(I).
Таблица 20. Результаты индицирования рентгенограммы фазы Ф' в образце № 13(II). Сингония – кубическая. Параметр ячейки: а= 5.794(1) Å
Выводы. 1. Проведен анализ литературных данных по системе 2. Проведен синтез и идентификация безводного BiF3 . 3. Методом твердофазного синтеза получены 14 образцов системы. Образцы изучены методом РФА. 4. Подтверждена невозможность при данных условиях закалить высокотемпературные фазы b-BiOy F3-2y и b-BiOF, обе со структурой флюорита. Обнаружены области гомогенности твердых растворов на основе моноклинного Bi7 F11 O5 и на основе кубического b-BiOF. 5. Определены параметры элементарной ячейки флюоритоподобного твердого раствора Ф на разрезах Nax Bi1-x (O,F)2,36 и Na0 , 05 Bi0,95 (O,F)2 + y . 6. Установлено расширение области гомогенности флюоритоподобного твердого раствора Ф при 600 и 650°С. Уточнены его границы. Список литературы. 1. Azad A.M., Larose S., Akbar S.A.// J. Mater. Sci., – 1994, V. 29, №. 16,P. 4135. (Цит. по РЖ Хим., 6Б3216, 1996.) 2. Alcock C.B., Li Baozhen, Fergus J.W., Wang Li // Solid State Ionics, 1992, V. 53-56,№ 1, P. 39. 3. Патент. "Oxygen generator having honeycomb structure made of oxygen conducting materials" William N. Lawless. U.S. US 5,205,990 (Cl 422-121; C25B9/00), 27 Apr. 1993. (Цит. по Chem. Abs., P 126998, II 1993.) 4. Новикова Е.Н., Федоров П.П., Зимина Г.В., Заманская А.Ю., Широков Ю.В., Степина С.Б., Федоров П.И., Прокопец В.Е., Соболев Б.П.// Ж. Неорган. Химии. – 1981, Т. 26, № 3, С. 774. 5. Lucat C., Sorbe P., Portier J., Hagenmuller P.// Mat. Res. Bull. – 1977, V. 12, № 2, P. 145. 6. Laborde P., Reau J.-M.// Rev. Chim. Miner. – 1986, V. 23, P. 523. 7. Справочник химика. – М., 1962, Т.1, С. 419, 446. 8. Shannon R.D.// Acta Cryst. – 1976, V. A32, P. 761. (Цит. по [11].) 9. Турова Н.Я. Неорганическая химия в таблицах. – М., 1997. 10. Большой энциклопедический словарь. Химия. – М., 1998, С. 365. 11. Серов Т.В. Дипл. работа. – М., МГУ, 1999. 12. Medernach J.W., Snyder R.L.// J. Amer. Ceram. Soc. – 1978, V. 61, 13. Radaev S.F., Simonov V.I., Kargin Yu.F.// Acta Cryst., Struct. Sci. – 1992, V. B48, № 5, P. 604. (Цит. по Chem. Abs., 223545s,II 1992.) 14. Марушкин К.Н., Алиханян А.С.// Докл. Акад. Наук, – 1993, Т. 329,№ 4, С. 452. 15. Калинченко Ф.В. Диссертация на соиск. ученой степени канд. хим. наук. – М., МГУ, 1982. 16. Ардашникова Е.И., Борзенкова М.П., Калинченко Ф.В., Новоселова А.В.//Ж. Неорган. Химии. – 1981, Т. 26, № 7, С. 1727. 17. Калинченко Ф.В., Борзенкова М.П., Новоселова А.В.// Ж. Неорган. Химии. – 1981, Т. 26, № 1, С. 222. 18. Калинченко Ф.В., Борзенкова М.П., Новоселова А.В.// Ж. Неорган. Химии. – 1983, Т. 28, № 9, С. 2351. 19. Laval J.P., Champarnaud-Mesjard J.C., Frit B., Britel A., Mikou A.// Eur. J. Solid State Inorg. Chem. – 1994, V.31, № 10, P. 943. (Цит. по Chem. Abs., 95105n, I 1995.) 20. Вечер Р.А., Володкович Л.М., Петрович И.А.// Твердые электролиты и их аналитическое применение, 3 Всесоюзный симпозиум. Тезисы докладов. – Минск, 1990, C. 13. (Цит. по РЖ Хим., 14Б3232, 1990.) 21. Федоров П.П., Янкин Д.Д., Зимина Г.В., Степина С.Б.// Ж. Неорган. Химии. – 1979, Т. 24, № 10, C. 2831. 22. Карасева О.С. Курсовая работа по неорганической химии. – М., МГУ, 1997. 23. Ueda W., Thomas J.M.// J. Chem. Soc., Chem. Commun. – 1988, № 17, P. 1148. 24. Ueda W., Thomas J.M.//Proc. Int. Congr. Catal., 9th , 1988, part 2, P.960. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||