Министерство образования российской федерации
Самарский государственный университет
Химический факультет
Кафедра органической химии
Специализация органическая химия
СИНТЕЗ 5`-Р-(ДИАМИНОАДАМАНТИЛ)- 2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИН-МОНОФОСФАТА
Курсовая работа
Выполнила студентка
4 курса 441 группы
Зенина Наталья Ивановна
________________________
Научный руководитель д.х.н.
проф. Пурыгин П.П.
________________________
Работа защищена
²_____²____________2003 г.
Оценка__________________
Зав. каф. ОХ д.х.н.
проф. Пурыгин П.П.
________________________
Самара
2003
СОДЕРЖАНИЕ
| 1. Введение |
3 |
| 2. Обзор литературы |
4 |
| 2.1. Перспективы использования адамантана |
4 |
| 2.2.Фармакологические свойства адамантана |
5 |
| 2.3. Клиническое применение производных адамантана |
5 |
| 2.4. Противовирусная активность производных адамантана |
8 |
| 2.5. Противоспидовая активность производных адамантана |
9 |
| 2.6. Противоопухолевая активность производных адамантана |
13 |
| 2.7. Другие биологически активные производные адамантана |
14 |
| 2.8. Синтез адамантансодержащих соединений включающих пуриновые и пиримидиновые кольца |
16
|
| 3. Экспериментальная часть |
19 |
| 3.1. Реагенты и оборудование |
19 |
| 3.2. Синтез 2`,3`-о-изопропилиденаденозина |
19 |
| 3.3. Синтез 5`-р-(дихлор) -2`,3`-о-изопропилиденаденозинмонофосфата |
20 |
| 3.4. Синтез аминоадамантана |
20 |
| 3.5 Синтез 5`-р-(диаминоадамантил)- 2`,3`-о-изопропилиденаденозин-монофосфата |
21
|
| 4. Обсуждение результатов |
22 |
| 5. Вывод |
26 |
| 6. Список использованных источников |
27 |
1.ВВЕДЕНИЕ
Актуальность работы: В современной химии одной из актуальных проблем является синтез биологически активных производных адамантана, которые в дальнейшем могут быть использованы как лекарственные препараты при лечении онкологических больных в том числе и ВИЧ-инфицированных.
Целью данной работы является синтез модифицированного нуклеозида по углеводной части молекулы, к которым в последние десятилетия сильно возрос интерес, как к потенциальным противоопухолевым и противовирусным препаратам.
Практическая ценность работы состоит в получении нового производного адамантана, биологическая активность которого обусловлена особенностями структуры адамантана, его симметрией, большим объемом и значительной липофильностью молекулы. Так уже в 70-е гг. XX в. в медицине широко использовали аминопроизводные адамантана, обладающие противовирусной активностью в отношении штаммов вирусов гриппа А и В [1].
Научная новизна: Показана принципиальная возможность получения 5`-р-(диаминоадамантил)-о-изопропилиденаденозинмонофосфата.
2. ОБЗОР ЛИТЕРАТУРЫ
2.1. ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ АДАМАНТАНА
Химия адамантана и его производных является сравнительно молодым разделом органической химии (со времени обнаружения адамантана в нефтях прошло примерно 70 лет). В то же время, наблюдается постоянный рост числа исследований в этой области, особенно начиная с 70-х годов ХХ столетия. Одной из причин этого является перспективность практического использования его производных.
На основе адамантана получают алмазоподобные пленки (свое название адамантан получил от греческого “непобедимый” – греческое название алмаза), по своей твердости лишь в 3 раза уступающие алмазу. Они были получены из паров адамантана при наложении двух видов электрического разряда – тлеющего и высокочастотного.
Алкиладамантаны используют как углеводородное реактивное топливо. Масла, полученные на основе алкиладамантанов обладают термостойкостью, низким индексом вязкости, поэтому их рекомендуют использовать в качестве кабельного масла. Также алкиладамантаны обладают бактерицидным действием, вследствие чего рекомендовано использовать их в качестве антимикробных присадок к смазочным материалам.
Известно, что Управление вооружений армий США намеревалось провести испытания нового взрывчатого вещества – 1,3,5,7-тетранитроадамантана, обладающего высокой стойкостью к ударным нагрузкам и в то же время по эффективности превосходящего “классический” тол.[2]
Перфторированный адамантан применяется в качестве компонента искусственной крови. [3]
2.2. ФАРМОКОЛОГИЧЕСКИЕ СВОЙСТВА АДАМАНТАНА
Высокая липофильность и объемная структура адамантильного радикала при его введении в молекулы различных биологически активных соединений в значительной мере модифицирует их фармакологическое действие. Таким образом была модифицирована структура ряда антимикробных, противоопухолевых, иммунодепрессивных, гормональных, аналгетических, противовоспалительных, нейротропных средств. [133] Так введение адамантила в 1-β-D-арабинофуранозил, цитозин привело к пролонгированию эффекта полученного соединения. При этом молекулярный механизм действия этого вещества не изменяется, так как для проявления им цитостатической активности требуется гидролиз и освобождение от адамантана. Присоединение адамантильного радикала к пуриновому антиметаболиту 6- тиоинозину также усилило иммуносупрессивную активность производного по сравнению с исходным соединением. [4]
Предполагают, что модификация биологической активности связана с изменением пространственного строения, гидрофобности и липофильности соединений, более благоприятными условиями их транспорта через биологические мембраны. [3]
На данный момент синтезировано более 1000 новых производных адамантана, в том числе и по мостиковому положению. Фармакологическое изучение показало наличие среди них веществ, обладающих выраженной психотропной, курареподобной, иммунотропной, противовирусной, антикаталептической, противоаллергической активностями, а также соединений, влияющих на ферментативную систему печени. [5]
2.3. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ АДАМАНТАНА
Введение в адамантан в положение 1 или 3 различных заместителей приводит к тому, что его можно использовать во многих областях медицины. Еще в 1966 г. в медицинскую практику был введен гидрохлорид 1-аминоадамантана в качестве антивирусного средства. В медецине это соелинение часто называют мидантаном или амантадином, но фирменное название симметрел: [2]

Изначально его применяли только как антигриппозный препарат. В настоящее же время мидантан наиболее часто используется в неврологической клинике для лечения болезни Паркинсона и паркинсонического синдрома (паркинсонизм является одним из наиболее распространенных заболеваний центральной нервной системы и встречается у 1-2,5% людей, причем риск заболевания с возрастом увеличивается). [4]
Механизм действия симметрела состоит в том, что он не убивает вирусы, а лишь блокирует их проникновение в клетку, вследствие чего он особенно эффективен для профилактики и на ранних этапах заболевания. Имеется, однако, другая точка зрения на механизм действия препарата, согласно которой аминоадамантан и его производные “вмешиваются” в ранние этапы репродукции вирусов, а их ингибирующее действие связано с латентным периодом – началом репликации и синтеза вирусспецифических РНК. [2]
В качестве других средств против заболеваний центральной нервной системы в клинике прошли испытания бемантан (I) (2-(N-бензоиламино)адамантан), димантан (II) (2,2`-ди(адамантил)амин гидрохлорид), кемантан (III) (1-гидроксиадамантан-4-он), адапромин (IV) (2-этил-1-адамантанметиламина гидрохлорид) и мемантин (V) (1,3-диметил-5-аминоадамантана). [4]
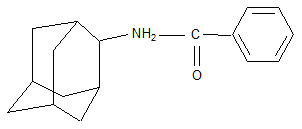 (I) (I) |
Бемантан
|
 (II) (II) |
Димантан
|
 (III) (III) |
Кемантан
|
 (IV) (IV) |
Адапромин
|
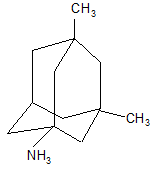 (V) (V) |
Мемантин
|
 (VI) (VI) |
Ремантадин |
В медицине широко используется ремантадин (VI) (2-метил-1-адамантанметиламина гидрохлорид) как антигриппозное лекарственное вещество. [2] Помимо этого ремантадин ингибирует репродукцию вируса Синдбис из-за того, что он как липофильное слабое основание способен повышать рН эндосомального содержимого и препятствует депротенизации вируса. [6]
2.4. ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ АДАМАНТАНА
Среди вирусных инфекций грипп и другие острые заболевания дыхательных путей, вызываемые РНК-содержащими вирусами, занимают ведущее место. Поскольку стадии размножения вируса в зараженной клетке еще до конца не изучены, то трудно сказать с каким именно процессом связано противовирусное действие активных производных адамантана. Однако установлено, что производные адамантана не влияют на адсорбцию вирусных частиц на поверхности чувствительных клеток и проникновение вируса в клетку [7].
Как уже упоминалось, антивирусной активностью обладают аминопроизводные адамантана (ремантадин и симметрел). Механизм их действия связан с блокированием функции ионных каналов клетки или белка вируса группы А. В институте нефтехимического синтеза были разработаны новые лекарственные вещества, которые ингибировали репродукцию вирусов гриппа А и В, а также вирусов простого герпеса. Эти лекарственные вещества представляют собой комплексные препараты адамантанов и полимерных матриц (поликарбоксилаты анионного типа на основе малеинового ангидрида и дивинилового спирта). Данные соединения обладают токсичностью в 5-10 раз ниже, чем у ремантадина [8].
Также осуществлена трехкомпонентная конденсация инозиндиальдегида, пропандиенфосфонистой кислоты и 1-аминометиладамантана, приведшая к образованию 9-[(1`,4`-морфолил)-3`-окси-N`-(1-адамантилалкил)-5`-пропандиенфосфинат-6`-оксиметил-2`]-гипоксантинов, обладающих противовирусной активностью в отношении РНК и ДНК-содержащих инфекционных и онкогенных вирусов [3].
Из литературных данных известно, что одним из лекарственных средств против вируса гриппа А и В является 2-(адамант-2-ил) пиперидин [9]:

2.5. ПРОТИВОСПИДОВАЯ АКТИВНОСТЬ ПРОИЗВОДНЫХ
АДАМАНТАНА
Число людей заразившихся и умерших от СПИДа постоянно возрастает, лекарственные вещества не всегда эффективны. По этим причинам актуально использовать в качестве иммунорегуляторов, в частности, для борьбы с вирусом СПИДа, аминоадамантановые производные следующей формулы:

где R-R3
=H, арил, гетерофил, замещенный или незамещенный NH2
, алкил, алкенил, алкинил [10].
Анти-ВИЧ-активностью обладает также кемантан (III). Это было показано в экспериментах с использованием ВИЧ-инфицированных человеческих МТ-4 лимфобластодных клеток. Кемантан при добавлении в культуру указанных клеток после их заражения вирусом, обладал анти-ВИЧ-активностью в широком диапазоне концентраций. При концентрации 500 мкг
/мл
он ингибировал экспрессию вирусных протеинов на поверхности инфицированных клеток на 50%. При этом наблюдалось уменьшение (на 30% по сравнению с контролем) выхода растворимых ВИЧ-антигенов в культурную среду [11].
Японские исследователи разработали метод синтеза производных 3`-азидо-3`-дезокситимидина содержащих фрагмент адамантана в положении 5`-нуклеозида. Изучение биологического действия сложного эфира (VIII), полученного из азидотимидина (VII) и (1-адамантил)-уксусной кислоты, показало, что его концентрация в паренхиматозной ткани головного мозга в 18 раз превышает величину, полученную в сравнительном эксперименте с 3`-азидо-3`-дезокситимидином. Следовательно, введение фрагмента адамантана в 3`-азидо-3`-дезокситимидин облегчает транспорт этого лекарственного средства в ткани головного мозга, куда проникает вирус СПИДа и поражает центральную нервную систему.
Схема 1.
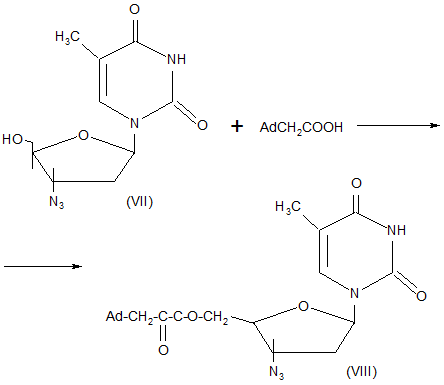
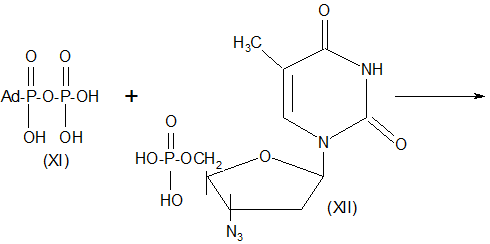
С целью поиска новых антиспидовых препаратов осуществлен синтез 3`-(1-адамантил) тиоуреидопроизводного тимидина (Х) взаимодействием 3`-аминотимидина (IX) с (1-адамантилфосфонил) фосфата (XI) с монофосфатом азидотимидина (XII) [3].
Схема 2.

Схема 3.

Патентуют использовать в качестве противовирусноактивных соединений, в том числе в отношении ВИЧ, полимерные аналоги адамантана.
 где n=30-50 где n=30-50
x=0,1-0,25
M=H, NH2
, щелочные металлы
Z=группа ab
a= NH, O
b=C1
-C8
алкилен [12].
2.6. ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ ПРОИЗВОДНЫХ
АДАМАНТАНА
Патентуют способ лечения рака путем вызывания апоптоза раковых клеток с помощью соединений формулы:
где W=CH2
, O, S, SO, SO2
R1
=H, галоген, алкил
R2
=ОН, замещенный алкил, незамещенный алкил
R3
=Н, ОН, алкил, алкокси
R4
=Н, алкил, галоген, алкоксил
R5
=галоген, замещенный алкил, незамещенный алкил
R6
=Н, ОН, галоген, алкокси
R7
=Н, галоген
R8
=Н, галоген, алкил
R9
=Н, ОН, галоген
Y=алкил, алкилен, О, С=N
|
NH2
Z=N, CH
X=Q, Q1
, Q2
. [13]
Противоопухолевая активность среди адамантанзамещенных фософорилированных нуклеозидов найдена у 5`-o-(1-адамантилалкил)фосфорилпроизводных 1-β-D-арабинофуранозилцитозина [3].
Сложные эфиры адамантанкарбоновой кислоты и некоторые нуклеотиды общего строения

(где R=6-азаурацил, 6-меркаптопурил, аденин, гипоксантин) проявляют антиопухолевую активность.[14]
2.7. ДРУГИЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ
АДАМАНТАНА
Замещенные амиды адамантанкарбоновой кислоты могут служить снотворными средствами. Введение адамантильного остатка в 2-оксинафтохинон приводит к получению антималярийных препаратов. [14]
Адамантиламиноспирты и их соли обладают выраженным психостимулирующим действием и при этом мало токсичны. [15]
Некоторые N-(адамант-2-ил)анилины проявляют нейротропную активность [16], а биологическая активность N-(адамант-2-ил)гексаметиленимина проявляется по отношению к паркинсоническому синдрому [17].
В качестве иммунодепрессантов и как противовоспалительные средства предлагается включать в состав лекарственных препаратов соединения следующего строения:

где R=H, Ph
R1
=H, алкил
А=адамантил
Х=О
Y=ОН
Извилистая линия обозначает С1
-С5
В=фениленовое или циклогексиленовое кольцо. [18]
Предложен способ лечения лейкемии и других заболеваний, связанных с недостаточностью функций ионотропных ацетилхолиновых рецепторов. Способ основан на использовании лекарственных форм, содержащих производные адамантана следующей структуры:

где R1
и R2
=H, алкил, или вместе с атомом азота образуют гетероциклическое кольцо.
R3
и R4
=Н, алкил, циклоалкил или фенил
R5
=Н или фенил [19].
Из литературных данных известно, что данные вещества могут быть использованы как лекарственные средства для борьбы с нейродегенеративными заболеваниями мозга человека и животных, в частности, вызываемых белками – прионами (заболевание скрапия). Данные белки вызывают гибель нейронов. Производные адамантана типа (XIV) ингибируют действие этих белков [20].
Кроме того алкильные производные аминоадамантана схожие по строению с соединениями типа (XIV) могут применяться для лечения заболеваний внутреннего уха и шума в ушах [21].
2.8. СИНТЕЗ АДАМАНТАНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
ВКЛЮЧАЮЩИХ ПУРИНОВЫЕ И ПИРИМИДИНОВЫЕ КОЛЬЦА
Высокая биологическая активность и малая изученность производных адамантана приводит к высокому интересу по синтезам новых производных адамантана. Так реакцией присоединения 1,3-дегидроадамантана к 2-метилпиридину (2-пиколину) был получен 2-(адаман-1-илметил)пиридин [22]. Патентуется способ получения 5-[3(4)-R-1-адамантил]-пиримидинов общей формулы:

где R, R1
=Н, Рh, низший алкил.
R1
, R2
, R3
, R4
=Н, ОН, NН2
, галоген.
Данные соединения были получены взаимодействием адамантанола-1 с соответствующим пиримидиновым основанием в среде трифторуксусной кислоты при молярном соотношении адамантанол : пиримидиновое основание : трифторуксусная кислота 1 : 1 : 6 [23].
Преображенской и сотрудниками было осуществлено взаимодействие уридина с дихлорангидрином 1-адамантилфосфоновой кислоты в пиримидине. В результате получили неразделимую смесь двух веществ [4]. Дальнейшие исследования показали, по данным ЯМР, масс-спектроскопии и отсутствию подвижности при электрофорезе на бумаге в фосфатно-щелочном (рН 7,7) и боратном (рН 9,2) буферах, полученные соединения являются изомерными цикло-(1-адамантил)фосфонатами уридина (IIa) и (IIIa):

где X=OH – a
X=OAc – б
Х=F – в
Аналогичные соединения образовывались при взаимодействии 5`-о-ацетилуридина и 5`-фтор-5`-дезоксиуридина с дихлорангидридом 1-адамантилфосфоновой кислоты. Однако реакция с 2`,3`-о-изопропилиденуридином в этих же условиях не пошла [25]. Смесь диастереомерных по фосфору соединений получается также при взаимодействии 5-бром-, 5-фтор-, 6-азауридина или их 5`-о-производных с дихлорангидридом 1-адамантилфосфоновой кислоты [26].
При взаимодействии дихлорангидрида 1-адамантилфосфоновой кислоты с пуриновыми основаниями получается многокомпонентная смесь с большим содержанием исходного нуклеозида. Однако реакция идет по той же схеме с образованием диастереомерных соединений:
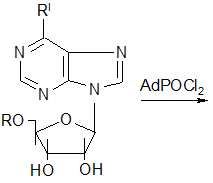 |
 |
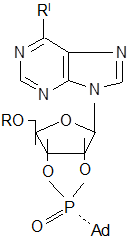 |
| (I а-г) |
(II а-г) R-изомер |
(III а-г) S-изомер |
где а: R=Н, R`=NН2
;
б: R=Ac, R`=NH2
;
в: R=H, R`=SCH3
;
г: R=Tr, R`= SCH3
.
Количество R-изомера в 2,5-3 раза больше количества S-изомера [27].
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1. РЕАГЕНТЫ И ОБОРУДОВАНИЕ
Перемешивание аденозина с ацетоном, концентрированной серной кислотой и безводным сульфатом меди проводили на магнитной мешалке.
Упаривание всех растворов поводили на роторном испарителе "Rotodest" под вакуумом 15-20 мм. рт. ст.
Инфракрасный спектр синтезированного соединения регистрировали на спектрометре "ИКС-29", в таблетках из KBr.
В качестве реагентов были использованы
1) высушенный аденозин;
2) абсолютированный ацетон;
3) прокаленный сульфат меди;
4) концентрированная серная кислота;
5) триэтилфосфат;
6) треххлористая окись фосфора;
7) сухой гидроксид кальция;
8) водный раствор гидроксида аммония;
9) вода;
10) бензол;
11) эфир;
12) абсолютированный хлороформ;
13) сухой гидроксид натрия;
14) гидрохлорид аминоадамантана.
3.2. СИНТЕЗ 2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНА
0,4 г (1,5∙103
моль) аденазина высушивали в пистолете Фишера в течение 10-12 ч при 100 0
С (в парах толуола над пятиокисью фосфора) и готовили суспензию с 40 мл ацетона, добавляли 2 г (1,25∙10-2
моль) безводного сульфата меди и 0,01 мл концентрированной серной кислоты. Суспензию перемешивали 48 ч при 38 0
С. Осадок отделяли, промывали 2-3 раза небольшим количеством ацетона и объединенный фильтрат встряхивали в течение 1 ч с 0,4 г сухого гидроксида кальция. Осадок отфильтровывали и промывали ацетоном 2 раза по 10 мл. Фильтрат упаривали досуха. Выход продукта составил 0,21 г (52% от теоретического), белые кристаллы, t.пл. 218-220 0
С (лит 220-222 0
С) [26].
3.3. ПОЛУЧЕНИЕ 5`-Р-(ДИХЛОР)-2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНМОНОФОСФАТА
Охлаждали до 0 0
С раствор треххлористой окиси фосфора (0,15 мл) в триэтилфосфате (8 мл) добавляли 2`,3`-о-изопропилиденаденозина (0,75∙10-3
моль). Смесь выдерживали 24 ч при 4 0
С и затем нейтрализовали 25% водным раствором гидроксида аммония и оставляли на 1 ч при 4 0
С. Затем добавляли воду (20 мл), смесь экстрагировали бензолом (10 мл), а затем эфиром (2 х 10 мл). Водный слой отделяли, упаривали досуха и растворяли в воде (80 мл). Нуклеотид выделяем ионнообменной хроматографией на колонке (2,5 х 10 см), неподвижная фаза – Дауэкс-50 (Н+
), роль подвижной фазы выполняет вода. Собирали частицы, поглощающие в УФ-области. Объединяли, упариваем досуха, соупаривали с 10% водным раствором гидроксида аммония (6 мл) растворяли в воде (10 мл) и подвергали сухой заморозке. Выход составил 0,126 г (60% от теоретического) [29].
3.4. СИНТЕЗ АМИНОАДАМАНТАНА
К водному раствору 1,87 г (1 моль) гидрохлорида аминоадамантана добавляли 0,40 г (1 моль) NaOH. Смесь экстрагировали эфиром (2 х 15 мл). Органический слой отделяли и выпаривали досуха. Выход аминоадамантана 1,83 г (98%), t.пл.=210 0
С.
3.5. СИНТЕЗ 5`-Р-(ДИАМИНОАДАМАНТИЛ)-2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНМОНО-ФОСФАТА
К полученному 5`-р-(дихлор)аденозинмонофосфату добавили 0,585 г раствора аминоадамантана в 2 мл абсолютного хлороформа. Осадок отфильтровывали. Фильтрат упаривали. Выход продукта составил 0,065 г (52% от теоретического).
4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Синтез 2`,3`-о-изопропилиденаденозина осуществлялся взаимодействием аденозина с ацетоном в среде абсолютного ацетона при постоянном перемешивании. Схема этой реакции такова:
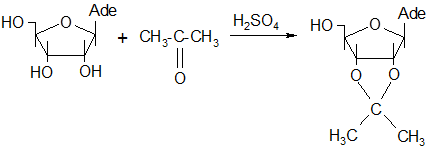
Предполагаемый механизм этой реакции следующий [29]:


Синтез 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфата осуществлялся взаимодействием 2`,3`-о-изопропилиденаденозина с треххлорокисью фосфора в присутствии водного раствора гидроксида аммония по следующей схеме:
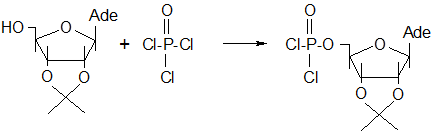
Предполагаемый механизм этой реакции следующий:

Синтез аминоадамантана осуществлен реакцией нейтрализации гидрохлорида аминоадамантана гидроксидом натрия по следующей схеме:

Синтез 5`-р-(диаминоадамантил)- 2`,3`-о-изопропилиденаденозинмоно-фосфата осуществлялся взаимодействием аминоадамантана с 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфатом. Схема этой реакции такова:

Предполагаемый механизм этой реакции следующий [30]:
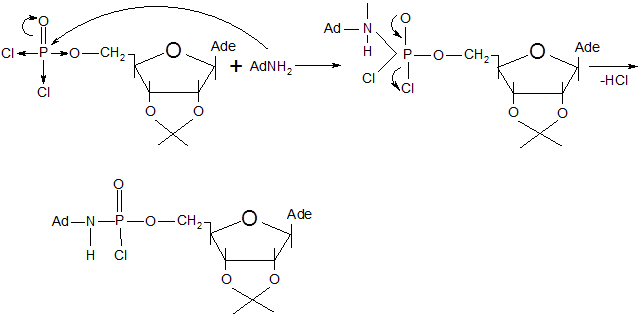

Чистота 5`-р-(диаминоадамантил)-2`,3`-о-изопропилиденаденозинмонофосфата была доказана методом ТСХ в системе бутанол : вода : уксусная кислота – 5:3:2 Rf
=0,78 при УФ проявлении.
Наличие адамантильного остатка подтверждено ИК-спектроскопией. В ИК-спектре прослеживаются полосы, характерные для С-С (800 см-1
, 970 см-1
), Н-С-С (1155 см-1
, 1350 см-1
), Н-С-Н (1453 см-1
, 2853 см-1
), С-С-С (2907 см-1
, 2933 см-1
) адамантильного ядра и P-N (890 см-1
).
5. ВЫВОДЫ
1. Показана принципиальная схема получения 5`-р-(диаминоадамантил)-2`,3`-о-изопропилиденаденозинмонофосфата взаимодействием аминоадамантана и 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфата.
2. Чистота синтезированного соединения доказана методом ТСХ. Структура доказана методами ИК-спектроскопии.
6. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Касьян Л.И., Касьян А.О., Голодаева Е.А. // журн. органич. химии. 2000. т.36. №12. с. 1776-1779.
2. Багрин Е.И. Адамантаны: получение, свойства, применение. М.:Наука, 1989. 264 с.
3. Литвинов В.П. //Химия гетероциклических соединений. 2002. №1. с. 12-39
4. Морозов И.С., Петров В.И., Сергеева С.А. Фармакология адамантанов. Волгоград: Волгоградская мед. академия, 2001. 320 с.
5. РЖ Химия. 2000. 10. 19029.
6. Андронова В.Л. // Антибиотики и химотерапия. 1996. т.41. №718. с. 26-30.
7. Механизмы антивирусного действия производных адамантана / Под ред. М.К. Индугена. Рига: Зинатне, 1981.
8. РЖ Химия 2001. 10. 19067К.
9. РЖ Химия 2002. 15. 19061.
10. Патент 6255348 США // РЖ Химия 2002. 15. 19042П.
11. Ковалев И.Е., Щипулина Н.В. // Доклады Российской академии наук. 2001. т. 378. №6. с. 819-822.
12. Заявка 99102174/14 Россия // РЖ Химия 2001. 11. 19053П.
14. Севастьянова В.В., Краюшкин М.М., Юрченко А.Г. // Успехи химии. 1970. т. 39. вып. 10. с. 1721-1753.
15. IX Международная научная конференция по химии и технологии каркасных соединений // Нефтехимия. 2001. т. 41. №6. с. 478-480.
16. РЖ Химия 1998. 22. Ж 195.
17. РЖ Химия 2000. 06. 190359.
18. Заявка 98122430/ Россия // РЖ Химия 2001. 11. 19047П.
19. Заявка 1201234 ЕАВ // РЖ Химия. 2002. 20. 190241П.
20. Заявка 4229805 ФРГ // РЖ Химия. 1996. 16. 0230П.
21. Заявка 19528388 Германия // РЖ Химия. 1999. 01. 0345П.
22. РЖ Химия. 2002. 17. 19Ж95.
23. Патент 2064930 Россия // РЖ Химия. 1997. 13Н. 87П
24. Преображенская М.Н., Мельник С.Я., Олейник Д.М., Шепелев Е.С., Турчин К.Ф., Санин П.И. // Биоорганическая химия. 1975. т.1. №2. с. 277-278.
25. Преображенская М.Н., Мельник С.Я., Олейник Д.М., Шепелев Е.С., Турчин К.Ф., Санин П.И. // Биоорганическая химия. 1975. т.2. №5. с. 627-631.
26. M.N. Preobrazhenskaya, S.Ya. Melnik, D.M. Oleinik, E.S. Shepelev, P.I. Sanin // Carb. Nucleosides, Nucleotides. 1975. т.2. №2. с. 413.
27. Недоаезова Т.П., Мельник С.Я., Ярцева И.В., Преображенская М.Н. // Биоорганическая химия. 1978. т.4. №8. с. 1058-1064.
28. Овчинников Ю.А. // Биоорганическая химия. 1978. т.12. №2. с. 205.
29. A.V. Azhayer, A.M. Ozols, A.S. Bushnev, N.B. Dyatkina, S.V. Kochetkova, L.S. Victorova, M.K. Kunhanova, A.A. KrayevskyandB.P. Ejottikh // NucleicAcidsResearch. 1979. т.6. №2. с. 625-643.
|