Контрольная работа
Павлодарский государственный университет им. С. Торайгырова
2005
Исторический очерк биохимии.
Как самостоятельная наука биохимия сформировалась на рубеже XIX – XX веков. До середины XIX века биохимия существовала как раздел физиологии и называлась физиологическая химия. Однако накопление фактического материала в области строения биологических структур, а также идентификация простейших метаболических процессов сыграли значительную роль в становлении биохимии как самостоятельной науки.
Бурное развитие органической химии в первой трети XIX века оказало огромное влияние на формирование структурной биохимии. Точкой отсчёта можно считать 1826 год, когда Ф. Вёллер сообщил о первом синтезе органического вещества – мочевины из аммиака и циановой кислоты. Спустя 70 лет Э. Бухнер показал, что экстракты дрожжевых клеток переваривают крахмал, так же эффективно, как и живые дрожжевые клетки. Обе эти работы нанесли существенный удар по витализму – учению, согласно которому химические вещества живой природы синтезируются только с помощью особой жизненной силы, и дали мощный импульс дальнейшему развитию биохимии. Так, в 50 – х годах XIX века М. Бертло удалось синтезировать целый ряд органических соединений, свойственных живой природе. М. Шеврель заложил основы химии липидов, а Ф. Мишер открыл нуклеиновые кислоты, положив начало изучению этого класса веществ. Однако наибольший вклад в развитие структурной биохимии внёс Э. Фишер своими блестящими работами по анализу аминокислот, жиров и липидов.
Исследования процессов метаболизма также началось на рубеже XIX века. На основе открытого М.В. Ломоносовым закона сохранения материи и накопившихся к концу XVIII века экспериментальных данных французского учённого А. Лавуазье количественно исследовавший и объяснивший сущность дыхания, отметив роль кислорода в этом процессе. Работы Лавуазье стимулировали исследования по энергетике метаболизма и уже в начале XIX века были определены количество теплоты при сгорании 1 г. жиров, белков и углеводов. Примерно в это же время, работали Дж. Присли и Я. Ингенхуза был открыт процесс фотосинтеза. Из живых объектов К. Шесле выделил ряд органических кислот, Д. Руэль – мочевину, Ф. Конради – холестерин.
В XX веке большое число открытий привело к подлинному рассвету биохимии. Фундаментальные исследования в области энзимологии, химии белков, липидов, углеводов, идентификация молекулярных механизмов основных обменных процессов, а также структур и функций генома, вывели биохимию на уровень основной количественной биологической науки. Велика роль российских учёных в становлении и развитии биохимии. Приоритетные исследования белков и аминокислот (А.Я. Данилевский, С.С. Салазкин, М.В. Ненцкий и другие); витаминов (Н.И. Лунин, К.А. Сосик, В.В. Пашутин); тканевого дыхания (А.Н.Бах, В.И. Палладин); трансаминирования аминокислот (А.Е. Браунштейн) ; механизмов механохимического сопряжения (В.А. Энгельчардт) ; химии нуклеиновых кислот и механизмов биосинтеза белка (А.Н. Белозёрский, А.С. Спирин) ; биоэнергетике (В.П. Скулачёв); структуры и функции генома (Г.П. Георгиев) и работы других российских учёных внесли огромный вклад в современную биохимию.
Биологическая биохимия изучает различные структуры, свойственных живым организмам, и химические реакции, протекающие на клеточном и организменном уровнях. Основой жизни является совокупность химических реакций, обеспечивающих обмен веществ. Таким образом, биохимию можно считать основным языком всех биологических наук. В настоящее время как биологические структуры, так и обменные процессы, благодаря применению эффективных методов, изучены достаточно хорошо. Многие разделы биохимии в последние годы развивались столь интенсивно, что выросли в самостоятельные научные направления и дисциплины. Прежде всего можно отметить биотехнологию, генную инженерию, биохимическую генетику, экологическую биохимию, квантовую и космическую биохимию и так далее. Велика роль биохимии в понимании сути патологических процессов и молекулярных механизмов действия лекарственных веществ.
Общая характеристика витамина А. Биохимические функции. Авитаминоз.
Витамин А был открыт Н. Друшмандом в 1916 году. Этому открытию предшествовали наблюдения о наличии жирорастворимого фактора в пище, необходимого для нормального развития сельскохозяйственных животных. В дальнейшем было установлено, что имеется три витамина группы А: ретинол, или витамин А1, неоретинол – стереоизомер А1 и А2. Этот витамин необходим не только животным, но и человеку, и при его дефиците у человека появляются заболевания глаз – ксерофтальмия и гемералопия. Витамин группы А содержится только в животных продуктах, таких, как печень, рыбий жир, сливочное масло и других. В растительной пищи содержаться поратинойды, способные предупреждать А – авитаминоз. При поступлении в организм человека или животных они под влиянием фермента каротиназы превращаются в витамин А1. Ретинол представляет собой непредельный одноатомный спирт, состоящий из бета – ионного кольца, а также боковой цепи, содержащей два остатка изопрена и первичную спиртовую группу:
Витамин А – ретинол.
Витамин А2 отличается от ретинола наличием дополнительной двойной связью в бета – ионном кольце. Потребность человека в витамине А составляет 1,5 мг.
Витамин А и соответствующие провитамины – каротиноиды широко распространены в природе и находятся в основном в животных организмах.

Витамин А поступая в организм как в свободном, так и в эстерифицированном виде. Свободный ретинол сорбируется слизистой кишечника, а его эфиры сначала гидролизуются при помощи фермента гидролазы эфиров карбоновых кислот. На внутренней поверхности ворсинок кишечника происходит ресинтез эфиров ретинола, которые затем поступают в кровь или лимфу. В лимфе более 90 % витамина А находится в эстерифицированном состоянии. В крови витамин А связывается со специфическим ретинолом – связывающим белком, а затем депонируется в печени. Благодаря этому концентрация витамина А в сыворотке крови более или менее постоянна даже при некотором дефиците этого витамина в пище.
Витамин А в организме осуществляет разнообразные функции. Вскоре после открытия была установлена его необходимость для нормального роста, а также для процесса сперматогенеза. В дальнейшем было показано, что витамин А необходим для нормального эмбрионального развития, а его окислённая форма – ретиновая кислота – контролирует ростовые процессы. Биохимическая основа действия витамина А чаще всего связанна с влиянием на проницаемость клеточных мембран. С помощью радиоизотопной технике было установлено также, что витамин А сорбируется на мембранах эндоплазматического ретикулума, влияя на созревание и транспорт секреторных белков. Велика роль витамина А в фотохимических процессах зрения. В зрительном акте можно выделить изменение конформации пигментов под действием кванта света, формирование нервного импульса, а также релаксацию пигмента в исходное состояние. Пигмент, состоящий из ретиналя и белка опсина, называется родопсином, при замене ретиналя на гидроретиналь образуется порфиропсин. Пигменты локализованы в колбочках, расположенных в мембране сетчатки. При фотохимической реакции происходит поглощение квантов световой энергии зрительным пигментом – родопсином. Родопсин, который в качестве хромофора содержит 11 – цис – ретиналь, под действием света превращается в нестабильный продукт лумиродопсин. При этом происходит изменение конформации молекулы родопсина, которые инициирует формирование нервного импульса передающегося в мозг. Затем в результате фотоизомеризации образуется полный транс – ретиналь, который в конечном счёте распадается на транс – ретиналь и белок опсин. В результате действия фермента ретиналь изомеразы полный транс – ретиналь, который в темноте взаимодействует с опсином и регенерирует родопсин.
Среди заболеваний у людей, особенно в детском возрасте, связанных с недостатком витамина, гипо – и авитаминоз А встречаются относительно часто. Они обусловлены недостаточным поступлением витамина А с пищей или нарушением резорбции и обмена этого витамина ( эндогенное происхождение ).
По данным ВОЗ в мире ежегодно наблюдается не менее 100000 случаев ксерофтальмии. Наиболее частой причиной слепоты в Южной и Восточной Азии является перенесённая в детстве ксерофтальмия.
В НРБ клиническое появление авитаминоза А – явление крайне редкое.
У здоровых людей при смешанной диете потребности в витамине А обычно удовлетворяются. Пища, бедная животными белками, как правило, бедна и ретинолом. Поэтому гипо – и авитаминоз А сопровождается недостаточностью белков и гипотрофией.
Растительная пища, а главным образом зеленолистые овощи, как и овощи и фрукты жёлто – оранжевого цвета, к которым относятся морковь, абрикосы, шиповник, перец, помидоры и другие, содержат только провитамин А. Из каротиноидов витамин А – активностью обладают только бета – каротины ( приблизительно равна 1/6 активности ретинола ). Активность выражается в международных единицах: 1 МЕ витамин А = 0,3 мкг. Ретинола или 0,6 мкг. бета – каротина. Резорбция и превращение β – каротина в витамин А осуществляется в клетках кишечной мукозы, откуда по лимфатическому пути переносится и депонируется в печени. Посредством специфического транспортного белка ретинол переносится из печени к месту действия – клетке.
Подобно резорбции нейтральных жиров, витамин А в кишечнике нарушается при отсутствии панкреатической липазы и желчи, а также при нарушении функции слизистой оболочки кишечника, целиакии, целиакоподобном синдроме, фиброзе поджелудочной железы, циррозе печени, обтурационной желтухе, мальабсорбционном синдроме и некоторых также острых инфекционных заболеваниях. К последним относятся: сепсис, тяжёлая пневмония или тяжёлый гломерулонефрит, а также некоторые интоксикации с поражением печени. В следствии увеличенной экскреции гиповитаминоз А возможен и при хронических инфекционных заболеваниях и инфекциях мочевых путей.
При белковом голодании снижается белок, переносящий ретинол из печени и тканям, и уровень витамина А в плазме резко снижается.
Витамин А устойчив при обычной варке, разрушается при высокой температуре, при сушке и под влиянием окислителей. От окисления его предохраняет витамин Е.
В печени имеются значительные резервы витамина А, поэтому клинические проявления авитаминоза А наступают после продолжительного его дефицита.
Витамин А участвует в образовании фоточувствительных пигментов в сетчатке и обеспечивает ночное зрение, принимает участие в развитии костной ткани, в созревании эпителия кожи и слизистых глаз, пищеварительной, дыхательной и мочеполовой системы. Он играет важную роль в процессе ороговения и образования слизи.
Известна роль витамина А в стабильности мембран. Большие дозы приводят к руптурам лизосомных мембран с освобождением гидролаз. Подобные явления наблюдаются и при дефиците. При недостаточном поступлении витамина А клинические явления соответствуют нарушенным функциям организма, при осуществлении которых витамин А играет существенную роль. Понижение содержание витамина А в крови, соответственно в сетчатке, приводят к нарушению ночного зрения (“куриная слепота” – гемералопия) в следствии нарушения цикла зрительного пурпура. Участие витамина А в формировании клеток особенно отчётливо проявляется по отношению эпителия: при дефиците витамина А в эпидермисе и в эпителии слизистых наступают атрофические изменения базальных слоёв с плоско – клеточной метаплазией и ороговением. При дефиците витамина А в связи с отсутствием его воздействия на хрящевые клетки прекращается эндохрондральное окостенение как результат нарушения деления ядра и созревания хрящевых клеток в эпифизах.
О механизме общего неблагоприятного воздействия на организм дефицита витамина А, в смысле его влияния на рост, массу тела и устойчивость по отношению к инфекционным возбудителям, можно судить по некоторым биохимическим и морфологическим изменениям. Отставание роста и массы тела связывается с нарушением белкового обмена. Это отставание проявляется ещё больше при усилении катаболических процессов, обусловленными продолжительными вторичными инфекциями кожи и слизистых. Нарушение окостенения в эпифизах длинных трубчатых костей вызывает замедление роста в длину.
Роль АТФ.
Как известно в биоэнергетике живых организмов имеют значение два основных момента:
а) химическая энергия запасается путём образования АТФ, сопряжённого с экзергоническими катаболическими реакциями окисления органических субстратов;
б) химическая энергия утилизируется путём расщепления АТФ, сопряжённого с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии.
Встаёт вопрос, почему молекула АТФ соответствует своей центральной роли в биоэнергетике. Для его разрешения рассмотрим структуру АТФ
Структура АТФ4 –( при рН 7,0 тетразаряд аниона).
АТФ представляет собой термодинамически нестойкое соединение. Нестабильность АТФ определяется, во – первых, электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы, однако сильнее всего связи – Р – О – Р, и во – вторых, конкретным резонансом. В соответствии с последним фактором существует конкуренция между атомами фосфора за неподелённые подвижные электроны атома кислорода, расположенного между ними, поскольку на каждом атоме фосфора имеется частичный положительный заряд в следствии значительного электронаицепторного влияния групп Р=О и Р – О-. Таким образом, возможность существования АТФ определяется наличием достаточного количества химической энергии в молекуле, позволяющей компенсировать эти физико – химические напряжения. В молекуле АТФ имеется две фосфоангидридных (пирофосфатных) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН 7,0 и 37оС).
АТФ+Н2О = АДФ + Н3РО4 ΔG0I = -31,0 КДж/моль.
АДФ+Н2О = АМФ +Н3РО4 ΔG0I = -31,9 КДж/моль.
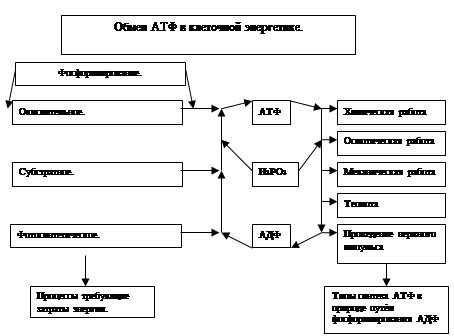
Одной из центральных проблем биоэнергетики является биосинтез АТФ, который в живой природе происходит путём Фосфорилирование АДФ.
Фосфорилирование АДФ является эндергоническим процессом и требует источника энергии. Как отмечалось ранее, в природе преобладает два таких источника энергии – это солнечная энергия и химическая энергия восстановленных органических соединений. Зелёные растения и некоторые микроорганизмы способны трансформировать энергию, поглощённых квантов света в химическую энергию, которая расходуется на фосфорилирование АДФ в световой стадии фотосинтеза. Этот процесс регенерации АТФ получил название фотосинтетического фосфорилирования. Трансформация энергии окисления органических соединений в макроэнергетические связи АТФ в аэробных условиях происходит преимущественно путём окислительного фосфорилирования. Свободная энергия, необходимая для образования АТФ, генерируется в дыхательной окислительной цепи митаходрий.
Известен ещё один тип синтеза АТФ, получивший название субстратного фосфорилирования. В отличии от окислительного фосфорилирования, сопряжённого с переносом электронов, донором активированной фосфорильной группой (- РО3 Н2), необходимой для регенерации АТФ, являются интермедианты процессов гликолиза и цикла трикарбоновых кислот. Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений: 1,3 – дифосфоглицерата (гликолиз), сукцинил – КоА (цикл трикарбоновых кислот), которые при участии соответствующих ферментов способны фолирировать АДФ и образовывать АТФ. Трансформация энергии на уровне субстрата является единственным путём синтеза АТФ в анаэробных организмах. Этот процесс синтеза АТФ позволяет поддерживать интенсивную работу скелетных мышц в периоды кислородного голодания. Следует помнить, что он является единственным путём синтеза АТФ в зрелых эритроцитах не имеющих митохондрий.
Особо важную роль в биоэнергетике клетки играет адениловый нуклеотид, и которому присоединены два остатка фосфорной кислоты. Такой вещество называется аденозинтрифосфорной кислотой (АТФ). В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфорита: АТФ= АДФ+Ф+Е, где Ф – фермент, Е – освобождающая энергия. В этой реакции образуется аденозинфосфорная кислота (АДФ) – остаток молекулы АТФ и органический фосфат. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производство тепла, нервных импульсов, свечений (например, улюминисцентных бактерий), то есть для всех процессов жизнедеятельности.
АТФ – универсальный биологический аккумулятор энергии. Световая энергия, заключенная в потребляемой пище, запасается в молекулы АТФ.
Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20 – 30 сокращений. При усиленной, но кратковременной работе мышцы работают исключительно за счёт расщепления содержащейся в них АТФ. После окончания работы человек усиленно дышит – в этот период происходит расщепление углеводов и других веществ ( происходит накопление энергии) и запас АТФ в клетках восстанавливается.
Глюкоза. Формула глюкозы.
Сахара имеют общую формулу С(Н2О)n, где n – целое число (от 3 до 7).
Всё сахара содержат гидроксильные, а также либо альдегидные, либо китонные группировки. Взаимодействую друг с другом, моносахара могут образовывать ди-, три- или олигосахариды. Сахара являются главным энергетическим субстратом клеток. Кроме того, они образуют связи с белками и липидами, а также являются строительными блоками при образовании более сложных биологических структур. Основными реакционоспособными группировками сахаров являются гидроксильные группы, участвующие, в частности, в образовании связей между мономерами.
Во всех клетках способных метаболизировать глюкозу, первой реакцией является её фосфорилирование до глюкозо – 6 – фосфата. Реакция катализируется ферментом гексокиназой, а донором фосфорильной группы является молекула АТФ.
Эта реакция практически необратима, дельта G0I= -16,74 КДж/моль. Гексокиназа, присутствующая во всех тканях, за исключением паренхимы печени имеет высокое средство к глюкозе, а также способна фосфорилировать и другие гексозы, но значительно с меньшей скоростью. В клетках печени эту функцию выполняет глюкокиназа, активность которой зависит от питания. Глюкокиназа специфична к глюкозе и эффективно функционирует только при высокой концентрации в крови глюкозы. Важным свойством глюкокиназы является ингибирование продуктом реакции глюкозо – 6 – фосфатом по аллостерическому механизму.
Фосфорилированная глюкоза не способна проходить через цитоплазматическую мембрану и оказывается “запертой” в клетке. Таким образом, глюкозо – 6 – фосфат является центральным метаболитом углеводного обмена и занимает важное положение в интеграции ряда метаболических путей (гликолиз, глюкогинез, пентозофосфатный путь, гликогенолиз).
Обратный процесс дефосфорилирования глюкозы идёт только в трёх тканях, клетки которых способны транспортировать глюкозу в кровь, а именно ткани печени, эпителия почечных канальцев тонкого кишечника. Это становится возможным благодаря действию гидролитического фермента глюкозо – 6 – фосфатазы, который катализирует реакцию:
О регуляции активности этого фермента до сих пор известно мало, а следовательно, неясно, какие факторы предотвращают непрерывный цикл фосфорилирования и дефосфорилирования глюкозы.
В растительном мире огромные количества глюкозы образуется путём восстановления диоксида углерода в процессе фотосинтеза. В организме животных глюкоза непрерывно синтезируется в строго регулируемых реакциях из простых предшественников. Предшественниками могут быть: 1) пируват или лактат; 2) некоторые аминокислоты; 3) любой другой компонент, который в процессе катаболизма может превращён в пируват или один из метаболитов ЦТК.
Биосинтез глюкозы из неуглеводных предшественников носит название глюконеогенез, а пируват обуславливает вхождение в этот процесс. Как отмечалось выше, в процесс глюконеогенеза вовлекают ряд аминокислот, после превращения их в пируват или оксалоацетат. Также аминокислоты получили название глюкогенных. Из продуктов деградации триацилглицералов только глицерол может участвовать в глюконеогенезе путём превращения его в дегидроксиацетон ( метаболит гликолиза), а затем в глюкозу.
Подобно тому как гликолиз представляет собой центральный путь катаболизма глюкозы, в процессе которого она распадается до двух молекул пирувата, превращение последних в глюкозу составляет центральный путь глюконеогенеза. Таким образом, глюконеогенез в основном протекает по тому же пути, что и гликолиз, но в обратном направлении. Однако три реакции гликолиза ( глюкоза > глюкозо – 6 – фосфат; фруктозо – 6 – фосфат > фруктозо – 1,6 – дифосфат; фосфоеноилпируват > пируват) необратимы, и в обход этих реакций в глюконеогенезе протекают другие реакции с иной стехиометрией, катализируемые другими ферментами. Известны 4 фермента, катализирующие реакции глюконеогенеза и не принимающие участие в гликолизе: пируваткарбоксилаза, фосфоеноилпируваткарбоксилаза, фруктозо – 1,6 – диофосфотаза, глюкозо – 6 – фосфотаза.
Они локализованы преимущественно в печени, где и происходит главным образом глюконеогенез. Значительно менее интенсивно этот процесс идёт в корковом веществе почек.
После того как в мышцах истощается запас глюкогена, основным источником пирувата становится аминокислоты, образующиеся после деградации белков. При этом более 30% аминокислот, поступающих из крови в печень, приходится на аланин – одну из глюкогенных аминокислот, углеродный скелет которой используется в печени как предшественник для синтеза глюкозы. Другим источником пирувата является лактат, который накапливается в интенсивно работающих мышцах в процессе анаэробного гликолиза, когда митохондрии не успевают реокислить накапливающийся НАДН. Лактат транспортируется в печень, где снова превращается в пируват, а затем в глюкозу и гликоген. Этот физиологический цикл называется циклом Кори (по имени его первооткрывателя). У цикла Кори две функции – сберечь лактат для последующего синтеза глюкозы в печени и предотвратить развитие ацидоза.
Энергетика обмена.
Обмен веществ (метаболизм) – это совокупность протекающих в живых организмах химических превращений, обеспечивающих их рост, жизнедеятельность, воспроизведение, постоянный контакт и обмен с окружающей средой. Благодаря обмену веществ происходит расщепление и синтез молекул, входящих в состав клеток, образование, разрушение и обновление клеточных структур и межклеточного вещества . Например, у человека половина всех тканевых белков расщепляется и строится заново в среднем в течении 80 суток, белки печени и сыворотки крови наполовину обновляются каждые 10 суток, а белки мышц – 180, отдельные ферменты печени – каждые 2 – 4 часа. Обмен веществ неотделим от процессов превращения энергии: потенциальная энергия химических связей сложных органических молекул в результате химических превращений переходит в другие виды энергии, используемой на синтез новых соединений, для поддержания структуры и функции клеток, температуры тела, для совершения работы и так далее. Все реакции обмена веществ и превращения энергии протекают при участии биологических катализаторов – ферментов. У самых разных организмов обмен веществ отличается упорядочностью и сходством последовательности ферментативных превращений, несмотря на большой ассортимент химических соединений, вовлекаемых в обмен. В тоже время для каждого вида характерен особый, генетическизакреплённый тип обмена веществ, обусловленный условиями его существования.
Обмен веществ складывается из двух взаимосвязанных, одновременно протекающих в организме процессов – ассимиляция и диссимиляция, или анаболизм и катаболизм. В ходе катаболических превращений происходит расщепление крупных органических молекул до простых соединений с одновременным выделением энергии, которая запасается в форме богатых энергией фосфатных связей, главным образом в молекуле АТФ и других богатых энергией соединений. Катаболические превращения обычно осуществляются в результате гидролитических и окислительных реакций и протекает как в отсутствии кислорода (анаэробный путь – гликолиз, брожение), так и при его участии (аэробный путь – дыхание). Второй путь эволюционно более молодой и в энергетическом отношении более выгодный. Он обеспечивает полное расщепление органических молекул до СО2 и Н2О. Разнообразные органические соединения в ходе катаболических процессов превращаются в органическое число небольших молекул (помимо СО2 и Н2О): углеводы – в трифосфаты и (или) пируват, жиры – в ацетил – КоА, пропионил – КоА, оксалоацетат, α – кетоглютарат, фумарат, сукцинат и конечные продукты азотистого обмена – мочевину, аммиак, мочевую кислоту и другие.
В ходе анаболических превращений происходит биосинтез сложных молекул из простых молекул – предшественников. Автотрофные организмы (зелёные растения и некоторые бактерии) могут осуществлять первичный синтез органических соединений из СО2 с использованием энергии солнечного света (фотосинтез) или энергии окисления неорганических веществ. Гетеротрофы синтезируют органические соединения только за счёт энергии и продуктов, образующихся в результате катаболических превращений. Исходным сырьём для процессов биосинтеза в этом случае служит небольшое число соединений, в том числе ацетил – КоА, сукцинил КоА, рибоза, пировиноградная кислота, глицерин, глицин, аспарагиновая, глутаминовая и другие аминокислоты. Каждая клетка синтезирует характерные для неё белки, жиры, углеводы и другие соединения. Например, глюкоген мышц синтезируется в мышечных клетках, а не доставляется кровью из печени. Как правило, синтез включает восстановительные этапы и сопровождается потреблением энергии.
Функции липидов.
Липиды (от греческого “липос” – жир) – низкомолекулярные органические соединения полностью или почти полностью нерастворимые в воде, могут быть извлечены из клеток животных, растений, и микроорганизмов неполярными органическими растворителями, такими как хлороформ, эфир, бензол.
Гидрофобность (или липофильность) является отличительным свойством этого класса соединения, хотя по природе химическому строению и структуре – они весьма разнообразны. В их состав входят спирты, жирные кислоты, азотистые соединения, фосфорная кислота, углеводы и другие. Следовательно, учитывая различия в химическом строении, функциях соединений, относящихся к липидам, дать единое определение для представителей этого класса веществ невозможно.
Роль липидов в процессе жизнедеятельности организма велика и разнообразна. К основным функциям липидов относятся структурная, энергетическая, резервная, защитная, регуляторная.
Структурная функция.
В комплексе с белками липиды являются структурными компонентами всех биологических мембран клеток, а следовательно, влияют на их проницаемость, участвуют в передаче нервного импульса, в создании межклеточного взаимодействия и других функциях биомембран.
Энергетическая функция.
Липиды являются наиболее энергоёмким “клеточным топливом”. При окислении 1г. жира выделяется 39 КДж энергии, что в два раза больше, чем при окислении 1г. углеводов.
Резервная функция.
Липиды являются наиболее компактной формой депонирования энергии в клетке. Они резервируются в адипоцитах – клетках жировой ткани. Содержание жира в организме взрослого человека составляет 6 – 10 кг.
Защитная функция.
Обладая выраженными термоизоляционными свойствами, липиды предохраняют организм от термических воздействий; жировая прокладка защищает тело и органы животных от механических и физических повреждений; защитные оболочки в растениях (восковой налёт на листьях и плодах) защищает от инфекции и излишней потери или накопления воды.
Регуляторная функция.
Некоторые липиды являются предшественниками витаминов, гормонов, в том числе гормонов местного действия – эйкозаноидов: простагландинов, тромбоксанов и лейкотриенов. Регуляторная функция липидов проявляется также в том, что от состава свойств, состояния мембранных липидов во многом зависит активность мембранно – связанных ферментов.
У бактерий липиды определяют таксономическую индивидуальность, дифференциацию видов, тип патогенеза и многие другие особенности. Нарушение липидного обмена у человека приводит к развитию таких патологических состояний, как атеросклероз, ожирение, метаболический ацидоз, желчнокаменная болезнь и других.
Список литературы
1 В.П. Комов., В.Н. Шведова “Биохимия” – М.:”Дрофа” 2004 г.
2 Гл. ред. М.С. Гиляров. Ред.кол.: А.А. Абаев, Г.Г. Винберг, Г.А. Гаварзин и др. “Биологический энциклопидический словарь” – М.: Современная энциклопедия 1986 г.
3 З.А. Власова “Биология. Пособие для поступающих в ВУЗ” – М.: Филологическое общество Слово “Эксмо” 2003 г.
4 Под ред. Пр. Бр.Батанова “Клиническая педиатрия”: София 1988г.
|