С.Л. Борисенко
Микроэлектродное исследование глаза Lymnaea stagnalis выявило два типа электрических сигналов: постоянный потенциал и его изменения в ответ на световую стимуляцию (ЭРГ). Установлено, что полярность фаз ЭРГ не зависит от точки на поверхности глазного бокала, в которой производилось погружение микроэлектрода в сетчатку. Сравнение динамики компонентов ЭРГ позволяет сделать предположение об их различном происхождении, а также о существовании профиля полярности и амплитуды ЭРГ по толщине сетчатки.
Введение
Камерный глаз брюхоногих моллюсков сравнительно редко выступает объектом электрофизиологических исследований. Можно указать лишь на небольшое число работ, в которых производилась регистрация электроретинограммы (ЭРГ) или электрических ответов фоторецепторных клеток сетчатки глаза морских и сухопутных видов [1]. Поэтому логичной кажется постановка такой экспериментальной задачи по отношению к глазу пресноводного легочного моллюска. Объектом настоящей работы был выбран большой прудовик Lymnaea stagnalis. Камерный глаз этого моллюска имеет строение, типичное для брюхоногих, и включает в себя роговицу, хрусталик, стекловидное тело и однослойную сетчатку с микровиллярными фоторецепторными клетками [2]. Особенностью строения является геометрия сетчатки, внутренняя поверхность которой образует характерные углубления – дорсальную и более глубокую вентральную ямки [3].
Ранее была описана ЭРГ, полученная всасывающим электродом в области основания глазного бокала в месте формирования оптического нерва [4]. В данной работе производилась микроэлектродная регистрация электрических сигналов глаза в различных топографических точках. При этом ставилась цель – получить представление о пространственном распределении электрических потенциалов в глазном бокале в условиях темновой адаптации и при генерации ответа на световую стимуляцию.
Материалы и методы
Объект исследования. Взрослые особи Lymnaea stagnalis L. с раковиной высотой 2 см были собраны прудах Калининграда и содержались в емкостях с отстоянной водопроводной водой. Световой режим 12 С : 12 Т устанавливали лампами накаливания.
Препарат. Глаз размером около 300 мкм по продольной и 200 мкм по поперечной оси с обрубком оптического нерва длиной около 700 мкм выделяли под красным светом (фильтр КС-10).
Препарат изолированного глаза фиксировали в экспериментальной камере за отходящие от него пучки коллагеновых волокон вольфрамовыми иглами, заточенными электролитически. При этом апертурное отверстие глаза ориентировали навстречу стимулирующему световому потоку.
Физиологический раствор (мМ): NaCl – 40; KCl – 3; CaCl2 – 3; MgCl2 – 1; рН = 7,5 поддерживали карбонатным буфером [5].
Электрофизиологическая установка. Эксперименты проводились в электрофизиологической установке, состоящей из измерительного комплекса для работы с микроэлектродами, цифрового осциллографа С9-8 и чернильного графопостроителя Н306.
Световая стимуляция осуществлялась источником света (лампа КГМ-150) с регулируемым накалом. Световые стимулы продолжительностью 0,5 с формировали электромеханическим затвором, которым управляли электронным стимулятором ЭС-50 – 1. После прохождения абсорбционных фильтров (ФИ-05) световой пучок по оптоволоконному кабелю направляли к препарату и фокусировали на нем.
Микроэлектроды с диаметром кончика менее 1 мкм изготавливали на горизонтальной кузнице Leitz. Электроды заполняли 3 М раствором KCl. Сопротивление микроэлектродной системы в физиологическом растворе было около 15 – 20 МОм и контролировалось перед каждым погружением микроэлектрода.
Ход эксперимента. Позиционирование микроэлектрода проводили при красном свете, подаваемом через световолоконный жгут, снабженный фильтром КС-10. После темновой адаптации длительностью 30 мин осуществляли погружение микроэлектрода до появления устойчивой разности потенциалов и проводили контрольное освещение препарата. Если ответа не было, погружение продолжали.
В ходе каждого эксперимента производили серию последовательных регистраций вдоль длинной оси глазного бокала, начиная от края роговицы и до окончания области нейропиля. Точки отведения на разных препаратах выбирали визуально – ориентируясь относительно границ пигментного слоя глазного бокала. С достаточной уверенностью удалось идентифицировать три основные точки отведения потенциала (рис. 1, 2). Для каждой точки проводили последовательно три – четыре
Рис. 1. Примеры ЭРГ, полученные микроэлектродным отведением
в области роговицы (а) и средней части глазного бокала Lymnaea stagnalis (б). Точки погружения микроэлектрода показаны на вставке.
Отметка стимуляции общая для всех приведенных ЭРГ
электрических ответа на световую стимуляцию. В связи с тем, что длительность регистрации электрических потенциалов глаза была ограничена (сеанс регистрации из каждой точки, как правило, не превышал 20 – 30 мин), отведения от всех трех точек получены не для каждого препарата. Но на 12 препаратах удалось провести во всех точках весь набор отведений. Всего было исследовано 72 препарата и произведено 229 записей ЭРГ.
 
Рис. 2. Примеры ЭРГ, полученные микроэлектродным отведением
в области нейропиля глазного бокала Lymnaea stagnalis.
Место погружения микроэлектрода указано на вставке.
Для каждого столбца записей показана общая отметка стимуляции
Результаты
Было зарегистрировано два вида электрических сигналов: постоянный потенциал (ПП) положительного или отрицательного знака относительно индифферентного электрода и его быстрые изменения в ответ на световую стимуляцию – ЭРГ, которая могла состоять из одного или нескольких медленных компонентов (волн) и более быстрых пиков. Употребляемая при описании ЭРГ терминология – отрицательный или положительный компонент (волна или пик) – относится к направлению смещения потенциала во время ответа относительно исходного ПП. Ниже следует описание ответов, полученных в различных точках глазного бокала.
Область роговицы. При проколе микроэлектродом в районе роговицы фиксировали положительный ПП амплитудой до 12 мВ. Волна ЭРГ с равной вероятностью могла иметь как положительную (амплитуда до 3 мВ, рис 1а 1), так и отрицательную (амплитуда до 10 – 11 мВ, рис. 1а 2) полярность. Фаза реполяризации более медленная, чем соответствующий компонент ЭРГ в нейропиле. Погружение электрода приводит к увеличению положительного значения потенциала. Быстрых изменений потенциала на фоне развивающейся ЭРГ, характерных для области нейропиля, зафиксировано не было. Зарегистрированная в этой области форма ЭРГ была наиболее стабильной по сравнению с отведениями в других точках: со временем наблюдалось лишь изменение амплитуды при сохранении направления и динамики фаз. В этой точке была получена 61 ЭРГ.
Средняя часть глазного бокала. При проколе бокала регистрировали небольшой положительный ПП до двух мВ, который при длительном нахождении электрода в этой точке мог падать до нуля. ЭРГ, полученные в этих точках, имели вид волн, среди которых встречались как положительные, так и отрицательные. Были зарегистрированы двух- и трехфазные волны ЭРГ (рис. 1б 1 – 3) При дальнейшем погружении микроэлектрода ПП падал до нулевого значения, вместе с тем уменьшалась и амплитуда ЭРГ без заметного искажения фаз. В этой части бокала было получено 69 ЭРГ.
Нейропиль. На первых этапах погружения электрода в глазной бокал наблюдался отрицательный ПП величиной до 10 мВ. В этой точке регистрировали ЭРГ, по крайней мере, трех видов.
1. Отрицательная монофазная волна амплитудой до 7 мВ, состоящая из относительно быстрого смещения потенциала и более медленного его возврата к исходному значению (реполяризация) (рис. 2 4). Такой вид имели около 45 % из 99 зарегистрированных в этой точке ЭРГ.
2. В стольких же случаях регистрировали сходную по кинетике положительную волну ЭРГ амплитудой до 8 мВ (рис. 2 3).
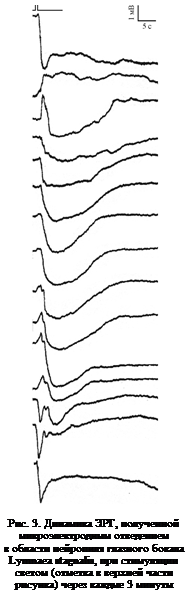
3. В 10 % случаев медленные волны ЭРГ сочетались с быстрыми колебаниями, не привязанными к определенной фазе волны. Среди них быстрые отрицательные (рис. 2 6) и положительные пики (рис. 2 2, 5) с отрицательной медленной последующей волной, а также множества положительных пиков на фоне общей медленной деполяризации (рис. 2 1). С течением времени форма ЭРГ этих пиков могла изменяться. Наблюдаемые изменения касались как амплитуды, так и (иногда) полярности компонентов ответов (рис. 3). При дальнейшем погружении электрода сначала наблюдали увеличение ПП и амплитуды фаз ЭРГ, а затем – уменьшение обоих сигналов.
Обсуждение
 Задача регистрации электрических сигналов от различных участков изолированного глаза брюхоногого моллюска ставилась и прежде. Исследованиями на Strombus luhuanus [6] и Helix aspersa [7] показано, что полярности фаз ЭРГ, получаемых электродами-присосками от основания глазного бокала и области роговицы, противоположны. Перемещение электрода внутри глазного бокала от микровиллярного слоя глаза H. aspersa к роговице также сопровождается инверсией полярности волны ЭРГ с отрицательной на положительную [7]. Изменение полярности фаз ЭРГ в зависимости от положения регистрирующего электрода-присоски наблюдалась также и в исследованиях на Achatina fulica. При этом в области боковой поверхности бокала была получена двухфазная ЭРГ, состоящая из быстрого пика положительной и последующей медленной отрицательной волны [8]. В своих опытах мы получили результат, противоречащий на первый взгляд приведенным данным. Так, в независимых экспериментах при погружении микроэлектрода в топографически близкие точки глазного бокала могла быть получена различная полярность компонентов ЭРГ. Более того, как оказалось, при длительной регистрации в одном и том же положении микроэлектрода форма и полярность компонентов ЭРГ могли претерпевать изменения. Причину наблюдаемой динамики можно усматривать в том, что в разных отведениях кончик микроэлектрода был погружен в сетчатку на различную глубину. При продолжительной же регистрации силы деформации мягкой ткани глаза, возникшие при погружении микроэлектрода, могли вызывать ее постепенное движение и, таким образом, смещение глубины точки регистрации относительно первоначального положения в бокале. Если такое рассуждение справедливо, то следует признать наличие зависимости амплитуды и полярности ЭРГ от глубины погружения электрода, как это было показано на примере глаза насекомых, который по сравнению с моллюсками имеет более жесткую структуру, дающую возможность послойного анализа электрических сигналов. Таким методом был получен профиль постоянного потенциала, коррелирующий с амплитудой ЭРГ [9]. Для объяснения существования пиков в профиле постоянного потенциала, а также точки реверсии амплитуды ЭРГ был использован подход к глазу насекомого как объемному проводнику, содержащему много источников тока. Предполагалось существование нескольких контуров темнового тока, разбалансировка которых при освещении приводит к возникновению компонентов ЭРГ. В частности, такие токи могут генерироваться последовательно расположенными на пути погружения микроэлектрода фоторецепторами и нейронами ламины. В структуре сетчатки L. stagnalis можно указать, по крайней мере, на два типа клеток, которые могли бы генерировать токи и вносить вклад в формирование ЭРГ: непосредственно фоторецепторные и нервные клетки [2]. Ультраструктурными исследованиями функциональная связь между этими клетками до сих пор не установлена [2, 10], и предположение о том, что в сетчатке L. stagnalis именно в клетках второго порядка формируется импульсный сигнал в ответ на освещение сетчатки, основывается на электрофизиологических данных [11]. Сам вопрос о том, в каких клетках глаза брюхоногих моллюсков происходит генерация распространяющегося потенциала действия, является важным для понимания функциональной организации сетчатки этих животных. Импульсная активность фоторецепторных клеток обнаружена в сетчатке голожаберных моллюсков Aplysia californica [12] и Hermissenda crassicornis [13, 14], а также в светочувствительных клетках малого ганглия заднежаберного Clione limacina [15]. Фоторецепторы S. luhuanus [16] и A. fulica [8] отвечают на освещение лишь градуальными изменениями мембранного потенциала и импульсный ответ формируется вероятнее всего в клетках второго порядка. Нам не удалось обнаружить явных признаков потенциалов действия в электрических ответах на освещение глаза L. stagnalis, хотя в составе ЭРГ, полученной от области нейропиля, часто присутствовали быстрые пики, появление которых может быть обязано синхронному возбуждению нейронов. Можно полагать, что зоны генерации потенциалов действия локализованы главным образом как раз в этой области. Такое предположение может объяснить тот факт, что ЭРГ, полученные в области роговицы или средней части глазного бокала, практически не содержат быстрых пиков. Во всяком случае сравнительно независимое изменение быстрых и медленных компонент ЭРГ наводит на мысль о том, что они могут генерироваться различными элементами сетчатки. Задача регистрации электрических сигналов от различных участков изолированного глаза брюхоногого моллюска ставилась и прежде. Исследованиями на Strombus luhuanus [6] и Helix aspersa [7] показано, что полярности фаз ЭРГ, получаемых электродами-присосками от основания глазного бокала и области роговицы, противоположны. Перемещение электрода внутри глазного бокала от микровиллярного слоя глаза H. aspersa к роговице также сопровождается инверсией полярности волны ЭРГ с отрицательной на положительную [7]. Изменение полярности фаз ЭРГ в зависимости от положения регистрирующего электрода-присоски наблюдалась также и в исследованиях на Achatina fulica. При этом в области боковой поверхности бокала была получена двухфазная ЭРГ, состоящая из быстрого пика положительной и последующей медленной отрицательной волны [8]. В своих опытах мы получили результат, противоречащий на первый взгляд приведенным данным. Так, в независимых экспериментах при погружении микроэлектрода в топографически близкие точки глазного бокала могла быть получена различная полярность компонентов ЭРГ. Более того, как оказалось, при длительной регистрации в одном и том же положении микроэлектрода форма и полярность компонентов ЭРГ могли претерпевать изменения. Причину наблюдаемой динамики можно усматривать в том, что в разных отведениях кончик микроэлектрода был погружен в сетчатку на различную глубину. При продолжительной же регистрации силы деформации мягкой ткани глаза, возникшие при погружении микроэлектрода, могли вызывать ее постепенное движение и, таким образом, смещение глубины точки регистрации относительно первоначального положения в бокале. Если такое рассуждение справедливо, то следует признать наличие зависимости амплитуды и полярности ЭРГ от глубины погружения электрода, как это было показано на примере глаза насекомых, который по сравнению с моллюсками имеет более жесткую структуру, дающую возможность послойного анализа электрических сигналов. Таким методом был получен профиль постоянного потенциала, коррелирующий с амплитудой ЭРГ [9]. Для объяснения существования пиков в профиле постоянного потенциала, а также точки реверсии амплитуды ЭРГ был использован подход к глазу насекомого как объемному проводнику, содержащему много источников тока. Предполагалось существование нескольких контуров темнового тока, разбалансировка которых при освещении приводит к возникновению компонентов ЭРГ. В частности, такие токи могут генерироваться последовательно расположенными на пути погружения микроэлектрода фоторецепторами и нейронами ламины. В структуре сетчатки L. stagnalis можно указать, по крайней мере, на два типа клеток, которые могли бы генерировать токи и вносить вклад в формирование ЭРГ: непосредственно фоторецепторные и нервные клетки [2]. Ультраструктурными исследованиями функциональная связь между этими клетками до сих пор не установлена [2, 10], и предположение о том, что в сетчатке L. stagnalis именно в клетках второго порядка формируется импульсный сигнал в ответ на освещение сетчатки, основывается на электрофизиологических данных [11]. Сам вопрос о том, в каких клетках глаза брюхоногих моллюсков происходит генерация распространяющегося потенциала действия, является важным для понимания функциональной организации сетчатки этих животных. Импульсная активность фоторецепторных клеток обнаружена в сетчатке голожаберных моллюсков Aplysia californica [12] и Hermissenda crassicornis [13, 14], а также в светочувствительных клетках малого ганглия заднежаберного Clione limacina [15]. Фоторецепторы S. luhuanus [16] и A. fulica [8] отвечают на освещение лишь градуальными изменениями мембранного потенциала и импульсный ответ формируется вероятнее всего в клетках второго порядка. Нам не удалось обнаружить явных признаков потенциалов действия в электрических ответах на освещение глаза L. stagnalis, хотя в составе ЭРГ, полученной от области нейропиля, часто присутствовали быстрые пики, появление которых может быть обязано синхронному возбуждению нейронов. Можно полагать, что зоны генерации потенциалов действия локализованы главным образом как раз в этой области. Такое предположение может объяснить тот факт, что ЭРГ, полученные в области роговицы или средней части глазного бокала, практически не содержат быстрых пиков. Во всяком случае сравнительно независимое изменение быстрых и медленных компонент ЭРГ наводит на мысль о том, что они могут генерироваться различными элементами сетчатки.
Световые ответы некоторых фоторецепторов S. luhuanus содержат фазы быстрой и более медленной деполяризации, последняя из которых, вероятно, имеет синаптическое происхождение [17]. Реакции на свет фоторецепторов голожаберных моллюсков A. californica [12] и H. crassicornis [13, 14] еще более разнообразны, частично вследствие взаимодействия клеток сетчатки. Если учесть, что в сетчатке L. stagnalis можно выделить два морфологических типа фоторецепторных клеток [2], то можно рассуждать об их относительном вкладе в ЭРГ. Все же очевидно, что вопрос о различном клеточном происхождении компонентов электрического ответа и функциональной гетерогенности сетчатки L. stagnalis требует детального ее исследования, и результаты, полученные нами, представляют собой лишь первый шаг в этом направлении.
Список
литературы
1. Messenger J.B. Comparative physiology of vision in molluscs // Handbook of sensory physiology / Ed. H. Autrum. Berlin; Heidelberg; New-York: Springer-Verlag. 1981. 7/6C. P. 93 – 200.
2. Бобкова М.В. Структурно-функциональная организация периферического отдела зрительной системы прудовика обыкновенного Lymnaea stagnalis // Журн. эвол. биох. и физиол. 1998. 34 (6). С. 716 – 731.
3. Она же. Форма сетчатки, структура хрусталика и природа экранирующего пигмента глаза Lymnaea stagnalis // Журн. эвол. биох. и физиол. 1996. 32 (1). С. 109 – 112.
4. Жуков В.В., Грибакин Ф.Г. Спектральная чувствительность глаза моллюска Lymnaea stagnalis и Planorbarius corneus в ультрафиолетовой и видимой области спектра // Сенсорные системы. 1990. 4 (4). С. 341 – 350.
5. Suzuki H., Watanabe M., Tsukahara Y., Tasaki K. Duplex system in the simple retina of a gastropode mollusc Limax flavus L. // J. comp. physiol. 1979. Vol. 133. P. 125 – 130.
6. Gillary H.L. Light-evoked electrical potentials from the eye and optic nerve of Strombus: response waveform and spectral sensitivity // J. exp. biol. 1974. Vol. 60. P. 383 – 396.
7. Idem. Electrical responses from the eye of Helix to photic stimulation and simultaneous electrical stimulation of the optic nerve // Vision Res. 1970. Vol. 10. P. 977 – 991.
8. Tamamaki N. Visible light reception of accessory eye in the giant snail, Achatina fulica, as revealed by an electrophysiological study // Zoological science. 1989. Vol. 6. P. 867 – 875.
9. Грибакин Ф.Г. Механизмы фоторецепции насекомых. Л.: Наука, 1981.
10. Stoll C.J. Observations on the ultrastructure of the eye of the basommatophoran snail Lymnaea stagnalis (L.) // Proc. Kon. Ned. Akad. Wet. 1973. Vol. 76. P. 414 – 424.
11. Stoll C.J., Bijlsma A. Optic nerve activity in Lymnaea stagnalis (L.) to photic stimulation of the eye // Proc. Kon. Ned. Akad. Wet. 1973. Vol. 76. P. 406 – 413.
12. Jacklet J.W., Rolerson C. Electrical activity and structure of retinal cells of the Aplysia eye: II. Photoreceptors // J. exp. biol. 1982. Vol. 99. P. 381 – 395.
13. Dennis M.J. Electrophysiology of the visual system in a nudibranch mollusc // J. neurophysiol. 1967. Vol. 30. P. 1439 – 1465.
14. Alkon D.L., Fuortes M.G.F. Responses of photoreceptors in Hermissenda // The j. gen. physiol. 1972. Vol. 60. P. 631 – 649.
15. Аршавский Ю.И., Орловский Г.Н., Панчин Ю.В. Электрофизиологическое исследование фоторецепторных клеток у заднежаберных моллюсков Clione limacina и Coryphella rufibranchialis // Сенсорные системы. 1990. Т. 4 (3). С. 331 – 334.
16. Quandt F.N., Gillary H.L. Classes of light-evoked response in the retina of Strombus // J. exp. biol. 1979. Vol. 80. P. 287 – 297.
17. Iidem. Separable phases of light-evoked depolarization in the retina of Strombus // J. exp. biol. 1980. Vol. 84. P. 137 – 148.
|