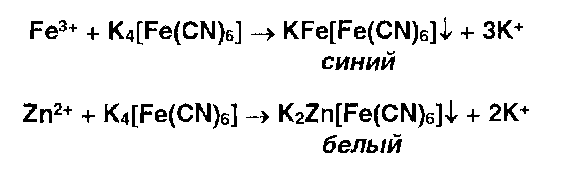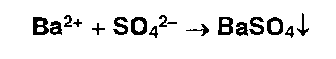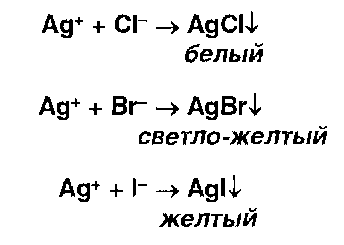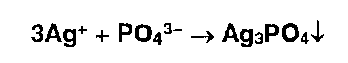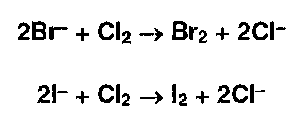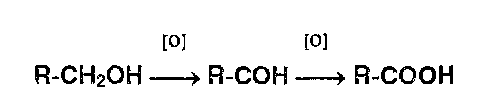Химические методы установления подлинности лекарственных веществ
Тема 14-15 Химические методы установления подлинности лекарственных веществ
1. Общие принципы испытаний подлинности лекарственных веществ.
Испытание на подлинность - это подтверждение идентичности анализируемого ЛВ (ЛФ), осуществляемое на основе требований ГФ или другой НТД. Испытания выполняют физическими, химическими или физико-химическими методами. Испытание подлинности ЛВ - идентификация тех ионов и функциональных групп, входящих в структуру молекул, которые обусловливают фармакологическую активность. С помощью физических и химических констант (удельного N вращения, рН среды, показателя преломления, УФ и ИК спектра) подтверждают и другие свойства молекул, оказывающие фармакологическое влияние. Применяемые в фарм. анализе хим. реакции сопровождаются образованием окрашенных соединений, выделением газообразных или нерастворимых в воде соединений. Последние можно определить по температуре плавления.
А) Физические методы установления подлинности. Они основаны на выявлении физических свойств путем измерений физических констант ЛВ. Подлинность подтверждают: агрегатное состояние (твердое вещество, жидкость, газ); окраска, запах, форма кристаллов или аморфность вещества; гигроскопичность или степень выветриваемости на воздухе; устойчивость к воздействию света, кислорода воздуха; летучесть, подвижность, воспламеняемость. Более объективным является установление различных физических констант: температуры плавления (разложения), температуры затвердевания или кипения, плотности, вязкости, растворимости в воде, кислотах, щелочах, органических растворителях (эфире, хлороформе, ацетоне, бензоле, этиловом и метиловом спиртах, маслах и др.).
Б) Химические методы установления подлинности. Идентификация неорганических ЛВ - это установление их подлинности, основанное на обнаружении с помощью химических реакций катионов и аминов, входящих в состав их молекул.
Реакции осаждения анионов и катионов используют для обнаружения наибольшего числа катионов и анионов, входящих в состав молекул вещества. Образующиеся нерастворимые в воде вещества могут быть охарактеризованы по окраске, растворимости (в кислотах, щелочах, органических растворителях), способности образовывать растворимые в избытке реактивов комплексные соединения и т. д.
2. Подлинность неорганических ЛС
|
* Ионы натрия осаждают цинкуранилацитатом: |
|
*Ионы калия - осаждают винной кислотой: 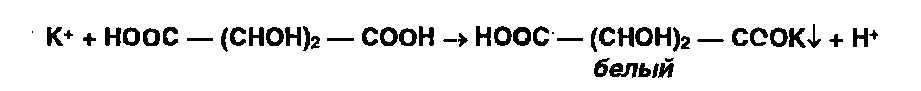
Ион калия можно также осадить гексанитрокобальтатом (111) натрия:
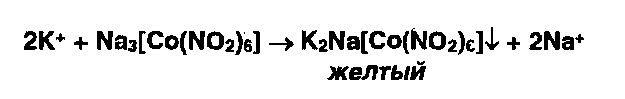
|
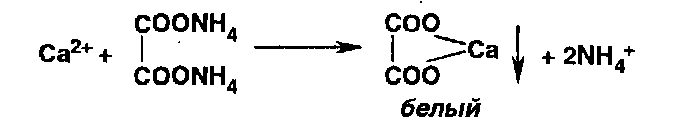
*Ионы кальция осаждают оксалатом аммония: |
|
Некоторые реакции осаждения можно использовать для обнаружения и катионов и анионов.
* Ионы Магния образуют в присутствии фосфат и аммоний- ионов осадок фосфата
магния-аммония
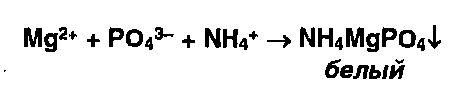
Ионы магния с растворами карбонатов образуют белый осадок основного карбоната магния:
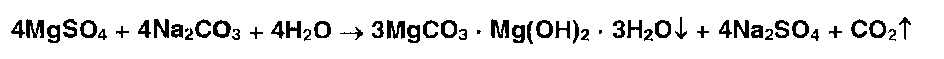
* Ионы железа (III) в растворе приобретают красное окрашивание в присутствии роданид- ионов, образуя малодиссоциирующее соединение:
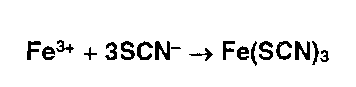
Ряд реактивов образуют белые или окрашенные осадки с несколькими катионами.
* Ионы ртути, цинка, висмута, мышьяка взаимодействуют с сульфидами:

|
* Ионы железа (III) и цинка осаждаются растворами гсксацианоферрата (II) калия: |
|
*Ионы железа (II) дают аналогичные результаты с гексацианоферратом (III) калия:
Fe +2 + K3[Fe (CN)6] = K Fe[ Fe (CN)6 ] cиний
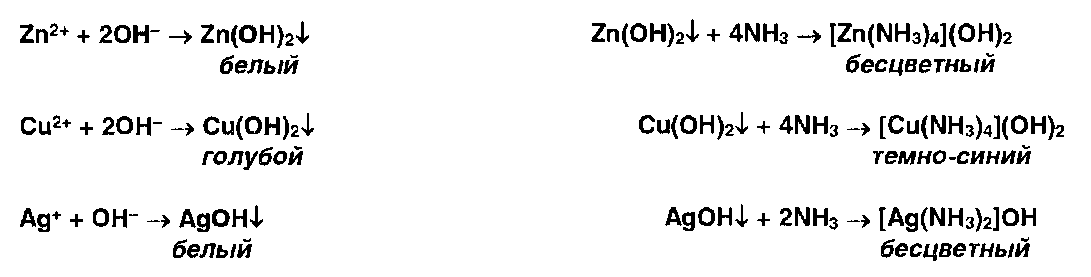
* Ионы цинка, меди и серебра осаждаются гидроксидом аммония с образованием осадков, растворимых в избытке реактива:
АНИОНЫ
* Фосфат-ионы образует с р-ом молибдата аммония жёлтый осадок фосфор-молибдата аммония:
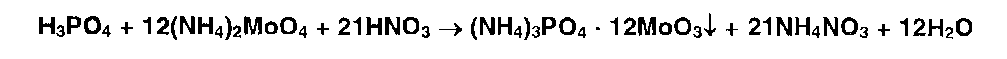
|
* Ионы бария образуют белый осадок с сульфат-ионами: Аналогичную реакцию дают сульфиты: Сульфит бария, в отличие от сульфата бария, растворим в хлороводородной кислоте. |
|
* Ионы фтора открывают реакцией осаждения из раствора хлорида кальция:
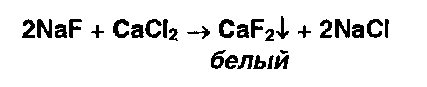
|
* Ионы серебра образуют осадки с хлоридами, бромидами, йодидами: Образующиеся галогениды различаются по растворимости в растворе аммиака. Желтый осадок образуют ионы серебра с фосфатами: |
|
Окислительно -восстановительные реакции, используемые для испытаний подлинности, сопровождаются изменением окраски образующихся продуктов взаимодействия.
* Бромид - и йодид- ионы окисляют хлором ( или хлорамином или др. окислителями - FeС13 ):
|
|
Выделившийся бром окрашивает слой хлороформа в оранжевый цвет, а йод — в фиолетовый. Йод обнаруживают также по синему окрашиванию крахмального клейстера. |
* Нитрат- и нитрит- ионы обнаруживают путем окисления дифениламина до дифенилбензидина, а затем до дифенилдифенохинондиимина гидросульфата (синее окрашивание) в присутствии концентрированной серной кислоты:
Нитрит-иоиы (в отличие от нитратов) обесцвечивают раствор перманганата калия, подкисленный серной кислотой:
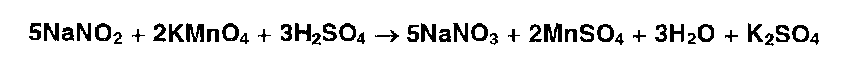
Взаимодействуя с антипирином (феназоном), нитриты образуют продукт замещения — нитрозоантипирин (зеленое окрашивание):
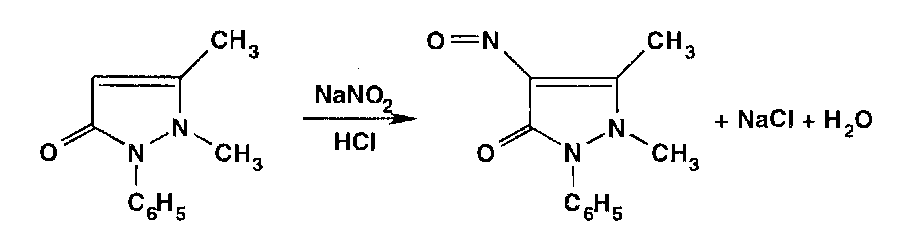
Реакции разложения сопровождаются образованием газообразных продуктов, которые обнаруживают органолептически (запах, окраска).
* Ионы аммония разлагаются под действием растворов гидроксидов (запах аммиака или изменение окраски красной лакмусовой бумаги).
* Карбонат-ионы под действием насыщенного раствора сульфата магния образуют белый осадок, а гидрокарбонат образует осадок только при кипячении смеси (см. реакцию на магний).
- Карбонат- и гидрокарбонат- ионы образуют газ — диоксид углерода под действием минеральных кислот:
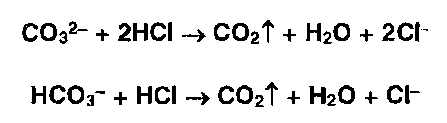
* Сульфит-ионы в тех же условиях образуют диоксид серы (резкий запах):
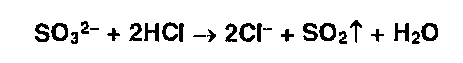
* Нитрит-ионы, в отличие от нитрат-ионов, под действием кислот выделяют оксиды азота (диоксид азота имеет красно-бурую окраску):
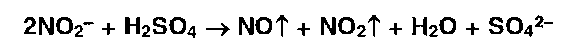
Превращения, происходящие при нагревании и прокаливании некоторых ЛВ.
Йод кристаллический, соединения мышьяка, ртути возгоняются (испытания выполнять под тягой!). Цинка оксид при прокаливании желтеет (после охлаждения окраска исчезает). Висмута нитрат основной разлагается с образованием оксида висмута (желтое окрашивание) и диоксида азота (желто-бурые пары). Соли алюминия при прокаливании с нитратом кобальта образуют плав синего цвета, представляющий собой алюминат кобальта (тенарова синь). Соли цинка в этих условиях образуют плав зеленого цвета (зелень Ринмана).
Установить наличие ряда элементов в неорганических и элементорганических ЛВ можно по изменению окраски бесцветного пламени горелки. Так, соль натрия, внесенная в пламя, окрашивает его в желтый цвет, калия — в фиолетовый, кальция — в кирпично-красный, лития — в карминово-красный. Соли бора, смоченные этанолом, окрашивают кайму пламени в зеленый цвет.
3. Идентификация органических лекарственных веществ
А) Общие химические реакции
В фарм. анализе используются различные химические реакции органических соединений, которые дают определенный аналитический эффект (выпадение осадка, выделение газа, образование окрашенного раствора и т.д.).
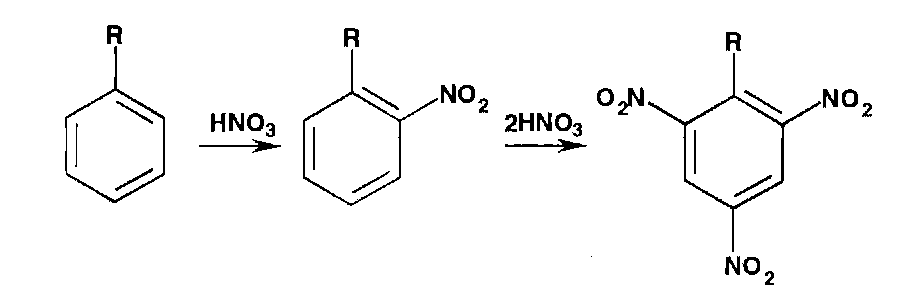
* Реакции нитрования сопровождаются образованием
|
окрашенных в желтый цвет моно-, ди- и тринитропроизводных ароматического ряда: |
|
* Под действием гидроксидов калия (натрия) продукты нитрования образуют окрашенные ацисоли:
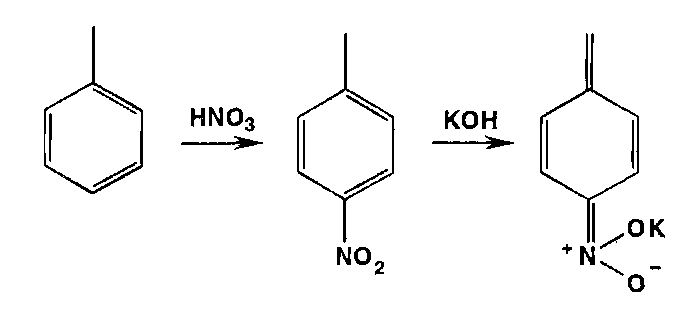
* Реакции нитрозироваиия приводят к образованию окрашенных, флюоресцирующих или имеющих стабильную температуру плавления нитрозосоединений:
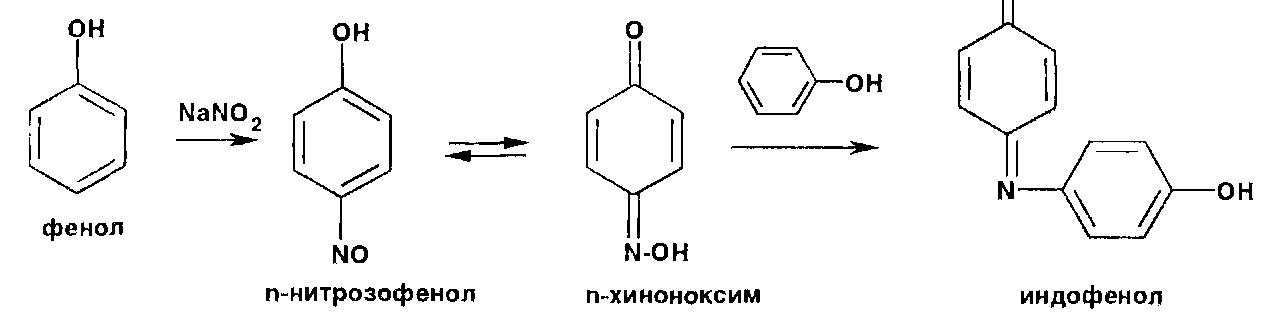
 Фенолы образуют нитрозосоединения, бесцветные или окрашенные в сине-зеленый (фенол), сине-фиолетовый (резорцин) цвет. При нитрозировании фенолов с последующим окислением образуются индофенолы (интенсивно-синее окрашивание):
Фенолы образуют нитрозосоединения, бесцветные или окрашенные в сине-зеленый (фенол), сине-фиолетовый (резорцин) цвет. При нитрозировании фенолов с последующим окислением образуются индофенолы (интенсивно-синее окрашивание):
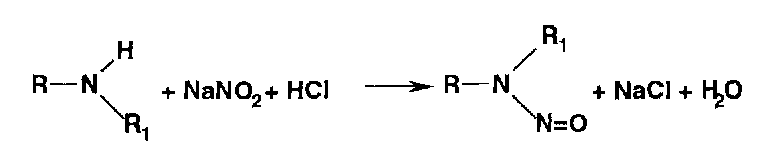
* Реакции диазотирования и азосочетания используют для идентификации производных первичных ароматических аминов и фенолов. Азосоединения — окрашенные (в красный, коричневый и оранжевый цвет) продукты, получаемые в две стадии: Диазотирование (получение соли диазония):
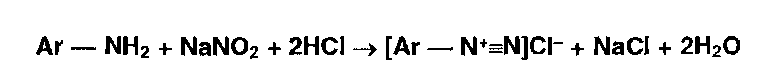
Азосочетание (взаимодействие соли диазония с фенолом или ароматическим амином). Сочетание происходит в орто- или пара- положеннях по отношению к гидроксильной или аминогруппе, но идет легче в пара- положении:
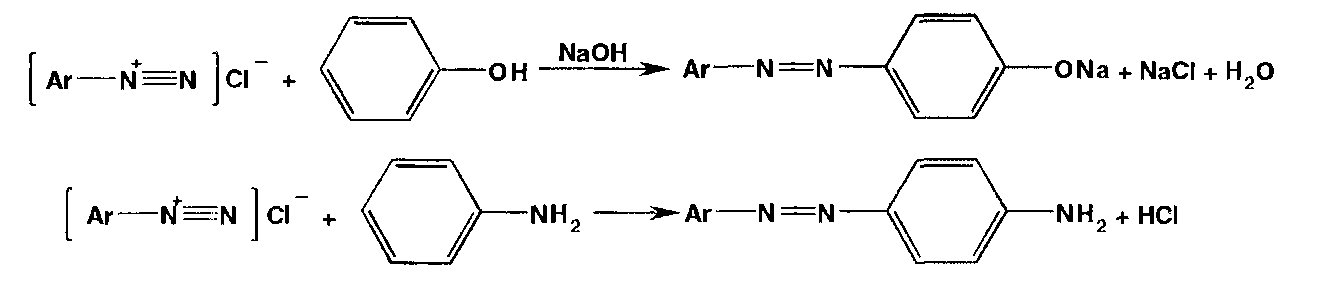
Азосочетание с фенолами (нафтолами) происходит в слабощелочной (рН 9,0-10,0), а с аминами — в слабокислой среде.
Реакцию азосочетания используют также для идентификации сложных эфиров фенолов, ацилированных первичных ароматических аминов (после гидролиза) и нитропроизводных (после гидрирования).
* Реакции галогенирования (бромирование и йодирование) по типу реакции электрофильного замещения используют для обнаружения производных фенолов и первичных ароматических аминов. Наличие в их молекулах заместителей первого рода (окси- и аминогруппы) обусловливает происходящий процесс образования трибромфенола или триброманилина (белый осадок):
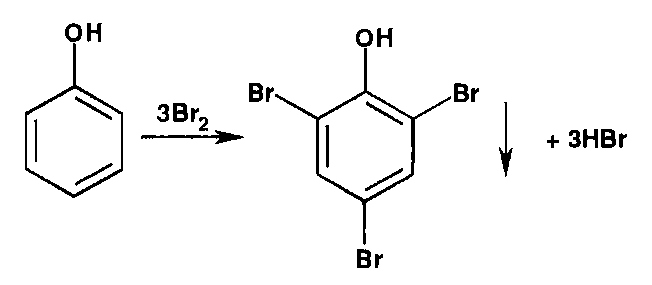
Аналогично происходит процесс образования трийодпроизводных. При наличии в молекулах фенола и анилина радикалов в пара- или орто-положениях образуются моно- или дигалогенпроизводные.
* Реакции конденсации альдегидов и кетонов с первичными аминами, гидроксиламином, гидразинами используются для идентификации всех указанных групп органических соединений по общей схеме:
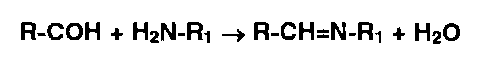
Альдегиды, конденсируясь с первичными аминами, образуют окрашенные в желтый, красный или оранжевый цвет соли оснований Шиффа:
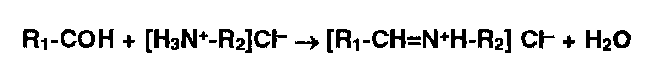
Эта реакция лежит в основе лигниновой пробы на первичные ароматические амины, которые взаимодействуют с лигнинами, содержащимися в бумаге.
Окислительная конденсация с участием альдегидов лежит в основе таких реакций, как образование ауринового красителя, нингидриновая реакция, мурексидная проба, проба Ле Розена и др.
Нингидриновая реакция является общей для а-аминокислот, иминокислот, полипептидов. Нингидрин (1,2,3-трикето- гидринденгидрат) образует с аммиаком, выделившимся из этих соединений, продукт конденсации — ион дикетогидрин- дилидендикетогидрамина, имеющий сине-фиолетовое окрашивание:
* Реакции этерификации, ацилирования и гидролиза. Для подтверждения подлинности спиртов и карбоновых кислот широко используют реакцию этерификации, а подлинность сложных эфиров подтверждают с помощью обратного процесса — гидролиза: 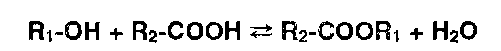
Этерификацию проводят в присутствии дегидратирующих веществ (конц. серная кислота), а гидролиз — в кислой или щелочной среде.
Сходен с этерификацией процесс ацилирования (особенно ацетилирования) аминопроизводных:
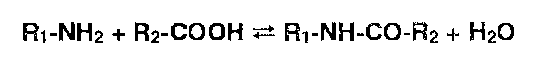
а также обратный процесс — гидролиз ацильных производных.
Образовавшиеся в результате этерификации, ацилирования, гидролиза продукты идентифицируют по аналитическому эффекту (цвету, запаху, образованию газа или осадка, температуре плавления осадка и др.).
Очень широко используют реакцию образования этилацетата, имеющего своеобразный запах (МОМЕНТ). Этилацетат образуют органические соединения, выделяющие при гидролизе этанол или уксусную кислоту:
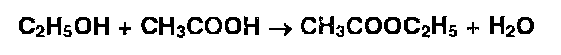
Общим способом испытаний ЛВ, содержащих в молекуле сложноэфирную, лактонную, лактамную, амидную, имидную группы, является реакция с гидроксиламином, основанная на образовании гидроксамовых кислот (гидроксамовая проба):
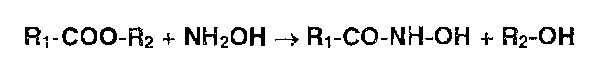
Гидроксамовые кислоты, взаимодействуя с ионами железа (III) или меди (II), образуют окрашенные соли.
|
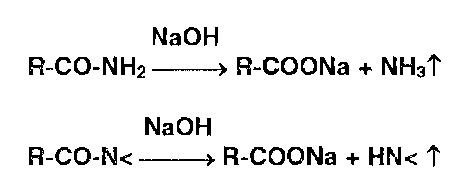
* Реакции разложения амидов происходят при нагревании в растворах едких щелочей с образованием аммиака или алкиламинов, имеющих характерный запах: |
|
Указанные химические реакции используют для испытания подлинности солей первичных аммониевых оснований, амидов ароматических и гетероциклических кислот, производных уретанов.
К этой группе реакций можно отнести используемый в фармацевтическом анализе пиролиз (термическое разложение в сухой пробирке). Используют пиролиз для идентификации сульфаниламидов, производных бензодиазепина, пиридина и других ЛВ, которые образуют плавы с различной окраской и выделяют газообразные продукты с характерным запахом.
* Реакции окисления-восстановления. Широко используются в фармацевтическом анализе реакции окисления.
|
Первичные спирты идентифицируют, последовательно окисляя до альдегидов и кислот, которые затем обнаруживают с помощью характерных реакций: |
|
Так, например, восстановительные свойства альдегидов устанавливают с помощью реакции образования «серебряного зеркала»:
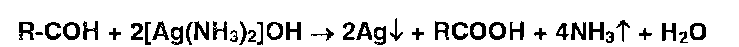
Этот же процесс лежит в основе взаимодействия реактива Несслера с альдегидами (коричневый ):
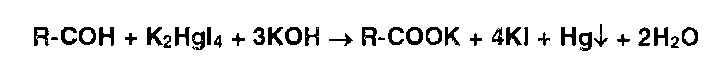
Реакция окисления альдегидов лежит в основе использования реактива Фелинга, представляющего собой смесь отдельно приготавливаемых растворов сульфата меди и калий-натриевой соли винной кислоты. В щелочной среде при нагревании в присутствии альдегидов образуется красный осадок оксида меди (I). Общая схема этой реакции: 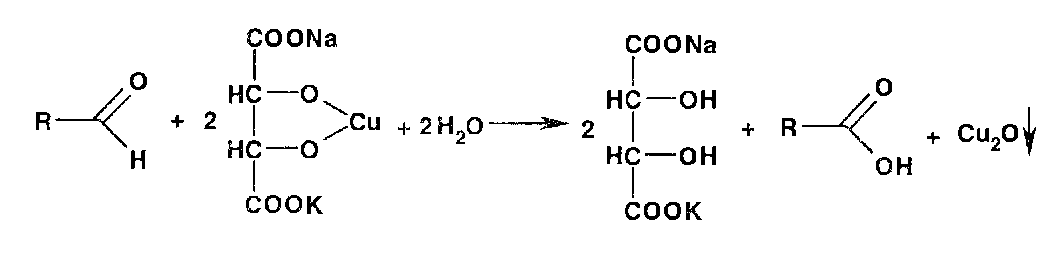
Б) Реакции образования солей и комплексных соединений
Соли органических кислот идентифицируют по наличию катионов натрия, калия, кальция и др. (с помощью рассмотренных выше реакций), а также по наличию анионов органических кислот (ацетат-, бензоат-, салицилат-, тартрат-, цитрат- и других ионов).
А) Широко пользуются при испытаниях на подлинность реакцией нейтрализации натриевых (калиевых) солей органических кислот (бензойной, салициловой и др.):
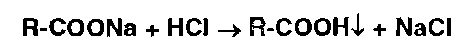
Нерастворимые в воде кислоты при этом осаждаются, и их идентифицируют по температуре плавления.
Б) Органические ЛВ, содержащие в молекуле: спиртовый и фенольный гидроксил, вторичную аминогруппу, имидную группу и др. образуют с ионами тяжелых металлов нерастворимые в воде или окрашенные соли и комплексные соединения. В качестве реактивов при этом используют соли железа (III), меди (II), ртути (II), кобальта, свинца, кадмия, серебра, сурьмы и др.
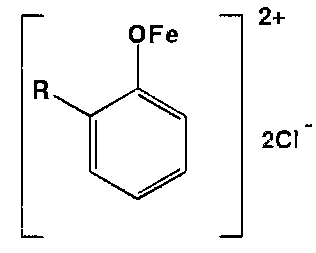
- Ион железа (III) —широко используемый в фарм. анализе реактив. Взаимодействуя с фенолами, он образует ионы феноксидов железа, окрашенные в синий, фиолетовый или красный цвет, например:
|
|
Окрашенные комплексы с ионами железа (III) образуют практически все органические соединения, содержащие в молекуле фенольный гидроксил. Если он связан в сложноэфирную группу, то р- ю выполняют после гидролиза. |
Различную окраску в зависимости от рН среды имеют комплексные соединения иона железа (III) и салицилат-иона: рН 1-фиолетовый, рН2,5 – красный, рН 7,4 –жёлтый.
Структура этих комплексов обусловлена наличием у салицилат-иона не только фенольного гидроксила, но и карбоксильной группы.
- Ионы железа (III) образуют окрашенные в красный цвет соли с ацетат-ионом:

- с бензоат-ионом — бензоат железа (розовато-желтый осадок):
- комплексные соли образуют с ионами железа (III) также глюконат-, аминосалицилат-ионы, кислота аскорбиновая и др.
|
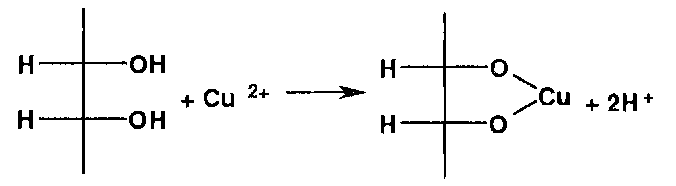
-Ион меди II образует окрашенные комплексные ионы с многоатомными спиртами (глицерол, аминоспирты): |
|
Наличие спиртового гидроксила и вторичной аминогруппы в молекулах аминоспиртов создает условия для образования окрашенных внутрикомплексных соединений:
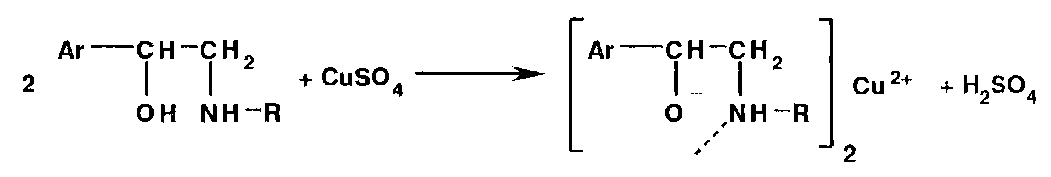
Аминокислоты с солями меди (II) образуют комплексные соединения, имеющие темно-синюю окраску:
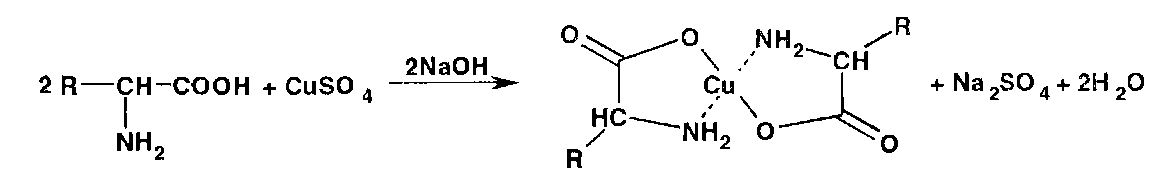
Различные по растворимости и окраске внутрикомплексные соединения меди (II) образуются с сульфаниламидами _голубовато-зелёный, серо-грязно-фиолетовый …). Ион меди при этом замещает подвижный атом водорода:
Подобные комплексы с амидами сульфаниловой кислоты образуют и другие ионы тяжелых металлов (кобальта, серебра).
При определенных значениях рН среды с солями меди образуют комплексные соединения барбитураты, гидроксамовые кислоты и др.
Ионы кальция с цитратами образуют при кипячении белый осадок цитрата кальция:
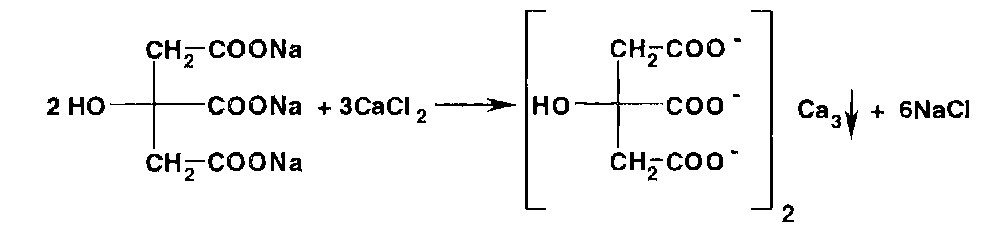
Ионы кобальта в присутствии солей кальция образуют сине-фиолетовые комплексные соединения с барбитуратами. С производными пурина, имеющими в молекуле незамещенный атом водорода в имидной группе в положении 1 и 7, соли кобальта образуют окрашенные осадки.
Ионы серебра образуют растворимые (монозамещенные) соли с барбитуратами, производными пурина, при наличии в их молекулах незамещенной имидной группы:

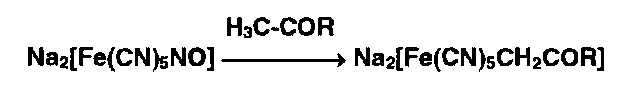
Нитропруссид натрия Nа2[Fе(СN)5NO] • Н2О образует окрашенные продукты с различными органическими соединениями вследствие замещения нитрозогруппы
|
в его молекуле, например, кетонами: |
|
Кроме кетонов, окрашенные продукты с нитропруссидом натрия образуют альдегиды, фенолы, сульфаниламиды, производные пиридина, изоникотиновой кислоты, имидазола, ряд алкалоидов, сердечных гликозидов и др.
В) Идентификация органических оснований и их солей
Общим испытанием на соли органических оснований [ R =N] • НА с неорганическими и органическими кислотами (НА) является реакция нейтрализации связанных с ними кислот. При этом органическое основание выпадает в осадок:
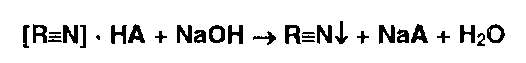
Затем основание можно идентифицировать по температуре плавления или с помощью цветных реакций.
Анионы связанных неорганических (хлороводородной, бромоводородной, йодоводородной, азотной, фосфорной) и органических (бензойной, салициловой, виннокаменной и др.) кислот обнаруживают с помощью рассмотренных выше качественных реакций.
Органические азотсодержащие основания и их соли, в т.ч. алкалоиды, витамины, антибиотики, можно идентифицировать с помощью осадительных (общеалкалоидных) реактивов.
Осадительные реактивы образуют с органическими азотсодержащими основаниями (алифатической, ароматической, гетероциклической структуры) и их солями аморфные или кристаллические осадки (белые или окрашенные), которые имеют стабильную температуру плавления, что также подтверждает подлинность испытуемого ЛВ. Особенно широко для испытания подлинности используют пикриновую кислоту, образующую со многими органическими основаниями пикра- ты (жёлтые), нерастворимые в воде.
Для идентификации орг. оснований и их солей используют реактивы, которые не совсем точно называют специальными (специфичными) по отношению к некоторым алкалоидам. К их числу относятся: конц. серная кислота, конц. азотная кислота, смесь этих кислот (реактив Эрдмана), конц. серная кислота, содержащая ванадиевую кислоту (реактив Манделина), конц. серная кислота, содержащая формальдегид (реактив Марки).
Конц. серная кислота —широко используемый в фарм. анализе реактив. При испытании подлинности многих орг. соединений используются ее активные окислительные, дегидратирующие свойства и каталитическое действие. Сочетание конц. серной кислоты с другими окислителями усиливает окислительную активность этих реактивов. Кроме того, она участвует в таких химических процессах, как конденсация, кислотный гидролиз, минерализация.
Конц. азотная кислота используется для опред. органических соединений, т.к. проявляет свойства окислителя и нитрующего агента. Продукты окисления приобретают различное окрашивание, а образовавшиеся ни- тропроизводные имеют характерное желтое окрашивание и легко переходят под действием гидроксидов щелочных металлов в ацисоли, имеющие хиноидную структуру и иную окраску
PAGE 1
Химические методы установления подлинности лекарственных веществ