Основные проблемы молекулярной биофизики. Физика биополимеров как раздел молекулярной биофизики и ее задачи. Первый закон термодинамики
Лекция 1. Основные проблемы молекулярной биофизики. Физика биополимеров как раздел молекулярной биофизики и ее задачи. Первый закон термодинамики.
Биофизика – или биологическая физика – наука, образовавшаяся на стыке двух наук. Биология – это наука о живой природе, объекты которой неизмеримо сложнее неживых. Физика – это наука, изучающая строение и свойства конкретных видов материи – вещества и поля – и формы существования материи – пространство и время. В этом определении нет разграничения живой и неживой природы. Оно не означает сведение всего естествознания к физике, но из него следует, что конечные теоретические основы любой области естествознания имеют физический характер. Поэтому биофизику можно определить как физику явлений жизни, изучаемых на всех уровнях, начиная с молекул и клеток и заканчивая биосферой в целом. Итак, биофизика – это наука, изучающая физические и физико-химические процессы, которые протекают в биологических системах на разных уровнях организации и являются основой физиологических процессов. То есть биофизика – не вспомогательная область физики или, с другой стороны, биологии и физиологии. Она не сводится к использованию физических методов или приборов в биологических экспериментах. Медицинский термометр, электрокардиограф, томограф микроскоп – физические приборы, но биолог или врач, использующие эти устройства, не занимаются биофизикой. Биофизические исследования начинаются с физической постановки задачи, относящейся к живой природе и должны формулироваться исходя из общих законов физики и атомно-молекулярного строения вещества.
Формулировка биофизических задач сегодня возможна в ограниченном числе случаев, поскольку живая природа настолько сложна, что биологические знания большей частью недостаточны для реализации физических подходов. Задачи биофизики те же, что и биологии. Они состоят в познании явлений жизни. В настоящее время нет строго определения – что же такое жизнь. Но можно перечислить основные признаки живой материи, которые отличают ее от неживой материи.
Есть такое определение живого организма как открытой, саморегулируюшейся, самовоспроизводящей и развивающейся гетерогенной (неоднородной) системы, важнейшими функциональными веществами которой являются биологические полимеры – белки и нуклеиновые кислоты сложного атомно-молекулярного строения.
Биологи задают вопрос «Для чего?», а физики – «Почему?». Второй вопрос более научен, т.к. наука, и естествознание в целом, ищет причины явлений. Все методы исследования в биофизике должны давать количественные результаты. Поэтому выделяют несколько основных задач биофизики:
- Раскрытие общих закономерностей поведения открытых неравновесных систем. Теоретическое обоснование термодинамических основ жизни.
- Научное истолкование явлений индивидуального и эволюционного развития, саморегуляции и самовоспроизведения.
- Выяснение связей между строением и функциональными свойствами биополимеров и других биологически активных веществ.
- Создание и теоретическое обоснование физико-химических методов исследования биообъектов.
- Физическое истолкование всего комплекса функциональных явлений (генерация и распределение нервного импульса, мышечное сокращение, рецепция, фотосинтез и др.)
Биофизика условно подразделяется на такие основные области:
- Молекулярная биофизика изучает строение и физико-химические свойства, биофизику молекул.
- Биофизика клетки изучает особенности строения и функционирования клеточных и тканевых систем.
- Биофизика органов исследует молекулярные механизмы рецепции, процессы преобразования энергии внешних воздействий в специфические реакции нервных клеток и механизмов кодирования информации в органах чувств.
- Биофизика сложных систем изучает кинетику биопроцессов, поведение во времени разнообразных процессов присущих живой материи и термодинамику биосистем.
Молекулярная биофизика – часть биологической физики, основными объектами изучения которой являются биологические полимеры – белки и нуклеиновые кислоты, а также их компоненты. Методами современной физики молекулярная биофизика исследует физические свойства этих соединений. Прежде всего исследуются: 1) сложнейшая структура биологических полимеров; 2) условия стабильности пространственной структуры; 3) природа сил, ответственных как за устойчивость биополимеров, так и определяющих их удивительную конформационную подвижность и 4) условия, в которых существуют стабильные формы и происходят различные структурные изменения биополимеров. Важным является изучение взаимодействия биополимеров с малыми молекулами и ионами, а также взаимодействия биополимеров друг с другом. Именно процессы взаимодействия определяют все превращения в биологических системах: хранение и передача наследственной информации, синтез и распад биополимеров, процессы обмена на всех уровнях организации: от клетки до целого организма и многие другие. Для осуществления всех перечисленных процессов необходимо создание определенных, биологически функциональных или нативных структур, устойчивость их в определенных диапазонах условий (температура, концентрации ионов, состав растворителя и уровень влажности, наличие малых биологически активных молекул, различных внешних воздействий – УФ-облучение, радиация, сверхвысокие частоты и т.д.). Все эти вопросы являются предметами молекулярной биофизики.
Чем занимается биология и чем физика? Физик и химик изучают атомы, молекулы и т.д. Биолог, идя им навстречу, интересуется органами, тканями, клетками. Пересекаются ли области интересов физика и биолога, или только соприкасаются, или между ними лежит пропасть? Вопрос острый – ведь если пропасть, то нам никогда не понять как следует, что такое жизнь. Оказывается, что именно биополимеры со своими тремя иерархическими уровнями структуры – первичной, вторичной и третичной – имеют все основания претендовать на роль моста через пропасть: с одной стороны, биополимерная цепь – это просто молекула, и вопрос о ее свойствах можно поставить как чисто физический, с другой стороны, свойства биополимерной макромолекулы если не обладают тем, что можно назвать биологической спецификой, то во всяком случае тесно с ней связаны.
Действительно, в чем с точки зрения физика специфика любого биологического объекта, от слона до микроба? Одна из главных особенностей – наличие конструкции, приданной от рождения и сохраняемой до смерти. Но этим свойством, пусть в простейшей форме, обладает и цепь биополимера – при синтезе она получает первичную структуру и сохраняет ее до распада. Академик Лифшиц И.М., выдвинувший изложенные соображения в 1968 г., назвал это свойство биополимеров линейной памятью: можно сказать, что молекулярная цепь «помнит» возникшую при синтезе линейную структуру. Получается, что, анализируя физику систем с линейной памятью, можно надеяться вплотную подойти к тайнам биологии.
Чисто словесное описание структуры биополимеров – иерархической структуры и каких-то их физико-химических свойств – дает довольно поверхностное представление о них. Необходимо привлечь математику для получения строгих моделей процессов, в которых участвуют биополимеры. Но реальные системы очень сложны, при их полном описании надо учитывать огромное число факторов, и при этом задача построения точной теории безнадежна. Теоретическому анализу доступны только упрощенные модели реальности, ухватывающие ее основные черты и игнорирующие второстепенные. Но зато математическое описание модели дает более глубокое понимание ее свойств, которое позволяет совсем иначе смотреть на реальность.
Cпецифика полимерных молекул в отличие от малых молекул определяется большим числом однотипных звеньев - мономеров, связанных в линейную цепь. Тепловое движение входящих в полимерную цепь атомов и атомных групп, повороты и вращения их вокруг единичных связей обуславливают большое число внутренних степеней свободы макромолекулы. Это заставляет рассматривать макромолекулы как макроскопическую систему, статистический характер поведения которой проявляется в наличии средних значений таких параметров как масса, размеры, степень свернутости макромолекулы. Вместе с тем существующие между атомами химические связи и взаимодействия ближнего и дальнего порядка накладывают определенные ограничения на число возможных конформаций биополимеров. Изменение конформации биомакромолекул, происходящее в процессах клеточного метаболизма и переноса (трансформации) энергии, так же носят вполне определенный характер и отражают внутримолекулярную динамическую организацию биополимеров. Таким образом, своеобразие биомакромолекулы как физического объекта состоит в тесном сочетании статистических и детерминистских (механических) особенностей ее поведения. С одной стороны, большое число взаимодействующих атомов и внутримолекулярных степеней свободы и, как следствие, возможность осуществления огромного числа различных конформаций, а с другой - определенный химический характер и конформационные изменения при функционировании биополимеров.
Основная проблема состоит в том, чтобы раскрыть природу взаимодействия атомных групп, определяющих конформационные особенности и внутреннюю динамику биомакромолекул, механизмы взаимодействия электронных и конформационных переходов, и на этой основе понять механизмы функционирования биополимеров в живых системах. Именно это и составляет предмет молекулярной биофизики в целом, и физики биополимеров, в частности.
Возникает вопрос: можем ли мы применять законы физики, используемые для изучения относительно более простых систем неживой природы, к объектам более сложным, являющимся основой жизни. Вопрос этот во многом и философский. Он стоял перед исследователями всегда, еще в античности, и позже, по мере развития знания о строении живого организма были предложения о рассмотрении живого организма как высокоупорядоченной машины – механистическая теория, возникшая после таких открытий, как описание Гарвеем системы кровообращения. Одновременно существовала и виталистическое воззрение – об уникальности живого, непознаваемости его на уровне физики и химии, существование некой «живой» силы, определяющей свойства живого «быть живым» - т.е. воспроизводится во времени и пространстве, создавать себе подобные в целом, но уникальные в частностях живые организмы. Позже он обсуждался такими серьезными физиками как Бор, Шредингер. Наиболее серьезно к нему подошел Нильс Бор в 20-30-х годах прошлого века. В 1927 г. Он сформулировал принцип неопределенности, основанный на новых взглядах на природу и ее познание, возникшее по мере развития квантовой механики и атомной физики, но имевший более общий, общефилософский смысл. Применительно к квантовой механике этот принцип звучит так: «Чтобы наиболее адекватно описать физический объект, относящийся к микромиру, его нужно описывать во взаимоисключающих, дополнительных системах описания, например, и как волну, и как частицу, учитывать непрерывность и атомизм световых явлений». Применимость такого принципа к познанию живого, самой жизни Бор понимал так: «Мы вынуждены принять, что собственно биологические закономерности представляют собой законы природы, дополнительные к тем, которые пригодны для объяснения свойств неодушевленных тел». При этом он высказывается так, что свойства неживых объектов лучше объяснять свойствами входящих в них частей, а свойства живого объекта – законами существования целого. Эти представления наиболее полно были высказаны им на Международном конгрессе по световой терапии в Дании (Копенгаген) в 1932 г. - лекция «Свет и жизнь». Позже, в 1958 г. он опубликовал всю подборку материалов о связи проблем живых организмов и процессов, в них происходящих, с современной физикой (сборник «Атомная физика и человеческое познание»). По этим материалам видно, что Бор создал своего рода методологический подход, который приводил в соответствие возможность применимости законов микромира – физических и химических – к изучению биологических объектов на молекулярном уровне – на низшей ступени иерархии живого организма, чтобы применять полученные знания для анализа и изучения живого организма как целого. Это возможно, поскольку в конечном итоге живой организм на молекулярном уровне – это атомы, специфически организованные в молекулы живого. Он ввел и понятие жизни как элементарного кванта – т.е. жизнь как квант – или она есть, или ее полностью нет. Вся биология умещается в кванте жизни, как состояние атомов умещаются в квантах действия, открытых Планком. Но вирус – это живое или неживое – фактически кристалл большую часть времени своего существования, и делящаяся частица в короткий промежуток времени при попадании в клетку хозяина.
Несколько позже (1943-44 гг.) Шредингер в своей знаменитой книге «Что такое жизнь? С точки зрения физика» популяризировал и развил идеи Тимофеева-Ресовского и Дельбрюка о связи биологии, точнее, генетики и той области биологии, которую позже назовут «молекулярной биологией», с квантовой механикой. Эти идеи родились как раз после лекций Бора и привели Тимофеева-Ресовского, Циммера и Дельбрюка к идее о том, что– ген – это «квант» - т.е. неделимая, дискретная единица наследственности. Они смогли выделить такой «квант» - оценить его размеры. Вопрос, который стоял в эти времена перед наукой: как физика и химия могут объяснить те явления в пространстве и времени, которые происходят в живом организме? Возникает такой вопрос неслучайно. Действительно, расположение и взаимодействие атомов в биологических молекулах коренным образом отличается от того расположения, с которыми физики и химики имеют дело в экспериментальных и теоретических исследованиях неживой природы. В физике объектом является так называемый периодический кристалл, когда говорят об определении структуры вещества на молекулярном и атомном уровнях. Самые же существенные молекулы живых организмов – биополимеры – «с полным основанием можно назвать апериодическим кристаллом». Для физиков периодические кристаллы являются очень интересными и сложными объектами исследований (рис. Кристалла). «Они составляют одну из наиболее очаровательных и сложных структур, которыми неодушевленная природа приводит в замешательство интеллект физика. Однако по сравнению с апериодическим кристаллом они кажутся несколько элементарными и скучными». (рис. ДНК и белка).
Интересно заметить, что биологическая индивидуальность, проявляющаяся в форме всеобщего закона и являющаяся неотъемлемым качеством всего живого, выражается прежде всего в бесконечном разнообразии «архитектуры» биологических объектов. Имеется в виду их структура и строение, а применительно к биополимерам, и конформация макромолекул. При этом симметрия и упорядоченность у организмов и у кристаллов радикально различаются. У организмов многое определяется скоростью роста в разные моменты и в разных направлениях, а не только геометрией трехмерной решетки, т.е. законами пространственной упаковки. Биополимеры – это начальная, низшая ступень симметрии живого. Их полимерные цепи строятся по химическим законам, которые весьма своеобразны. Например, все натуральные полипептиды содержат только левые изомеры аминокислот, тогда как правые изомеры, химически вполне равнозначные, природой отвергаются. Причина этого пока не установлена, но структурное своеобразие биополимеров выявляется четко.
Далее, биологические полимеры сворачиваются в уникальные и по-своему всегда симметричные трехмерные системы, которые в свою очередь определяют строение клеточных органелл, самих клеток и образованных из них тканей. Поскольку структуры и конформации всех биополимеров строго генетически детерминированы, генетически заданными окажутся и все более сложные «архитектурные» формы живого. Нельзя при этом забывать, что окончательный вид высших биологических структур, начиная с клетки, зависит также и от времени (хронологически детерминирован), так как в процессе индивидуального развития – онтогенеза – в различных клетках в разное время работают далеко не все и далеко не одинаковые гены (явление клеточной дифференцировки).
Поэтому совершенно очевидным является утверждение, что как бы велика ни казалась дистанция от атомов и молекул до интегрированной системы клетки, включающей многие тысячи атомов и молекул, в клетках как элементарных биологических системах не содержится ничего другого, кроме атомов и молекул, специфическое взаимодействие которых и приводит ко всем особенностям биологического функционирования, называемого жизнью. Именно поэтому изучение специфических взаимодействий атомов и молекул, имеющих место в биологических системах, представляется необходимой конечной целью любого исследования, ставящего задачу выяснения молекулярных механизмов любых биологических процессов.
Весь опыт развития биофизики в целом, и молекулярной биофизики в частности, показывает, что поскольку в основе жизнедеятельности любого организма в конечном итоге лежат процессы, происходящие на молекулярном уровне, то все законы физики и химии применимы к молекулам, участвующим в этих процессах. Правда, эти молекулы – биополимеры - отличаются по сложности от органических соединений или синтетических полимеров. Тем не менее, можно сделать основной вывод: не может быть сомнения, что все своеобразие живых организмов, отличающее их от тел неживой природы, возникает в результате особой организации сложных молекулярных систем, в основе которых лежат те же закономерности, которые определяют свойства атомов и молекул и построенных из них тел неживой природы.
Методы молекулярной биологии, основанные на убеждении, что путь к пониманию сложного лежит в расчленении этого сложного на все более и более простые составные части и изучение их природы и свойств, оказывается совершенно незаменимым, особенно при анализе структурной изменчивости сложных биологических систем. Такой путь исследования, приводящий в конце концов к установлению исходных взаимообусловленных связей, позволяет открыть важные стороны связи части и целого как в биологических макромолекулах, так и в более сложных биологических системах. При этом в биологических системах связывание практически никогда не выражается в простой сумме связываемых единиц. При изучении биополимеров возникает возможность выяснить роль тех или иных связей и их влияние на взаимодействующие части, не расчленяя макромолекулы на составные единицы. Исследование переходов порядок-беспорядок в биополимерах позволяет получить количественные характеристики поведения отдельных частей макромолекулы непосредственно в комплексе.
Молекулярная биофизика решает те же проблемы по отношению к биологическим молекулам, что и молекулярная физика по отношению к атомам и молекулам тел неживой природы. Какие же это проблемы?
Молекулярная физика изучает физические явления, существенным образом зависящие от атомно-молекулярной природы вещества. Молекулярная физика дает информацию, во-первых, о строении вещества, т.е. о строении молекул на основании изучения их физических свойств. Во-вторых, она дает информацию о природе физических и физико-химических процессов в веществе исходя из его строения. Можно представить, исходя из этого, три основные группы задач молекулярной физики.
Первая группа – определение строения в широком смысле этого слова. Методы физики позволяют установить геометрическое расположение атомов в молекулах, кристаллах и жидкостях. Основные методы – это рентгеноструктурный анализ, нейтронография, некоторые спектроскопические методы. Интерференция рентгеновских и электронных волн, рассеянных атомами, зависит от межатомных расстояний и позволяет их определить. Атомы водорода рассеивают рентгеновские лучи и электроны. Но расположение атомов водорода можно лучше установить по рассеянию нейтронов.
Механические характеристики молекул, т.е. силы взаимодействия между атомами, определяют частоты и формы колебаний атомов в молекулах относительно друг друга. Поэтому они устанавливаются при изучении колебательных спектров – методами инфракрасной спектроскопии и спектров комбинационного рассеяния. Пространственное распределение электронов в молекуле, набор уровней энергии электронов и вероятности переходов между уровнями определяют оптические, электронные и магнитные свойства молекул. За электрические и оптические молекулярные явления ответственны в первую очередь две основные молекулярные характеристики (константы) – поляризуемость и дипольный момент. Поляризуемость характеризует способность электронов смещаться под действием постоянного или переменного электрического поля, она находит свое выражение в диэлектрической проницаемости, в преломлении и рассеянии света. Дипольный момент молекулы, или ее составной части (отдельной химической связи, группы атомов) выражает полярность системы, равновесное распределение зарядов. Свойства электронной оболочки молекулы непосредственно проявляется в электронных – УФ и видимых – спектрах. Теория строения электронной оболочки молекулы и явлений, им определяемых, это квантовая механика и квантовая химия. Само явление химической связи и тем самым существование самой молекулы определяется квантовомеханическими закономерностями. Но часто проблемы, связанные с электромагнитными свойствами молекул, с успехом решаются на основе полуэмпирической классической теории, позволяющей обойти огромные трудности квантовохимических расчетов для сложных многоэлектронных систем.
Вторая группа задач молекулярной физики связана с равновесными свойствами молекулярных систем – газов, кристаллов, жидкостей. Общее описание этих свойств дается термодинамикой. Задачи молекулярной физики при исследовании равновесных систем состоят в нахождении термодинамических условий равновесия и их статистическом объяснении на основе молекулярных представлений. То есть для решения этих задач необходимо и достаточно нахождения такой молекулярной модели, которая позволила бы вычислить статистическую сумму ансамбля, т.е. определить вероятности различных состояний, а из них рассчитать любую термодинамическую величину: энергию, энтальпию, энтропию и т.д.
Третья группа задач молекулярной физики относится к рассмотрению кинетических свойств исследуемых систем. Классическая термодинамика является, в сущности, термостатикой – она игнорирует временной ход процессов, считая их практически бесконечно медленными. Поэтому ни термодинамические, ни статистические расчеты не дают ответов на вопросы, связанные с определением скоростей превращения изучаемых веществ. Соответствующие задачи решаются методами физической кинетики и термодинамики необратимых процессов.
Теперь рассмотрим, как молекулярная биофизика связана с молекулярной физикой. Понимание, что в основе жизненных явлений лежат молекулярные процессы, привело биологию в непосредственный контакт с молекулярной физикой. Молекулярная биофизика, таким образом, изучает физическую природу явлений, исследуемых молекулярной биологией и биохимией. Здесь формулируются те же три класса задач, что и в молекулярной физике: изучение структуры, термодинамики равновесных процессов и кинетики. В современной молекулярной биофизике основное внимание уделяется строению и физическим свойствам биополимеров – белкам и нуклеиновым кислотам. Молекулярная биофизика изучает условия равновесия молекулярных биологических процессов, в которых участвуют биополимеры, кинетику этих процессов. Речь идет о структурных и химических превращениях белков и нуклеиновых кислот, ответственных за важнейшие жизненные процессы: синтез белка и нуклеиновых кислот, ферментативный катализ и проч. Молекулярная биофизика основывается на теоретических представлениях и экспериментальных методах современной молекулярной физики и представляет собой физическую часть молекулярной биологии. Невозможно отделить молекулярную биофизику от биофизической химии как молекулярную физику от физической химии. Все процессы, протекающие на молекулярном уровне, одновременно являются и физическими, и химическими.
За последние годы открыты, проанализированы и получили достаточно полное качественное описание многие генетические, физиологические и другие биологические процессы и явления. Все они, в той или иной мере, связаны со структурной организацией объектов исследования, в качестве которых выступали либо просто биополимеры – биологически активные высокомолекулярные органические соединения, построенные из большого числа одинаковых или различных по своей физико-химической природе ковалентно-связанных друг с другом мономеров (белки, нуклеиновые кислоты), либо более сложные комплексы, например, биомембраны, рибосомы, митохондрии и целые клетки. Современная молекулярная биология демонстрирует, что именно изменчивость структурной организации биомакромолекул обуславливает протекание всех физиологических процессов в живой клетке и организме и определяет их специфичность. Изучение этой структурной изменчивости на молекулярном уровне – одна из основных задач физики биополимеров.
Эти выводы вытекают также из представлений о необходимости высокой упорядоченности всех процессов, протекающих в живых организмах на молекулярном уровне, поскольку только так можно создавать и поддерживать столь сложные многоклеточные организмы в функционирующем состоянии. Кроме того, необходима также высокая упорядоченность взаимодействий организмов с окружающей средой для поддержания жизнедеятельности. Все такие процессы невозможны без строгой «физичности», лежащей в их основе, т.е. в подчинении физическим и химическим законам, известным для неживой природы. Также надо учитывать, что случайные, флуктуационные явления не должны играть очень большой роли в биологических процессах, чтобы, с одной стороны, обеспечить высокую стабильность организма, а, с другой стороны, дать возможность в появлении определенных изменений, т.е. гибкости организма для выживания при изменяющихся внешних условиях.
Обсуждая физические закономерности строения и функционирования биополимеров укажем на одно существенное различие в подходах к решению проблем на биохимическом и физическом уровнях. Результаты молекулярной биологии и биохимии получены, как правило, по одной общей схеме. Проблема считается решенной, если удается выявить основных участников рассматриваемого процесса (молекулы химических веществ) и с помощью «стрелок» и «черточек» построить логически непротиворечивую схему причинно-следственных связей между ними (рис.1 - какой-нибудь цикл из биохимии). Как писал в 1957г. Лауреат Нобелевской премии биохимик Сент-Дьерди «Биоэнергетика», биохимия «все еще продолжает быть наукой Лукреция или Эпикура: буква-черта-буква». С точки же зрения физики на этом этапе исследования проблема часто только формулируется, так как за каждой «стрелочкой» на молекулярно-биологической схеме скрыт, как правило, неизвестный механизм. Так, поражающая воображение четкая работа «клеточной ЭВМ» – рибосомы (рис.1-2) остается загадочным явлением, совершенно непонятным с физической точки зрения. По этой причине в физике биополимеров ограничиваются более «простыми» задачами, которые можно решить имеющимися средствами экспериментально или теоретически. В действительности это очень сложные проблемы, требующие для своего решения использования часто предельных возможностей современных экспериментальных физических методов и всей мощности вычислительной техники для теоретических расчетов. Новые экспериментальные данные, полученные при исследовании биологических процессов на молекулярном уровне, требуют особой интерпретации. Выяснение на молекулярном уровне механизма биологических процессов требует привлечение различных областей физики, чтобы успешно описать взаимодействия на атомном уровне. Предполагается, что эти задачи могут быть решены на основе знания атомного состава основных биологических элементов при учете внутримолекулярных и межмолекулярных взаимодействий и вызываемых ими преобразований и конформационных изменений макромолекул, переносом энергии как «внутри» молекул, так и между ними.
Tермодинамика. Система, энергия, работа, внутренняя энергия, энтальпия. Общая формулировка первого закона термодинамики.
Для физики есть три наиболее общие задачи при объяснении процессов, проходящих в неживой природе – энергетические основы процессов, строение вещества, динамика процессов, то есть их прохождение во времени. Основа жизнедеятельности любого живого организма – энергия. Растения получают энергию от энергии солнца, животный мир – через питательные вещества и их обмен в организме. Физика позволяет установить закономерности превращения различных видов энергии в живом организме для возможности осуществления его функций, т.е. в терминах физики – возможности совершения различных видов работы.
Термодинамика – это наука, изучающая наиболее общие закономерности превращения различных видов энергии в системе. Или термодинамика – это раздел физики, который занимается описанием – качественным и количественным – процессов превращения различных видов энергии. Она не дает ответов о механизмах и природе явлений, происходящих в живых организмах, а исследует энергетические основы этих процессов. В классической термодинамике рассматриваются главным образом равновесные состояния системы, в которых параметры не изменяются во времени.
Для физической постановки задачи необходимо ввести некоторые основные понятия. В частности, для изучения живых организмов с точки зрения физики вводятся понятие системы и ее видов для того, чтобы установить энергетические основы жизни. Система – совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединяющихся в целое выполнением некоторой общей функции, несводимой к функциям ее компонентов. Система - это совокупность материальных объектов, ограниченных каким-либо образом от окружающей среды.
Термодинамическая система – часть пространства с материальным содержимым, ограниченная оболочкой.
Любая система характеризуется определенными свойствами, или термодинамическими параметрами. Их совокупность определяет термодинамическое состояние системы, поэтому изменение хотя бы одного из параметров приводит к изменению термодинамического состояния системы в целом.
Термодинамические параметры:
- экстенсивные, зависят от количества вещества в системе (масса, объем),
- интенсивные, не зависят от количества вещества в системе (давление, t0).
В зависимости от характера обмена энергии и веществом с окружающей средой через границы системы образуют три группы. Изолированные системы – не обмениваются с внешней средой ни энергией, ни веществом. Закрытые (замкнутые) системы обмениваются с окружающей средой только энергией. Открытые системы обмениваются с окружающей средой и веществом, и энергией.
Существование живого организма и все процессы его жизнедеятельности непрерывно связаны с изменением энергии, с изменением энергетического баланса в системе организм – окружающая среда. Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы между телами. В открытых биологических системах постоянно происходит процесс обмена энергией с внешней средой. Внутренние метаболические процессы также сопровождаются превращениями одних форм энергии в другие.
Энергия (U, E, F, G, E, dE)– количественная мера определенного вида движения материи при ее превращении из одного вида в другой. Энергия всегда определяет способность системы совершать работу. Основные виды (формы) энергии: тепловая, механическая, химическая, электрическая.
Работа (A, A, dA) – мера превращения энергии из одной формы в другую. Численно работа равна энергии, превращенной из одной формы в другую в процессе совершения работы.
Виды энергии: тепловая, механическая, химическая, электрическая, энергия излучения. Виды работы: механическая, осмотическая, химическая, электрическая, работа по высвечиванию.
Единицы измерения энергии – джоуль= н.м, кал – количество тепла, необходимое для нагревания 1 г воды на 1оС, 1 кал=4,18 Дж.
Тепловая энергия – сумма кинетической энергии теплового, хаотического движения атомов и молекул вещества. Показатель теплового движения частиц – температура. Средняя кинетическая энергия: Е = 3/2 kТ, где k – постоянная Больцмана («тепловой квант»), k =1,380.10-16 эрг/град или 3,3110-24 кал/град.
Механическая энергия – форма энергии, характеризующая движения макротел и способность совершать механическую работу по перемещению макротел. Механическая энергия подразделяется кинетическую, определяемую скоростью движения тел, и потенциальную, определяемую расположением макротел друг относительно друга.
Химическая энергия – энергия взаимодействия атомов в молекулах. Всякая химическая энергия – это суммарная энергия движения электронов по атомным или молекулярным орбитам.
Электрическая энергия – энергия взаимодействия электрически заряженных частиц, вызывающая движение этих частиц в электрическом поле.
Термодинамика базируется на двух основных законах – первом и втором началах термодинамики.
Первый закон термодинамики основывается на большом экспериментальном материале – т.е. является обобщением многочисленных опытов – от Ломоносова до Гельмгольца. Он формулируется так:
Общая сумма энергии материальной системы остается постоянной величиной независимо от изменений, происходящих в системе. Изменение в системе возможно только в результате обмена энергией с окружающей (внешней) средой. Таким образом, первый закон термодинамики является количественным выражением закона сохранения энергии, который формулируется так:
Энергия не исчезает и не возникает, а только переходит из одной формы в другую в эквивалентных количествах.
Закон сохранения энергии для тепловых процессов формулируется как первое начало термодинамики. Если мы имеем закрытую систему, то взаимодействие такой системы с окружающей средой, сопровождается обменом энергии между ними, т.е. может осуществляться в результате двух процессов: при теплообмене и при совершении работы. Мерой передачи энергии в процессе теплообмена является количество теплоты, Q, Q, dQ, а мерой передачи энергии при совершении работы – является работа (A, A, dA) (передача энергии в этом процессе).
Внутренняя энергия (U, U, dU) – это общая сумма всех видов энергии в данной системе (тепловой, механической, химической, электрической). Внутренняя энергия является функцией состояния системы и для данного состояния имеет определенное значение: U есть разность двух значений внутренней энергии, соответствующих конечному и начальному состояниям системы:
U = U2 – U1.
Количество теплоты, как и работы, является функцией процесса (передача энергии), а не состояния.
Первый закон термодинамики – обобщение многовекового опыта человечества, он является законом сохранения энергии в применении к процессам преобразования теплоты.
Обычная запись первого закона термодинамики имеет вид
DQ = DU + DA
И означает, что теплота DQ, поглощенная системой из внешней среды, идет на увеличение внутренней энергии DU и совершение работы DA против внешних сил. В общем случае DA включает работу против сил внешнего давления pdv и максимальную полезную работу, сопровождающую химические превращения
DA = pdv + DAmax
Итак,
Первый закон термодинамики: Изменение внутренней энергии системы равно алгебраической сумме тепла, переданного в процессе, и совершенной работе:
DU = DQ + DA
Или: Теплота DQ, поглощенная системой из внешней среды, идет на увеличение внутренней энергии системы DU и совершение работы DA
DQ = DU + DA
Т.е. если dQ – количество теплоты, поглощенное системой из окружающей среды, то она идет на увеличение внутренней энергии системы и совершение работы против сил внешнего давления p по изменению объема V системы и полезную работу, сопровождающуюся, например, химическими превращениями.
dQ = dU+pdV+dA
или:
DQ = DU + DA
В реальных ситуациях значения Q, A, U, dQ, dA, dU могут быть как положительными (теплота передается системе внешними телами, внутренняя энергия увеличивается), так и отрицательными (теплота отнимается от системы, внутренняя энергия уменьшается).
Полное теплосодержание системы - энтальпия (H, H, dH) – это мера изменения теплоты системы, которая соответствует теплообмену при постоянном давлении:
dH = dU + pdV
В биохимических процессах при постоянных p и V
dH = dU,
т.е. H и U – характеристики состояния системы.
Первый закон термодинамики для живых систем. Закон Гесса.
Как первый закон термодинамики применяется к живым системам?
Первичным источником энергии в организме для производства всех видов работ является химическая энергия пищевых веществ (белков, жиров, углеводов), выделяющихся при их окислении. Для растений первичным источником энергии является энергия солнечного излучения, запасаемая в процессе фотосинтеза. Эта же энергия переходит к животным, питающимся растениями.
Но ни энергия солнечного излучения, ни энергия, выделяющихся при окислении пищевых веществ, не используется непосредственно для совершения всех видов работ в организме. Вначале энергия солнечного излучения и пищи трансформируется в энергию макроэргических связей некоторых веществ, главным из которых является аденозинтрифосфорная кислота – АТФ. Таким образом, основной источник энергии для всех процессов жизнедеятельности – энергия, запасенная в высокоэнергетических соединениях, прежде всего в молекулах АТФ. Расщепление, гидролиз АТФ при отщеплении одной фосфатной группы выделяется от 7 до 8,5 ккал/моль (30 – 38 кДж/моль).
АТФ + Н2О АДФ + Н3РО4 + 7,0 – 8,5 ккал
Т.е. все виды работы, совершаемые в живом организме, совершаются за счет энергии АТФ. АТФ – это универсальный источник энергии.
В живом организме все виды энергии в конечном итоге переходять в тепло – тепловую энергию. Она бывает первичной (пассивная) – т.е. непосредственно сразу переход в тепло необратимо, и вторичная (активная) – энергия сначала идет на совершение работы с последующим переходом опять-таки в тепло. Например, прокачивание крови по сосудам – механическая работа с преодолением трения и рассеянием в виде тепла. Т.к. в организме все время совершаются различные виды работы, то в конечном итоге вся энергия переходит в тепло. Большая часть энергии – это мышечная деятельность, т.е. на совершение механической работы.
Как доказать, что первый закон термодинамики работает в живом организме? Надо попробовать оценить количество поглощаемой и выделяемой теплоты, т.е. показать, что живой организм не производит дополнительной энергии при своей жизнедеятельности.
Для этого нужно измерить количество совершаемой работы по количеству тепла, выделяемого организмом с помощью изолированной камеры и калориметра.
Первые попытки установления законов термодинамики для живих органи змов были предприняты еще в XVIII в. Лавуазье и Лаплас, измеряя количество тепла и углекислого газа, выделяемых морской свинкой в ледяном калориметре, пришли к выводу, что окисление веществ в организме и прямое сжигание этого вещества в калориметрической бомбе дают примерно одинаковые тепловые эффекты. Последующие измерения подтвердили этот основной вывод.
Мы можем оценить количество тепла, получаемого при окислении питательных веществ, поступаемых в организм, и сравнить с теплом, выделяемым организмом. Для этого измеряют количество выделяемого тепла и оценивают газообмен, т.е. количество поглощаемого кислорода и выделяемого углекислого газа. Прямая калориметрия – измерения теплопоглощения – измерение выделяемого тепла. Непрямая калориметрия – оценка газообмена. Известно, сколько тепла освобождается при окислении жиров, белков и углеводов до СО2 и Н2О. При этом оценивается и количество выделившегося СО2. Одновременно можно установить и количество поглощаемого кислорода с помощью дыхательного коэффициента – соотношения между СО2 и О2, величина котрого зависит от вида окисляемого продукта (жиры, белки, углеводы). При этом выделяется и различное количество тепла. Такие соотношения между количеством поглощенного кислорода и выделяющегося тепла называется калорическим эквивалентом кислорода. Таким образом, зная общее количество потребленного организмом кислорода и его калорический эквивалент, установленный по величине дыхательного коэффициента, вычисленного на основе данных газообмена, можно определить энергетические траты организма. (см. Схему калориметрии этого процесса).
Определение расхода энергии в течение суток. Метод прямой или непрямой калориметрии.
Прямая калориметрия: Камера "ледяной калориметр". Теплоизолирующий материал, лед, лабораторное животное (человек). Определяется – измеряется все выделяемое организмом тепло.
Прямая калориметрия основана на непосредственном учете в биокалориметрах количества тепла, выделенного организмом. Биокалориметр представляет собой герметизированную и хорошо теплоизолированную от внешней среды камеру. В камере по трубкам циркулирует вода. Тепло, выделяемое находящимся в камере человеком или животным, нагревает циркулирующую воду. По количеству протекающей воды и изменению ее температуры рассчитывают количество выделенного организмом тепла. Одновременно в биокалориметр подается О2 и поглощается избыток СО2 и водяных паров. Продуцируемое организмом человека тепло измеряют с помощью термометров (1,2) по нагреванию воды, протекающей по трубкам в камере. Количество протекающей воды измеряют в баке (3). Через окно (4) подают пищу и удаляют экскременты. С помощью насоса (5) воздух извлекают из камеры и прогоняют через баки с серной кислотой (6 и 8) — для поглощения воды и с натронной известью (7) — для поглощения СО2. О2 подают в камеру из баллона (10) через газовые часы (11). Давление воздуха в камере поддерживают на постоянном уровне с помощью сосуда с резиновой мембраной (9).
Непрямая калориметрия (газовый анализ): Методы прямой калориметрии очень громоздки и сложны. Учитывая, что в основе теплообразования в организме лежат окислительные процессы, при которых потребляется О2 и образуется СО2, можно использовать косвенное, непрямое, определение теплообразования в организме по его газообмену - учету количества потребленного О2 и выделенного СО2 с последующим расчетом теплопродукции организма.
Для длительных исследований газообмена используют специальные респираторные камеры (закрытые способы непрямой калориметрии). Кратковременное определение газообмена в условиях лечебных учреждений и производства проводят более простыми не камерными методами (открытые способы калориметрии).
Наиболее распространен способ Дугласа - Холдейна, при котором в течение 10 -15 мин собирают выдыхаемый воздух в мешок из воздухонепроницаемой ткани (мешок Дугласа), укрепляемый на спине обследуемого. Он дышит через загубник, взятый в рот, или резиновую маску, надетую на лицо. В загубнике и маске имеются клапаны, устроенные так, что обследуемый свободно вдыхает атмосферный воздух, а выдыхает воздух в мешок Дугласа. Когда мешок наполнен, измеряют объем выдохнутого воздуха, в котором определяют количество О2 и СО2.
Кислород, поглощаемый организмом, используется для окисления белков, жиров и углеводов. Окислительный распад 1 г каждого из этих веществ требует неодинакового количества О2 и сопровождается освобождением различного количества тепла. При потреблении организмом 1 л О2 освобождается разное количество тепла в зависимости от того, на окисление каких веществ О2 используется.
Количество тепла, освобождающегося после потребления организмом 1 л О2, носит название калорического эквивалента кислорода. Зная общее количество О2, использованное организмом, можно вычислить энергетические затраты только в том случае, если известно, какие вещества — белки, жиры или углеводы, окислились в теле. Показателем этого может служить дыхательный коэффициент.
Дыхательным коэффициентом (ДК) называется отношение объема выделенного СО2 к объему поглощенного О2. Дыхательный коэффициент различен при окислении белков, жиров и углеводов. Для примера рассмотрим, каков будет дыхательный коэффициент при использовании организмом глюкозы. Общий итог окисления молекулы глюкозы можно выразить формулой:
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
При окислении глюкозы число молекул образовавшегося СО2 равно числу молекул затраченного (поглощенного) О2. Равное количество молекул газа при одной и той же температуре и одном и том же давлении занимает один и тот же объем (закон Авогадро— Жерара). Следовательно, дыхательный коэффициент (отношение СО2/О2) при окислении глюкозы и других углеводов равен единице.
При окислении жиров и белков дыхательный коэффициент будет ниже единицы. При окислении жиров дыхательный коэффициент равен 0,7. Проиллюстрируем это на примере окисления трипальмитина:
2 С3Н5 (С15Н31СОО)3 + 145 О2 = 102 СО2 + 98 Н2О
Отношение между объемами углекислого газа и кислорода составляет в данном случае:
102 CO2/45 O2= 0,703
Аналогичный расчет можно сделать и для белка; при его окислении в организме дыхательный коэффициент равен 0,8. При смешанной пище у человека дыхательный коэффициент обычно равен 0,85-089. Определенному дыхательному коэффициенту соответствует определенный калорический эквивалент кислорода.
Определение энергетического обмена у человека в покое методом закрытой системы с неполным газовым анализом. Относительное постоянство дыхательного коэффициента (0,85-0,90) у людей при обычном питании в условиях покоя позволяет производить достаточно точное определение энергетического обмена у человека в покое, вычисляя только количество потребленного кислорода и беря его калорический эквивалент при усредненном дыхательном коэффициенте. Количество потребленного организмом кислорода определяют при помощи различных спирографов.
Определив количество поглощенного кислорода и приняв усредненный дыхательный коэффициент равным 0,85, можно рассчитать энергообразование в организме; калорический эквивалент 1 л кислорода при данном дыхательном коэффициенте равен 20,356 кДж, т. е. 4,862 ккал. Способ неполного газового анализа благодаря своей простоте получил широкое распространение.
Измеряется количество поглощенного кислорода и выделенного углекислого газа, азота, мочевины и др. Учитывая, что окисление до углекислого газа и воды 1 г жиров дает 9,3 ккал, 1 г белков – 5,4 ккал (или 4,1 ккал до мочевины) и 1 г углеводов – 4,1 ккал, подсчитывали общее количество энергии, поступившей в организм.
Определение питательных веществ, поступающих в организм. Металлический сосуд с теплоизолирующими стенками, в который помещаются исследуемые питательные вещества, затем их сжигают с помощью высоковольтных разрядов и измеряют теплоту сгорания.
Дыхательный Коэффициент равен отношению количества выделяемого СО2 в единицу времени к количеству поглощенного О2 в единицу времени. При окислении углеводов дыхательный коэффициент равен 1, при окислении белков – 0,8, жиров – 0,7. При окислении 1 грамма каждого из этих веществ потребляется различное количество кислорода и освобождается разное количество тепла. Так, при окислении углеводов на 1 л потребленного кислорода выделяется 5,05 ккал, при окислении белков – 4,80 ккал, а жиров - 4,69 ккал.
Количество тепла, которые освобождается при утилизации (переработке) организмом 1 л кислорода, получило название калорического эквивалента кислорода (КЭК). Таким образом, зная общее количество потребляемого организмом кислорода и его калорический эквивалент, установленные по величине дыхательного коэффициента, вычисленного на основании данных газообмена, можно определить энергетические траты организма
Производят сравнение состава и объема вдыхаемого и выдыхаемого воздуха. Используют мешок Дугласа и газоанализаторы: система стеклянных трубочек, поглощающая CO2 и O2.
Полученное с помощью непрямой калориметри значение энергии совпадает с точностью до 1% с количеством тепла, непосредственно измеренного с помощью калориметра в опыте. Для энергетического баланса человека в сутки получено: приход – 1 879 ккал; расход – 1859 ккал. Таким образом, живой организм не является источником новой энергии, и первый закон термодинамики полностью применим к живым организмам.
Первый закон термодинамики полностью применим к живым организмам и может быть сформулирован для живых систем следующим образом:
Все виды работ в организме совершаются за счет эквивалентного количества энергии, выделяющейся при окислении питательных веществ.
Доказательства справедливости первого закона термодинамики применительно к живым системам, как мы уже знаем, получены из опытов по измерению количества тепла и углекислого газа, выделяемых живым организмом. Результаты таких измерений показывают, что, во-первых, живой организм не является источником новой энергии и, во-вторых, окисление поступающих продуктов питания освобождает в организме количество энергии, равное производимой организмом работе.
При химических превращениях следствием первого закона термодинамики является закон Гесса: Тепловой эффект химического процесса, проходящего ряд промежуточных стадий, не зависит от пути превращения, а определяется лишь начальным и конечным состояниями химической системы.
Закон Гесса позволяет вичислить теплове эффекты таких реакций, которые совсем не проте кают в условиях опыта, а также для таких, для которых невозможно измерить тепловой эффект. Биохимические реакции в организме очень сложные и имеют много промежуточных стадий, которые не всегда известны. Однако на основании закона Гесса, зная начальне и конечне продукты реакции, можно рассчитать тепловой эффект сложной биохимической реакции. Закон Гесса используется также для вычисления калорийности пищевых продуктов. Хотя питательные вещества претерпевают в организме сложные превращения, энергетический эффект их равен тепловому эффекту непосредственного сжигания в калориметрической бомбе, поскольку в обоих случаях начальное и конечное состояния реагирующих веществ одинаковы.
Лекция 2. Обратимые и необратимые процессы. Свободная энергия и энтропия. Общая формулировка второго закона термодинамики.
Процессы, протекающие в термодинамической системе и изменяющие ее состояние, могут быть равновесными и неравновесными. Равновесные, или обратимые, процессы протекают в системах таким образом, что вызванные ими изменения в состоянии системы могут произойти в обратной последовательности без дополнительных изменений в окружающей среде. Наоборот, неравновесные, или необратимые, процессы, к которым относятся реальные превращения в природе, не обладают этими свойствами, и их протекание в обратном направлении сопровождаются остаточными изменениями в окружающей среде.
В биосистемах протекают самые разные энергетические процессы: дыхание, фотосинтез, мышечное сокращение, транспорт веществ и т.д. Однако при всем качественном разнообразии эти процессы также можно попытаться свести к двум типам: обратимые и необратимые. Обратимый процесс - это такой процесс, при котором система в каждый данный момент времени находится в состоянии, бесконечно близком к термодинамическому равновесию, и достаточно лишь незначительно изменить условия, чтобы процесс был обращен. При этом под термодинамическим равновесием понимают такое состояние системы, когда градиенты различных видов энергии (химической, электрической) выровнены, и способность системы совершать работу равна нулю. Обращение обратимого процесса не вызывает остаточных изменений в окружающей среде.
В отличие от этого при необратимом процессе система изменяется по направлению к конечному состоянию (при самопроизвольном протекании процесса - к состоянию равновесия) с определенной скоростью. При этом часть свободной энергии системы (то есть той энергии системы, за счет которой может совершаться работа при постоянной температуре) теряется в виде тепла. Например, если совершается механическая работа, то часть затраченной на нее свободной энергии теряется при трении. Для того чтобы обратить данный процесс, необходимо компенсировать эти потери. Следовательно, обращение необратимого процесса связано с остаточными изменениями в окружающей среде.
Свободная энергия (G) – это способность системы совершать работу. Свободная энергия определяется как G = U +pDv – TS, где U – внутренняя энергия системы, р – давление, v – объем, Т – температура, S – энтропия. U + рv = Н - энтальпия системы. Максимальная полезная работа, совершаемая системой, связана со свободной энергией системы:
DАmax - D(U + pDv – TS) = TDS - DU -pDv= - (D G),
где знак “< “ соответствует необратимым процессам.
То есть особая функция – энтропия S, с помощью которой может быть описано состояние системы.
Градиент, связь между градиентом и свободной энергией. Градиент Г какого-либо параметра (величины) представляет собой отношение разности его (ее) значений в двух точках I к расстоянию x между ними:
Г = I/ x
Любая термодинамическая система может совершать работу только тогда, когда в ней есть какие-либо градиенты. Тогда величина свободной энергии G системы определяется величиной градиента:
G=RTlnI1 /I2
где R – универсальная газовая постоянная, Т – температура, I1, I2 - значения параметра, определяющего градиент.
Если вещество неравномерно распределено по какому-то объему и его концентрация в одной точке равна С1, а в другой точке – С2, то концентрационный градиент Г будет равен
Г = (С1 – С2)/(х1 –х2),
где (х1 –х2) – расстояние между данными точками.
Совершение работы в системе связано с реализацией этой свободной энергии. Если совершается работа, то градиент, за счет энергии которого это происходит, уменьшается, но параллельно возникает другой градиент противоположной направленности. При необратимых процессах величина второго градиента будет меньше, чем величина первого.
Что такое энтропия. Энтропия (S) - это термодинамическая функция. Среди термодинамических функций, характеризующих энергетическое состояние биологического объекта, исключительно важное место принадлежит энтропии. Понятие энтропии было введено в 1865 году Рудольфом Клаузиусом, и с тех пор эта функция привлекает внимание физиков и физико-химиков. Значение энтропии особенно четко проявляется при рассмотрении второго принципа термодинамики. Этот принцип, как известно, представляет собой фундаментальный закон природы и в общей форме устанавливает, что в изолированной системе энергия самопроизвольно может переходить только от более высокого уровня к более низкому, а не наоборот. Так постулировал Клаузиус, теплота не может переходить сама собой от более холодного тела к более теплому. Почему для этого анализа выбрали именно энтропию? Это связано с тем, что данная функция дает наиболее полную и в то же время обобщенную характеристику системы. Она может указывать, какие процессы возможны в данных условиях и до какого предела они могут идти. Потери энергии при необратимых процессах, которые происходят обычно в виде тепла, и характеризует энтропия. Таким образом, энтропия отражает ту часть энергии системы, которая рассеялась, деградировала в тепловой форме и не может уже быть использована для совершения работы при постоянной температуре. Из сказанного становится ясным, что при обратимых процессах изменение энтропии равно нулю (S= 0), а при необратимых оно положительно (S> 0).
Второй закон термодинамики устанавливает критерий, отражающий одностороннюю направленность необратимых (неравновесных) процессов не зависимо от их конкретной природы. Согласно второму закону термодинамики, состояние системы может быть описано особой функцией – энтропией S. Изменение энтропии S определяется суммарным значением поглощенных системой теплот, приведенных к температуре: Q/T. При очень малом изменении состояния системы изменение энтропии S равно или больше значения поглощенной системой элементарной приведенной теплоты Q/T, если процесс носил соответственно равновесный (обратимый) или неравновесный (необратимый) характер:
Q/T : DS DQ/T
где Q – поглощенная системой теплота, Т – температура. Для системы, не обменивающейся теплом с внешней средой (изолированной), Q = 0 и, следовательно, S0. Знак неравенства относится к неравновесным процессам. Значит, в изолированной системе энтропия остается неизменной в равновесных (обратимых) и возрастает в неравновесных (необратимых процессах). Это и является критерием направленности превращений в изолированной системе. Таким образом, протекающий в изолированной системе самопроизвольный неравновесный (необратимый) процесс всегда вызывает увеличение энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия. В этом и состоит эволюционный критерий направленности необратимых изменений в изолированных системах, которые всегда идут с увеличением энтропии до ее максимальных значений при окончании процесса и установлении термодинамического равновесия. Увеличение энтропии означает падение степени упорядоченности и организованности в системе, ее хаотизацию. Пользуясь понятием энтропии, можно придать второму закону термодинамики конкретный вид: в изолированной системе могут самопроизвольно протекать только такие процессы, при которых энтропия или остается постоянной (обратимые), или увеличивается (необратимые). Самопроизвольного уменьшения энтропии в такой системе не происходит.
Общая формулировка второго закона термодинамики: Любой самопроизвольный процесс в изолированной системе приводит к уменьшению свободной энергии (G<0), если процесс необратим (неравновесен); если процесс обратим (равновесен), то свободная энергия системы постоянна и минимальна.
Роль энтропии.
Энтропия как мера рассеяния энергии при необратимых процессах. Чем больше возрастание энтропии при каком-либо процессе, тем больше рассеяние энергии и тем более необратим данный процесс.
Энтропия как мера возможности процесса. В этом качестве энтропия выполняет важную роль, и приговор ее непререкаем. Самопроизвольно могут протекать только такие процессы, при которых эта функция или увеличивается (необратимые), или остается постоянной (обратимые). Процессы, при которых энтропия уменьшается, самопроизвольно протекать не могут, то есть термодинамически невозможны. Эта роль энтропии полностью приложима и к биологическим системам. Термодинамический энтропийный критерий однозначно определяет возможность протекания того или иного процесса.
Энтропия как мера упорядоченности системы. Мы уже говорили, что энтропия отражает ту часть энергии системы, которая деградировала, то есть равномерно рассеялась в виде тепла. Таким образом, чем меньше порядка в системе, то есть чем меньше градиенты энергии, тем больше ее энтропия. Особенно четко связь энтропии с упорядоченностью системы проявляется в формуле Планка - Больцмана, которая связывает энтропию с термодинамической вероятностью:
S=klnW,
где S - энтропия, k - постоянная Больцмана, равная 1,38 10-23Дж . К-1 или 3,3110-24 энтропийных единиц (энтропийная единица равна 1 кал/град-1) и W - термодинамическая вероятность, то есть число способов, которыми достигается данное состояние.
Рис. При переходе системы от полного беспорядка (а) к полному порядку (б) меняется термодинамическая вероятность W, а, следовательно, и энтропия S, которая, в соответствии с уравнением Планка-Больцмана равна S=klnW. Чем больше упорядоченность системы, тем меньше ее энтропия.
W - термодинамическая вероятность - всегда больше единицы. В общем виде она равна:
где (если речь идет о молекулах) N - общее число молекул, Ni - число молекул в i-м фазовом объеме. Допустим, у нас есть система, состоящая из трех отсеков. В системе находятся девять молекул. Полный беспорядок в такой системе будет тогда, когда молекулы распределены равномерно, то есть в каждом отсеке будет по три молекулы (рис.). Термодинамическая вероятность такой системы равна:
Полный порядок в системе наблюдается при нахождении всех девяти молекул в одном из трех отсеков (рис.). Термодинамическая вероятность такой системы будет
Таким образом, энтропия - мера упорядоченности системы и отражает ту часть энергии системы, которая деградировала и равномерно рассеялась в виде тепла. То есть, чем меньше порядка в системе и чем меньше градиенты энергии, тем больше ее энтропия. Особенно четко связь энтропии с упорядоченностью системы проявляется в формуле Планка-Больцмана, которая связывает энтропию с термодинамической вероятностью: S=klnW. Таким образом, чем больше упорядоченность в данной системе, тем меньше ее термодинамическая вероятность, и, следовательно, тем меньше энтропия.
Связь между энтропией и информацией. Пусть задано макроскопическое состояние некоторой системы, то есть с определенной степенью точности указаны значения таких параметров, как объем, давление, температура, химический состав и т.п. Каждому макросостоянию системы соответствует набор микросостояний. В микросостоянии точно заданы состояния всех частиц, входящих в систему. Для любой макросистемы при температуре выше абсолютного нуля число микросостояний W, соответствующих данному макросостоянию, огромно. W называется статистическим весом или термодинамической вероятностью данного макросостояния. согласно основному постулату статистической физики, все W микросостояний, соответствующие одному макросостоянию, имеют одинаковую вероятность. Знать микросостояние системы - значит знать о системе все! Величина W непосредственно связана с энтропией. По формуле Планка-Больцмана S=klnW, где k - постоянная Больцмана (1,3810-16эрг/град или 3,31-24 кал/град). Количество информации, которое надо получить о системе, находящейся в данном макросостоянии, чтобы однозначно определить ее микросостояние равно 
Биосистемы и второе принцип термодинамики
Широко используется энтропия и биологами, что вполне понятно. Ведь живой организм – это, прежде всего, энергетическая система, где действуют те же законы термодинамики, что и в неживой природе. Следует, однако, учесть, что живые организмы характеризуются особенностями, которые отсутствуют у физических объектов. Это, как известно, размножение, развитие и т.д. Поэтому энергетический обмен таких систем обладает качественным своеобразием и требует специального анализа. Применим ли второй принцип термодинамики к биосистемам? Ответ на этот вопрос не так прост. В биосистемах протекают процессы, при которых энергия в соответствии с этим принципом переходит с более высокого на более низкий уровень. Это, например, процесс дыхания. В ходе его богатые энергией соединения (углеводы) распадаются до простых низкоэнергетических веществ - воды и углекислоты, а выделившаяся свободная энергия используется для протекания других процессов (например, синтеза АТФ). Однако хорошо известно, что в живых системах осуществляются и такие процессы, в ходе которых энергия переходит с более низкого на более высокий уровень. Так, например, происходит при фотосинтезе. Здесь, как известно, из простых бедных энергией соединений углекислоты и воды при участии квантов света синтезируются вещества (например, углеводы), содержащие значительный запас свободной энергии. Можно назвать и другие процессы в биосистемах, протекание которых, казалось бы, не подчиняется второму принципу термодинамики. Это позволило некоторым ученым говорить о том, что данный принцип не действует в биосистемах. Что так ли это? Ответ на этот вопрос связан с выбором системы для рассмотрения.
Изменение энтропии в открытых системах. Применение второго закона к биологическим системам в его классической формулировке приводит, как кажется на первый взгляд, к парадоксальному выводу, что процессы жизнедеятельности идут с нарушением принципов термодинамики. В самом деле, усложнение и увеличение упорядоченности организмов в период их роста сопровождаются кажущимся уменьшением, а не увеличением энтропии, как должно было бы следовать из второго закона. Однако увеличение энтропии в необратимых самопроизвольных процессах происходит в изолированных системах, а биологические системы являются открытыми. Проблема поэтому заключается в том, чтобы, во-первых, понять, как связано изменение энтропии с параметрами процессов в открытой системе, а во-вторых, выяснить, можно ли предсказать общее направление необратимых процессов в открытой системе по изменению ее энтропии. Главная трудность в решении этой проблемы состоит в том, что мы должны учитывать изменение всех термодинамических величин во времени непосредственно в ходе процессов в открытой системе.
Итак, необходимо рассматривать организм не изолированно от внешней среды, а во взаимодействии с ней. Как известно, в изолированной системе самопроизвольно протекающие процессы приводят ее к состоянию так называемого термодинамического равновесия. При этом состоянии градиенты энергии выровнены, работоспособность системы равна нулю, а ее энтропия максимальна. Однако хорошо известно, что биологические системы, пока они функционируют, никогда не достигают такого состояния. Они всегда обладают работоспособностью, а их энтропия не максимальна. Это связано с тем, что биосистемы являются не изолированными, а открытыми системами. Они постоянно обмениваются энергией с внешней средой. При этом свободная энергия поступает в организм в виде пищевых продуктов, различных излучений и т.д, а выделяется чаще всего в деградированной тепловой форме или в виде низкоэнергетических соединений. Поскольку приток свободной энергии способствует уменьшению энтропии системы (увеличиваются градиенты энергии, уменьшается количество деградированной формы энергии), то нередко говорят, что организм питается отрицательной энтропией и выделяет положительную энтропию. Исходя из сказанного, для рассмотрения приложимости второго принципа термодинамики к биосистемам следует брать не организм как таковой, а организм вместе с участком среды, обеспечивающим его нормальное функционирование в течение определенного времени. Такая система получила название условно изолированной системы. В ней второй принцип термодинамики полностью приложим. В отдельных участках этой системы энтропия, казалось бы вопреки второму принципу термодинамики, может даже уменьшаться (например, в зеленом листе при фотосинтезе). Однако это уменьшение происходит за счет возрастания энтропии в другой части такой системы (например, в источнике света, от которого световая энергия поступает в лист). В результате общая энтропия такой системы в соответствии со вторым принципом термодинамики не уменьшается, а имеет тенденцию к увеличению. Таким образом, можно констатировать, что, так же как и к неживым объектам, второй принцип термодинамики приложим и к биосистемам. Протекание процессов в них идет в соответствии с этим принципом и энтропии здесь принадлежит важная роль.
Таким образом, постулат И.П. Пригожина состоит в том, что общее изменение энтропии dS открытой системы может происходить независимо либо за счет процессов обмена с внешней средой (deS), либо вследствие внутренних необратимых процессов (diS): dS=deS+diS.
Во всех реальных случаях diS>0, и только если внутренние процессы идут обратимо и равновесно, то diS=0. Для изолированных систем deS= 0, и это классическая формулировка второго закона: dS = diS =0. В клеточном метаболизме всегда можно выделить такие две группы процессов. Например, поступление извне глюкозы, выделение наружу продуктов ее окисления (deS) и окисление глюкозы в процессах дыхания (diS). В фотосинтезе приток свободной энергии света приводит к уменьшению энтропии клетки deS<0, а процессы дыхания, диссимиляции в клетке увеличивают ее энтропию diS>0. В зависимости от соотношения скоростей изменения deS и diS общая энтропия dS открытой системы может либо увеличиваться, либо уменьшаться со временем. Если единственной причиной необратимости и увеличения энтропии системы являются ее внутренние процессы, то они ведут к уменьшению ее термодинамического потенциала. В этом случае
где G - полный термодинамический потенциал (или энергия Гиббса G = U + PV - TS).
Энергетическую характеристику открытой биологической системы в соответствии со вторым принципом термодинамики можно дать на основе баланса (обмена) энтропии. Это впервые сделал бельгийский ученый, лауреат Нобелевской премии И. Пригожин. Если обозначить dS /dt - скорость изменения энтропии открытой системы, diS/dt - скорость образования энтропии в системе за счет внутренних необратимых процессов, deS/dt – скорость обмена энтропией с внешней средой, то уравнение Пригожина имеет вид
dS/dt = dSi/dt + dSe/dt
причем член dSi/dt по определению, всегда положителен, а член deS/dt может быть как положительным, так и отрицательным. Таким образом, это изящное уравнение в лаконичной и обобщенной форме выражает суть энергетических процессов, происходящих в открытой биологической системе.
Стационарное состояние. Теорема Пригожина. Особенностью биосистем является то, что они не просто открытые системы, но системы, находящиеся в стационарном состоянии. При стационарном состоянии приток и отток энтропии происходят с постоянной скоростью, поэтому общая энтропия системы не меняется во времени (dS/dt=0). Классической моделью стационарного состояния является система баков (модель Бэртона) (рис. ). При определенной степени открытости кранов в баках В и С устанавливаются постоянные уровни воды. Однако это постоянство коренным образом отличается от постоянства уровня в сосуде с водой. Оно обеспечивается непрерывным притоком и оттоком воды с определенной скоростью. Зачем нужно стационарное состояние биосистемам? Ответ очевиден. Благодаря ему за счет непрерывного обмена энергией с внешней средой биосистемы не только находятся на удалении от термодинамического равновесия (низший возможный энергетический уровень, на котором энтропия системы максимальна) и сохраняют свою работоспособность, но и поддерживают во времени постоянство своих параметров. Немаловажно и то, что в стационарном состоянии биосистемы обладают способностью к авторегуляции. По крайней мере два основных свойства характерны для стационарного состояния биосистем. Прежде всего, это его энергетический уровень, который показывает, насколько далеко система удалена от термодинамического равновесия. Живой организм, как отмечал Оствальд, - это очаг установившихся стационарных состояний. Их уровни не случайны. Они возникли в процессе эволюции и обеспечивают организму наиболее выгодный энергетический обмен в данных конкретных условиях.
Особенностью биосистем является то, что многие протекающие в них процессы находятся на значительном удалении от термодинамического равновесия. В этих условиях для системы характерен очень интенсивный обмен энтропией с внешней средой, что обеспечивает возможность протекания в ней процессов самоорганизации и возникновение специфических динамических структур. Системы, далекие от равновесия, в которых происходит интенсивное рассеяние, диссипация энергии, обозначаются как диссипативные, а область физики, изучающая эти системы и их упорядочение, называется синергетикой. Другой интересной особенностью стационарного состояния является определенная степень его устойчивости. Если стационарное состояние достаточно устойчиво, то после не очень сильного отклонения от него, вызванного каким-либо возмущающим воздействием, система может вновь вернуться в исходное положение. Типичный пример такой устойчивости - содержание глюкозы в крови человека. Как известно, оно достаточно постоянно, но это постоянство поддерживается за счет непрерывного притока и оттока глюкозы. Если ввести в кровь какое-то количество этого углевода, то его содержание увеличится. Однако через некоторое время содержание глюкозы в крови вернется к исходному уровню. Причина устойчивости стационарных состояний была вскрыта Пригожиным. Он доказал, что в стационарном состоянии биосистемы обладают очень интересным свойством. Если система не очень удалена от состояния термодинамического равновесия, член diS/dt при стационарном состоянии сохраняет свое положительное значение, но стремится к минимуму, то есть
Такое нахождение системы в экстремуме, соответствующем минимуму производства энтропии, обеспечивает ей наиболее устойчивое состояние. Важность этого положения ярко обрисовал известный биоэнергетик А. Качальский: «Этот замечательный вывод проливает свет на мудрость живых организмов. Жизнь - это постоянная борьба против тенденции к возрастанию энтропии. Синтез больших, богатых энергией макромолекул, образование клеток с их сложной структурой, развитие организации - все это мощные антиэнтропийные факторы. Но поскольку, согласно второму закону термодинамики, справедливому для всех явлений природы, избежать возрастания энтропии нельзя, живые организмы избрали наименьшее зло - они существуют в стационарных состояниях, для которых характерна минимальная скорость возрастания энтропии».
Теорема Пригожина. Итак, в стационарном состоянии в открытой системе
dS/dt = deS/dt + diS/dt,
причем каждый из членов deS/dt и diS/dt отличен от нуля. Возникает вопрос, можно ли по характеру изменений величины diS/dt во времени предсказать установление в открытой системе стационарного состояния. Ответ на этот вопрос дает теорема Пригожина:
В стационарном состоянии положительная функция diS/dt принимает минимальное положительное значение, или
В стационарном состоянии скорость возрастания энтропии, обусловленного протеканием необратимых процессов, имеет положительное и минимальное из возможных значение:
di S/dt > 0 ® min
Следовательно, по мере приближения к стационарному состоянию скорость образования энтропии внутри открытой системы монотонно уменьшается, постепенно приближаясь к своему минимальному положительному значению. В этом состоит критерий направленности необратимых процессов в открытых системах, находящихся вблизи равновесия. Экспериментальные измерения скорости образования энтропии внутри системы можно проводить в калориметрах, изучая тепловые потоки, сопровождающие образование энтропии при необратимых изменениях в системе.
Второй закон термодинамики для живых систем.
Второй закон термодинамики для живых систем:
Скорость изменения энтропии в организме равна алгебраической сумме скоростей производства энтропии внутри организма и скорости поступления отрицательной энтропии из среды в организм.
dS/dt = dSi/dt + dSe/dt -
математическая запись второго закона термодинамики для живых систем.
Здесь dS, dSi, dSe – общее изменение энтропии системы, изменение энтропии за счет процессов, происходящих в организме и изменение энтропии, обусловленное взаимодействием с внешней средой, соответственно.
Термодинамика – еще некоторые дополнительные замечания.
Свободная энергия F = E — TS складывается из энергии системы E и ее энтропии S. С энергией все понятно. С температурой понятно скорее интуитивно, и к ней мы еще вернемся. С энтропией сложнее, и хочется повторить еще раз.
В простейшем случае частицы в сосуде, который мы рассмотрели, S = k lnV, где V - доступный для частицы объем.
В чем смысл вхождения в свободную энергию этой энтропии (в виде члена -TS)? В том, что если посмотреть на exp[-F/kT], забыв о E - то: exp[-(-TS)/kT] = exp[-(-TklnV)/kT] = V есть просто доступный объем, а он определяет число возможных состояний частицы в пространстве. Чем выше энтропия, тем больше это число состояний, тем вероятнее поэтому нахождение частицы именно в этом объеме.
В общем случае (когда возможные состояния частицы ограничены не только ее столкновениями со стенками, окружающими объем V, но и, скажем, столкновениями c другими частицами), энтропия S частицы равна S = k [логарифм числа доступных состояний].
В молекулярной физике, биологии, химии обычно говорят не об одной частице, а о моле (6 x 1023) частиц, и пишут S = R [логарифм числа доступных состояний]. Здесь стоит еще раз напомнить, что различие между k и R только в том, что k употребляют, говоря об одной частице, а R - о моле частиц. Величина
F = E — TS
называется, строго говоря, свободной энергией Гельмгольца. О ней просто рассказывать, и ее просто и удобно вычислять, так как эта величина относится к системе, которая находится в замкнутом и неизменном объеме.
Однако обычно на опыте измерения ведутся не при постоянном объеме V, а при постоянном внешнем давлении P (например, при атмосферном давлении). В этом случае измеряется не изменение чистой энергии Е изучаемого вещества, а изменение его энтальпии Н=Е+P. В изменение энтальпии H, помимо собственно изменения энергии тела (Е), входит работа, совершенная против постоянного внешнего давления P при изменении объема V этого тела.
На практике величину PV можно игнорировать, так как нас будут интересовать жидкости или твердые тела (где на каждую молекулу приходится небольшой объем), причем при невысоком (типа атмосферного) давлении. При этих условиях величина PV много-много меньше, чем тепловая энергия тела.
Поэтому для нас будет в дальнейшем несущественна разница между H и E. Обе эти величины обычно называют просто «энергия». Столь же несущественно будет и различие между свободной энергией Гельмгольца F = E — TS и свободной энергией Гиббса
G = Н — TS = (E+PV) — TS = F + PV .
И то, и другое (и G, и F) мы, не делая различия, будем именовать просто свободной энергией. Пожалуй, стоит запомнить, что, обсуждая процессы, протекающие в замкнутом объеме, следует употреблять буквы E и F, а обсуждая процессы, протекающие при постоянном внешнем давлении — буквы H и G.
И еще следует запомнить то, что равновесному, стабильному состоянию любой системы при заданной температуре (T=const) соответствует минимум величины F=E - TS, если равновесие устанавливается при фиксированном объеме, и минимум величины G = H- TS, если оно устанавливается при фиксированном внешнем давлении.
При малом изменении состояния системы ее свободная энергия слегка меняется:
F ® F + dF = F + (dE - TdS - SdT) или G ® G + dG = G + (dH - TdS - SdT)
Это значит, в частности, что все возможные перестройки системы в окрестности ее стабильного состояния (а они могут изменять и энергию системы, и ее энтропию) подчиняются следующим уравнениям, характеризующим минимум функции (точка минимума функции обладает тем свойством, что небольшое отклонение от нее практически не меняет функцию):
1) при V=const стабильному состоянию (при заданном Т) соответствует минимум F, т.е.
dF |V=const = dE |V=const - T dS |V=const = 0
[dT=0 при T=const, т.е. SdT=0];
2) при P=const, когда стабильному состоянию (при заданном Т) соответствует минимум G,
dG |P=const = dH |P=const - T dS |P=const = 0.
Из этих уравнений следует термодинамическое определение температуры:
T = (dE/dS) |V=const = (dH/dS) |P=const
Сейчас это определение получено довольно формально, и его физический смысл не очевиден. Остановимся теперь на химическом потенциале - величине, определяющей термодинамические характеристики не системы в целом, а одной молекулы в этой системе.
Если добавлять в систему молекулу за молекулой при постоянном давлении, то на добавление каждой новой частицы надо затратить в точности ту же работу, что на добавление любой предыдущей: объем системы будет расти, а плотность системы и интенсивность взаимодействий в ней меняться не будет. Поэтому термодинамическое состояние молекулы в системе удобно определять величиной свободной энергии Гиббса G, деленной на число молекул N,
m = G/N
называемой химическим потенциалом (а так как в жидкой или твердой фазе и невысоких давлениях F » G, то здесь m»F/N). Если N означает не число молекул, а, как обычно, число молей молекул, то и m относится не к одной молекуле, а к молю молекул.
Химический потенциал, или, что то же самое, свободная энергия Гиббса в расчете на одну молекулу — пригодится, когда речь пойдет о распределении молекул между фазами. Дело в том, что молекулы перетекают из той фазы, где их химический потенциал выше, в ту, где их химический потенциал ниже, это понижает общую свободную энергию системы и приближает ее к равновесию. А в равновесии химический потенциал молекул в одной фазе равен химическому потенциалу тех же молекул в другой фазе.
Для будущего нам еще понадобится две формулы. Во-первых, определение теплоемкости, показывающей рост энергии системы с температурой:
CР= dН/dT |P=const
\это при постоянном давлении; можно считать теплоемкость и при постоянном объеме.
Во-вторых, связь энтропии сo свободной энергией:
S = — dG/dT |P=const= — dF/dT |V=const
Это важнейшие формулы термодинамики. Они прямо следует из того, что малое приращение свободной энергии dG = d(H-TS) = dH-TdS-SdT (и dF = d(E-TS) = dE-TdS-SdT), в то время как в равновесии системы dH-TdS=0 (и dЕ-TdS=0) в силу термодинамического определения температуры: T = dH/dS = dE/dS.
Формулы показывают, что свободная энергия достигает своего минимального (или максимального) значения при той температуре T, когда S(T)=0. Полезно знать также, что величина G/RT достигает своего минимального (или максимального) значения, когда H(T)=0, так как
d(G/RT)/dT = (dG/dT)/RT — G/RT2 = -S/RT — (H-TS)/RT2 = -H/RT2.
Основные моменты лекций 1-2.
- Молекулярная биофизика – часть биологической физики, основными объектами изучения которой являются биологические полимеры – белки и нуклеиновые кислоты, а также их компоненты. Предмет физики биополимеров - физические свойства биомакромолекул и их связь с функциональной активностью.
- Специфика полимерных молекул: в их состав входит огромное число мономеров. Таким образом, своеобразие биомакромолекулы как физического объекта состоит в тесном сочетании статистических и детерминистских (механических) особенностей ее поведения.
- Связь молекулярной физики и молекулярной биофизики. Молекулярная физика дает информацию о строении вещества и о природе физических и физико-химических процессов в веществе исходя из его строения.
Отсюда три основных задачи молекулярной физики: а) определение строения в широком смысле этого слова; б) исследование равновесных систем, т.е. нахождение термодинамических условий равновесия и их статистическом объяснении на основе молекулярных представлений; в) рассмотрение динамических и кинетических свойств исследуемых систем. Задачи молекулярной биофизики: а) Структура биополимеров, общие принципы и уровни структурной организации; б) Стабильность структуры, энергетический вклад различных взаимодействий, тепловые переходы; в) Природа конформационной подвижности и динамика биополимеров.
Понятие системы, энергии, работы. Первый закон термодинамики в общей формулировке: Согласно первому закону, количество теплоты dQ, поглощенное системой из внешней среды, идет на увеличение ее внутренней энергии dU и совершение общей работы dA, которая включает работу против сил внешнего давления P по изменению объема dV системы и максимальную полезную работу dAmax, сопровождающую химические превращения:
dQ = dU + dA, где работа dА = pdV +dAmax или dQ = dU + pdV +dAmax .
Следствие первого закона термодинамики - закон Гесса.
Общая формулировка второго закона термодинамики: Любой самопроизвольный процесс в изолированной системе приводит к уменьшению свободной энергии, если процесс необратим (неравновесен); если роцесс обратим (равновесен), то свободная энергия системы постоянна и минимальна.
Второй закон термодинамики для живых систем: скорость изменения энтропии в организме равна алгебраической сумме скоростей производства энтропии внутри организма и скорости поступления отрицательной энтропии из среды в организм.
dS/dt = dSi/dt + dSe/dt -
математическая запись второго закона термодинамики для живых систем.
Особенностью биосистем является то, что они не просто открытые системы, но системы, находящиеся в стационарном состоянии. При стационарном состоянии приток и отток энтропии происходят с постоянной скоростью, поэтому общая энтропия системы не меняется во времени (dS/dt= 0). Благодаря стационарному состоянию за счет непрерывного обмена энергией с внешней средой биосистемы не только находятся на удалении от термодинамического равновесия (низший возможный энергетический уровень, на котором энтропия системы максимальна) и сохраняют свою работоспособность, но и поддерживают во времени постоянство своих параметров.
Причина устойчивости стационарных состояний была определена Пригожиным. Он доказал, что в стационарном состоянии биосистемы обладают очень интересным свойством. Если система не очень удалена от состояния термодинамического равновесия, член diS/dt в уравнении 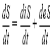 при стационарном состоянии сохраняет свое положительное значение, но стремится к минимуму, то есть
при стационарном состоянии сохраняет свое положительное значение, но стремится к минимуму, то есть 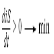 Это математическая запись теоремы Пригожина, которая формулируется так: В стационарном состоянии скорость возрастания энтропии, обусловленного протеканием необратимых процессов, имеет положительное и минимальное из возможных значение.
Это математическая запись теоремы Пригожина, которая формулируется так: В стационарном состоянии скорость возрастания энтропии, обусловленного протеканием необратимых процессов, имеет положительное и минимальное из возможных значение.
Основные проблемы молекулярной биофизики. Физика биополимеров как раздел молекулярной биофизики и ее задачи. Первый закон термодинамики