Кинетика химических и биохимических процессов
Лекция 2.Кинетика химических и биохимических процессов.
На прошлой лекции вы познакомились с основами химической термодинамики, научились термодинамическим расчетам, а самое главное определять принципиальную возможность химических превращений веществ по изменению энергии Гиббса.
Однако, термодинамика, определяя направленность химических и биохимических процессов, не рассматривает их протекание во времени, а также механизм этих процессов.
Например:
образование молекулы воды из водорода и кислорода протекает самопроизвольно, т.к. Gor < 0, но чтобы при 25С прореагировал 1% водорода потребуется 3 млрд. лет.
Вопросы скоростей химических реакций и механизмы их протекания решает химическая кинетика
Химическая кинетика – это раздел химии, который изучает скорость химических реакций и зависимость её от различных факторов, а также механизмы протекания химических процессов.
В живых системах химические процессы совершаются с различными скоростями, причем сбалансированность скоростей биохимических реакций обеспечивает стационарное состояние организма. Изменение скорости какой-либо реакции может быть либо причиной развития патологии, либо лежать в основе защитной функции организма. Поэтому корректировка биохимических процессов связана с регуляцией скоростей их протекания. Так, физиотерапевтические методы основаны на изменении условий протекания процессов (локальное повышение температуры), фармакотерапевтические – введение веществ, влияющих на скорость реакций.
К основным понятиям химической кинетики относятся механизм и скорость химической реакции.
Механизм реакции – это последовательность и характер стадий данного химического процесса.
В зависимости от механизма реакции могут быть:
- простые – протекают в одну стадию (пример: ионные реакции);
- сложные – протекают в несколько стадий (пример: образование воды из кислорода и водорода).
В химической кинетике существует несколько классификаций химических реакций, подготовить их надо по учебнику В.И. Слесарев. «Химия. Основы химии живого» стр.97-100.
Под скоростью химической реакции следует понимать число элементарных актов химического взаимодействия за единицу времени в единице реакционного пространства (Р.П.).
Для гомогенных реакций скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени.
Скорость реакции величина положительная.
При определении скорости реакции по продуктам c > 0, т.к. концентрация продукта в результате протекания реакции возрастает. Следовательно,
При определении скорости реакции по исходным веществам c < 0, т.к. концентрация исходных веществ в результате протекания реакции убывает.
Единицы измерения:
Скорость химической реакции не является величиной постоянной в течение всего времени ее протекания, поэтому различают среднюю и истинную скорости.
Средняя скорость химической реакции рассчитывается как усредненная скорость для определенного промежутка времени.
Истинная скорость химической реакции соответствует скорости реакции в данный момент времени и рассчитывается как предел, к которому стремится средняя скорость при условии 0
ист =
Факторы, влияющие на скорость химических реакций:
- Природа реагирующих веществ.
- Концентрация реагентов.
- Температура.
- Катализаторы.
- Под природой реагентов понимают совокупность физических и химических свойств, обусловленных строением атомов и молекул, типом химических связей и т.д.
2. Влияние концентрации. Кинетическое уравнение. Константа скорости. Порядок реакции.
При увеличении концентрации реагирующих веществ скорость химической реакции увеличивается, т.к. возрастает число частиц и, следовательно, вероятность их столкновения.
Зависимость скорости от концентрации выражает закон действия масс (Гульдберг, Вааге):
Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степень, равную их стехиометрическим коэффициентам.
Пример:
a A + b B = d D + f F (1)
= k Ca(A) Cb(B) (2) – кинетическое уравнение
где а и b – стехиометрические коэффициенты в уравнении реакции
С(А) и С(В) – молярные концентрации исходных веществ, [моль/л]
k – коэффициент пропорциональности, называемый константой скорости реакции
Физический смысл k – если С(А) = С(В) = 1 моль/л, то k = , т.е. константа скорости численно равна скорости, с которой реагируют вещества при их концентрациях (или произведении концентраций), равной единице. k определяется природой реагирующих веществ и зависит от температуры и присутствия катализатора, но не зависит от концентрации
Уравнение (2), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции для простой реакции. Кинетическое уравнение сложной реакции определяют экспериментально, т.к. его нельзя предсказать по виду химического уравнения реакции.
Основной закон кинетики не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. их концентрации постоянны, и они реагируют лишь на поверхности, которая остается неизменной. В кинетическое уравнение входят только концентрации исходных веществ в газообразной или жидкой фазах.
Пример: С(т) + О2(г) = СО2(г)
Кинетическое уравнение: = k C(О2); т.е. скорость реакции пропорциональна только концентрации кислорода.
Ни истинная, ни средняя скорости не используются в качестве кинетических характеристик реакции, т.к. первая – это величина, изменяемая во времени; вторая – величина приближенная. Такой характеристикой является константа скорости реакции.
Для сложных реакций кинетическое уравнение имеет следующий вид
a A + b B = d D + f F (1)
= k Cna(A) Cnb(B) (2) – кинетическое уравнение
где na и nb – порядок по реагентам А и В.
Порядок реакции показывает, каким образом скорость реакции зависит от концентрации. Порядок реакции по реагенту не зависит от стехиометрических коэффициентов в уравнении реакции, а определяется ее механизмом и только экспериментально.
Порядок реакции определяется как степень, в которую надо возвести концентрацию данного реагента в кинетическом уравнении, чтобы вычисленная по этому уравнению скорость была равна скорости, найденной экспериментально.
- Полный или суммарный порядок реакции определяется суммой показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении.
- Частный порядок реакции по данному компоненту соответствует показателю степени при концентрации данного компонента в кинетическом уравнении.
Пример: a A + b B = d D + f F = k Cna(A) Cnb(B) где
na и nb – частные порядки реакции по реагентам А и В
na + nb – суммарный порядок
Если порядок реакции равен стехиометрическим коэффициентам, то это указывает, что реакция простая, т.е. одностадийная.
В сложных реакциях порядок может принимать значения 0, 1, 2, 3 и быть дробным.
Реакции нулевого порядка – это реакции, в которых скорость не зависит от концентрации реагирующих веществ. Таких реакций мало, к ним можно отнести гетерогенные реакции или реакции, в которых концентрация поддерживается автоматически, например, в насыщенных растворах.
Кинетическое уравнение: = k
Реакции первого порядка – к ним относятся реакции изомеризации, разложения, радиоактивного распада, гидролиз и т.д.
Кинетическое уравнение: = k C
Реакции второго порядка – большинство бимолекулярных реакций.
Молекулярность реакции – минимальное число молекул (частиц), необходимое для осуществления элементарного акта реакции. Различают мономолекулярные, бимолекулярные реакции. Столкновение одновременно трех и более молекул для начала реакции маловероятно.
- Влияние температуры. Понятие о теории активных соударений. Энергия активации.
При увеличении температуры скорость большинства химических реакций возрастает. Математическая зависимость скорости химической реакции от температуры опытным путем установил Вант-Гофф.
Правило Вант-Гоффа:
При увеличении температуры на каждые 10К скорость химической реакции увеличивается в 2-4 раза.
Математическое выражение правила Вант-Гоффа:
Т2 = Т1 , где
Т2 и Т1– скорости реакции соответственно при начальной Т1 и конечной Т2 температурах
– температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 К.
Для обычных реакций имеет значения от 2 до 4, в биохимических реакциях – от 1,5 до 3 и может доходить до 7 или 10, правда, интервал температур при этом составляет 10С – 45С.
Аналогично выражается зависимость константы скорости реакции от температуры
kТ2 = kТ1
Влияние температуры на скорость химических реакций можно объяснить двумя причинами:
- возрастает скорость движения молекул, а, следовательно, вероятность их столкновения;
- увеличивается число активных молекул.
Активными называются молекулы, которые обладают энергией активации.
Еа – энергия активации – это минимальная энергия, достаточная для осуществления акта химического взаимодействия.
Её определяют экспериментально, она изменяется в пределах от 5 до 500 кДж\моль.
Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры.
Еа характеризует энергетический барьер, который надо преодолеть частицам исходного вещества для образования продуктов. Поэтому чем выше значение энергии активации, тем труднее протекает реакция и скорость ее меньше.
Понятие о теории переходного состояния. Активированный комплекс.
Энергия активации всегда меньше энергии, которую надо затратить, чтобы разрушить связи в молекулах исходных веществ. Это объясняет теория переходного состояния.
На основании этой теории для протекания реакции необязательно полностью разрывать химические связи в исходных веществах, достаточно их ослабить. Это происходит при образовании промежуточного соединения – активированного комплекса.
Пример: Реакция синтеза йодистого водорода.
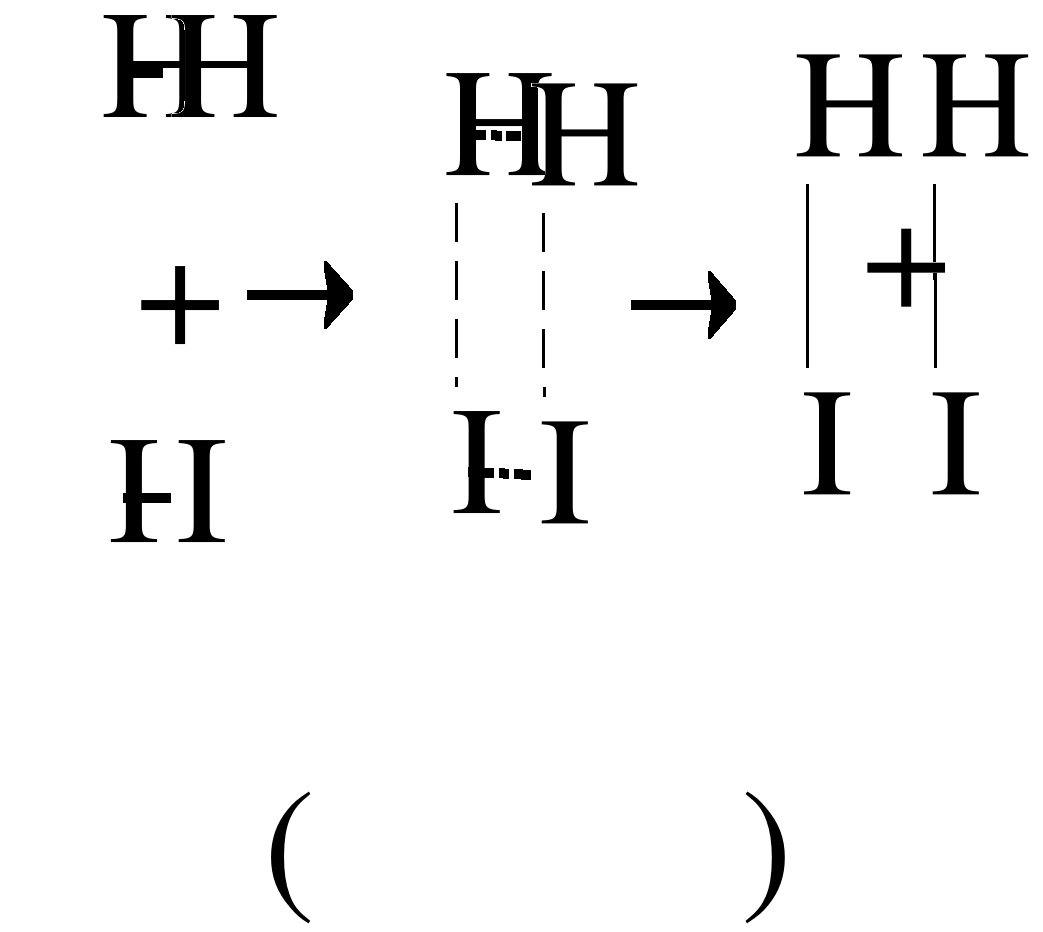
Активные молекулы Н2 и I2 объединяются в промежуточный активный комплекс Н2I2, в котором образование новых связей Н–I идёт одновременно с разрывом связей Н–Н и I–I.
Образование переходного состояния – процесс энергетически более выгодный, чем полное разрушение связей в молекулах исходных веществ. Вот почему образование активированных комплексов характерно для многих реакций, особенно ферментативных.
4. Катализ и катализаторы.
В.И.Слесарев. «Химия. Основы химии живого». стр. 106-107.
Ферментативный катализ и его особенности.
Все биохимические процессы протекают в присутствии катализаторов – ферментов.
Ферменты – это белковые молекулы, которые катализируют химические реакции в живых организмах.
Другое название ферментов – энзимы. В настоящее время известно около 2000 различных ферментов, около 150 ферментов удалось выделить в чистом виде.
Для веществ, участвующих в ферментативных реакциях приняты следующие названия:
- субстрат (S) – вещество, на которое фермент оказывает специфическое каталитическое действие;
- фермент (Е) – вещество, ускоряющее превращение субстрата;
- продукт (Р) – вещество, в которое превращается субстрат в результате ферментативного катализа.
Ферментативный катализ имеет свои особенности, отличающие его от обычного химического катализа:
- Высокая эффективность. Реакции, катализируемые ферментами, ускоряются в десятки тысяч раз. Объясняется это тем, что при действии фермента на субстрат образуется фермент-субстратный комплекс, энергия активации которого значительно ниже энергии активации некаталитической реакции.

- Высокая специфичность (избирательность). Каждый фермент катализирует только определенную биохимическую реакцию, т.е. действует только на определенный субстрат. Для объяснения такой высокой специфичности используется теория «ключ-замок» или «рука-перчатка». В.И. Слесарев «Химия. Основы химии живого», стр.117-118.
На активность ферментативного катализа влияют следующие факторы:
- концентрация фермента
- концентрация субстрата
- температура
- реакция среды (рН)
В.И.Слесарев «Химия. Основы химии живого», стр.116-119.
Химическое равновесие.
Химическое равновесие возникает в обратимых реакциях.
Обратимыми называются реакции, которые протекают в двух взаимно противоположных направлениях.
Например:
прям
Н2 + J2 2НJ
обр
Таких реакций большинство. Составим кинетические уравнения прямой и обратной реакций.
пр = k1·cH2·cJ2
обр = k2·c2HJ
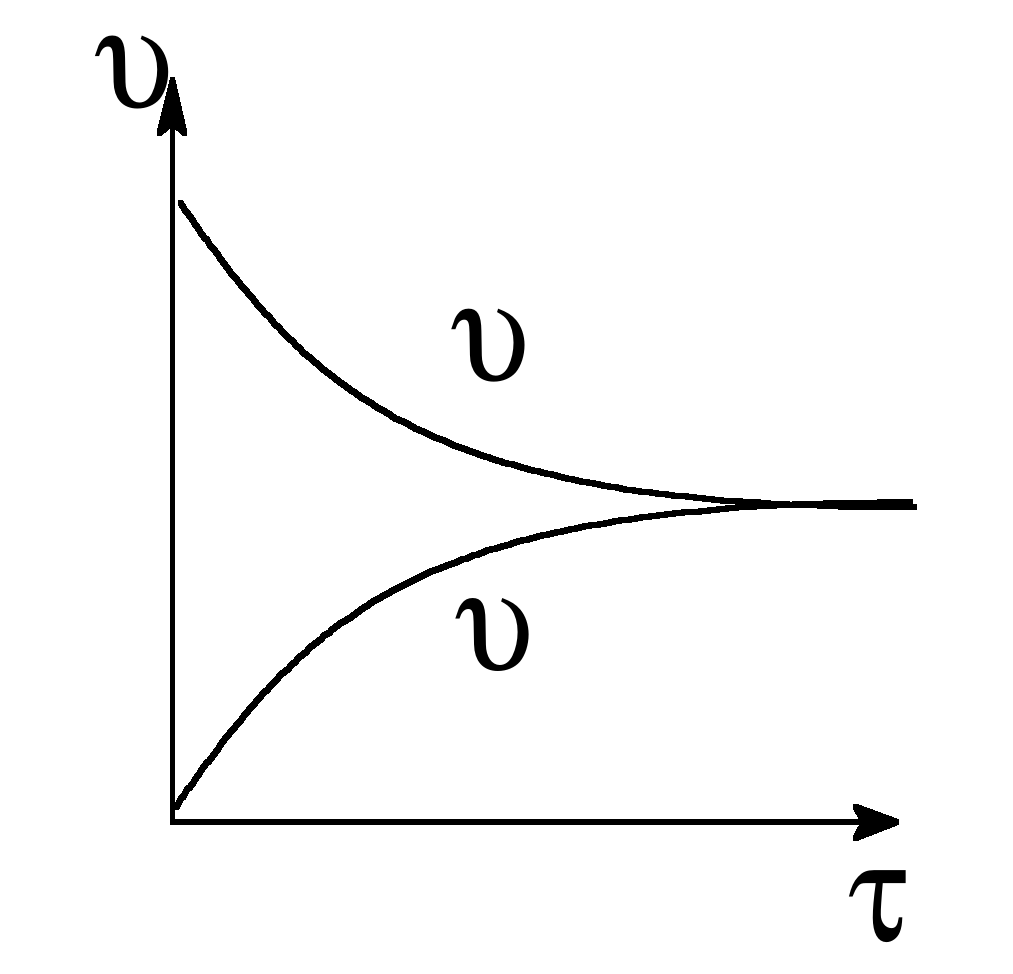
В обратимых реакциях скорость прямой и обратной реакций по-разному изменяются с течением времени. Так, в начальный момент времени скорость прямой максимальна, а скорость обратной реакции практически равна 0, т.к. продукты еще не образованы, а концентрация исходных веществ максимальна. С течением времени скорость прямой реакции будет убывать, а скорость обратной реакции увеличиваться пока не наступит их равенство.
Состояние системы, при котором скорость прямой реакции равна скорости обратной называется химическим равновесием .
пр = обр
В условиях равенства скоростей, концентрации исходных веществ и продуктов реакции не изменяются, остаются постоянными и являются равновесными.
Тогда, можно записать k1·cH2·cJ2 = k2·c2HJ
Для количественной характеристики состояния равновесия введен безразмерный параметр – константа равновесия. Она равна отношению констант скоростей прямой и обратной реакций.
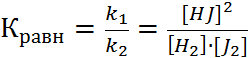
Константа химического равновесия обратимого процесса прямо пропорциональна произведению концентраций продуктов реакции и обратно пропорциональна произведению равновесных концентраций исходных веществ, возведенных в степень равную их стехиометрическим коэффициентам.
Кх.р. зависит от природы реагентов и температуры, но не зависит от концентраций и наличия катализатора.
Значение константы определяет преимущество протекания одной из противоположных реакций:
Если К > 1, то в системе выше содержание продуктов, т.е. преимущественно идет прямая реакция. Если К < 1, то в системе выше концентрация исходных веществ и преимущество имеет обратная реакция.
Между константой равновесия и энергией Гиббса существует математическая зависимость:
= – RT ln Kравн
– изменение энергии Гиббса
R – газовая постоянная
T – температура
Kравн – константа равновесия.
Химическое равновесие носит динамический характер и характеризуется постоянством при неизменности внешних условий.
При изменении концентрации реагентов, температуры и давления скорость одной из реакций может увеличиться, тогда происходит смещение равновесия:
- если возрастает скорость прямой реакции, то равновесие смещается вправо;
- если увеличится скорость обратной реакции, то равновесие смещается влево.
Смещение равновесия определяется принципом Ле-Шателье:
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие.
При увеличении концентрации исходных веществ равновесие смещается вправо, а при увеличении концентрации продуктов реакции – влево.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
- Влияние давления (только для газов и при условии, что количество моль газов исходных веществ и продуктов не равны).
При увеличении давления равновесие смещается в сторону реакции, которая протекает с уменьшением числа моль газов, а при уменьшении давления – в сторону увеличения числа моль газов.
Кинетика химических и биохимических процессов