СИНТЕЗ И ИССЛЕДОВАНИЕ КООРДИНАЦИОНЫХ СОЕДИНЕНИЙ КАРБОКСИЛАТОВ МЕДИ И ЦИНКА
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра общей, неорганической химии и информационно-вычислительных технологий в химии
Допустить к защите в ГАК
Заведующий кафедрой
д-р хим. наук, профессор
__________ Н.Н. Буков
(подпись)
_________________2014г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ
РАБОТА БАКАЛАВРА
СИНТЕЗ И ИССЛЕДОВАНИЕ КООРДИНАЦИОНЫХ СОЕДИНЕНИЙ КАРБОКСИЛАТОВ МЕДИ И ЦИНКА
Работу выполнил __________________________________ И.Н. Кравцов
(подпись, дата)
Факультет химии и высоких технологий, ОФО
Специальность «Химия» - 020100.62
Научный руководитель
канд. хим. наук,
доц._______________________________________________ В.И. Зеленов
(подпись, дата)
Нормоконтролер
канд. хим. наук,
доц._______________________________________________ __________________ ________ Ф.А.Колоколов
(подпись, дата)
Краснодар 2014
СОДЕРЖАНИЕ
Введение...................................................................................................................3
1 Литературный обзор.............................................................................................5
- Медь. Свойства и координационные соединения меди.......................5
- Электронное строение и свойства...........................................5
- Координационные соединения меди (II)................................6
- Цинк. Свойства и координационные соединения цинка...................13
- Электронное строение и свойства.........................................13
- Координационные сединения цинка.....................................13
- Аминокислоты. Их свойства и применение.......................................14
- Физические свойства аминокислот.......................................16
- Химические свойства аминокислот......................................17
- Применение аминокислот......................................................18
- Комплексные сединения аминокислот................................................19
- Электрохимический синтез комплексных соединений. Перспективы его применения..............................................................25
- Электронное строение и свойства...........................................5
- Экспериментальная часть...............................................................................31
- Оборудование и реактивы....................................................................31
- Оборудование..........................................................................31
- Реактивы...................................................................................31
- Получение комплексных соединений меди (II) и цинка(II) с аланином методом электрохимического синтеза...............................32
- Оборудование и реактивы....................................................................31
Список литературы................................................................................................33
ВВЕДЕНИЕ
Координационные соединения биометаллов широко распространены в живой природе. Они входят в состав ферментов, гормонов, витаминов и других жизненно важных соединений. Экспериментально доказано, что координационные соединения микроэлементов необходимы для многих важных биологических процессов; их недостаток замедляет эти процессы или останавливает их. Для белкового, углеводного и жирового обмена необходимы соединения молибдена, железа, ванадия, кобальта, вольфрама, бора, марганца, цинка. В синтезе белка участвуют соединения магния, марганца, железа, кобальта, меди, никеля, хрома. В кроветворении — соединения кобальта, меди, марганца, никеля, цинка. В дыхании — железа, меди, цинка, марганца, кобальта, магния.
Поэтому координационные соединения этих элементов в последнее время широко исследуются и находят применение в качестве микроудобрений нового поколения для полевых культур, в виде подкормок в животноводстве, птицеводстве, рыбоводстве. Недостаток (или избыток) соединений микроэлементов приводит к нарушению ряда биохимических функций и заболеваниям животных. Например, при недостатке меди в организме овец и крупного рогатого скота возникает эндемическая анемия; при недостатке йода нарушается функция щитовидной железы, а при избытке селена происходит деформация копыт, облысение овец. Чтобы устранить эти нежелательные явления прибегают к применению специальных подкормок для животных. Особенно важны они в геохимических провинциях с недостатком микроэлементов в почвах и кормах животных. К ним, в частности, относится территория Татарстана и Удмуртии.
Лекарственные препараты на основе комплексных соединений биометаллов используются в медицине в качестве антиаритмический средств.
Поэтому модификация существующих методов синтеза комплексных соединений и разработка новых синтетических методик является практически важной задачей, а метод электрохимического синтеза один из эффективных способов ее решения.
1.ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Медь. Свойства и координационные соединения меди
1.1.1 Электронное строение и свойства
Медь (Cuprum), Cu – химический элемент побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Порядковый номер – 29, атомная масса 63,54. Распределение электронов в атоме меди – 1s22s22p63s23p63d104s1.
Природная медь состоит из смеси двух стабильных изотопов с массовыми числами 63 (69,1 %) и 65 (30,9 %).
В химическом отношении меди занимает промежуточное положение между элементами VIII группы и щелочными элементами I группы. Заполненная d-оболочка меди менее эффективно экранирует s-электрон от ядра, чем оболочка инертного газа, поэтому первый потенциал ионизации меди выше, чем у щелочных металлов. Так как в образовании металлической связи принимают участие и электроны, принимающие участие и электроны d-оболочки, теплота испарения и температура плавления меди значительно выше, чем у щелочных металлов. Второй и третий потенциалы меньше, чем у щелочных металлов, что в значительной степени объясняет проявление свойств меди как переходного элемента, который в степени окисления II и III проявляет парамагнитные свойства окрашенных ионов и комплексов. Медь(I) также образует многочисленные соединения по типу комплексов переходных металлов [1].
Медь – электроположительный металл. Она вытесняется их своих солей более электроотрицательными элементами и не растворяется в кислотах, не являющихся окислителями. При температуре ниже 185oС с сухим кислородом и воздухом не реагирует, горит в парах серы. С водородом, азотом, углеродом не реагирует даже при высоких температурах [2].
1.1.2 Координационные соединения Cu(II)
Медь в двух- и одновалентных состояниях образует многочисленные комплексы, обладающие значительной устойчивостью. К настоящему времени в литературе существует большое количество экспериментальных данных по комплексообразованию меди.
Медь образует окрашенные комплексные соединения с большим количеством органических соединений различных классов, которые используют в аналитических целях. Сравнительное изучение их применимости для фотометрического определения меди проведено в работах Иванчева Г.[3], Марченко З.[4], Мустафина И.С.[5].
Наиболее применяемым и доступным реагентом является диэтилдитиокарбамат натрия. В монографии Бырько В.М. описывается, что данный реагент в присутствии комплексообразователей достаточно селективен и чувствителен. Гораздо большей избирательностью обладает диэтилкарбаматы кадмия, свинца и цинка. Специфичным реагентом на медь(I) является дисульфид меркаптохинолина. Наиболее чувствительным (но не селективным) является дитизон. В отличие от других реагентов его можно применять в кислых растворах. Производные 1,10-фенантролина менее чувствительны, чем ДДТК-Na. Определению меди с использованием этих реагентов мешают аниона-комплексообразователи. 2,2'-Дихинолин и его производные практически могут быть применены для анализа любых объектов [6].
Для анализа объектов, содержащих большие количества меди, часто используют различные комплексоны и амины.
Высокой чувствительностью обладают арилзамещенные карбазиды и карбазоны. Ароматические альдоксимы и кетоксимы, образующие с медью окрашенные комплексы, с еще большей чувствительностью реагируют с никелем, кобальтом и железом.
Изучению комплексообразования меди (II) с биологически активными лигандами посвящено значительное количество работ. Анализируя имеющийся материал, можно сказать, что основная часть этих исследований относится к изучению комплексообразования в растворах. Большинство органических лигандов, являющихся аналогами природных соединений, способных взаимодействовать с ионами меди, содержат в своем составе кислород- и (или) азот- содержащие группы, за счет которых и возможна координация. При этом координация может осуществляться различными способами, что связано как со строением молекулы лиганда (взаимным расположением донорных групп), так и с условиями протекания реакции комплексообразования.
При исследовании комплексных соединений меди наибольший интерес уделяется определению структуры и состава полученных продуктов.
В работе [4] описан синтез трех новых тройных смешаннолигандных комплексов меди (II) с 1,10-фенантролином (Phen) и L–-аминокислотой [L-валином (L-val), L-аланином (L-ala) и L-аргинином (L-arg)] : [Cu(Phen)(L-val)] · CLO4 · H2O, [Cu(Phen)(L-ala)] · CLO4 · 0,5H2O и [Cu(Phen)(L-arg)] · 2CLO4 · 0,5H2O. Полученные комплексы исследованы методами элементного анализа, ИКС, абсорбционной спектроскопии в видимой и УФ-области и измерениями молярной электропроводности. Установлено, что в комплексах Phen связан с медью (II) посредством атомов азота, а L–аминокислота как бидентатный лиганд координационно связана с центральным ионом меди посредством азота аминокислоты и карбоксилатного атома кислорода.
В работе [5] авторами были изучены d-d-переходы в комплексных соединения Cu (2+) c дигидробензоксазинами в растворе хлороформа; методом модели углового перекрывания (МУП) определена энергия взаимодействия Cu (2+) – донорный атом лиганда. Анализ значений параметров МУП, рассчитанных по электронным спектрам d-d-переходов, позволил определить устойчивость координационных связей меди(2+) с О- и N-донорными атомами лиганда. Методом ИК-, ЭПР-спектроскопии и РТСА определена димерная структура комплексов в твердом состоянии, что подтверждено также измерениями магнитной восприимчивости и квантово-химическими расчетами.
Авторами работы [6] описан синтез комплексов меди(2+) состава {[Cu(pz)(COO)2)(H2O)]4·HBr}n,{[Cu(pz)(COO)2)(NH3)2]2·H2O}n, {[Cu3H2(pz(COO)2)4(H2O)3]·2H2O}n и {[Cu2(pz(COO)2)2(NH3)2(H2O)3] [Cu(pz(COO)2(NH3)(H2O)2][Cu(pz(COO)2(NH3)(H2O)]·2H2O}n, где pz=пиразин. Определены их спектры, выполнены термический и элементный анализы, измерена магнитная восприимчивость. Отмечено образование полимерных цепей в их структуре.
В [7] работе синтезированы и охарактеризованы методами УФ/видимой спектроскопии, элементного анализа и ЭПР спектроскопии два полиядерных комплекса меди(2+) с тридентатными лигандами метил 2-(2-(2,2'-бипиридин-6-ил)-5-метилтиазол-4-илокси)ацетатом и метил 2-(5-метил-2-(1,10-фенантралин-2-ил)тиазол-4-илокси)ацетатом.Исследованы структуры и строение полученных соединений.
Нестеровой Е.Ю. и соавторами в публикации [8] методами ИК-, электронной спектроскопии, ДТА, РСТА исследованы координационные соединения дигидразида 2,6-диметил-3,4-пиридиндикарбоновой кислоты (ДГ) с нитратами и сульфатами меди(2+) и кобальта(2+). Установлено образование полиядерных соединений состава {[М(ДГ)(ROH)n]Anm}zгде М=Cu2+, Co2+, An=SO2-4, NO-3, R=H, изо-Pr; n=0,5-4, m=1,2, z4, содержащих в качестве мостиковых лигандов бидентатно координированные молекулы ДГ, хелатирующие металл атомом кислорода карбонильной группы и атомом азота аминогруппы гидразидного фрагмента.
В работе [9] были синтезированы новые комплексы [Cu(phen)(oba)2]·(DMF)2·(H2O)(I), {[Cu(2,2-bipy)2(Hoba)][Cu(2,2-bipy)2(oba)2]·(нитрат)·(Н2O)13} (II) и [Cd(oba)(ptca)]·(DMA)2 (III) (H2oba=4,4'-оксидибензойная кислота, H2ptca=терефталевая кислота, 2,2-bipy=2,2'-дипиридинамин, ДМА=диметиламин; phen=1,10-фенантролин) и охарактеризованы методами элементного анализа, ИК-спектроскопии и рентгеновской кристаллической дифракции. Определены структуры I-III и исследованы их флуоресцентные свойства.
Целью авторов [10] работы был синтез ряда комплексов Cu(2+) с 2- и 4-фторбензойными кислотами (HR1 и HR2, соответственно), содержащих 1,10-фенантролин (phen) или 2,9'-бипиридин (bipy). Комплексы были охарактеризованы методами РСТА, ИК спектроскопии и термического анализа. Определены и описаны структуры и особенности строений [Cu(bipy)(H2O)(R1)2], [Cu(bipy)(H2O)(R2)2], [Cu(phen)(H2O)(R1)2] и [Cu(phen)(R1)2].
В ходе работы [11] была синтезирована новая лигандная система – N,N'-бис(3-формил-5-трет-бутилсалицилиден) 1,3-диаминопропанол-2 (H3L) и биядерные комплексы меди(2+) и никеля(2+) на его основе состава [M2L(Y)]. Соединения исследованы методами ИК и ПМР спектроскопии, ТГ/ДТА, магнетохимии и РСТА. Наличие в молекуле изометина двух свободных формильных групп позволяет не только получать биядерные комплексы с несимметричным обменным фрагментом, но и образовывать с различными аминами и гидразинами лигандные системы, способные хелатировать еще два иона металла. Это открывает путь для получения как гомо-, так и гетерометаллических комплексов, содержащих четыре обменно-связынных парамагнитных центра.
Методом переменнотокового электрохимического синтеза исходя из CuCL2·2H2O и хлорида N,N'-диаллилбезимидазолия в спиртовой среде авторами работы [12] были получены кристаллы соединения состава [С13H15N2]+2[Cu''CL4]2- (I) которые в процессе эксперимента превращаются в кристаллы -комплекса состава [C13H15N2]+[Cu2'CL3]- (II).
В исследовании [13] в процессе работы разработаны методики получения различных N-донорных лигандов с пиразольным фрагментом: 2,6-бис(пиразолил)пиридинов, l-тиенилпиразолов, 3-тиенилпиразолов. Для синтезированных лигандов изучены равновесия в растворе с солями меди и никеля, охарактеризованы образующиеся соединения. Показано, что состав комплексов с бис(пиразолил)пиридинами зависит от наличия объемных заместителей в пиразольном кольце: в случае их отсутствия состав Me:L=1:2, при их наличии – 1:1. Обнаружен гидролиз 3,6-бис(пиразолил)-1,2,4,5-тетразина водой в присутствии меди, предложен механизм гидролиза, при этом для никеля гидролиз не протекает. Полученные комплексы исследованы методами ЭПР, электронной спектроскопии, масс-спектрометрии.
А.Н. Чехловым в работе [14] получено комплексное соединение гидрат(сольвата) триаква[0,25(бромо)1,75(нитрато-о)]медь(II)18-краун-6, [СuBr0.25(NO3)1.75(H2O)3]·18-краун-6·5H2O, и методом РСА изучена его кристаллическая структура.
В работе [15] методами рН-потенциометрии, спектро- и фотометрии в сульфатной, нитратной и хлоридной средах установлено образование однолигандного и смешанолигандных комплексов (СЛК) в системах: медь(II)-аскорбиновая кислота (H2Asc), медь(II)-аскорбиновая кислота-фенантролин (Phen), медь(II)-аскорбиновая кислота-никотиновая кислота (HNic) и медь(II)-никотиновая-фенантролин; определены состав и устойчивость однолигандного комплекса [CuHAsc]+, смешанолигандных комплексов [CuHAscNic], [CuHAscPhen2]+, [CuNicPhen2]+ в водных растворах с ионной силой I = 0.1 или 0.2 в интервале рН 2.6-4.0; найдены эффективные константы скорости окислительно-восстановительного распада комплексов [CuHAsc]+, [CuHAscPhen2]+, [CuHAscNic] в сульфатной среде. Смеша-нолигандные комплексы характеризуются большей устойчивостью, чем однолигандные аскорбат-ный и никотинатный комплексы, что объясняется взаимным влиянием лигандов. При длительном растворении никотината медь(II) в спиртовом растворе фенантролина выделено соединение состава [CuPhen2]Nic2.
Работа [16] заключалась в синтезе и исследовании биядерных комплексов меди(II) с ацилдигидразонами предельных дикарбоновых кислот и пировиноградной кислоты, в которых координационные полиэдры соединены полиметиленовыми цепочками разной длины (от 1 до 5 звеньев). Комплексы изучены методами химического и термогравиметрического анализа, ИК-спектроскопии и ЭПР. Строение биядерного комплекса меди(II) с ацилдигидразоном янтарной кислоты состава [Cu2L · 4Py] · 2Py установлено по данным рентгеноструктурного анализа.
Авторами публикации [17] была синтезирована серия новых комплексных соединений на основе нитрата и перхлората меди(II) с ацилгидразонами замещенных производных салицилового альдегида, содержащими объемные mpem-бутильные заместители. Показано, что строение и свойства выделенных комплексов определяются как структурными особенностями лигандных систем, так и природой ацидолигандов. Методом РСА определено строение металлхелата на основе продукта взаимодействия нитрата меди с ли-гандной системой, полученной из гидразида гексановой кислоты.
В работе [18] были синтезированы и исследованы биядерные комплексы меди(II) с ацилдигидразонами 1,3- или 1,4-бензолдикарбоновой кислоты и 5-метил- или 5-бром-2-гидроксиацетофенона, в которых координационные полиэдры соединены ароматическим мостиком. Строение комплекса меди(II) с диацил-гидразоном изофталевой кислоты и 2-гидрокси-5-метилацетофенона (H4L) состава [Cu2L · 3Py] изучено методом рентгеноструктурного анализа. Координационные сферы катионов меди образованы донорными атомами (2N + O) дважды депротонированного ацилгидразонного фрагмента и атомом азота молекулы пиридина. Один катион меди дополнительно координирует еще одну молекулу пиридина, атом азота которой достраивает координационный полиэдр до тетрагональной пирамиды. Второй атом меди участвует в дополнительном взаимодействии с феноксильным атомом кислорода соседней молекулы. В спектрах ЭПР растворов исследуемых биядерных комплексов наблюдается изотропный сигнал из четырех линий СТС, характерный для моноядерных комплексов меди(II).
Однако, существуют публикации, в которых главной задачей является изучение теромодинамических характеристик процесса комплексообразования.
Так в работе [19] Орловой Т.Д. в калориметре с изотермической оболочкой измерены тепловые эффекты комплексообразования ионов меди (2+) с малоновой, малеиновой и янтарной кислотами при 298,15 К и нескольких значениях ионной силы на фоне NaNO3. Рассчитаны стандартные термодинамические характеристики реакций комплексообразования в водном растворе.
В работе [20] синтезирован гептадентатный лиганд трис(L)-аланил-2-карбоксамидоэтил]амин (H3tr) в виде его тетрагидрохлоридной соли. Потенциометрическим методом определены константы протонирования H3tr и константы устойчивости хелатов меди(2+) и никеля(2+). Установлено образование в растворах моноядерных форм [Cu(H5tr)]4+, [M(H4tr)]3+, [M(H3tr)]2+, [M(H2tr)]+ и [M(Htr)] (M=Cu2+, Ni2+), а также диядерных форм [Cu2(H2tr)]2+, [Cu2(Htr)]2+, [Cu2(tr)]+ и [Cu2(tr)(OH)].
В публикации Т.Н. Кропачевой представлены результаты исследования электрохимического восстановления 1,2-дигидрокси-9,10-антрахинона (ализарина) в среде диметилсульфоксида на платиновом электроде методом циклической вольтамперометрии. Установлено, что восстановление ализарина протекает как ступенчатый двухэлектродный процесс, определены его характеристики. Показано, что образование комплексов состава 1:1 с катионами меди (2+) оказывает влияние на потенциалы и обратимость восстановления ализарина. Ионы меди (2+), связанные в комплекс, проявляют электрохимическую активность, что делает эту систему перспективной для разработки новых инверсионных вольтамперометрических методов определения меди [21].
1.2 Цинк. Свойства и координационные соединения
1.2.1 Электронное строение и свойства
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с порядковым номером 30 и атомным весом 65,38 а.е.м. Электронная конфигурация атома цинка – 1s22s22p63s23p63d104s2.
Природный цинк состоит из трех стабильных изотопов 64Zn (48,6%), 66Zn (26,9%) и 67Zn (4,1%). Известно несколько радиоактивных изотопов, важнейший из них – 65Zn с периодом полураспада 244 сут. Степень окисления +2.
Цинк – типичный пример металла, образующего амфотерные соединения, например оксид ZnO и гидроксид Zn(OH)2. Стандартный электродный потенциал равен – 0, 76 В, что располагает его в ряду стандартных электродных потенциалов до железа.
На воздухе цинк покрывается оксидной пленкой, реагирует как с кислотами, так и с щелочами. Так же цинк реагирует при нагревании с галогенами и халькогенами. В воде ион цинка образует аквакомплексы состава [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
1.2.2 Координационные соединения цинка
Цинк образует комплексы, схожие с теми, что образует медь, но с меньшими константами устойчивости, вследствие чего его комплексы описаны меньшим количеством научных работ. Но координационные соединения цинка представляют не меньший интерес вследствие большой биологической активности их, например в работе [22] цинк-органические комплексы расссматриваются как катализаторы полимеризации и олигомеризации изоцианатов, олефинов, альдегидов и лактонов. Карбоксилатные комплексы цинка с лантаноидам проявляют люминисцентные сввойства, позволяющие применять их в качестве материалов для лазеров, компонентов тонких люминесцирующих пленок, оптических усилителей, сенсоров, излучающих слоев электролюминесцентных устройств [23]. Цинк в данном случае используется для увеличения эффективности поглощения энергии возбуждения, так как поглощение ионов лантаноидов обычно малоинтенсивное. Так же существует ряд работ в которых комплексы цинка с аминокислотами используются в качестве пищевых добавок при кормежке птицы и скота и вызывают прирост массы.
1.3 Аминокислоты. Их свойства и применение
Аминокислоты — это органические (карбоновые) кислоты, содержащие одну или более аминогрупп; являются основными структур ными единицами молекул белков.
Глутаминовая кислота (-аминоглутаровая кислота) – важнейшая заменимая аминокислота. Структурная формула:
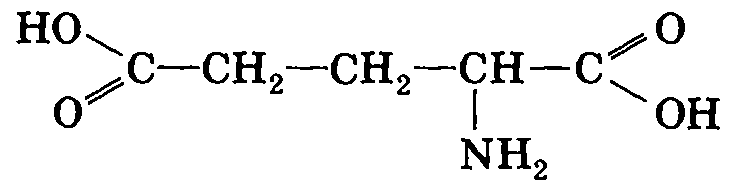
Входит в состав практически всех природных белков и других биологически активных веществ. В свободном состоянии присутствует во всех тканях живых организмов, занимает ключевое положение в азотистом обмене. Глутаминовая кислота служит донором аминогруппы в реакциях -кетокислот и участвует, таким образом, в биосинтезе многих заменимых кислот.
Аспарагиновая кислота (-аминоянтарная кислота, 1-аминоэтан-1,2-дикарбоновая кислота) – природная аминокислота; важнейшая составная часть белков. Структурная формула:

Из всех природных аминокислот у аспарагиновой кислдоты наиболее выраженные кислотные свойства, ее изоэлектрическая точка лежит при рН = 2,8, соответственно, константы кислотной диссоциации рК=1,88, рК2=3,65. Аспарагиновая кислота впервые была получена при кислотном гидролизе амида аспарагиновой аспарагиновой кислоты – аспарагина, а затем и из гидролизаторов белков (Риттгаузен, 1868). Формула аспарагиновой кислоты установлена Либихом в 1833 г. Аспарагиновая кислота наряду с другими аминокислотами является важнейшей составной частью белков. В составе белков, в свободном состоянии, а также в виде аспарагина и других производных широко распространена в органах и тканях различных организмов. Аспарагиновая кислота может синтезироваться в организме человека и животных из других веществ и, таким образом, относится к заменимым аминокислотам. Однако для некоторых микроорганизмов аспарагиновая кислота является необходимым фактором роста и обязательно должна присутствовать в питательной среде. Являясь одним из промежуточных продуктов обмена азотистых веществ, аспарагиновая кислота играет важнейшую роль в обмене веществ.
1.3.1. Физические свойства аминокислот
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований (см. табл. 1 и 2). Они лучше растворимы в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления (часто разложения). Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме. Например, для глицина кислотно-основное равновесие: 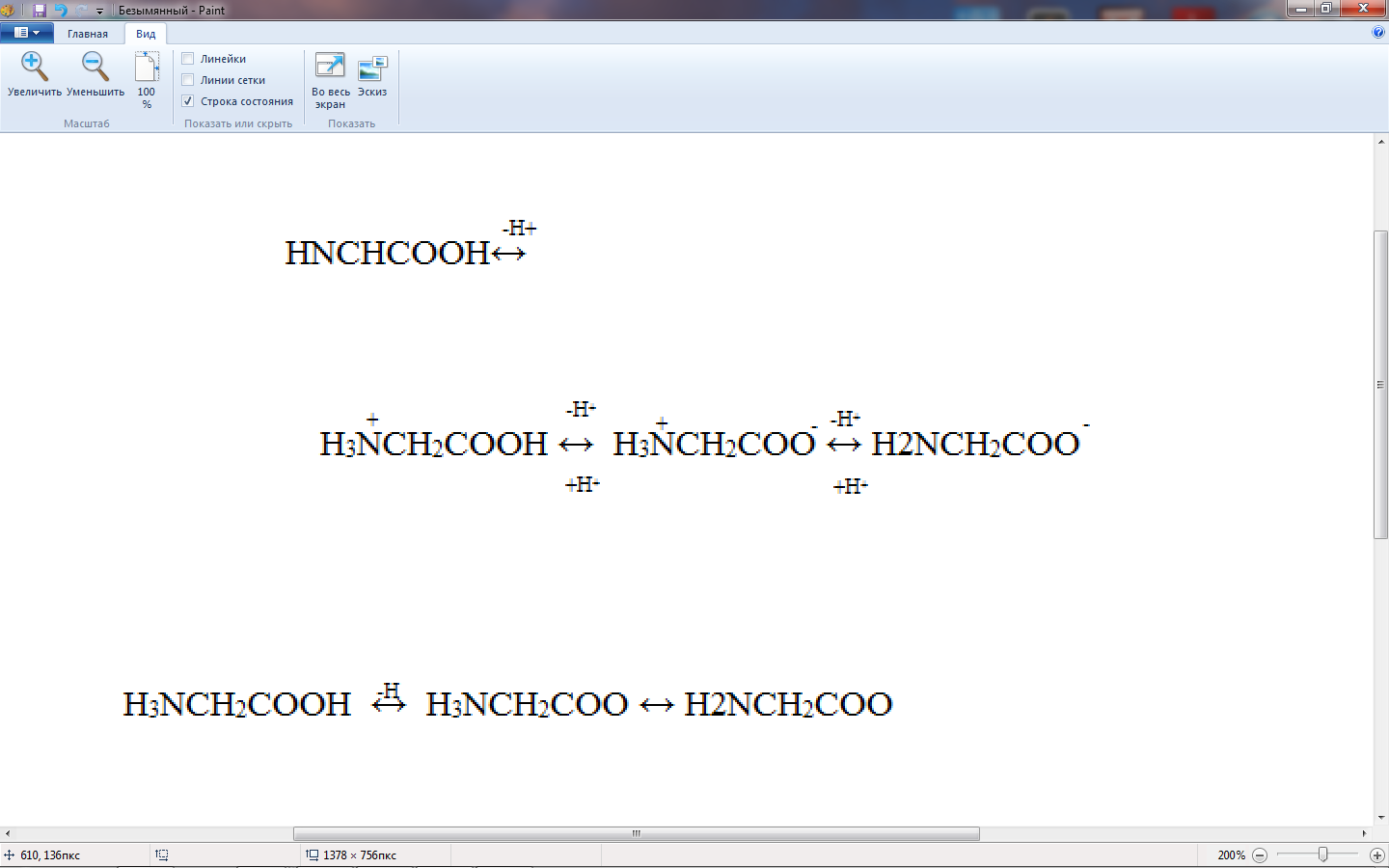
Таблица 1 – Физические свойства аминокислот
|
название |
Молярная масса, г/моль |
Изоэлектрическая точка |
Тпл.,°С |
Растворимость, г. на 100мл. |
|
|
воды |
этанола |
||||
|
Аспарагиновая кислота |
133,11 |
2,77 |
271 |
0,8225 |
0,03225 |
|
Глутаминовая кислота |
147,13 |
3,22 |
199 |
0,8925 |
0,0325 |
В работе [22] А.В. Шапкиной были исследованы концентрационные и температурные зависимости электропроводности водных растворов аминокислот – глицина, валина и изолейцина в различных ионных формах.
1.3.2 Химические свойства аминокислот
Реакции по карбоксильным группам аминокислот, аминогруппа которых защищена ацилированием или солеобразованием, протекают аналогично превращениям карбоновых кислот. Аминокислоты легко образуют соли, сложные эфиры. амиды, гидразиды, азиды, тиоэфиры, галогенангидриды, смешанные ангидриды и т.д. Эфиры аминокислот под действием натрия или магнийорганических соединений превращаются в аминоспирты. При сухой перегонке в присутствии Ва(ОН)2 аминокислоты декарбоксилируются.
Реакции аминогрупп аминокислот аналогичны превращениям аминов. Аминокислоты образуют соли с минеральными кислотами и пикриновой кислотой, легко ацилируются хлорангидридами кислот в водно-щелочном растворе (реакция Шоттена-Баумана) и алкилируются алкилгалогенидами. Метилиодид и диазометан превращают аминокислоты в бетаины (CH3)3N+CHRCOO-. С формалином аминокислоты дают мегилольные или метиленовые производные, а в присутствии муравьиной кислоты или каталитически активированного Н2- N,N-диметиламинокислоты. Под действием HNO2 ароматические аминогруппы диазотируются, а алифатическиезамещаются на гидроксил. При обработке эфироваминокислотыизоцианатамии изотиоцианатами образуются производные мочевины и тиомочевины. При нагревании с содой или при одновременном воздействии алкоголята и СО2 аминокислоты дают соли или эфиры N-карбоксипроизводных аминокислот, а при использовании CS2-аналогичные дитиокарбаматы.
Реакции с одновременным участием групп NH2 и СООН наиболее характерны для -аминокислот, которые способны образовывать устойчивые 5-членные гетероциклы. С ионами переходных металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr) -аминокислоты образуют прочные хелатные комплексы, что используется в комплексонах и в комплексообразующих ионообменных смолах на основе аминокарбоновых и аминофосфоновых кислот. При взаимодейсвтии с фосгеном -аминокислоты превращаются в циклические ангидриды N-карбоксиаминокислот (ф-ла I), а при нагревании с уксусным ангидридом или ацетилхлоридом - в азлактоны (II); нагревание аминокислоты с мочевиной или обработкаизоцианатами дает гидантоины (III), а при использовании -аминокислот, и особенно легко их эфиры, при нагревании превращаются в 2,5-пиперазиндионы, или дикетопиперазины (V). -аминокислоты при нагревании дезаминируются и образуют ,-ненасыщенные кислоты, - и -аминокислоты отщепляют воду и образуют 5- и 6-членные лактамы. -аминокапроновая кислота при нагревании образует в основном полиамид и лишь частично превращается в капролактам, что характерно и для аминокислот с большим числом метиленовых звеньев между функциональными группами [23].
1.3.3 Применение аминокислот
Наибольший интерес представляют 20 L--аминокислот (аланин, аргинин, аспарагин и другие), входящих в состав белковых молекул. Смеси L-аминокислот, а также индивидуальные аминокислоты (например, метионин) применяют в медицине для парэнтерального питания больных с заболеваниями пищеварительных и других органов, при нарушениях обмена веществ и др.; лизин, метионин, треонин, триптофан - в животноводстве для обогащения кормов; глутамат натрия и лизин - в пищевой промышленности. -аминокислоты и их лактамы служат для промышленного производства полиамидов. -аминомасляная кислота (аминалон) - медиатор в центральной нервной системе, применяется как лекарственное средствово при сосудистых заболеваниях головного мозга. Ароматические аминокислоты используют в синтезе красителей и лекарственных средств. На основе аминокарбоновых и аминофосфоновых кислот синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные сорбенты, ПАВ [23].
1.4 Комплексные соединения аминокислот
Аминокислоты являются структурными единицами пептидов и белков, поэтому их комплексообразование можно рассматривать в качестве модели, позволяющей оценить химическое сродство конкретных функциональных групп к определенным ионам металлов. Результаты многочисленных исследований обобщены в виде констант равновесия комплексообразования в растворах [24] и структурной информации в кристаллическом состоянии [25].
В работе [26] методом потенциометрического титрования исследовано комплексообразование L-аспарагина и L-глутамина с ионом кальция в водном растворе при 298,15 К и нескольких значениях ионной силы. Установлено образование комплексных частиц состава СаL+ и CaHL2+, определены их константы устойчивости.
Н.Н.Киреевой на примере соединений с аминокислотами и различными фосфатами выявлена специфичность воздействия состава смешанных растворителей на константы скорости обмена, константы устойчивости интермедиатов и скорости их диссоциации, передаваемая эффектами разбавления, гидрофобного и стэкинг-взаимодействия заместителей в интермедиатах и изомеризации комплексов с амбидентными лигандами [27].
Цель работы Я.Е.Зильбермана "Комплексообразование и лигандный обмен в растворах кобальта(II) и никеля(II) с аминокислотами и аденозин-5'-трифосфатом" - выяснение влияния природы металлов и лигандов на термодинамику комплексообразования, кинетику и механизмы реакций химического обмена в гомо- и гетеролигандных комплексах указанных металлов. В результате исследования экспериментально обоснован механизм обмена анионов аминокислот по кинетическим путям первого и второго порядков, предложен новый метод расчета констант скорости обмена протонов и молекул воды в растворах Ni(II). Сделано заключение, что в реакциях замещения с участием анионов аминокислот частично меняется характер образования первой связи от M-N к M-O при переходе от Ni(II) к Co(II). Я.Е.Зильберману впервые удалось охарактеризовать гомолигандные комплексы с формой АТФ, координированной депротонированными спиртовыми группами рибозного остатка – октаэдрические для никеля(II) и тетраэдрические для кобальта(II) [28].
В 1995 г. Г.А.Назмутдинова провела сопоставление динамического поведения оксованадия(IV) с соединениями других переходных металлов. Она доказала протекание реакций лигандного обмена в растворах оксованадия(IV) с аминокислотами по ассоциативному механизму подобно комплексам меди(II), но со спецификой, обусловленной быстрой миграцией карбоксигруппы координированного лиганда между аксиальным и экваториальным положениями (это устранило существующее заблуждение о диссоциативной активации указанных процессов). Предложены общие и специфические для аминокислот механизмы катализа протонного обмена. Выявлена роль в протонном обмене внутри- и межмолекулярных водородных связей между карбоксильными группами, а также между аммонийной группой аминокислоты и атомом кислорода фрагмента V=О [29].
В работе [30]методом потенциометрического титрования и калориметрическим методом авторами определены константы и тепловые эффекты реакции образования комплекса CdL- при 298,15 К и значениях ионной силы 0,2; 0,5; 1,0 (KNO3). Рассчитаны термодинамические характеристики реакции образования CdL- в водных растворах. Дана интерпретация полученных величин.
Два хиральных комплекса [Cu(L1)(L2)H2O]·3H2O (I) и [Ni(L1)(SCN)(H2O)2]·2H2O (II) (HL1=L-гистидин, HL2=L-аланин)в работе [31] синтезированы с использованием процесса медленного выпаривания растворителя. I – II охарактеризованы данными монокристаллической (порошковой) рентгеновской дифракции, ИКС, элементного анализа и измерениями кругового дихроизма. Показано, что комплексы I и II моноклинные, пр. гр. Р2I. Исследованы феромагнитные и ферроэлектрические свойства комплексов.
Существует небольшое количество работ, посвященных термодинамике процессов комплексообразования аминокислот с ионами металлов.
Г.Г. Горболетовой в работе [32] измерены тепловые эффекты смешения водных растворов Cu(NO3)2 и L-валина прямым калориметрическим методом при температуре 298,15 К и ионной силе 0,5-1,5 (KNO3). Экстраполяцией на нулевую ионную силу по уравнению с одним индивидуальным параметром получены значения стандартных тепловых эффектов образования комплексов Cu(2+) с L-валином в водном растворе. Рассчитаны значения стандартных термодинамических характеристик процессов комплексообразования в системе Cu2+-L-валин.
В работе [33] авторами измерены тепловые эффекты взаимодействия растворов Cu(NO3)2 c растворами L-глутамина прямым калориметрическим методом при температуре 298,15 К и значения ионной силы 0,5, 1,0 и 1,5 (KNO3). Проведена строгая математическая обработка экспериментальных данных с учетом одновременного протекания нескольких процессов по универсальной программе RRSU. Из калориметрических измерений рассчитаны тепловые эффекты образования комплексов CuL+ и CuL2. Экстраполяцией на нулевую ионную силу получены стандартные значения тепловых эффектов образования комплексов Cu2+ c L-глутамином. Получена полная термодинамическая характеристика (rH°, rG°, rS°) процессов комплексообразования в системе Cu2+-L-глутамин.
В работе [34] автором был синтезирован ахиральный плоскоквадратный комплекс иона Cu'' с шиффовым основанием (2-бензоилфенил)амидопиридил-2-карбоновой кислоты (РВР) и глицина. Комплекс исследован в реакции асимметрического каталитического синтеза глутаминовой кислоты с использованием в качестве хирального катализатора3,3'-бис(дифенилгидроксиметил)-1,1'-бинафтил-2,2'-диола(BIMBOL). Показано, что синтезированный новый высокоэффективный ахиральный субстрат в условиях межфазного катализа обеспечивает получение глутаминовой кислоты с высокой энантиомерной чистотой (87%). При этом исходный ахиральный лиганд РВР регенерируется с количественным выходом.
Наибольший интерес представляют работы, посвященные изучению способа координации аминокислот с металлами. Так в работе [35] авторами были синтезированы смешаннолигандные комплексные соединения празеодима (III) с аспарагиновой, глутаминовой и салициловой кислотами состава [Pr(HAsp)2HSal]·2H2O, [Pr(HGlu)2HSal]·2H2O. На основании ИК спектров сделаны выводы о бидентатной координации Hasp-, HGlu- ионов посредством амино- и карбоксильных групп. Координация HSal- иона осуществляется атомами кислорода – СООН и ОН (фенол) группы.
А.К.Молодкиным, Н.Я.Есиной и Н.К.Тинаевой по реакции ионного обмена были синтезированы разнолигандные комплексы состава Pd(Ala)(АТФ2-), Pd(Ser)(АТФ2-)? Pd(Glu)(АТФ2-) и Pd(Asp)(АТФ2-). Устаовлено, что аланин (Ala), серин (Ser), глутаминовая (Glu) и аспарагиновая (Asp) кислоты являются монодентатными нейтральными лигандами (связи Pd(II)- NH2), а анион АТФ2 - тридентатен за счет N-7 атома гетероцикла и атомов кислорода фосфато-групп [36].
По данным исследования [37] методом потенциометрического титрования было установлено образование комплексов никеля (II) и палладия (II) с аминокислотами (глутаминовой и аспарагиновой кислотами) состава 1:1 и 1:2.
Авторами работы [38] были разработаны методики синтеза комплексных соединений Сo(II), Ni(II), Cu(II), Zn(II), Cd(II),Hg(II), Pt(II) и Pd(II) с L-валином, DL-валином, L-изолейцином, L-лейцином, L-лизином, DL-метионином, DL-серином, DL-тирозином, L-цистеином, L-глутаминовой и L-аспарагиновойкислотами. Они охарактеризованы по данным химического, рентгенофазового и термическогоанализа. Полученным веществам приписан следующий химический состав: Ni(L-Ile)22H2О,Co(L-Ile)22H2O, Ni(L-Leu)22H2O, Cd(L-Leu)2.2H2O, [Ni(L-Val)2(H2O)2](H2O), Ni(DL-Val)2(H2О)2,[Co(L-Val)2(H2O)2].H2O, Pd(L-Cys)Cl2, Pd(L-Met)Cl2, Pd(DL-Met)Cl2, Pt(DL-Met)Cl2, Ni(DL-Met)2,Cu(DL-Met)2, Zn(DL-Met)2,, Cd(DL-Met)2, [Co(L-Asp)(H2O)2].H2O, [Cu(DL-Asp)(H2O)2]H2O,[Cu(DL-Glu)(H2O)].H2O, Hg(L-Glu), Ni(DL-Ser)2(H2O)2, Cu(DL-Tyr)2, CuCl2(L-Lys). Предложены возможные способы координации аминокислот в соединениях.
В работе [39] реакцией ионного обмена были получены комплексные соединения меди (II) с аспарагиновой кислотой. Согласно данным ИК спектрального анализа полученного соединения одна группа СООН аспаргинат-иона не образует координационной связи.
С.Р.Гараевой синтезированы комплексы меди и кобальта с Шиффовыми основаниями -аминокислот и их гидрированными по азометиновой связи аналогами. Методами элементного анализа, ИК-, электронной спетрофотометрии, термогравиметрии, магнехимии изучены состав и строение полученных комплексов. Показано, что комплексы меди с Шиффовыми основаниями имеют квадратно-пирамидальное строение, а с гидрированными аналогами – тетраэдрическое. Кобальт с обоими типами лигандов образует трехъядерные смешанно-валентные Co(III)-Co(II)-Co(III)-комплексы [40].
Два хиральных комплекса [Cu(L1)(L2)H2O]·3H2O (I) и [Ni(L1)(SCN)(H2O)2]·2H2O (II) (HL1=L-гистидин, HL2=L-аланин) синтезированы с использованием процесса медленного выпаривания растворителя. I – II охарактеризованы данными монокристаллической (порошковой) рентгеновской дифракции, ИКС, элементного анализа и измерениями кругового дихроизма. Показано, что комплексы I и II моноклинные, пр. гр. Р2I. Исследованы феромагнитные и ферроэлектрические свойства комплексов.[41]
В работе [42] авторами синтезирован 5-нитросалицилальдегид-глициновый лиганд типа основания Шиффа. Получены также его комплексы с Cu(II)и Ni(II). Изучены флуоресцентные свойства полученных соединений.
А.Н.Юнусхуджаевым и соавторами синтезированы смешаннолигандные комплексы Co(II), Ni(II)и Cu(II) с пиридоксином (ПН), глутаминовой (ГК) и аспарагиновой (АК) кислотами состава Co(ПН-Н)(ГК-Н)·Н2О, Ni(ПН-Н)(ГК-Н)·4Н2О, Cu(ПН-Н)(ГК-Н)·3Н2О, Co(ПН)(АК-2Н)·4Н2О, Cu(ПН)2(АК-2Н)·3Н2О. Охарактеризованы их свойства. На основании изучения ИК спектров поглощения и электронных спектров диффузного отражения обсуждены способы координации лигандов и строение комплексов [43].
Инфракрасные спектры аминокислот и их соединений широко изучены. Обычно комплексные соединения аминокислот имеют сложные колебательные спектры, поэтому для доказательства образования комплексного соединения и установления способа координайии применяют эмпирическое отнесение полос поглощения колебаний функциональных групп в молекулах используемых аминокислот. Наиболее полное отнесение характеристических колебаний можно провести на основании монографий Беллами [44,45].
В работах [46-49] приведена методология определения способа координации карбоновых и аминокислот с ионами металлов. Так карбоксильная группа карбоновых кислот может существовать в ионизованной и неионизованной форме. В случае неионизованной карбоксильной группы в ИКспектре наблюдается полоса поглощения карбонильного атома кислорода при 1700 см-1. При удалении протона, связи углерод-кислород становятся эквивалентными и в ИК спектре наблюдаются полосы поглощения валентного симметричного ( при 1410 см-1 ) и ассиметричного ( при 1590 см-1 ) колебания карбоксильной группы. При координации через карбоксильную группу происходит смещение этих полос поглощения. Разность СОО- - asСОО- - sСОО- широко используется [47] для оценки степени ковалентности связи металл-кислород в комплексах. При этом считается, что для преимущественно ковалентных связей СОО->225 см-1, для преимущественно ионных СОО-<225 см-1. При монодентатной координации карбоксильной группы СОО->300 см-1, а если
СОО-<300 см-1, то карбоксильная группа бидентатносвязанная. Те же закономерности справедливы и для карбоксильной группы аминокислот.
1.5 Электрохимический синтез комплексных соединений. Перспективы его применения.
Электрохимический синтез является одним из наиболее интересных и доступных методов получения координационных соединений. Современное состояние электрохимического метода синтеза позволяет получать все виды комплексных соединений, а также синтезировать соединения, которые невозможно получить другим способом.
В исследовании [50] электролизом при постоянном потенциале в нейтральном растворе получены ,-ненасыщенные альдегиды. Продукты образуются в результате последовательной дегидратации альдоля на Pt катоде. Продуктами являются кротоновый альдегид, коричный альдегид, п-метоксикоричный альдегид, п-гидроксикоричный альдегид и п-бромбензальдегид.
Авторами работы [51] разработан новый промышленно-приемлемый способ получения никельорганических сигма-комплексов, основанный на реакции окислительного присоединения орто-замещенных ароматических бромидов к электрохитмически генерируемому комплексу никеля(0) с 2,2'-бипиридилом. Электролиз проводится в бездиафрагменных электролизерах, снабженных растворимым никелевым анодом, при переодической или непрерывной загрузке электролита. Электрохимически получены никельорганические сигма-комплексы типа [NiBr(Ar)(bpy)], где Ar=2,4,6-триметилфенил, 2,4,6-триизопропилфенил, 2,6-диметилфенил, могут быть использованы в качестве высокоэффективных катализаторов олигомеризации этилена, приводящей к образованию линейных альфа-олефинов фракций С4-С12.
Электрохимические реакции, не требующие применения окислителей и восстановителей, позволяют получить труднодоступные соединения одностадийным методом. Интерес к этому методу связан с селективностью протекающих реакций, возможностью его контроля, а также тем, что протекающие процессы можно прекращать в любой момент и проводить в мягких условиях с хорошими выходами целевого продукта. Так в 1882 году Гердесом был разработан и апробирован метод получения гексааминов платины (IV) путем анодного растворения платинового электрода в растворе углекислого аммония под действием переменного тока. Позже в 1906 Сцилард получил алкосиды металлов. Более масштабное исследование и использование электросинтеза как нового метода началось в 1908 году, когда Л.А.Чугаевым были получены аммиакаты кобальта путем электролиза с использованием кобальтового анода и платинового катода, им также были получены аммиакаты платины и хелаты никеля с диметилглиоксимом и этилендиамином и рекомендован электролиз с постоянным и переменным током. Благодаря работам Д.Тюк и А.Соусы осуществлен прорыв в использовании электрохимического метода для синтеза различных классов координационных соединений.
Наиболее распространенным видом электрохимического синтеза комплексов является анодный синтез, а точнее метод растворяемого анода. Сущность его заключается в использовании в качестве анодов разных металлов, частично растворяющихся при прохождении тока через электрохимическую систему. Получающиеся при этом катионы металлов вступают в химические реакции с лигандами, входящими в состав электрохимической ячейки, образуя различные комплексные соединения. В общем случае эти процессы можно описать следующей схемой
Анод: М – nе Мn+
Катод: L + е L-
В растворе: Мn+ + nL- MLn
Так, например, в работе [52] путем электрохимического синтеза были получены комплексные соединения меди (II) с аспарагиновой кислотой, серином и валином. Индивидуальность соединений подтверждена данными элементного анализа и термогравиметрии. Из данных ИК спектров следует, что во всех комплексах присутствует пятичленный хелатный цикл, в котором ион меди (II) образует связи с атомом кислорода карбоксильной группы и атомом азота аминогруппы.
Авторами публикации [53] изучены условия образования ацетилацетонатов редкоземельных элементов цериевой группы (La, Ce, Pr, Nd) при анодном растворении металлов в растворе ацетонитрила. В качестве фонового электролита использовали хлорид тетраэтиламмония. Синтез вели при разности потенциалов на электродах 3,5 В, плотности тока 60 А/дм2, выход по току составил 95-97 %. Полученные соединения не содержат кристаллизационной воды, по результатам элементного анализа имеют состав Ln(CH3COCHCOCH3)3. По данным ИК-спектров в координации участвует карбонильная группа лиганда. Термогравиметрический анализ выявил летучесть соединений, что указывает на их молекулярную структуру.
В работе [54] представлены результаты анализа роли аминокислот (АК) в кинетике анодных процессов меди в щелочном электролизе. Эксперименты проводили на стационарном медном электроде Сu (99,99%) в 0,01 М NaOH (pH=12). Концентрацию добавок Glu и -Ala варьировали в интервале 1x10-6 - 1x10-1 М, Asp - 1x10-5 - 1x10-3 M. Анализ эспериментальных данных с привлечением метода инверсионной вольамперометрии позволяет предположить, что Glu и -Ala стимулируют процесс анодного окисления меди за счет адсорбции и формирования растворимых комплексов металла с анионами Glu и -Ala. В системах с добавками Asp аминокислоты проявляются специфические свойства последней. С одной стороны, медь повергается локальной активации (ЛА) во всем исследуемом диапазоне концентраций ( 1·10-5 - 1·10-3 М), с другой – процесс ЛА происходит в двух зонах потенциалов: Е'ЛА = 0,20-0,30 В и Е''ЛА = 0,80-0,90 В. При этом характер поражений поверхности меди существенно различается: при Е'ЛА они имеют вид неглубоких мелких питтингов, которые при Е''ЛА переходят в глубокие ямки травления. Подтверждено экспериментально, что процесс ЛА при Е''ЛА обусловлен действием ацетат-ионов, образующихся в системе с Asp в результате вторичных процессов окисления аспаргинат-ионов. На основе формально-кинетического подхода интерпретирован механизм инициирования питтинга в исследуемых системах, который индифферентен к природе АК и коррелирует с теорией нуклеофильного замещения диссоциативного типа и принципом «жестких и мягких кислот и оснований».
Значительное количество работ по электрохимическому синтезу посвящено изучению влияния каких-либо факторов на эффективность процесса, а также определению кинетических параметров и констант образования комплексных соединений.
Авторами работы [55] полярографическим методом определены кинетические параметры и константы образования комплексов Со(2+) с L-аргинином, L-лизином, L-триптофаном, L-аспарагиновой и L-глутаминовой кислотами при рН 8,40±0,20, ионной силе 0,1 в водном ДМФА, смеси N-метилформамида на РКЭ. Восстановление всех комплексов необратимое. Величина Е1/2 смещалась к более отрицательным значениям во всех Со2+-комплексах в среде N-метилформамида.
В исследовании [56] Д.Г.Явхаровым определены основные электрохимические и термодинамические параметры электрохимического синтеза никельорганических сигма-комплексов [NiBr(Mes)(L)] (L= 2.2'-бипиридил, 1,10-фенантролин) по реакции окислительного присоединения электрохимически генерируемых комплексов [Ni0L2] к 2,4,6-триметилбромбензолу. Наибольшая эффективность процесса достигается при использовании электролизера без разделения анодного и катодного пространств, снабженного растворимым никелевым анодом, при потенциале рабочего электрода -1,40…-1,60 В (электрод сравнения – система Ag/AgNO3, 0.01 M в CH3CN) и катодной плотности тока 0,5-2,0 мА·см-2 в интервале температур 20-50°С. Установлено, что повышение потенциала рабочего электрода приводит к электрохимическому разложению никельорганических сигма-комплексов по реакции элиминирования бромид-аниона или лиганда с образованием координационно-ненасыщенных комплексов, подтвержденных реакциям диспропорционирования. Понижение температуры приводит к понижению реакционной способности комплексов никеля (0) в реакциях окислительного присоединения, а при ее повышении протекают реакции разложения целевых продуктов.
В работе [57] на примере комплексного изучения химического и электрохимического растворения меди в растворах глицина проведено определение возможного влияния на эффективность химического взаимодействия переходных металлов с аминокислотами различных факторов (диэлектрическая проницаемость, дипольный момент, донорное число и количество растворителя, температура, продолжительность реакции, растворимость аминокислот и их комплексов, соотношение реагентов, присутствие окислителей и хелатирующих агентов, состав и кислотность среды). На основе полученных результатов оптимизированы условия химического и электрохимического растворения переходных металлов в водных и органических средах, содержащих аминокислоты. Предложен прямой метод синтеза комплексных соединений меди (II) с аминокислотами.
Публицистами работы [58] методом ЦВА изучены стабильность глутамина (I) в системе Сu-I и электроосаждение меди на катоде. В интервале потенциалов от -1,5 до 3 В (отн. насыщ. к. э.) нет других редокс-реакций, но имеет место гидролиз комплекса. Электроосаждение меди полностью необратимое.
Основной задачей большинства исследований является синтез координационных соединений и выявление их структуры как путем элементного анализа, так и благодаря физико-химическим методам.
Авторами работы [59] методом электрохимического синтеза получены комплексные соединения Си(Н2ФМГ)2 (N-фосфонометилглицин) и Cu(H2OMr)HHis (гистидин), состав и строение которых установлены элементным и титриметрическим анализом и методом ИК спектроскопии.
Цокур М.Н. впервые электрохимическим методом синтеза с применением импульсного тока переменной скважности были получены бинарные и смешаннолигандные координационные соединения меди (II) с бензойной, никотиновой, салициловой, фталевой кислотами и пиридином. По данным ИК спектров полученных комплексных соединений все используемые карбоновые кислоты в комплексах находятся в депротонированной форме и координируются бидентатно по карбоксильной группе. В CuSalBen-C2H5OH и CuSal2Py-H20 салициловая кислота координируется также по спиртовой группе; в CuNicBen-3C2H5OH и CuNicSal-C2H5OH пиридиновый атом азот никотиновой кислоты не участвует в координации [60].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Исходные вещества:
2.1.1 Оборудование:
1. Источник питания постоянного тока «Б 5-50»;
2. Аналитические весы «Typ WA-21»;
3. Спектрофотометр «IR Prestige»;
4. Колориметр фотоэлектрический концентрационный «КФК-2МП»;
5. Микробюретка, ЦД 0,01 мл;
6. Пипетки на 1, 5, 10 мл;
7. Химический стакан на 100, 250, 350 мл;
8. Колбы мерные на 25, 50 и 100 мл;
9. Шпатель;
10. Эксикатор;
2.1.2 Реактивы:
1. Аланин, C3H7NO2, х.ч.;
2. Этиловый спирт х.ч.;
3. Хлорид калия, KCL, х.ч.;
4. Сu0
5. Zn0
6. Дистиллированная вода
7. Соляная кислота HCLконц.
8. Мурексид, ч.д.а.
9. Эриохромовый черный, ч.д.а.
10. NH3, ч.д.а.
11. ЭДТА, фиксанал
12. Хлорид кальция, Ca(CL)2, х.ч.
13. Ацетонитрил, х.ч.
14. Диметилформамид, х.ч.
2.2 Получение комплексных соединений меди (II) и цинка(II) с аланином методом электрохимического синтеза
В качестве источника тока использовался стабилизированный прибор Б5-50. Электролиз вели в бездиафрагменной двухэлектродной ячейке, заполненной раствором электролита – водно-неводная среда составами ацетонитрил:вода (50:50), этиловый спирт:вода (50:50), диметилформамид:вода (50:50), КСL в качестве электролита, аминокислота. Использование водно-неводного растворителя позволило снизить растворимость синтезированных соединений и предотвратить загрязнение продуктов, кроме того, растворимость аминокислот в смешанных средах выше.
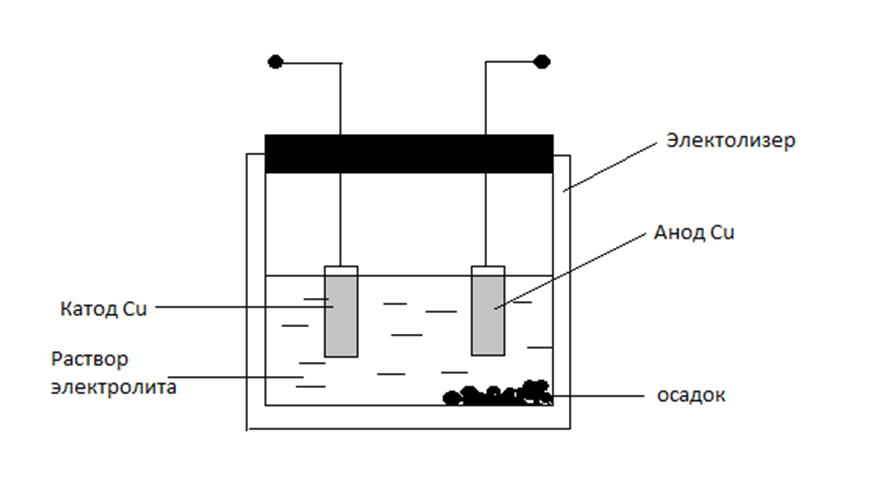
Рисунок 1 – Ячейка для электрохимического синтеза на примере меди
В качестве анода и катода использовались пластины меди (99,9%) и цинка (99,9%). Процесс вели при плотности тока равной 8 mA/cm 2 для меди и 5 mA/cm 2 для цинка в течение одного часа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. М.: Мир, Т. 3. – С. 592.
- Подчайнова В.Н., Симонова Л.В. Медь. М.: Наука, 1990. – 279 с.
- Иванчев Г. Дитизон и его применение. М.: Издательство иностранной литературы, 1961. – 450 с.
- Марченко З. Фотометрическое определение элементов. М.: Мир, 1971. – 501 с.
- Мустафин И.С., Фрумина Н.С. Ассортимент реактивов на медь. М.: НИИТЭХИМ, 1969. – 78 с.
- Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. – 341 с.
- Sheng Ruilong, Тестовый набор колориметрического типа для детектирования ионов Сu2+. Colorimetric test for Сu2+ detection/Wangg Pergfei, Gao Yunhua, Wu Yan, Liu Weimin , Ma Jinggjin, Li Huaping, Wu Shikang// Org. Lett. – 2008. – Т. 10. – № 21. – С. 5015-5018.
- Afzali Daryoush, Определение следовых количеств ионов меди(2+), никеля(2+) и марганца(2+) после предварительного концентрирования на органической наноглине с иммоболизованным 1-(2-пиридилазо)-2-нафтолом в качестве нового сорбента. Determination of trace amounts of Сu2+ , Ni2+, Mn2+ ions after preconcentration onto PAN-immobilized organo nanoclay as a new sorbent/ Afzali Daryoush, Mostafavi Ali// Journal AOAC Int. – 2008. – Т. 91. – № 6. – С. 1430-1434.
- Сумина Е.Г. Фотометрическое определение меди (II) с хромазуролом S и хлоридом цетилпиридиния в присутствии сильных электролитов. Цв. Мет, 2009. – С. 53-54.
- Скорых Т.В., Определение ионов меди(2+) на натуральной матрице с использованием бензилбензимидазолилформазана/ Т.В. Скорых, И.Г. Первова, Т.И. Маслакова, Т.А. Мельник, И.Н. Липунов // Зав. лаб.: Диагност. матер. – 2009. – Т. 75. – № 9. – С. 12-15, 71.
- Wu Lin-Hua, Распознавание иона ртути и меди с 8-аминохинолин производными/ Wu Lin-Hua, Han Li-Feng, Ruan Yi-Bin, JiangYun-Bao// J. Anal. Chem. – 2010. – Т. 38. – № 1. – С. 121-124.
- Ezoddin M., Применение аналитического комплекса на основе сочетания спектрофотометра с волоконно-оптическим панорамным детектором и системы микроэкстракции в системе жидкость-жидкость для концентрирования и определения меди. Fiber optic-linear array detection spectrophotometry in combination with dispersive liquid-liquid microextration for preconcentration and determination of copper/ Ezoddin M., Shemirani F., Jamali M.// Ж. анал. Химии. – 2010. – Т. 65. – № 2. – С. 158-162.
- Баширов Э.А., Изучение окрашенного соединения меди (II) с метилтиомоловым синим/ Э.А. Баширов, Т.Э. Абдуллаева// Уч. зап. Азебр. ун-т. Сер. хим. н. – 1973. – № 4. – С. 21-24.
- Shivastava K.C., Метилтимоловый синий как хромогенный реагент в неорганическом анализе. Влияние рН на реагент и цветные реакции с катионами. Methylthymol blue as a chromogenic reagent in injrganic analysis: influence of pH on the reagent and color reactions with cations/ Shivastava K.C., Banerji Samir K.// Chem. Age India. – 1969. – Т. 20. – № 7. – С. 606 – 609.
- Гуркина Т.В., Фотометрическое определение микрограммовых количеств меди, цинка, свинца в природных водах с использованием ксиленоловго оранжевого/ Т.В. Гуркина, А.М. Игошин //Журнал аналитической химии. – 1965. – Т. 20. – С. 778-781.
- Nogami T., Определение ионов металлов методом капиллярного электрофореза в микрочипе с хамилюминесцентным детектированием, основанным на реакции 1,10-фенантролина. Analysis of metal ions by microchip capillary electrophoresis with chemiluminescence detection based on 1,10-phenantroline reaction/ Nogami T., Hashimoto M., Tsukagoshi K.// Luminescence. – 2008. – Т. 23. – № 4. – С. 256.
- Егорова Л.С., Тест-определение меди (II) с использованием бумаг, пропитанных комплексами цинка и свинца с диэтилдитиокарбаматом/ Л.С. Егорова, В.К. Чеботарев, Л.В. Трабер, О.В. Варламова // Изв. АГУ. – 2008. – № 3. – С. 57-61, 97.
- Yu Yong-li, Определение следов меди(2+), основанное на тушение флуоресценции наночастиц NaGdF4 :Eu/ Yu Yong-li, Liu yan, Xu Shu-kun, Wang Naizhi, Zhai Han// Spectrosc. and Spectral Anal. – 2009. – Т. 29. – № 11. – С. 3061-3065.
- Gao Ying, Одновременное и селективное предварительное концентрирование следов меди и серебра одностадийной вытеснительной экстракцией в точке помутнения для определения методом пламенной атомно-абсорбиционной спектроскопии. Simultaneous and selective preconcentration of trace Cu and Ag by one-step displacement cloud point extraction for FAAS determination/ Gao Ying, Wu Peng, Li Wei, Xuan Yuelan, Hou Xiandeng// Talanta. – 2010. – Т. 81. – № 1-2. – С. 586-590.
- Михайлов О.В., Комплексные соединения меди(II) с гидразином 2-хлорбензойной кислоты/ О.В. Михайлов, В.В. Сентемов// Координационная химия. – 1989. – Т. 15. – № 12. – С. 1674-1675.
- Апенышева Т.Е., Строение комплексных соединений меди(II)с производными дигидробензоксазина в растворе хлороформа/ Т.Е. Апенышева, Н.Н. Буков, А.А. Скляр, С. Н. Болотин, К.С. Пушкарева// Координационная химия. – 2006. – Т. 32. – № 5. – С. 350-353.
- Дж. Ж. М. ван дер Керк, Координационная химия цинкорганических соединений и каталитическое действие координационных цинкорганических соединений// Достижения химии. – 1972г - . - Т. 41. - № 7.
23. Гринштейн Дж., Химия аминокислот и пептидов / Дж. Гринштейн, М. Виниц // пер. с англ. — Москва. — 1965.
24. Smith K.M., Critical Stability Constants / K.M. Smith, A.E. Martell // Plenum Publishing Corporation. —Т.6. — c.1989.
25. Cambridge Structural Database System, Cambridge Crystallographic Data Centre, University Chemical Laboratories, Cambridge, United Kindom, 1996.
26. Курочкин В.Ю., Комплексообразование L- аспарагина, L-глутамина с ионом кальция в водном растворе / В.Ю. Курочкин, В.В. Черников, А.И. Лыткин // Изв. Вузов. Химия и хим. Технология. — 2010. —Т.53. — № 11. — с. 6-9.
27. Киреева Н.Н., Влияние растворителя на лабильность гомо- и гетеролигандных комплексов меди(II) / Н.Н. Киреева // Автореферат диссертации. — Химико-технологический институт им. С.М. Кирова. — Казань. — 1991.
28. Зильберман Я.Е., Комплексообразование и лигандный обмен в растворах кобальта(II) и никеля(II) с аминокислотами и аденозин-5-трифосфатом / Я.Е. Зильберман // Автореферат диссертации. — Казанский государственный технологический университет. — Казань. — 1993.
29. Назмутдинова Г.А., Кинетика и механизмы реакций ассоциации лигандного и протонного обмена в растворах комплексов оксованадия (IV) / Г.А. Назмутдинова // Автореферат диссертации. — Казанский государственный университет имени В.И. Ульянова-Ленина. — Казань. — 1995.
30. Лыткин А.И., Термодинамика процессов комплексообразования Cd(II) с N-(карбоксиметил) аспарагиновой кислотой в водных растворах / А.И. Лыткин, Н.В. Чернявская, В.Э. Литвиненко // Изв. вузов. Химия и хим. технол. — 2012. — Т.55. — № 8. — с. 27-31.
31. Tan Xin., Two chiral complexes constructed from mixed L-histidine and L-alanine/thiocyanate ligands: Synthesis, structure, ferromagnetic and ferroelectric properties / Xin Tan, Yun-Xia Che, Ji-Min Zheng // Inorg. Chem. Commun. —2012. — Т. 22. — c. 10-13.
32. Горболетова Г.Г., Термодинамика процессов комплесообразования L-валина с ионами Cu2+ в водном растворе / Г.Г. Горболетова, С.Н. Гридчин, А.А. Луценко // Координац. химия. — 2010. —Т.36. — №9. — с. 699-702.
33. Горболетова Г.Г., Термохимическое исследование процессов комплексообразования ионов Сu2+ c L-глутамином в водном растворе / Г.Г. Горболетова, С.Н. Гридчин, А.А. Луценко // Жур.физ.химии. — 2010. — Т.84. — №11. — с. 2036-2041.
34. Акопян К.В., Синтез и исследование нового ахирального Cu''-комплекса основания шиффа глицина / К.В. Акопян // Хим. ж. Армении. — 2011. — Т.64. — №3. — с. 367-372.
35. Алиева Р.А., Синтез и исследование смешаннолигандных комплексов празеодима (III) с аспарагиновой, глутаминовой и салициловой кислотами / Р.А. Алиева, А.Д. Кулиев, В.А. Гурбанова // Химия и химическая технология. — 2004. — т. 47. — Вып. 7.
36. Молодкин А.К., Разнолигандные комплексные соединения палладия(II) с аминокислотами и АТФ / А.К Молодкин, Н.Я. Есина, Н.К. Тинаева // Жур. неорганической химии. — 2003. — Т.48. — № 10. — с. 1657-1659.
37. Тинаева Н.К., Комплексные соединения никеля (II), палладия (II) с аминокислотами и АТФ / Н.К. Тинаева // Автореферат диссертации. — Российский университет дружбы народов. — Москва. — 2002.
38. Есина Н.Я., Разнолигандные комплексные соединения меди (II), никеля (II) и кобальта (II) с L-аспарагиновой кислотой и L-треонином / Н.Я. Есина, А.К. Молодкин, Е.В. Тараканова // Жунал неорганической химии. —1996. — Т. 41. — №11. — с. 1874-1879.
39. Головнев Н.Н., Синтез соединений d-элементов с аминокислотами / Н.Н. Головнев, Г.В. Новикова, А.Д. Васильев, Т.В. Исакова, Е.А. Ронжина // Жур. неорганич. химии. — 1993. — Т.13. — № 8. — с. 1584-1590.
40. Гараева С.Р., Синтез и строение комплексов Cu(II) и Co(II) с N-(2-гидроксибензил)--аминокислотами / С.Р. Гараева // Азерб. хим. ж. — 2010. — №1. — с. 106-109.
41. Tan Xin., Two chiral complexes constructed from mixed L-histidine and L-alanine/thiocyanate ligands: Synthesis, structure, ferromagnetic and ferroelectric properties / Xin Tan, Yun-Xia Che, Ji-Min Zheng // Inorg. Chem. Commun. —2012. — Т.22. — c. 10-13.
42. Xian Jing-chun., Синтез и флуоресцентные свойства связанного с 5-нитросалицилальдегидом глицина и его комплекса с медью(II) и никелем(II) / Jing-chun Xian // J. Northeast Norm. Univ. Natur Sci. Ed. — 2011. — Т.43. — № 3. — с. 154-156.
43. Юнусходжаев А.Н., Смешанные комплексы Co(II), Ni(II)и Cu(II) с пиридоксином, глутаминовой и аспарагиновой кислотами / А.Н. Юнусходжаев, У.А. Мукаррамова, Х.Х. Хакимов // Координац.химия. — 1993. — Т.19. — № 4. — с. 319-321.
44. Беллами Л., Инфракрасные спектры сложных молекул. – М.: Издательство иностранной литературы. — с. 1963.
45. Беллами Л., Новые данные по ИК-спектрам молекул. – М.: Мир,. —1971. — с. 326.
46. Шевченко Л.Л., Инфракрасные спектры солей и комплексных соединений карбоновых кислот и некоторых их производных / Л.Л. Шевченко // Успехи химии. — 1963. —Т. 32. — № 4. — с. 456-469.
47. Накамото К., Инфракрасные спектры неорганических координационных соединений. – М.: Мир. — 1966. – с. 412.
48. Спектроскопические методы в химии комплексных соединений / под ред. Вдовенко В.М. – М.: Химия. — 1964. – с. 320.
49. Браун Д.Н., Спектроскопия органических веществ. – М.: Мир. — 1992. —с. 72-73.
50. Kumar Sanjeev., Electrochemical synthesis of ,-unsaturated aldehydes at Pt cathode in the dimethylformamide solvent / Sanjeev Kumar, Sushma Singh, R. K. Singh // Indian Chem. Soc. — 2010. — Т.87. — № 9. — с. 1145-1148.
51. Яхваров Д.Г., Электрохимический синтез и каталитическая активность никельорганических сигма-комплексов: Докл. [17 Совещание «Электрохимия органических соединений» (ЭХОС), Тамбов, сент., 2010] / Д.Г. Яхваров, Е.А. Трофимова, И.Х. Ризванов, О.С. Фомина, О.Г. Синяшин // Электрохимия. — 2011. — Т.47. — № 10. — с. 1180-1190.
52. Крюкова Н.П., Синтез и исследование комплексных соединений меди (II) с аспарагиновой кислотой, серином и валином / Н.П. Крюкова, В.Ю. Фролов, Ф.А. Колоколов, С.Н. Болотин, В.Т. Панющкин // Журнал общей химии. — 2005. — Т. 75. — Вып. 4.
53. Болотин С.Н., Анодный синтез комплексных соединений редкоземельных металлов цериевой группы с ацетилацетоном / С.Н. Болотин, В.Ю. Фролов, В.И. Зеленов // Изв. вузов. Сев.-Кавк. Регион. Естеств. н. — 2011. — №2. — с. 29-31.
54. Скрыпникова Е.А., Анодное окисление меди в щелочных средах в присутствии глицина, -аланина и аспарагиновой кислоты / Е.А. Скрыпникова, С.А. Калужина, Е.В. Орлова // Новости электрохимии органических соединений 2010: 17 Совещание по электрохимии органических соединений с международным участием. — Тамбов. — 2010. — Тезисы докладов. — 2010. — с. 61.
55. Bairwa B.S., Electrochemical behavior of cobalt(II) L-amino acids in aqueous dimethyl formamide, N-methylformamide and formamide media at dropping mercury electrode / B.S. Bairwa, Manu Gupta, Sarita Varshney, I.K. Sharma, P.S.Verma // J. Indian Chem. Soc. — 2010. — Т.87. — №5. — с. 609-613.
56. Яхваров Д.Г., Электрохимические и термодинамические параметры электрохимического синтеза никельорганических сигма-комплексов [NiBr(Mes)(L)] (L= 2.2'-бипиридил, 1,10-фенантролин) / Д.Г. Яхваров, С.В. Квашенникова, Д.С. Трифонов, О.Г. Синяшин // Учен. зап. Казан. гос. ун-та. Сер. Естеств. н. — 2012. — Т.154. — № 1. — с. 23-32.
57. Огородникова Н.П., Химическое взаимодействие металлов – меди, железа и марганца с - и -аминокислотами в водных и органических средах / Н.П Огородникова // Автореферат диссертации. — Астраханский государственный технический университет. — Астрахань. — 2010.
58. Yang Tian-zu., Электроосаждение меди (2+) в системе глутамина / Tian-zu Yang, Cun-mao Lei, Wei Liu, Ai-chun Dou, Du-chao Zhang, Wei-feng Liu // Zhongnan daxue xuebao. Ziran kexue ban. . J. Cent. S. Univ. Sci. and Technol. — 2011. — Т.42. — № 2. — с. 305-311.
59. Трудникова Н.М., Строение и свойства комплексных соединений меди(II), кобальта(II) и никеля(II) с N-фосфонометилглицином и гистидином / Н.М. Трудникова // Автореферат диссертации. — Кубанский государственный университет. — Краснодар. — 2007.
60. Цокур М.Н., Электрохимический синтез и строение смешаннолигандных и гетерометаллических координационных осединений меди(II), железа(II) и неодима(III) с некоторыми карбоновыми кислотами / М.Н. Цокур // Автореферат диссертации. — Кубанский государственный университет. — Краснодар. — 2009.
СИНТЕЗ И ИССЛЕДОВАНИЕ КООРДИНАЦИОНЫХ СОЕДИНЕНИЙ КАРБОКСИЛАТОВ МЕДИ И ЦИНКА