Химические концепции в естественнонаучной картине мира
«Концепции современного естествознания»
2014/2015 учебный год
Лекция 10
Химические концепции в естественнонаучной картине мира
10.1. Возникновение химии как науки
Химия, как известно, изучает превращения веществ. В древности химией называли искус�ство получать золото, серебро или их сплавы. В те времена науки химии в современном по�нимании еще не было, а весь громадный прак�тический опыт в области получения веществ и материалов накапливался человечеством методом проб и ошибок. И дело, конечно, не ограничивалось добычей драгоценных метал�лов и их сплавов. Люди уже тогда широко ис�пользовали железо, свинец, олово, медь. Це�лые исторические эпохи, например бронзовый век, теперь связывают с металлургическими технологиями. Значительное развитие полу�чили гончарное ремесло, изготовление изде�лий из стекла, методы окраски, приготовле�ние лекарственных снадобий и многое другое, что сейчас тесно связано с практической хи�мией. Знания эти передавались по традиции из поколения в поколение кастами жрецов.
Уже в Древней Греции люди пытались отвечать не толь�ко на вопрос, как получить то или иное вещество или мате�риал, но и почему происходит превращение веществ и из�менение их свойств. Однако вплоть до XVII в. на эти вопро�сы давались столь абстрактные, умозрительные ответы, что ни о каких действительно научных представлениях, кото�рые могли стать надежной путеводной звездой в практиче�ской деятельности, не могло быть и речи. Достаточно вспом�нить в связи с этим о первичных элементах и свойствах материи (земля, вода, воздух, огонь, сухость, влажность, тепло, холод и т. п.), лежащих в основе древнегреческой философии. Даже атомистика греков на самом деле не име�ла ничего общего с атомно-молекулярной теорией, которая только к началу XIX в. завоевала признание и стала фунда�ментом классической естественнонаучной картины мира.
Особого внимания заслуживает алхимический период в истории становления химии как естественной науки, продолжавшийся свыше тысячи лет. Начиная с IV в. н. э. алхимики безуспешно пытались решить три главные за�дачи: найти философский камень, отыскать эликсир дол�голетия и создать универсальный растворитель. Среди алхимических методов было много мистицизма и схоластики. Вот как сами алхимики в XIII в. опре�деляли свое занятие: «Алхимия — весьма необходимая, божественная часть тайной небесной натуральной фило�софии, составляющая и образующая единую, не всем из�вестную науку и искусство, которые учат чистить и очи�щать потерявшие ценность драгоценные камни и прида�вать присущие им свойства, восстанавливать немощные и больные человеческие тела и приводить их в должное со�стояние и в наилучшее здоровье и даже превращать все металлы в настоящее серебро, а затем и в настоящее золо�то посредством единого всеобщего медикамента, к кото�рому сводятся или были сведены все частные лекарства». В то же время именно алхимики, открывшие невероятное количество процессов, наблюдавшие огромное число ре�акций между самыми различными веществами, заложи�ли экспериментальную базу будущей науки химии.К XVI в. алхимия утрачивает то значение, которое она имела в предшествующие века. Почувствовав тщетность своих усилий, алхимики постепенно переключились на более прагматическую деятельность. Знаменитый врач, алхимик и оккультист Т. Парацельс утверждал, что «на�стоящая цель химии заключается не в изготовлении золо�та, а в приготовлении лекарств» (это направление алхи�мии получило название ятрохимия). Его идея о том, что жизненные явления обладают химической природой и что здоровье зависит от нормального состава органов и «со�ков», является и сейчас вполне современной.
Первые по-настоящему научные труды в области хи�мии появились в середине XVII в., а первые химики были «по совместительству» физиками. Например, один из ос�новоположников химии Р. Бойль являлся соавтором зна�менитого закона о зависимости давления от объема газа при постоянной температуре (закон Бойля-Мариотта). Именно Бойль дал первое научно обоснованное определе�ние химического элемента как предела разложения веще�ства на составные части.
Типичным для того времени было представление о фло�гистоне как об особой субстанции, присутствующей в ве�ществах и обусловливающей их горение. Борьба с концеп�цией флогистона длилась почти сто лет, пока М. В. Ломо�носов, а затем А. Лавуазье не доказали, что горение — это взаимодействие вещества с кислородом. Примерно в то же время, в конце XVIII в., А. Лавуазье публикует «Началь�ный учебник химии», который фактически завершил ста�новление химии как науки о составе веществ, об их ана�лизе. В список простых веществ Лавуазье включил все известные неметаллы, металлы, а также «невесомые на�чала» — «свет» и «теплород».
К началу XIX в. понятие химического элемента (по Р. Бойлю) уже прочно вошло в химию. Однако что стоит за этим понятием — оставалось загадкой. Отгадать ее «помог�ло» атомистическое учение Дж. Дальтона о природе хими�ческих элементов. Правда, Дальтон игнорировал структу�ру и форму атомов, считая их маленькими «шариками».
Из всех свойств этих «шариков» он рассматривал только массу. Изучая закономерности соединений различных эле�ментов друг с другом, он пришел к закону кратных отно�шений: при образовании химических соединений (газов) массы химических элементов относятся как небольшие целые числа. Именно на основании этого закона удалось не только определить химические формулы различных соединений, но и установить относительные массы атомов химических элементов.
Важной вехой на пути «наведения порядка» в химии стал первый Международный химический конгресс, орга�низованный в 1860 г. выдающимся немецким химиком Ф. Кекуле. В следующее десятилетие такой порядок дейст�вительно был наведен, и химики начали активный поиск закономерностей в свойствах примерно шестидесяти хи�мических элементов, которые тогда были известны. Этот поиск завершился сенсацией: в 1869 г. Д. И. Менделеев впервые представил научной общественности свою Перио�дическую таблицу химических элементов. Триумфом Пе�риодической таблицы стало открытие предсказанных Мен�делеевым новых элементов, о которых в 1869 г. никто не знал.
К началу XX в. таблица Д.И.Менделеева стала «Библией» химии. И в это время пути химиков и физиков пересек�лись. Связано это было с тем, что новые физические мето�ды исследования вещества (прежде всего, метод масс-спектроскопии) показали, что существуют химические элемен�ты с одинаковыми свойствами, но с разными массами — так называемые изотопы. Стало ясно, что свойства хими�ческих элементов определяются не столько атомным ве�сом, сколько каким-то другим параметром атома. Решаю�щий вклад в ответ на этот вопрос был сделан физикой. Сна�чала возникла планетарная модель атома Резерфорда-Бора (1913), а затем и более строгая квантово-механическая мо�дель (1926).
Сейчас установлено, что химические свойства элемен�тов определяются не массой, а зарядом ядра атома, кото�рое определяет число электронов в атоме, расположенных на разных расстояниях от ядра и, следовательно, обладаю�щих разной энергией связи. Заполнение электронных «оболочек» в ядре осуществляется в соответствии с прин�ципом Паули. Сильнее связан�ными с ядром оказываются, очевидно, наиболее близкие к ядру электроны, которые не участвуют в химических превращениях. Самые удаленные от ядра электроны, ва�лентные, могут создавать различные типы связей.
10.2. Концептуальные уровни в химии
История развития химии предстает перед нами как процесс последовательного формирования четырех кон�цептуальных уровней.
10.2.1. Первый из них сформировался в середине XVIII в. и может быть назван как учение о соста�ве. На этом уровне содержание химии полностью соответ�ствовало определению Д. И. Менделеева: «химия — это нау�ка о химических элементах и их соединениях». Долгое вре�мя актуальным в химии являлся вопрос о том, что считать элементарным «кирпичиком» вещества — химическим эле�ментом? Как уже было сказано выше, фундаментальный вклад в решение этой проблемы внес Д. И. Менделеев, ко�торый в основу систематизации свойств химических эле�ментов положил атомную массу. В дальнейшем, правда, оказалось, что существуют одинаковые по свойствам веще�ства, которые обладают разной массой (изотопы), поэтому основой классификации элементов стал заряд ядра. Та�ким образом, химический элемент — это вид атомов с оди�наковым зарядом ядра, то есть совокупность изотопов.
В 1930-е гг. периодическая система химических эле�ментов заканчивалась ураном U92. В 1950-е гг. ученые по�лучили в руки мощный инструмент синтеза новых транс�урановых элементов — ускорители частиц. Таким путем были синтезированы элементы до 112 номера включитель�но, которые, правда, не являются стабильными и быстро распадаются под действием электрических сил отталки�вания между протонами. Сейчас уже исследуют свойства 118-го элемента.
Практически все химические элементы в земных ус�ловиях существуют в составе тех или иных химических соединений. В настоящее время известно более 8 миллио�нов соединений, из которых большинство (около 96%) — органические (соединения углерода). С современной точ�ки зрения химическое соединение — это вещество, атомы которого за счет химических связей объединены в моле�кулы, комплексы, макромолекулы, монокристаллы или иные квантово-механические системы.
10.2.2. Вторая концептуальная схема может быть названа структурной химией. В XIX в. были открыты изомеры — вещества, имеющие одинаковый состав, но разные свой�ства в зависимости от пространственного расположения химических элементов друг относительно друга. Период становления структурной химии называют «триумфаль�ным маршем органического синтеза».
Основоположником учения о структуре химического со�единения считается великий русский химик А. М. Бутлеров, который в 1861 г. создал теорию химического строения, суть которой выражается следующими утверждениями:
- атомы в молекулах соединены между собой в опреде�ленном порядке химическими связями согласно их валентности;
- строение вещества выражается структурной формулой, которая для данного вещества является единственной;
- химические и физические свойства вещества опреде�ляются качественным и количественным составом молекул, их строением и взаимным влиянием атомов как связанных химическими связями, так непосредствен�но и не связанными;
- строение молекул можно изучать химическими методами.
Приведем, здесь только один пример, известный с 1861 г. и связанный с именем А. М. Бутлерова. Из четы�рех атомов углерода и десяти атомов водорода можно по�лучить два вещества: бутан СН3(СН2)2СНз и изобутан (СН3)3СН.
Первый плавится при -138°С и кипит при -0,5°С, растворим в спирте, эфире, воде. Второй плавится при -160°С, кипит при -11,7°С, растворим в спирте и эфи�ре, но плохо растворим в воде.
Однако особенно актуальной теория химических структур оказалась для развития органиче�ской химии, а в дальнейшем в биохимии.
В 1870-1890.гг. развитие органической химии приве�ло к получению разнообразных красителей для текстиль�ной промышленности, всевозможных лекарств, искусст�венного шелка и огромного числа разнообразных материа�лов. С теории химического строения начался новый этап развития химии, когда она из аналитической науки пре�вратилась в синтетическую.
Теория А. М. Бутлерова и сейчас не утратила своего значения: идея о связи свойств со строением отражает уни�версальную природную закономерность, которая прояв�ляется не только на химическом уровне организации ма�терии, но и на других, не химических уровнях.
10.2.3. Новый скачок в развитии химии в начале XX в. был связан с созданием третьей концептуальной схемы хи�мии — учения о химических процессах.
Что было известно о химических процессах? То, что они обычно сопровождаются выделением (экзотермиче�ские реакции) или поглощением (эндотермические реак�ции) энергии (теплоты). К экзотермическим реакциям от�носятся, как правило, все реакции соединения (напри�мер, 2Н2 + О2 --> 2Н2О), а типичными эндотермическими реакциями являются реакции разложения (например, СаСО3 --> СаО + СО2). Легко понять, почему так происхо�дит. В реакциях соединения молекулы реагентов образу�ют более устойчивую конфигурацию, более сильно связа�ны друг с другом. Поэтому их потенциальная энергия Uх понижается по сравнению с тем значением Uo, которое описывает свободные, невзаимодействующие молекулы (часто считают Uo ~ 0). Энергия, соответствующая разно�сти (Uо - Uх), и выделяется в виде тепла. При разложении молекулы на более простые компоненты, наоборот, требу�ется затратить энергию на разрыв молекулярных связей.
Известно, что одни химические реакции происходят практически мгновенно (например, взаимодействие водо�рода с кислородом при нагревании или в присутствии пла�тины), а другие идут так медленно, что их трудно даже на�блюдать (например, коррозия металлов). С повышением температуры скорость большинства химических превраще�ний существенно возрастает. Согласно правилу Вант-Гоффа при повышении температуры в арифметической про�грессии скорость реакции изменяется в геометрической прогрессии.
Другим фактором, влияющим на скорость протекания реакций, является концентрация реагентов. Основной за�кон химической кинетики гласит: скорость химических реакций, протекающих в однородной среде, пропорциональ�на произведению концентраций реагирующих веществ, возведённым в некоторые степени. Объекты химии понимаются теперь как процессы превращения веществ, а не как законченные вещества. Узло�вым понятием современной химии, наряду с «веществом», «молекулой», становятся организованный молекулярный ансамбль, активированный молекулярный комплекс (со�ставная молекула с малым временем жизни) и т. п.
Однако самым эффективным способом увеличения ско�рости химических реакций в сотни, тысячи и более раз, является использование катализаторов — веществ, ко�торые сами по себе не изменяются во время реакции, но ускоряют ее протекание. Действие катализаторов заклю�чается в том, что они «активируют» молекулы реагентов, как бы возбуждают их, после чего последние легче объе�диняются, создавая молекулу нового вещества.
Особенно важна роль катализаторов в биохимических реакциях. Катализаторами в этих процессах выступают многочисленные белки, функции которых узкоспециа�лизированы. Без них невозможен синтез сложных высо�комолекулярных веществ, осуществляемый в клетках.
Существуют вещества, противоположные по действию катализаторам, — это так называемые ингибиторы, ино�гда значительно замедляющие скорость реакции.
Именно изучением кинетики химических реакций, способов управления их протеканием и занимается химия на третьем концептуальном уровне. Достижения этого уровня позволили существенно повысить эффективность управления химическими процессами, в частности орга�ническим синтезом. Мировое производство таких материа�лов, как синтетический каучук, пластмассы, искусствен�ное волокно, моющие средства, этиловый спирт стало ба�зироваться на нефтяном сырье, а производство азотных удобрений — на использовании азота воздуха.
10.2.4. В последние десятилетия наметился переход к наибо�лее сложному, четвертому концептуальному уровню хи�мической науки — эволюционной химии. Рассмотрение химической формы материи в развитии как ступени за�кономерного процесса эволюции материального мира в целом позволит выйти на новый уровень и в сфере хими�ческой технологии. Этот уровень связан прежде всего с реализацией идеи крупнейших ученых прошлого — воз�можностью копирования, воспроизведения сложных хи�мических процессов происходящих в живых организмах (самоорганизация химических систем, ферментативный катализ и т. п.).
Действительно, подавляющее большинство химиче�ских реакций, реализованных руками человека, относит�ся к «неорганизованным» реакциям, в которых частицы (молекулы, ионы, атомы, радикалы) реагируют при слу�чайных встречах (во времени и в пространстве). В то же время «природная» химия является высокоорганизован�ной, то есть почти все химические превращения осущест�вляются в системах с молекулярным и надмолекулярным порядком. Целые каскады биохимических реакций орга�низованы в пространстве и во времени. Именно благодаря такой высокой степени организации селективность и про�изводительность биохимических реакций происходит на уровне, пока недостижимом в обычной химии. С позиций эволюционной химии ученые смогут решить как пробле�му биогенеза, так и освоить каталитический опыт живой природы.
10.3 На переднем крае химии
Что же представляет собой сейчас передний край хи�мии? Главной задачей химии, по-прежнему, является раз�работка методов синтеза и создание новых веществ, препа�ратов и материалов. Число химически созданных соедине�ний неуклонно растет. Молекулярная архитектура вновь синтезированных соединений бесконечно разнообразна и фантастически богата. Получены молекулы-ромбоиды (со�ставляющие структуру одномерных металлов), протонные «губки» и «трубки» (молекулярно-организованные протононесущие резервуары и каналы), молекулярные тороиды, крауны (способные разделять катионы и анионы), гипер�валентные радикалы, высокоспиновые молекулы (имею�щие десятки неспаренных электронов в одной структуре), многопалубные полиароматические молекулы и т. д.
Крупным событием в химии стало освоение принци�пов звездообразного синтеза, при котором реагенты соеди�няются по фрактальному типу в гигантскую молекулу — дендример. Природа использовала этот принцип при фор�мировании гликогена, амилопектина и некоторых других полисахаридов и белков. Про�гнозируется, что полимерные дендримеры будут служить молекулярно-энергетическими антеннами, собирающими энергию солнечного излуче�ния и преобразующими ее в фототок.
Настоящим сокровищем для химии стали фуллерены, с которыми связывают самые смелые и радужные прогнозы. Фуллерен – это молекула, состоящая из 60, 70 и бо�лее атомов углерода, связанных друг с другом так, что вся структура напоминает футбольный мяч (рис. 1). Ока�зывается, что и «чистые» фуллерены, и эндофуллерены (с внедренными в молекулу различными атомами и иона�ми) являются очень перспективными для микроэлектро�ники и для использования в составе сверхпроводников.
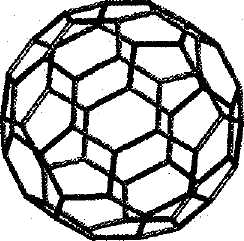
Рис.1 Фуллерен. Атомы углерода расположены в узлах решетки.
Крупным событием в современной химии стал син�тез цилиндрических углеродных нанотрубок (диаметром около 10 нм), которые построены по тому же принци�пу, что и фуллерены. Эти трубки характеризуются высо�кой растворимостью водорода, что позволяет использовать их в химических источниках тока. Такие нанотрубки мож�но укладывать, изгибать, резать, выпрямлять, организуя молекулярные электронные устройства.
Большой интерес к себе вызывает синтетическая хи�мия на поверхности, которая исследует сверхтонкие объ�екты, мономолекулярные слои, мембраны, межфазные границы, адсорбционные слои реагентов на твердых те�лах, а также нанокластеры. Именно благодаря этим исследова�ниям появилось большое разнообразие источников света всех возможных цветов.
Новое «лицо» химии — это когерентная химия. Коге�рентность в химии проявляется в синхронизации реакции во времени, которая выражается в периодическом изме�нении скорости реакции и детектируется как осцилляции в выходе продуктов, эмиссии люминесценции, электро�химического тока и т. д. Когерентность в химии вносит в нее такие понятия, как волновой пакет, фаза, интерфе�ренция, бифуркация, фазовая турбулентность. В когерент�ной химии случайное, статистическое поведение молекул заменяется организованным, упорядоченным и синхрон�ным: хаос становится порядком.
Первые наблюдения осциллирующих режимов хими�ческих реакций стали уже достоянием истории. Тогда ос�цилляции воспринимались скорее как экзотика, а не как химическая закономерность. Сегодня реакция Белоусова—Жаботинского, осцилляции рН и электрохимического потенциала в гетерогенных системах типа вода-масло, волновое горение и прочие — стали уже классикой.
Реакция Белоусова—Жаботинского — класс химических реакций, протекающих в колебательном режиме, при котором некоторые параметры реакции (цвет, концентрация компонентов, температура и др.) изменяются периодически, образуя сложную пространственно-временную структуру реакционной среды.В настоящее время под этим названием объединяется целый класс родственных химических систем, близких по механизму, но различающихся используемыми катализаторами (Ce3+, Mn2+ и комплексы Fe2+, Ru2+), органическими восстановителями (малоновая кислота, броммалоновая кислота, лимонная кислота, яблочная кислота и др.) и окислителями (броматы, иодаты и др.). При определенных условиях эти системы могут демонстрировать очень сложные формы поведения от регулярных периодических до хаотических колебаний и являются важным объектом исследования универсальных закономерностей нелинейных систем.
�
Рис.2 Некоторые конфигурации, возникающие при реакции Белоусова — Жаботинского в тонком слое в чашке Петри
Одна�ко осознание того, что макроскопическая когерентность является фундаментальным свойством, пришло лишь не�давно. Это связано с двумя обстоятельствами. Во-первых, в когерентных режимах можно ожидать увеличения вы�ходов реакции, селективности процессов, самоочистки поверхностей от каталитических ядов и т. п. Во-вторых, интерес к химическим осцилляторам проявился вновь благодаря биохимическим осциллирующим процессам в нервных клетках, мышцах, митохондриях. Считается, что система химических осцилляторов является прообразом будущих моделей нейронных сетей.
Современная химия, раздвигая свои горизонты, актив�но вторгается в области, которые для «классической» химии не представляли интереса или были недостижимы. Особенно впечатляющие результаты достигнуты в облас�ти фемтохимии, которая развивается благодаря прогрес�су в получении ультракоротких (10-14 - 10-15с) лазерных импульсов. Эти импульсы позволяют эффективно воздей�ствовать на отдельные атомы и молекулы вещества, обес�печивая высочайшее пространственно-временное разреше�ние в управлении химическими превращениями. Мощные лазерные импульсы — великолепное средство генерации коротких ударных волн, стимулирующих экзотические химические превращения (например, синтез металличе�ского водорода). Другим направлением создания экзоти�ческих условий является лазерное охлаждение до сверх�низких температур (10-4 - 10-6К), с помощью которого, например, удалось получить новое состояние вещества — кристаллический газ.
PAGE \* MERGEFORMAT 1
Химические концепции в естественнонаучной картине мира