Производство крахмалсодержащих питательных сред
Введение
Целью работы являлось усовершенствование существующей технологии производства крахмалсодержащих питательных сред.
В настоящее время предлагается рассматривать производство крахмала и крахмалсодержащих сред как объект замкнутой биологической системы, включающей выращивание сырья, его переработку, утилизацию сопутствующих крахмалу веществ (зерновые оболочки) на кормовые цели, повышение их ценности путем биохимической и механической обработки сырья в технологическом потоке, возвращение неиспользованных веществ в почву для последующего воспроизводства этого растительного сырья. При этом необходимо оценивать и экономическую целесообразность переработки на крахмал новых видов крахмалсодержащего сырья с учетом их технологических свойств.
Для России восстановление и увеличение объемов выработки крахмала становится проблемой, так как импорт этого продукта за последние годы составил более 70% от общего потребления. Падение объемов производства крахмала вызвано прекращением субсидирования переработки картофеля и недостаточными ресурсами зерна кукурузы, поэтому вовлечение в переработку на крахмал основного отечественного зернового сырья - пшеницы, ржи, ячменя является актуальной задачей. Для решения вопроса о возможности использования этих зерновых крахмалов требуется проведение научных исследований по определению физико-химических показателей и свойств с целью их анализа и сопоставления.
К объектам системы научных исследований в области производства крахмалсодержащих сред следует отнести:
- молекулярную структуру крахмала, определяющую его функциональные свойства;
- микро- и макроструктуру крахмалсодержашего сырья, определяющую его технологические свойства;
- производство крахмалсодержашего сырья;
- технологические процессы переработки сырья и выработки крахмала.
- процесс утилизации побочных продуктов и комбинирование производств, обеспечивающие экологическую безопасность технологии крахмала.
Молекулярный состав крахмала (как микроструктура крахмалсодержашего сырья) и его функциональные свойства зависят от вида крахмалоноса и могут быть изменены его селекцией, включая создание трансгенных видов.
Минимальные трудовые и энергетические затраты на производство крахмала зависят от крахмалистости, урожайности, технологических свойств сырья и совершенства процессов его переработки.
Создание экологически безопасных технологий крахмала при переработке различных видов крахмалсодержашего сырья зависит от макроструктуры сырья, его технологических свойств, совершенства процессов утилизации сопутствующих крахмалу компонентов:белка, клетчатки.
Производство крахмала должно осуществляться не только с минимальными трудовыми и энергетическими затратами, но и с минимальными материальными затратами, которые характеризуются расходом сырья и вспомогательных материалов на единицу готовой продукции. Поскольку в себестоимости крахмала удельный вес стоимости сырья составляет более 50%, то для достижения поставленной цели вовлечения в промышленную обработку нетрадиционных видов сырья важным фактором является их экономическая оценка. [1]
Строение и состав зерна пшеницы.
Зерно — важнейший продукт сельского хозяйства. Оно служит основным источником питания человека, кормовой базой про�дуктивного животноводства и сырьем для технического произ�водства.
На рис.1 приведена морфологическая структура зерна, характеризующая всю сложность разделения его на составляющие.
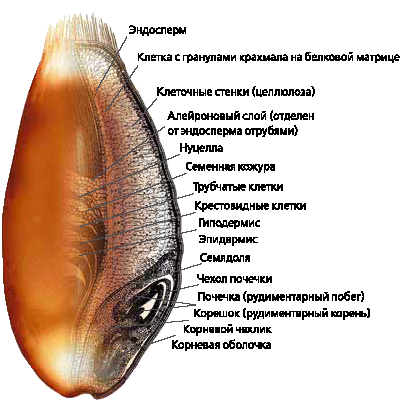
[2]
Весь крахмал зерна сосредоточен равномерно в эндосперме, который занимает всю внутреннюю часть зерна и составляет до 85% его массы. Он состоит из крупных тонкостенных клеток, заполненных зернами крахмала, которые прочно скреплены белковыми веществами, не поддающимися механическому отделению. Белки распределены в эндосперме неравномерно: наибольшее их количество содержится в его периферийных частях. Других составляющих (жир, сахара и клетчатка) в эндосперме немного, наряду с белками они находятся в окраинных частях эндосперма. Химический состав зерна одной и той же культуры колеблется в широких пределах в зависимости от почвенно-климатических условий, агротехнических мероприятий и генетических особенностей сорта.
Усреднённый состав пшеничного зерна представлен в таблице 1. [1]
|
Таблица 1. Усредненный состав пшеничного зерна
Наименование
Соотн. частей, %
Белок, %
Углеводы
Липиды, %
Витамины, мкг
Крахмал
Сахара
Клетчатка
Тиамин
Рибофлав.
Ниацин
Пиридоксин
Каротиноиды
Токоферолы
Целое зерно
100
14
63
4,5
10
2,2
6
1,4
60
4
0,2
9
Эндосперм
80
12
80
3,5
3
0,7
3,5
0,3
10
1,3
0
0,3
Зародыш
3
35
0
25
10
14
20
6
80
15
6
300
Алейрон. слой
6,5
45
0
15
15
12
30
2,3
300
14
3,3
100
Щиток
1,5
30
0
20
15
30
30
2,3
300
14
3,3
100
Семенные оболочки
9
14
0
4
50
6
30
2,3
300
14
3,3
100
|
В России возделывают в основном два вида пше�ниц — мягкие и твердые, причем предпочтение отдают мягким, на их долю приходится более 90 % посевов и сборов. По срокам посева она может быть яровой и озимой. Распространены как яровая, так и озимая мягкая пшеница.
У мягкой пшеницы зерно округлое, с хорошо заметной бо�родкой (опущение на конце зерна, противоположном зародышу), с ярко выраженной глубокой бороздкой, проходящей вдоль зер�новки. Отношение длины зерна к его ширине составляет 2:1. Из всех злаковых культур пшеница отличается наиболее высо�ким содержанием белка (9,2...26,8 %), однако он неполноценен из-за дефицита лизина и метионина. Содержание белка в яровой пшенице выше, соответственно доля крахмала ниже, чем в ози�мой.
Таблица 2. Углеводы [1]
|
Содержание, г на 100г съедобной части продукта
|
Пшеница мягкая яровая
|
|
Моносахариды
Арабиноза
Галактоза
Глюкоза
Ксилоза
Фруктоза
Итого
|
-
0,02
0,09
-
0,07
0,18
|
|
Ди-, три-, тетрасахариды
Лактоза
Мальтоза
Раффиноза
Сахароза
Итого
|
0,02
0,06
0,17
0,61
0,86
|
|
Полисахариды
Гемицеллюлозы
Клетчатка
Крахмал
Пектин
Итого
|
7,7
2,5
52,4
-
62,6
|
|
Всего
|
63,6
|
Строение крахмала.
Крахмал представляет собой наиболее важный резервный гомополисахарид растений, относящийся к группе углеводов. Этот полимер синтезируется высшими и низшими растительными организмами из глюкозы, которая образуется в результате фотосинтеза зелеными растениями. В процессе фотосинтеза углекислый газ, поглощенный растением из воздуха, под влиянием солнечного света взаимодействует с водой, в результате чего образуется глюкоза и выделяется кислород. Реакция протекает по уравнению:
хлорофилл
6CO2 + 12H2O ---------------- C6H12O6 + 6H2O.
свет
Накопленная в растениях глюкоза превращается затем в крахмал по уравнению:
nC6H12O6 ---------------- (C6H10O5)n + n H2O.
Крахмал является полимером глюкозы, которая образуется и существует в разных формах. Преобладающей из них является циклическая пиранозная форма. Превращение открытой формы D-глюкозы в циклическую - D-глюкозу сопровождается образованием кислородного мостика -О- между первым и пятым атомами углерода.
В зернах крахмала содержатся 98-99,5% полисахаридов и 0,5-2% неуглеводных компонентов (в т.ч. липиды, белки, зольные элементы). Крахмал представляет собой смесь линейного (амилозы-20-30% от массы крахмала) и разветвленного (амилопектина – 70-80%) полисахаридов.
Первый из них состоит из длинных, неразветвленных цепей остатков D-глюкозы, соединенных друг с другом -(1-4)-связями. Молекулярная масса таких цепей колеблется от нескольких тысяч до 500 000. Это объясняется тем, что в зависимости от метаболических потребностей клеток моносахаридные остатки могут ферментативно присоединяться к полисахаридам или же отщепляться от них.
Амилопектин также имеет высокую молекулярную массу, но в отличие от амилозы его цепи сильно разветвлены.В неразветвленных участках амилопектина остатки глюкозы соединены друг с другом связями -(1-4), а в участках ветвления цепи – -(1-6).
Благодаря -(1-4)-связям полимерные цепи в молекулах амилозы и амилопектина приобретают сильно спирализованные компактные структуры. Это уменьшает вероятность образования межцепных Н-связей, но увеличивает возможность возникновения таких связей с молекулами воды. Поэтому амилоза растворяется в воде.
В отличие от линейной амилозы амилопектин имеет разветвленное строение и в точках ветвления звенья соединяются за счет отщепления воды от – OH и CH2OH – групп. [4]
Различия в строении амилопектина и амилозы обуславливают их неодинаковые свойства, что видно из таблицы 3.
Таблица 3. Свойства амилозы и амилопектина. [3]
|
Свойства или признак
|
Амилозная фракция
|
Амилопектиновая фракция
|
|
Растворимость при обработке зерен крахмала водой с температурой ниже 1000С
|
Растворима
|
Нерастворима
|
|
Стабильность раствора при хранении
|
Легко образует осадок
|
Остается стабильным
|
|
Окраска йодного комплекса
|
Синяя
|
От красно-бурой до красно-фиолетовой
|
|
Способность связывать йод,%
|
18-20
|
0-1,3
|
|
Число нередуцируюших концевых групп на одну молекулу
|
1
|
несколько сот
|
|
Отношение растворов к высшим спиртам
|
Выпадает в осадок в виде комплексного соединения
|
Остается в растворе
|
|
Действие -амилазы
|
Расщепляется
полностью
|
Расщепляется примерно
на 50%
|
|
Пленкообразующая способность фракций и их производных
|
Эластичные пленки
|
Хрупкие пленки
|
Зерна пшеничного крахмала различаются размерами: менее 10 мкм- 78% и 25-30 мкм - около 3,7%, имеется значительное количество мелких зерен размером от 2 до 5 мкм. Зерна имеют эллиптическую и круглую сдавленную форму. [3]
а б
Крахмальные зерна растений:
а- картофель
б - пшеница
в - кукуруза
г - рис
в г
Нативные крахмалы при использовании в пищевых и технических целях, как правило, подвергаются термической обработке в присутствии воды. При повышении температуры водных крахмальных суспензий выше 30°С происходит частичный разрыв водородных связей в молекуле зерна крахмала, ведущий к изменению его микроструктуры. При этом резко возрастает гидратация амилозы и амилопектина и соответственно увеличиваются размеры зерен - происходит их так называемое “набухание”. При повышении температуры амилоза частично диффундирует из аморфной части зерен и переходит в раствор, а амилопектин остается в основном в нерастворенном состоянии. При разрушении зерен происходит деструкция кристаллической части зерен, полисахариды переходят в раствор.
Изменения, протекающие при нагревании водной суспензии крахмала, зависят от температуры, до которой нагрета суспензия, и ее концентрации. При этом в процессе изменения структуры зерен крахмала различают четыре этапа.
На первом этапе при комнатной температуре или незначительном нагревании суспензии (обычно до 50°С) происходит медленное и обратимое ограниченное набухание зерен крахмала.
На втором этапе набухание зерен крахмала становится интенсивным и необратимым. Происходит частичная клейстеризация крахмала и переход в раствор низкомолекулярной фракции амилозы, быстро возрастает вязкость суспензии. После охлаждения системы, зерна крахмала претерпевают существенное изменение -большая их часть утрачивает первоначальную структуру. На третьем этапе в результате дальнейшего повышения температуры происходит полное растворение амилозы, содержащейся в крахмальных зернах.
На четвертом этапе нагревания зерна крахмала полностью разрушаются, и полисахаридные молекулы переходят в раствор, образуя клейстер. [5]
Технология производства крахмала из пшеницы.
Технология, разработанная компанией “Westfalia Separator”.
Пшеница во всем мире является важнейшим сырьем для производства крахмала, глютена и их производных, таких как патока. Основной используемой в этой области технологией является центробежное разделение в силу высоких экономических и экологических стандартов для такого производства.
Две уникальные характеристики пшеницы, требующие применения специальных технологий:
• наличие двух фракций крахмальных гранул, значительно различающихся по размеру и форме – А+ - и А- - крахмал;
• способность определенной части белковой фракции к гидратации и образованию под механическим воздействием эластичной клейкой массы - глютена (клейковины).
Учитывая эти свойства пшеницы, компания “Westfalia Separator” разработала технологию трехфазного разделения при переработке пшеничной муки на крахмал.
Эффективное удаление внешних слоев (отрубей) пшеничного зерна достигается при помощи многостадийной подготовки и многопроходного вальцового помола; для последующей классификации используются плоские специальные сита. После этого вся масса муки выдерживается в течение определенного времени до подачи на последующее разделение. Основной задачей при помоле является повышение выхода муки при минимальном разрушении крахмальных гранул.
На рис.2 приведена принципиальная аппаратурно-технологическая схема, иллюстрирующая этот процесс. [2]
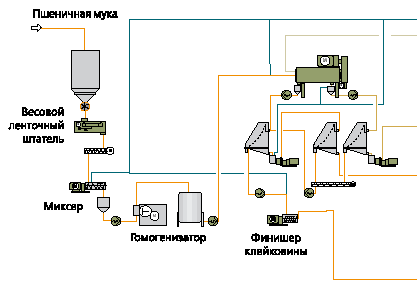
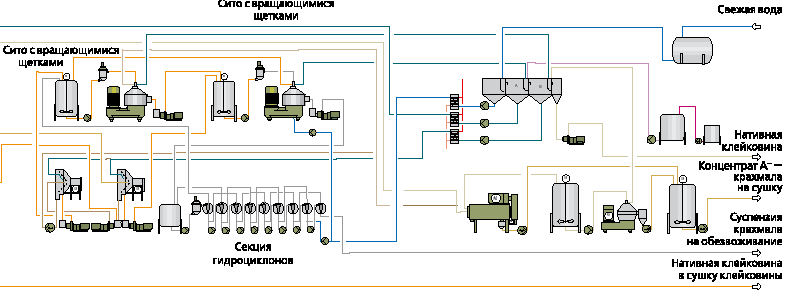
Подготовка муки и выделение клейковины.
Непрерывная пневматическая система подачи наполняет бункеры для хранения муки. Перед смешением муки с водой, она проходит взвешивание на ленточном весовом конвейере. Вода нагревается до 55 0С и подаётся через дозатор в смеситель. Только при использовании специально разработанного смесителя удаётся достичь необходимой пастообразной консистенции суспензии. Соотношение воды/муки соответствует приблизительно 1:1 в зависимости от качества муки. Эта суспензия при помощи эксцентрикового винтового насоса подается в насос высокого давления (гомогенизатор). За счет механического воздействия этого насоса достигается агрегация частиц клейковины. При этом благодаря сдвиговой нагрузке, разрушаются агломераты из глютена и крахмала. Это является очень важным шагом в достижении высоких показателей выхода и качества конечного продукта наряду с низким уровнем потребления воды. Суспензия, выходящая из насоса высокого давления (гомогенизатора) подается через буферный резервуар в центробежные декантеры.
Эта технология позволяет:
• выделять А+ - крахмал из суспензии и концентрировать его для наиболее эффективного удаления растворённых веществ и взвешенных примесей;
• отделять А- - крахмал и клейковину;
• отделять пентозаны и другие слизистые примеси на одной единственной стадии процесса.
На выходе из декантера, клейковина образует комочки ещё до подачи в систему отделения А- - крахмала промывкой. В процессе этой промывки образуется типичная для клейковины структура. После этой стадии клейковина направляется на финишер, где регулируется количество белка. Затем она направляется на обезвоживание перед сушкой.
После отделения клейковины промывкой, в потоке остаются А- - крахмал и мелкие частицы клейковины. Для выделения этих частиц клейковины, поток подается на контрольную промывку, после чего — в секцию концентрирования А- - крахмала. Отделённая на стадии контрольной промывки клейковина направляется обратно на очистку. Фракция пентозанов покидает декантер в качестве лёгкой фазы и направляется непосредственно на очистку стоков.
Сконцентрированный А+ - крахмал проходит участок контрольного просеивания остаточной клейковины, которая возвращается на очистку. Фильтрат А+ - крахмала подается на удаление волокнистых примесей (мезги).
Выделение и промывка крахмала.
После извлечения клейковины молоко А+ - крахмала подается на центробежное сито. Там удаляются частицы мезги. Они добавляются к А- -крахмалу. Молоко А+ - крахмала собирается в буферную емкость для последующей концентрации в 3-фазных сопловых сепараторах, оборудованных устройством промывки. Осветлённая фаза на выходе из сепаратора возвращается в производственный цикл в качестве технической воды. Средняя фаза, содержащая большую часть взвешенных примесей, подаётся на выделение крахмала. В завершение, сконцентрированное крахмальное молоко промывается на многостадийной гидроциклонной установке в противотоке чистой водой. С целью повышения выхода крахмала, удаётся выделить даже его мельчайшие гранулы. Таким образом, суспензия А- - крахмала, выходящая после извлечения клейковины, проходит стадию очистки от мелкой мезги при помощи центробежного сита. Фильтрат подается в буферный резервуар перед его регенерацией вместе со средней фазой от первичной сепарации. Для регенерации крахмала используется трехфазный сепаратор. Извлеченный концентрат А+ -крахмала рециркулирует перед первичной сепарацией. Фаза А-- крахмала (средняя фаза) закачивается на участок концентрирования. Верхний продукт сепаратора может использоваться в качестве технологической воды.
Концентрирование А- - крахмала и система технологической воды.
Выделение А- - крахмала и отрубей.
Фракция А- - крахмала в смеси с пентозанами и волокнистыми примесями обезвоживается при помощи декантера. Из него легкая фаза подается на сепаратор-осветлитель. Концентрат объединяют с обезвоженным А- - крахмалом. Осветленная жидкость возвращается в процесс, а ее избыток сбрасывается на очистные сооружения. Система технологической воды представляет собой каскадную емкость, качество воды на каждой ступени которой различается. Чистая вода проходит через нагревающий теплообменник, прежде чем поступить в производственный цикл. Различные потоки производственной воды распределяются в соответствие с технологическими требованиями. Система безразборной мойки (СIР) является интегрированной частью системы подготовки технологической воды.
Этот процесс, разработанный фирмой “Westfalia Separator” предлагает множество экономических и технологических преимуществ. Эти преимущества связаны с тем, что процессы классификации и концентрирования объединены в одну стадию. После эффективного выделения клейковины при помощи 3-фазного декантера, происходит выделение крахмала на сопловых сепараторах в 3-фазном исполнении с высоким выходом и качеством, а также низким уровнем потребления воды. Таким образом, данная технология обеспечивает:
- высокий выход клейковины;
- высокий выход крахмала;
- низкий уровень потребления воды. [2]
Технология, разработанная А О «Raision Fehoat»
(Paйcuo - процесс)
В Финляндии акционерным обществом Raision Fehoat разработан и внедрен в производство способ переработки пшеницы на крахмал и клейковину под названием Райсио - процесс. В качестве сырья используют сорта мягких и твердых пшениц. Муку из зерна получают непосредственно на заводе на специальной размольной установке. Получаемая мука по сравнению с обычной имеет более грубый помол, что снижает количество поврежденных зерен крахмала и положительно сказывается на выходе крахмала.
Данный технологический процесс полностью замкнутый. Расход воды на переработку I т муки составляет около 4 м3. Потери сухих веществ (от очистки и помола зерна до получения готовой продукции) зависят от качества зерна и равны от 1,3 до 4,0%.
Технологическая схема представлена на рис. 3.
Рис.3 Технологическая схема переработки пшеничной муки Райсио-процесс:
1- смеситель муки и воды, 2- диспергатор, 3- центрифуга, 4- вызреватель клейковины, 5- дезинтегратор, 6,9- сита, 7- осадительная центрифуга, 8-вибрационное сито, 10- первая группа осадительных центрифуг, 11- вторая группа осадительных центрифуг, 12- сепаратор, 13- линия отцеживания и высушивания клейковины, 14,15- оборудование получения "Райсорба", 16- линия производства экстракта.
По данной схеме суспензия муки разделяется на осадительной центрифуге на две фракции, крахмальную и белковую, содержащую 35-40 % белка. Белковая фракция содержит значительное количество крахмала А и Б, растворимых веществ и мезги. Эту фракцию направляют в вызреватель клейковины, где из белковой фракции образуются и уплотняются волокнистые соединения клейковины. Из вызревателя клейковина поступает в дезинтегратор, куда направляют также процессовую воду с первой группы центрифуг промывки крахмала и далее на дуговое сито для отделения крахмального молока. Механически обезвоженную клейковину высушивают.
Рафинированный крахмал для отделения от него белка и растворимых веществ последовательно обрабатывают на двух группах осадительных центрифуг по принцип противотока. Чистая вода вводится на разведение крахмала после первой группы центрифуг.
С первой группы центрифуг верхний сход кроме белка и растворимых веществ содержит также мелкие зерна крахмала (крахмал Б), который направляют в дезинтегратор.
Суспензия крахмала Б, отделенная от клейковины на ситах и шнеке-отцеживателе, поступает на осадительную центрифугу для отделения от нее части крахмала А. Нижний сход с центрифуги содержит кроме фракций крахмала А и Б еще и кусочки клейковины, его направляют на вибрационное сито для выделения клейковины. Крахмальное молоко с сита поступает в линию рафинировки крахмального молока, а кусочки клейковины - в шнек-отцеживатель.
Крахмал Б используют для получения пшеничного экстракта и белкового продукта, получившего торговое название "Райсорб". Для этого устанавливают определенное значение рН суспензии крахмала Б, нагревают ее до 120-150°С. Зерна крахмала при этом клейстеризуются, а растворенный и мелкодисперсный белок денатурируется и начинает коагулировать. Затем суспензию охлаждают до 75-85°С и вводят в нее ферменты -амилазу и -глюконазу и оставляют на 0,5-2,0 часа. За это время крахмал гидролизуется, белки коагулируют. Полученную суспензию обрабатывают на сопловом сепараторе, где выделяются скоагулированные белки, которые смешивают с мезгой и высушивают на сушильной установке.
Разжиженную суспензию с сепаратора охлаждают до 50-55°С и направляют на осахаривание в течение 20-40 часов с помощью ферментов амилоглюкозидазы или плесневой амилазы. Осахаренный сироп сгущается до содержания сухих веществ 72-75%.
Выход крахмала 62 – 62,5 %. Содержание белка в крахмале составляет 0,5%.
Основными недостатками известного способа являются: недостаточная чистота и относительно невысокий выход получаемого крахмала, повышенный расход воды на процесс, большие энергозатраты. [6]
Мартин – процесс
По способу Мартина из пшеничной муки и воды замешивается густое тесто с содержанием сухих веществ 55 - 60 % в периодически действующих дежах или тестомесильных агрегатах непрерывного действия (А). После отлежки теста в бункере - отстойнике (Б) из него вымывается крахмал при температуре
воды 18 -35 0С. Для этого используют ленточные смесители, дежи с двойным шнеком и вращающиеся сита (Л). Распространенным является модифицированный ленточный смеситель, известный под названием моечной машины «Мартин».
В процессе Мартина предусмотрена стадия рафинирования крахмальной суспензии для отделения мезги, крахмала и кусочков клейковины. Эта стадия осуществляется на ситовых аппаратах (К), центрифугах (3, И) либо отстойниках. Кусочки клейковины присоединяются к основной массе клейковины и высушиваются на вальцовых или кольцевых сушилках (М).
Выход продуктов при этом составляет, %: крахмал 1 сорта - 48 – 50%, крахмал 2 сорта - 18 – 20 %, клейковина - 10 – 12 %.
Существенным недостатком этого метода является большой расход воды, на переработку 1т муки приходится 8-12 м 3 воды.
Рис. 4 Мартин - процесс:
А - непрерывная тестомесильная машина; Б - бункер - отстойник; В - моечная машина «Мартин»; Г - отжиматель воды; Д - холодильник; Е, Ж, 3 -центрифуга непрерывного действия; И - отстойная центрифуга; К, Л - сита; М -кольцевая сушилка; Н - калорифер; О - парообразователь; П - теплообменник; Р - фильтр; С - вальцовая сушилка; Т - сушилка мгновенного действия. [7]
Сравнительная экономическая оценка видов крахмалосодержащего сырья для промышленной переработки на крахмал.
Крахмал - продукт международной торговли, его стоимость на мировом рынке определяется в основном стоимостью сырья. В этой связи производство крахмала в каждой стране ориентировано на местное сырье, что диктуется также независимостью сельскохозяйственной политики каждой страны.
К 2001 году в России сложилась следующая структура переработки крахмалосодержащего сырья: 91% - кукуруза, 7 % - картофель, 1 % - пшеница, т.е. современное производство явно ориентировано на переработку импортного сырья. Переработка традиционного для России сырья – картофеля, практически прекращена, т.к. имеет существенный недостаток – носит сезонный характер (2-3 месяца в году), а следовательно обуславливает низкий коэффициент использования основных фондов. Урожаи товарной кукурузы (преимущественно в южной зоне России) незначительны, и в результате крахмалопаточные предприятия вынуждены перерабатывать импортную кукурузу, что негативно отражается на экономике производства продукции. В настоящее время общепризнанным считается, что наиболее перспективным источником для производства крахмала в России являются зерновые культуры (рожь, пшеница, ячмень). Сущность системного подхода к оценке крахмалсодержащего сырья состоит в том, чтобы учитывать не только стоимость сырья и издержки производства на его переработку, но и возможность, и целесообразность повышения ценности побочных продуктов за счет биохимической, термической и механической обработки сырья и полупродуктов в технологическом производстве крахмала. [1]
Амилолитические ферменты.
Амилазы - это ферменты, вызывающие гидролитическое расщепление крахмала. Точный состав конечного продукта можно контролировать и регулировать так, чтобы он обладал необходимыми физическими свойствами. Ферментативное расщепление крахмала в промышленных масштабах используется уже давно и в настоящее время практически заменило традиционные процессы кислотного гидролиза. Амилазы очень широко распространены в природе. Они синтезируются многими микроорганизмами (бактерии, грибы, актиномицеты, дрожжи), животными и растениями. До развития ферментной промышленности глав�ным промышленным источником получения амилаз в европейских странах было проросшее зерно (солод). Для медицинских целей амилазы получали из животного сырья. В настоящее время главным источником амилаз явля�ются микроорганизмы, особенно бактерии, грибы и реже дрожжи. [8]
1. Микробные амилазы.
К группе амилотических ферментов относятся - и -амилазы, глюкоамилаза, пуллуланаза, изоамилаза и некоторые другие ферменты. Амилазы бывают двух типов: эндо- и экзоамилазы. Четко выра�женной эндоамилазой является а-амилаза, способная к разрыву внутримо�лекулярных связей в высокополимерных цепях субстрата.
Глюкоамилаза и -амилаза являются экзоамилазами, т. е. ферментами, атакующими субстрат с нередуцирующего конца.
При изучении механизма действия амилаз имеются определенные слож�ности, и прежде всего они заключаются в том, что субстрат - крахмал неод�нороден и имеет различные характеристики по степени полимеризации гликозидной цепи и количеству ветвлений.
Реакции, катализируемые амилазами, имеют две стадии: короткую -предстационарную и длительную - стационарную. Во время первой стадии эндоамилаза быстро уменьшает молекулярную массу субстрата, образуя смесь линейных и разветвленных олигосахаридов. Второй этап реакции продолжается, пока продукты гидролиза не перестанут окрашиваться йо�дом; он протекает значительно медленнее и зависит от индивидуальных свойств фермента и его природы.
1.1 -Амилаза
Фермент -Амилаза (а-1,4-глюкан-4-глюканогидролаза, КФ 3.2.1.1.) яв�ляется эндоамилазой, вызывающей гидролитическое расщепление -1,4-гликозидных связей в амилозе, амилопектине и гликогене. а-Амилаза - водорастворимый белок, обладающий свойствами глобулина и имеющий молекулярную массу 45 000-60 000. В зависимости от вида микроорганизма свойства -амилаз могут сильно отличаться не только по механизму воздействия на субстрат и конечным продуктам, но и по оптимальным условиям для проявления максимальной активности. Действуя на целое крахмальное зерно, -амилаза атакует его, разрыхляя поверхность и образуя каналы и бороздки, т.е. как бы раскалывает зерно на части. Воздействие -амилазы приводит к резкому уменьшению вязкости крахмальных растворов.
Клейстеризованный крахмал гидролизуется ею с образованием на окрашиваемые йодом продукты - в основном состоящие из низкомоле�кулярных декстринов. Процесс гидролиза крахмала многостадийный. В результате воздействия -амилазы на первых стадиях процесса в гидролизате накапливаются декстрины, затем появляются неокрашивающиеся йо�дом тетра- и тримальтоза, которые очень медленно гидролизуются -амилазой до ди- и моносахаридов. Гидролиз амилопектина приводит к накоплению в реакционной среде низкомолекулярных разветвленных предельных -декстринов, в состав которых входят 4 и более глюкозидных остатков, соединенных -1,6-связями, а также мальтозы и глюкозы. Помимо воздействия на амилопектин и гликоген -амилаза на второй стадии гидролиза расщепляет мальтотриозы, а также осуществляет медленный гидролиз специфических связей -�предельных декстринов вблизи точек разветвления.
Разжижающие и осахаривающие -амилазы отличаются по механизм расщепления крахмала, так как продукты осахаривающей -амилазы обладают в два раза большей редуцирующей способностью по сравнению с продуктами действия разжижающих ферментов. Культуры Bacillus subtilis var. amylosacchariticus, В. subtilis Marburg и В. natto образуют осахаривающие -амилазы, В. amyloliquefaciens продуцирует большое количество разжижающей -амилазы.
-Амилазы обычно стабильны в интервале рН от 5,5 до 8,0, а также при экстремальных значениях рН в присутствии кальция. Наивысшая активность проявляется при рН 4,8-6,5. Однако формы кривой рН - активности, а также абсолютная величина оптимума рН ферментов различного происхождения не одинаковы. Высокоочишенные препараты -амплазы быстро теряют активность при температуре выше 50°С, но в присутствии кальция инактивация может замедляться. В присутствии кальция они вполне устойчивы к экстремальным значениям температуры и рН, обработке мочевиной, кислотой и воздействию протеаз. Тяжелые металлы, такие, как медь, ртуть, серебро и свинец, ингибируют -амилазы.
Разжижение - процесс дисперсии нерастворимых гранул крахмала в водном растворе протекает при частичном гидролизе полисахарида с использованием термостабильной амилазы. Крахмальные гранулы нерастворимы, но при нагревании в водном растворе они набухают, разрушаются и крахмал диспергирует. Температура полной дисперсии для клейстеризации большинства крахмалов составляет 105 – 110 оС. В промышленных процессах разжижения крахмальная суспензия обычно имеет концентрацию 35 %, в процессе клейстеризации вязкость стремительно растет. Термостабильная -амилаза используется в качестве разжижающего агента, который уменьшает вязкость и частично гидролизует крахмал. Таким образом, при последующем охлаждении исключается возможность спонтанного осаждения крахмала. Традиционно в качестве разжижающего агента в технологии крахмала использовалась соляная или щавелевая кислоты (процесс вели при рН 2,0 и температуре 140 - 150°С в течение 5 мин). При использовании термостабильной -амилазы условия процесса смягчаются, в результате снижается образование побочных продуктов и получается более чистый продукт с меньшей стоимостью. Широко используются в технологических процессах обработки крахмала два вида термостабильной -амилазы: амилаза В. amyloliquefaciens и амилаза В. licheniformis.
Термолабильные -амилазы используются в качестве фермента, осахаривающего предварительно разжиженный крахмал. Эти ферменты недостаточно термостабильны для того, чтобы их можно было использовать в процессах разжижения, однако они обладают большей гидролитической активностью, чем разжижающие ферменты. Получаемый продукт содержит большие количества мальтозы. Применяемый в промышленном производстве крахмалопродуктов фермент получают из штаммов культуры A. oryzae. Оптимальные значения температуры и рН для этого фермента равны 55 оС и 4,7, и они значительно ниже, чем для термостабильных ферменов.
-Амилаза, найденная в культуральной жидкости Streptomyces ргаесох, привлекает внимание тем, что единственным продуктом расщепления крахмала является мальтоза. В отличие от -амилазы, которая гидролизует -1,4-эндоглюкозидные связи, этот фермент образует мальтозу из мальтотриозы без образования глюкозы.
Механизм действия -амилаз зависит от специфических свойств ферментов и условий гидролиза.
Возможные варианты действия -амилаз на молекулярном уровне можно установить при полном теоретическом анализе различных способов воздействия амилаз на субстрат: многоцепочечный, одноцепочечный и комбинированный способы.
По многоцепочечному способу молекула фер�мента в случайном порядке атакует одну из полисахаридных цепей, отщепляет от нее звено (мономер или димер) и затем также в случайном порядке атакует следующие цепи, в том числе, возможно, и атакованную ранее. Таким образом, за время существования фермент-субстратного комплекса происходит только один каталитический акт.
По одноцепочечному способу молекула фермен�та, атаковав в случайном порядке одну из полисахаридных цепей, последовательно отщепляет от нее звенья до тех пор, пока цепь полностью распадется. Лишь после этого фермент атакует следующие цепи. За время существования одного фермент-суб�стратного комплекса гидролизуются все доступные для фермента связи.
Комбинированный способ, или способ мно�жественной атаки, заключается в том, что за время су�ществования одного фермент-субстратного комплекса гидролизуется несколько связей. При этом после отщепления одного звена от цепи фермент не отталкивается, а задерживается. Атака про�исходит с чередованием одно-_и многоцепочечного способов.
Фермент может переключаться с одного механизма действия на другой в зависимости от условий эксперимента, и при этом могут наблюдаться комбинации нескольких механизмов. Степень участия -амилаз в различных механизмах каталитического расщепления прежде всего зависит от длины цепи субстрата. [9]
1.2 -Амилаза.
-Амилаза (-1,4-глюкан мальтогидролаза, КФ 3.2.1.2) - активный белок, обладающий свойст�вами альбумина. Представляет собой экзофермент концевого дей�ствия, проявляющий срод�ство к предпоследней -1,4-связи с нередуцирующего конца линейного участка амилозы и амилопектина. В отличие от -амилазы -амилаза практически не гидролизует нативный крахмал, тогда как клейстеризованный крахмал гидро�лизуется ею с образованием мальтозы -конфигурации, поэтому данная амилаза по аналогии с -амилазой на�зывается -амилазой. Если гидролизу подвергается амилоза, то гидролиз идет полностью до мальтозы. Если субстратом для -амилазы служит амилопектин, то гидролиз идет в значительно меньшей степени. -Амилаза отщепляет фрагмент с не�редуцирующего конца участка от внешних линейных ветвей, имеющих по 20-26 глюкозных остатков, с образованием 10—12 молекул мальтозы. Гид�ролиз приостанавливается на предпоследней -1,4-связи, граничащей с -1,6-связью. В гидролизате накапливается 54-58% мальтозы, остальное составляют высокомолекулярные декстрины, содержащие значи�тельное количество а-1,6-связей - так называемые -декстрины. -Амилазы проявляют большую стабильность в отсутствие ионов Са2+. Молекулярная масса -амилазы растений достаточно высока, она составля�ет от 50 000 до 200 000. Фермент чувствителен к действию тяжелых метал�лов. Считается, что -амилаза обладает высокой спо�собностью к множествен�ной атаке субстрата. Для амилозы средней молеку�лярной массы в одном при�соединении фермента к суб�страту возможно отщепле�ние до четырех остатков мальтозы. При увеличении молекулярной массы суб�страта возможно и большее количество мест атаки. [9]
1.3 Глюкоамилаза
. Глюкоамилаза (а-1,4-глюкан глюкогидролаза, КФ 3.2.1.3.) широко распространена в природе. Она синтезируется многими ми�кроорганизмами и образуется в животных тканях, особенно в печени, почках, плаценте кишечника и т. д. Фермент в литературе известен под различ�ными названиями: амилоглюкозидаза, -амилаза, лизосомальная -глюкозидаза, кислая мальтаза, матулаза и экзо-1,4--глюкозидаза.
Глюкоамилаза катализирует последовательное отщепление концевых остатков -D-глюкозы с нередуцирующих концов субстрата. Это фермент с экзогенным механизмом воздействия на субстрат. Многие глюкоамилазы обладают способностью так же быстро, как и -1,4-связь, гидролизовать -1,6-глюкозидные связи. Но это происходит только в том случае, когда за -1,6-связью следует -1,4-связь, поэтому декстран ими не гидролизуется. От�личительной особенностью глюкоамилаз является способность в десятки раз быстрее гидролизовать высокополимеризованный субстрат, чем олиго-и дисахариды.
Почти все глюкоамилазы являются гликопротеидами, содержащими от 5 до 35% углеводов, которые состоят из олиго-, ди- и моносахаридов. Угле�водный компонент может быть целостным фрагментом или же разбитым на индивидуальные соединения, которые прикрепляются к белку через трео�нин и серин. Например, у глюкоамилазы A. niger их 20. Большинство из�вестных глюкоамилаз имеет оптимум рН при 4,5-5,2, реже - при 5,7-6,0, в основном для дрожжевых глюкоамилаз.
РН-стабильность микробных глюкоамилаз лежит в широком диапазоне -от 2,5 до 9. Термостабильность глюкоамилаз лежит в интервале от 30 до 45°С и редко повышается до 55-60°С. Глюкоамилазы различного происхо�ждения заметно отличаются по молекулярной массе, которая, по данным различных авторов, имеет значения от 48 000 до 210 000. Следует заме�тить, что далеко не все микробные глюкоамилазы способы полностью гид�ролизовать крахмал до глюкозы. Еще в 60-х годах И.Фукумото предложил все микробные глюкоамилазы разделить на два типа:
- полностью гидро�лизующие крахмал до глюкозы и
- гидролизующие крахмал до глюкозы на 80-85%.
В то время предполагалось, что степень гидролиза зависит только от свойств глюкоамилаз и их происхождения. Позже было показа�но, что при росте культуры параллельно накапливаются и другие амилоли�тические ферменты, обладающие не только гидролитическим, но и трансферазным действием. Это гликозилтрансфераза и -амилаза. Даже в слу�чае, если система открытая и продукт гидролиза (глюкоза) постоянно уда�ляется из системы, процесс может дойти до полного гидроли�за крахмала до глюкозы. Если же система закрытая и концентрация суб�страта велика, то при достижении определенной концентрации глюкозы в реакционной среде в результате переноса глюкозильных остатков на глю�козу, ди- и олигосахариды начинают накапливаться изомальтоза, паноза, нигероза, изомальтотриоза и другие сахара, которые имеют горький вкус. В результате процесс не может дойти до полного превращения крахмала в глюкозу и возникает ошибочное представление, что глюкоамилаза не пол�ностью гидролизует крахмал. Сама же глюкоамилаза может проявлять не�большую трансферазную активность, но только при концентрации глюко�зы свыше 60-70%. Поэтому ранее принятое деление глюкоамилаз на два типа следует считать необоснованным. [9]
1.4 Декстриназы
К этой группе ферментов относятся амилазы, способные гидролизовать -1,6-глюкозидные связи в амилопектине, гликогене и других субстратах. Группу ферментов, объединенных под общим названием декстриназы или дебранчинг-ферменты, можно разделить на две подгруппы: истинные и условные (косвенные) декстриназы.
Истинные декстриназы гидролизуют -1,6-глюкозидные связи в немодифицированном амилопектине и гликогене; таким образом, в образовании фермент-субстратного комплекса участвуют фрагменты цепочки различной длины. Истинные декстриназы классифицируются на пуллулуназы и изоамилазы по принципу субстратной специфичности. Пуллулуназа катализирует гидролиз -1,6-глюкозидных связей в пуллулане, амилопектине, гликогене и в предельных декстринах, полученных при гидролизе амилопектина и гликогена - и -амилазами. Изоамилаза гидролизует -1,6-глюкозидные связи в точках разветвления молекул гликогена, амилопектина и -предельных декстринов.
При совместном действии пуллуланазы и -амилазы происходит почти полная конверсия амилопектина и гликогена до мальтозы, что доказывает способность пуллуланазы отщеплять от предельных декстринов фрагменты, состоящие из двух – трех глюкозных остатков.
Причем при совместном действии пуллуланазы и -амилазы на клейстерризованный крахмал выход мальтозы составляет 90%. Высокомальтозные сиропы получают и зи растворимого крахмала с использованием пуллуланазы одновременно с - или грибной -амилазой (выход мальтозы 88-90%).
1.4 -Глюкозидаза
-Глюкозидаза (КФ 3.2.1.20, -D-глюкозидглюкогидролаза) катализирует гидролиз -1,4-связей с нередуцирующего конца субстрата, отщепляя глюкозу. Она быстро гидролизует дисахариды и олигосахариды относительно больших размеров. [9]
2. Иммобилизоване амилазы
Иммобилизованные ферменты – это единая система, которая состоит из трех частей: фермента, носителя и связующего их звена. Все носители подразделяются на органические и неорганические. Органические полимерные носители в свою очередь делятся на:
- природные – полисахаридные (целлюлоза, аргароза, губчатый крахмал, хитин);
- природные – белковые;
- синтетические полимерные носители (полиакриламид).
Неорганические носители: синтетические кремнеземные сорбенты, металлы и их окислы, глина, керамика, природные минералы.
В качестве сшивающего агента может выступать глутаровый альдегид, изоцианиды, ненасыщенные сульфоны и т.д.
Иммобилизованные ферменты обладают множеством преимуществ по сравнению с обычными ферментными препаратами. К ним относятся: непрерывность процесса, регенерация и повторное применение, повышенная стабильность, усиление кинетических свойств, отсутствие примесей фермента в готовом продукте, возможность более строгого контроля каталитического процесса, более низкая стоимость, возможность использования мультиэнзимных систем.
Стоимость носителя и стабильность конечного иммобилизованного фермента - вот два критерия, которые учитываются при выборе метода иммобилизации.
Иммобилизованная -амилаза мало используется в промышленности, что связано как с техническими причинами, так и с тем, что препараты растворимого фермента имеют низкую стоимость. Поскольку фермент сохраняет активность в течение короткого времени, а иммобилизация связана с дополнительными затратами на носитель и закрепление фермента, то вызывает сомнение эффективность использования иммобилизованной -амилазы. К тому же, что более важно, рассматриваемый фермент разрушает крупные молекулы на начальных стадиях гидролитического процесса, и доступность активного центра для субстрата ограничивается. В результате этого активность иммобилизованной -амилазы оказывается значительно ниже, чем растворимой формы фермента. Замена растворимой -амилазы на иммобилизованную привела бы к усложнению процесса разжижения крахмала и снижению его эффективности. [8]
Ферментативный гидролиз крахмала.
Химизм гидролиза.
Независимо от природы катализатора при разрыве каждой -1,4- и -1,6-глюкозидной связи в крахмале по месту разрыва присоединяется молекула воды:
Исследования по гидролизу крахмала амилазами в Н2О (с меченым кислородом) показали, что они катализируют разрыв глюкозидных связей между С1 и О. В амилозе при разрыве -1,4-глюкозидной связи гидроксил воды присоединяется к пер�вому углеродному атому левого остатка глюкозы, образуя альдегидную группу в скрытой (полуацетальной) форме, водород воды присоединяется к кислороду глюкозидной связи при четвертом углеродном атоме правого остатка глюкозы. Гидролиз амилопектина в точке ветвления (а- 1,6-глюкозидной связи) сопровождает�ся присоединением гидроксила воды также к первому углеродно�му атому, а водорода воды — к шестому углеродному атому.
В пределе — при разрыве всех глюкозидных связей — присо�единяется п— 1 молекул воды (где п — число глюкозных остатков в макромолекулах амилозы и амилопектина) и образу�ется п молекул глюкозы. Так как п очень велико, то числовое значение n—1 будет практически пренебрежимо мало отличаться от n и реакция гидролиза может быть выражена уравнением:
(C6H10O5) n + n H2O = n C6H12O6.
Или применительно к одному глюкозному остатку:
C6H10O5 + H2O = C6H12O6.
162 18 180
Отсюда теоретический выход глюкозы в процессе гидролиза составляет 111,11 % к массе крахмала. [12]
Кинетика гидролиза крахмала.
Механизм действия всех ферментов основан на образовании неустойчивых промежуточных соединений — комплексов из реа�гирующих молекул субстрата и активных центров ферментов. При этом в реагирующих молекулах происходит деформация, обеспечивающая вступление их в реакцию. После реакции фер�мент и химически измененный субстрат отталкиваются один от другого и фермент может реагировать с новой молекулой суб�страта. Все сказанное можно представить в виде следующей схемы:
K1
S + E ES (1)
K -1
K2
ES P + E (2)
Скоростью химической реакции V называют первую производ�ную от концентрации любого из исходных веществ или конечных продуктов реакции во времени . Таким образом уравнение для скорости ферментативной реакции (уравнение Михаэлиса-Ментен) имеет вид:
V = dP/ d = - dS/ d = (K2 E0 S) / (KM + S), (3)
где V – скорость ферментативной реакции,
S, P – концентрации субстрата и продукта соответственно,
E0 – начальная концентрация фермента,
K2 – константа скорости образования продукта из фермент-субстратного комплекса,
KM – константа Михаэлиса, KM = (K -1 + K2) / K1 ,
где K -1 , K1 , K2 - константы скоростей реакций, соответствующих схеме (1).
Фермент дозируется в зависимости от такой величины как единицы активности.
Единица активности - это такое количество фермента, которое при 30 оС за 1 минуту превращает 1 микромоль субстрата в продукт. Скорость реакции зависит еще от концентрации субстрата и величины рН. Для каждого фермента эти стандартные условия его "дозирования" заранее определены. Таким образом, количество фермента определяется по кинетике модельной реакции, и точное определение приходящейся на единицу активности массы фермента обычно неизвестно. Можно определить лишь концентрацию фермента в единице массы или объема вещества, проявляющего ферментативную активность, в ед. г или ед. мл.
В Уравнении (3) произведение K2 E0 можно заменить на V max .
В результате получается принятый в ферментативной кинетике вид уравнения:
V = V max S / (K м +S) (4)
Для определения констант V max и K м используют координаты Лайнувера и Бэка:
1/ V = K м / (V max S) + 1/ V max
при 1/ V =0 1/ S = - 1/ K м
при 1/ S = 0 1/ V = 1/ V max
Рис. 5 Определение коэффициентов уравнения методом Лайнуивера и Бэрка (двойных обратных координат).
Другой вариант – координаты Корниш – Боудена (V и V/S):
V = V max - K м V/S
при V/S = 0 V = V max
при V = 0 V/S = V max / K м
Рис. 6 Определение коэффициентов уравнения методом Корниш – Боудена.
Кинетика гидролиза крахмала зависит в основном от актив�ности и концентрации ферментов, температуры и концентрации водородных ионов.
Ряд условий может подавлять эффективность действия ферментов или снижать скорость ферментативной реакции. Кроме того, существует большое количество специфических ингибиторов, действующих различным образом.
В ферментативной кинетике кроме уравнения Михаэлиса - Мэнтен существуют уравнения, учитывающие ингибирование субстратом:
V = V max S/ (K м +S + S2/ Ki) , (5)
где Ki - константа ингибирования.
Конкурентное и неконкурентное ингибирование вторым субстратом описывается уравнениями:
V = V max S1/ (K м +S1 + S2/ Ki) (конкурентное); (6)
V = (V max S1 / ( K 1 +S1)) (1/(1+ S2/ K2 )) (неконкурентное), (7)
где K 1 – константа Михаэлиса по субстрату S1,
K2 – константа ингибирования по субстрату S2 .
Конкурентное торможение.
Немногие ферменты являются строго специфичными относительно субстрата, тогда как большинство их обладает сродством к целым классам родственных соединений. Пусть имеется два вещества (S и I), которые могут связываться с одним и тем же активным центром фермента Е, но один из образующихся комплексов (ЕI) является неактивным. Таким образом, наличие вещества I подавляет реакцию фермента с субстратом S и является тем самым ингибитором процесса. Такой случай, при котором образуется активный комплекс ES и неактивный EI, но не образуется третичный комплекс ESI, называется конкурентным торможением.
Неконкурентное торможение.
При неконкурентном угнетении ингибитор может равным образом реагировать как со свободным ферментом, так и с фермент-субстратным комплексом, при этом как EI, так и ESI являются неактивными. Поскольку ингибитор атакует молекулу фермента, то эффект угнетения не будет зависеть от концентрации субстрата, а на него будет оказывать влияние лишь концентрация ингибитора. В некотором отношении эти ингибиторы можно рассматривать как яды ферментов, и часто они представляют собой простые неорганические ионы, которые инактивируют активные центры.
Угнетение избытком субстрата.
При рассмотрении идеальной молекулы фермента предполагают, что все активные центры обладают одинаковым сродством к молекулам “натурального” субстрата и это может означать, что каждый центр взаимодействует с одной молекулой субстрата. В ряде случаев, очевидно, действует более сложный механизм, поскольку обнаруживается, что скорость реакции возрастает до максимальной при определенном соотношении субстрата и фермента, а затем резко падает при дальнейшем повышении концентрации субстрата. Существует несколько объяснений этого эффекта насыщения. Одно из них заключается в том, что поскольку каждый участок может легко связываться с одной молекулой субстрата и образовывать активный комплекс, то при более высоких концентрациях субстрата он может взаимодействовать с двумя и большим количеством молекул, экранируя функциональные группы фермента, которые необходимы для проявления высокой активности.
Эффект угнетения можно проиллюстрировать путем сопоставления графиков угнетаемой и неугнетаемой реакций, катализируемых одним и тем же ферментом. Метод, предложенный Лайнуивером и Бэрком, дает возможность полупить зависимость для неконкурентного типа угнетения, показанную на рис. 7, где видно, что обе кривые пересекают ось абсцисс в точке, которая соответствует обратной величине константы Михаэлиса.
Рис. 7 График, составленный по методу Лайнуивера – Бэрка для сравнения ингибируемых и неингибируемых ферментативных реакций.
Конкурентное и неконкурентное ингибирование продуктом реакции выражается соотношениями:
V = V max S/ (K s +S + P/ Kp) (конкурентное); (8)
V = V max S/ (K s +S ) (1 + P/ Kp) (неконкурентное), (9)
где K s – константа Михаэлиса по субстрату,
Kp – константа ингибирования по продукту.
Подобно кинетике микробиологических процессов в ферментативной кинетике учитывается влияние температуры и величины рН на скорость реакции. [11]
Температура.
С повышением температуры увеличивается реак�ционная способность молекул субстрата как вследствие возраста�ния кинетической энергии, так и вследствие поднятия электро�нов на орбиту с более высоким энергетическим уровнем.
Зависимость константы скорости химической реакции от тем�пературы выражается уравнением Аррениуса:
d lnk/ dT = / (RT2 ) , (10)
где k – константа скорости реакции;
R- универсальная газовая постоянная, равная 8,3134 кДж/(моль К);
Т – абсолютная температура, К;
– энергия активации, кДж/ кмоль-1.
После интегрирования этого уравнения в пределах от Т1 до Т2 получаем уравнение:
= (( lnk1 – lnk2)RT1T2)/ (T1 – T2), (11)
где k1 и k2 – константы скорости соответственно при температуре Т1 и Т2 .
По этому уравнению и известным из опыта кинетическим кон�стантам можно вычислить энергию активации, которая для фер�ментативного гидролиза крахмала (при величине ее, принятой в первые стадии гидролиза) оказалась равной около 45 кДжкмоль-1 (для кислотного гидролиза—около 130 кДжкмоль-1 ).
Влияние температуры на скорость химической реакции выра�жается также средним температурным коэффициентом Q10, представляющим собой отношение кинетических констант при температуре t+10 и t°С:
Q10 = kt + 10 / kt , (12)
Ниже приведены значения Q 10 для амилазы (по исследованиям А. Г. Забродского и В. А. Витковской).
|
Температурный интервал, 0С
|
Q10
|
|
25-35
|
1,67
|
|
35-45
|
1,35
|
|
40-50
|
1,30
|
|
45-55
|
0,90
|
|
50-60
|
0,58
|
При Q10>1 скорость реакции с повышением температуры воз�растает, при Q10<1 — убывает, при Q10 = 1 —остается без изме�нения. Температура, соответствующая максимальной скорости реакции, называется оптимальной для действия фермента.
Концентрация водородных ионов.
Этот фактор может оказать на активность ферментов многостороннее действие: изменять ионизацию активного центра, степень стабильности третичной структуры белка и т. д. Существует определенное значение рН, при котором скорость амилолиза оптимальна.
Оптимальное значение рН для действия амилаз зависит от температуры:
|
Температура, 0С
|
20
|
40
|
50
|
55
|
60
|
65
|
70
|
|
Оптимум рН:
для разжижения
для осахаривания
|
-
4,5
|
4,7
4,6
|
4,8
4,8
|
5,0
4,9
|
5,3
5,1
|
5,6
5,6
|
-
5,9
|
Аналогично ферментации можно учитывать инактивацию продукта P:
V = V(S,P) - KP . (13)
Есть особенность ферментативных реакций, связанная с деградацией самого фермента. При выводе уравнения Михаэлиса - Ментен эту особенность не учитывали. Но фермент - вещество лабильное, и оно подвергается старению и разложению.
Деградацию можно учитывать по выражению:
d Vmax / dt = -k Vmax , (14)
где k – константа скорости деградации фермента.
Возможны и другие варианты кинетики деградации фермента:
d Vmax / dt = -K Vmax S; (15)
d Vmax / dt = K1 Vmax (1/ (1 + S/K2)), (16)
где K1 и K2 - кинетические константы.
Процессы биокатализа и биотрансформации могут быть периодическими, непрерывными, с подпиткой субстратом и с подпиткой ферментом.
Вместо очищенных ферментов в них могут использоваться ферменты, имеющие примеси, и даже убитые или неразмножающиеся клетки, сохранившие ферментативную активность.
Уравнения кинетики позволяют проводить расчет и оптимизацию подобных процессов.
Следует обратить внимание на одну важную особенность биокаталитических процессов. Условия, оптимальные для биокатализа (основного процесса), могут быть неоптимальны в отношении старения фермента. Например, низкая температура хороша для предотвращения старения, но замедляет ход самого процесса биокатализа и биотрансформации.
То же и с величиной рН- значения оптимумов для процесса биокатализа и для предотвращения старения фермента могут различаться. [12]
В заключении этого раздела рассмотрим преимущества и недостатки биокаталитических процессов по сравнению с химическими.
Недостатки:
- Для получения чистого продукта нужен и чистый фермент, а его выделение очень дорого.
- в выходящем из реактора продукте сохраняется фермент, который продолжает действовать.
- Дорогостоящий фермент используется только однократно.
- Свободный фермент быстро инактивируется, т.е. разрушается.
- в отличие от биомассы, которая самовоспроизводится в процессе непрерывной ферментации, фермент в непрерывном процессе нужно все время вводить, т.к. он вымывается с продуктом реакции.
Преимущества:
- Каталитическая активность ферментов высокоспецифична и ограничивается одним типом реакции, так что не происходит побочных реакций.
- Ферменты могут сразу атаковывать исходную молекулу и осуществлять превращение, для которого потребовалось бы несколько вспомогательных много ступенчатых химических синтезов.
- Химические преобразования вещества упрощаются – одна или две ступени вместо много ступенчатого синтеза.
- Ферментативные реакции могут протекать с большой скоростью в мягких условиях. [11]
Исследование амилаз продуцентов биологически активных веществ.
Продуцент аминокислоты лизина не вырабатывает собственных амилолитических ферментов, поэтом крахмал должен пройти предварительный гидролиз с помощью технологических методов.
Микробиологический синтез лизина осуществляют мутантные штаммы бактерии, относящиеся к родам Corynebacterium и Brevibacterium. Как правило, они проявляют дефицит к одной из аминокислот: гомосерину, треонин, изолейцину, метионину или их сочетанию, а также биотину и тиамину. Лизин синтезируется, в основном, из аспарагиновой кислоты. Помимо этого пути эукариотные организмы имеют еще один путь синтеза лизина - через .-аминоадипиновую кислоту. В соответствии со схемой для биосинтеза лизина и его накопления необходимо создать такие условия, при которых будет ограничен синтез аланина, глутаминовой и молочной кислот, но интенсифицирован синтез аспарагиновой кислоты. Биохимический механизм регуляции синтеза лизина основан на принципе отрицательной обратной связи. Согласно этому принципу, как известно, избыток конечного продукта реакции ингибирует собственный синтез. Узловым ферментом в синтезе лизина является аспартаткиназа. Угнетают ее активность лизин и треонин при их совместном действии, так как аспартаткиназа представляет собой мультивалентный фермент.
Аминокислоты, необходимые для роста микроорганизмов, вносят со средой. Их количество должно контролироваться, чтобы не были созданы условия, при которых аминокислоты выступают в качестве регуляторов процесса. Одним из компонентов среды, оказывающим влияние на ход биосинтеза аминокислот, является фосфор (в виде фосфата). Так, при увеличении оптимальной для накопления лизина концентрации фосфора в десять раз количество лизина снижается на 40%, а содержание других аминокислот, особенно валина, значительно увеличиваются.
При изучении механизмов регуляции образования целевых продуктов преимущественное внимание обычно обращают на конечные этапы биосинтеза. Но важно знать и весь путь биосинтеза с точки зрения оценки ферментативной активности всех реально функционирующих систем. Интерес может представлять соотношение количеств глюкозы, включающихся в обмен по фруктозобисфосфатному пути или через гексозомонофосфатный путь. Последний путь способен обеспечить процесс большим количеством восстановленной формы никотинамиддинуклеотид(фосфата)а, а также синтез продуктов, образующихся через шикимовую кислоту.
Применительно к механизму синтеза лизина несомненный интерес имеет функция цикла трикарбоновых кислот. Известно, что синтез лизина проходит через ЦТК, далее - через аспарагиновую кислоту после аминирования щавелевоуксусной и ее фосфорилированное производное. Поэтому вполне закономерен вопрос о коррелятивных взаимоотношениях величин активности ферментов брожения, ЦТК и синтезом лизина. В непосредственной связи с этим вопросом находится представление о влиянии концентрации углерода на синтез лизина. Показано, что при увеличении концентрации углеводов в среде в культуре Brevibacterium sр.выше некоторой эмпирически установленной оптимальной величины, удлиняется лаг-фаза, увеличивается удельная скорость роста в экспоненциальной фазе, но снижается выход лизина и изменяется активность ферментов пути Эмбдена - Мейергофа -Парнаса и ЦТК. Следует отметить, что оптимальная для синтеза лизина концентрация углеводов не является постоянной. Она зависит от многих показателей, в том числе от интенсивности перемешивания среды. [13]
Возможные источники углерода в питательных средах для продуцентов L-лизина.
Микробиологический синтез лизина осуществляют мутантные штаммы бактерий, относящиеся к родам Corynebacterium и Brevibacterium.
Весьма сложная взаимосвязь между микроорганизмами, средой и условиями культивирования определяет требования продуцентов к источникам углерода. Степень удовлетворения этих требований во многом обусловливает эффективность микробиологического синтеза.
Углеводы относятся к наиболее доступным для микроорганиз�мов источникам углерода. При выращивании микроорганизмов на синтетической среде чаще всего применяют глюкозу или сахарозу. Однако доступность углеводов не всегда обеспечи�вает желаемый результат направленного биосинтеза. Отношение бактерий — продуцентов аминокислот к некоторым углеводам и соответствующие изменения биосинте�тической активности в присутствии этих соединений представ�лены в табл. 4. Можно привести множество примеров, свидетельствующих о том, что максимальная спо�собность микроорганизма ассимилировать тот или иной угле�вод не совпадает с максимальной интенсивностью биосинтеза.
Табл. 4. Использование разных моносахаров продуцентом L-лизина Brevibacterium sp.
|
Источник
углерода
(конц. 7,6%)
|
Лизин,
г/л
|
Биомасса,
г/л
|
Ассимили�рованный сахар, %
|
Выход лизина, % от ассимили�рованного сахара
|
Удельная активность биомассы,
г лизина
г биомассы
|
|
Галактоза
|
1,0
|
2,0
|
0,7
|
1,3
|
0,5
|
|
Глюкоза
|
22,0
|
15,2
|
7,0
|
29,0
|
1,45
|
|
Ксилоза
|
3,5
|
5,2
|
2,5
|
5,3
|
0,77
|
|
Манноза
|
6,0
|
9,3
|
4,5
|
8,0
|
0,64
|
|
Рамноза
|
2,0
|
3,6
|
1,3
|
2,7
|
0,55
|
|
Арабиноза
|
Следы
|
1,0
|
0,7
|
-
|
-
|
При культивировании продуцента лизина на питательной среде из смеси глюкозы, рамнозы, ксилозы, галактозы и маннозы наблюдается определенная последовательность ассимиляции моносахаров. В первую очередь ассимилируется глюкоза. Когда ее остаток в среде приближается к концентрации 0,6% культура начинает утилизировать ксилозу и маннозу. Манноза ассимилируется полностью, ксилоза — на 60—75% ее перво�начальной концентрации. Последними ассимилируются рамноза и галактоза, причем не полностью.
Современная микробиологическая промышленность требует более доступных и дешевых источников углерода. В настоящее время сравнительно редко используют чистые сахара, чаще применяют многокомпонентные отходы пищевой, сахарно-крахмальной или дрожжевой промышленности, а также гидролизаты полисахаридов.
Меласса — отход производства свекловичного или тростникового сахара — является одним из самых распространенных видов сырья для микробного синтеза. Хотя меласса в основном при�меняется для кормовых целей, ее широко используют также в тех�нической микробиологии.
Меласса характеризуется и высоким содержанием редуцирующих веществ (РВ) — 48-55%, из которых преобладает сахароза — 43—49% от объема. Кроме сахаров в мелассе содержатся другие компоненты: коллоиды, органические кислоты, белки, аминокислоты, витамины, минеральные вещества (табл. 5-6 ). Из нелетучих органических кислот могут присутство�вать, %: лимонная — 0,01—0,5, глюконовая — 0,5—1,0, яблоч�ная — 0,1—0,5, янтарная — 0,1—0,7.
Таблица №5. Общая характеристика свекловичной мелассы.
|
Показатели
|
Содержание, %
|
|
|
минимальное
|
максимальное
|
среднее
|
|
Сухие вещества
|
61
|
86
|
75-77
|
|
Сахароза
|
40
|
55
|
45
|
|
Инвертный сахар
|
0,1
|
10
|
0,5-1,2
|
|
Сбраживаемые сахара
|
43
|
57
|
46-48
|
|
Коллоиды
|
1,5
|
4,6
|
3-4
|
|
Зола
|
4
|
10
|
6,6-7,5
|
|
K2O
|
1,0
|
5,5
|
2,5-3,5
|
|
MgO
|
0,001
|
1,0
|
0,1-0,24
|
|
CaO
|
0,1
|
2,0
|
0,5-0,8
|
|
Азот:
общий
аминный (после гидролиза)
|
0,1
0,3
|
0,5
0,8
|
0,2-0,35
0,5-0,6
|
Таблица № 6. Аминокислотный состав мелассы.
|
Аминокислота
|
мг/ 100 г сух. в-в
|
Аминокислота
|
мг/ 100 г сух. в-в
|
|
Лизин
|
41
|
Аланин
|
118
|
|
Гистидин
|
24
|
Цистин
|
Следы
|
|
Аргинин
|
26
|
Валин
|
89
|
|
Аспарагиновая кислота
|
251
|
Метионин
|
120
|
|
Треонин
|
41
|
Изолейцин
|
13
|
|
Серин
|
101
|
Лейцин
|
120
|
|
Глутаминовая кислота
|
2534
|
Тирозин
|
89
|
|
Пролин
|
103
|
Фенилаланин
|
35
|
|
Глицин
|
117
|
|
|
В золе свекловичной мелассы много кальция, магния, железа, но относительно мало фосфора. Состав мелассы изменяется в ши�роком диапазоне, в некоторой степени даже при хранении; он зави�сит от климатических и почвенных условий выращивания сахарной свеклы, времени ее уборки (поздние сроки уборки отрицательно влияют на качество), технологии переработки, условий транспор�тировки. Меласса широко применяется в производстве спирта, дрожжей, органических кислот, аминокислот и других продуктов.
Диффузионный сок сахарной свеклы. В некоторых случаях при микробном синтезе целесообразно использовать натуральный или упаренный диффузионный сок — полуфабрикат сахарного произ�водства. Химический состав диффузионного сока, %: сухие вещества — 14—17, РВ — 9—15, зола — 0,5—0,7, общий азот --0,12—0,24. Общее количество аминокислот (после гидролиза бел�ковых веществ) составляет 1,7—2,5 г/л, в том числе: L-треонин — 170—200 мг/л, L-метионин — 28—32 мг/л. Из витаминов в диффу�зионном соке содержатся, мкг/л: биотин — 10—20, пантотеновая кислота — 5000—8000. Лизинсинтезирующий мутант Brevibacterium flavum на питательной среде с диффузионным соком (10% по со�держанию сахарозы) обеспечивает уровень накопления внеклеточ�ного лизина 35—40 г/л, что соответствует уровню биосинтеза лизина данным продуцентом на мелассной среде.
Рафинадная патока. Это отход свекловичного производства сахара-рафинада, представляющий собой густую вязкую коричне�вую жидкость, сладкую на вкус с горьким привкусом, содержащую не менее 72% сухих веществ. Сахарозы содержится не менее 49%. Рафинадная патока по сравнению со свекловичной мелассой имеет большую доброкачественность, содержит вдвое меньше красящих веществ, меньше коллоидов (1,3—3,0%), золы (3—4%), общего азота (0,25%) и больше инвертного сахара (10—20%) и витаминов. Рафинадную патоку используют для микробного синтеза молочной кислоты.
Гидрол – отход производства глюкозы из гидролизатов крахмала или гидролизатов целлюлозы. Под названием “гидрол” или “патока” известно несколько отличающихся по своему составу субстратов. Гидрол – отход производства глюкозы из кукурузного крахмала – содержит до 77% сухих веществ, в том числе около 50% сбраживаемых сахаров (главным образом глюкозу), 6-8% золы, а также органические кислоты. Гидрол – отход производства глюкозы из соляно-кислых гидролизатов древесины – содержит 65-67% сухих веществ, в том числе 38-45% РВ. Состав редуцирующих веществ ( в % от их суммарного количества): глюкоза – 65, манноза – 1,2, ксилоза – 25, несахара – 8,7. Из минеральных веществ доминируют хлористый натрий (11% от золы), соли калия, фосфора и кальция. При использовании древесных гидролизатов в качестве источника углерода для микробного синтеза L-лизина можно получить 12-15 г/л биомассы, 17-20 г/л лизина; коэффициент конверсии в пределах 27-30%. Известны также и другие технические продукты, представляющие собой отходы производства глюкозы из картофельного или пшеничного крахмала, целлюлозы или других сахаров, содержащие глюкозу и именуемые гидролом или патокой.
Сульфитный щелок является отходом целлюлозно-бумажного производства, в нем содержится сравнительно мало сахаров (~3,5%), в том числе манноза, галактоза, глюкоза и арабиноза; пентозы представлены в основном ксилозой и арабинозой. В про�изводстве дрожжей все сахара питательного субстрата делятся на сбраживаемые (на спирт и С02) и несбраживаемые. В сухих ве�ществах щелока содержится 65—75% сбраживаемых сахаров, остальную часть составляет лигносульфитный комплекс, в состав которого входят также кальциевые соли, танины и зола. Щелок содержит также летучие кислоты.
Барда. При производстве спирта из крахмалсодсодержащего сырья или мелассы только 30—33% углеводов перерабатывается в спирт, столько же переходит в углекислоту и биомассу дрожжей, осталь�ные 30—35% почти полностью поступают в отходы — зерново-картофельную или мелассную барду. Мелассная барда содержит 8—9% сухих веществ, в том числе 1,2—1,5% дрожжевых клеток, погибших при переработке (перегонке) спирта. В состав барды входят моно- и дисахариды, карбоновые кислоты, спирты, амино�кислоты, органические и неорганические азотистые соединения, соли К, Mg, Fe, микроэлементы и витамины. Барда из зерновых и картофельных заторов содержит около 6,5% сухих веществ, из которых около половины составляют углеводы. В основном это пентозы и полисахариды (декстрины, крахмал, гемицеллюлоза, целлюлоза). В барде содержится 0,4—1,2% молочной кислоты и до 0,72% свободной уксусной кислоты. По количеству питательных веществ зерновая барда почти вдвое превосходит картофельную. Барда почти не содержит сбраживаемые сахара, однако в ней присутствуют в минимальном количестве пентозы, а также летучие кислоты.
Зерново-картофельная барда может быть использована в ка�честве субстрата для производства амилолитичееких ферментов плесневыми грибами Aspergillus usatnii, A. niger, A. batatae. Картофельную барду также успешно используют для получения кормового белка.
Депротеинизированный сок растений. Используемые в сельском хозяйстве методы консервации зеленой массы (получение сена, травяной муки, силоса) приводят к большим потерям ее питатель�ной ценности. Кормовые продукты, получаемые из зеленой массы, содержат большое количество непереваримой целлюлозы и срав�нительно мало белка. Однако свежая зеленая биомасса содержит на 20—40% больше белка и кормовых единиц, чем зерно, убранное с той же площади. Белок травы и листьев по питательной ценности превосходит таковой у семян и приближается к рыбному белку, поэтому во многих странах большое внимание уделяется разра�ботке технологии микробиологической переработки зеленой массы растений.
Крахмал. В микробиологической промышленности в качестве основного или дополнительного источника углерода иногда применяется крахмалосодержащее сырье (например, кукурузная или соевая мука), богатое ростовыми факторами. Кукурузная мука содержит 67-70% крахмала, 10% других углеводов (главным образом целлюлозу, пентозаны, декстрины и растворимые углеводы). Белки составляют около 12% от сухой массы муки. Кукурузная мука богата витаминами группы В. Используются разные сорта соевой муки: содержащая или не содержащая соевое масло, пропаренная (дезодорированная) или непропаренная. Содержание углеводов не превышает 25%. Соевая мука богата белками, главным образом глицином, содержит много ферментов и витаминов группы В.
Гидролизаты крахмалсодержащих субстратов. В микробиоло�гической промышленности применяются гидролизаты как крах�мала, так и муки и зерноотходов. Ферментативный гидролизат кукурузной муки, высушенный на распылительной сушилке, имеет следующий химический состав, %: сухие вещества — 91, сырой протеин — 9, зола — 1,6, жиры — 3,7. Мальтозный эквивалент 71,1. В Румынии в качестве источника углеродного питания при биосинтезе L-лизина и L-глутаминовой кислоты применяют куку�рузную муку, гидролизованиую химическим способом. Перс�пективным сырьем для микробиологической промышленности явля�ются гидролизаты пшеничных отрубей, содержащие 25-30% крахмала. Исследования возможности автогидролиза крахмала пшеничных отрубей амилолитическими ферментами и ферментами микроорганизмов, обитающих в отрубях, показали, что при тем�пературе 50°С и влажности субстрата 60% в течение 6 ч содер�жание РВ в них увеличивается до 8—9% (в пересчете па сухой субстрат). В промышленно развитых странах, имеющих богатые ресурсы крахмала, в качестве заменителей сахарозы широко применяются целенаправленно гидролизованные продукты крахмала. Из 100 млн. т сахарозы, потребляемой ежегодно в мире, около 2,5—5,0 млн. т составляют фруктозные и глюкозные сиропы. По сладости сиропы равны (или превосходят) сахарозе. При оценке сладости за 100% принимают сладость 15%-ного раствора сахарозы. Приведем данные о сладости некоторых видов Саха�ров, %: D-фруктоза — 130—160, D-глюкоза — 65—67, инвертный сахар из сахарозы — 95—100, смесь (55% D-глюкозы и 45% D-фруктозы) — 95—100. Стоимость фруктозных сиропов ниже, чем тростникового сахара.
В табл.7 представлены результаты использования различ�ных источников углерода в биосинтезе лизина продуцентом Вг. flavum RC115.
Табл. 7. Сравнительные данные по использованию различных источников углерода для биосинтеза L-лизина (продуцент – Brevibacterium flavum RC115).
|
Источник углерода
|
Начальная концентрация сахара, %
|
Продолжитель�ность роста, час
|
Лизин-HCl,
г/л
|
Содержание
в среде сухих
веществ, %
|
Выход лизина-HCl , % от ассимили-рованного
сахара
|
|
|
|
|
|
в начале
процесса
|
в конце
процесса
|
|
|
Меласса отечественная
|
12
|
78
|
30-50
|
18,9
|
13,5
|
30-36
|
|
Меласса французская
|
12
|
78
|
36
|
17,9
|
11,9
|
34
|
|
Меласса американская свекловичная
|
12
|
76
|
30
|
18,2
|
12,2
|
25
|
|
Меласса американская тростниковая
|
12
|
72
|
26
|
17,2
|
11,0
|
23
|
|
Меласса из ГДР
|
12
|
78
|
36
|
18,0
|
13,1
|
30
|
|
Диффузионный сок
|
12
|
72
|
42
|
14,5
|
10,0
|
35
|
|
Кислотный гидролизат крахмал
|
11
|
72
|
46
|
15,9
|
12,0
|
38
|
|
Фермента-
тивный гидролизат крахмала
|
12
|
72
|
40
|
17,2
|
12,2
|
33
|
|
Двойная соль глюкозы
|
12
|
72
|
20
|
13,2
|
9,6
|
20
|
|
Гидролизат целлолигнина
|
8
|
66
|
25
|
20,5
|
15,9
|
37
|
|
Гидрол
|
12
|
78
|
33
|
18,5
|
12,6
|
29
|
Все указанные субстраты кроме источников углерода содержат и ростовые фак�торы (аминокислоты и витамины), а также минеральные эле�менты в легко ассимилируемой форме. [14]
Ферментативные гидролизаты крахмалосодержащего сырья как источник углеводного питания для микроорганизмов.
Для получения концентрированных гидролизатов проводили предварительное разжижение клейстеризованного картофельного крахмала.
Для разжижения крахмала использовали амилосубтилин. Высокая термостабильность этого фермента позволяет совместить стадии клейстеризации и разжижения. К 35% водной суспензии крахмала добавляли амилосубтилин. Значение рН доводили до значения 6,0 1%-ым раствором NaOH. Суспензию крахмала прогревали при постоянном перемешивании до 80 - 85°С. По мере клейстеризации крахмала под действием фермента происходит разрыв длинных цепочек молекул крахмала. При этом вязкость клейстера значительно снижается. Расход фермента составлял в разных опытах от 1 до 20 ед./ г крахмала. Установлено, что минимальная приемлемая концентрация фермента – 1,5-2 ед./ г крахмала. При расходе фермента 1,5 ед./ г крахмала процесс разжижения заканчивается через 30 мин. Разжиженный крахмал на этой стадии характеризуется следующими показателями, окраска йодом фиолетовая, что свидетельствует о наличии в растворе амилодекстринов (содержание свободных редуцирующих веществ 0,2 – 0,4% в пересчете на мальтозу, содержание общих углеводов 28 – 30%). Разжиженный крахмал подвергали термообработке при температуре 110°С в течение 10 мин. Это позволяло достичь полной клейстеризации крахмала и улучшения фильтрационных свойств гидролизатов.
Следующим этапом получения гидролизатов является осахаривание разжиженного крахмала. На этапе осахаривания использоали ферментные препараты: амилосубтилин, амилоризин, глюкаваморин. Значение рН охлажденного раствора крахмала доводили до значения, оптимального для действия ферментов. Добавляли ферментный препарат и смесь выдерживали при оптимальной для действия фермента температуре. Через определенные промежутки времени отбирали пробы для определения свободных редуцирующих веществ и состава образующихся мальтоолигосахаридов.
В таблицах 8-10 и на рис. 8-10 приведены результаты ферментативного гидролиза клейстеризованного крахмала.
Таблица 8. Динамика осахаривания разжиженного крахмала под действием амилосубтилина.
|
Вариант опыта
|
Расход фермента, ед/г крахмала
|
Время гидролиза, час
|
Окраска с йодом
|
Состав мальтоолигосахаридов по данным ТХС *
|
|
1
|
1,0
|
0,5
1,0
2,0
3,0
4,0
5,0
|
Бурая
Бурая
Желтая
Желтая
Желтая
Желтая
|
Г2Г3Г4Г5Г6Г7Г8Г9
Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
|
|
2
|
2,0
|
0,5
1,0
2,0
3,0
4,0
5,0
|
Бурая
Желтая
Желтая
Желтая
Желтая
Желтая
|
Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4Г5
|
|
3
|
3,0
|
0,5
1,0
2,0
3,0
4,0
5,0
|
Бурая
Желтая
Желтая
Желтая
Желтая
Желтая
|
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4Г5
|
* -здесь и последующих таблицах: Г – глюкоза, Г2 – мальтоза, Г3,Г4, Г5…Г9 – мальтоолигосахариды из трех, четырех, пяти и т.д. остатов глюкозы.
Таблица 9. Динамика осахаривания разжиженного крахмала под действием амилоризина.
|
Вариант опыта
|
Расход фермента, ед/г крахмала
|
Время гидролиза, час
|
Окраска с йодом
|
Состав мальтоолигосахаридов
|
|
1
|
1,0
|
0,5
1,0
2,0
3,0
4,0
|
Фиолетовая
Бурая
Бурая
Красная
Желтая
|
Г Г2Г3Г4Г5
Г Г2Г3Г4Г5
Г Г2Г3Г4Г5
Г Г2Г3Г4Г5
Г Г2Г3Г4Г5
|
|
2
|
3,0
|
0,5
1,0
2,0
3,0
4,0
|
Бурая
Красная
Желтая
Желтая
Желтая
|
Г Г2Г3Г4Г5
Г Г2Г3Г4Г5
Г Г2Г3Г4
Г Г2Г3Г4
Г Г2Г3
|
|
3
|
5,0
|
0,5
1,0
2,0
3,0
4,0
|
Красная
Желтая
Желтая
Желтая
Желтая
|
Г Г2Г3Г4
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
Г Г2Г3
|
Таблица 10. Динамика осахаривания разжиженного крахмала под действием глюкаваморина.
|
Вариант опыта
|
Расход фермента, ед/г крахмала
|
Время гидролиза, час
|
Окраска с йодом
|
Состав мальтоолигосахаридов
|
|
1
|
2,5
|
1,0
2,0
3,0
5,0
|
Фиолетовая
Фиолетовая
Бурая
Желтая
|
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
|
|
2
|
3,0
|
0,5
2,0
3,0
5,0
|
Фиолетовая
Бурая
Желтая
Желтая
|
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
|
Как видно из представленных данных, использование разных ферментных препаратов позволяет получить разные по составу гидролизаты крахмала. Для удобства осуществления технологического процесса на производстве время приготовления гидролизата не должно превышать 6 - 8 часов (одна смена). Поэтому окончательный выбор расхода фермента осуществляется из этого условия.
В таблице 11 приведены показатели трех основных типов гидролизатов условно названных низкоосахаренный, мальтозный и глюкозный. Следует отметить, что все гидролизаты представляют собой невязкие растворы, которые могут быть использованы для дозирования в аппарат по ходу процесса. [15]
Таблица 11. Условия осахаривания и свойства основных типов гидролизатов крахмала.
|
Тип гидролизата
|
Фермент, ед/г крахмала
|
Время гидролиза, час
|
Содержание общих редуцирующих веществ, %
|
Содержание свободных
редуцирующих веществ, %
|
Состав мальтоолигосахаридов, %
|
Вязкость гидролизатов, сПз
|
|
|
|
|
|
|
Г1
|
Г2
|
Г3
|
Г4
|
Г5
|
Г6
|
|
|
Низко-осаха-ренный
|
Амило-субтилин 2,0
|
3
|
28
|
11
(по мальтозе)
|
7
|
19
|
24
|
15
|
12
|
23
|
63,8
|
|
Маль-тозный
|
Амило-ризин 3,0
|
4
|
28
|
23
(по мальтозе)
|
9
|
65
|
26
|
-
|
-
|
-
|
30,0
|
|
Глюкоз-ный
|
Глюка-ваморин 3,0
|
5
|
28
|
11
(по глюкозе)
|
65
|
15
|
19
|
-
|
-
|
-
|
7,5
|
Гидролиз кукурузной муки проводили по аналогичной схеме. Для гидролиза использовали 35% затор кукурузной муки. Отличие заключалось в том, что стадию разжижения проводили в два этапа. На первом этапе разжижения к суспензии добавляли хлорид кальция из расчета 0,7 г на 1 г крахмала и амилосубтилин из расчета 1,0 ед/г крахмала. Процесс разжижения осуществляли при непрерывном интенсивном перемешивании при температуре 75 - 85°С в течение 30 мин. Затем частично разжиженную кукурузную муку подвергают термообработке под давлением и температуре 115°С в течение 15 мин. После охлаждения продукта проводили вторую стадию разжижения, используя амилосубтилин из расчета 0,5 ед/г крахмала. Двухэтапное разжижение способствует значительному улучшению фильтрационных свойств суспензии кукурузной муки.
Разжиженную кукурузную муку подвергали осахариванию. В таблице 12 приведены показатели осахариваемых гидролизатов кукурузной муки под действием амилосубтилина, амилоризина и глюкаваморина. Как видно, из кукурузной муки можно получить несколько типов гидролизатов, состав которых аналогичен таким же гидролизатам из картофельного крахмала. Однако гидролизаты кукурузной муки имеют более низкое содержание углеводов, чем аналогичные гидролизаты крахмала. Учитывая, что содержание крахмала в кукурузной муке влажностью около 80% составляет 65 - 70 % из нее можно получить гидролизаты с концентрацией общих углеводов 15 – 19%. Увеличение исходной концентрации кукурузной муки невозможно вследствие высокого содержания сухих веществ: получаемая суспензия в этом случае будет слишком густой.
Полученные осахаренные гидролизаты кукурузной муки могут быть использованы в составе питательных сред. Для использования гидролизатов кукурузной муки для дозирования в аппарат необходима дополнительная стадия механическое отделение осадка. Как показали проведенные исследования, фильтрационные свойства гидролизатов кукурузной муки в значительной степени определяются степенью осахаривания крахмала кукурузной муки (табл. 12). Как видно, гидролизат кукурузной муки, полученный с помощью амплосубтилина относится к труднофильтруемым жидкостям, поэтому амилосубтилин не может быть использован для приготовления гидролизата кукурузной муки. При осахаривании кукурузной муки амилоризином или глюкаваморином наблюдается более глубокое осахаривание. Среди продуктов гидролиза практически отсутствуют высокомолекулярные фрагменты и как следствие, фильтрационные свойства этих гидролизатов значительно выше. Получаемые фильтраты гидролизатов кукурузной муки представляют собой абсолютно невязкие светло-желтые растворы. Получаемый при фильтрации жмых кукурузной муки является ценным жиро - белковым продуктом и может быть использован на корм скоту. Поэтому, учитывая низкую стоимость исходного сырья (кукурузной муки), при наличии на производстве достаточных фильтрационных мощностей гидролизаты кукурузной муки можно рассматривать как выгодный заменитель растворов углеводов (глюкозы, сахарозы), используемых при биосинтезе.
Таблица 12. Динамика осахаривания разжиженной кукурузной муки
|
Вариант опыта
|
Расход фермента, используемого на стадии осахаривания
|
Время гидролиза, час
|
Окраска с йодом
|
Состав мальтоолигосахаридов
|
|
1
|
Амилосубтилин 2,0 ед/г крахмала
|
1,0
3,0
5,0
|
-
-
612
|
Г Г2Г3Г4Г5Г6Г7Г8Г9
Г Г2Г3Г4Г5Г6Г7Г8
Г Г2Г3Г4Г5Г6
|
|
2
|
Амилоризин 3,0 ед/г крахмала
|
0,5
1,0
2,0
3,0
|
-
-
-
65
|
Г Г2Г3Г4Г5Г6
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
|
|
3
|
Глюкаваморин 2,75 ед/г крахмала
|
2
4
6
8
|
-
-
-
-
|
Г Г2Г3Г4Г5
Г Г2Г3
Г Г2Г3
Г Г2Г3
|
|
4
|
Глюкаваморин 4,0 ед/г крахмала
|
2
4
6
8
|
506
101
67
36
|
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
Г Г2Г3
|
|
5
|
Глюкаваморин 5,0 ед/г крахмала
|
2
4
6
8
|
-
-
-
-
|
Г Г2Г3Г4
Г Г2Г3
Г Г2Г3
Г Г2Г3
|
Выводы:
- Исследованы условия гидролиза картофельного крахмала и кукурузной муки под действием амилолитических ферментных препаратов.
- Показано, что используя двухстадийный гидролиз крахмала, заключающийся в первоначальном разжижении крахмала с помощью амилосубтилина и последующего осахаривания с помощью амилоризина или глюкаваморина можно получить три основных типа гидролизатов крахмала с содержанием общих углеводов 28 -30 %. Первый тип - низкоосахаренный гидролизат, характеризуется невысоким содержанием глюкозы и наличием мальтоолигосахаридов вплоть до мальтогексаозы. Второй тип – мальтозный, содержит в качестве основного продукта мальтозу. Третий тип – глюкозный, содержит в качестве основного продукта глюкозу.
- Установлено, что из кукурузной муки по аналогичной схеме гидролиза можно получить те же три основные типа гидролизатов из крахмала, но с содержанием общих углеводов не более 19 %.
- Установлено, что фильтрационные свойства гидролизатов кукурузной муки улучшаются с увеличением степени осахаривания.
- Полученные гидролизаты крахмала и кукурузной муки содержат смесь легкоусваеваемых углеводов, и обладают высокими технологическими параметрами, что делает возможным их применение при биосинтезе биологически активных веществ, как в составе питательных сред, так и для дозирования по ходу процесса. [16]
В-крахмал
лейковина
Крахмал
(А-минус)
Крахмал
(А-плюс)
Стоки
Сепарация
Промывка
Промывка
Очистка сточных вод
Техноло-гическая вода 1
Техноло-гическая вода 2
Сепарация
Сепарация
Просеивание
Классифи-кация
Сепарация
Рассев мезги
Рассев мезги
Концентри-рование
3-х фазное разделение
Промывка клейковины
Приготовление теста
Пшеничная мука
Принципиальная схема трехфазного разделения
Производство крахмалсодержащих питательных сред