Электрохимические и массообменные характеристики анионообменных мембран
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
"КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ"
(ФГБОУ ВПО «КубГУ»)
Кафедра физической химии
ДОПУСТИТЬ К ЗАЩИТЕ В ГАК
Заведующий кафедрой,
ученая степень, ученое звание ________________Инициалы, фамилия
(Подпись)
___________________201_ г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
Электрохимические и массообменные характеристики анионообменных мембран
Работу выполнил ____________________________________М. Д. Бойкова
(Подпись, дата)
Факультет _________________________________________________________
Направление бакалаврской подготовки ________________________________
Научный руководитель, проф.,
д-р хим. наук, проф. _________________________Н.Д. Письменская (Подпись, дата)
Нормоконтролер, вед. науч. сотр.,
канд. хим. наук, ст. науч. сотр. ________________________О.А. Демина
(Подпись, дата)
Краснодар 2014
РЕФЕРАТ
Дипломная работа содержит 47 страниц, 12 рисунков, 4 таблицы, 39 литературных источников.
Объектом исследования является гомогенная мембрана AMX.
Целью работы является изучение электрохимических характеристик и процесса массопереноса анионообменной мембраны AMX в растворе гидротартрата калия.
В процессе работы проводились экспериментальные исследования методом вольтамперометри.
В результате исследования получены концентрационные и массообменные зависимости, которые позволяют сделать следующие выводы:
- Предложена методика определения концентрационных зависимостей коэффициентов массопереноса и чисел переноса одно- и двухзарядных противоионов для анионообменных мембран, которые участвуют в обессоливании раствора гидротартрата калия.
- Показано, что в случае обессоливания 0,02 М раствора гидротартрата калия числа переноса ионов гидроксила являются высокими даже в области предельных токов.
- Вероятнее всего, в основе наблюдаемого явления лежит не усиление реакций протонирования - депротонирования фиксированных групп на границе мембрана/раствор (как в случае растворов NaCl), а депротонирование ионов дигидротартрата, которые затем переносятся через мембрану в виде двухзарядных ионов. Протоны же выносятся электрическим полем в обессоливаемый раствор.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Электромембранные методы относятся к одним из наиболее эффективных методов очистки и разделения водных растворов. В настоящее время электродиализ разбавленных растворов переживает вторую жизнь благодаря использованию гибридных технологий. Возросший интерес к этому методу обусловлен появлением новых ниш его применения. В частности, это деминерализация растворов после обратного осмоса с получением сверхчистой воды или воды с заданным составом микрокомпонентов. Лимитирующей стадией процесса переработки разбавленных растворов является доставка ионов соли к межфазной границе. Опытным путём установлено, что эксплуатация электромембранных модулей в сверхпредельных токовых режимах позволяет увеличить скорость массопереноса в 4-5 раз при разумных значениях скачка потенциала. Исследования последних лет (работы Е.И. Беловой, М. Веслинга, В.И. Заболоцкого, Б. Зальцмана, К.А. Лебедева, Н. Мищук, В.В. Никоненко, И. Рубинштейна, М.Х. Уртенова) показывают, что наиболее перспективным способом частичного снятия диффузионных ограничений при интенсивных токовых режимах является использование электроконвекции, развивающейся как электроосмос второго рода и позволяющей частично разрушить диффузионный слой в каналах обессоливания со стороны межфазной границы мембрана/раствор. Причём, воздействие этого явления на массоперенос удаётся усилить за счёт подавления каталитической генерации H+, OH– ионов на границе мембрана/раствор путём обработки поверхности мембран полиэлектролитами, ионогенные группы которых имеют низкую каталитическую активность по отношению к реакции диссоциации воды. В исследованиях Г.Ю. Лопатковой и Р.Х. Чермит установлено, что замена вторичных и третичных аминогрупп на поверхности анионообенных мембран на четвертичные аммониевые основания позволяет добиться подавления реакции диссоциации воды на границе мембрана/раствор и улучшить их массообменные свойства.
Однако подавляющее большинство исследований в данной области проведено в растворах NaCl. Вместе с тем, наиболее часто ионообменные мембраны используются в амфолит содержащих растворах, когда транспорт ионов осложнён реакциями переноса протона.
Целью работы является изучение электрохимических характеристик и процесса массопереноса анионообменной мембраны AMX в растворе гидротартрата калия.
В задачи исследования входят:
- разработка методики проведения эксперимента и обработки экспериментальных данных;
- сравнительный анализ зависимостей, полученных для мембраны AMX при различных скачках потенциала.
1 Аналитический обзор
1.1 Механизмы сверхпредельного массопереноса
1.1.1 Каталитическая генерация ионов H+ и OH– и эффект экзальтации предельного тока
В литературе [1,14,17] выделено четыре механизма, объясняющих сверхпредельный массоперенос (рисунок 1). Два из них обусловлены генерацией H+ (OH) ионов [15]) на границе мембрана/раствор.
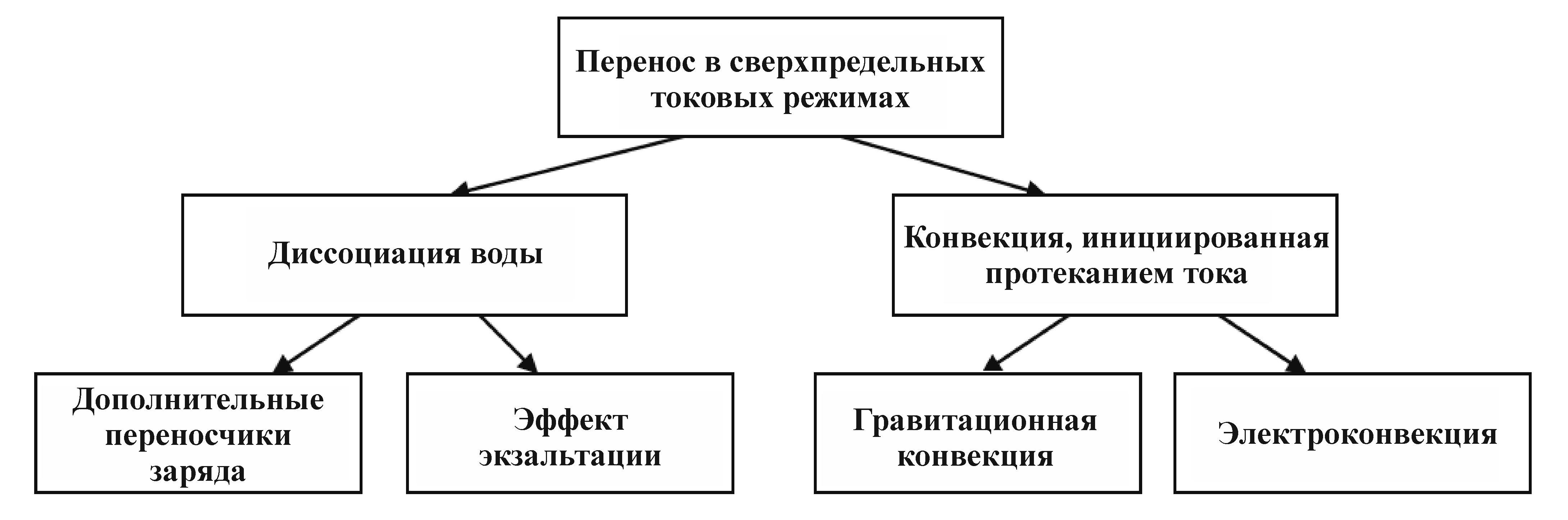
Рисунок 1 – Схема механизмов переноса в сверхпредельных токовых режимах [1]
Обзоры, посвящённые каталитической генерации H+ (OH) ионов в мембранных системах, представлены в работах [1,14,17]. В соответствии с современными представлениями, H+ и OH– ионы генерируются внутри поверхностного двойного электрического слоя (ДЭС) монополярной мембраны в ходе реакций протонирования и депротонирования, в которых участвуют фиксированные ионогенные группы, как каталитические центры, и молекулы воды [24,25]. Каталитическая активность фиксированных групп по отношению к реакции диссоциации воды растёт в ряду [24,25]:
<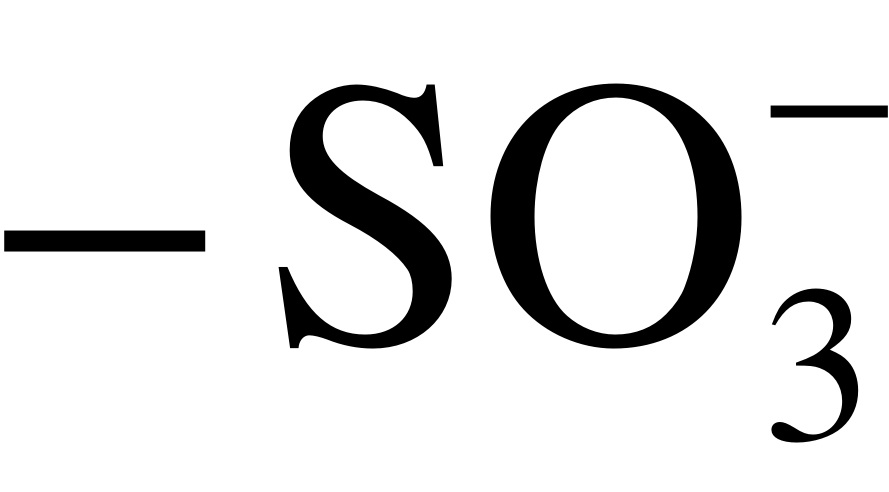 <
<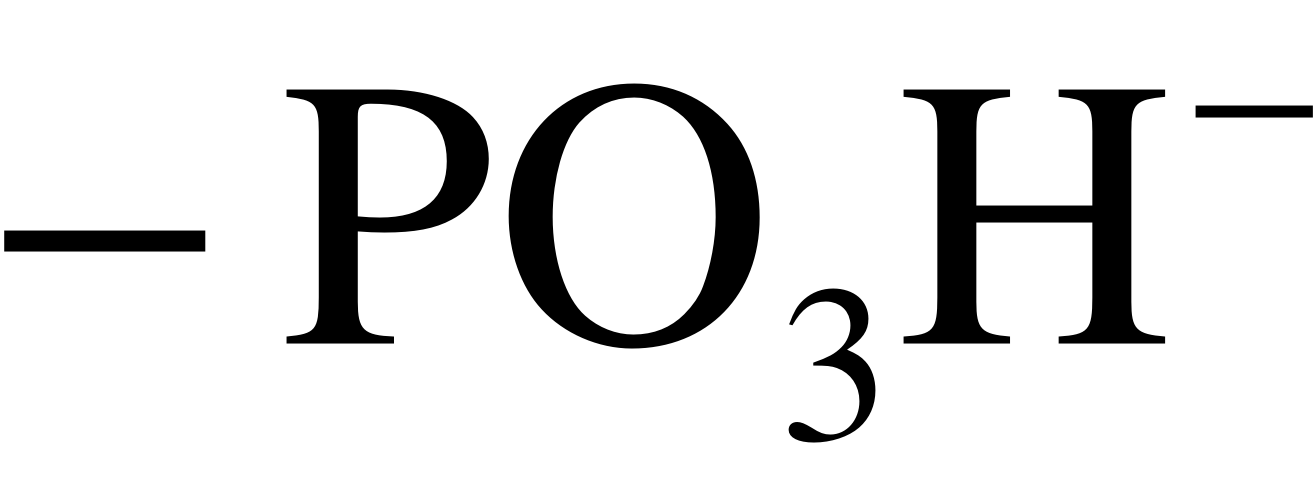 <
< 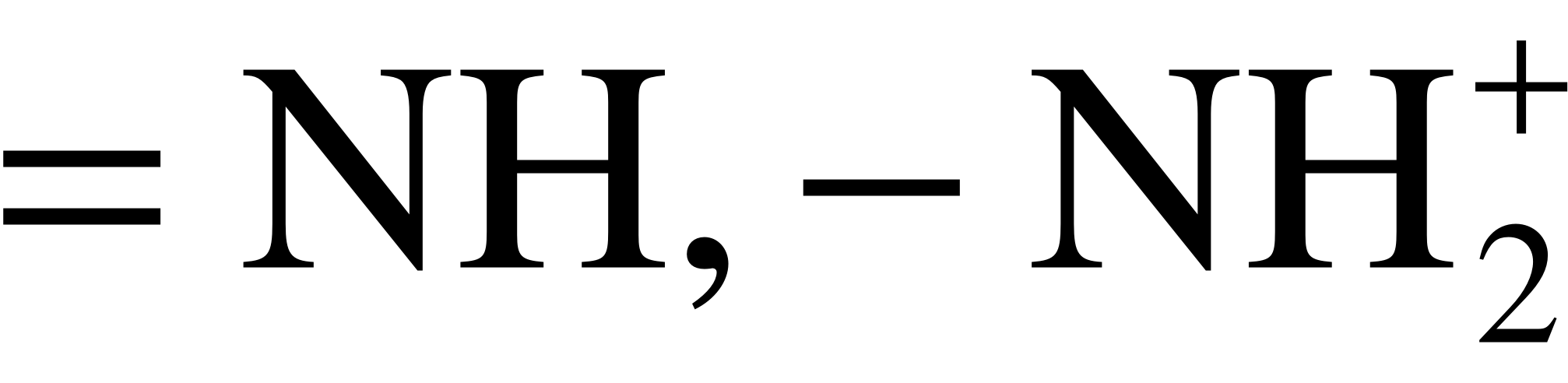 <
<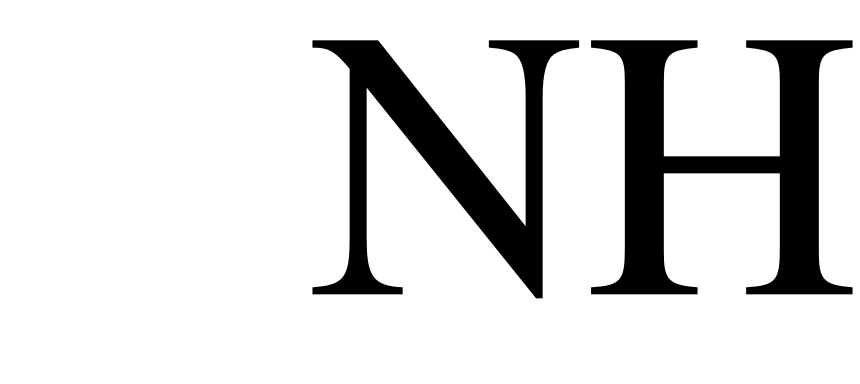 <
<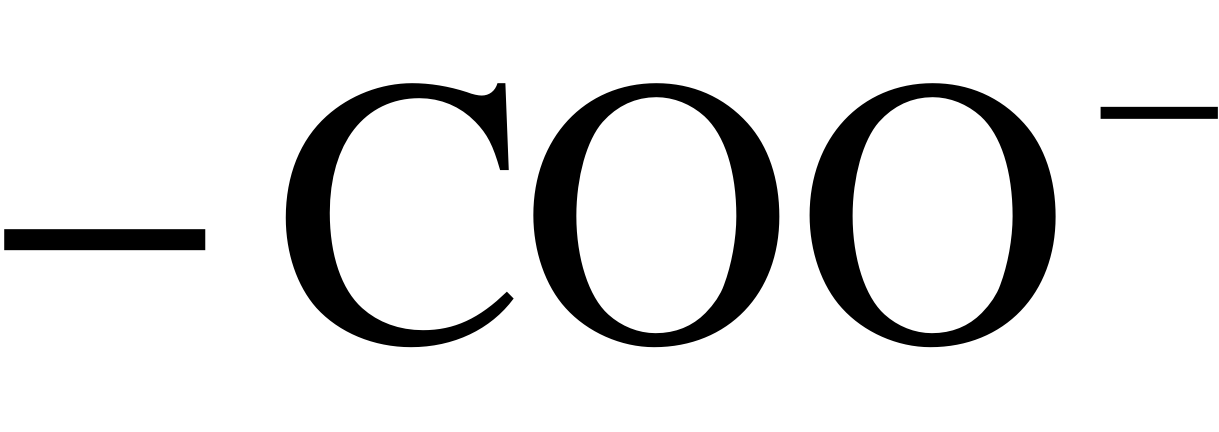 <
<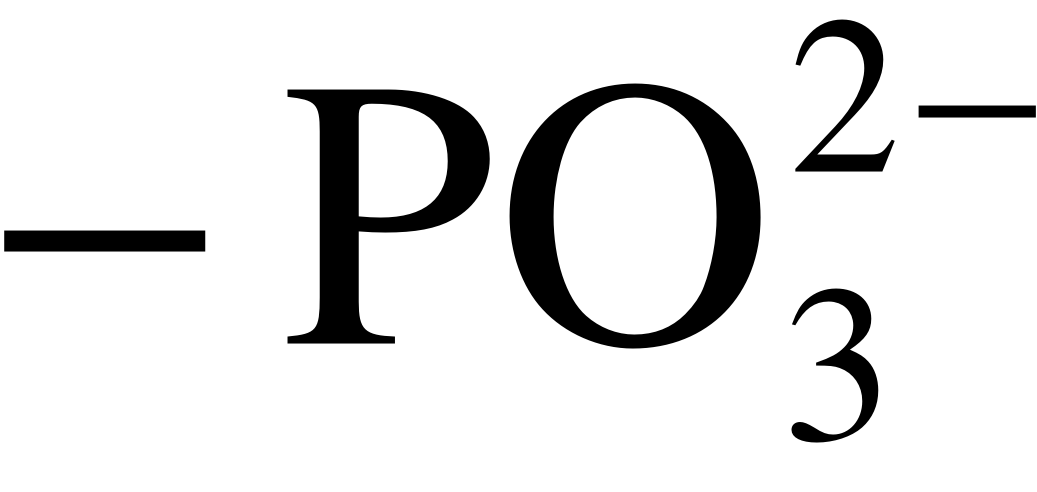 (1)
(1)
Скорость генерации H+, OH– ионов экспоненциально зависит от напряжённости электрического поля на границе мембрана/раствор. Экспоненциальный вид зависимости определяется вторым эффектом Вина, который проявляется в «растягивании» связи между анионом кислоты и протоном (или катионом основания и ионом гидроксила) и способствует такому ориентированию молекул воды, при котором снижается энергия, необходимая для их диссоциации. В результате константа скорости реакции диссоциации воды увеличивается, при этом скорость реакции рекомбинации остаётся неизменной. Простые выражения для учета зависимости константы скорости реакции диссоциации воды от напряженности электрического поля получены В.И. Заболоцким, Н.В. Шельдешовым и др. [29]. Показано, что механизм диссоциации воды является одинаковым для всех мембранных систем независимо от типа мембран и природы функциональных групп.
Важно подчеркнуть, что в течение длительного времени считалось, что появление дополнительных переносчиков электрического заряда, H+ и OH– ионов, является основной, если не единственной причиной сверхпредельной проводимости [15]. Вместе с тем, этот эффект вызывает другой, менее очевидный механизм сверхпредельного переноса, – эффект экзальтации предельного тока, впервые изученный Ю.И. Харкацем. Появление H+ или OH– ионов в растворе у поверхности мембраны влияет на распределение электрического поля. Например, ионы OH–, генерированные в обеднённом диффузионном слое у поверхности катионообменной мембраны, «притягивают» катионы соли из объема раствора к межфазной границе, и таким образом вызывают рост (экзальтацию) переноса ионов соли.
1.1.2 Сопряжённая конвекция раствора
Два других механизма сверхпредельной проводимости, которые содействуют переносу ионов соли, относятся к сопряжённой (индуцированной протеканием электрического тока) конвекции раствора. Это гравитационная конвекция и электроконвекция. Они обеспечивают дополнительное по сравнению с вынужденной конвекцией перемешивание обедненного раствора у поверхности мембраны. Это перемешивание обусловлено возникновением локальных вихрей в результате действия объёмных сил.
Гравитационная конвекция развивается благодаря неравномерному распределению плотности раствора, в результате чего возникает объёмная Архимедова сила. В канале обессоливания с вертикально расположенными мембранами у поверхности мембраны, обращённой в канал обессоливания, раствор является более разбавленным, чем в ядре потока. Кроме того, температура в обедненном пограничном слое, имеющем высокое электрическое сопротивление, повышается благодаря Джоулеву разогреву. В результате у поверхности мембраны действие объемной Архимедовой силы направлено вертикально вверх, что может приводить к вихревому движению жидкости в некотором пространстве у поверхности мембраны: более легкие слои жидкости у поверхности мембраны поднимаются вверх, тогда как более плотные слои жидкости в центре канала опускаются вниз.
Электроконвекция возникает в результате воздействия электрического поля на пространственный электрический заряд в приповерхностном слое обеднённого раствора [9,19]. Механизм образования парных вихрей вблизи устья заряженной поры показан на рисунке 2. Возникновение вихрей происходит в результате взаимодействия электрического поля с индуцированным этим полем неравновесным пространственным зарядом на обедненной границе мембраны. Такой механизм получил название электроосмоса 2-го рода, в отличие от электроосмоса 1-го рода, когда пространственный заряд находится в квазиравновесном ДЭС на поверхности мембраны. Действие электрического поля на ОПЗ вызывает повышение давления в этой области. Под действием избыточного давления жидкость выдавливается в соседние области, в которых пространственный заряд отсутствует или существенно меньше. Набегание жидкости на неподвижные слои и вызывает появление вихрей.
Протекание явления, изображенного на рисунке 2, возможно на разных масштабах. В общем случае поверхность ионообменной мембраны является электрически неоднородной, хорошо и плохо проводящие участки поверхности могут иметь размер от нескольких нанометров (устье поры) до десятков микрометров (частичка ионита на поверхности гетерогенной мембраны).
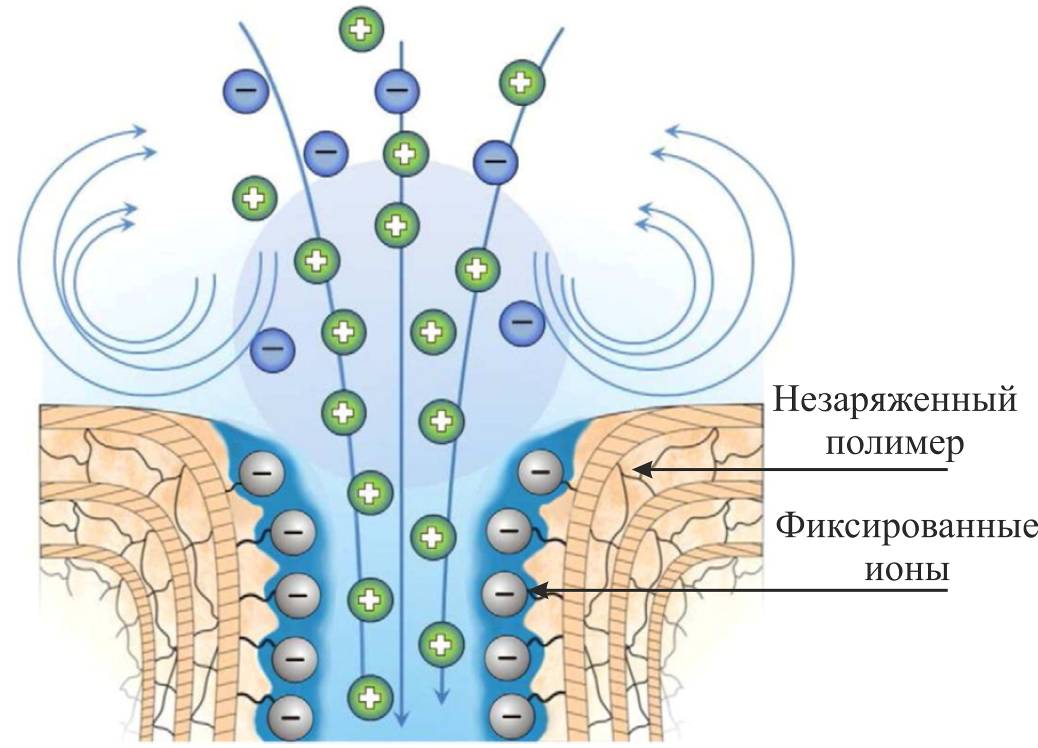
Рисунок 2 – Схема возникновения электроконвекции на входе в заряженную нанопору ионообменной мембраны: взаимодействие электрического поля с индуцированным этим полем неравновесным пространственным зарядом вызывает локальное увеличение давления, что приводит к генерации парных вихрей. Адаптировано из [1]
Генерация электроконвективных вихрей возможна и вблизи гомогенной поверхности [9]. В общем случае необходимым условием является ненулевой ротор объемной электрической силы, приложенной к заряженному раствору [14]. Это условие выполняется уже потому, что объемная сила всегда неравномерно распределена по нормали к поверхности мембраны. Кроме того, неравномерность возникает из-за того, что толщина диффузионного слоя распределена неравномерно по длине мембраны. Наконец, неравномерность появляется вследствие случайных флуктуаций скорости течения раствора или его концентрации. Далее возможны несколько сценариев развития событий: флуктуации рассасываются или же служат причиной возникновения еще более сильных отклонений от стабильного состояния и переходу к нестабильному гидродинамическому режиму. И. Рубинштейн и Б. Зальцман [9] теоретически показали, что возможны три разных режима электроконвективного вихревого движения возле гомогенной мембраны. В случае режима 1, который имеет место при очень небольшом превышении предельного тока (порядка нескольких долей процента), в прилегающем к поверхности мембраны обедненном растворе образуются небольшие стационарные парные вихри одинакового диаметра. Такие вихри вызывают только несколько одиночных осцилляций потенциала перед выходом на стационарный режим, но способны доставлять к межфазной границе порции более концентрированного раствора. Хотя прирост тока по отношению к предельному значению (принимаемому фиксированным в модели [9]) и очень мал, важно понимать, что появление вихрей приводит к уменьшению толщины диффузионного слоя и к росту предельного тока. Поэтому абсолютный прирост тока, регистрируемый на начальном участке плато ВАХ, может быть вполне заметным уже в этом режиме. С увеличением скачка потенциала отдельные пары вихрей объединяются в более крупные (режим 2): к межфазной границе начинает доставляться более концентрированный раствор, что приводит к более заметному росту сверхпредельного тока ионов соли. Этот режим характеризуется регулярными осцилляциями потенциала. По-видимому, ему отвечает переходный участок ВАХ вблизи точки перегиба. Наконец, при достижении третьего порогового значения скачка потенциала, объединение вихрей принимает хаотический характер, причём размеры наиболее крупных вихрей становятся сопоставимыми с толщиной диффузионного слоя (режим 3). Это приводит к росту амплитуды и хаотическому характеру колебаний потенциала (участок ВАХ после точки перегиба). В работе Е.И. Беловой и др. [20] эти режимы были выявлены экспериментально.
Все перечисленные исследования проведены в растворах NaCl. Использование этого электролита обусловлено его дешевизной и тем, что он является достаточно простым объектом. Транспорт ионов натрия и хлора осуществляется по гидродинамическому механизму и не осложнён химическими взаимодействиями с растворителем – водой. Вместе с тем, наиболее часто ионообменные мембраны функционируют в амфолит содержащих растворах, когда транспорт ионов осложнён реакциями переноса протона.
Целью работы является изучение электрохимических характеристик и процесса массопереноса анионообменной мембраны AMX в растворе гидротартрата калия.
В задачи исследование входит:
- разработка методики проведения эксперимента и обработки экспериментальных данных;
- сравнительный анализ зависимостей, полученных для мембраны AMX при различных скачках потенциала.
2 Экспериментальная часть
2.1 Объекты исследований
Объектом исследования является гомогенная мембрана AMX. Некоторые свойства этой мембраны приведены в таблице 1.
Таблица 1 – Свойства мембраны АМХ
|
Матрица
Ионогенная группа
Толщина ( мм )
Электропроводность ( См/м в 0,1М NaCl)
Число переноса ионов Cl- ( 0,1м NaCl, метод Гитторфа)
|
Сополимер дивинилбензола с полистиролом
–N(CH3)3 +
170 ± 10
0,60
0.99 ± 0.01
|
Мембрану AMX получают пастовым методом. Паста состоит из мономеров дивинилбензола и стирола, а также измельчённого в пудру поливинилхлорида (ПВХ). После процесса полимеризации в ионообменную матрицу вводятся четвертичные аммониевые группы. Таким образом, мембрана AMX содержит также, как и МА-41, непроводящий наполнитель (ПВХ), но размеры различных частиц, видимых на поперечном сечении не превышают 60 мкм, а размеры каверн составляют 1-3 мкм. Таким образом, поверхность мембраны AMX гораздо более однородна по сравнению с гетерогенной мембраной МА-41.
В качестве рабочего раствора использовали гидротартрат калия, KHT. Винная кислота, анионом которой является гидротартрат калия, имеет следующую структурную формулу:
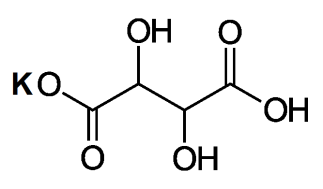
Винная кислота и её анионы также вступают в реакции протолиза, которые характеризуются соответствующими константами равновесия (приведены для температуры 25°С) [39]:
(2)
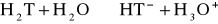 (3)
(3)
 (4)
(4)
Соответственно константы равновесия равны:
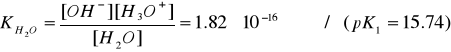 (5)
(5)
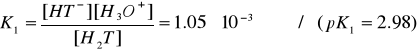 (6)
(6)
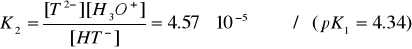 [39]. (7)
[39]. (7)
Здесь и в дальнейшем:  ;
; 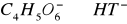 ;
; 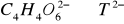
Указанные обозначения введены для более компактного представления данных.
Расчёты доли отдельных составляющих раствора с использованием констант химического равновесия (5-7) показывают, что при pH = 2.98 концентрации винной кислоты H2T и ионов гидротартрата HT– одинаковы. Аналогичная ситуация возникает при значении pH = 4.34 для ионов HT– и T2–. Максимальные концентрации H2T, HT– и T2– в растворе достигаются соответственно при значениях pH менее 0.5; 3.65 и более 7.0 (рисунок 3). В растворах тартратов одновременно могут присутствовать все три возможные формы: H2T, HT– и T2–. Мольная доля H2T и T2– превышает 1% в диапазоне pH 2.8-5.1. При pH, равном 3.65 значения мольных долей H2T и T2– становятся одинаковыми, равными 0.15. Соответственно максимальная доля HT– при этом значении pH не превышает 0.7. Протекание реакций протолиза приводит к тому, что состав растворов во многом определяется их pH.
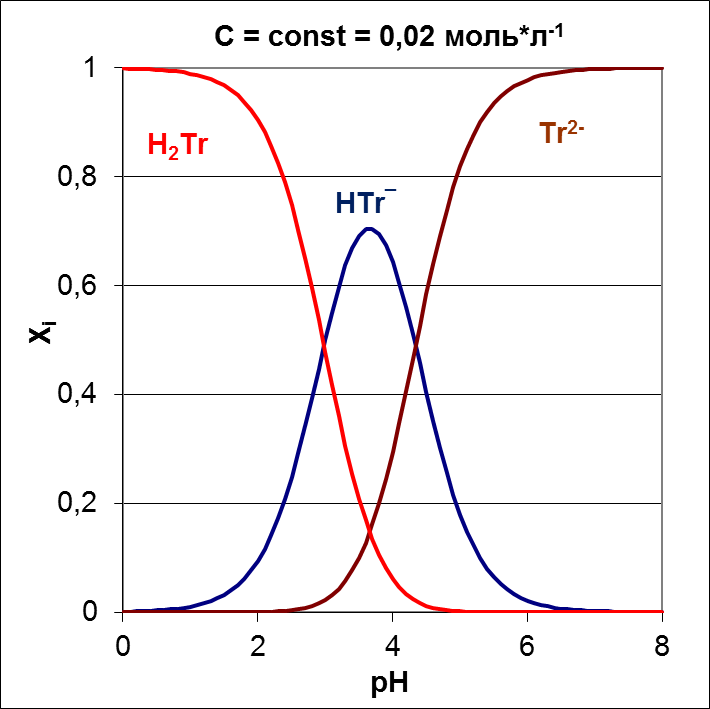
Рисунок 3 – Содержание в растворе H2T и ионов HT–, T2– (в мольных долях Xi) в зависимости от рН раствора
2.2 Комплексная методика изучения электрохимических и массообменных характеристик ионообменной мембраны
Вольтамперометрия и хронопотенциометрия являются наиболее простыми, а потому – самыми распространенными инструментами исследования электрохимических характеристик мембранных систем. Существует большое количество модификаций экспериментальных ячеек и этих методов, в частности, методы, в которых применяют диск с вращающейся мембраной.
Для того, чтобы изолировать исследуемую систему от продуктов электродных реакций, ее отделяют от поляризующих электродов соответствующими ионообменными мембранами или используют метод гидродинамической задержки.
Протекание электрического тока в электромембранной системе сопровождается изменением концентрации электролита не только в диффузионных слоях, но и в ядре потока. Для того, чтобы иметь возможность отнести измеренные вольтамперные характеристики (ВАХ) или хронопотенциограммы (ХП) к определенной концентрации электролита, это изменение стараются свести к минимуму, уменьшая площадь поляризуемого участка мембран, применяя обратимые Ag/AgCl [,28] или Cu/Cu+ поляризующие электроды, а также увеличивая объем непроточных полуячеек и перемешивая в них раствор вращающимися с большой скоростью мешалками. Кроме того, используют проточные ячейки.
Для обеспечения постоянной на всём исследованном образце толщины диффузионного слоя используют вращающиеся с заданной скоростью дисковые мембраны, а также проточные ячейки с достаточно протяженными «разгонными» участками, со специально подобранными спейсерами в межмембранном пространстве или особыми конструкциями устройств ввода и вывода раствора.
Используемая нами шестикамерная ячейка снабжена специальными устройствами ввода и вывода раствора. Схема ячейки представлена на рисунке 3. Проточные камеры ячейки образованы мембранами (1), а также плексигласовыми рамками (2) и резиновыми прокладками (3) с квадратным отверстием площадью 22 см2 (4). Толщины плексигласовых рамок и резиновых прокладок (3) равна, соответственно, 5.0 и 0.75 мм. Таким образом, расстояние между соседними мембранами составляет 6.3 мм. Камеры, прилегающие к исследуемой мембране (A*) со стороны плоского платинового катода (5), отделены анионообменными (А), а со стороны плоского платинового анода (6) - катионообменными (К) мембранами. Поляризующие платиновые электроды и поляризуемый участок мембран имеют форму квадрата с площадью S = 22 см2. Кончики двух пластиковых капилляров Луггина-Габера (7) диаметром около 0.8 мм зафиксированы в центре обеих сторон поляризованной поверхности исследуемой мембраны. Капилляры соединены с влажными пробкокранами, в которые погружены закрытые Ag/AgCl измерительные электроды. Подача и отвод раствора в камеры ячейки осуществляется через каналы 8, имеющие входы и выходы в виде щелевидных прорезей 9 на горизонтальных плоскостях отверстия 4 рамки 2, что обеспечивает ламинарное равномерное течение раствора внутри каждой из камер. Штуцеры 10 представляют собой трубки, введенные в каналы 8 рамок 2, и служат для соединения ячейки с гидравлической системой установки. Если ячейка находится в вертикальном положении, раствор в нее поступает снизу вверх.
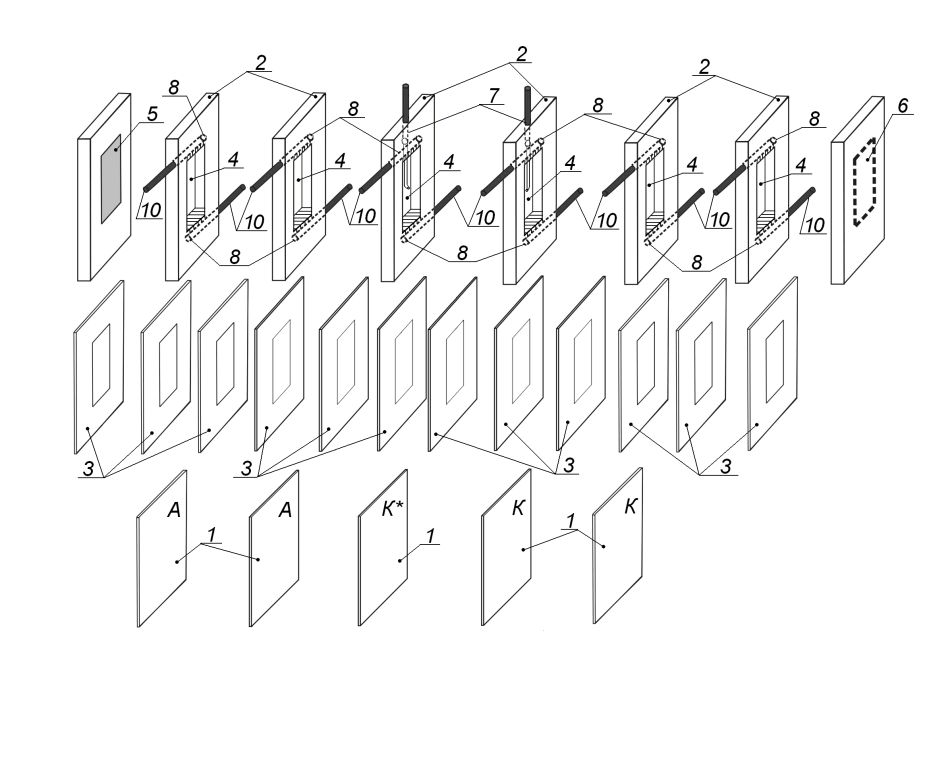
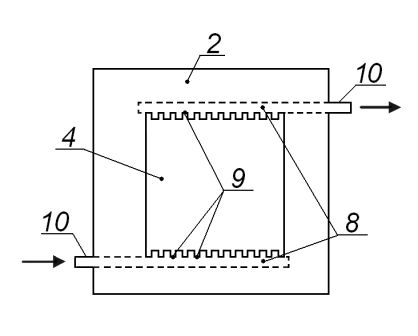
мембраны (1); пластиковые рамки (2); резиновые прокладки (3); квадратные отверстия (4); катод (5); анод (6); стеклянные капилляры Луггина – (7); каналы (8); щелевидные прорези (9); исследуемая мембрана (А*); катионообменная мембрана (К); анионообменная мембрана (A)
Рисунок 3 – Схема экспериментальной ячейки
Схема экспериментальной установки для комплексного исследования электрохимических и массообменных характеристик ионообменной мембраны изображена на рисунке 4. Установка может работать в двух режимах:
- Режим измерения вольтамперных характеристик и хронопотенциограмм – прямоточный гидравлический режим;
- Режим определения массообменных характеристик ионообменной мембраны (чисел переноса и парциальных ВАХ противоионов через исследуемую мембрану) – циркуляционный гидравлический режим.
В режиме измерения вольтамперных характеристик и хронопотенциограмм (рисунок 4) вентили (30) и (38) закрыты, вентиль (37) на гибких трубках (22) в процессе эксперимента открыт. В буферную емкость (16) и емкость (21) для подачи раствора электролита обессоливаемый раствор электролита (17) не заливается. Из емкостей (19) и (20) рабочий раствор электролита (15) насосами (18) закачивается в буферные емкости (13) и (14) соответственно, откуда самотеком поступает в электродные камеры (4), буферные камеры (5), камеру концентрирования 6 и камеру обессоливания (7) шестикамерной ячейки (1). Действующей силой является разность гидростатических давлений между буферными ёмкостями (13) и (14) и шестикамерной ячейкой (1). С помощью насосов (18) уровень рабочего раствора электролита (15) в буферных ёмкостях (13) и (14) поддерживается постоянным. Раствор электролита (15) через электродные камеры (4) шестикамерной ячейки (1) возвращается в ёмкость (19). Рабочий раствор электролита (15) необходимо доливать в ёмкость (20) для подачи электролита по мере его расходования. Отработанный раствор электролита из буферных камер (5), камеры концентрирования (6) и камеры обессоливания (7) сбрасывается в ёмкость (23) для слива отработанного раствора электролита. Скорость протока рабочего раствора электролита (15) через электродные камеры (4) регулируется вентилями (35) и (36), через буферные камеры (5) – вентилями (31) и (34), через камеру концентрирования (6) – вентилем (32), и через камеру обессоливания (7) – вентилем (33). Для регистрации потенциала используется вольтметр (10), соединенный с хлорсеребряными электродами (11), и подключенный к компьютеру (12). Ток задаётся потенциостатом 9.
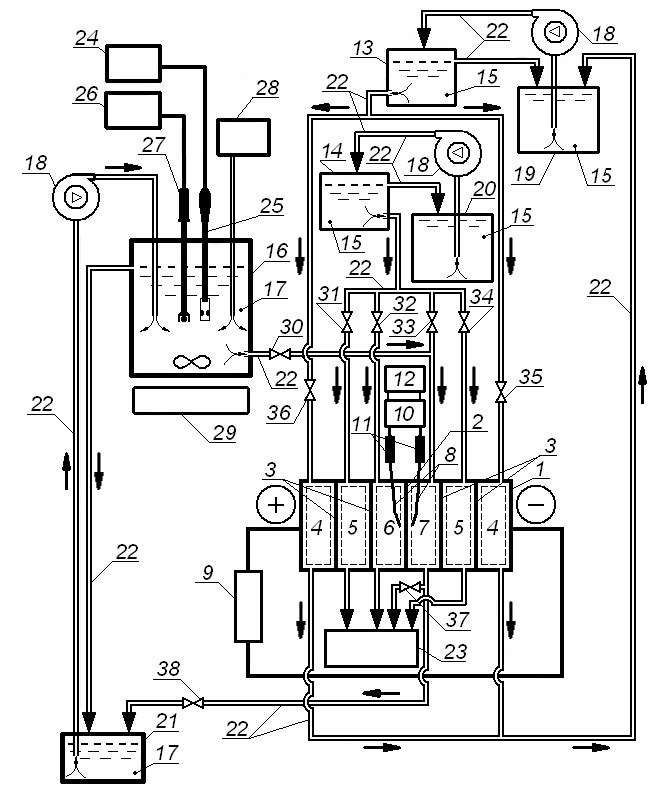
шестикамерная ячейка (1); исследуемая мембрана (2); вспомогательные мембраны (3); электродные камеры (4); буферные камеры (5); камера концентрирования (6); камера обессоливания (7); капилляры Луггина (8); потенциост (9); вольтметр (10); хлорсеребряные электроды (11); персональный компьютер (12); буферные емкости (13) и (14); рабочий раствор электролита (15); буферная емкость (16), предназначенная для накопления обессоливаемого раствора электролита (17); насосы (18); емкости (19) и (20) для подачи раствора электролита; емкость (21) для подачи обессоливаемого раствора электролита; гибкие трубки (22); емкость (23) для слива отработанного раствора; кондуктометр (24); кондуктометрическая ячейка (25); рН-метр (26); комбинированный электрод (27); устройство (28) для поддержания постоянного значения рН в буферной емкости (16); магнитная мешалка (29); вентили (30)-(36) для регулирования скорость истечения раствора; вентили (37) и (38) для прерывания потоков раствора
Рисунок 4 – Схема установки для комплексного исследования массообменных и электрохимических характеристик ионообменной мембраны
Шестикамерную ячейку (1), можно использовать в горизонтальном и вертикальном положениях независимо от гидравлического режима работы установки. Концентрационные профили NaCl в электрохимической ячейке в случае исследования характеристик катионообменной мембраны представлены на рисунке . Если шестикамерная ячейка (1) находится в вертикальном положении, вблизи исследуемой мембраны (2) может развиваться как гравитационная конвекция, так и электроконвекция. В тех случаях, когда шестикамерная ячейка (1) расположена горизонтально, то более легкий обедненный диффузионный слой электролита находится под исследуемой мембраной (2), и гравитационная конвекция в непосредственной близости от исследуемой мембраны (2) отсутствует [23].
В том случае, если установка (рисунок 4) работает в режиме определения массообменных характеристик ионообменной мембраны (чисел переноса и парциальных ВАХ противоионов через исследуемую мембрану), в буферную ёмкость (16) и ёмкость для подачи раствора электролита (21) заливают обессоливаемый раствор электролита (17) известной концентрации. В процессе эксперимента концентрация обессоливаемого раствора электролита (17) убывает. Из буферных емкостей (13) и (14) рабочий раствор электролита (15) самотеком поступает в электродные камеры (4), буферные камеры (5) и камеру концентрирования (6) шестикамерной ячейки (1). Через электродные камеры (4) шестикамерной ячейки (1) раствор электролита (15) возвращается в емкость (19) для подачи раствора электролита. В емкость (20) в процессе эксперимента рабочий раствор электролита (15) необходимо доливать по мере его расходования. Отработанный раствор электролита из буферных камер (5) и камеры концентрирования (6) течет в емкость (23) для слива отработанного раствора электролита. Скорость протока раствора рабочего электролита (15) через электродные камеры (4) регулируется вентилями (35) и (36), через буферные камеры (5) – вентилями (31) и (34) и камеру концентрирования (6) – вентилем (32). Из буферной емкости (16) обессоливаемый раствор электролита (17) самотеком поступает в камеру обессоливания (7), а затем в ёмкость (21) для подачи раствора электролита, откуда насосом (18) закачивается в буферную ёмкость (16). Вентили (33) и (37) закрыты. Вентиль (38) открыт, а вентилем (30) регулируют скорость протока обессоливаемого раствора электролита (17) через камеру обессоливания (7) шестикамерной ячейки (1). При наложении электрического поля с помощью потенциостата (9) концентрация обессоливаемого раствора электролита (17) убывает за счет переноса противоионов соли через соответствующие мембраны. В случае неодинаковой скорости генерации H+/OH– ионов на обращенных в камеру обессоливания (7) поверхностях мембран (2) и (3) pH обессоливаемого раствора (17) в буферной ёмкости (16) поддерживается постоянным, путем дозирования в неё титранта устройством (28). Для равномерного перемешивания обессоливаемого раствора электролита (17) в буферной емкости (16) используют магнитную мешалку (29). Весь эксперимент проводят при постоянном (контролируемом вольтметром (10)) скачке потенциала между капиллярами Луггина (8), Такой режим достигается симбатным регулированием задаваемого значения тока при уменьшении концентрации обессоливаемого раствора электролита (17) в буферной емкости (16). При наличии электрохимического комплекса Autolab поддержание постоянного потенциала между измерительными хлорсеребряными электродами может осуществляться в автоматическом режиме.
Электропроводность (концентрацию) и pH обессоливаемого раствора электролита (17) в буферной емкости (16) регистрируют через равные промежутки времени кондуктометром (24) и pH-метром (26) с помощью кондуктометрической ячейки (25) и комбинированного электрода (27) соответственно. По изменению состава обессоливаемого раствора электролита (17) в буферной емкости (16) можно рассчитать числа переноса и парциальные ВАХ по току.
2.3 Порядок работы с потенциостатом и программатором
Потенциостат ПИ-50-1.1 предназначен для исследования быстро протекающих электрохимических процессов на границе электрод-электролит потенциостатическим, потенциодинамическим и импульсным методом. Основными функциями потенциостата является регулирование заданного потенциала исследуемого (рабочего) электрода в режиме «ПОТЕНЦИОСТАТ» или регулирование заданного тока поляризации в цепи исследуемого (рабочего) электрода в режиме «ГАЛЬВАНОСТАТ» независимо от процессов, происходящих в электрохимической ячейке. Регулирование потенциала рабочего электрода осуществляется путем автоматического изменения поляризующего (выходного) тока потенциостата. Регулирование тока поляризации в цепи рабочего электрода осуществляется путем автоматического изменения выходного напряжения потенциостата. В потенциостате ПИ-50-1.1 предусмотрена возможность работы с электрохимическими ячейками как трехэлектродными (вспомогательный, рабочий, сравнения), так и четырехэлектродными (имеющими еще один вспомогательный электрод). Кроме того рабочий электрод ячейки соединяют проводом, обозначенным буквой «К», со входом схемы компенсации. Подключение компенсационного провода обязательно как в режиме «ПОТЕНЦИОСТАТ», так и в режиме «ГАЛЬВАНОСТАТ».
Подключение электрохимической ячейки к потенциостату осуществляется с помощью специального кабеля, который подключают к гнезду «Выход» потенциостата, а четыре штепселя этого кабеля подключают к ячейке согласно маркировке, нанесенной на планке у штепселя. Штепселя «Р.Э.» и «К» должны быть подключены обязательно вместе к выводу рабочего электрода ячейки. Вход электрометра должен быть подключен к выводу электрода сравнения ячейки.
Включение и выключение потенциостата производят в следующем порядке:
- проверяют наличие и надежность заземления базового блока потенциостата;
- нажимают кнопки: «ПОТЕНЦИОСТАТ», «ВЫКЛ»(«КОМП.IR»); «РУЧН», «ЯЧ.ОТКЛ.»;
- включают вилку кабеля питания в розетку сети;
- нажимают кнопку «СЕТЬ»; должны засветится индикаторы «СЕТЬ», «ЗАЩИТА», «ЯЧ.ОТКЛ.» и «1A/V»;
- нажимают кнопку «ЗАЩИТА»; при этом одноименный индикатор должен погаснуть. Указатели индикаторов «НАПРЯЖЕНИЕ» и «ТОК» должны установиться в положение «0».
Для выключения потенциостата нажимают кнопку «ЯЧ.ОТКЛ.», а затем отжимают кнопку «СЕТЬ». При этом все индикаторы погаснут. Время установления рабочего режима не более 30 минут. Время непрерывной работы 24 часа. Время перерыва до повторного включения один час. После включения потенциостата необходимо подготовить его к работе. Подготовка осуществляется путем установки нулей усилителя потенциостата. Проверка установки нуля является обязательной операцией при подготовке потенциостата к работе. Проверку производят или с использованием усилителя потенциостата, или встроенного цифрового индикатора. Проверку установки нуля с использованием усилителя потенциостата производят в следующем порядке:
- К гнезду «ВЫХОД» потенциостата подключают кабель, предназначенный для соединения с ячейкой, но штепселя этого кабеля к ячейке не подключают. Штепселя «К» (компенсационный провод) и «Р.Э.» (рабочий электрод) соединяют вместе. Все остальные штепселя к корпусу потенциостата и друг другу касаться не должны;
- К гнезду «ЭЛЕКТРОМЕТР» потенциостата подключают кабель электрометр, а вход последнего (штепсель) соединяют с корпусом электрометра;
- кабелем соединяют гнездо «ВХОД» потенциостата с гнездом «УСТ.0», расположенным на задней стороне потенциостата;
- включают потенциостат. Спустя пять минут начинают проверку установки нуля с тем, чтобы через 30 минут уточнить ее;
- нажимают кнопки «ПОТЕНЦИОСТАТ» и «0,1A/V»;
- поворачивают ручку «КОМП.IR» влево до упора и нажимают кнопку «ВКЛ.»;
- потенциометром «УСТ.0» на электрометре устанавливают указатель индикатора «НАПРЯЖЕНИЕ» на нулевую отметку;
- поочередно нажимают кнопки «ГАЛЬВАНОСТАТ» и «ПОТЕНЦИОСТАТ». При этом в обоих случаях указатель индикатора должен быть на нулевой отметке с возможным отклонением ± 8 деления шкалы (что соответствует разбалансу в 0,5 мВ по входу усилителя потенциостата;
- нажимают «ЯЧ.ОТКЛ.»
Программатор ПР-8 предназначен для формирования ступенчатых и линейно изменяющихся во времени напряжений, используемых в качестве задающих в потенциостатах, гальваностатах, полярографах и других устройствах, применяемых для электрохимических исследований в лабораториях. Программатор вырабатывает программы, состоящие из двух частей: ступенчатой программы и линейной программы. В верхней части программатора задается ступенчатая программа (СП), она формируется из четырех шагов (1-4). Параметры, вводимые в программу: напряжения шагов и их полярность; длительность шагов. В средней части программатора задается линейная программа (ЛП), она также состоит из четырех шагов (4-8). В ней задается: начальное напряжение и его полярность; конечные напряжения шагов и их полярность; крутизна шагов и их полярность или длительность шагов. В нижней части программатора формируется общая работа программатора. В ней задается количество повторений ступенчатой и линейной программ; коэффициент деления выходного напряжения; запуск одноразовый или N-разовый (повторение всей программы).
Выходное напряжение программатора до пуска программы и после ее окончания равно установленному начальному напряжению. Выходное напряжение программатора во время хода программы равно алгебраической сумме начального напряжения и напряжений каждого из восьми шагов установленной программы. Таким образом, изменение начального напряжения представляется возможным легко и быстро сдвигать всю программу, как до пуска программы, так и во время хода ее. Напряжение шагов СП и конечные напряжения шагов ЛП задаются относительно начального напряжения, причем конечное напряжение восьмого шага не задается оно всегда равно нулю. Перед включением программатора для проверки следует убедиться в надежности его заземления (контакт заземления находить на задней панели программатора).
Для регистрации потенциала используется вольтметр, подключенный к компьютеру. Для обработки и записи, передающихся с вольтметра данных Рытухиным Д. разработана специальная программа.
2.4 Порядок автоматизированной регистрации вольтамперных характеристик и хронопотенциограмм
- Включить вольтметр В7-65/5.
- Присоединить электроды к измеряемому источнику напряжения.
- На подсоединенном к вольтметру компьютере запустить программу Voltmeter.
- В программе: Основное менюCommunicationConnect
- На передней панели вольтметра нажать последовательно кнопки «МЕНЮ», «ТПД» (начнется передача данных в COM-порт компьютера).
- При необходимости изменения точности измерения на вольтметре можно нажимать кнопки «<», «>» для увеличения и уменьшения точности измерения соответственно.
- На панели программы PC:
а) установить Time interval (ms) (время, через которое снимать значения);
б) установить Time period (s) (время, в течении которого производить измерения);
в) нажать кнопку START (начинается запись измерений).
После окончания измерений можно сохранить (Основное менюFileSave) либо очистить массив полученных данных (кнопка Clear).
Прервать процесс измерения можно кнопкой STOP или дождаться окончания установленного Time periods.
- После окончания измерения выключить программу, выключить вольтметр.
2.5 Особенности работы с программатором ПР-8 и потенциостатом ПИ-50-1.1
- При выборе делителя на потенциостате необходимо учитывать, что значения тока на включенных диапазонах крутизны (делителя) не должно превышать более чем в два раза номинальное значение тока. В противном случае срабатывает «ЗАЩИТА» потенциостата, при этом на передней панели ПИ-50-1.1 загорается одноименный индикатор. В таблице 2 приведены значения делителя и силы тока  , до которой «работает» соответствующий делитель.
, до которой «работает» соответствующий делитель.
Таблица 2 – Соотношения между значениями делителей потенциостата и задаваемым значением силы тока
|
Делитель
|
«1 мА/В»
|
«10 мА/В»
|
«0,1 А/В»
|
«1 А/В»
|
|
I, мА
|
2
|
20
|
200
|
2000
|
- Систематические погрешность программатора  мВ. Эта погрешность устраняется установлением на восьмом шаге величины погрешности.
мВ. Эта погрешность устраняется установлением на восьмом шаге величины погрешности.
- Значения, задаваемые на программаторе должны быть на два порядка больше погрешности программатора.
- На пятом, шестом и седьмом шагах программатора переключатель 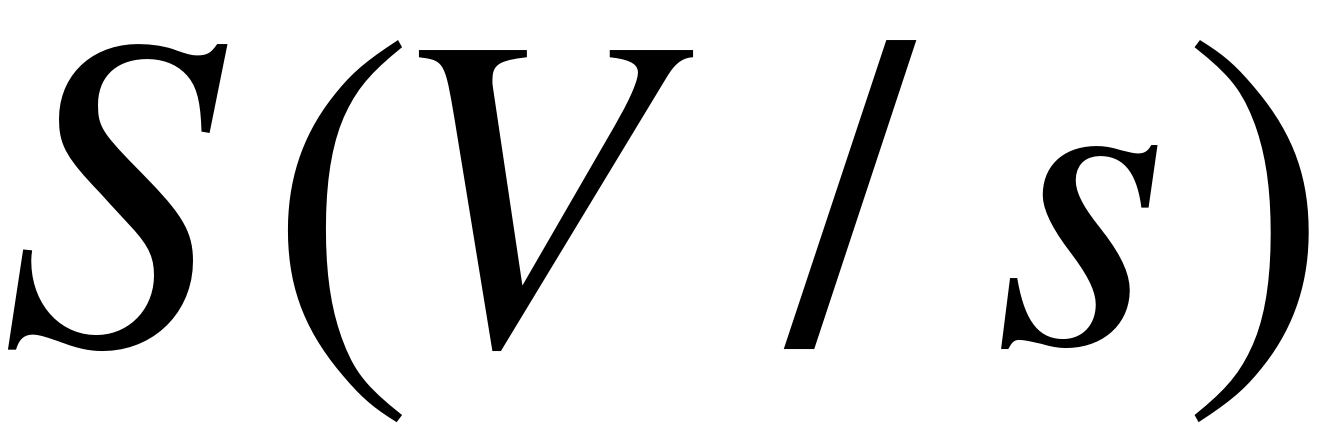 ,
, 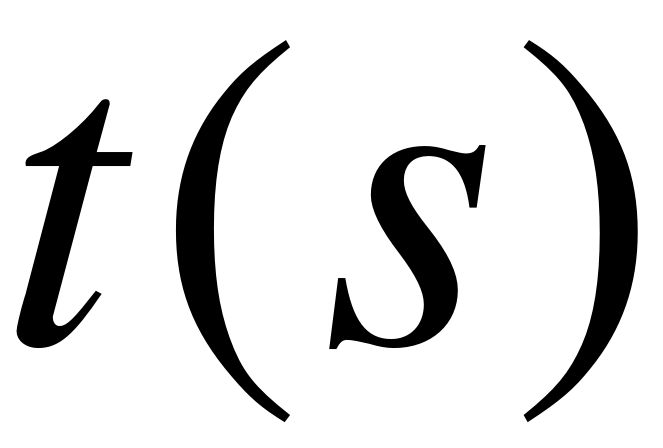 в положении
в положении  не работает.
не работает.
Соотношения между значениями, задаваемыми на программаторе, и делителем на потенциостате. Наблюдаемая величина  , мА. Величина, задаваемая на программаторе
, мА. Величина, задаваемая на программаторе  , мВ. Используя делитель потенциостата на «выходе» необходимо получить мА. В таблице 3 приведено соотношение между величиной делителя, указанной на передней панели потенциостата и значением
, мВ. Используя делитель потенциостата на «выходе» необходимо получить мА. В таблице 3 приведено соотношение между величиной делителя, указанной на передней панели потенциостата и значением  , используемой в расчетах при составлении программы для программатора ПР-8.
, используемой в расчетах при составлении программы для программатора ПР-8.
Таблица 3 – Значения делителя потенциостата ПИ-50-1.1
|
Делитель
|
«1 мА/В»
|
«10 мА/В»
|
«0,1 А/В»
|
«1 А/В»
|
|
 , А/В , А/В
|
0,001
|
0,01
|
0,1
|
1
|
Т.е. мы должны задаваемую на программаторе величину  , мВ умножить на величину делителя
, мВ умножить на величину делителя  ,
, 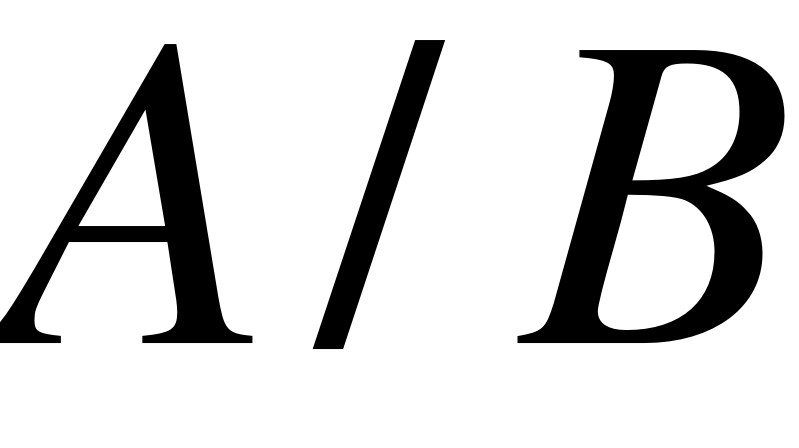 и получим на «выходе» необходимое значение
и получим на «выходе» необходимое значение 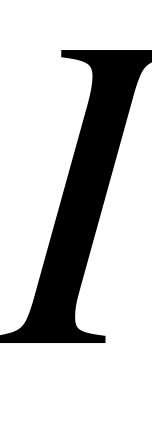 , мА. Например, необходимо задать
, мА. Например, необходимо задать 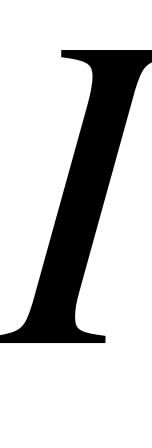 = 30,4 мА. Учитывая погрешность программатора, теоретически надо использовать делитель потенциостата 10 мА/В и задать
= 30,4 мА. Учитывая погрешность программатора, теоретически надо использовать делитель потенциостата 10 мА/В и задать  = 3040 мВ. Но воспоминаем, что этим делителем можно пользоваться только до 20 мА. Значит, необходимый делитель 0,1 А/В и, следовательно, на программаторе необходимо задать 304 мВ.
= 3040 мВ. Но воспоминаем, что этим делителем можно пользоваться только до 20 мА. Значит, необходимый делитель 0,1 А/В и, следовательно, на программаторе необходимо задать 304 мВ.
Выбранный делитель не влияет на величину скорости развертки потенциала. Скорость развертки выбирается с учетом времени протекания эксперимента. Например, время снятия ВАХ не должно быть меньше 25 мин. и не должно превышать 3 ч.
2.6 Определение массообменных характеристик ионообменных мембран
Концентрационные зависимости коэффициентов массопереноса получены в той же ячейке, что ВАХ и ХП в квазиравновесных условиях методом медленного (менее 1 % в минуту) [30] уменьшения концентрации pH-статируемого раствора в промежуточной ёмкости, введённой в тракт обессоливания (рисунок 5). Перед началом эксперимента этот тракт заполняется 0.03 М раствором NaCl. Исходный объем раствора в тракте обессоливания составляет 0.12 дм3. Исследованный в данной работе диапазон постоянных скачков потенциала между капиллярами Луггина составляет от 0.75 В до 3.0 В (рисунок 5).
Исследования проведены при температуре 250.5 oC. Ёмкость (3) снабжена датчиками pH, электропроводности и температуры, сигналы от которых поступают в ПК с интервалом 2 мин. pH раствора в промежуточной ёмкости (3) поддерживают постоянным путём непрерывного добавления титранта (NaOH или HCl). Значения концентрации NaCl в каждый момент времени рассчитывают по специальной программе с использованием второго приближения Дебая–Гюккеля. Через те же промежутки времени идёт цифровая запись силы тока в электрохимической ячейке. Продолжительность каждого эксперимента составляет 6-8 часов.
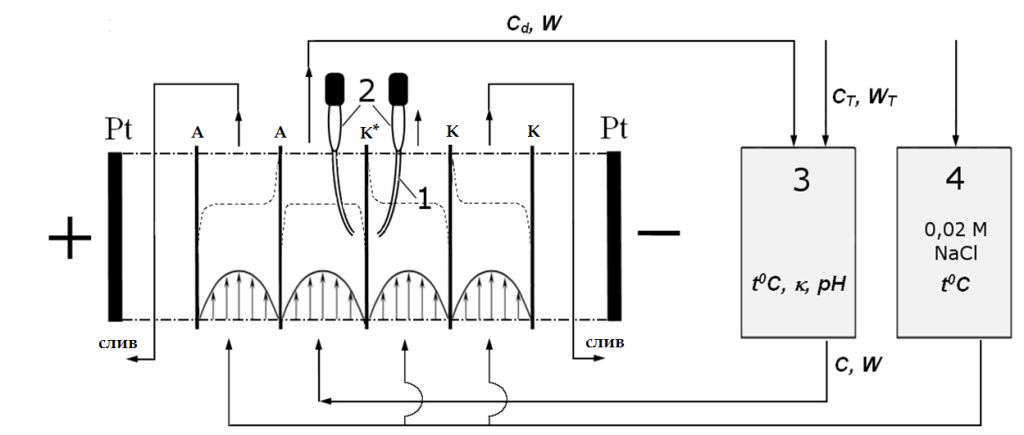 Концентрационные профили NaCl в каждой из камер указаны пунктирной линией; стрелками показаны векторы скоростей вынужденного течения раствора.
Концентрационные профили NaCl в каждой из камер указаны пунктирной линией; стрелками показаны векторы скоростей вынужденного течения раствора.
Рисунок 5 – Принципиальная схема установки, используемой для измерения вольтамперных характеристик, хронопотенциограмм и коэффициентов массопереноса: капилляры Луггина (1), находящиеся на расстоянии около 0,8 мм от обеих поверхностей исследуемой мембраны (К*) и соединённые с измерительными Ag/AgCl электродами (2); промежуточная ёмкость (3) тракта обессоливания с мешалкой и помещёнными в неё датчиками pH, удельной электропроводности и температуры; ёмкость (4) с 0,02 М раствором NaCl, питающим остальные камеры электрохимической ячейки
Скорость массопереноса для каждой из мембран КО может быть определена по скорости снижения концентрации ионов соли в растворе, находящемся в промежуточной ёмкости. Концентрация соли в этой ёмкости изменяется из-за переноса ионов через мембраны КО в соседние камеры, а также вследствие добавления щёлочи (кислоты) в эту ёмкость для того, чтобы поддержать pH раствора в ней равным 6. Материальный баланс для ионов i в тракте обессоливания описывается уравнением:
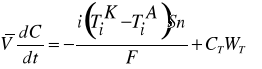 , (8)
, (8)
где  – эффективные числа переноса противоиона i соответственно через катионо- и анионообменную мембраны канала обессоливания, (
– эффективные числа переноса противоиона i соответственно через катионо- и анионообменную мембраны канала обессоливания, (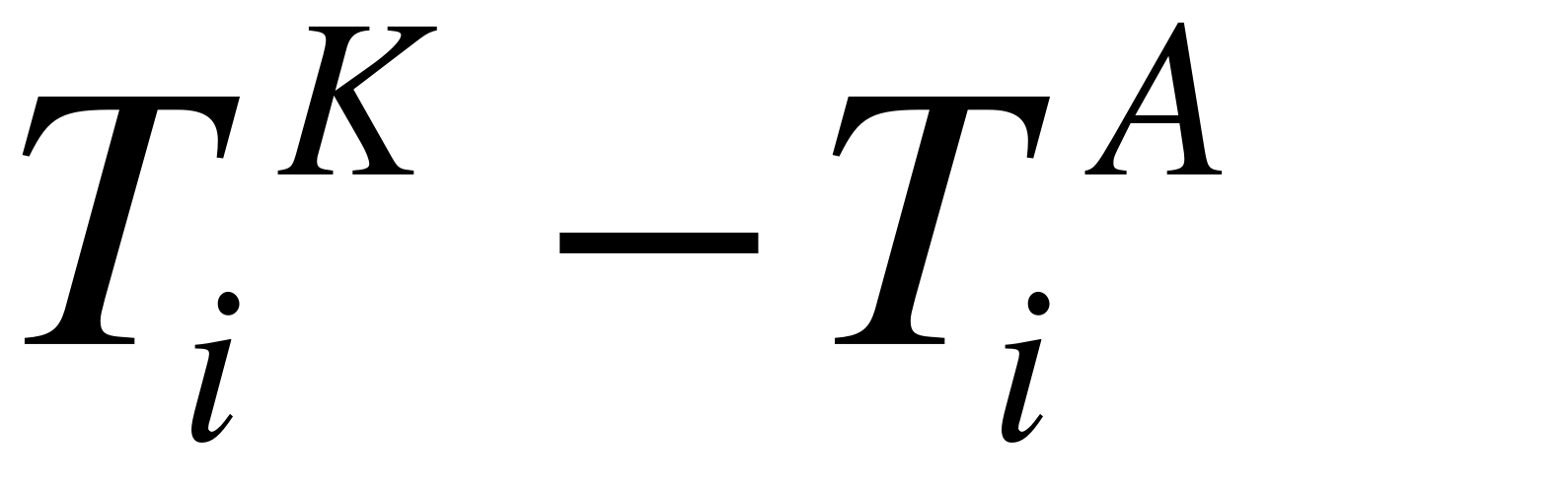 ) – выход по току для ионов i; С – текущая концентрация соли (NaCl) в промежуточной ёмкости;
) – выход по току для ионов i; С – текущая концентрация соли (NaCl) в промежуточной ёмкости;  – объем раствора в тракте обессоливания (включая его объём в ёмкости, КО ячейки и соединительных трубках); n – число камер обессоливания (n=1);
– объем раствора в тракте обессоливания (включая его объём в ёмкости, КО ячейки и соединительных трубках); n – число камер обессоливания (n=1);  и
и 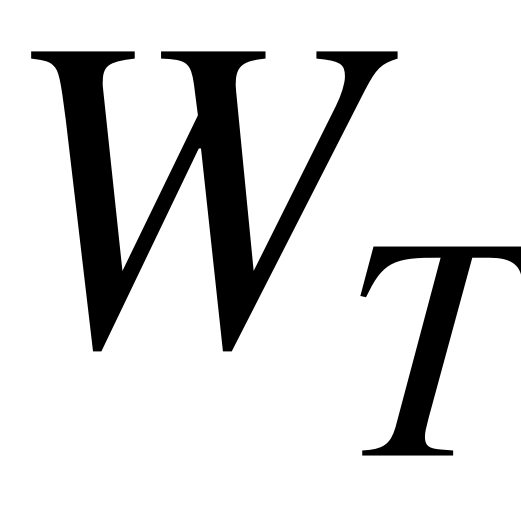 – концентрация и объемная скорость титранта (HCl или NaOH), добавляемого в промежуточную ёмкость; S –площадь активной поверхности мембраны. Первый член правой части уравнения (8) описывает изменение концентрации ионов соли в ёмкости, вызванное электродиализным обессоливанием; второй член – добавлением титранта.
– концентрация и объемная скорость титранта (HCl или NaOH), добавляемого в промежуточную ёмкость; S –площадь активной поверхности мембраны. Первый член правой части уравнения (8) описывает изменение концентрации ионов соли в ёмкости, вызванное электродиализным обессоливанием; второй член – добавлением титранта.
Коэффициент массопереноса, характеризующий скорость переноса противоиона через исследуемую мембрану (в рассмотренных случаях – это катионообменная мембрана, противоион – ион Na+) определяется как
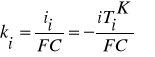 , (9)
, (9)
где ii – парциальная плотность тока противоиона соли через исследуемую мембрану.
В случае, когда переносом коионов соли через вспомогательную мембрану можно пренебречь ( <<1) из уравнения (8) с учетом определения (9) найдем:
<<1) из уравнения (8) с учетом определения (9) найдем:
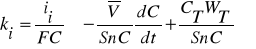 . (10)
. (10)
Уравнение (10) справедливо для того иона соли, который добавляется в промежуточную емкость вместе с титрантом: для ионов Na+ если добавляется NaOH (случай подкисления обессоливаемого раствора), или для ионов Cl-, если добавляется HCl (случай подщелачивания обессоливаемого раствора). Для иона соли, который не добавляется вместе с титрантом, уравнение для расчета коэффициента массопереноса имеет вид:
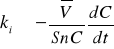 . (11)
. (11)
Инструментальная (приборная) погрешность измерений коэффициента массопереноса, определенная по стандартной методике [32], составляет ±6 %.
Рассчитав коэффициент массопереноса по формулам (9) и (10) можно перейти к определению других массообменных характеристик:
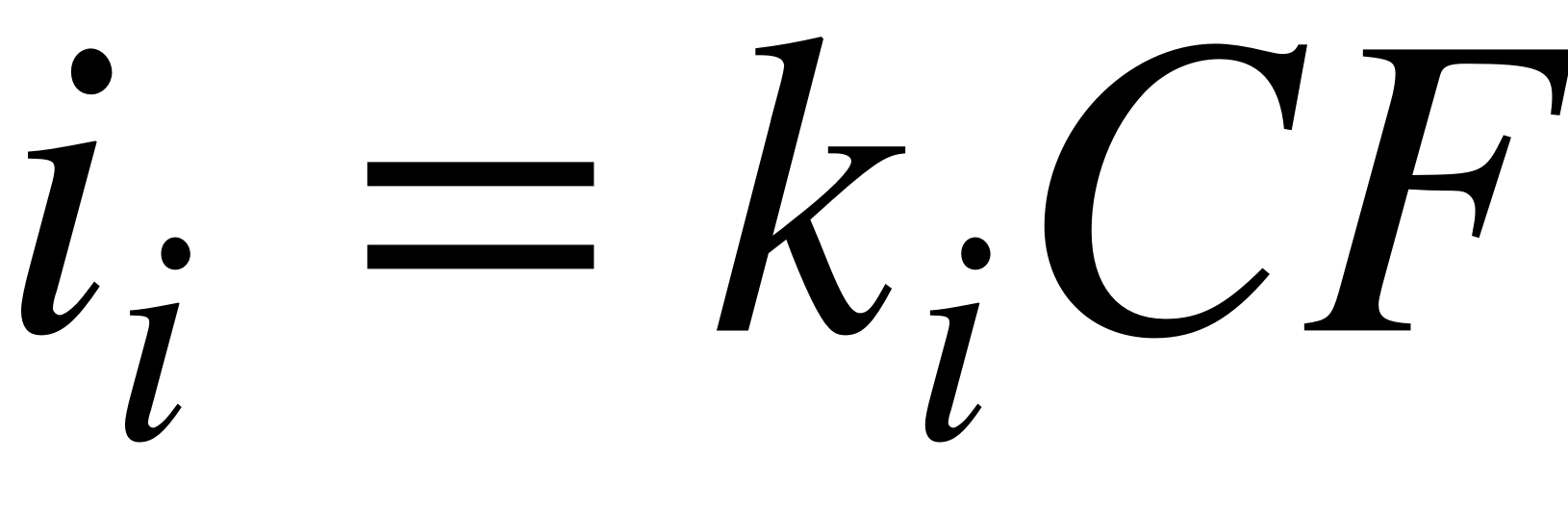 , (12)
, (12)
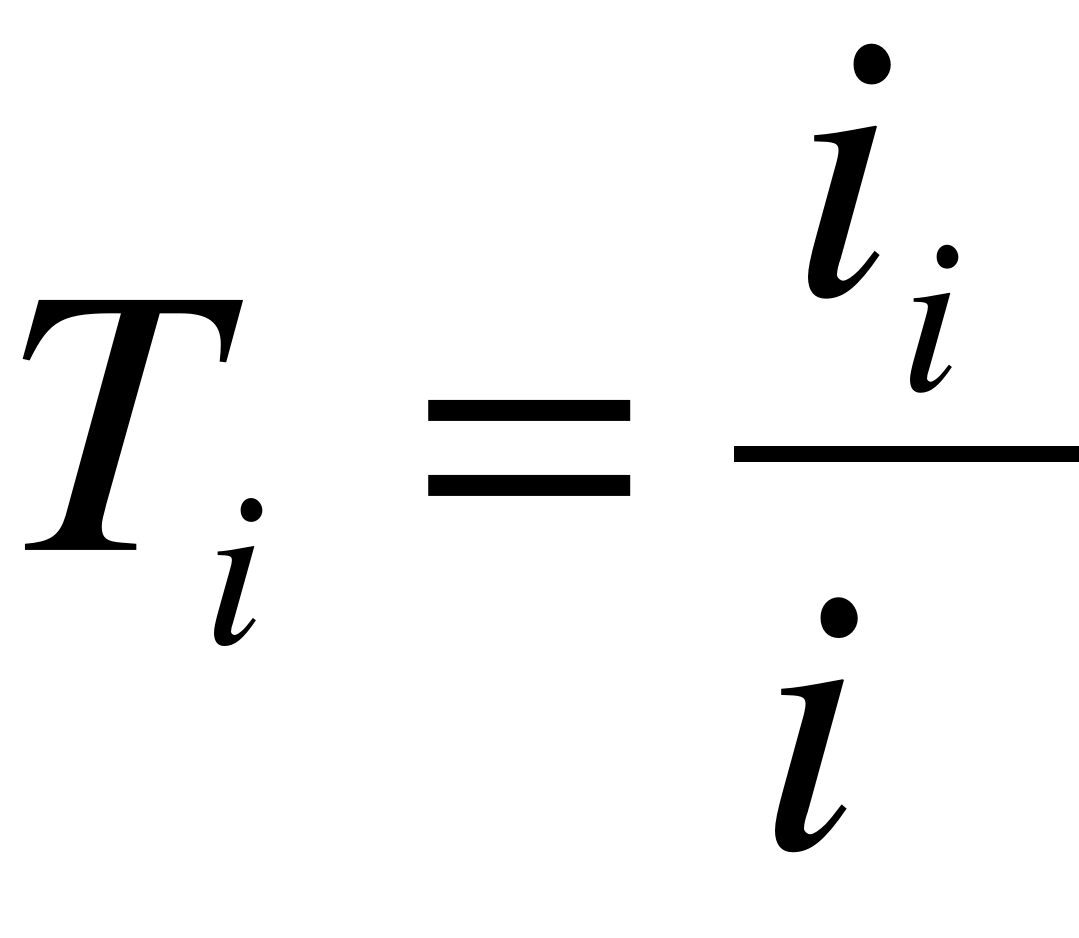 , (13)
, (13)
где 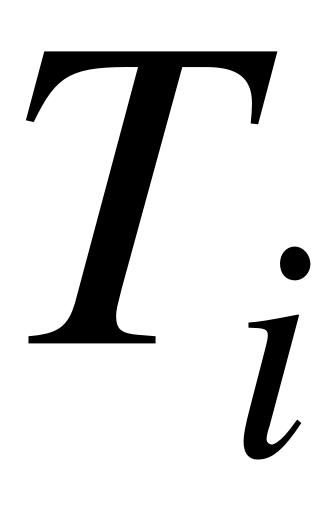 – число переноса противоиона через мембрану.
– число переноса противоиона через мембрану.
Проведение экспериментов при различных значениях 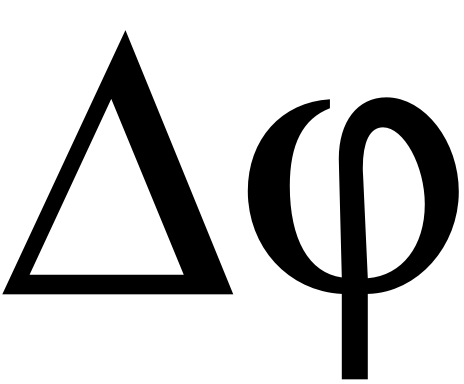 позволяет в достаточно сжатые сроки получить трёхмерную картину влияния на массообменные характеристики исследуемой мембраны, как концентрации электролита, так и степени поляризации мембранной системы.
позволяет в достаточно сжатые сроки получить трёхмерную картину влияния на массообменные характеристики исследуемой мембраны, как концентрации электролита, так и степени поляризации мембранной системы.
Отличительными признаками данной методики являются:
- использование вспомогательной мембраны с более низкой каталитической активностью фиксированных групп для исключения конкурентного переноса через исследуемую мембрану продуктов диссоциации воды, генерируемых на вспомогательной мембране;
- медленное (не более 1%/мин) [37] изменение концентрации pH-статируемого раствора, поступающего в канал обессоливания для обеспечения квазистационарного процесса обессоливания;
- использование тех диапазонов концентраций соли (0,001 МC0,03 М), когда можно пренебречь переносом через исследуемую мембрану коионов [37] и продуктов диссоциации угольной кислоты, образующейся вследствие непрерывного растворения атмосферного углекислого газа в рабочем растворе [37];
- создание условий для ламинарного режима течения раствора между мембранами и минимизации краевых эффектов (отсутствие наполнителя, применение специальных устройств ввода-вывода), когда толщина диффузионного слоя в отсутствии сопряженных эффектов хорошо описывается уравнением Левека, полученном в рамках теории конвективной диффузии;
- возможность вращения мембранной системы в поле тяжести Земли (для оценки вклада в массоперенос гравитационной конвекции).
2.7 Методика обработки экспериментальных данных
Методики изучения массообменных характеристик мембран в растворах NaCl уже разработаны. Согласно этой методике небольшой объём раствора циркулирует через тракт обессоливания. Коэффициенты массопереноса, парциальные токи и числа переноса ионов натрия и протонов через катионообменную мембрану и ионов хлора и ионов гидроксила через анионообменную мембрану находят из кинетических зависимостей концентрации ионов соли и pH раствора, циркулирующего в тракте обессоливания.
Для обработки данных изучения массообменных характеристик для раствора тартрата калия, нами была разработана методика расчета, применимая для сложных растворов.

Из формулы (14) мы находим концентрацию ионов водорода в нашей системе.
(14)
Концентрации ионов T2-, HT-, H2T и K+ мы находим по формулам (15-17).
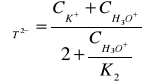
(15)
(16)
(17)
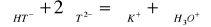
(18)
Так как расчеты с учетом ионной силы раствора показали большую степень воспроизводимости и меньший процент ошибки (относительная погрешность 10 %), в разработке модели расчетов использовалась формула (19) для нахождения электропроводности каждого из ионов
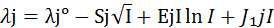
(19)
где коэффициенты вычисляются по формулам
(20)
(21)
(22)
(23)
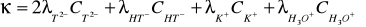
Суммарная электропроводность вычислялась по закону Кольрауша из уравнения электронейтральности (18).
(24)
Калибровочные зависимости были рассчитаны с использованием закона Кольрауша. Способ первый – в формулу (24) подставляли значения эквивалентных электропроводностей для бесконечно разбавленных растворов. Способ второй – для расчётов использовали значения эквивалентных электропроводностей, найденные с учётом влияния на эти величины ионной силы раствора. Для учёта этого влияния использовали формулы (19)-(23), выведенные в статье [39].
Для расчета предельных токов было использовано уравнение Левека.
(24)
В случае получения концентрационных зависимостей массообменных характеристик значение pH в ёмкости тракта обессоливания поддерживалось постоянным. Задача заключалась в том, чтобы из заданного значения pH и значений электропроводности рассчитать концентрации отдельных компонентов раствора.
Для этого решали систему уравнений, которая состояла из уравнений химических равновесий, уравнения электронейтральности и уравнения Кольрауша.
Проверка адекватности проведённых расчётов была сделана следующим образом. Методом разбавления приготовили серию растворов, измерили их электропроводность и pH при заданной температуре.
Расчет электропроводности этого раствора производили с привлечением эквивалентных электропроводностей при бесконечном разбавлении раствора. В другом расчёте использовали эквивалентные электропроводности, найденные с учётом значения ионной силы раствора. Для их вычисления брали коэффициенты из таблицы 4, из работы «Conductivity Studies on Aqueous Solutions of Stereoisomers of Tartaric Acid and Tartrates. Part III. Acidic Tartrates».
Таблица 4 – Коэффициенты для осуществления расчётов по уравнениям (19)-(23)
Сравнение результатов расчёта и экспериментальных данных (рисунок 6) показало, что влияние ионной силы раствора необходимо обязательно учитывать, не смотря на то, что мы работали в области достаточно разбавленных растворов. В этом случае относительная ошибка не превышала 6 %
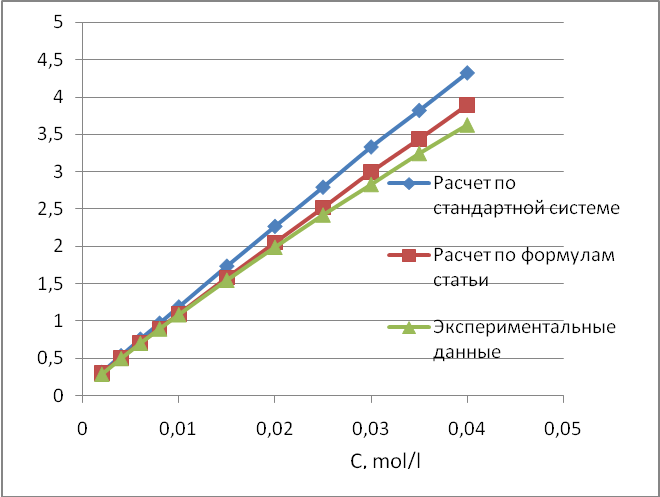
Рисунок 6 - Сравнительный калибровочный график для 25 градусов

Рисунок 7 – Сравнительный калибровочный график для 20 градусов. Экспериментальное значение электропроводности раствора при суммарной концентрации гидротартрата 0,03 М обозначено крестом.
Эти же коэффициенты, полученные из полуэмпирических зависимостей, были использованы для построения калибровочной кривой для температуры 20 градусов (рисунок 7), при которой мы изучали массообменные характеристики мембраны AMX. Оказалось, что в рассматриваемом нами диапазоне концентраций концентрационная зависимость аппроксимируется прямой линией. Это простое уравнение
y=84,008x+0,1305 (25)
позволяет находить суммарную концентрацию тартратов в растворе, если известна его электропроводность.
3 Результаты и обсуждение
Полученная вольтамперная характеристика демонстрирует более высокий предельный ток по сравнению с рассчитанным по уравнению Левека (24).
Рисунок 8 – Вольтамперная характеристика мембраны AMX в 0.02 М раствора KHT. Пунктирная линия – значение предельного тока, рассчитанное по уравнению Левека. Штрих-пунктирные линии – скачки потенциала, при которых осуществлено измерение массообменных характеристик
Для получения массообменных характеристик выбраны значения скачка потенциала 0,75 В – чуть выше экспериментального предельного тока – и 1,5 В – сверхпредельный токовый режим.
Концентрационные зависимости всех составляющих обессоливаемого раствора в эксперименте найдены по кинетическим зависимостям электропроводности и pH растворов промежуточной ёмкости трата обессоливания.
а
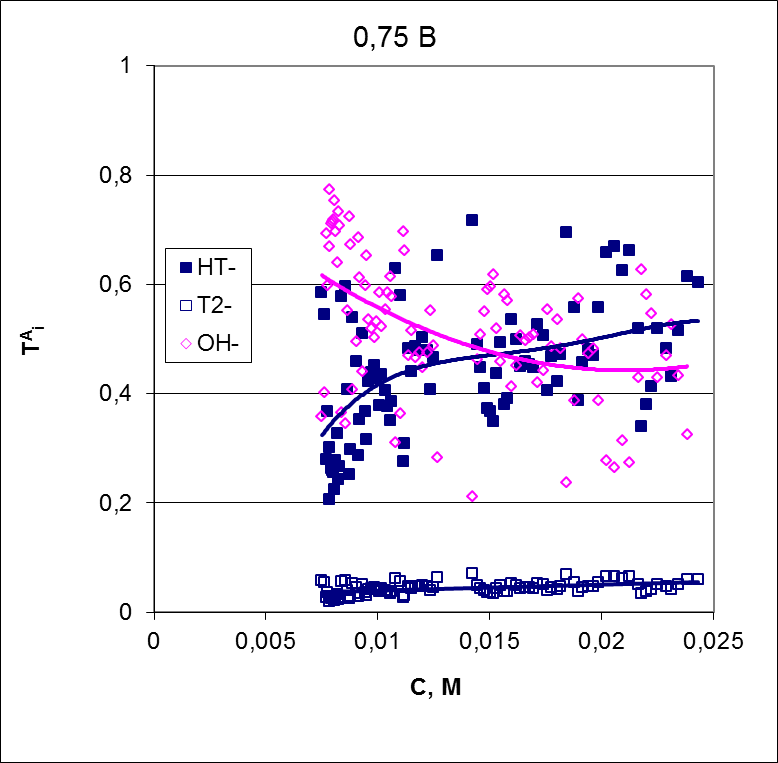
б
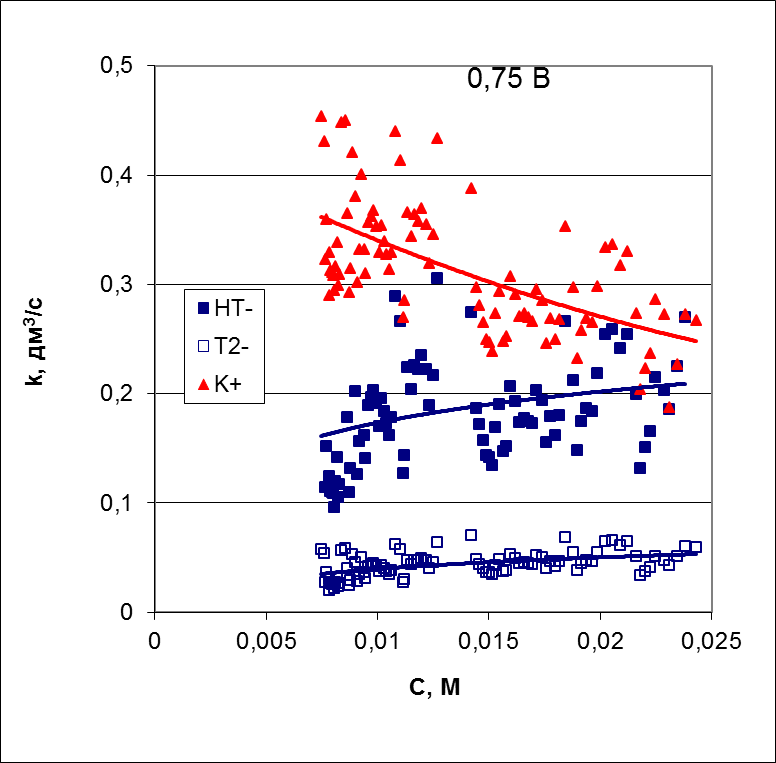
Рисунок 9 – Концентрационные зависимости коэффициента массопереноса (а) и чисел переноса (б) противоионов для анионообменной мембраны AMX, полученные при скачке потенциала 0,75 В
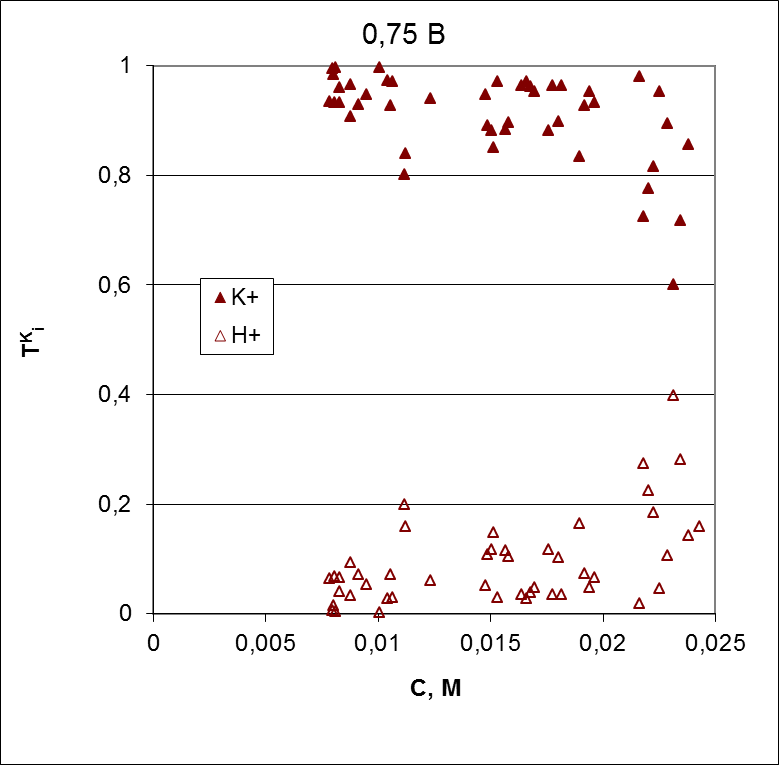
в
Рисунок 10 – Концентрационные зависимости чисел переноса противоионов для катионообменной мембраны МК-40, полученные при скачке потенциала 0,75 В (вместе с исследуемой мембраной AMX данная мембрана образовывала канал обессоливания)
Для расчёта коэффициентов массопереноса и чисел переноса отдельных противоионов анионообменных мембран использованы уравнения (9-13). Для расчёта массообменных характеристик катионообменных мембран учитывается скорость добавления в циркулирующий раствор титранта KOH.
Из анализа этих данных следует, что коэффициент массопереноса катиона калия через катионообменную мембрану растёт с разбавлением раствора. Эти данные находятся в хорошем согласии с литературными данными для NaCl.
Коэффициент массопереноса двухзарядного аниона гидротартрата практически не зависит от концентрации, а аналогичный коэффициент однозарядного гидротартрата постепенно падает с разбавлением раствора. Причиной этого падения является нарастающий перенос ионов гидроксила, числа переноса которого возрастают с 0,4 при концентрации 0,025 М до 0,7
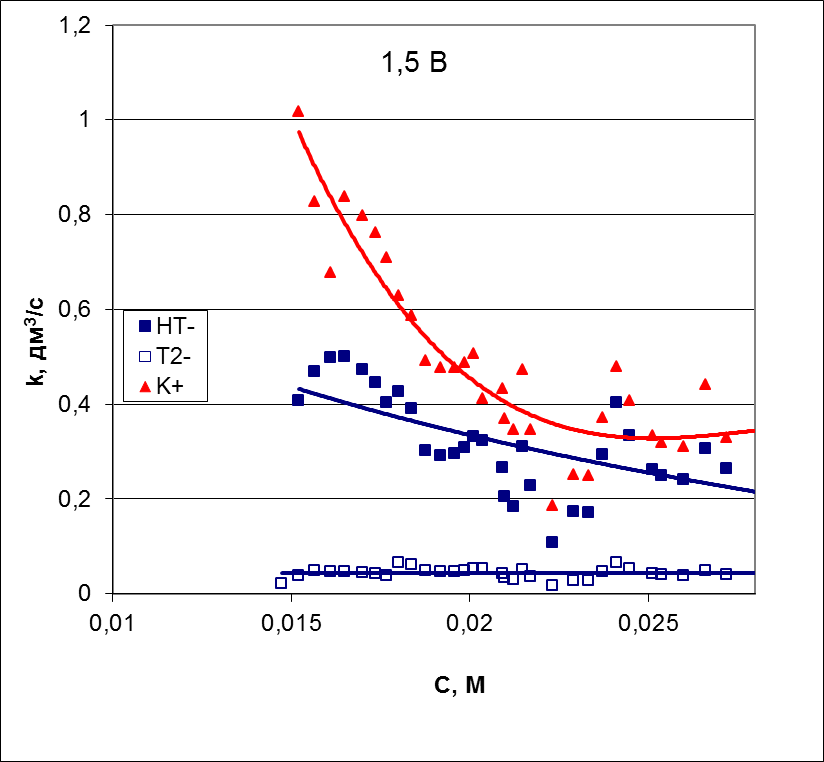
а
б
Рисунок 11 – Концентрационные зависимости коэффициента массопереноса (а) и чисел переноса (б) противоионов для анионообменной мембраны AMX, полученные при скачке потенциала 1,5 В
при концентрации 0,008 М. В то же время числа переноса протонов через катионообменную мембрану практически равны 1 и слабо меняются в исследованном диапазоне концентраций. Увеличение скачка потенциала до 1,5 В приводит к ещё более резкому росту коэффициента массопереноса иона калия с разбавлением раствора.
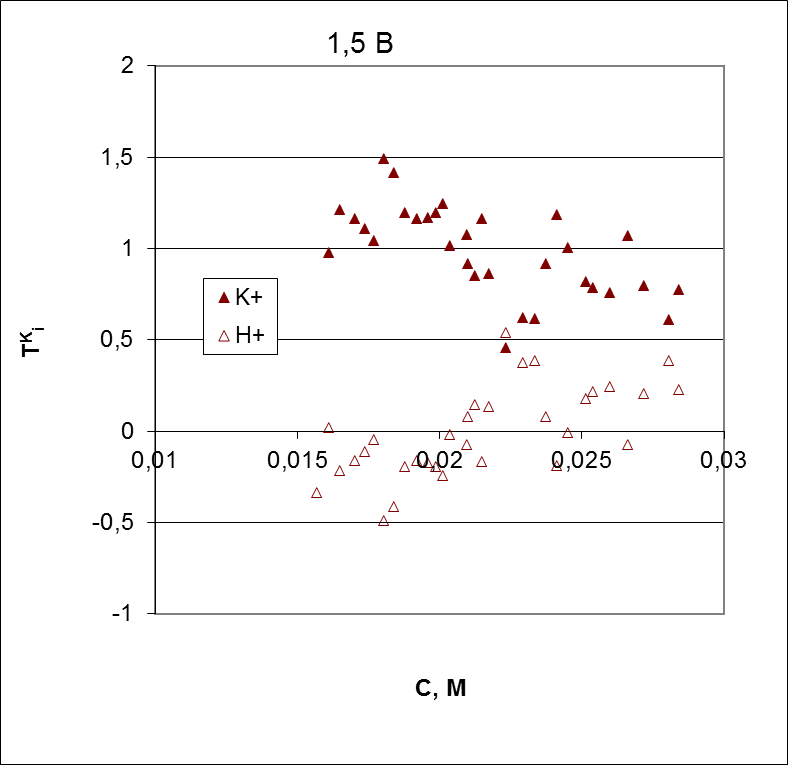
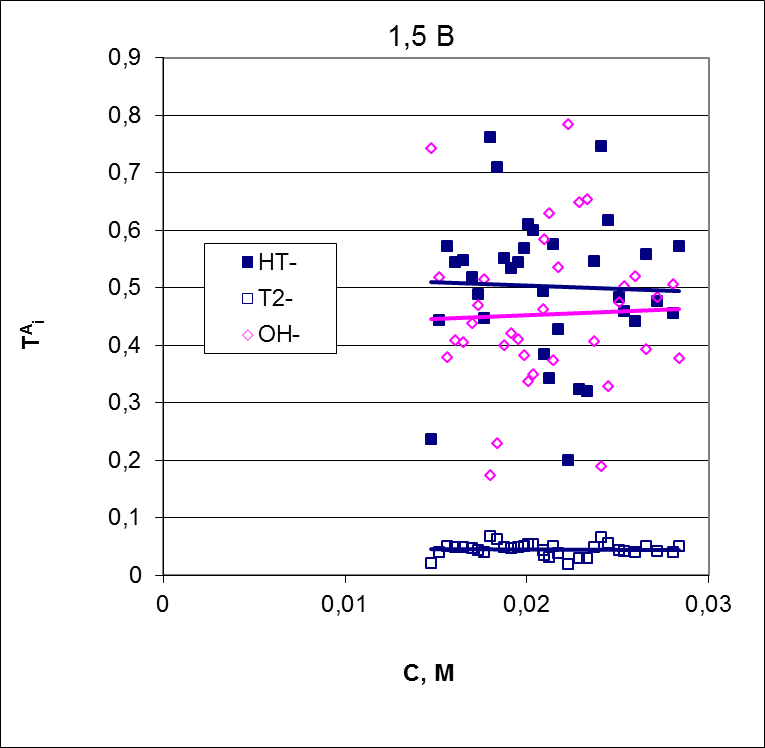
Рисунок 12 – Концентрационные зависимости чисел переноса противоионов для катионообменной мембраны МК-40, полученные при скачке потенциала 1,5 В (вместе с исследуемой мембраной AMX данная мембрана образовывала канал обессоливания)
Причиной, по-видимому, является развитие электроконвекции у поверхности катионообменной мембраны. Коэффициент массопереноса аниона гидротартрата увеличивается почти в 2 раза по сравнению с данными, полученными при скачке потенциала 0,75 В. Более того, наблюдается небольшой рост этого параметра с разбавлением раствора. В исследованном диапазоне концентраций мы не наблюдаем роста чисел переноса ионов гидроксила, но сами значения этих чисел остаются примерно такими же, как и в случае скачка потенциала 0,75 В.
Высокие значения чисел переноса по ионам гидроксила свидетельствуют об усилении генерации H+, OH- в присутствии амфолита. Механизм этой генерации отличается от наблюдаемого в мембранных системах с NaCl. Эта генерация вероятнее всего связана не с реакциями протолиза фиксированных групп на границе мембрана/раствор. Она обусловлена депротонированием ионов гидроксила, которые затем переносятся через мембрану в виде двухзарядных ионов. Протоны же выносятся электрическим полем в обессоливаемый раствор. Косвенным подтверждением такого механизма является тот факт, что на обеспечение заданного значения pH в случае обессоливания раствора KHT уходит на порядок больше KOH, чем в случае обессоливания раствора NaCl.
Следует также принять во внимание, что в растворе присутствует до 13 % молекулярной формы винной кислоты, влияние которой на потоки ионов через анионообменную мембрану пока не совсем понятно.
ЗАКЛЮЧЕНИЕ
Так как подавляющее большинство исследований в области изучения мембранных процессов проведено в растворах NaCl, вместе с тем, наиболее часто ионообменные мембраны используются в амфолит содержащих растворах, когда транспорт ионов осложнён реакциями переноса протона, актуальность данной работы не вызывает сомнений.
Целью работы являлось изучение электрохимических характеристик и процесса массопереноса анионообменной мембраны AMX в растворе гидротартрата калия.
В ходе работы нами были выполнены все поставленные перед нами цели и задачи, что позволяет сделать следующие выводы:
- Предложена методика определения концентрационных зависимостей коэффициентов массопереноса и чисел переноса одно- и двухзарядных противоионов для анионообменных мембран, которые участвуют в обессоливании раствора гидротартрата калия.
- Показано, что в случае обессоливания 0,02 М раствора гидротартрата калия числа переноса ионов гидроксила являются высокими даже в области предельных токов.
- Вероятнее всего, в основе наблюдаемого явления лежит не усиление реакций протонирования - депротонирования фиксированных групп на границе мембрана/раствор (как в случае растворов NaCl), а депротонирование ионов дигидротартрата, которые затем переносятся через мембрану в виде двухзарядных ионов. Протоны же выносятся электрическим полем в обессоливаемый раствор.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Nikonenko, V.V. Intensive current transfer in membrane systems: Modelling, mechanisms and application in electrodialysis / V.V. Nikonenko, N.D. Pismenskaya, E.I. Belova, Ph. Sistat., P. Huguet, G. Pourcelly, Ch. Larchet // Adv. Colloid and Interface Sci. – 2010. – Vol. 160. – P.101-123.
- Гельферих, Ф. Иониты. – М.: Иностр. лит., 1962. – 490 с.
- Manzanares, J. Interfacial Kinetics and Mass Transport, Diffusion and migration / J. Manzanares, K. Kontturi // Encyclopedia of Electrochemistry / ed by M. Stratmann, E.J. Calvo. Indianapolis: Whiley Publishing Inc. – 2003. – Vol. 2. – P.81-121.
- Хванг, Т. Мембранные процессы разделения / Т. Хванг, С. Каммермейер; под ред. Ю.И. Дытнерского. – М.: Химия, 1981. – 464 с.
- Заболоцкий, В.И. Перенос ионов в мембранах / В.И. Заболоцкий, В.В. Никоненко. – М.: Наука, 1996. – 390 с.
- Larchet, Ch. A simplified procedure for ion-exchange membrane characterization / Ch. Larchet, L. Dammak, B. Auclair, S. Parchikov, V.A. Nikonenko // New J. Chem. – 2004. Vol. 28. – P.1260-1267.
- Koros, W.J. Terminology for membranes and membrane processes (IUPAC Recommendations 1996) / W.J. Koros, Y.H. Ma, T. Shimidzu // Pure Appl. Chem. – 1996. – Vol. 68, № 7. – P.1479-1489.
- Strathmann, H. Ion-exchange membrane separation processes. Membrane Science and Technology Ser. 9. / H. Strathmann. – Amsterdam : Elsevier, 2004. – 360 p.
- Rubinstein, I. Electro-osmotically induced convection at a permselective membrane / I. Rubinstein, B. Zaltzman // Phys. Rev. E. – 2000. Vol. 62, № 2. – P.2238-2251.
- Дамаскин, Б.Б. Электрохимия / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина. – М.: Химия, 2001. – 624 с.
- Peers, A.M. Membrane phenomena / A.M. Peers // Disk. Faraday Soc. – 1956. – Vol. 21. – P.124-125.
- Гнусин, Н.П. Конвективно-диффузионная модель процесса электродиализного обессоливания. Предельный ток и диффузионный слой / Н.П. Гнусин, В.И. Заболоцкий, В.В. Никоненко, М.Х. Уртенов // Электрохимия. – 1986. – Т. 22, № 3. – С.298-302.
- Ньюмен, Дж. Электрохимические системы / Под ред. Ю.А. Чизмаджиева. М.: Мир, 1977. 463 с.
- Zabolotsky, V.I. Coupled transport phenomena in overlimiting current electrodialysis / V.I. Zabolotsky, V.V. Nikonenko, N.D. Pismenskaya, M.Kh. Urtenov, E.V. Laktionov, H. Strathmann, M. Wessling, G.H. Koops // Sep. Pur. Tech. – 1998. – Vol. 14. – P.255-267.
- Forgacs, C. Polarization at Ion-Exchange Membranes in Electrodialysis / C. Forgacs, N. Ishibashi, J. Leibovitz, J. Sinkovic, K.S. Spiegler // Desalination. – 1972. – Vol. 10, № 2. – P.181-214.
- Davis, T.A. Membrane technology in chemical industry / T.A. Davis, V. Grebenyuk, O. Grebenyuk. – Weinheim: Wiley-VCH, 2001. – 222 p.
- Balster, J. Morphology and microtopology of cation-exchange polymers and the origin of the overlimiting current / J. Balster, M.H. Yildirim, D.F. Stamatialis, R. Ibanez, G.H. Lammertink, V. Jordan, M. Wessling // J. Phys. Chem. B. – 2007. – Vol. 111. – P.2152-2165.
- Lu, J. Numerical simulation of the electrodeionization (EDI) process accounting for water dissociation / J. Lu, Y-X. Wang, J. Zhu // Electrochim. Acta – 2010. – Vol. 55, № 8. – P. 2673-2686.
- Zaltzman, B. Electroosmotic slip and electroconvective instability / B. Zaltzman, I. Rubinstein // J. Fluid Mech. – 2007. – Vol. 579. – P.173-226.
- Belova, E.I. Effect of anion-exchange membrane surface properties on mechanisms of overlimiting mass transfer / E.I. Belova, G.Yu. Lopatkova, N.D. Pismenskaya, V.V. Nikonenko, C. Larchet, G. Pourcelly // J. Phys. Chem. B. – 2006. – Vol. 110, № 27. – P.13458-13469.
- Shaposhnik, V.A. The interferometric investigations of electromembrane processes / V.A. Shaposhnik, V.I. Vasil'eva, O.V. Grigorchuk // Adv. Colloid Interface Sci. – 2008. – Vol. 139. – P.74-82.
- Xu, T. Ion exchange membranes: State of their development and perspective / T. Xu // J. Membr. Sci. – 2005. – Vol. 263. – P. 1-29.
- Письменская Н.Д. Сопряжённая конвекция раствора у поверхности ионообменных мембран при интенсивных токовых режимах / Н.Д. Письменская, В.В. Никоненко, Е.И. Белова, Г.Ю. Лопаткова, Ф. Систа, Ж. Пурсели, К. Ларше // Электрохимия. – 2007. – Т. 43, № 3. – С.325-345.
- Simons, R. Electric field effects on proton transfer between ionizable groups and water in ion exchange membranes // Electrochimica Acta. – 1984. – Vol. 29. – P. 151-158.
- Заболоцкий, В.И. Диссоциация молекул воды в системах с ионообменными мембранами / В.И. Заболоцкий, Н.В. Шельдешов, Н.П. Гнусин // Успехи химии. – 1988. – Т. 57. – С.1403-1414.
- Strathmann, H. Limiting current density and water dissociation in bipolar mem-branes / H. Strathmann, J.J. Krol, H.-J. Rapp, G. Eigenberger // J. Membr. Sci. – 1997. – Vol. 125, N 1. – P.123-142.
- Krol, J.J. Concentration polarization with monopolar ion exchange membranes: current-voltage curves and water dissociation / J.J. Krol, M. Wessling, H. Strathmann // J. Membr. Sci. – 1999. – Vol. 162, N 1/2. – P.145-154.
- Danielsson, C.O. A model for the enhanced water dissociation on monopolar membranes / C.O. Danielsson, A. Dahlkild, A. Velin, M. Behm // Electrochim. Acta. – 2009. – Vol. 54. – P. 2983-2991.
- Умнов, В.В. Вольт-амперная характеристика области пространственного за-ряда биполярной мембраны / В.В. Умнов, Н.В. Шельдешов, В.И. Заболоцкий // Электрохимия. – 1999. – Т. 35, № 8. – С. 871-878.
- Hurwitz, H.D. Experimental and theoretical investigations of steady and transient states in systems of ion exchange bipolar membranes / H.D. Hurwitz, R. Dibiani // J. Membr. Sci. 2004. Vol. 228. P.17-43.
- Hamann, C.H. Electrochemistry / C.H. Hamann, A. Hamnett, W. Vielstich. VCH: Wiley, Weinheim, 1998. – 423 p.
- Заболоцкий, В.И. Исследование влияния природы ионогенных групп мембран на процесс диссоциации воды и перенос ионов электролита методом вращающегося мембранного диска / В.И. Заболоцкий, М.В. Шарафан, Н.В. Шельдешов // Электрохимия. – 2008. – Т. 44, № 10. С. – С. 1213–1220.
- Харкац, Ю.И. О механизме возникновения запредельных токов на границе ионообменнная мембрана/электролит / Ю.И. Харкац // Электрохимия. – 1985. – Т.21, № 7. – С.974-977.
- Волгин, В.М. Естественно-конвективная неустойчивость электрохимических систем / В.М. Волгин, А.Д. Давыдов // Электрохимия. – 2006. – Т. 42, № 6. – С.635-678.
- Волгин В.М., Давыдов А.Д. // Электрохимия. 2006. Т. 42, № 6. С. 567.
- Pismenskiy, A.V. Mathematical modelling of gravitational convection in electrodialysis processes / A.V. Pismenskiy, V.V. Nikonenko, M. A.-K. Urtenov, G. Pourcelly // Desalination. – 2006. – Vol. 192. – P.374-379.
- Lue, S.J. Pervaporation of benzene/cyclohexane mixtures using ion-exchange membrane containing copper ions / S.J. Lue, F.J. Wang, S.-Y. Hsiaw // J. Membr. Sci. – 2004. – Vol. 240. – P. 149–158.
- Волков, А.И. Большой химический справочник / А.И. Волков, И.М.Жарский.– М.: Современная школа. – 2005. – 608с. – ISBN985-6751-04-7.
- D.R. Lide, CRC Handbook of chemistry and physics, CRC Press, New York.
Электрохимические и массообменные характеристики анионообменных мембран