ОПРЕДЕЛЕНИЕ КАРБОКСИЛЬНЫХ ГРУПП В РАЗЛИЧНЫХ СИСТЕМАХ
Министерство образования Республики Беларусь
Учреждение образования
«Могилёвский государственный университет имени А.А. Кулешова»
ОПРЕДЕЛЕНИЕ КАРБОКСИЛЬНЫХ ГРУПП В РАЗЛИЧНЫХ СИСТЕМАХ
Выпускная работа
по анализу биологических объектов
студенток 4-ого курса
дневная форма обучения
группа 4 «Х»
Н.Д. Городецкая, Е.В. Сказецкая
Научный руководитель
канд. хим. наук доцент
Н.А.Клебанова
Могилёв
2013 г.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ 3
ГЛАВА I ОБЗОР ЛИТЕРАТУРЫ 4
1.1 Химический состав, структура, характерными показатели и применение пектина
1.2 Строение, образование и применение глюкозы 10
1.3 Влияние микроорганизмов различные системы
ГЛАВА II ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Титриметрическое определение содержания карбоксильных групп в пектине
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ВВЕДЕНИЕ
В настоящее время люди потребляют большое количество пищевых волокон, но не происходит дополнительного употребления бифидобактерий для разложения большого количества волокон. В литературе было показано, что бифидобактерии продуцируют большое количество органических кислот (молочной, уксусной, янтарной) и летучих жирных кислот (уксусная, пропионовая, масляная, изомасляная, валериановая, изовалериановая, капроновая, изокапроновая), за счет которых подавляется рост и размножение патогенных и условно патогенных бактерий.
В последнее время широко используются пищевые волокна (пектин), которые также могут быть субстратами для бифидобактерий.
Пектин –водорастворимое вещество, свободное от целлюлозы и состоящее из частично или полностью метоксилированных остатков полигалактуроновой кислоты.
В процессе метаболизма за счёт образования карбоновых кислот содержание карбоксильных групп должно возрастать.
Поэтому, целью нашей исследовательской работы, было определение количества карбоксильных групп в различных системах.
Передо мной были поставлены следующие задачи:
- определение количества карбоксильных групп в пектине
- определение количества карбоксильных групп в системе пектин-бифидобактерии
- определение количества карбоксильных групп в глюкозе
- определение количества карбоксильных групп в системе глюкоза-бифидобактерии
ГЛАВА I
ОБЗОР ЛИТЕРАТУРЫ
1.1 Химический состав, детоксицирующие свойства, структура, характерными показатели и применение пектина
Пектины это природные полисахариды, которые содержатся почти во всех растениях. Как вещество, пектин был открыт более 200 лет назад и впервые получен из корнеплода топинамбура (земляной груши) [13].
Наиболее распространенным в нашей стране пектинсодержащим сырьем являются яблоки, сахарная свекла, цитрусовые, подсолнечник, клубни топинамбура и др [5,17].
Пектин способен сорбировать и выводить из организма микроорганизмы и выделяемые ими токсины, биогенные токсины, анаболики, ксенобиотики, продукты метаболизма, а также биологически вредные вещества, способные накапливаться в организме: холестерин, желчные кислоты, мочевину, билирубин, серотонин, гистамин, продукты тучных клеток [8]. В процессе усвоения пищи деметоксилизация пектина способствует превращению его в полигалактуроновую кислоту, которая соединяется с определенными тяжелыми металлами и радионуклидами, в результате чего образуются нерастворимые соли, не всасывающиеся через слизистую желудочно-кишечного тракта и выделяющиеся из организма вместе с калом [16].
Для оценки детоксицирующих свойств пектина имеют значение такие показатели как: молярная масса, уронидная составляющая, степень этерификации, содержание свободных карбоксильных групп, связывающая способность, сорбционная способность, полная статистическая обменная емкость и др [1,8].
Пектины представляют собой полисахариды клеточных стенок. Основным компонентом пектиновых полисахаридов являются полиуроновые кислоты. У высших растений они состоят из остатков D-галактуроновой кислоты, связанных С-1С-4-связями, на долю которой в зависимости от источника происхождения пектиновых веществ приходится от 83 до 90 % [14].
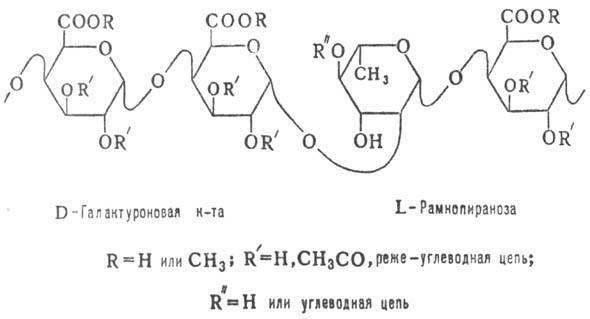
Карбоксильная группа каждого остатка D-галактуроновой кислоты может существовать в разных состояниях: образовывать соли с ионами определенных металлов, чаще всего кальция (пектат), причем атомы двух- и трехвалентных металлов могут связывать несколько цепей полигалактуроновой кислоты; соль может быть одновременно и метоксилирована (пектинат), или оставаться немодифицированной (пектовая кислота основа всех видов пектиновых веществ), или быть частично метоксилированной (эту форму обычно называют пектином) , что изображено на рисунке 1.1.1: [1]
Рисунок 1.1.1
Незначительную часть в составе пектиновых веществ составляют нейтральные полисахариды арабинаны и галактаны, что и обусловливает гетерополисахаридный характер пектина [14]. Арабинаны представляют собой разветвленные полимеры, состоящие из остатков L-арабофуранозы, соединенные между собой -С-1С-5-связями. Галактаны неразветвленные цепи, образованные из остатков D-галактопиранозы, соединенных -С-1С-4-связями. При этом возможно, что часть карбоксильных групп галактуроновой кислоты этерифицирована указанными нейтральными полисахаридами. Молекулярная масса пектиновых веществ достигает 200000.
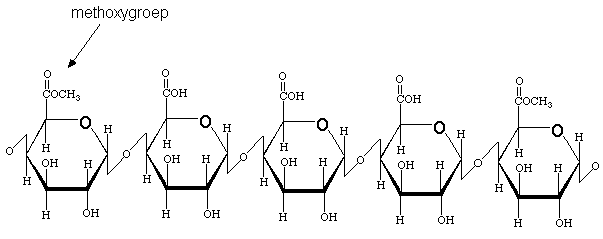
Согласно современным представлениям пектин имеет линейную структуру, в которой остатки D-галактуроновой кислоты имеют пиранозную конфигурацию. Используют и другой способ изображения молекулы пектина, в котором отдельные кольца повернуты относительно друг друга и лежат в различных плоскостях. Структурная формула пектина предствлена на рисунке 1.1.2: [6].
Рисунок 1.1.2
Пектин (pectin) –водорастворимое вещество, свободное от целлюлозы и состоящее из частично или полностью метоксилированных остатков полигалактуроновой кислоты. В зависимости от количества метоксильных групп и степени полимеризации существуют различные пектины. Н-пектин (H-pectin) –высокоэтерифицированный пектин. Имеет степень этерификации, т. е. отношение числа этерифицированных карбоксильных групп на каждые 100 карбоксильных групп пектиновой кислоты, более 50 %; L-пектин (L-pectin) –низкоэтерифицированный пектин. Имеет степень этерификации менее 50 %;
Структура и химический состав пектиновых веществ определяют пространственную форму их молекул и характер взаимодействия с другими соединениями. Установлено, что пектиновые вещества обладают структурой с ограниченной гибкостью, стабилизируемой водородными и гидрофобными связями [9].
Пектиновые растворы оптически активные, правовращающие, удельное вращение постоянно при значении рН около от 3,0 до 6,5 [5].
Характерными показателями пектина являются:
Молекулярный вес, метоксильное число, ацетильное число, растворимость в воде, вязкость золя, желеобразующая способность [4].
Содержание метоксильных групп является важным показателем пектиновых веществ. Степень этерификации полигалактуроновой кислоты меняется в широких пределах в зависимости от источника получения и способа извлечения –от полностью лишенной метоксильных групп (пектовой кислоты) до полностью замещенных всех карбоксильных остатков полигалактуроновой кислоты [6]. Пектины, полученные из разных растений, значительно различаются по степени этерификации [1].
Метоксильное число имеет большое значение для желирующих свойств пектина. Для желеобразующего пектина установлена норма содержания метоксильных групп не ниже 7 %. Количество карбоксильных груп достигает до 3,7% (свекловичный пектин содержит наибольшее количество карбоксильных групп).
Значительно в меньшем количестве содержатся в пектине ацетильные группы. Ацетильное число колеблется в широких пределах: от сотых долей процента до 2,5 %. Ацетильные группы оказывают отрицательное влияние на желирование. Установлены допустимые пределы содержания ацетильных групп для студнеобразующего пектина –не более 1 %.
Наилучшим растворителем пектиновых веществ является вода. Растворяются они также в 84%-ной фосфорной кислоте и жидком аммиаке; в глицерине и формамиде –набухают. В остальных органических и неорганических растворителях они практически нерастворимы [7].
Растворимость пектина в воде возрастает с увеличением степени этерификации и с уменьшением степени полимеризации. Из двух пектинов с одинаковой длиной цепи легче растворим тот, у которого выше метоксильное число; из двух пектинов одинаковой степени этерификации легче растворим обладающий меньшим молекулярным весом [10].
Желирующая способность пектина растительного, широко используемая пищевой промышленностью, у разных растений далеко не одинакова и зависит от относительной молекулярной массы пектина, от степени метоксилирования остатков галактуроновой кислоты и количества сопутствующих балластных веществ, концентрации сахара в растворе, температуры и рН среды [5].
Между карбоксильными и гидроксильными группами цепей пектиновой кислоты возникают водородные связи. Возможно, что водородные связи образуются также между карбоксильными и гидроксильными группами пектиновых молекул и полярными группами сахара [12].
При повышении температуры пектины разрушаются [5]. Этот процесс сопровождается уменьшением вязкости и желирующей способности. Понижение вязкости и желирующей способности вызывается разрушением суперструктуры пектиновых веществ. Оптимальной для сушки пектиновых веществ является температура, приблизительно равная 80С. При сушке выше этой температуры желеобразование пектина ухудшается в связи с происходящей деградацией.
Под действием кислот молекулы растворимых пектиновых веществ могут претерпевать одновременно два существенных изменения [2]:
а) омыление этерифицированных карбоксильных групп;
б) разрушение молекулы вследствие разрыва гликозидной связи между остатками D-галактуроновой кислоты.
При действии сильной минеральной кислоты на высокоэтерифицированную пектиновую даже при комнатной температуре через несколько недель происходит ее омыление до нерастворимой полигалактуроновой кислоты, выпадающей в осадок. Одновременно с метоксильными омыляются и ацетильные группы пектиновой молекулы. При повышении температуры кислотное омыление происходит быстрее. При дальнейшем же повышении температуры скорость этого процесса еще более возрастает, но вместе с тем начавшийся распад макромолекул по главным валентностям увеличивается настолько, что деградация начинает преобладать над омылением [6]. В присутствии сахарозы окислительный распад пектиновых веществ подавляется, т.е. сахароза является ингибитором окисления пектиновых веществ [5].
Карбоксильные и гидроксильные группы пектиновой или пектовой кислот могут вступать в химические реакции; полученные при этом соединения рассматриваются как соответствующие производные двух видов [16].
Карбоксильные группы пектина могут восстанавливаться до первичных спиртовых групп с помощью алюмогидрида лития или боргидрида натрия. Довольно легко происходит сшивка пектиновых веществ формальдегидом в присутствии соляной кислоты как катализатора, в результате чего образуется метилольный полуацеталь пектина [3].
При взаимодействии пектиновых веществ с полифункциональными соединениями образуются пространственные трехмерные структуры. В качестве связующих агентов используют диметилдихлорсилан, глиоксаль, дихлорэтилсульфамид и др [11].
Применение пектина:
Объединенный комитет экспертов ФАО/ВОЗ по пищевым добавкам рекомендует пектин как безопасную добавку без ограничения приемлемой дозы ежедневного потребления [16]. Одно из направлений применения пектинов связано с их использованием в фармацевтических технологиях. Вместе с тем большой интерес вызывают результаты экспериментальных и клинических исследований, свидетельствующие о том, что пектины способны проявлять лечебные и профилактические свойства при ряде заболеваний, не уступая по эффективности некоторым лекарственным препаратам.
В медицине пектин используется при лечении желудочно-кишечного тракта, для профилактики сахарного диабета, онкозаболеваний [17]. Пектин способствует снижению кровяного давления, выведению из организма холестерина, нормализации обменных процессов, улучшает периферическое кровообращение, перистальтику кишечника, рекомендуется для диетического питания [17].Установлено, что пектиновые вещества тормозят процессы гниения в кишечнике больше, чем искусственно введенные дезинфицирующие вещества [15].
Пектин обладает способностью очищать организм от вредных веществ, не нарушая при этом бактериологический баланс организма. Благодаря способности пектиновых веществ не расщепляться под действием ферментов желудка, а также взаимодействовать с ионами различных металлов, они используются как профилактическое средство при интоксикации организма тяжелыми металлами [7].
Наличие в составе пектиновых веществ уроновых кислот повышает сопротивляемость организма [6].
Пектины являются вспомогательным средством при приготовлении многих лекарственных форм, служат основой для получения пастилок, суппозиториев, являются исходным сырьем в приготовлении гидрогелей, таблеток, мягких желатиновых и ректальных капсул, свечей. Используется их пролонгированное действие в таблетках, микстурах с разными лекарственными препаратам [9].
1.2 Строение, образование и применение глюкозы
Глюкоза —моносахарид, одна из восьми изомерных альдогексоз. Глюкоза в виде D-формы (декстоза, виноградный сахар) является самым распространённым углеводом. D-глюкоза (обычно её называют просто глюкозой) встречается в свободном виде и в виде олигосахаридов (тростниковый сахар, молочный сахар) , полисахаридов (крахмал, гликоген, целлюлоза, декстран) , гликозидов и других производных. В свободном виде D-глюкоза содержится в плодах, цветах и других органах растений, а также в животных тканях (в крови, мозгу и др.) . D-глюкоза является важнейшим источником энергии в организмах животных и микроорганизмов.
Продуктом полного гидролиза крахмала и целлюлозы является глюкоза. При разрыве полуацетальной (гликозидной) связи образуются гидроксильная и альдегидная (в полуацетальной форме) группы. Образование глюкозы после гидролиза крахмала и целлюлозы представлено на рисунке 1.3.1:
Рисунок 1.3.1
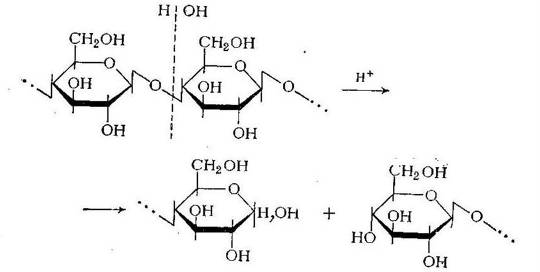
Катализаторами реакции гидролиза полисахаридов являются водородные ионы. Гидроксильные ионы не ускоряют этой реакции, благодаря чему полисахариды относительно стойки в щелочной среде и нестойки в кислой. Катализаторами реакции гидролиза полисахаридов служат также ферменты: а-глюкозидаза для крахмала и р-глюкозидаза для целлюлозы [18].
Глюкоза является альдегидоспиртом, так как атомы углерода связаны между собой сигма-связью, возможно вращение частей молекулы относительно сигма-связей. При этом альдегидная функциональная группа взаимодействует со спиртовым гидроксилом пятого углеродного атома, и образуется циклическая форма глюкозы, которая пердствлена на рисунке 1.3.1:
Рисунок 1.3.1
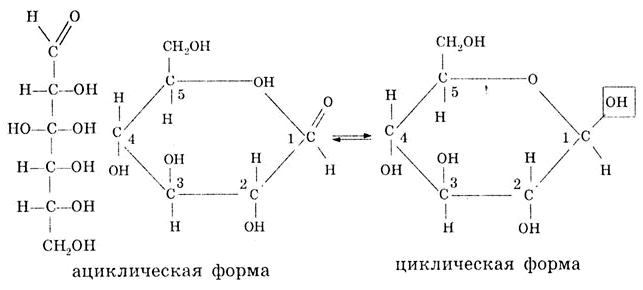
В растворе ациклическая (альдегидная) форма глюкозы находится в равновесии с циклической (полуацетальной) формой. При переходе ациклической формы в циклическую полуацетальную форму у первого углеродного атома формируется полуацетальная —гликозидная гидроксигруппа. По своим свойствам эта группа отличается от спиртовой. В циклической глюкозе, которая имеет строение кресла или лодки, полуацетальный гидроксил жестко расположен в пространстве относительно плоскости [19].
Применение глюкозы:
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению: C6H12O6 + 6O2 = 6H2O + 6CO2 + 2800 кДж. Этот процесс протекает ступенчато, и поэтому энергия выделяется медленно.
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т.д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и гликоновых кислот, для синтеза ряда производных сахаров и т.д.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
1.3 Влияние микроорганизмов различные системы
Морфологически бифидобактерии представляют собой неспорообразующие, грамположительные палочки, в старых культурах могут встречаться грамотрицательные варианты.
Для большинства штаммов оптимальной является температура 36—°С, рост почти всех штаммов прекращается при 20°С и ниже, максимальная температура находится в пределах 45—°С. Оптимальным для развития бифидобактерии является рН 6—. При рН ниже 5,5 рост этих микроорганизмов приостанавливается. Основными продуктами метаболизма при сбраживании глюкозы являются уксусная кислота и L( + )-молочная кислота с небольшой примесью муравьиной и янтарной кислот. Масляная и пропионовая кислоты и углекислый газ не образуются. Некоторые штаммы бифидобактерии продуцируют ферменты, полисахариды с различными свойствами и составом.
Наибольшее значение для организма человека имеют: Bifidobacterium bifidum, Bifidobacterium lonngum.Их содержание о организме - 10*8-10*12 КОЕ в 1 мл кишечного содержимого и составляют 90-98% от общего объема нормофлоры кишечника ( в зависимости от возраста).
Бифидобактерии участвуют в утилизации пищевых субстратов, улучшают процессы гидролиза и всасывания белков, углеводов, активизируют пищеварение и стимулирауют перистальтику толстого кишечника. Обладают детоксикационными свойствами, разлагают 50% мочевины, снимая нагрузку с почек. Оказывают стимулирующее влияние на функции печени путем обеспечения кишечно-печеночной циркуляции органических и неорганических соединений, гормонов, цитокинов, ведущих компонентов желчи-солейжелчных кислот, желчных пигментов, холестерина, кобальта, цинка.
Бифидобактерии продуцируют большое количество органических кислот (молочной, уксусной, янтарной ) и летучих жирных кислот (уксусная, пропионовая, масляная, изомасляная, валериановая, изовалериановая, капроновая, изокапроновая), за счет которых подавляется рост и размножение патогенных и условно патогенных бактерий.
Бифидобактерии способны перерабатывать моносахариды (глюкозу, галактозу и фруктозу). Для большинства бифидобактерий оптимальной является температура 36—°С, рН 6—.
При гидролизе пектиновой кислоты пектиназой в течение первых стадий разложения аккумулируются только небольшие количества свободной D-галактуроновой кислоты. Обычно ферментами разлагаются ди-, три -, тетра - и пентагалактуроновые кислоты. В последующие стадии гидролиза длинные молекулы распадаются под влиянием каталитической деятельности пектиназы и накапливаются свободная D-галактуроновая кислота и другие соединения.
Распад пектиновой кислоты может быть выражен следующей схемой:
С46Н68О40 + nН20 = СНО(СНОН)4СООН+С6Н12О6 + С5Н10О5 + С5Н10 О5 + СН3ОН + СН3СООН
Продукты распада пектиновой кислоты (галактоза, арабиноза и др.) подвергаются окислению или сбраживанию разнообразными микроорганизмами. В частности, при анаэробиозе они сбраживаются бактериями. Продуктами брожения являются органические кислоты (уксусная, молочная), а также газы Н2 и СО2, кроме указанных веществ, образует и небольшое количество ацетона и бутилового спирта.
ЧАСТЬ II
ЭКСПРИМЕНТАЛЬНАЯ
2.1 Титриметрическое определение содержания карбоксильных групп в пектине
Методика определения содержания свободных карбоксильных групп(ОСТ 18-62-72):
Около 1 г промытого и высушенного пектина помещают в колбу на 300 мл, смачивают чистым 96%-ным этиловым спиртом для предотвращения комкования и добавляют 100 мл дистиллированной воды, перемешивают и оставляют на ночь для полного растворения пектина. Раствор титруют 0,1 н NaOH до появления красного окрашивания, не исчезающего в течение 1 минуты, при добавлении 6 капель индикатора Хинтона (для его приготовления смешивают 1 объем 0,4 % бромтимолблау, 1 объем 0,4%-ного красного крезола, 3 объема 0,4% красного фенола и 1 объем дистиллированной воды).
Содержание свободных карбоксильных групп Кс, %, рассчитывают по формуле (1).
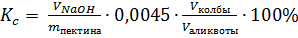 (1)
(1)
Для проведения эксперимента нами был выбран в качестве бактерий препарат «Бифидумбактерин форте». Этот препарат представляет собой микробную массу живых бактерий антоганистически активного штамма Bifidobacterium bifidum №1, сорбированных на частицах активированного угля, лиофилизированную, смешанную с лактозой.
Система пектин-бактерии:
В качестве субстрата нами был использован свекловичный пектин, который растворяли на водном термостате при температуре 40°С что известно из литературы.
Для приготовления системы брали раствор пектина, концентрацией 1 грамм на 100 миллилитров, и аккуратно всыпали бактерии (в одном пакетике не менее 50 млн колониеобразующих единиц) в колбу. Один пакетик препарата на 100 мл раствора.
Первый эксперимент проводился в течение 28 часов, результаты исследования представлены в таблице 2.1.1.
Таблица 2.1.1
|
Время, мин
|
V(NaOH)б, мл
|
V(колбы), мл
|
V(аликвоты), мл
|
m(пектина), г
|
Кс б, %
|
V(NaOH) без б, мл
|
Кс без б, %
|
Кс, %
|
|
0
|
,415
|
|
|
,11
|
,2304
|
,415
|
,2304
|
|
|
120
|
,525
|
|
|
,11
|
6,7148
|
,5
|
,6047
|
,67
|
|
240
|
,6
|
|
|
,11
|
,0450
|
,5
|
,6047
|
6,67
|
|
480
|
,6
|
|
|
,11
|
,0450
|
,5
|
,6047
|
,67
|
|
600
|
,615
|
|
|
,11
|
,1111
|
,5
|
,6047
|
,67
|
|
1440
|
,62
|
|
|
,11
|
,1331
|
,5
|
,6047
|
|
|
1680
|
,655
|
|
|
,11
|
,2872
|
,5
|
,6047
|
,33
|
Второй эксперимент проводился в течение 29 часов 30 минут, результаты исследования представлены в таблице 2.1.2.
Таблица 2.1.2
|
Время, мин
|
V(NaOH)б, мл
|
V(колбы), мл
|
V(аликвоты), мл
|
m(пектина), г
|
Кс б, %
|
V(NaOH) без б, мл
|
Кс без б, %
|
Кс, %
|
|
0
|
,43
|
|
|
,13
|
,2719
|
,43
|
,2719
|
|
|
120
|
,515
|
|
|
,13
|
,6447
|
,5
|
,5789
|
|
|
180
|
,61
|
|
|
,13
|
,0614
|
,505
|
,6009
|
,98
|
|
390
|
,61
|
|
|
,13
|
,0614
|
,505
|
,6009
|
,98
|
|
600
|
,615
|
|
|
,13
|
,0833
|
,505
|
,6009
|
7,31
|
|
1440
|
,62
|
|
|
,13
|
,1053
|
,505
|
,6009
|
,64
|
|
1590
|
,625
|
|
|
,13
|
,1272
|
,505
|
,6009
|
,97
|
|
1770
|
,635
|
|
|
,13
|
7,1711
|
,52
|
,6667
|
,57
|
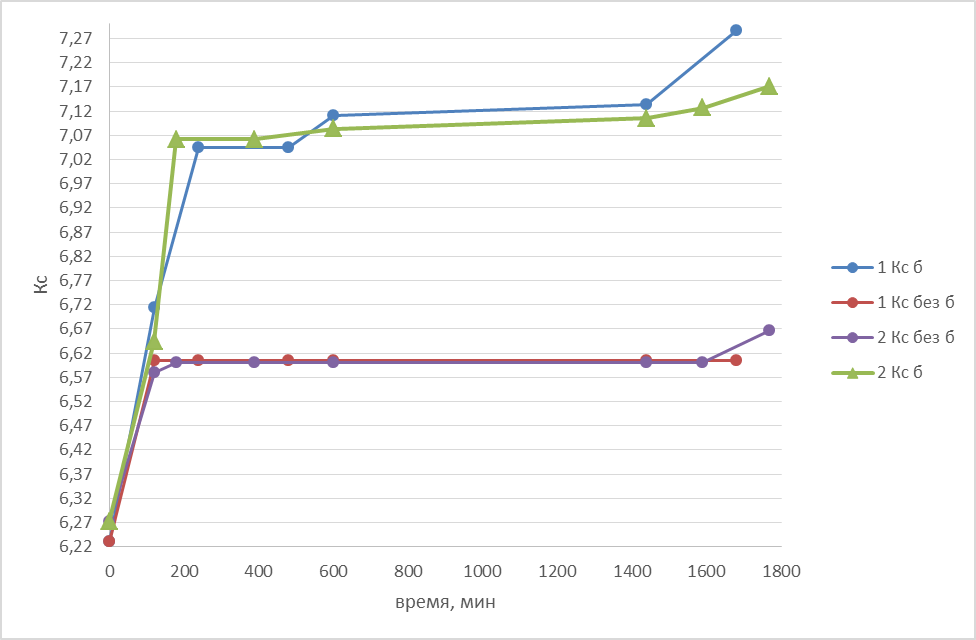
На графике 2.1.1 представлены результаты 2-х опытов:
График 2.1.1
Система глюкоза-бактерии:
В качестве субстрата нами была использована глюкоза.
Для приготовления системы брали раствор глюкозы, концентрацией 1 грамм на 100 миллилитров, и аккуратно всыпали бактерии (в одном пакетике не менее 50 млн колониеобразующих единиц) в колбу. Один пакетик препарата на 100 мл раствора.
Опыт проводился в течение 28 часов, результаты исследования представлены в таблице 2.1.3:
Таблица 2.1.3
|
Время, мин
|
V(NaOH)б, мл
|
V(колбы), мл
|
V(аликвоты), мл
|
m(глюкозы), г
|
Кс б, %
|
V(NaOH) без б, мл
|
Кс без б, %
|
Кс, %
|
|
0
|
|
|
|
,0022
|
|
|
|
|
|
120
|
,23
|
|
|
,0022
|
,5178
|
|
|
,5172
|
|
240
|
,26
|
|
|
,0022
|
,5847
|
|
|
,5847
|
|
480
|
,28
|
|
|
,0022
|
,6297
|
|
|
,6297
|
|
600
|
,29
|
|
|
,0022
|
,6522
|
|
|
,6522
|
|
1440
|
,35
|
|
|
,0022
|
,7871537
|
|
|
,7872
|
|
1680
|
0,45
|
|
|
,0022
|
,9237136
|
0
|
0
|
,01
|
Опыт проводился в течение 29 часов 30 минут, результаты исследования представлены в таблице 2.1.4:
Таблица 2.1.4
|
Время, мин
|
V(NaOH)б, мл
|
V(колбы), мл
|
V(аликвоты), мл
|
m(глюкозы), г
|
Кс б, %
|
V(NaOH) без б, мл
|
Кс без б, %
|
Кс, %
|
|
0
|
|
|
|
,0047
|
|
|
|
|
|
120
|
,15
|
|
|
,0047
|
,3372
|
|
|
,3372
|
|
180
|
,23
|
|
|
,0047
|
,5170
|
|
|
,5170
|
|
390
|
,24
|
|
|
,13
|
,5263
|
|
|
,5263
|
|
600
|
,25
|
|
|
,13
|
,5482
|
|
|
,5482
|
|
1440
|
,27
|
|
|
,13
|
,5921
|
|
|
,5921
|
|
1590
|
,31
|
|
|
,0055
|
,6967
|
|
|
,6967
|
|
1770
|
,42
|
|
|
,0055
|
,9440
|
|
|
,9440
|
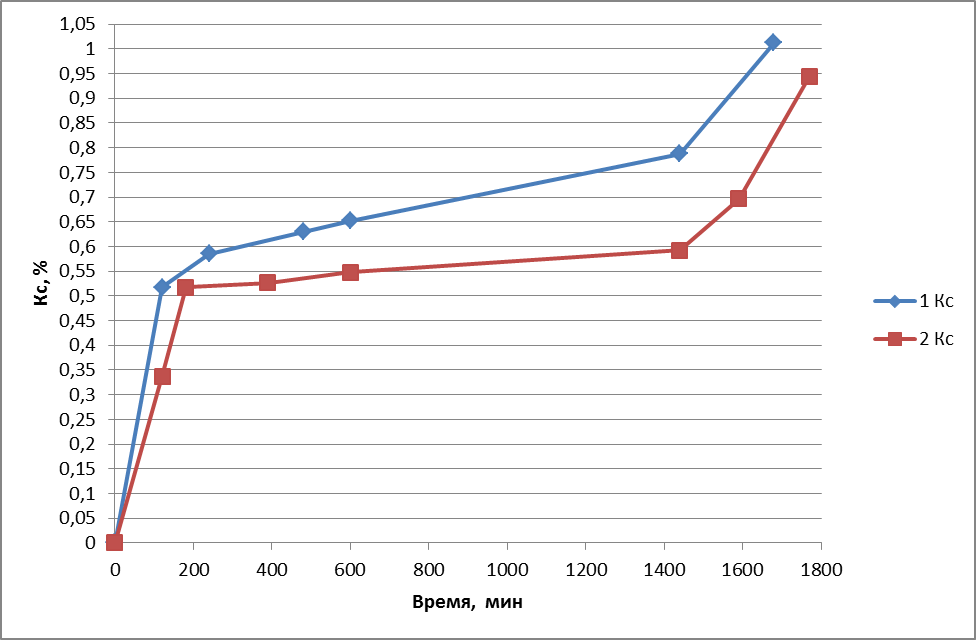
Результаты двух опытов представлены на графике 2.1.2:
График 2.1.2:
Результаты проведенной работы представлены на графике 2.1.3:
График 2.1.3

В результате было получено, что бифидобактерии увеличивают число карбоксильных групп в течении 28 часов до 10,33%.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Арасимович, В.В. Методы анализа пектиновых веществ, гемицеллюлоз и пектолитических ферментов в плодах / В.В. Арасимович, С.В. Балтага, Н.П. Пономарева.- Кишинев: АН Молд. ССР, 1970.- 84 с.
- Бек, М.М. Химия реакций комплексообразования / М.М. Бек.- М.: Мир, 1973.- 279 с.
- Березин, И.В. Практический курс химической и ферментативной кинетики / И.В. Березин.- М.: Изд-во МГУ, 1976.- 320 с.
- Василенко, Ю.К. Получение и изучение физико-химических и гепатопротекторных свойств пектиновых веществ / Ю.К. Василенко, С.В. Москаленко, Н.Ш. Кайшева // Хим.- фармац. журн.- 1997.- Т.31, № 6.- С. 28-29.
- Государственная фармакопея РФ.- 12-е изд.- М.: Науч. центр экспертизы средств мед. применения, 2007.- Ч. 1.- 704 с.
- Зависимость колориметрической реакции галактуроновой кислоты и нейтральных моносахаридов с карбазолом от условий её проведения / М.П. Филиппов [и др.] // Изв. АНМолд. ССР. Серия биолог. и хим. наук.- 1986.- №1.- С. 75.
- Исследование взаимодействия пектиновых веществ с солями меди, ртути, цинка и кадмия / Г.П. Кацева [и др.] // Химия природ. соединений.- 1988.- № 2.- С. 171-175.
- Комиссаренко, С.Н. Пектины –их свойства и применение / С.Н. Комиссаренко, В.Н. Спиридонов // Раст. ресурсы.- 1998.- Т. 34, вып. 1.- С. 111-119.
- Мелвин-Хьюз, Е.А. Равновесие и кинетика реакций в растворах / Е.А. Мелвин-Хьюз.- М.: Химия, 1975.- 472 с.
- Оводов, Ю.С. Современные представления о пектиновых веществах / Ю.С. Оводов // Биоорган. химия.- 2009.- Т.5, № 3.- С. 293-310.
- Определение комплексообразующей способности пектинов и пектинсодержащих препаратов / В.А. Компанцев [и др.] // Охрана окружающей среды.- 1991.- Вып. 3.- С. 25-27.
- Пат. 2206089 Российская Федерация, МПК G01 N31/16. Способ определения массовой доли функциональных групп полиуронидов / Н.Ш. Кайшева (РФ). - № 2001134132/04; заявл. 13.12.2001; опубл. 10.06.2003. [Электронный ресурс].- Режим доступа: http://ru-patent.info/21/80-84/2181551.html.- Загл. с экрана.
- Пектин. Тенденции научных и прикладных исследований / И.Л. Новосельская [и др.] // Химия природ. соединений.- 2000.- №1.- С. 3-11
- Пектин. ВФС 42-3433.- Введ. 1999.- 08.10.- М., 1999.- 4 с.
- Природные свойства топинамбура // Новые лекарственные препараты.- 2003.- Вып. 12.- С. 6-19.
- Рациональное питание. Рекомендуемые уровни потребления пищевых и биологически активных веществ: методические рекомендации МР 2.3.1. 19150.- Введ. 2004.- 02.06.- М.: Медицина, 2004.- 25 с.
- Разработка пищевых продуктов и лечебных препаратов на основе клубней и травы топинамбура / Н.С. Зяблицева [и др.].- Пятигорск, 2009.- 25 с.- Деп. в ВИНИТИ РАН 27.07.2009, № 497- В2009.
- Грасси Н. химия процессов деструкции полимеров. М. Издатинлит, 1959.
- В.Г. Жиряков «Органическая химия». –Москва –г.
21
ОПРЕДЕЛЕНИЕ КАРБОКСИЛЬНЫХ ГРУПП В РАЗЛИЧНЫХ СИСТЕМАХ