Общая характеристика Фотохимических и фотобиологических процессов
Контрольная работа
Общая характеристика Фотохимических и фотобиологических процессов
Содержание
1. Классификация фотобиологических процессов
2. Основные законы фотохимии
3.Спектр действия фотохимического или фотобиологического процесса
4.Основные типы фотохимических реакций
5.Фотоинактивация биологических систем. Теория мишеней
6.Защитные системы, регулирующие выживаемость клеток
7.Основные типы смерти клеток: некроз, апоптоз, аутофагия
8.Основные сигнальные пути в клетках
Литература
1. Классификация фотобиологических процессов
Все фотобиологические процессы можно подразделить на функциональные, или физиологические и деструктивные.
В функциональных фотобиологических процессах с помощью света образуются продукты, необходимые для выполнения естественных физиологических функций клетки или организма. К ним относятся:
- Фотоэнергетические процессы, в ходе которых в растениях или микроорганизмах запасается энергия. Важнейшим из таких процессов является фотосинтез, в котором энергия света преобразуется в химическую энергию и синтезируются необходимые клеткам органические вещества.
- Информационные процессы, в которых клетка или организм с помощью света получает информацию об окружающем мире. Это:
- зрение животных;
- фототаксис - движение организма к свету или от него;
- фототропизмы у растений – ориентировка или рост растения в направлении света;
- фотопериодизм растений и животных (регуляция суточных, сезонных ритмов).
- Фотобиосинтетические процессы, в которых под действием света образуются необходимые организму вещества:
- фотосинтез, в котором образуются глюкоза и другие органические вещества;
- фотоиндуцированный биосинтез хлорофилла у растений;
- синтез витамина Д у животных под действием ультрафиолетового света и т.д.
В фотодеструктивных процессах свет повреждает биомолекулы и клетки. Конечный эффект может быть связан как с непосредственным фотоповреждением важных молекул, так и с фотохимическим образованием каких-то продуктов, индуцирующих смерть клеток уже после воздействия. Так, поглощение фотонов нуклеиновыми кислотами может сразу привести к гибели организма или к изменению генетической информации – мутациям, что окажется гибельным впоследствии.
К фотобиологическим процессам также относится биолюминесценция, при которой квант не поглощается, а наоборот, излучается в результате биохимических реакций.
Любой фотобиологический процесс можно представить как последовательность первичных фотофизических и фотохимических и вторичных темновых биохимических и физиологических реакций:
1. Поглощение кванта и образование электронно-возбужденного состояния.
2. Дезактивация электронно-возбужденного состояния
а) фотофизическая - люминесценция, безизлучательная диссипация, миграция энергии,
б) фотохимическая - образование фотопродуктов.
3. Вторичные темновые реакции с участием лабильных фотопродуктов и образование стабильных фотопродуктов.
Биологический макроэффект.
2. Основные законы фотохимии
В основе фотобиологического процесса лежит фотохимическая реакция, начинающаяся c поглощения кванта, и запускающая целую цепь последующих событий. Как известно, молекулы претерпевают фотохимические превращения не в основном, а в электронно-возбужденном состоянии М*, приобретая дополнительную энергию от поглощенного кванта.1 Отсюда следует правило Гротгуса-Дрейпера: Элементарные фотохимические реакции вызываются только поглощенным светом. Это важнейшее положение фотохимии. Отраженный или рассеянный свет не вызывают фотохимического действия. Обычно фотохимические и фотобиологические процессы сложны и включают множество стадий, как первичных фотофизических и фотохимических, так и вторичных, протекающих в темноте и не требующих света. Но для того, чтобы запустить эти процессы, необходима первичная фотохимическая реакция, в которой поглощение фотона возбуждает молекулу, дает ей дополнительную энергию и приводит к образованию первичных фотопродуктов, которые затем инициируют дальнейшие процессы.
По закону Эйнштейна-Штарка, поглощенный фотон вызывает только одно первичное физическое или химическое превращение молекулы. (Этот линейный одноквантовый закон может нарушаться при очень больших интенсивностях световых потоков, когда фотохимическая реакция может осуществляться при поглощении двух квантов). Следовательно, количество образовавшихся первичных фотопродуктов определяется количеством поглощенных фотонов. Переходя к энергетическим единицам, это правило можно сформулировать так: количество образовавшихся фотопродуктов определяется поглощенной дозой световой энергии. В линейной области, в которой справедлив закон Эйнштейна-Штарка, можно считать, что количество поглощенных квантов прямо пропорционально количеству падающих квантов. Поэтому можно говорить, что количество фотопродуктов пропорционально дозе падающего света D = It, т.е. произведению интенсивности падающего света I на время облучения t, причем не важно, как набирается доза - путем увеличения интенсивности, или увеличения экспозиции. Отсюда следует правило Бунзена-Роско, или правило взаимозаменяемости интенсивности и времени облучения: интенсивность света и экспозиция взаимозаменяемы, т.е одинаковый эффект можно получить либо увеличением интенсивности света, либо временем облучения, лишь бы их произведение было одинаковым: I1 t1 = I2 t2.
В контексте этих положений, важнейшей характеристикой фотохимического и фотобиологического процесса является квантовый выход - отношение числа возбужденных молекул, вступивших в фотохимическую реакцию, nр, к общему числу возбужденных молекул, поглотивших фотон, nпогл:
= nр/nпогл,
Можно изобразить кинетическую схему фотохимического превращения вещества А в фотопродукт Р, как:
где k2 – константа скорости образования фотопродукта, а k1 характеризует процессы, не приводящие к фотохимической реакции (флуоресценция, безизлучательные переходы и т.д.). Если это одноквантовая реакция, то можно написать:
= k1/(k1+k2)
Другая характеристика фотохимической реакции – ее поперечное сечение:
= s,
где s – поперечное сечение поглощения, т.е. элементарная площадка, попадание фотона в которую обязательно приводит к его поглощению. Физический механизм поперечного сечения фотохимической реакции состоит в том, что пересекающий его, т.е. попавший в молекулу фотон, обязательно, с вероятностью, равной 1, должен вызвать фотохимическую реакцию.
3.Спектр действия фотохимического или фотобиологического процесса
Один из первых вопросов, встающих при изучении фотобиологических процессов – выяснение молекулярной природы фотоакцептора, вещества, непосредственно поглощающего фотоны и запускающего цепочку вторичных реакций.
Спектр действия фотобиологического процесса – зависимость величины фотобиологического эффекта от длины волны или частоты воздействующего света, рассчитанная на количество поглощенных фотонов.
Если рассмотреть фотохимическое превращение некоего вещества, то в одноквантовом, одноударном процессе скорость изменения числа молекул этого вещества (n) пропорциональна интенсивности поглощенного света:
dn/dt = - Iпогл = - (Io-I) = - I0(1-e-snl).
где - квантовый выход фотохимической реакции, l - толщина кюветы, а s - поперечное сечение поглощения. При малой оптической плотности раствора:
dn/dt - I0 snl.
В момент времени t:
nt n0 e Iо snlt
или:
ln (n0/nt) = (I0 t)( s)l = D l,
где D = I0t - доза падающего света, а = s – поперечное сечение фотохимической реакции. При n0 /nt = e, т.е. при nt = n0/e =37% n0 и l=1:
= 1/Dt = 1/D37,
где D37 – доза, вызывающая превращение e-1 или 37 % молекул.
Рис.1. Экспериментальное определение поперечного сечения фотохимической реакции.
Изучая экспоненциальную дозовую зависимость фотопревращения молекул (Рис.1), можно определить поперечное сечение фотохимической реакции. Еще точнее это можно сделать на линеаризованном графике:
= ln (n0/nt)/D .
Зависимость поперечного сечения фотохимической реакции от длины волны света, (), называют в фотохимии спектром действия. Экспериментально показано, что квантовый выход фотохимической реакции , как и квантовый выход люминесценции, не зависит от длины волны падающего света. Это обусловлено тем, что в реакцию вступают только возбужденные молекулы. Поэтому поперечное сечение фотохимической реакции так же зависит от длины волны света, как и поперечное сечение поглощения:
() = s(),
то есть спектр действия ) в большинстве случаев совпадает по форме со спектром поглощения s). Это позволяет, сопоставляя экспериментально полученный спектр действия фотохимического или фотобиологического процесса с известными спектрами поглощения различных хромофоров, установить природу фоторецептора, обуславливающего данное фотобиологическое явление.
Конечно, фотобиологические процессы намного сложнее простых фотохимических реакций, поскольку кроме первичных фотохимических стадий они включают множество вторичных процессов. Тем не менее, изучение спектра действия дает неоценимую информацию об их первичном механизме. Например, спектр действия гибели бактерий под влиянием ультрафиолета характеризуется максимумом при max=265 нм. Это позволило Ф.Л. Гейтсу (1930) сделать вывод, что причина гибели клеток - фотоповреждение нуклеиновых кислот, обладающих соответствующим пиком поглощения. Также, исходя из того, что спектр действия фотомутагенеза кукурузы имел максимум вблизи 260 нм, Л.Д. Стадлером и Ф.М. Угером (1942) был сделан вывод о том, что мутации обусловлены некими повреждениями в нуклеиновых кислотах. Эти факты в свое время подтвердили связь процессов деления клеток и наследования генетической информации с нуклеиновыми кислотами.
Другой пример – изучение механизма действия лазерного излучения на нервные клетки. Лазерное воздействие вызывало учащение импульсной активности нейрона, но не сразу, а после некоторого латентного периода, зависящего от интенсивности и длины волны излучения. Затем после фаза торможения и повторного учащения нейронная активность необратимо прекращалась. При постоянной интенсивности облучения (I) эффективность лазерного воздействия характеризовалась величиной Е, обратно пропорциональной дозе облучения, вызывавшего первые изменения импульсации, т.е. обратно пропорциональной длительности латентного периода (Е ~ D-1 ~ I L-1). В спектре действия, т.е. в зависимости E() обнаружился острый максимум при 460 нм, соответствующий наименьшему латентному периоду (Рис.2). Так как из клеточных компонентов в этой области хорошо поглощают флавины (max ~450-460 нм), то был сделан вывод о флавиновой природе фотоакцептора, ответственного за изменения нейронной активности.
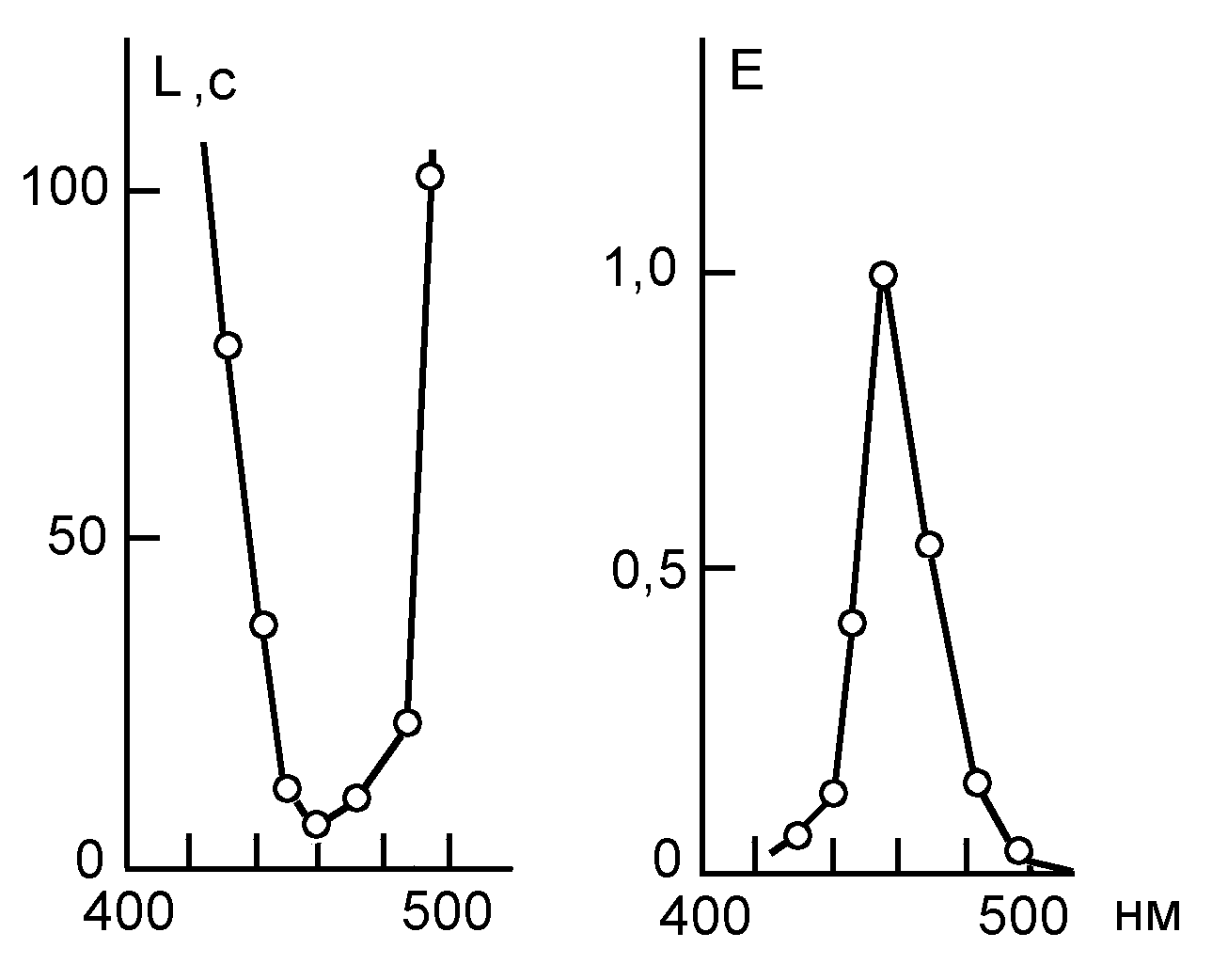
Рис.2. Зависимость латентного периода импульсной реакции нейрона (L) и эффективности лазерного воздействия (Е ~ L-1) от длины волны лазерного излучения (по: Savransky, Uzdensky, 1997).
4.Основные типы фотохимических реакций
Свет может вызвать фотохимические реакции, среди которых можно выделить следующие:
а) Фотораспад, или фотолиз с образованием:
- радикалов: АВ + h · + B·;
- ионов: АВ + h + + B;
- молекул: АВ + h + B;
б) Фотоприсоединение:
- фотодимеризация: А + А + h + A - A,
например, образование димеров пиримидиновых оснований в нуклеиновых кислотах Т-Т, Ц-Ц, У-У, которые вызывают нарушение генетических свойств.
- фотоокисление: А + h + O2 O2;
в) Фотоперегруппировки:
- фотоизомеризация: изменение пространственного расположения разных группировок;
- фототаутомеризация: перенос атома из одной части молекулы в другую.
В электронно-возбужденном состоянии может изменяться пространственное строение электронных оболочек молекул, сопровождаемое изменением дипольного момента (п. 3.10). При возбуждении также появляется электронная вакансия на верхнем заполненном энергетическом уровне, и молекула становится хорошим акцептором электрона, который может восстанавливаться, принимая электрон от близлежащего донора. Вместе с этим, электрон появляется на нижней из свободных орбиталей. Он может передаваться акцепторам в процессе окисления. Именно так действует хлорофилл, вступающий в реакции окисления и восстановления при поглощении фотона.
5.Фотоинактивация биологических систем. Теория мишеней
Одним из плодотворных подходов к изучению повреждения сложных биологических систем, таких как вирусы, клетки или целые организмы, световым или ионизирующим излучением является теория мишеней. В ней подразумевается, что несмотря на всю сложность клетки или организма, в них существует одна или несколько критических, жизненно важных структур - мишеней, вывод из строя которой приводит к летальному повреждению целой системы. Это может быть, например, ДНК или плазматическая мембрана, митохондрии или другие органеллы. В организме такими мишенями могут быть мозг, сердце и т.п. В случае ультрафиолетового или ионизирующего излучения повреждение мишени может быть вызвано ударом высокоэнергетического фотона или ионизирующей частицы. Одноударный механизм предполагает, что для инактивации мишени достаточно одного удара, т.е. попадания частицы в мишень. Разумеется, не следует понимать буквально, что в клетке есть всего один физический участок, чувствительный к повреждению. Чувствительная мишень может представлять собой ряд таких участков или быть распределенной в значительном объеме, как например, ДНК, занимающая все клеточное ядро, но поглощение света любым из ее участков может инактивировать всю систему. Эти участки даже могут иметь разную чувствительность, но все равно механизм повреждения будет одноударным, если для инактивации системы достаточно одно попадание фотона в чувствительную мишень.
Важное значение при исследовании фотобиологических эффектов имеет изучение кривых “доза-эффект”. Для одноударных реакций процесс инактивации частиц является экспоненциальным. Действительно, можно записать уравнение инактивации:
Активный Неактивный,
где k – константа скорости инактивации. Соответственно:
,
откуда:
В одноударном или одноквантовом процессе константа скорости инактивации k, как и для поглощения света, пропорциональна концентрации инактивируемых частиц n, толщине образца x и поперечному сечению поглощения s, а также квантовому выходу повреждений и интенсивности излучения I. Поэтому можно написать:
или
где D=It – доза облучения, а = s - поперечное сечение инактивации. Линеаризованный график этой зависимости приведен на Рис.3. Эту простую зависимость часто характеризуют дозой облучения D37, снижающей долю активных частиц или выживаемость в е раз до 37 %, или дозами D50, D90, или D10, при которых выживаемость снижается до 50, 90 или 10 %, соответственно.
Рис.3. Кривая выживания для случая простой одноударной кинетики инактивации имеет вид прямой линии, если выживаемость откладывать в логарифмической шкале по оси ординат, а дозу или время облучения – в линейной шкале по оси абсцисс
Часто в экспериментах регистрируются двух- и более фазные кривые выживания, которые можно представить как сумму двух и более экспонент, имеющих вид ломаной линии из двух прямых отрезков в линейно-логарифмической шкале «Доза-log (N/N0)» (Рис. 4). Один из отрезков соответствует выживаемости более чувствительной компоненты, которая инактивируется при малых дозах, а второй – менее чувствительной, инактивирующейся при больших дозах, т.е. долю более устойчивых клеток. Если экстраполировать второй отрезок до пересечения с осью ординат, т.е. до нулевой дозы, то можно определить долю низкочувствительной компоненты (в примере, представленном на рис.4 она составляет около 1%).
Рис. 4 Двухфазная кривая выживаемости гетерогенной системы. А – более чувствительный компонент, инактивирующийся при малых дозах. Б – менее чувствительный компонент, инактивирующийся при больших дозах.
Одноударная модель справедлива для самых простых случаев. Часто для инактивации системы необходимо попадание в мишень двух и более фотонов. Выживание системы при двухударном механизме выражается кривой:
,
где N – число активных частиц или выживших клеток, а N0 – исходное сисло частиц (клеток). В общем случае для n-ударного процесса:
.
В случае многоударных процессов наклон кривой увеличивается по сравнению с одноударной кривой, а затем достигает некоторого предельного значения так что получается кривая с плечом (Рис.5). Похожая кривая получается, когда для инактивации клетки необходимо поразить не одну, а две чувствительных мишени. В этом случае выживаемость системы выражается формулой:
,
где и ’ –поперечные сечения инактивации разных мишеней.
По наклону линейной части этой кривой, соответствующей экспоненциальному процессу, можно определить поперечное сечение инактивации. Число ударов в первой модели инактивации или число мишеней во второй можно определить путем экстраполяции кривой выживания к оси ординат, т.е. к нулевой дозе. Понятно, почему кривая инактивации систем со многими мишенями имеет такую форму: по мере увеличения дозы облучения поражается все больше и больше мишеней и в конце концов процесс инактивации клетки приходит к простому одноударному поражению оставшейся мишени.
Рис.5. Кривые выживания для двухударной инактивации системы с одной мишенью и одноударной инактивации системы с двумя мишенями, имеющими одинаковую чувствительность, такую же, как и чувствительность мишени при двухударной инактивации. Экстраполяция этих кривых к оси ординат позволяет определить число ударов или число мишеней, соответственно. Из формы кривых нельзя однозначно определить механизм инактивации: двухударный или связанный с наличием двух мишеней (По: Смит, Хэнеуолт, 1972)
Так как фотохимические процессы по закону Эйнштейна обычно однофотонные, то при сравнительно низкой интенсивности света многофотонные процессы, вероятно, не существенны для фотоповреждения биосистем. При действии мощных лазерных импульсов вероятность таких процессов, резко возрастает. Поэтому более важными кажутся модели со многими мишенями. Однако, часто эксперименты дают неожиданные результаты. Например, Смит и Хэнеуолт (1972) приводят данные Луриа по фотоинактивации бактерий E.coli, у которых плечо на кривой выживания настолько выражено, что экстраполяционное число 240 указывает на наличие 240 мишеней. На самом деле оказалось, что у этих клеток всего одна фоточувствительная мишень – ДНК, а появление плеча связано с эффективной системой репарации повреждений, устраняющей появляющиеся дефекты. У мутантов с поврежденной системой репарации этот эффект не проявлялся и наблюдалась классическая одноударная кривая.
6.Защитные системы, регулирующие выживаемость клеток
Клетки не пассивно реагируют на внешние воздействия. У низ есть несколько систем, противодействующих повреждениям и высокоразвитая система управления клеточными реакциями. Только когда эти системы не срабатывают, клетка умирает. В состав системы, регулирующей выживаемость и смерть клетки можно отнести следующие подсистемы, обеспечивающие жизнедеятельность и защиту клеток (Рис.6):
- Общий метаболизм, в том числе его важнейшее звено – комплекс биоэнергетических процессов.
- Системы поддержания гомеостаза, в частности, внутриклеточных концентраций важнейших ионов: H+, Na+, K+ и Ca2+. Они включают ионные насосы, ионные каналы и транспортные белки.
- Защитные механизмы, включающие подсистемы:
- детоксикации активных форм кислорода и перекисей липидов (антиоксиданты, каталаза, пероксидазы, супероксиддисмутаза и т.п.);
- стресс-белки (белки теплового шока или шапероны), исправляющие пространственную структуру развернутых или неправильно свернутых белков в результате стрессового воздействия;
- системы репарации ДНК;
- везикулярный транспорт, залечивающий механические повреждения плазматической мембраны;
- ферменты детоксикации чужеродных молекул, такие как цитохром P-450;
- Белки множественной лекарственной устойчивости MRP (multidrug resistance proteins), выводящие чужеродные вещества из клеток.
Рис.6. Клеточные системы, участвующие в реакциях клеток на повреждение
7.Основные типы смерти клеток: некроз, апоптоз, аутофагия
Основные механизмы смерти клеток: некроз - неконтролируемый катастрофический процесс, осуществляющийся при интенсивном повреждении клеток внешними факторами, и апоптоз – запрограммированная смерть клетки, находящаяся под контролем системы внутриклеточной сигнализации и происходящая при сравнительно слабых, но длительных воздействиях.
Инициирующими и определяющими признаками некроза являются повреждение плазматической мембраны, инактивация мембранных ферментов и падение уровня АТФ в клетке. Комплекс некротических изменений – многоступенчатый процесс, который может неспецифически запускаться разными повреждающими факторами. Он включает:
- Нарушение целостности плазматической мембраны и мембран внутриклеточных органелл.
- Проникновение воды и набухание клетки и органелл (митохондрий, эндоплазматического ретикулума и комплекса Гольджи).
- Падение ионных градиентов и перераспределение низкомолекулярных соединений в клетке.
- Инактивацию мембранных ферментов, торможение биосинтетических процессов и снижение общего уровня метаболизма.
- Деградацию клеточных органелл. В митохондриях происходит разрушение крист, просветление матрикса, падение мембранного потенциала и разобщение окислительного фосфорилирования. При этом для поддержания клеточной энергетики активируется гликолиз, но он приводит к закислению цитоплазмы. После исчерпания запасов гликогена производство АТФ быстро падает.
- Выход в цитозоль ионов Ca2+, которые активируют кальций-зависимые фосфолипазы, протеиназы и нуклеазы. Это приводит к деструкции мембран и цитоскелета, набуханию клетки и лизису.
При некрозе изменения сначала развиваются в цитоплазме, а затем в ядре. Принято считать, что некроз – неуправляемый процесс, не поддающийся фармакологической коррекции. Он сопровождается воспалительной реакцией и образованием тканевого рубца.
В отличие от некроза, апоптоз – эволюционно консервативный, строго регулируемый процесс. Он осуществляется специальным набором ферментов в особых случаях: при нарушении нормальных взаимодействий с другими клетками в процессе развития организма, при старении и при слабых, но продолжительных внешних воздействиях. Результат апоптоза – межнуклеосомная фрагментация ДНК, конденсация хроматина, сжатие и фрагментация ядра, «пузырение» поверхностной мембраны и распад клетки на ограниченные мембранами фрагменты - апоптозные тельца, которые фагоцитируются соседними клетками и лейкоцитами. При этом, в отличие от некроза, в тканях не развивается воспаление и не формируется рубец, что важно с медицинской точки зрения.
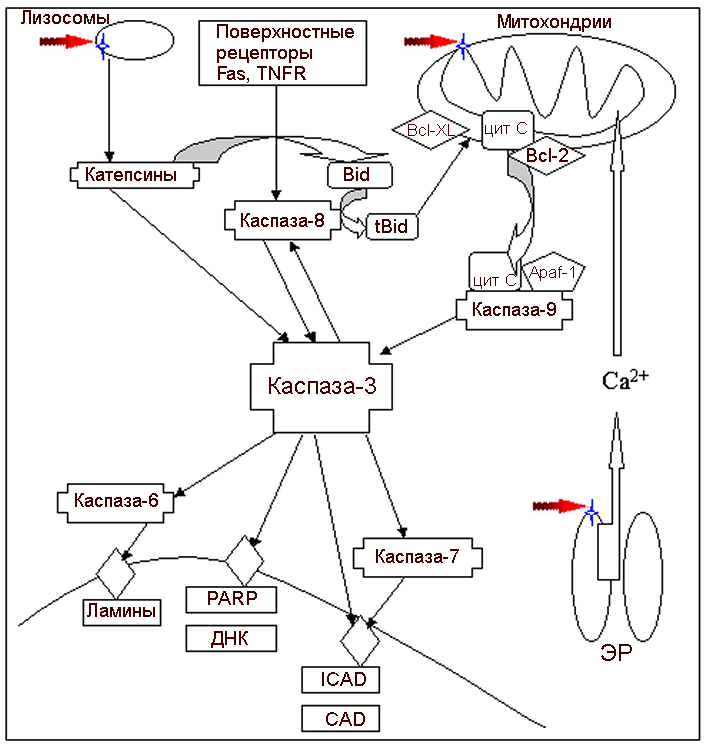
Рис 7. Основные компоненты клетки, участвующие в апоптозе. Стрелки указывают наиболее вероятные точки приложения светового воздействия.
Деградация ДНК и фрагментация хроматина при апоптозе осуществляются при сравнительно сохранных цитоплазматических органеллах, практически не нарушенном синтезе АТФ и неповрежденной плазматической мембране. Это решающие факторы, переключающие программы клеточной смерти. Если мембрана повреждена и/или низок уровень АТФ, то клетки погибают от некроза, если нет – возможен апоптоз.
Основным исполнительным механизмом апоптоза является система гидролитических ферментов: протеаз, нуклеаз, фосфолипаз, осуществляющих разборку клеточных структур. Эта система запускается каскадами каспаз - специальных протеиназ, расщепляющих белки между аспарагиновой кислотой и цистеином (Рис.6.8). Они отщепляют ингибирующий пептид от неактивной прокаспазы, превращая ее в активную каспазу. В центре каспазного каскада стоит каспаза 3, которая активируется каспазами 8, 9, 10 или 12. В свою очередь, она активирует каспазы 6 и 7, которые «включают» исполнительные гидролитические белки: протеиназы, фосфолипазы и нуклеазы, осуществляющие апоптотическую «разборку» клетки. В число мишеней этих гидролаз входят ядерные белки, участвующие в упаковке ДНК (гистоны); белки, осуществляющие межнуклеосомную фрагментацию ДНК (DFF, CAD); ламины, образующие ядерную оболочку; регуляторные белки цитозоля, такие как различные протеинкиназы; белки, участвующие в перестройках и дезинтеграции цитоскелета, мембран, органелл, формировании апоптотических телец и т.д.
Активация протеолитического каспазного каскада, выполняющего основные процессы апоптоза, может инициироваться как снаружи, так и изнутри клетки (Рис.6.8). В первом случае апоптоз запускается при связывании специальных молекул - «лигандов смерти»: FasL, TNF или TRAIL с поверхностными рецепторами плазматической мембраны: Fas, TNF1 или TRAIL R1/2, соответственно. Они активируют каспазы 8 или 10, а те – каспазу 3 и нижележащие пути, ведущие к апоптозу.
Рис.8. «Митохондриальные» пути апоптоза
Во втором случае сигналы для запуска апоптоза могут исходить из внутриклеточных органелл – митохондрий, эндоплазматического ретикулума и лизосом. Митохондрии играют центральную роль в активации ферментных каскадов, ведущих к апоптозу (Рис.6.8 и 6.9). При их повреждении из межмембранного пространства могут высвобождаться белки-активаторы апоптоза: цитохром с, AIF, SMAC/DIABLO и Omi. Цитохром с вместе с цитоплазматическим белком Apaf-1 и дезокси-АТФ (dATP) стимулирует каспазу 9, которая затем активирует каспазы 3, 6 и 7 и далее исполнительные белки апоптоза. SMAC/DIABLO и Omi ингибируют белок IAP, препятствующий апоптозу, облегчая тем самым апоптотические процессы. Белок AIF активирует ядерные нуклеазы, осуществляющие фрагментацию ДНК. Кроме этих белков, из митохондрий высвобождается эндонуклеаза G, также участвующая во фрагментации ДНК. Митохондриальный путь апоптоза обычно индуцируется при окислительном стрессе.
При повреждении лизосом из них могут выходить протеолитические белки катепсины, которые либо непосредственно активируют каспазу 3, либо активируют белок Bid, способствующий выходу цитохрома с из митохондрий и запуску апоптоза по митохондриальному пути. В результате повреждения цистерн эндоплазматического ретикулума из них может высвобождаться Ca2+, стимулирующий кальпаин, который активирует каспазу 3 и дальнейшие проапоптозные пути.
Третий, недавно открытый аутофагический путь смерти клетки связан с образованием аутофагосом, переваривающих поврежденные компоненты клетки. Этот путь деградации клеточных структур может участвовать как в защите клетки, освобождении ее от продуктов распада, так и в ее смерти.
8.Основные сигнальные пути в клетках
Одно из важнейших открытий последних десятилетий – система внутриклеточной сигнализации, состоящая из многочисленных взаимодействующих сигнальных путей, ведущих от рецепторов на плазматической мембране в цитоплазму, далее в ядро, где регулируется работа генетического аппарата, назад в цитоплазму, к клеточной поверхности и внеклеточной среде. Эта система состоит из межклеточных сигнальных молекул (гормонов, нейромедиаторов, цитокинов), рецепторов на клеточной поверхности, цитоплазматических сигнальных каскадов, факторов транскрипции, управляющих экспрессией генов, и исполнительных белков, определяющих клеточный ответ. Некоторые компоненты этой системы поддерживают выживаемость клеток, другие участвуют в клеточной смерти. Основные ее звенья приведены на рис.9.
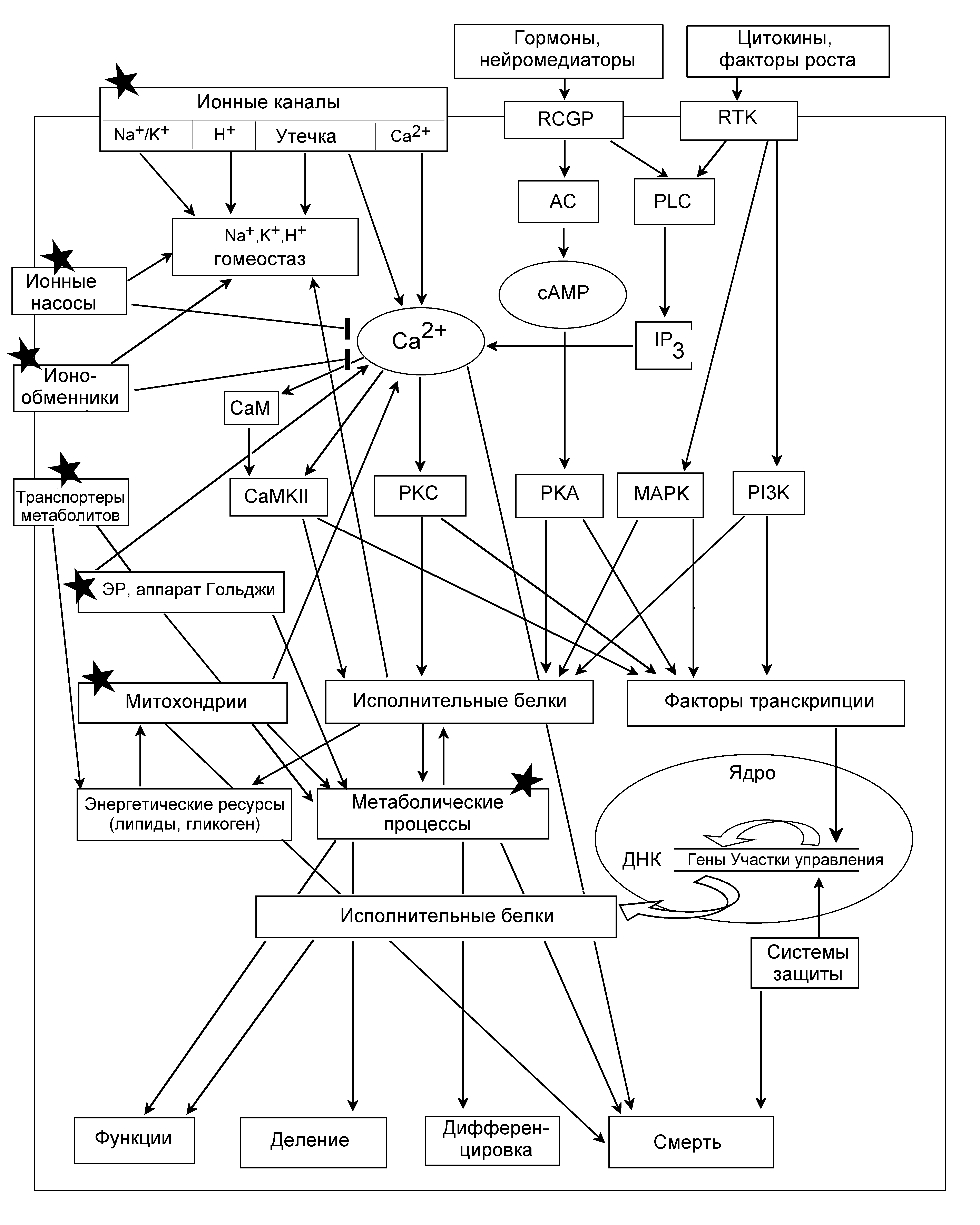
Рис.9. Основные сигнальные процессы в клетках. AC – аденилатциклаза; cAMP – циклический аденозинмонофосфат; CaM – кальмодулин; CaMKII – кальмодулин-зависимая протеинкиназа II; MAPK – митоген-активируемая протеинкиназа; PI3K – фосфатидилинозитол 3-киназа; PKA – протеинкиназа А; PKC –протеинкиназа С; PLC – фосфолипаза С; RCGP – рецепторы, сопряженные с G-белками; RTK – рецепторные тирозинкиназы. Звездочки обозначают предполагаемые мишени фотодинамического воздействия.
Внеклеточные сигнальные молекулы распознаются рецепторами, связанными с G-белками (RCGP), или рецепторными тирозинкиназами (RTK). Межклеточный матрикс или соседние клетки распознаются рецепторами адгезии интегринами и кадгеринами, которые активируют фокальную адгезионную киназу (FAK) и сигнальные пути, управляющие перестройками цитоскелета, формой и подвижностью клеток.
Кальциевый сигнальный путь запускается входом ионов Ca2+ через клеточную мембрану или их высвобождением из митохондрий и/или эндоплазматического ретикулума. Повышение уровня Ca2+ в цитозоле ведет к активации Ca2+-зависимых сигнальных белков: протеинкиназы С, кальмодулина, кальмодулин-зависимой киназы II (CaMKII) и многих других.
В аденилатциклазном пути связывание сигнальной молекулы с RCGP активирует G-белок, который затем стимулирует аденилатциклазу, производящую циклический аденозинмонофосфат (cAMP). В ответ на cAMP протеинкиназа А активирует разнообразные клеточные реакции.
Рецепторные тирозинкиназы могут инициировать сигнальные пути, опосредованные (а) фосфолипазой C и ионами Ca2+; (б) фосфатидилинозитол 3-киназой и протеинкиназой B/Akt (PKB); (в) митоген-активируемыми протеинкиназами (MAPK). Известны три основные протеинкиназы, семейства MAPK: внеклеточно регулируемая протеинкиназа (ERK), c-Jun терминальная киназа (JNK), и протеинкиназа p38. ERK стимулируется факторами роста, цитокинами или химическими сигналами и регулирует пролиферацию и выживаемость клеток. JNK и p38 участвуют в выживании, апоптозе и делении клеток.
Все эти протеинкиназы фосфорилируют и тем самым регулируют многочисленные исполнительные белки и факторы транскрипции, которые определяют конкретные реакции клеток. Каждый тип клеток имеет свой индивидуальный набор таких белков, которые обеспечивают специфические реакции клеток на различные воздействия.
Повреждающие воздействия, такие как окислительный стресс, не только разрушают клеточные компоненты, но и усиливают экспрессию ряда сигнальных и защитных белков. К ним обычно относятся защитные белки (шапероны, супероксиддисмутаза, циклооксигеназа-2), белки-исполнители апоптоза (каспазы, белки семейства Bcl-2, нуклеазы), а также белки сигнальной трансдукции и факторы транскрипции (MAP киназы, PI 3-киназа, протеинкиназы А, В и С, AP-1, NF-B и др.), регулирующие клеточные реакции на различные воздействия, включая защитные процессы и реализацию программы клеточной смерти.
В последние годы внимание исследователей сконцентрировано на выяснении сигнальных механизмов, лежащих в основе различных фотобиологических процессов. Пока эти данные фрагментарны и зачастую противоречивы, но в будущем знание механизмов управления клеткой позволит управлять ее реакциями на различные воздействия и либо повышать выживаемость, либо усиливать повреждения, если клетка патологически изменена.
Литература
Антонов В.Ф.: Физика и биофизика. - М.: ГЭОТАР-Медиа, 2010
под общ. ред.: Г.Ю. Ризниченко, А.Б. Рубина: Динамические модели процессов в клетках и субклеточных наноструктурах. - Ижевск: Ижевский институт компьютерных исследований, 2010
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Дрофа, 2010
Ремизов А.Н.: Сборник задач по медицинской и биологической физике. - М.: Дрофа, 2010
Соболев В.А.: Редукция моделей и критические явления в макрокинетике. - М.: ФИЗМАТЛИТ, 2010
Узденский А.Б.: Клеточно-молекулярные механизмы фотодинамической терапии. - СПб.: Наука, 2010
Шимановский Н.Л.: Молекулярная и нанофармакология. - М.: ФИЗМАТЛИТ, 2010
Антина Е.В.: Химия билирубина и его аналогов. - М.: КРАСАНД, 2009
В.Ф. Антонов и др.: Физика и биофизика. - М.: ГЭОТАР-Медиа, 2009
под ред. В.Ф. Антонова ; рец.: Ю.А. Владимиров, А.Я. Потапенко: Физика и биофизика. - М.: ГЭОТАР-Медиа, 2009
Векшин Н.Л.: Флуоресцентная спектроскопия биополимеров. - Пущино: Фотон-век, 2008
Волькенштейн М.В.: Биофизика. - СПб.: Лань, 2008
Ефремов И.В.: Моделирование почвенно-растительных систем. - М.: ЛКИ, 2008
Присный А.А.: Биофизика. - Белгород: БелГУ, 2008
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Дрофа, 2008
Ремизов А.Н.: Сборник задач по медицинской и биологической физике. - М.: Дрофа, 2008
Сотников О.С.: Статика и структурная кинетика живых асинаптических дендритов. - СПб.: Наука, 2008
Антонов В.Ф.: Физика и биофизика. - М.: ГЭОТАР-Медиа, 2007
Государственное унитарное предприятие, НИИ медицинских технологий, Научно-исследовательский центр технологий ; М.В. Грязев и др. ; под ред.: Т.И. Субботиной, А.А. Яшина ; рец.: В.И. Дедов, Е.И. Нефедов : Экспериментальная магнитобиология. - М. ; Тверь ; Тула: Триада, 2007
Под ред. Ю.А. Ершова ; Рец. Н.Е. Кузьменко: Общая химия. Биофизическая химия. Химия биогенных элементов. - М.: Высшая школа, 2007
под ред.: Т.И. Субботиной, А.А. Яшина ; рец.: В.Г. Зилов, Н.А. Фудин ; Н.М. Исаева и др. ; Государственное унитарное предприятие, НИИ новых медицинских технологий, : Код Фибоначчи и "золотое сечение" в экспериментальной патофизиологии и электромагнитобиологии. - М. ; Тверь ; Тула: Триада, 2007
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Дрофа, 2007
Самойлов В.О.: Медицинская биофизика. - СПб.: СпецЛит, 2007
В. Н. Цыган, М.М. Богословский, В.Я. Апчел, И.В. Князькин: Физиология и патология сна. - СПб.: СпецЛит, 2006
под ред. В.Ф. Антонова ; рец.: Каф. биофизики биологического фак. МГУ им. М.В. Ломоносова и др.: Биофизика. - М.: ВЛАДОС, 2006
Под ред.: Ю.И. Афанасьева, С.Л. Кузнецова, Н.А. Юриной ; Рец.: Д.И. Медведев, Т.К. Дубовая: Гистология, цитология и эмбриология. - М.: Медицина, 2006
Теплов В.И.: Физиология питания. - М.: Дашков и К, 2006
Кветная Т.В.: Мелатонин - нейроиммуноэндокринный маркер возрастной патологии. - СПб.: ДЕАН, 2005
Павлов А.Н.: Экология: рациональное природопользование и безопасность жизнедеятельности. - М.: Высшая школа, 2005
Под ред. Ю.А. Ершова ; Рец. Н.Е. Кузьменко: Общая химия. Биофизическая химия. Химия биогенных элементов. - М.: Высшая школа, 2005
n0
n
7%
D37 D
ln(n0/n)
D
=tg
Сигнальная система
Воздействие
Антиоксидантная система
Поддержание гомеостаза
Выкачивание и обмен ионов
[ATP]
Гликолиз
Окислительное фосфорилирование
Энергетические ресурсы:
липиды, гликоген
Мобилизация энергетического метаболизма
Везикулярный транспорт
Цитохром P450
Репарация повреждений
[Ca2+]i
Апоптоз
Выживание
Процессы защиты
клетки
Шапероны
[ATP]
Некроз
1 Возбужденное состояние часто обозначают звездочкой.
Общая характеристика Фотохимических и фотобиологических процессов