Фотоповреждение клеток и клеточных структур ультрафиолетовым излучением
Контрольная работа
Фотоповреждение клеток и клеточных структур ультрафиолетовым излучением
Содержание
Введение
1.Фотоповреждение нуклеиновых кислот ультрафиолетовым излучением
2.Защита клеток от фотоповреждения ДНК
2.1Нуклеотид-эксцизионная репарация повреждений ДНК
2.2 Фотореактивация
3.Фотоповреждение аминокислот и белков ультрафиолетовым излучением
4.Влияние ультрафиолетового излучения на биомембраны
5.Действие ультрафиолетового излучения на клетки
5.1Мембранные процессы
5.2Митохондрии
5.3Фотоинактивация клеток
Литература
Введение
В большинстве случаев деструктивным является коротковолновый УФ (< 320 нм), энергия кванта которого сопоставима с энергией различных химических связей. Эффективность более длинноволнового излучения значительно ниже, но он также может влиять на биологические объекты. Этот свет является экологически значимым фактором. В отличие от коротковолнового ультрафиолета, который поглощается озоном в верхних слоях атмосферы, световое излучение с длиной волны более 320 нм достигает поверхности Земли.
1.Фотоповреждение нуклеиновых кислот ультрафиолетовым излучением
После того, как Ф.Гейтсом (1928-1930) и Л. Стадлером и Ф. Угером (1942) было обнаружено соответствие спектров действия летального и мутагенного действия ультрафиолета и спектра поглощения нуклеиновых кислот стало ясно, что фотоповреждение именно нуклеиновых кислот, а не белков или других структур, ответственно за эти эффекты.
Максимумы поглощения ультрафиолетового излучения всех азотистых оснований, входящих в состав ДНК, кроме гуанина, находятся в области 260-265 нм. Гуанин имеет двойную полосу поглощения в этой области с максимумами около 247 и 277 нм. При формировании двойной спирали поглощение уменьшается (гипохромный эффект).
При поглощении ультрафиолетовых квантов с длиной волны около 260 нм азотистые основания нуклеиновых кислот переходят в возбужденное состояние, в котором они могут подвергаться превращениям. При однофотонном возбуждении ДНК могут происходить следующие фотодеструктивные реакции:
- Димеризация пиримидиновых оснований, главным образом, тимина;
- Гидратация азотистых оснований;
- Образование межмолекулярных сшивок ДНК-ДНК, ДНК-белок, белок-белок;
- Одно- или двухнитевые разрывы цепей.
Считается, что образование димеров пиримидиновых оснований, главным образом тимина, ответственно за 70-80 % всех летальных повреждений, индуцируемых в клетках коротковолновым ультрафиолетовым излучением, а пуриновые основания и углеводные группы нуклеиновых кислот значительно менее фоточувствительны.
Рис.1. Образование димеров тимина по действием ультрафиолетового излучения (А) и их пространственная структура. Форма (Б) образуется между соседними молекулами тимина на одной цепи ДНК; форма (В) - между разными цепями
Под действием ультрафиолетового излучения в молекуле тимина разрываются двойные связи между 5- и 6-м атомами углерода и образуется квадратное циклобутановое кольцо (Рис. 1А), прочно соединяющее два тимина: Т^Т. При этом возможно образование разных циклобутановых структур, соединяющих тимины, расположенные рядом на одной цепи ДНК (Рис.1Б), или принадлежащие разным ДНК (Рис.1В). Однако, в нативной ДНК два тимина не могут располагаться друг против друга, поскольку по принципу комплементарности напротив тимина должен располагаться аденин. Сближение тиминов, принадлежащих разным цепям ДНК, возможно только при денатурации ДНК и частичном расплетании двойной спирали. В этом случае образование циклобутановых димеров будет закреплять локальную денатурацию. Число образующихся димеров зависит от числа расположенных рядом тиминов в ДНК. Кроме того, образование димеров зависит от длины волны ультрафиолетового излучения.
Спектр действия димеризации тимина близок к суммарному спектру поглощения всех азотистых оснований ДНК. Он имеет максимум при 260 нм (Рис.2, сплошная линия). По-видимому, он обусловлен поглощением квантов не только тимином, но и другими основаниями в ДНК. Это может происходить в результате миграции энергии света от различных оснований, возбужденных ультрафиолетом, на тимин с последующей димеризацией. Механизм миграции энергии между азотистыми основаниям не вполне ясен: ферстеровский индуктивно-резонансный механизм предполагает способностью донора флуоресцировать, а у азотистых оснований время жизни флуоресценции и квантовый выход очень малы. Возможно, более вероятна обменно-резонансная миграция энергии с участием триплетных уровней нуклеотидов, которая происходит безизлучательно, если электронные оболочки находящихся рядом молекул перекрываются. Действительно, исследование спектров фосфоресценции нуклеотидов показало, что энергия триплетных состояний снижается в ряду: Ц > Г > А > Т. Это подтверждает потенциальную возможность миграции энергии от других оснований на тимин. Тушители триплетных состояний, такие как краситель акрихин, снижают димеризацию тимина и защищают вирусы от фотоповреждения ДНК, вероятно, вследствие триплет-триплетного переноса энергии электронного возбуждения с ДНК на краситель.
Тиминовые димеры очень прочны. Они не разрушаются ни при нагревании, ни при действии различных химических агентов. Только сам ультрафиолет способен их разрушить. Спектр действия фоторазрушения димеров тимина (Рис.2, прерывистая линия) существенно отличается от спектра действия их образования (Рис.2, сплошная линия). Эти спектры пересекаются при 254 нм, поэтому при меньших длинах волн более эффективен процесс разрушения димеров, а при больших - образования. Такая разница связана с разными спектрами поглощения димеров и мономеров.
Рис.2. Спектры действия образования (сплошная линия) и разрушения димеров тимина (прерывистая линия) под действием ультрафиолетового излучения. По оси ординат отложена эффективность этих процессов в относительных единицах. (По: Смит, Хэнеуолт, 1972)
Димеры тимина нарушают двухспиральную структуру ДНК. При репликации ДНК или транскрипции ферменты ДНК-полимераза или РНК-полимераза, дойдя до такого структурного дефекта останавливаются и прекращают синтез, а иногда “прочитывают” димер неверно, делая ошибку считывания. В случае репликации это приводит к мутации. Поэтому коротковолновый ультрафиолет является мутагеном и оказывает летальное действие. Но в клетках есть специальные механизмы репарации, устраняющие такие дефекты (см. ниже).
Аналогично димеризации тимина, может происходить димеризация урацила (У^У), цитозина (Ц^Ц) или образование смешанных димеров: (У^Ц; У^Т; Ц^Т). Но эффективность этих процессов ниже, а кроме того образующиеся димеры неустойчивы и в темноте могут мономеризоваться. (Возможно, однако, темновое дезаминирование цитозина в димерах Ц^Ц в результате чего они превращаются в димеры У^У, которые впоследствии мономеризуются, что приводит к мутациям.
Возможны и другие фотоповреждения ДНК. Фотогидратация - присоединение молекулы воды к пиримидиновым основаниям (Рис.3). Фотогидраты образуются только в растворах свободных цитозина или урацила или в однонитевой ДНК или РНК. В двухцепочечной ДНК они не обнаружены. Этот процесс идет через синглетные возбужденные состояния пиримидинов, т.к. тушители триплетов (О2) на него не влияют.
Рис.3. Фотогидратация урацила.
Ультрафиолетовое излучение также может вызывать образование межмолекулярных сшивок ДНК с белками. Сшивки ДНК-белок выявляются по ухудшению экстрагируемости ДНК из облученных клеток, которая восстанавливается после обработки трипсином, разрушающим белки. Фотоакцептором в этом случае могут служить как ДНК, так и белки. При этом группы -SH или -ОН аминокислот серина, тирозина, треонина, цистеина или метионина могут присоединяться к 5 или 6-му атомам углерода в тимине или цитозине (Рис.4). Наибольшей способностью связываться с ДНК обладают цистеин и тирозин.
В образовании сшивок могут также участвовать лизин, аргинин, гистидин и триптофан.
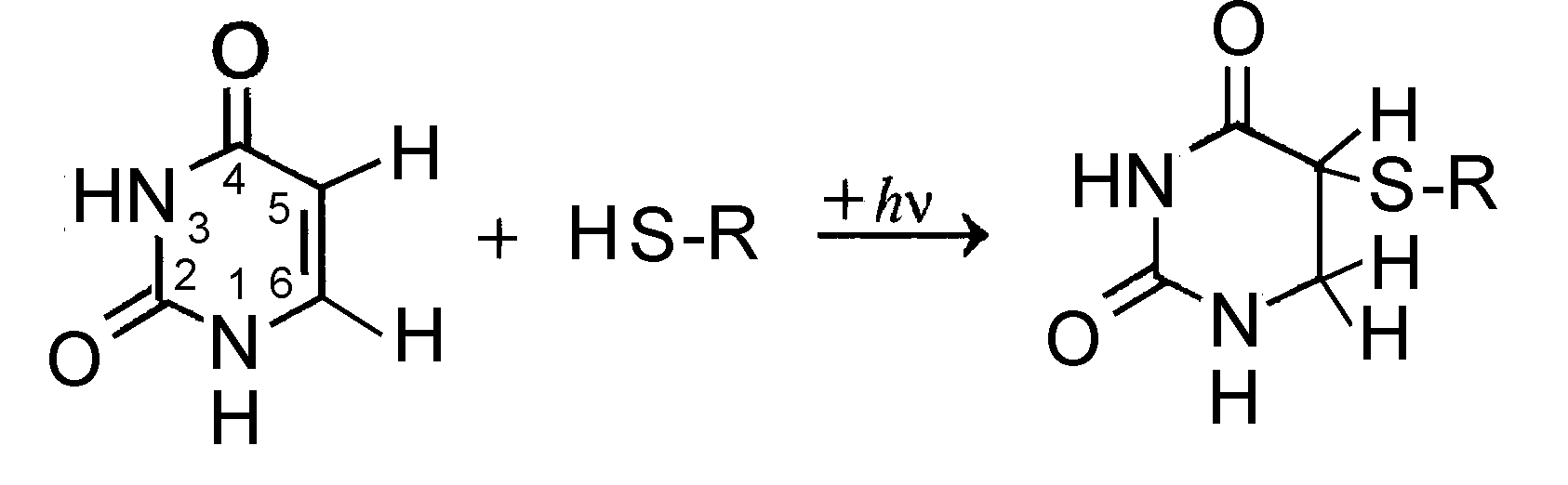
Рис.4. Фотоиндуцированное образование сшивки между SH-группой цистина, входящего в состав белка (R), и урацилом
Внутримолекулярные сшивки между двумя комплементарными нитями ДНК обнаруживаются но неспособности УФ-облучения ДНК расплетаться на отдельные нити при денатурирующих воздействиях. Они иногда образуются за счет образования тиминовых димеров Т^Т, формирующих транс-структуру (Рис.1В). Межмолекулярные сшивки ДНК-ДНК найдены только при облучении сухих препаратов ДНК, а во влажных и в клетках они не выявлены.
При действии коротковолновых УФ фотонов с большой энергией или при высокоинтенсивном лазерном облучении возможны одно- или даже двухнитевые разрывы ДНК, хотя вероятность этих процессов значительно ниже вероятности димеризации тимина.
В последнее время начало исследоваться биологическое действие вакуумного ультрафиолета с длиной волны 193 нм, энергия квантов которого столь высока, что способна, возбудив молекулу на высокие уровни энергии SоS2, ионизировать азотистые основания, оторвав от них электроны. В таблице 1 приведены данные о квантовых выходах различных фотопродуктов в двухнитевой ДНК при действии коротковолнового (254 нм) и вакуумного УФ (193 нм).
Таблица 1. Квантовые выходы (х104) различных фотопродуктов в двухнитевой ДНК при действии коротковолнового (254 нм) и вакуумного (193 нм) ультрафиолетового излучения (По данным Г.Б. Завильгельского, 1996)
|
Фотопродукты
|
Длина волны облучения, нм
|
|
|
193
|
254
|
|
Пиримидиновые димеры
|
18
|
30
|
|
(6-4)-аддукты
|
5
|
1,5
|
|
Фотогидраты
|
-
|
3
|
|
Однонитевые разрывы
|
15
|
0,4
|
|
Двухнитевые разрывы
|
0,6
|
0,01
|
|
Потеря азотистых оснований (например, отрыв тимина)
|
18
|
0,2
|
|
Межнитевые сшивки
|
1
|
0,01
|
|
Локальные денатурированные участки
|
1
|
0,01
|
По этим данным, при действии ультрафиолета с длиной волны 254 нм основную роль в повреждении ДНК играют образование димеров, фотогидратов и 4-6-аддуктов. Более существенные повреждения ДНК (разрывы, сшивки) редки. Но при облучении вакуумным ультрафиолетом их роль, особенно однонитевых разрывов и потери азотистых оснований, резко повышается.
Повреждение нуклеиновых кислот происходит и при двухступенчатом (Sо S1 S2) возбуждении молекулы мощной лазерной вспышкой, когда поток фотонов столь интенсивен, что за время жизни возбужденного синглетного состояния (1-10 нс) молекула может поглотить ещё один фотон и перейти на второй возбужденный уровень с примерно вдвое большей энергией. При высокой интенсивности лазерного излучения, в принципе, возможны и нелинейные двухквантовые переходы сразу на высокие энергетические уровни в результате одновременного поглощения двух квантов через виртуальное промежуточное состояние. В обоих последних случаях количество двухквантовых фотопродуктов, а следовательно и определяемый ими биологический эффект, быть пропорционально квадрату интенсивности излучения. По данным П.Г. Крюкова и соавторов (1978), процесс фоторазложения (фотолиза) тимина под влиянием высоко интенсивного импульсного пикосекундного лазерного облучения (266 нм, 1012-1013 Вт/см2) происходит по двухступенчатому механизму. Возможно, этот механизм реализуется и в других случаях. Порог наблюдения таких нелинейных эффектов порядка 109 Вт/см2.
Двухступенчатое возбуждение, в отличие от одноквановых процессов, может привести к ионизации азотистых оснований нуклеиновых кислот. Катион-радикалы азотистых оснований, образующиеся при отрыве электрона, играют ключевую роль в формировании разрывов ковалентных связей в ДНК. Квантовый выход однонитевых разрывов ДНК резко возрастает при увеличении интенсивности лазерной вспышки, что свидетельствует о наличии порога двухфотонного поглощения света. Г.Б. Данные о квантовых выходов разных типов фотоповреждений ДНК при действии низкоинтенсивного и высокоинтенсивного ультрафиолетового излучения (Табл.2) показывают значительное увеличение выхода фотопродуктов, требующих образования ион-радикалов азотистых оснований. Эффективность димеризации пиримидинов, однако, падает при увеличении интенсивности облучения с 3 до 1·10-3, вероятно, вследствие опустошения уровня S1 при поглощении второго кванта.
Таблица 2. Квантовые выходы образования фотопродуктов повреждения ДНК при действии низкоинтенсивного (11 Вт/м2) и высокоинтенсивного (=266 нм; I=4·1013 Вт/м2) импульсного ультрафиолетового излучения с длиной волны 266 нм (Завильгельский, 1996)
|
Фотопродукт
|
Низкоинтенсивное излучение
|
Высокоинтенсивное излучение
|
|
Пиримидиновые димеры
|
3·10-3
|
1·10-3
|
|
Однонитевые разрывы
|
2·10-5
|
1·10-3
|
|
Межнитевые сшивки
|
2·10-6
|
4·10-5
|
В последние годы обнаружено, что длинноволновое ультрафиолетовое облучение (УФА) в области 320-400 нм, не поглощающееся ДНК, также способно повреждать ДНК. Квантовые выходы этих процессов очень малы. Их удается обнаружить только при интенсивностях или дозах облучения, на 2-3 или 5-6 порядков, соответственно. превышающих интенсивности или дозы ультрафиолетового облучения с длиной волны 254 нм. Основными повреждениями ДНК при этом являются пиримидиновые димеры и одноцепочечные разрывы, образующиеся с примерно одинаковым квантовым выходом. Показано, что образование димеров не зависит от присутствия кислорода, мощного тушителя триплетных состояний, а разрывов - зависит. Следовательно, механизмы этих двух видов фотоповреждения ДНК различны: в первом случае процесс, видимо, происходит с синглетных уровней, а во втором - с триплетных. При этом ДНК не является первичным хромофором, так как она не поглощает свет в этой области. Вероятно, ее повреждение опосредовано каким-то эндогенным фотосенсибилизатором.
Ультрафиолетовое облучение нарушает все известные функции нуклеиновых кислот: способность к репликации и транскрипции у ДНК вызывает появление мутаций, а следовательно и модификацию белков, структура которых закодирована в ДНК. Повреждения мРНК и тРНК делают невозможным синтез белков.
2.Защита клеток от фотоповреждения ДНК
В клетках есть ряд специальных систем, защищающих ДНК от фотоповреждения и репарирующих повреждения ДНК, которые могут привести к наследуемым генетическим сдвигам.
2.1Нуклеотид-эксцизионная репарация повреждений ДНК
Система нуклеотид-эксцизионной репарации устраняет крупные структурные дефекты на одной из нитей ДНК. К наиболее распространенным дефектам такого рода, возникающим под действием ультрафиолетового облучения относятся пиримидиновые димеры, в частности, связанные циклобутановым мостиком димеры тимина (Рис.5).
В клетках есть специальный мультиферментный комплекс, двигающийся по ДНК отыскивающий структурные нарушения двойной спирали ДНК, такие как димеры тимина, и устраняющий повреждения. Механизм его движения и быстрого поиска дефектов пока неизвестен. Поскольку в месте локализации димеров или (6-4)-аддуктов образуется структурный дефект с нарушением комплементарного спаривания оснований двухцепочечной ДНК, то дойдя до такого дефекта, фермент эксинуклеаза делает однонитевые разрывы с двух сторон от дефекта.
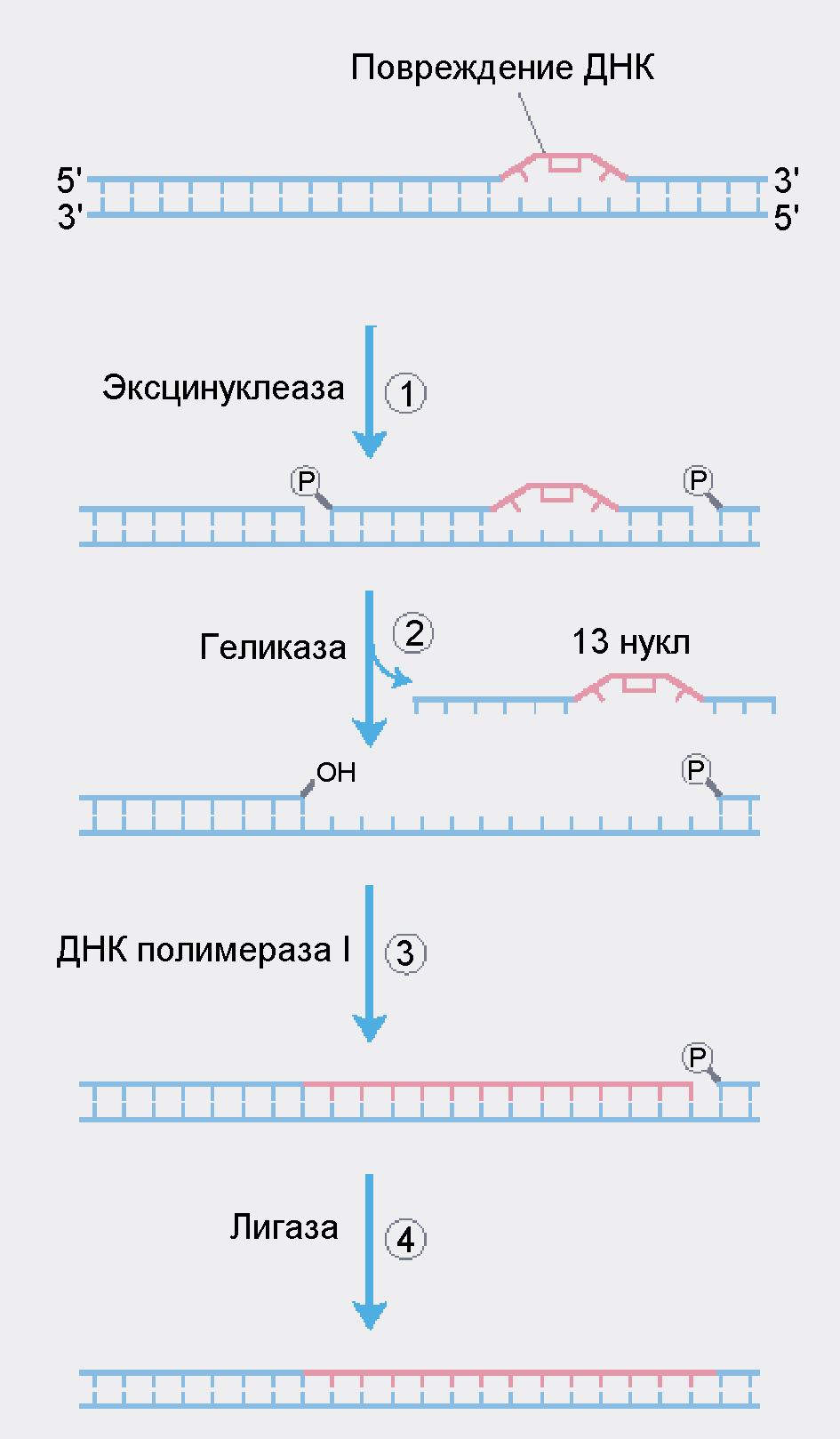
Рис. 5 Нуклеотид-эксцизионная репарация повреждений ДНК
У бактерий E.coli эксинуклеаза – это крупный белковый комплекс, состоящий из трех субъединиц: UvrA (104 кДа), UvrB (78 кДа) и UvrC (68 кДа). Он гидролизует пятую межнуклеотидную связь с 3’ стороны перед дефектным участком и восьмую с 5’ стороны после него. У эукариот аналогичный расщепляется шестая связь с 3' стороны и двадцать вторая с 5' стороны. Затем геликаза раскручивает спираль, разрушая водородные связи. При этом удаляется значительный сегмент ДНК с дефектным участком внутри – 12-13 нуклеотидов у прокариот и 27-29 нуклеотидов у эукариот, расчищая таким образом свободное место для дальнейшей работы. Затем ДНК-полимераза I по принципу комплементарности достраивает недостающие нуклеотиды, и, наконец, ДНК лигаза соединяет 3'-конец вновь построенной цепочки с 5’-концом старой цепочки (Рис.5). Эта система, в принципе, очень сходна с РНК-полимеразой, синтезирующей мРНК.
Система темновой репарации весьма эффективна, она репарирует до 90-98% всех повреждений.
2.2 Фотореактивация
А. Келнер (1949) обнаружил, что ультрафиолетовые повреждения ДНК могут устраняться при последующем облучении более длинноволновым светом в области 350-450 нм с максимумом около 380 нм. Оказалось, что специальный фермент фотолиаза способна разрушать циклобутановые пиримидиновые димеры (вспомним, что на них не действуют ни температура, ни химические воздействия). Этот фермент работает только под действием света, т.е. в электронно-возбужденном состоянии, за счет энергии которого формируются радикалы, разрушающие циклобутановые мостики. Долгое время был неизвестен первичный хромофор, поглощающий свет. Однако, недавно были получены высокоочищенные препараты фермента, которые обладали поглощением света в области, соответствующей спектру действия фотореактивации клеток. Было показано, что фотолиаза содержит два светопоглощающих кофактора. Один из них имеет флавиновую природу. Это флавинадениндинуклеотид, FADH. У бактерий E.coli и дрожжей. Второй хромофор – производное фолиевой кислоты N5,N10-метенилтетрагидрофолилполиглутамат (MTHFpolyGlu). Именно он поглощает квант синего света и передает энергию электронного возбуждения на FADH. Возбужденный флавин *FADH отдает свой электрон пиримидиновому димеру, становясь радикалом *FADH и превращая последнего в нестабильный радикал. В результате последующих перегруппировок полученный электрон переносится на кислородный атом одного из тиминов, циклобутановая связь разрушается, а лишний электрон снова передается на флавиновый радикал, возвращая его в исходное состояние FADH. У млекопитающих, включая человека, фотолиаза отсутствует.
3.Фотоповреждение аминокислот и белков ультрафиолетовым излучением
Как рассмотрено выше, ультрафиолетовое излучение поглощается главным образом аминокислотами триптофаном, тирозином и фенилаланином. Эти аминокислоты высоко чувствительны к повреждающему действию ультрафиолета. Но наибольшей фоточувствительностью к коротковолновому ультрафиолетовому излучению в белках отличаются дисульфидные мостики, разрываемые при поглощении фотона. Это подтверждают данные Табл. 3 о молярных коэффициентах поглощения , квантовых выходах и поперечных сечениях фотоинактивации основных хромофорных групп в белках для УФС излучения с длиной волны 254 нм. Они демонстрируют в 3 раза большую чувствительность (-S-S-) сшивок по сравнению с триптофаном. Фотодеструкция фенилаланина, тирозина, а также пептидных связей намного менее существенна.
При облучении УФВ светом с длиной волны более 280 нм фотоповреждение белков в большей мере обусловлено поглощением триптофана и тирозина. Основной процесс УФ- модификации ароматических аминокислот - образование катион-радикалов АН+:
АН АН*АН+ + e
При этом от них отщепляется электрон, который тут же сольватируется, т.е. покрывается оболочкой из ориентированных вокруг него диполей воды.
Таблица 3. Фотохимические свойства аминокислот (при max=254 нм) (По Смиту и Хэнеуолту, 1972)
|
Соединение
|
, л/мольсм
|
|
20 см2
|
|
Цистин (-S-S-)
Триптофан
Фенилаланин
Тирозин
Пептидные связи
|
270
2870
140
320
0,2
|
0,13
0,004
0,013
0,002
0,05
|
13,4
4,4
0,69
0,23
0,004
|
Схема фотопревращений ароматических аминокислот, описанная Д.И. Рощупкиным, представлена на Рис. 6. Радикалы аминокислот неустойчивы и в присутствии кислорода они подвергаются окислению. В результате фенилаланин превращается в тирозин, тирозин – в диоксифенилаланин, а триптофан – в формилкинуренин.
Сольватированные электроны также вступают в реакцию и сенсибилизируют повреждение аминокислот. Особенно чувствительны к нему дисульфидные мостики. При взаимодействии с электроном они сначала превращаются в анион-радикалы, а затем происходит их разрыв с образованием радикала цистеина:
R-CH2-S-S-CH2-R1 + e (R-CH2-S-S-CH2-R1) R-CH2-S + S-CH2-R1
В присутствии кислорода радикалы цистеина могут давать цистеинсульфоновую кислоту:
R-CH2-S + O2 R-CH2-SO-OH
Рис.6. Схема фотопревращений ароматических аминокислот под действием ультрафиолетового света в присутствие кислорода.
Процессы ультрафиолетовой инактивации белков, конечно, сложнее, чем фотопревращения отдельных аминокислот. За первичными фотохимическими процессами следуют темновые реакции, приводящие к изменению конформации, нарушению структуры активного центра и инактивации (Рис.7). Фотоинактивация белков происходит необратимо по одноквантовому механизму с квантовым выходом порядка 10-3-10-2 (для разных белков). Скорость инактивации линейно зависит от интенсивности света, т.е. подчиняется правилу взаимозаменяемости Бундзена-Роско (I1t1=I2t2). Квантовый выход фотоинактивации белков обычно не зависит от присутствия кислорода О2, т.е. она не связана с процессами окисления.
Рис.7. Схема ультрафиолетовой инактивации белков
Спектр действия фотоинактивации белков содержит полосы 250 и 280 нм, свидетельствующие об участии дисульфидных мостиков (цистина) и ароматических аминокислот, особенно триптофана, в этом процессе. При коротковолновом облучении (220-260 нм) преобладает цистиновая инактивация, а при действии более длинных волн (УФБ) – триптофановая. Характер фотоинактивации белка в случае первичного повреждения цистина или триптофана различается. Поэтому говорят о цистиновой или триптофановой инактивации белков. Если поврежденная аминокислота, например, триптофан, входит в состав активного центра белка, то белок теряет активность либо вследствие модификации этой аминокислоты, либо благодаря потере конформационной подвижности. К потере конформационной подвижности и последующей инактивации могут приводить сшивки не только в активном центре, но и в удаленных местах.
Миграция энергии возбуждения в белках может разобщать в пространстве место поглощения кванта и место повреждения молекулы. Это увеличивает поперечное сечение фотохимической реакции. В белках возможен индуктивно-резонансный механизм миграции энергии, т.к. поглощающие и флуоресцирующие аминокислотные остатки - триптофан, тирозин и фенилаланин – сближены в белковой глобуле. Направление миграции энергии:
Фен Тир Три ионизированный Тир.
Некоторые металлосодержащие белки могут инактивироваться вследствие фотоиндуцированной потери металлического атома.
4.Влияние ультрафиолетового излучения на биомембраны
Наиболее фоточувствительными молекулами из элементов биомембран являются ненасыщенные жирнокислотные цепи фосфолипидов, содержащие двойные связи, главным образом, остатки олеиновой, Они могут спонтанно окисляться кислородом, но ультрафиолетовое излучение значительно ускоряет этот процесс, инициируя появление свободных радикалов и цепное перекисное окисление липидов. Сами жирные кислоты практически не поглощают свет с длиной волны более 220-230 нм, и он вызывает превращения липидов не прямо, а косвенно. В этом случае ультрафиолетовое излучение сперва поглощается каким-нибудь другим хромофором, который под действием ультрафиолета превращается в свободный радикал, способный инициировать цепное перекисное окисление мембранных липидов. В качестве такого первичного хромофора могут выступать как нелипидные хромофорные группы (порфирины, флавины, триптофан, тирозин или -S-S-мостики в белках), так и собственные продукты окисления липидов, прежде всего гидроперекиси (ROOH). В результате окисления ненасыщенных кислот могут образовываться сопряженные системы двойных связей: диеновые: -СН=СН-СН=СН- (m 233 нм), триеновые: -СН=СН-СН=СН-СН=СН- (m 260-280 нм) и др. Чем длиннее цепочка сопряженных связей, тем дальше в красную область смещен спектр поглощения света.
Рис.8. Схема процессов, протекающих при цепном перекисном окислении липидов
Процессы перекисного окисления липидов (ПОЛ) могут начинаться спонтанно, независимо от облучения. Инициаторами ПОЛ служат свободные радикалы воды или биомолекул, небольшое количество которых всегда образуется в тканях в результате фоновой радиации или некоторых биохимических реакций. Например, при нарушении электронного транспорта в митохондриях электроны могут переноситься не на цитохромы, а прямо на кислород с образованием весьма активного супероксид-аниона О2. При взаимодействии первичного радикала Х с молекулой RH приводит к переносу на нее радикального состояния: R (Рис.8). Его окисление кислородом рождает перекисный радикал ROO, который, взаимодействуя с другой липидной молекулой R1H, продолжает цепочку, рождая новый радикал R1, а сам превращается в гидроперекись ROOH. Таким образом, в результате ПОЛ первичная энергия одного радикала приводит к появлению многих новых радикалов и новых молекул перекисей липидов ROOH. Окисление происходит по месту двойных связей в жирных кислотах.
Ультрафиолетовое излучение или двухвалентные ионы железа Fe2+ вызывают разветвление цепи, при котором генерируются два радикальных продукта, способных инициировать появление двух новых цепочек, что резко ускоряет процесс. Цепь ПОЛ может обрываться в результате (а) рекомбинации радикалов или (б) с помощью антиоксидантов, радикалы которых неактивны и не способны продолжать рождение новых радикалов. О цепном характере ультрафиолетового повреждения биомембран свидетельствует аномально высокие квантовые выходы, достигающие 10-100.
Кроме нарушений липидной фазы, ультрафиолетовое излучение вызывает инактивацию мембранных белков в результате разрыва дисульфидных мостиков и фотолиза ароматических аминокислот: триптофана, тирозина и фенилаланина. Также возможна фотодеструкция других важных биомолекул, присутствующих в липидной фазе мембраны или в составе мембранных белков: флавинов, пиридиннуклеотидов, порфиринов, коферментов А, Q и других. Фотоинактивация белков и нуклеиновых кислот, в отличие от фотоокисления липидов, почти не зависит от наличия кислорода.
5.Действие ультрафиолетового излучения на клетки
5.1Мембранные процессы
Главным результатом действия УФ-индуцированного перекисного окисления мембранных липидов является значительное увеличение ионной проницаемости мембран, снижение электрического сопротивления, нарушение барьерных функций, падению трансмембранных ионных градиентов. Эти эффекты являются наиболее ранним проявлением фотоповреждения мембраны. Одновременное повреждение мембранных белков – ионных каналов, транспортных АТФаз, переносчиков различных веществ, рецепторов и адгезионных белков лежит в основе фотоиндуцированных нарушений основных клеточных функций, включая поддержание гомеостаза, межклеточные взаимодействия и т.д. Как следствие, нарушается метаболизм, ингибируются синтезы важных биомолекул, нарушаются функциональные процессы, и развивается смерть.
Например, в облученных ультрафиолетом нервных клетках особенно важную роль играет фотоповреждение Na+,K+-АТФазы и ионных каналов. Так, по данным J.M. Fox, полученным в 1970-х годах, ультрафиолетовое излучение с «белковым» максимумом 280 нм намного сильней повреждает Na+-, чем К+-каналы. Это приводит к уменьшению амплитуды потенциалов действия. Такое облучение также инактивирует Na+,K+-АТФазу необходимую для поддержания градиента ионов Na+ и K+. Сопутствующая деполяризация приводит к учащению потенциалов действия в возбудимых нервных и мышечных клетках, за которым следует так называемый деполяризационный блок, т.е. потеря способности генерировать потенциалы действия.
Ультрафиолетовое излучение с длиной волны 260 нм действовало на нервное волокно иначе: оно не столько меняло мембранный потенциал, сколько повышало порог генерации нервных импульсов и, как следствие, снижало их частоту. Этот эффект мог быть связан с повышением внутриклеточной концентрации ионов Ca2+, от которой зависит порог. Более длинноволновое излучение с максимумами при 313 или 405 нм возбуждало нейронную активность без признаков существенного повреждения. Эти длины волн соответствуют поглощению света цитохромами. Поэтому их воздействие можно связать с влиянием на митохондрии, запасающие Са2+.
Дозы ультрафиолетового излучения, нарушающие ионную проницаемость биомембран имеют такой же порядок, как и дозы, инактивирующие нуклеиновые кислоты, и значительно ниже доз, повреждающих белки. Это указывает на присутствие в клетках двух основных мишеней для повреждающего действия ультрафиолетового излучения: нуклеиновые кислоты и биомембраны (цитоплазматическая мембрана и мембраны внутриклеточных органелл).
5.2Митохондрии
При действии ультрафиолета на митохондрии перекисное окисление липидов приводит к неспецифическому увеличению протонной проницаемости митохондриальных мембран, снижению трансмембранного градиента ионов Н+ и разобщению окислительного фосфорилирования. В результате митохондрии теряют способность синтезировать АТФ, что негативно сказывается на различных сторонах жизнедеятельности клеток. На ультраструктурном уровне видно, что митохондрии первыми реагируют на ультрафиолетовое повреждение. Даже небольшие дозы ультрафиолета вызывает их набухание, утрату крист, просветление матрикса.
Вследствие нарушения электронного транспорта по дыхательной цепи в митохондриях происходит непосредственный перенос электронов вместо цитохромов на кислород с образованием супероксид-аниона О2 и других активных форм кислорода, названных митохондриальными АФК. Это усиливает повреждение митохондрий. Появление в клетке большого количества свободных радикалов и активных форм кислорода индуцирует комплекс реакций, называемых окислительным стрессом, которые ведут к клеточной смерти. Ультрафиолетовое воздействие на митохондрии является эффективным индуктором одного из основных типов смерти клеток – апоптоза, а также может стимулировать неконтролируемое деление клеток – рак.
Еще одно следствие фотоповреждения митохондрий – высвобождение ионов кальция, запасаемых этими органеллами и высвобождаемых при их повреждении. Появляющиеся в цитозоле ионы кальция могут активировать ферменты – протеиназы, нуклеазы, фосфолипазы – участвующие в процессах некроза и апоптоза.
И наконец, митохондрии при повреждении в митохондриях открываются специальные высокопроницаемые поры (PTP), через которые из мембранного пространства выходит цитохром с. Он является индуктором апоптоза. В комплексе с цитоплазматическим белком Apaf-1, он активирует протеолитический каспазный каскад, ведущий к смерти клетки:
каспаза 9 каспаза 3 каспаза 6 и 7 протеиназы, нуклеазы, фосфолипазы разрушение белков, расщепление ДНК– апоптоз.
5.3Фотоинактивация клеток
Чувствительность клеток к ультрафиолетовой инактивации зависит как от вида клеток и их функционального состояния, так и от параметров облучения – длины волны, интенсивности, времени облучения и т.д.
Видовые различия в чувствительности разных клеток к УФС излучению (254 нм) отображены в таблице 4. Клетки эукариот более чувствительны к ультрафиолетовому воздействию, чем клетки микроорганизмов. Высокая устойчивость некоторых видов к УФ воздействию (грибов, инфузорий) возможно, связана с полиплоидией, т.е. с многократным дублированием, наличием нескольких копий ДНК в клетках, а следовательно, с наличием нескольких мишеней.
Таблица 4. Летальные дозы LD90 ультрафиолетового излучения (254 нм) для разных клеток
|
Летальные дозы LD90 (мДж/см2)
|
|
Эукариоты (млекопитающие)
Бактерии
Микрококки
Грибы
Инфузории
Морской жгутиконосец Bodo marina
|
1-3
5 (споры: ~10)
50-130
50-90
50-100
1120
|
Обычно делящиеся эпителиальные клетки значительно чувствительней, чем неделящиеся нервные клетки. Наибольшей фоточувствительностью в организме млекопитающих отличаются тимоциты (лимфоциты зобной железы). Но раковые клетки, однако, довольно устойчивы к ультрафиолетовому воздействию, несмотря на то, что они подвержены неконтролируемым делениям.
УФ-чувствительность клеток также зависит от клеточного цикла. В фазе митоза клетки мало чувствительны. Наибольшей фоточувствительностью клетки обладают в фазе G1. В этой фазе наиболее чувствительным компонентом ядра являются ядрышки, в которых синтезируется рибосомная РНК и собираются рибосомные субъединицы. Локальное ультрафиолетовое облучение ядрышек сфокусированным микролучом останавливает митоз. В фазе S, когда происходит копирование ДНК, клетки менее чувствительны к ультрафиолетовому воздействию. Однако, облучение клеток в фазе S вызывает наибольшее число хромосомных повреждений: разрывов, обменов и т.д. Механизм фотоповреждения клеток в фазе G2 отличен от механизма фотоповреждений клеток в фазах G1 и S.
Анаэробные клетки устойчивей к ДНК, чем аэробные. Это, очевидно, обусловлено тем, что митохондрии, участвующие в окислительном обмене, являются важной мишенью ультрафиолетового повреждения клеток. Это подтверждается тем, что УФ-чувствительность аэробных клеток повышается в аноксических условиях.
Кроме гибели клеток ультрафиолетовое излучение вызывает мутации и подавление клеточного деления (пролиферации). Спектр действия обоих эффектов имеет максимум 260 нм, что говорит, что за них ответственно повреждение ДНК, но определенной эффективностью обладает и более длинноволновое излучение. Основным их механизмом, как говорилось выше, является появление тиминовых димеров и другие повреждения ДНК.
Интересно, что малые дозы ультрафиолета не повреждали клетки, а, наоборот, стимулировали деление. В этом случае спектр действия соответствовал поглощению света белками, но не ДНК. Возможно, такое облучение действует через белки, управляющие процессом деления, запускающие митоз, или снимает ингибирующее действие каких-то белковых факторов.
Таблица Сравнение влияния на клетки ультрафиолетового излучения диапазонов UVС, UVB, UVA и видимого света
|
UV-B и UV-C
|
UV-A и BC
|
|
Повреждения ДНК фотореактивируются видимым светом и подвергаются темновой репарации.
|
Повреждения ДНК не репарируются и не фотореактивируются
|
|
Нет зависимости от концентрации О2, т.е. синглетный механизм
|
Есть зависимость от концентрации О2, т.е триплетный механизм.
|
|
Спектры мутаций для этих спектральных областей различаются
|
Ближний ультрафиолет вызывает похожие эффекты, но при дозах на 3-5 порядков больших, чем дальний. Сравнение действия ближнего и дальнего ультрафиолета на клетки (Табл.5) показывает, что в отличие от диапазона UVA, повреждения ДНК коротковолновым излучением репарируются и фотореактивируются видимым светом. Эти изменения не зависят от присутствия кислорода в среде, т.е. происходят по синглетному, а не триплетному механизму. Различны и спектры вызываемых ими мутаций. Но цитоплазматические структуры изменяются сходным образом.
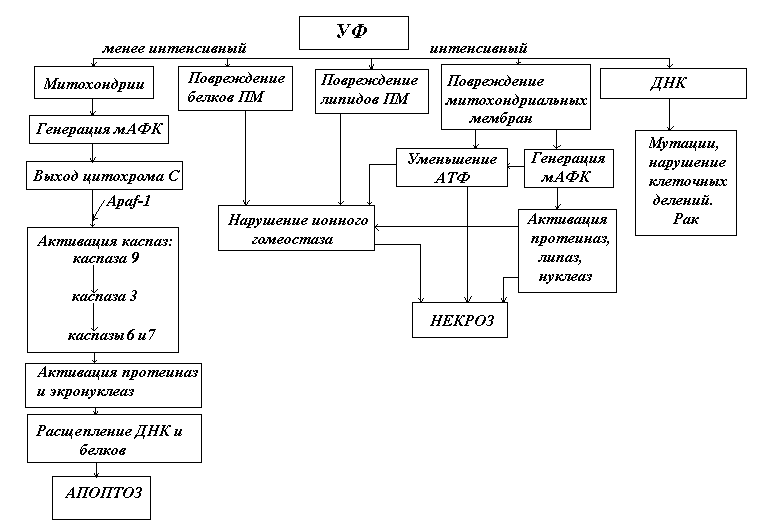
Рис.9. Схема ультрафиолетового повреждения клетки. В зависимости от интенсивности ультрафиолетовое излучение может вызвать некроз или апоптоз клеток
Схема повреждений клетки коротковолновым ультрафиолетовым излучением (УФВ и УФС) приведена на рис.9. На ней сравнительно интенсивное облучение (мера интенсивности зависит от вида и состояния клеток), способное существенно повредить клеточную мембрану, индуцировав в ней перекисное окисление липидов, нарушения проницаемости и ионного гомеостаза, приводит к некрозу. Этому способствует повреждение митохондрий и падение синтеза АТФ. Одновременно возникают повреждения ДНК, мутации, нарушения клеточных делений, ведущие к раку. Сравнительно слабое, но продолжительное воздействие, не так существенно повреждающее плазматическую мембрану и производство АТФ, может вызвать апоптоз. Этому способствует генерация вторичных АФК в митохондриях, высвобождение из них цитохрома с и других проапоптозных белков, которые активируют каскад каспаз, протеиназ и нуклеаз. Последние расщепляют клеточные белки и нуклеотиды и осуществляют апоптоз.
Следует рассмотреть подробнее, что происходит при повреждении ДНК. Нам пока далеко не все известно, но данные последних лет выявляют важные детали механизмов, определяющих дальнейшую судьбу клеток. Появление множественных однонитевых разрывов в молекулах ДНК активирует фермент PARP-1 - полимеразу 1 поли(АДФ-рибозы). Этот фермент направляет репаративный комплекс к сайтам повреждения ДНК путем присоединения к ним цепочки из полиадениловых нуклеотидов (поли-А) (Рис.10). Через короткое время цепочка поли-А разбирается. Это требует большого количества NAD и быстро истощает ресурсы АТФ. Большое количество АТФ также потребляется шаперонами, исправляющими конформацию поврежденных белков (heat shock response). Это снижает возможности ионных насосов по поддержанию ионных градиентов и мембранного потенциала.
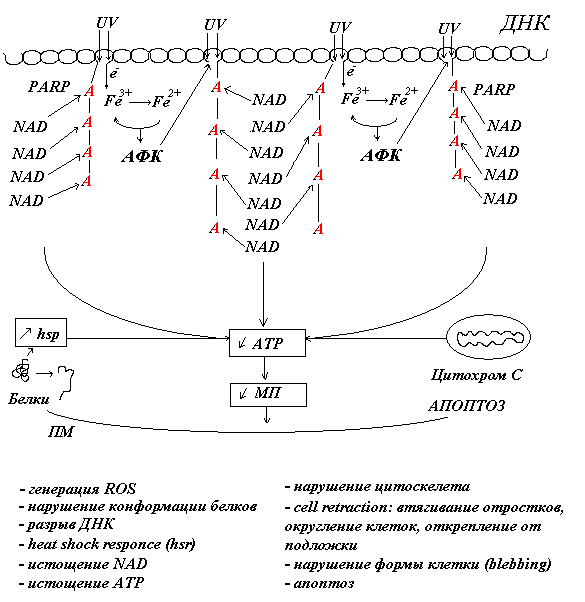
Рис.10. Полиаденилирование ДНК в местах разрывов цепи белком PARP привлекает к ним репарационный комплекс, но истощает запасы АТФ. Ниже указан список УФ-индуцированных функциональных нарушений в клетках
Нарушения цитоскелета приводят к нарушениям межклеточных контактов, формы и подвижности клеток. В результате повреждения митохондрий из них может высвободиться цитохром с, инициирующий апоптоз. Апоптоз также может запускаться белком p53 (Рис.11), чувствительным к повреждениям ДНК. Он активирует множество внутриклеточных мишеней, включая белок р21, приводящий к остановке клеточного цикла, что необходимо осуществления процессов репарации ДНК. Если повреждения ДНК не удается репарировать, то поврежденная клетка уничтожается путем Bax-опосредованного апоптоза. Иногда мутации затрагивают сам белок р53, что случается примерно у 50 % раковых клеток. В этом случае апоптоз не происходит, и клетки неконтролируемо делятся, приводя к раку.
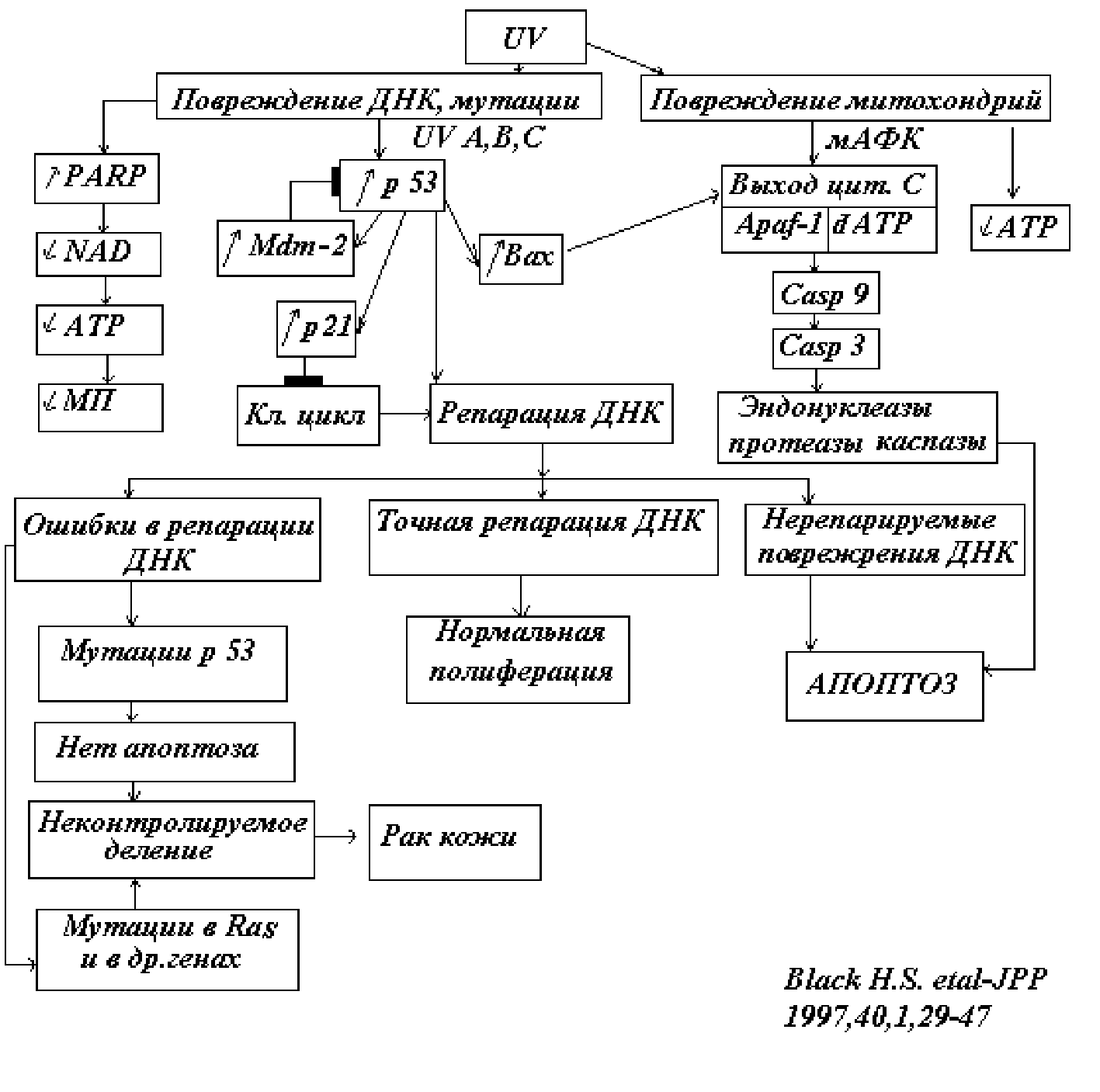
Рис.11. Комплекс изменений в клетках, облученных коротковолновым ультрафиолетовым излучением
Литература
Ремизов А.Н.: Сборник задач по медицинской и биологической физике. - М.: Дрофа, 2011
Ремизов А.Н.: Сборник задач по медицинской и биологической физике. - М.: Дрофа, 2011
Сост. В.А. Тихомирова, А.И. Черноуцан: Физика и биология. - М.: Бюро Квантум, 2011
А.М. Черныш и др. ; Под ред. В.Ф. Антонова ; Рец.: Каф. биофизики биологического фак. и др.: Биофизика. - М.: Владос, 2010
А.М. Черныш и др. ; Под ред. В.Ф. Антонова ; Рец.: Каф. биофизики биологического фак. МГУ им. М.В. Ломоносова и др.: Биофизика. - М.: ВЛАДОС, 2010
Дьяков Ю.Т.: Введение в альгологию и микологию. - М.: МГУ, 2010
под ред. Ю.А. Ершова: Общая химия ; Биофизическая химия ; Химия биогенных элементов. - М.: Высшая школа, 2010
Логвиненко А.Г.: Лабораторный практикум по медицинской и биологической физике, медицинской аппаратуре. - Белгород: БелГУ, 2009
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Высшая школа, 2009
Титомир Л.И.: Математическое моделирование биоэлектрического генератора сердца. - М.: Наука: Физматлит, 2009
Чернавский Д.С.: "Белок-машина". - М.: Янус-К, 2009
БелГУ; Сост.: В.П. Воронов, В.В. Сыщенко, Г.И. Ткаченко; Рец. Г.Н. Положенцев: Концепция современного естествознания. - Белгород: БелГУ, 2008
Орлов И.В.: Вестибулярная функция. - СПб.: Наука, 2008
Бернштейн Н.А.: Биомеханика и физиология движений. - М. ; Воронеж: Институт практической психологии : МОДЕК, 2007
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Высшая школа, 2006
Сергеев Б. : Как мозг учился думать. - М. : Цитадель, 2005
Артюхов В.Г.: Биофизика. - Воронеж: ВГУ, 2004
Авт.: Л.К. Зарембо, Б.М. Болотовский и др.; Сост. В.Н. Руденко: Школьникам о современной физике. - М.: Просвещение, 2010
Коломийцева И.К.: Радиационная биохимия мембранных липидов. - М.: Наука, 2009
Ремизов А.Н.: Медицинская и биологическая физика. - М.: Высшая школа, 2007
Ремизов А.Н.: Сборник задач по медицинской и биологической физике. - М.: Высшая школа, 2007
Эссаулова И.А.: Руководство к лабораторным работам по медицинской и биологической физике. - М.: Высшая школа, 2007
Богданов К.Ю.: Физик в гостях у биолога. - М.: Наука, 2006
Мэрион Дж.Б.: Общая физика с биологическими примерами. - М.: Высшая школа, 2006
Сергеев Б.Ф.: Ступени эволюции интеллекта. - Л.: Наука, 2006
Казаков Б.И.: Лаборатория внутри нас. - М.: Знание, 2004
Романовский Ю.М.: Математическая биофизика. - М.: Наука, 2004
Сергеев Б.Ф.: Ум хорошо.... - М.: Молодая гвардия, 2004
Чертков И.Л.: Стволовая кроветворная клетка и ее микроокружение. - М.: Медицина, 2004
Фотоповреждение клеток и клеточных структур ультрафиолетовым излучением