Фотодинамический эффект и фотодинамическая терапия
Контрольная работа
Фотодинамический эффект и фотодинамическая терапия
Содержание
1. История фотодинамической терапии
2. Фотодинамический эффект: фотофизика и фотохимия
3. Фотодинамическая терапия
4.Фотосенсибилизаторы
5. Клинические применения фотодинамической терапии
6. Внутриклеточная локализация фотосенсибилизаторов
7. Фотодинамическое воздействие на основные клеточные структуры
8. Плазматическая мембрана
9. Митохондрии
10.Аппарат Гольджи и эндоплазматический ретикулум
11.Цитоскелет: микротрубочки и актиновые филаменты
12.Ядро
13. Роль митохондрий в фотодинамически индуцированном апоптозе
14.Смерть клеток при фотодинамическом воздействии на лизосомы
15.Роль ионов кальция в фотодинамически индуцированном апоптозе
16. Участие сигнальных процессов в реакциях клеток на фотодинамическое воздействие
17. Протеинкиназа С
18.cAMP-зависимый сигнальный путь
19.Тирозинкиназы
20.MAP киназы
21.Фосфатидилинозитол 3-киназа и протеинкиназа В/Akt
22.AP-1
23.NF-B
24. Белок р53
25.Белок p21
26.Участие защитных белков в реакциях клеток на фотодинамическое воздействие
Заключение
Литература
1. История фотодинамической терапии
В 1900 году О. Рааб и Г. фон Таппейнер обнаружили, что инфузории и другие простейшие, окрашенные производными акридина, останавливаются и погибают при освещении. Г. фон Таппейнер назвал этот эффект фотодинамическим (ФД), что обозначало действие света на динамику клеток, их подвижность. Этот эффект также называют фотосенсибилизацией, т.е. приданием фоточувствительности клеткам или организмам. В 1902 году Леду-Лебартс показал, что для фотодинамического повреждения клеток кроме красителя и света обязательно нужен кислород, т.е. в фотодинамическом повреждении клеток участвует триада: «краситель – свет - кислород». Г. фон Таппейнер сразу понял потенциальную терапевтическую ценность фотодинамического эффекта. Уже в 1903 году он и А. Джезионек впервые вылечили рак кожи с помощью окрашивания эозином и освещения ярким солнечным светом. Но оказалось, что свет также повреждает кожу и вызывает сильную боль. Эти побочные эффекты, а также нестабильное лечебное действие, ограничение фотоповреждения только поверхностными слоями кожи побудило первых исследователей прекратить эксперименты. Позднее В. Хаусманн (1911) показал высокую фототоксичность гематопорфирина, а в 1924 году А. Поликар обнаружил избирательное накопление его опухолями, открывшее перспективы их флуоресцентной визуализации и фототерапии рака.
В конце 1950-х годов С. Шварц и Р.Л. Липсон показали, что красную флуоресценцию препаратов гематопорфирина, избирательно накопившихся в опухоли, можно видеть во время хирургической операции. В попытке очистить гематопорфирин с помощью серной и уксусной кислот была получена смесь различных производных, названная «производное гематопорфирина» (HpD), которая более избирательно локализуется в опухолях, чем чистый гематопорфирин. Авторы показали возможность использования HpD для флуоресцентной диагностики и разрушения опухолей. HpD не имеет точного химического состава. Это смесь различных веществ, наиболее активными из которых являются ди- и полигематопорфириновые эфиры. Препараты HpD, полученные в разных странах, называются Фотофрин, Фотофрин II (Сша, Канада), Фотосан-3 (Германия), Фотогем (Россия).
Широкое распространение фотодинамической терапии (ФДТ) началось в 1970-х годах с работ Т. Догерти и соавторов. Уже в первых работах они добились полного или частичного разрушения 111 из 113 кожных и подкожных опухолей и метастазов у 25 пациентов после внутривенного введения HpD и облучения красным светом ксеноновой лампы. После этих работ началось взрывное изучение фотодинамического эффекта и применение фотодинамической терапии для лечения рака и других болезней.
2. Фотодинамический эффект: фотофизика и фотохимия
В окрашенных клетках возбужденные светом молекулы красителей повышают чувствительность клеток к световому повреждению. Поэтому их называют фотосенсибилизаторами. Выделяются два типа фотодинамических процессов.
В фотодинамическом эффекте I типа фотовозбужденные молекулы фотосенсибилизаторов S переходят в возбужденное синглетное состояние 1S*, а затем в долгоживущее триплетное состояние 3Т* и реагируют с субстратом R и молекулами среды, в частности, с водой. При этом образуются промежуточные радикальные продукты, которые затем взаимодействуют с кислородом и дают сложную смесь высокоактивных продуктов, которые вступают в дальнейшие окислительные реакции и повреждают биоструктуры (Рис.1):
S + h 1S* 3Т*,
Далее происходит перенос электронов:
3Т* + R S•– + R•+
3Т* + R S•+ + R•–
или протонов на субстрат:
3Т*H + R S• + RH•
3Т* + RH S•H + R•
Образующиеся радикалы участвуют в различных реакциях, а в присутствии кислорода они инициируют цепное перекисное окисление, которому особенно подвержены ненасыщенные липиды в биомембранах:
R• + O2 ROO•
ROO• + R1H RH + R1OO•
и образование супероксид-аниона и других активных форм кислорода:
R•– + O2 R + O2•–
O2•– + H+ HO2•
HO2• + O2•– + H+ H2O2 + O2
H2O2 + O2•– OH• + OH– + O2
Последняя реакция называется реакцией Габера-Вейса. Она резко усиливается в присутствии ионов железа:
O2•– +Fe(III) O2 + Fe(II)
H2O2+ Fe(II) OH• + OH– + Fe(III)
Супероксид-анион O2•– , получающийся в этих реакциях, высокоактивен. Еще более активен гидроксил-радикал OH•. Эти активные формы кислорода (АФК) при взаимодействии с ненасыщенными жирными кислотами образуют радикалы липидов (L•), алкоксильные радикалы (LO•), перекисные радикалы (LOO•) или гидроперекиси липидов (LOOH), входящих в состав биомембран. Далее запускается цепь перекисного окисления липидов, повреждения биомембран и нарушения их функций.
В фотодинамических реакциях II типа (Рис.1) сначала энергия фотовозбужденного красителя переносится на кислород и переводит его в высокоактивное синглетное состояние 1О2 (1g), а затем синглетный кислород окисляет разнообразные субстраты в клетках:
S + h 1S* 3Т*,
3Т* + O2 S + 1О2,
и запускает цепь перекисных процессов:
1О2 + RH ROOH,
В отличие от других молекул, основное состояние обычного молекулярного кислорода - триплетное (3g-) с локализацией двух неспаренных электронов на разных ядрах. В электронно-возбужденном синглетном состоянии 1g оба спаренных электронов располагаются на одной орбитали, а вторая орбиталь свободна и может принять пару электронов, что обусловливает высокую реакционную способность синглетного кислорода. В воде время жизни 1О2 () примерно 3 мкс, а в органических растворителях 10-250 мкс. В биосистемах 1О2 быстро перехватывается аминокислотами и белками и значительно ниже: порядка 170-320 нс в цитоплазме и 24-30 нс в липидной фазе биомембран. По данным Й. Моана и К. Берга, в клетках, содержащих множество тушителей, диффузионная длина 1О2 не превышает 10-20 нм. Следовательно, 1О2 может повреждать только биоструктуры в непосредственной близости от молекул фотосенсибилизаторов. Поэтому фотодинамическое повреждение клетки во многом определяется внутриклеточной локализацией фотосенсибилизатора.
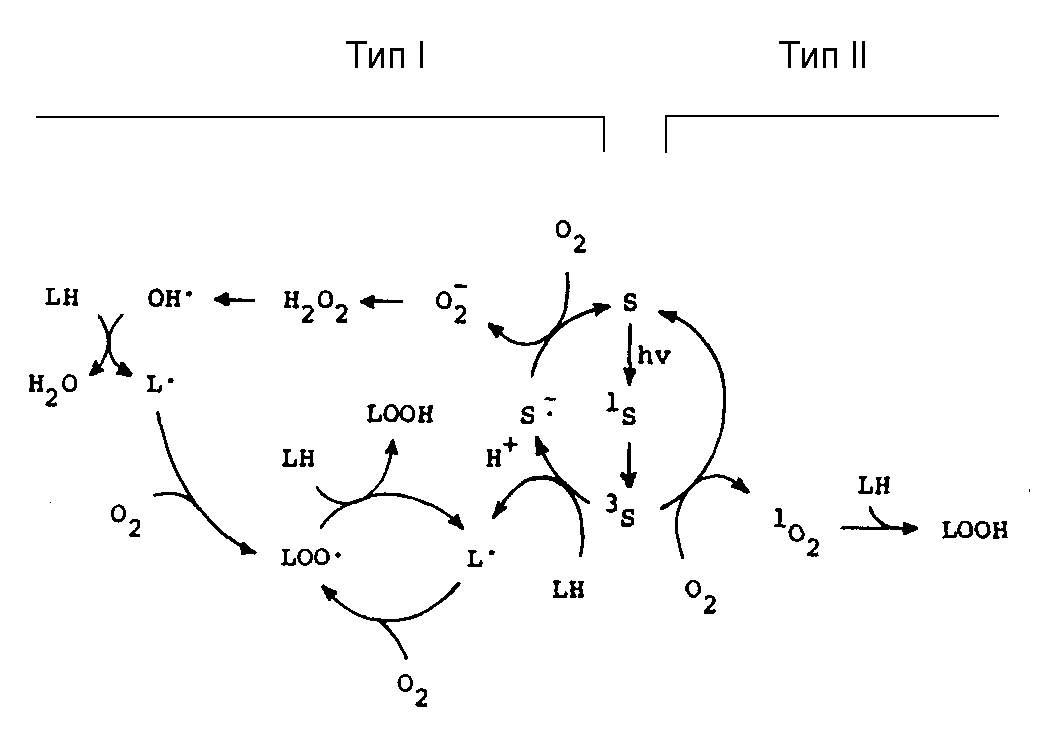
Рис.1. Инициация перекисного окисления липидов ФД реакциями I и II типов (по Girotti, 1990).
Окислительная способность синглетного кислорода на 2 порядка выше, чем обычного кислорода. Он может повреждать все основные компоненты клеток. Как показано T. Dougherty et al. (1976), именно синглетный кислород является основным цитотоксическим агентом при фотодинамическом повреждении опухолей производным гематопорфирина.
В нуклеиновых кислотах он атакует в основном тимин и урацил, а также вызывает поперечные сшивки ДНК-ДНК или ДНК-белок, однонитевые разрывы ДНК. Эти воздействия усугубляются тем, что ферменты, репарирующие ДНК, особенно чувствительны к синглетному кислороду. Однако, в интерфазных клетках ДНК не является первоочередной мишенью для ФД воздействия, т.к. фотосенсибилизаторы обычно локализуются в цитоплазме и не проникают в ядро.
В белках легче всего фотоокисляются дисульфидные связи, цистеин, гистидин, тирозин, триптофан и фенилаланин, особенно, если они расположены на поверхности глобул и доступны для фотосенсибилизатора. Они обычно играют ключевую роль в ферментативной активности, и поэтому белки очень чувствительны к фотодинамическому воздействию. Белки теряют активность в результате фотоиндуцированного нарушения структуры активного центра, внутренних сшивок или межмолекулярных сшивок с другими белками, липидами, РНК и ДНК.
В фотодинамических реакциях I типа радикальные пары, образующиеся при переносе электронов, относительно стабильны в среде с высокой диэлектрической проницаемостью, где обратный перенос электронов затруднен, т.е. в водных растворах. Напротив, в неполярных липидных средах время жизни и растворимость 1О2 выше. Следовательно, фотодинамические реакции I типа легче протекают в цитозоле, а II типа – в липидной фазе биомембран. То есть, фотодинамические реакции с участием гидрофильных фотосенсибилизаторов должны преимущественно идти по первому типу, а гидрофобных – по второму. Реакции II типа доминируют в повреждающем действии большинства фотосенсибилизаторов, включая порфирины, хлорины, фталоцианины и т.д.
Интенсивная генерация радикальных активных форм кислорода (О2–•, OH•, HO2•, H2O2 или синглетного кислорода (1О2) при фотодинамическом воздействии приводит к окислению и повреждению белков, перекисному окислению липидов клеточных мембран, нарушению клеточных функций, развитию окислительного стресса и, в итоге, к смерти клеток. Общая схема фотоповреждения клетки:
h
Фотосенсибилизатор
Триплетное состояние фотосенсибилизатора
Активация кислорода (генерация 1О2 ) или других молекул
Окислительные превращения биомолекул
Структурные перестройки биоструктур
Повреждение клеток и тканей
3. Фотодинамическая терапия
Процесс фотодинамической терапии (ФДТ), схематично представленный на рис. 2, можно разделить на следующие стадии:
А. Селективное окрашивание патологически измененных тканей.
Б. Фотофизические процессы, ведущие к генерации активных химических продуктов.
В. Темновые фотохимические процессы, ведущие к смерти клеток и деструкции опухоли.
Г. Очищение раны и заживление.
Д. Выведение фотосенсибилизатора из организма.
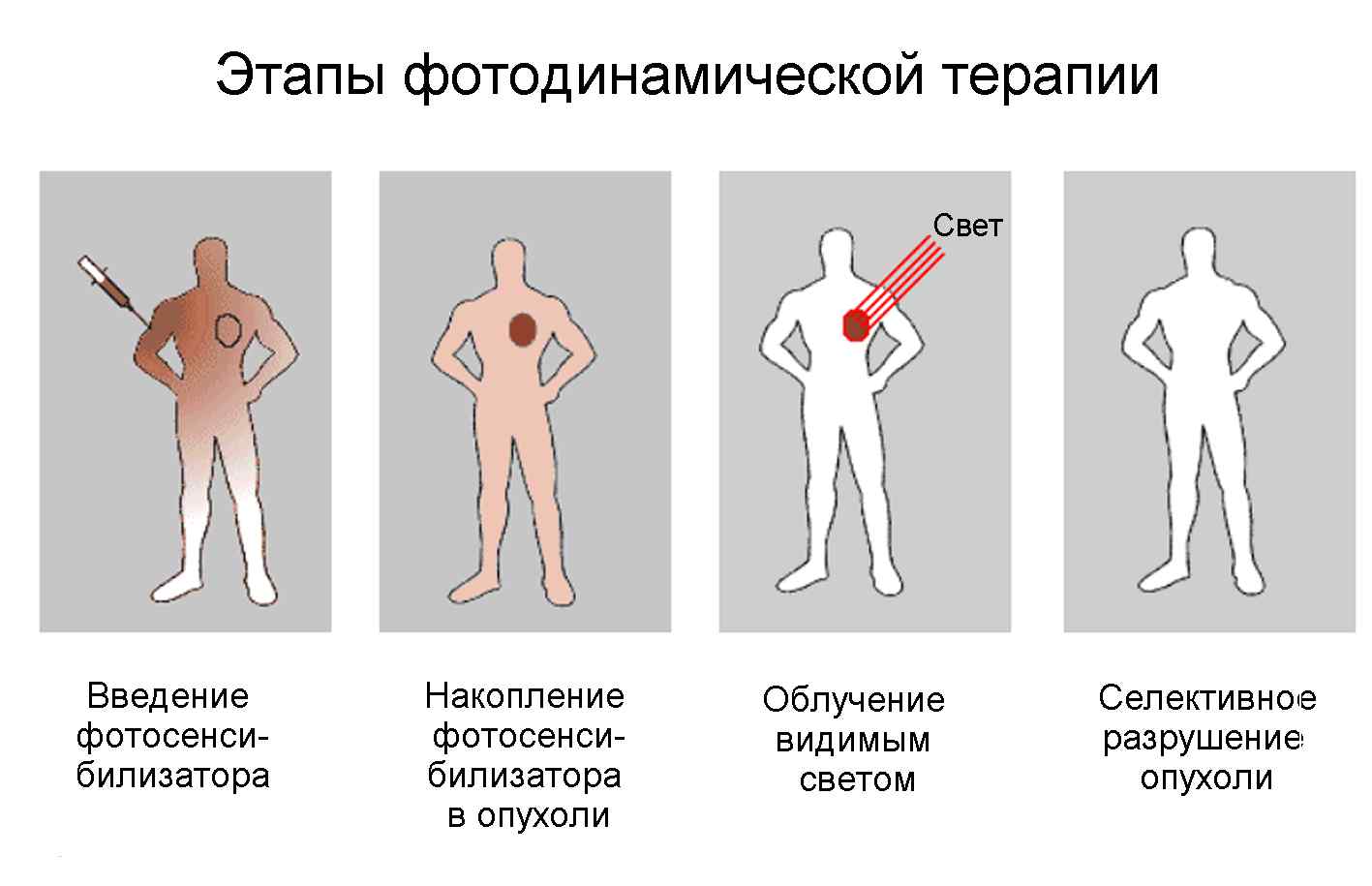
Рис.2. Основные этапы фотодинамической терапии
Рассмотрим эти стадии подробнее:
А1. Доставка фотосенсибилизатора к опухолевой ткани. Фармакокинетика фотосенсибилизаторов зависит как от свойств органов или тканей, например, от их кровоснабжения, так и от их физико-химических характеристик фотосенсибилизаторов, особенно, от их гидрофильности или липофильности. Гидрофильные сенсибилизаторы локализуются преимущественно в кровеносных сосудах, а гидрофобные – в опухолевой ткани. Они лучше проникают в опухолевые клетки. Концентрация фотосенсибилизатора в опухоли достигает максимума через несколько часов после внутривенного введения, а затем он постепенно выводится из организма. При этом концентрация фотосенсибилизатора в опухоли может превышать его концентрацию в окружающих тканях в 10-30 раз, что позволяет избирательно разрушать опухоль.
А2. Проникновение фотосенсибилизаторов в клетки и распределение их между различными внутриклеточными компонентами (плазматической мембраной, органеллами, ядром и цитозолем) зависит от физико-химических характеристик фотосенсибилизаторов. Гидрофобные вещества локализуются в основном в клеточных мембранах, а гидрофильные после пиноцитоза попадают в эндосомы и лизосомы. При освещении лизосомальные мембраны разрушаются, и краситель может перераспределяться внутри клетки и неспецифически окрашивать внутриклеточные структуры.
Б1. Облучение опухоли. В качестве источников света используются мощные лампы, лазеры, в частности, лазерные диоды (LED – light-emitting diode), излучающие красный или ближний инфракрасный свет в области 600-800 нм. В этой спектральной области, называемой «терапевтическим окном», собственное поглощение тканей, обусловленное, главным образом, гемоглобином крови и миоглобином мышц, уменьшается, и свет глубже проникает в ткани по сравнению с более коротковолновым или длинноволновым излучением (Рис.2, 3). Инфракрасное излучение с длиной волны, большей 800 нм, несмотря на хорошее проникновение в биологические ткани, оказывается неэффективным из-за неспособности низкоэнергетических фотонов генерировать синглетный кислород. В тканях свет поглощается и рассеивается, его интенсивность падает. Глубина проникновения света не превышает 1 см. Поэтому наиболее эффективно повреждаются небольшие и плоские опухоли. Однако, возможно послойное разрушение более крупных опухолей в несколько приемов. Для повышения эффективности облучения в опухолевую ткань иногда вставляют несколько световодов, доставляющих лазерное излучение на большую глубину.
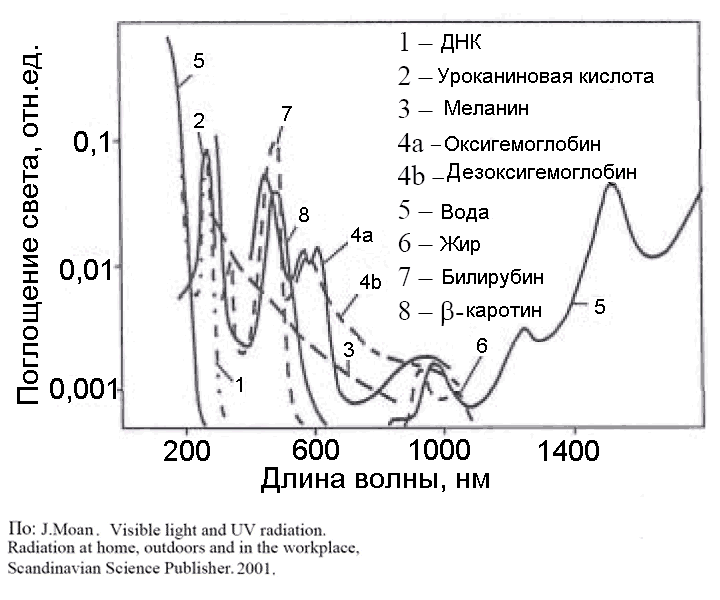
Рис.3. Спектры поглощения важнейших хромофоров в клетках и тканях (По: J. Moan, 2001)
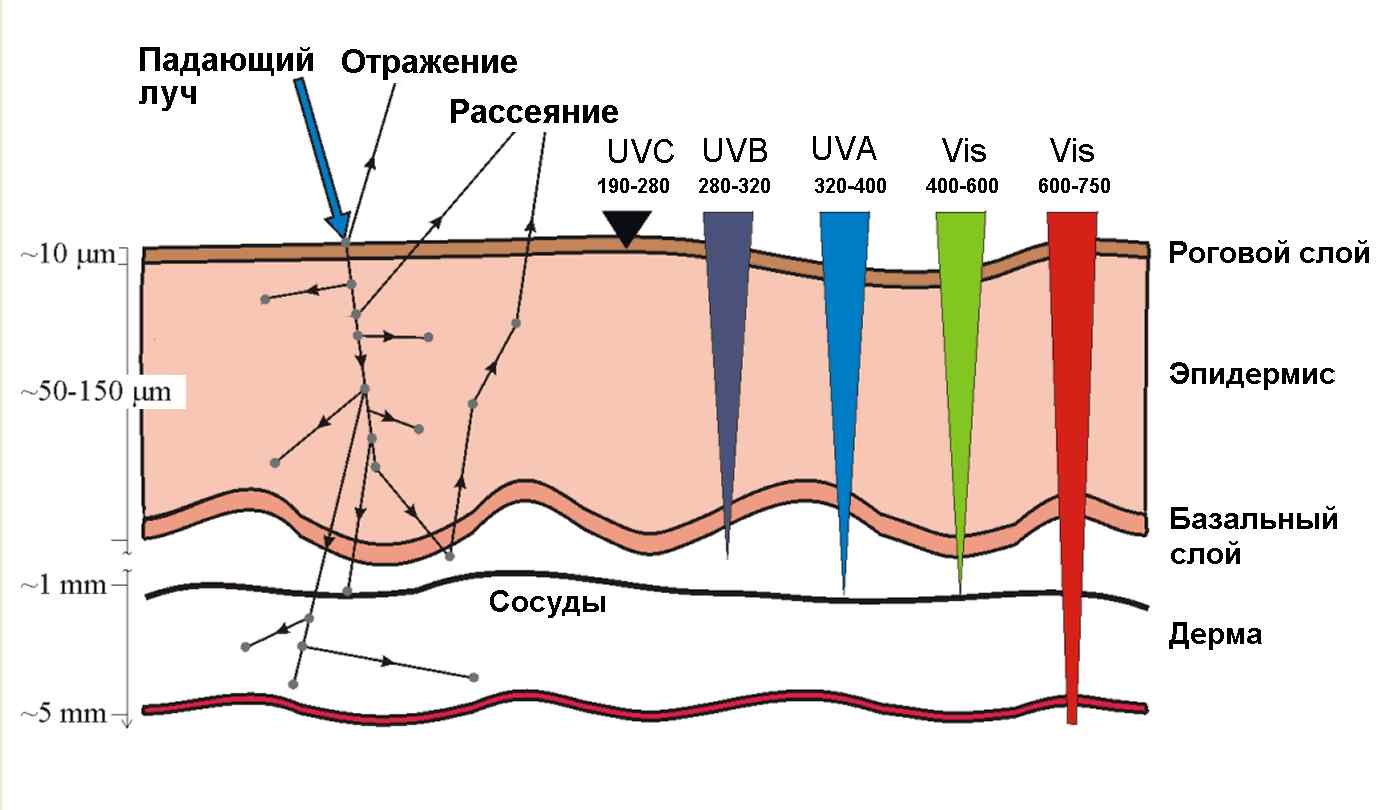
Рис.4. Проникновение оптического излучения с разной длины в кожу (По: J. Moan, 2007)
Б2. Поглощение света и первичные фотохимические реакции. Энергия фотовозбуждения молекул фотосенсибилизатора может не только расходоваться на тепловые процессы или флуоресценцию, но также пойти на фотохимические реакции. Это особенно эффективно происходит с участием долгоживущих триплетных состояний. Поэтому фотосенсибилизаторы должны отличаться высоким квантовым выходом интеркомбинационной конверсии синглетного состояния в триплетное. В результате переноса энергии фотовозбуждения на кислород и различные биомолекулы генерируются синглетный кислород, другие АФК и различные радикальные интермедиаты. Квантовые выходы генерации триплетных состояний и синглетного кислорода фотосенсибилизаторами имеют обычно значения 0,2-0,8 (Табл.1)
В1. Вторичные темновые реакции и повреждение клеток. На следующем этапе в клетках происходят свободнорадикальные процессы окисления липидов, белков и других биомолекул, вызывающие повреждение биомембран и клеточных органелл. В клетках развиваются цитотоксические каскады, ведущие к смерти клеток - апоптозу или некрозу. Эти процессы контролируются реакциями внутриклеточной сигнальной трансдукции.
В2. Лизис погибающих клеток. Высвобождение продуктов распада, стимулирующих как гибель соседних клеток, так и фагоцитоз клеточных обломков соседними клетками или лейкоцитами крови. Фагоцитоз продуктов распада больших опухолей представляет серьезную проблему для организма, поэтому лучшие результаты достигаются при лечении небольших новообразований.
Г. Заживление раны. В случае массивной некротической гибели клеток под влиянием интенсивного фотодинамического воздействия формируется рубцовая ткань, а при преимущественном развитии апоптоза продукты распада клеток успевают перевариваться соседними клетками и макрофагами, и заживление раны происходит быстрее, рубец не формируется и достигается лучший косметический эффект.
Д. Выведение фотосенсибилизатора из организма может занимать значительное время (до нескольких месяцев). При этом человек приобретает кожную фоточувствительность, что ограничивает возможность его пребывания на свету, снижает трудоспособность и качество жизни. Поэтому одной из проблем фотодинамической терапии является разработка быстро выводящихся сенсибилизаторов.
В качестве примера стандартного протокола фотодинамической терапии приведем методику, описанную Schuitmaker et al. (1996): внутривенная инъекция Фотофрина в дозе 2-5 мг/кг веса и через 24-72 часа после инъекции - облучение красным светом (630 нм, 100-200 Дж/см2). Основными мишенями фотодинамической терапии рака являются опухолевые клетки, капиллярная сеть, периферические нервные элементы и иммунные клетки.
Таблица 1. Квантовые выходы генерации триплетных состояний и синглетного кислорода разными фотосенсибилизаторами (По: http://www.chemsoc.org/chembytes/ezine/1998/miltbl1.htm)
|
Фотосенсибилизатор
|
Квантовые выходы
|
|
|
Триплетов,
Т
|
Синглетного кислорода,
|
|
PpIX
|
0,8
|
0,6
|
|
HpD
|
0,6
|
0,3
|
|
Хлорин e6
|
0,8
|
0,8
|
|
mTHPC
|
0,9
|
0,4
|
|
AlPcS2
|
0,3
|
0,2
|
|
BPD
|
0,75
|
0,7
|
|
Фуллерен С60
|
1,0
|
1,0
|
4.
4.Фотосенсибилизаторы
Производное гематопорфирина HpD, использованное Р. Л. Липсоном, а позднее Т. Догерти в первых работах по фотодинамической терапии, является эффективным сенсибилизатором и сегодня использующимся в онкологической практике. Но HpD, как и усовершенствованные препараты гематопорфирина Фотофрин или Фотогем (Россия) являются сложной смесью множества различных порфиринов, включая гематопорфирин, протопорфирин, дейтеропорфирины, их производные, мономеры, димеры и олигомеры, их эфиры, состав которой зависит от условий получения, а потому нестабилен. К тому же эти препараты медленно выводятся из организма, который приобретает фоточувствительность на срок до 4-6 недель. Это побудило исследователей к разработке фотосенсибилизаторов следующего поколения.
Оптимальный фотосенсибилизатор должен обладать следующими свойствами:
- Химическая чистота. Установленная химическая формула.
- Отсутствие темновой токсичности,` стимуляции клеточного деления и мутагенности.
- Высокая молярная экстинкция в дальней красной области.
- Высокий квантовый выход триплетных возбужденных состояний и фотогенерации синглетного кислорода.
- Стабильность в организме и при облучении.
- Быстрое и селективное накопление в опухолях.
- Отсутствие накопления в коже, глазах и слизистых оболочках и быстрое выведение из организма (за 1-2 суток).
- Отсутствие побочных явлений.
- Низкая цена.
- Официальное разрешение применения.
Многие из этих требований противоречат друг другу, поэтому оптимальный фотосенсибилизатор, удовлетворяющий всем требованиям, пока не создан. При создании новых препаратов исследователям приходится идти на компромисс. В качестве фотосенсибилизаторов уже синтезированы и испытаны многие соединения, относящиеся преимущественно к порфириновому ряду: различные порфирины, хлорины, фталоцианины, феофорбиды и т.д. (Рис.5; Табл. 2). К числу фотосенсибилизаторов, перспективных для клиники и уже прошедших II и/или III стадию клинических испытаний, относятся: производное бензопорфирина BPD-MA (лекарственные формы вертепорфин или визудин), сульфированный алюмофталоцианин Фотосенс; мезо-тетрагидроксифенилхлорин mTHPC (лекарственные формы темопорфин или фоскан); моноаспартилхлорин e6; этиопурпурин олова SnET2 (лекарственная форма Purlytin) и другие. Несмотря на наличие этих, достаточно хороших фотосенсибилизаторов, исследователи продолжают поиски новых, более эффективных.
5. Клинические применения фотодинамической терапии
С помощью фотодинамической терапии удается получить положительный лечебный эффект и полностью вылечить до 70-90 % больных некоторыми формами рака. Онкологические применения фотодинамической терапии, однако, ограничены опухолями, доступными для светового воздействия. Это могут быть либо поверхностные опухоли, которые можно непосредственно облучать, например, рак кожи, головы и шеи, либо опухоли полых внутренних органов, к которым можно доставить свет с помощью волоконного световода. К таким опухолям относятся полости рта, пищевода, желудка, толстого кишечника, легких, молочной железы, шейки матки, простаты и мочевого пузыря. Также проводятся экспериментально-клинические исследования применения фотодинамической терапии для лечения опухолей мозга, глаза, яичек, груди и т.д. В ряде стран фотодинамическая терапия рака уже получила одобрение национальных организаций, контролирующих применение лечебных препаратов. Современное состояние клинических применений различных фотосенсибилизаторов отражено в таблице 2.
Таблица 2. Современное состояние разработок в области клинических применений ФДТ (По: Moan, Peng, 2003)
|
Фотосенсибилизатор
|
Торговая
марка
|
,
нм
|
Современное состояние разработок
|
|
Производное гематопорфирина
(HpD)
|
Photofrin
Photofrin II
Photosan-3
Photoheme
|
632
|
Разрешено для лечения рака пищевода, желудка, легких, мочевого пузыря, шейки матки (Франция, Германия, США, Великобритания, Канада, Финляндия, Япония, Нидерланды). Проводятся клинические испытания для лечения рака мозга.
|
|
Производное бензопорфирина
(BPD-MA)
|
Visudine
Verteporfin
|
690
|
Разрешено в разных странах для лечения макулярной дегенерации сетчатки.
III фаза клинических испытаний для лечения базальноклеточной карциномы
|
|
5-аминолевули-новая кислота (ALA)
|
Levulan
|
632
375-400
|
Актиничный кератоз (США, ЕС)
Диагностика рака мочевого пузыря (I/II фаза клинических испытаний)
|
|
Метиламинолевунилат
|
Metvix
|
632
|
Актиничный кератоз и базальноклеточная карцинома (ЕС, Австралия)
|
|
Тетра(гидрокси-фенил)хлорин (mTHPC)
|
Foscan
|
652
|
Рак головы и шеи (ЕС, Норвегия, Исландия);
Рак груди, поджелудочной железы, желудка и кишечника (II фаза клинических испытаний)
|
|
Этиопурпурин олова (SnEt2)
|
Purlitin
|
660
|
Рак кожи, макулярная дегенерация сетчатки (III фаза клинических испытаний);
Рак простаты (I фаза клинических испытаний)
|
|
Порфирин бора
|
BOPP
|
628
|
Рак мозга (I фаза клинических испытаний)
|
|
Моноаспартилхлорин е6 (Npe6)
|
Talaporfin
|
664
|
Ранние стадии рака легкого (III фаза клинических испытаний)
Опухоли головы, шеи, легких, прямой кишки, простаты и др. (II фаза клинических испытаний)
|
|
Гиперицин
|
Гиперицин
|
600-1000
|
Глиобластома, кожная Т-клеточная лимфома, саркома Капоши, псориаз (I/II фаза клинических испытаний), антивирусный агент (СПИД и др.) (I фаза клинических испытаний)
|
|
Сульфированный
алюмофталоцианин
|
Фотосенс
|
675
|
Опухоли кожи, груди, легких, пищеварительного тракта (Россия)
|
Рис.5. Некоторые фотосенсибилизаторы, применяющиеся при фотодинамической терапии
Фотодинамическая терапия, как и другие методы лечения, особенно эффективна на ранних стадиях рака, в случае небольших локализованных опухолей. Ее достоинства по сравнению с другими методами лечения рака (хирургией, радио- и химиотерапией) – локальность и селективность воздействия, возможность многократного повторения процедур, послойной обработки опухолей, бесконтактность воздействия, возможность сочетания с другими методами лечения, снижение метастазирования. Фотодинамическая терапия является бинарным воздействием, оба компонента которого – краситель и свет - по отдельности нетоксичны и только при совместном применении разрушают клетки. К недостаткам относятся трудность точной дозиметрии, медленное выведение красителя из организма, придающее организму нежелательную фоточувствительность.
Области применения фотодинамической терапии не ограничиваются онкологией. В последние годы показано, что фотодинамическая терапия перспективна для лечения макулярной дегенерации сетчатки; псориаза, ревматоидного артрита, атеросклеоза, рестеноза кровеносных сосудов после балонной ангиопластики, бактериальной и грибковой инфекции, а также для стерилизации переливаемой крови или эритроцитарной массы.
6. Внутриклеточная локализация фотосенсибилизаторов
Для оптимизации фотодинамического воздействия на ткани и поиска наиболее эффективных фотосенсибилизаторов необходимо понять механизм их действия на клеточном уровне, выяснить, как структура фотосенсибилизаторов определяет их физико-химические свойства и фотодинамическую эффективность. Поскольку 1О2 диффундирует в клетке не более, чем на 10-20 нанометров, то локализация сенсибилизатора определяет мишени, которые в первую очередь подвергаются фотодинамическому воздействию.
Красители могут проникать в клетку, как путем диффузии, так и в результате эндоцитоза, когда некоторый объем внеклеточной жидкости захватывается внутрь эндоцитозных пузырьков, транспортируемых в клетку. Диффузионное проникновение фотосенсибилизатора в клетку и его внутриклеточная локализация сильно зависят от размеров молекул, их полярности (гидрофобность или гидрофильность), суммарного заряда и распределения заряженных групп (симметричное или асимметричное), способности к образованию водородных связей, подверженности к агрегации и т.д. Кроме того, локализация фотосенсибилизатора в клетке зависит от времени инкубации, состава внеклеточной среды, например, от присутствия в ней сыворотки крови или белков.
Гидрофобные фотосенсибилизаторы локализуются преимущественно вокруг ядра, в области, богатой клеточными органеллами - митохондриями, эндоплазматическим ретикулумом (ЭР), комплексами Гольджи, лизосомами и везикулами. Они легко проникают в липидную фазу плазматической мембраны, но с трудом выходят из нее в водную среду. Но они могут переноситься к внутриклеточным органеллам с помощью амфифильных белков цитозоля, таких как шапероны. Другой механизм их внутриклеточного транспорта - в составе мембран пиноцитозных пузырьков.
Проникновению в клетку полярных фотосенсибилизаторов препятствует липидный бислой клеточной мембраны. Они с трудом попадают в мембрану, но легко из нее выходят. Проницаемость мембраны для них характеризуют коэффициентом распределения Kp в системе «неполярный органический растворитель/вода». Для анионных красителей дополнительным барьером служит отрицательный заряд клеточной поверхности. Поэтому такие анионные фотосенсибилизаторы, как NPе6; TPPS3,4, AlPCS3,4 попадают в цитоплазму главным образом путем эндоцитоза.
Наиболее эффективны амфифильные фотосенсибилизаторы, у которых с одной стороны есть положительно заряженная группа, а другая сторона липофильна. За счет липофильной части они пересекают плазматическую мембрану и проникают в цитоплазму, а затем благодаря своему положительному заряду втягиваются в митохондрии. Так, у фибробластов мембранный потенциал относительно окружающей среды равен примерно –75 мВ, а разность потенциалов между митохондриальным матриксом и цитозолем около –180 мВ. Расчет с использованием уравнения Нернста показывает, что концентрация хорошо пересекающего мембраны катионного красителя в цитозоле 18 раз выше, чем в среде, а в митохондриях – в 1000 раз выше, чем в цитозоле. Поскольку объем митохондрий около 15% от объема клетки, то подавляющее большинство красителя концентрируется в митохондриях. Это значительно увеличивает фототоксичность.
Локализация фотосенсибилизаторов в клетке также зависит от их концентрации и времени инкубации. Например, при 10-минутной инкубации TPPS2a накапливается в плазматической мембране, а через 1 час попадает в лизосомы. Облучение клеток повреждает мембраны клеточных органелл, что может привести к перераспределению фотосенсибилизаторов из мест первоначального связывания в другие компартменты. Например, тот же TPPS2a, сконцентрированный в лизосомах, после облучения диффузно распределяется в цитоплазме.
В настоящее время ведутся работы по направленной доставке фотосенсибилизаторов в клетки. В качестве их носителей используются белки (альбумины или липопротеины низкой или высокой плотности), липосомы, полимерные наночастицы, квантовые точки и антитела.
Молекулы красителей связываются с белками за счет электростатических, вандерваальсовых, гидрофобных и водородных взаимодействий. Например, одна молекула липопротеина низкой плотности (ЛНП) может переносить до 1000 гидрофобных молекул. Они не фагоцитируются клетками крови и длительно циркулируют в кровеносном русле. Многие клетки имеют на своей поверхности рецепторы ЛНП, а в опухолевых клетках их особенно много. Поэтому с их помощью можно направленно доставлять фотосенсибилизатор в опухоль.
Липосомы – искусственные мембранные пузырьки из фосфолипидных молекул. Гидрофильные фотосенсибилизаторы вводятся внутрь липосом, а гидрофобные включаются в липосомную мембрану. Липосомы облегчают транспортировку гидрофобных фотосенсибилизаторов по кровеносным сосудам. Интересно применение фоточувствительных липосом, у которых мембрана содержит фотосенсибилизатор. При ее фотоповреждении переносимое вещество: лекарство, токсин, белок, или нуклеиновая кислота контролируемым образом высвобождается внутрь клетки.
Включение фотосенсибилизаторов в полимерные биодеградирующие наночастицы может увеличить количество переносимого вещества. При этом, варьируя материалы, можно добиться желаемых свойств носителя. Еще один способ направленной доставки фотосенсибилизаторов - связывание их с моноклональными антителами, специфичными к антигенам на поверхности раковых клеток, или с молекулами, способных отыскивать опухоль, благодаря наличию у опухолевых клеток специфических рецепторов. К таким молекулам относятся белок трансферрин, фолиевая кислота, некоторые гормоны, например, стероиды или инсулин, или эпидермальный фактор роста EGF. Их связывание с рецептором стимулирует эндоцитоз и захват фотосенсибилизатора из окружающей среды.
7. Фотодинамическое воздействие на основные клеточные структуры
В механизме повреждения клеток важную роль играет не только накопление фотосенсибилизатора в определенных органеллах и не только степень их повреждения, но и роль, которую эти структуры играют в жизнеспособности клетки. Например, по данным Kessel и Poretz (2000), при 10-минутной инкубации фотосенсибилизатор NPe6 накапливается преимущественно в эндосомах, а наиболее сильные повреждения отмечаются в митохондриях. Аналогично, по данным Fedorenko, Uzdensky (2008), при фотосенсибилизации нейронов алюмофталоцианинами, которые считаются лизосомотропными, наиболее выраженные ультраструктурные изменения наблюдаются не в лизосомах, а в митохондриях и аппарате Гольджи. При этом того небольшого количества фотосенсибилизатора, которое попадает в эти органеллы, достаточно, чтобы их повредить и вызвать смерть клетки.
8. Плазматическая мембрана
Плазматическая мембрана – первый барьер на пути фотосенсибилизатора в клетку. Перед тем, как попасть в клетку, фотосенсибилизаторы задерживаются в ней. Гидрофильные фотосенсибилизаторы сильнее сенсибилизируют клеточную поверхность, в частности, связанные с мембраной белки и гликопротеины, а липофильные – липидный бислой и гидрофобные участки интегральных или погруженных в мембрану белков.
Биомембраны особенно чувствительны к фотодинамическому воздействию. Фотодинамическое повреждение плазматической мембраны происходит быстро, в первые минуты воздействия. Синглетный кислород и другие АФК инициируют в ней цепные процессы перекисного окисления липидов. Особенно легко окисляются ненасыщенные жирные кислоты и холестерин. 1О2 может присоединяться по месту двойных связей в липидах (L) с образованием гидропероксидов LOOH. Кроме того, в результате перекисного окисления липидов в клетке образуются радикальные продукты типа L•, LOO•, OLOO•, и OLO•. Долгоживущие гидропероксиды скорее, чем короткоживущие радикалы могут служить сигнальными медиаторами в окислительном стрессе. Они могут транспортироваться в мембранах на большие расстояния, а их перенос между органеллами распространяет окислительный стресс по всей клетке. Перекисное окисление повышает жесткость липидного бислоя, вызывает образование межмолекулярных липид-липидных и липид-белковых сшивок, что приводит к образованию локальных дефектов и пор в липидных бислоях, изменению текучести мембран и подвижности ионов внутри мембраны (Рис.6).
Другой критической мишенью в мембранах, еще более важной для нарушения клеточных функций, являются мембранные белки. По данным Davies (2003), на их фотоповреждение тратится до 70 % синглетного кислорода, генерируемого в клетке, тогда как на окисление аскорбата – 17 %, а липидов - менее 1 %. Крупные мембранные белки, такие как ионные каналы или транспортные АТФазы весьма чувствительны к фотодинамическому воздействию. Ионные каналы теряют селективность и проводимость, а Na+,K+-, и Ca2+-АТФазы инактивируются. В результате утечки ионов и нарушения их транспорта происходит падение ионных градиентов и деполяризация клеток. Фотодинамическое воздействие также повреждает мембранные рецепторы и нарушает процессы сигнальной трансдукции.
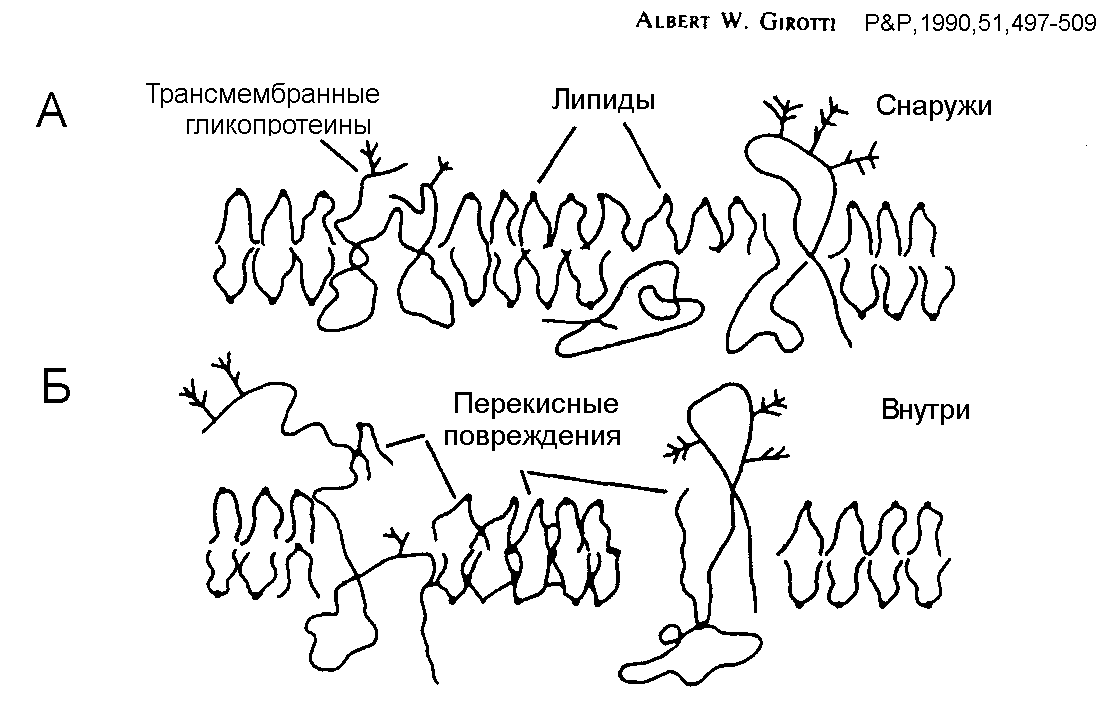
Рис. 6 Механизм повреждения биомембран при перекисном окислении липидов (по Girotti, 1990)
9. Митохондрии
Митохондрии очень чувствительны к фотодинамическому воздействию. К тому же они являются одной из главных мишеней цитотоксического действия порфиринов. Порфирины липофильны и обладают большим сродством к митохондриальным мембранам. Но кроме простой диффузии имеется специфический механизм транспорта порфиринов в митохондрии. Они связываются с периферическими бензодиазепиновыми рецепторами (PBR - peripheral benzodiazepine receptor), расположенными в зоне контакта наружной и внутренней митохондриальных мембран, и переносятся в матрикс, где они взаимодействуют с кардиолипинами внутренних митохондриальных мембран.
Первичная генерация синглетного кислорода и других активных форм кислорода при фотовозбуждении порфиринов усиливается в митохондриях вторичной генерацией «митохондриальных» АФК (мАФК). Ограниченная генерация супероксид-аниона может происходить в нормальных клетках вследствие одноэлектронного восстановления молекулярного кислорода электронами, утекающими из цепи электронного транспорта. Этот процесс усиливается при разобщении окислительного фосфорилирования, когда кофермент Q переносит избыточные электроны прямо на кислород, минуя цепь цитохромов.
Фотодинамическое воздействие резко усиливает генерацию АФК в митохондриях и вызывает как перекисное окисление липидов, так и инактивацию важнейших митохондриальных ферментов: гексокиназы, сукцинатдегидрогеназы; цитохромоксидазы; моноаминоксидазы; переносчиков органических кислот, участвующих в цикле Кребса (сукцината, цитрата и оксалоацетата); транслокатора адениновых нуклеотидов (ADP/ATP обменник, ANT), H+-ATP-синтетазы. По мнению Salet и Moreno (1994), фотоокисление белков более важно для нарушения функций митохондрий, чем перекисное окисление липидов митохондриальных мембран. В результате этих процессов ингибируется клеточное дыхание, разобщается окислительное фосфорилирование, падает митохондриальный потенциал m и снижается синтез АТФ. Фотоповреждение митохондрий, однако, не приводит к полному истощению запасов АТФ в клетке, так как производство АТФ частично компенсируется гликолизом. Полное падение внутриклеточного уровня АТФ происходит при комбинации фотодинамического воздействия и ингибиторов гликолиза.
На ультраструктурном уровне фотоиндуцированные изменения митохондрий отмечаются, как правило, раньше, чем изменения структуры плазматической мембраны, ядра или других органелл. Митохондрии набухают, в них происходит просветление матрикса и разрушение крист.
Первым признаком фотодинамического повреждения митохондрий является деполяризация митохондрий, т.е. падение m вследствие утечки протонов через дефекты в митохондриальной мембране, появляющиеся в результате перекисного окисления липидов. Фотоповреждение биоэнергетических ферментов развивается позднее.
10.Аппарат Гольджи и эндоплазматический ретикулум
Гидрофобные фотосенсибилизаторы, такие как гиперицин, фталоцианин Pc 4, фталоцианин цинка или Фотофрин, обычно накапливаются в перинуклеарной области, богатой мембранными органеллами - митохондриями, ЭР, аппаратом Гольджи и транспортными пузырьками. По электронно-микроскопическим данным, в фотосенсибилизированных клетках наряду с изменениями митохондрий и других внутриклеточных структур происходит набухание цистерн ЭР и комплекса Гольджи, а затем деградация последнего.
11.Цитоскелет: микротрубочки и актиновые филаменты
Микротрубочки наряду с другими элементами цитоскелета - актиновыми нитями и промежуточными филаментами - придают форму клеткам и участвуют в организации цитоплазмы, подвижности внутриклеточных органелл и сегрегации хромосом в митозе. По ним транспортируются клеточные компоненты. Их динамичная структура является результатом одновременной сборки из тубулина и разборки.
Фотодинамическое действие может повреждать мономерный тубулин, ингибировать сборку микротрубочек и разрушать имеющиеся микротрубочки в интерфазных или делящихся клетках. Поэтому предполагается, что тубулин и микротрубочки, наряду с плазматической мембраной и внутриклеточными органеллами, являются одной из мишеней фотодинамического воздействия. Воздействие на них в делящихся клетках предотвращает формирование митотического веретена и приводит к нарушению митоза. Фотосенсибилизированные клетки накапливаются в метафазе; повышается митотический индекс. Не вступившие в деление клетки затем умирают. Другие важные следствия разрушения микротрубочек – нарушение внутриклеточного везикулярного транспорта и формы клеток.
Морфологические изменения фотосенсибилизированных клеток: резкое снижение числа филоподий, «пузырение» клеточной поверхности, сморщивание и округление клеток, свидетельствуют о значительных нарушениях актинового цитоскелета. Актиновый цитоскелет - высоколабильная структурой, способная быстро перестраиваться при движении клеток, когда постоянно меняется их форма. Эти процессы находятся под контролем разнообразных сигнальных процессов, связанных с адгезионными молекулами. Поэтому фотодинамически индуцированные перестройки актинового цитоскелета могли быть опосредованы сигнальными процессами.
12.Ядро
Фотодинамическое воздействие эффективно повреждает ДНК в растворах. Однако, фотосенсибилизаторы порфиринового ряда - производные гематопорфирина HpD и Фотофрин, алюмофталоцианины ChlAIPc, AlS2Pc, AlS4PC или Pc 4, BPD MA и mTHPC - практически не попадают в клеточное ядро. Поэтому они не повреждают генетический аппарат, не вызывают мутации и не являются канцерогенами.
13. Роль митохондрий в фотодинамически индуцированном апоптозе
Фотодинамическое воздействие может индуцировать как некроз, так и апоптоз в зависимости от силы и интенсивности воздействия, а также от того, какие клеточные структуры повреждаются в первую очередь. Так, после кратковременной инкубации (порядка 1 часа) Фотофрин или HpD накапливаются в плазматической мембране, и последующее освещение преимущественно вызывает некроз. После 24-часовой инкубации, когда краситель распределяется по всей клетке и сосредотачивается в митохондриях, такое же освещение вызывает апоптоз. Фотодинамическое воздействие на клетки in vitro быстро и эффективно индуцирует апоптоз митохондриального типа.
Фотоповреждение митохондрий может привести к следующим процессам, участвующим в некротической и апоптотической смерти клетки:
- Резкое усиление генерации АФК, в частности, супероксид-аниона О2;
- Падение производства АТФ;
- Высвобождение ионов Ca2+;
- Высвобождение цитохрома c и запуск апоптоза.
Цитохром с является ключевым участником в фотоиндуцированной инициации апоптоза. Фотоиндуцированное перекисное окисление митохондриальных липидов, в частности, кардиолипина, удерживающего цитохром с на внешней поверхности внутренней митохондриальной мембраны, приводит к мобилизации цитохрома с и выходу его из межмембранного пространства в цитозоль. Там он где в комплексе с dATP и белком Apaf-1 активирует каспазу 3 и последующие гидролитические ферменты, осуществляющие апоптоз (Рис.4.7, 4.8). Но как цитохром с и другие проапоптозные белки могут выходить из межмембранного пространства через наружную митохондриальную мембрану, проницаемую лишь для молекул с молекулярной массой не более 6 кДа? Существуют две гипотезы,
- Открытие высокопроницаемых митохондриальных пор (PTP, permeability transition pore). PTP – крупный белковый комплекс, расположенный в месте слияния внутренней и наружной митохондриальных мембран. Открытие PTP вызывает мгновенную утечку ионов, потерю митохондриального трансмембранного потенциала m и сопряжения окислительного фосфорилирования, подавление синтеза ATP и генерацию мАФК. Массивный вход воды через PTP вызывает осмотическое набухание митохондриального матрикса и разрыв наружной митохондриальной мембраны, чья поверхность намного превышает поверхность внутренней мембраны. Это позволяет межмембранным белкам выйти из митохондрии в цитозоль.
- Открытие специальных мегаканалов в наружной митохондриальной мембране, достаточно больших для прохождения белков. Эти каналы формируются белками Bax или Bak, относящимися к семейству белков Bcl-2. Bak нормально присутствует в наружной митохондриальной мембране, а Bax находится цитозоле, где он связан с белком Ku70. При повреждении клетки этот комплекс диссоциирует и Bax высвобождается. Белок Bax также может активироваться фрагментом белка Bid, называемым tBid (Рис.4.8). После активации Bax перемещается в наружную митохондриальную мембрану, где он олигомеризуется и формирует мегаканалы.
Выход цитохрома с из митохондрий в цитозоль и последующий апоптоз «митохондриального типа» был продемонстрирован во многих работах при фотосенсибилизации разных клеток различными красителями. Как показали Kriska et al. (2005), выход цитохрома с из фотосенсибилизированных митохондрий происходит в результате перекисного окисления кардиолипина, который удерживает его в межмембранном пространстве митохондрий. В фотосенсибилизированных клетках могут реализоваться оба способа высвобождения цитохрома с и других проапоптозных белков из митохондрий: через открытые PTP и через Bax/Bak мегаканалы. При этом фотодинамическое воздействие может открывать PTP или, воздействуя на PTP, ингибировать их открытие.
Порфириновые фотосенсибилизаторы связываются с периферическими бензодиазепиновыми рецепторами как раз в области PTP, и поэтому PTP являются одной из главных мишеней для их фотодинамического действия. Однако, для фотосенсибилизаторов, не проявляющих особого сродства к PBR, механизм фотоповреждения митохондрий может быть иным.
Транслокатор адениновых нуклеотидов ANT, входящий в состав PTP, оказался наиболее чувствительным к фотодинамическому воздействию среди всех митохондриальных белков. ANT составляет 9-10 % от всех белков митохондрий. Его необратимое повреждение предшествует другим повреждениям митохондрий: инактивации дыхательных ферментов, потере m, снижению производства АТФ и выходу Ca2+ из митохондрий.
В других случаях фотоиндуцированный выход цитохрома с из митохондрий и последующий апоптоз происходили независимо от открывания PTP и падения m. В этих клетках выход цитохрома с контролировался белками семейства Bcl-2. Сверхэкспрессия антиапоптозных белков Bcl-2 и Bcl-xL задерживала или предотвращала фотоиндуцированное высвобождение цитохрома с, активацию каспаз 3 и 6, а также белков PARP и DFF/ICAD, участвующих во фрагментации ДНК. И наоборот, снижение уровня Bcl-2 способствовало апоптозу. Но иногда наблюдались парадоксальные результаты: в клетках A431 или MCF10A со сверхэкспрессией защитного белка Bcl-2 фотодинамическое воздействие неожиданно усиливало апоптоз. Оказалось, что в этих клетках была настолько повышена экспрессия проапоптозного белка Bax, что отношение Bax/Bcl-2 увеличивалось. Следовательно, клеточную судьбу определяет не уровень отдельных белков Bax и Bcl-2, а соотношение между ними. Вероятно, противоапоптозное действие белков Bcl-2 и Bcl-xL связано с их способностью формировать гетеродимеры с белком Bax. Это снижает количество молекул Bax, образующих мегаканалы в наружной митохондриальной мембране. В фотосенсибилизированных клетках уровень Bax мог повышаться, или понижаться. Но апоптоз усиливался тогда, когда повышалось отношение Bax/Bcl-2. В фотосенсибилизированных клетках белок Bax способствовал выходу из митохондрий не только цитохрома с, но и других проапоптозных белков: AIF или Smac/DIABLO.
14.Смерть клеток при фотодинамическом воздействии на лизосомы
Фотодинамическое повреждение лизосом может вызвать выход в цитоплазму гидролитических ферментов, повреждение цитоплазматических структур и смерть клеток. Но все же оно не является критическим цитотоксическим событием, т.к. лизосомные гидролазы теряют активность в цитозоле при pH 7,0-7,2. Они также могут фотоинактивироваться в лизосомах еще до их выхода в цитозоль. Поэтому гидрофильные сенсибилизаторы, локализующиеся в лизосомах обычно менее эффективны, чем гидрофобные, диффузно окрашивающие цитоплазму. Квантовый выход вызываемой ими фотодинамической инактивации клеток, как правило, ниже, чем для гидрофобных фотосенсибилизаторов, попадающих в митохондрии.
Фотосенсибилизаторы, локализующиеся в лизосомах, обычно индуцируют некроз, но иногда могут вызывать апоптоз, а иногда - смерть клеток с комбинацией свойств некроза и апоптоза. Фотоповреждение лизосом приводит к высвобождению из них катепсинов, протеолитических ферментов, способных превращать прокаспазу 3 в активную каспазу 3 (Рис.4.7, 4.8). Катепсины также могут активировать проапоптотический белок Bid, отрезая от него пептидный фрагмент. Укороченный белок tBid способствует олигомеризации белков Bak в наружной мембране митохондрий и формированию из них мегаканалов, через которые могут выходить цитохром с и другие проапоптозные белки.
15.Роль ионов кальция в фотодинамически индуцированном апоптозе
Ионы кальция, Ca2+, играют исключительную роль в регуляции различных клеточных процессов. Ca2+ является вторым мессенджером в системе сигнальной трансдукции и интегрирует разные сигнальные пути. В клетках одновременно работают различные системы регуляции уровня ионов кальция в цитозоле, [Ca2+]i (Рис.7). Внутриклеточная концентрация ионов Ca2+ может повышаться вследствие их проникновения в клетку через кальциевые каналы в плазматической мембране. Кроме того, Ca2+ может обмениваться на внутриклеточный Na+. Кальций также может высвобождаться из ЭР через каналы, образованные рецепторами 1,4,5-инозитолтрифосфата (IP3R) или рианодина (RyR). Выход Ca2+ из митохондрий происходит в результате открытия митохондриальных пор или разрыва внутренней митохондриальной мембраны. Возможен также обмен депонированного Ca2+ на цитоплазматические ионы H+ или Na+. При этом небольшое повышение концентрации Ca2+ в цитозоле может вызвать массивный выброс Ca2+ из ЭР или стимулировать открытие митохондриальных пор.
Также существует несколько путей снижения [Ca2+]i (Рис.7). Ионы Ca2+ выкачиваются из цитозоля кальциевым насосом PMCA через плазматическую мембрану или закачиваются в цистерны эндоплазматического ретикулума с помощью другой Ca2+-ATPазы SERCA. Также они могут накапливаться в митохондриях кальциевым унипортером.
Повышение уровня Ca2+ в цитозоле может индуцировать как некроз, так и апоптоз. Ионы Ca2+ активируют целый ряд гидролитических ферментов: протеиназ, нуклеаз, и фосфолипаз. Это вызывает открытие PTP и последующее высвобождение из митохондрий цитохрома с, активирующего каскад каспаз и эндонуклеаз, выполняющих программу апоптоза.
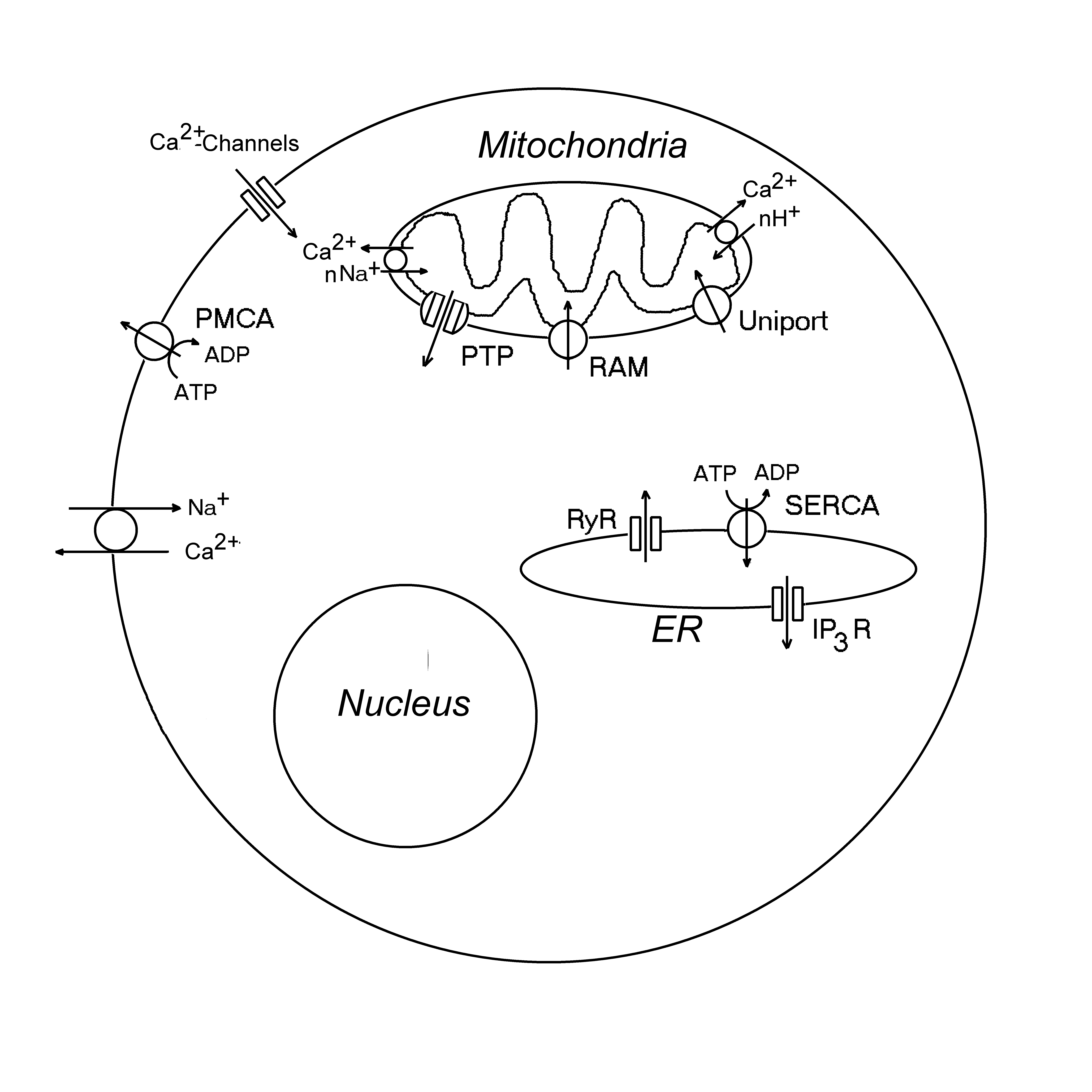
Рис.7. Системы поддержания кальциевого гомеостаза в клетке. IP3R – рецепторы инозитолтрифосфата, PMCA – кальциевая АТРаза плазматической мембраны; PTP - митохондриальные высокопроницаемые поры, RAM – быстрый транспорт ионов кальция в митохондрии, RyR- рианодиновые рецепторы; SERCA - кальциевая АТРаза эндоплазматического ретикулума.
Фотодинамическое воздействие быстро повышает уровень Ca2+ в цитозоле, а затем следует фаза медленного, но продолжительного повышения [Ca2+]i. Предполагается, что быстрое, но кратковременное повышение [Ca2+]i может быть результатом входа ионов через клеточную мембрану, а более продолжительное и стабильное – выхода Ca2+ из ЭР и митохондрий. Повышению уровня Ca2+ в цитозоле также способствует фотодинамическое повреждение кальциевых насосов с последующим нарушением депонирования Са2+ в эндоплазматическом ретикулуме. Действительно, в клетках, фотосенсибилизированных липофильным вертепорфином, нарушалась именно аккумуляция в цистернах эндоплазматического ретикулума, а его не высвобождение. Наиболее чувствительной к фотодинамическому действию вертепорфина была Са2+-АТФаза SERCA-2. Активация фосфолипазы С с последующим расщеплением мембранных фосфоинозитидов и активацией инозитолтрифосфат-управляемых кальциевых каналов также может привести к выбросу Са2+ из эндоплазматического ретикулума.
Митохондрии накапливают большое количество кальция, который может высвобождаться при их повреждении. Фотосенсибилизация по-разному влияет на эти процессы. Так, фотодинамическое воздействие mTHPC ингибирует поглощение Ca2+ изолированными митохондриями вследствие повреждения кальциевого унипортера, а кратковременная фотосенсибилизация митохондрий гематопорфирином инактивирует ANT и предотвращает открывание PTP, через которые может выбрасываться Ca2+.
Есть разные мнения о роли Ca2+ в фотосенсибилизированных клетках. По одним данным, Ca2+ участвует в защите клеток, активируя различные сигнальные пути. Так, согласно Penning et al. (1993), защитная роль Ca2+ в клетках карциномы T24 связана с активацией циклооксигеназы и последующим высвобождением простагландина Е2. Другой защитный механизм, описанный в работе Zheng et al. (2006) для клеток рака толстой кишки SW480, связан с активацией ERK-зависимого пути.
Однако, по мнению большинства авторов, фотоиндуцированное повышение [Ca2+]i влечет за собой смерть клеток. Например, было показано, что в клетках HeLa, фотосенсибилизированных вертепорфином, фотодеградация SERCA2, кальциевого насоса ЭР, приводила к накоплению Ca2+ в цитозоле. Это вызывало дефосфорилирование белка Bad, инактивацию Bcl-xL и в конце – апоптоз (Granville et al., 2001).
16. Участие сигнальных процессов в реакциях клеток на фотодинамическое воздействие
Процессы сигнальной трансдукции управляют как защитными механизмами клетки, так и механизмами, реализующими клеточную смерть. Поэтому в последние годы многие исследователи тщательно изучают роль различных сигнальных путей в клеточных реакциях на фотодинамическое воздействие. Пока эти полученных знаний недостаточно для получения полной картины процессов, происходящих в клетках. Эти данные зачастую противоречивы, что связано с различием исследованных клеточных линий, фотосенсибилизаторов, режимов фотодинамического воздействия и условий проведения экспериментов. Но можно надеяться, что в будущем, модулируя сигнальные процессы, лежащие в основе клеточной регуляции, можно будет управлять фотодинамическим воздействием на различные клетки с тем, чтобы избирательно усиливать повреждение патологически измененных клеток и одновременно защищать окружающие нормальные клетки.
Как показывают данные таблицы 3, фотодинамическое воздействие не только повреждает разнообразные клеточные белки, но также вызывает активацию и повышение экспрессии некоторых из них. К таким белкам относятся некоторые белки общего метаболизма, например, гликолитические, поддерживающие производство АТФ, когда нарушается окислительное фосфорилирование в митохондриях. Другой класс активируемых белков - защитные белки: разнообразные шапероны, супероксиддисмутаза, гемоксигеназа-1. Фотодинамическое воздействие также активирует белки, участвующие в апоптозе: каспазы, белки семейства Bcl-2, PARP и т.д. Наконец, самый интересный класс белков – сигнальные белки, контролирующие практически все внутриклеточные процессы. Это разнообразные протеинкиназы и факторы транскрипции, управляющие работой генома. Рассмотрим участие некоторых важнейших сигнальных белков в реакциях клеток на фотодинамическое повреждение.
Таблица 3. Белки, активирующиеся или экспрессирующиеся при фотодинамическом воздействии
|
Белки
|
Функции
|
|
Исполнители и регуляторы апоптоза
|
|
Каспазы -2,3,6,7,8 и 9
|
Протеолиз при апоптозе
|
|
Bax
|
Митохондриальные мегаканалы, апоптоз
|
|
Bcl-2
|
Предотвращение апоптоза
|
|
Bcl-xS, Bid, Bad, Bak
|
Индукция апоптоза
|
|
Smac/DIABLO
|
Индукция апоптоза
|
|
PARP
|
Апоптоз
|
|
Fas и Fas лиганд
|
Инициация апоптоза
|
|
Сигнальные белки
|
|
Кальмодулин
|
Ca2+-зависимый модулятор белков
|
|
Протеинкиназа В/Akt
|
Выживание клеток
|
|
PI 3-киназа
|
Фосфорилирование Akt/PKB
|
|
p38
|
MAP киназа
|
|
JNK
|
MAP киназа
|
|
ERK1/2
|
MAP киназа
|
|
MPK-1
|
MAPK фосфатаза 1. Дефосфорилирование Erk
|
|
FAK
|
Фокальная адгезионная киназа
|
|
GAP
|
Ras-активирующий белок
|
|
Фосфолипаза PLA2
|
Гидролиз фосфолипидов
|
|
Циклооксигеназа COX-2
|
Производство простагландинов
|
|
NO-синтаза
|
Производство NO
|
|
AP-1
|
Фактор транскрипции
|
|
c-fos
|
Компонент AP-1
|
|
c-jun
|
Компонент AP-1
|
|
NF-B
|
Фактор транскрипции
|
|
p53
|
Фактор транскрипции. Индукция апоптоза
|
|
p21
|
Ингибитор циклин-зависимых киназ
|
|
Структурные белки и ферменты общего метаболизма
|
|
Гликолиз
|
Синтез АТФ
|
|
Bap-31
|
Челнок между ЭР и Гольджи
|
|
DNA-PKCS
|
DNA-зависимая протеинкиназа
|
|
MMP-1, -3, -8, -9
|
Металлопротеиназы
|
|
Защитные белки
|
|
Hsp-47, Hsp-60, Hsp-70, Hsp-72, Hsp-73, Hsp-90, Hsp-110
|
Шапероны
|
|
GRP-78, GRP-80, GRP-94, GRP-100
|
Стресс-белки, регулируемые глюкозой
|
|
MnSOD (но не Cu,Zn-SOD)
|
Детоксикация О•2
|
|
Гемоксигеназа HO-1
|
Метаболизм гема и Fe2+
|
17. Протеинкиназа С
Протеинкиназа С – один из центральных регуляторов в сигнальной системе клетки. После активации ионами Ca2+ и диацилглицеролом она фосфорилирует и регулирует множество белков, контролирующих жизнедеятельность и выживаемость клеток, включая ферменты, факторы транскрипции, ионные каналы и белки цитоскелета.
Есть ряд примеров об участии протеинкиназы С в фотоиндуцированной смерти клеток CHO и апоптозе глиальных клеток, сенсибилизированных алюмофталоцианином. Но в большинстве работ ингибиторы протеинкиназы С: гиперицин, стауроспорин, тамоксифен или Н7 усиливали фотоиндуцированный апоптоз этих клеток, что указывает на защитную роль этого фермента, причем она защищала клетки не только от апоптоза, но и от некроза. Одним из механизмов ее противоапоптозной активности может являться фосфорилирование и активация противоапоптозного белка Bcl-2.
18.cAMP-зависимый сигнальный путь
Циклический аденозинмонофосфат, синтезируемый аденилатциклазой в ответ на связывание межклеточных молекулярных сигналов (гормонов, нейромедиаторов) рецепторами, связанными с G-белками, активирует протеинкиназу А, которая, в свою очередь, фосфорилирует и активирует разнообразные исполнительные белки в клетке. Этот путь обычно участвует в защите клеток от повреждений, индуцированных внешними воздействиями. Действительно, в ряде работ было показано, что аденилатциклазный путь участвует в защите различных клеток от фотодинамического повреждения.
19.Тирозинкиназы
Рецепторные тирозинкиназы, распознающие внеклеточные сигнальные молекулы, такие как цитокины и факторы роста, инициируют сигнальные пути, связанные с МАР киназами, фосфолипазой С, и фосфатидилинозитол 3-киназой, которые регулируют клеточные реакции на стресс, выживаемость клеток и поддерживают целостность тканей (Рис.4.9).
Фотодинамическое воздействие может повреждать рецепторы клеточной поверхности. Экспериментально показано, что фотосенсибилизация клеток может ингибировать связывание различных цитокинов (например, TNF-, IL-8, EGF) с рецепторами или связывание моноклональных антител - с поверхностными антигенами. Этот эффект специфичен для разных рецепторов, цитокинов или антител. Например, в эпителиальных клетках FaDu фотодинамическое воздействие протопорфирина IX, синтезированного из экзогенного ALA, вызывало структурные модификации и потерю рецепторов EGF, поперечные сшивки некоторых белков, дефосфорилирование фосфотирозинов в белках, ингибирование протеинфосфатаз и стимуляцию сигнального пути, опосредованного МАР киназой JNK (Liu et al., 2004). В результате нарушались межклеточные взаимодействия. Клетки теряли чувствительность к внеклеточным молекулярным сигналам, регулирующим их функции и выживаемость.
20.MAP киназы
MAP киназы (mitogen-activated protein kinase, MAPK) участвуют в реакциях клеток на разные физико-химические воздействия, включая гормоны, цитокины, окислительный стресс, ультрафиолетовое и ионизирующее излучение. Это семейство серин/треонин протеинкиназ, регулирующих экспрессию генов, метаболизм, подвижность, деление и смерть клеток. Их функции и структура эволюционно консервативны. В состав этого семейства входят три протеинкиназы: ERK, JNK и p38 (Рис.4.9). Протеинкиназа ERK, стимулируемая факторами роста, цитокинами и другими химическими сигналами, регулирует постмитотические процессы и пролиферацию клеток. JNK и p38, активируются в ответ на стрессовые воздействия, а также на факторы роста и воспалительные цитокины. JNK фосфорилирует белок c-Jun, который вместе с белком c-Fos образуют фактор транскрипции AP-1, контролирующий экспрессию многих генов, участвующих в реакциях клеток на стресс, в апоптозе и канцерогенезе.
Фотоиндуцированные изменения ERK зависят от дозы воздействия: сравнительно слабое фотодинамическое воздействие активирует этот фермент, но при повышении дозы – угнетает. Разумеется, эти изменения зависят также от использованного фотосенсибилизатора и изучаемого типа клеток. Предполагается, что активация сигнального пути с участием ERK играет защитную роль, но пока неясно, каким образом фотодинамическое воздействие активирует этот сигнальный путь, и не известны субстраты этого фермента в фотосенсибилизированных клетках.
В экспериментах на разных клеточных линиях, подвергнутых фотодинамическому воздействию различных фотосенсибилизаторов, также наблюдалась время- и дозозависимая активация других МАР киназ, JNK and p38. В ряде работ фотодинамическое воздействие не влияло на их исходный уровень, но быстро, в пределах 30 мин повышало содержание их фосфорилированных, т.е. активированных форм. Активация JNK и p38 была временной. Она длилась около получаса, а затем за несколько часов их активность возвращалась к исходному уровню.
Полученные к настоящему времени данные показывают, что JNK и p38 играют значительную роль в регуляции выживаемости и смерти клеток при фотодинамическом воздействии. Но установить однозначную связь с этими процессами пока не удалось, так данные экспериментов на разных видах клеток, фотосенсибилизированных различными красителями, не дают однородную картину. В некоторых случаях фотоактивация JNK или p38 вела к апоптозу, в других эти MAP киназы играли защитную роль. Очень часто эти ферменты действовали по-разному. Например, при фотосенсибилизации клеток гидрофобным гиперицином, локализующимся преимущественно в ЭР и аппарате Гольджи, активация JNK и p38 приводила к защите клеток от фотоиндуцированного апоптоза. Напротив, в клетках, сенсибилизированных гидрофильными фотосенсибилизаторами, локализующимися в плазматической мембране и лизосомах, их активация вызывала апоптоз. Каким образом фотоиндуцированный синглетный кислород и другие АФК активируют JNK и p38, и какие процессы, направленные на выживание или смерть клеток, активируются этими белками, пока не выяснено
21.Фосфатидилинозитол 3-киназа и протеинкиназа В/Akt
Фосфатидилинозитол 3-киназа (PI3K) участвует в клеточных реакциях на стрессовые воздействия и регулируют выживаемость клеток, их устойчивость к апоптозу путем активации протеинкиназы В/Akt и нижележащих сигнальных путей. В работе Xue et al. (1999) продемонстрировано участие PI3K в защите клеток карциномы простаты от апоптоза, вызванного фотодинамическим воздействием фталоцианина Pc 4. Фотодинамическое воздействие бенгальского розового вызывало значительную и продолжительную активацию протеинкиназ Akt и p38 в фибробластах мыши, за которой следовал апоптоз этих клеток. В этом случае активация Akt рассматривалась как сигнал жизни, а одновременная активация p38 – как сигнал смерти. Это показывает участие Akt в выживаемости клеток.
22.AP-1
Фактор транскрипции АР-1 (activating protein-1) контролирует экспрессию разных генов, участвующих в апоптозе, пролиферации клеток, дифференцировке, опухолевом росте и других клеточных функциях. Это гомо- или гетеродимер, состоящий из белков семейств Fos и Jun. АР-1 активируется факторами роста, цитокинами, гипоксией, ультрафиолетовой и ионизирующей радиацией. В активации АР-1 принимают участие разные сигнальные пути, в частности, путь с участием МАР киназы JNK. АР-1 – редокс-чувствительный белковый комплекс, хотя сенсоры кислорода, активирующие АР-1, пока не обнаружены.
В опытах Luna et al. (1994) фотодинамическое воздействие Фотофрина вызывало повышение уровня мРНК белков c-Fos и c-Jun в клетках фибросаркомы мыши. Было показано фотодинамическая активация АР-1 и генов раннего ответа c-fos и c-jun была опосредована протеинкиназой С и фосфолипазой PLA2. В эпителиальных клетках HeLa фотосенсибилизация Фотофрином также вызывала быструю, сильную и продолжительную стимуляцию c-jun и особенно c-foc, а также связывание АР-1 с ДНК, но это не требовало активации протеинкиназы С (Kick et al., 1996).
23.NF-B
Фактор транскрипции NF-B служит центральным интегратором сигнальных путей, направленных на поддержание выживаемости клеток. Он связывается с особой последовательностью нуклеотидов в ДНК и контролирует более 150 генов, ответственных за отдельные стадии апоптоза, пролиферацию, иммунные реакции, канцерогенез, разные сердечно-сосудистые, нейродегенеративные и другие болезни. В цитоплазме NF-B образует неактивный комплекс с ингибиторным белком IB, который предотвращает его проникновение в ядро. Под влиянием специального белка IKK этот комплекс распадается и высвобождает NF-B, который затем направляется в ядро, где стимулирует экспрессию генов. Разные стимулы - ультрафиолетовое или ионизирующее излучение, фармакологические агенты, гормоны, цитокины, гипоксия могут стимулировать NF-B. Многие из этих факторов генерируют АФК и вызывают окислительный стресс. Поэтому NF-B известен как редокс-чувствительный фактор транскрипции. Активация NF-B обычно предотвращает апоптоз. Он вызывает экспрессию генов, кодирующих противоапоптозные белки Bcl-2, Bcl-xL, c-Myc, сурвивин, XIAP, COX-2, MnSOD, и одновременно подавляет синтез про-апоптозных белков..
NF-B играет важную роль в реакциях клеток на фотодинамическое воздействие. Его активация в клетках разных видов наблюдалась при фотосенсибилизации различными красителями. При этом NF-B исчезает из цитоплазмы и появляется в клеточном ядре. Фотодинамическое воздействие также усиливает связывание NF-B с ДНК. В ряде случаев отмечена двухфазная активация NF-B: кратковременная активация в первые 30 мин и затем продолжительная стимуляция (до 24 часов). Фотодинамическое воздействие, активирующее NF-B, также запускает апоптоз. Но механизмы фотоактивации NF-B и стимуляции апоптоза, вероятно, различны. Как показали эксперименты, первый не зависел от генерации АФК, но требовал интернализации интерлейкина IL-1 и участия соответствующих сигнальных каскадов, в которых IKK фосфорилирует IB и запускает распад его комплекса с NF-B. Индукция апоптоза не зависела от IL-1. Каким образом фотогенерируемые АФК стимулируют IKK, который активирует NF-B, пока неизвестно.
24. Белок р53
Белок р53 координирует репарацию ДНК, клеточный цикл и апоптоз, индуцированный повреждением ДНК. Он регулирует экспрессию по меньшей мере 100 генов, участвующих в этих процессах. Важной физиологической функцией белка р53 является индукция апоптоза поврежденных клеток. Потеря или мутации гена р53 ведут к росту опухоли. Он также играет центральную роль в клеточных реакциях на окислительный стресс. Обычно его экспрессия поддерживается на низком уровне благодаря быстрому протеолизу. После клеточного стресса и обширного повреждения ДНК, вызванного АФК, ультрафиолетовой или ионизирующей радиацией, уровень белка р53 возрастает, хотя пока не очень понятно, как окислительный стресс индуцирует экспрессию р53 и последующие реакции. Сигнальные пути, регулирующие уровень р53, и нижележащие пути, контролируемые этим белком, очень сложны.
Повреждение ДНК не характерно для фотодинамического воздействия, так как большинство фотосенсибилизаторов не попадает в клеточное ядро. Тем не менее, белок р53 участвует в фотодинамическом повреждении различных (но не всех) клеток, сенсибилизированных разными фотосенсибилизаторами. В некоторых работах показано, что фотоиндуцированная активация р53 усиливала потерю клоногенности клеток и некроз. В других - то, что фотодинамическое воздействие может вызывать апоптоз независимо от белка p53. Но в большинстве исследований сообщалось об участии р53 в фотоиндуцированном апоптозе. Что могло индуцировать экспрессию р53 в фотосенсибилизированных клетках? Возможны два пути: (а) через активацию JNK и другие сигнальные пути и (б) через индукцию множественных разрывов ДНК на начальных стадиях апоптоза. Активированный р53 может индуцировать транскрипцию генов, кодирующих проапоптозные белки, которые остаются неповрежденными. Так может создаться цепь с положительной обратной связью, ускоряющая фрагментацию ДНК и развитие апоптоза. Оба механизма, в принципе, могут действовать совместно или по-отдельности ы разных типах клеток. Нужно помнить, что примерно в 50 % всех случаев рака опухолевые клетки несут мутации гена p53, что позволяет им избежать апоптоза и неконтролируемо делиться. Соответственно, многие из используемых в экспериментах опухолевых клеток являлись мутантами по гену p53.
25.Белок p21
Ингибитор циклин-зависимой протеинкиназы p21 вызывает остановку клеточного цикла и поэтому он играет важную роль в предотвращении неконтролируемого деления клеток и развития опухоли. Кроме этого, р21 ингибирует апоптоз и участвует в репарации ДНК. Благодаря своей центральной роли, р21, как и р53, считается одним из основных регуляторов выживаемости и смерти клеток . При окислительном стрессе экспрессия р21 может вызываться как р53-зависимым, так и р53-независимым путем.
Фотодинамическое воздействие вызывало остановку клеточного цикла и апоптоз культивируемых раковых клеток, связанную экспрессией белка р21 и остановкой клеточного цикла в фазе G0-G1. В отсутствие активности р53 в раковых клетках эти процессы могли быть связана с опосредованной белком р21 разрегуляцией клеточного цикла и предотвращением перехода клеток к фазе G1.
26.Участие защитных белков в реакциях клеток на фотодинамическое воздействие
Антиоксидантная защита клетки включает низкомолекулярные антиоксиданты (каротиноиды, глутатион, аскорбат и др.) и ферменты детоксикации АФК (супероксиддисмутаза, каталаза и различные пероксидазы). Хотя большинство фотосенсибилизаторов генерируют в основном синглетный кислород, при фотодинамическом воздействии повышается уровень марганец-зависимой супероксиддисмутазы (MnSOD). MnSOD локализуется в митохондриальном матриксе и, в отличие от конститутивной цитоплазматической Cu,Zn-SOD, является индуцибельной изоформой SOD. Ее основная функция – детоксикация супероксида и других митохондриальных АФК, интенсивно генерируемых в митохондриях во время и после фотодинамического воздействия.
В опытах с фотосенсибилизацией различных клеток отмечено повышение активности и экспрессии митохондриальной MnSOD, но не цитоплазматической Cu,Zn-SOD. В фотосенсибилизированных эритроцитах человека наблюдалась активация не только SOD, но и каталазы и глутатионпероксидаза. Сверхэкспрессия MnSOD защищала клетки от фотоиндуцированного апоптоза, а ее ингибирование усиливало цитотоксический и противоопухолевый эффект фотодинамического воздействия. Сигнальные механизмы, вызывающие сверхэкспрессию SOD в фотосенсибилизированных клетках пока не установлены.
Белки теплового шока и белки, регулируемые глюкозой
Белки теплового шока (Hsp - heat shock protein), или стресс-белки, или шапероны вырабатываются в клетках в ответ на стресс, вызванный разнообразными физико-химическими воздействиями. Они восстанавливают пространственную структуру денатурированных или неправильно свернутых белков, у которых неполярные аминокислотные остатки экспонированы наружу. Связываясь с таким белком, Hsp за счет энергии АТР меняет свою конформацию и вместе с ним изменяется конформация связанного белка. После серии конформационных изменений белок сворачивается правильным образом так, что все гидрофобные аминокислоты оказываются внутри глобулы. Hsp выполняет защитную, противоапоптозную роль.
Фотодинамическое воздействие на разные виды клеток повышало в них экспрессию различных стресс-белков (Табл. 3): Hsp27, Hsp47, Hsp60, Hsp70, Hsp72, Hsp73, Hsp90, Hsp110 и белков, регулируемых глюкозой (ЭР шаперонов): GRP78, Grp80, Grp94 и Grp100, что способствовало исправлению конформации денатурированных и неправильно свернутых белков и защищало клетки от фотоповреждения.
Заключение
Таким образом, в реакциях клеток на фотодинамическое воздействие участвуют практически все сигнальные пути клеток. Некоторые из них направлены на защиту клеток, а другие участвуют в процессах клеточной смерти. Пока наши знания о молекулярных механизмах клеточных реакций очень фрагментарны. Не известны сенсоры активных форм кислорода, Не известны все участвующие в них сигнальные пути и основные их компоненты в клетках разных видов. Еще меньше информации о том, какие именно исполнительные белки контролируются сигнальными системами при фотодинамическом воздействии, направленном на разные клеточные структуры. Из-за большой сложности сигнальной системы клетки, взаимодействий разных сигнальных путей между собой, различий между разными видами клеток пока трудно понять реальную цепь событий, ведущих к смерти данной клетки в данных условиях.
Тем не менее, можно надеяться, что модификация различных сигнальных путей может модулировать интегральный ответ клетки и привести либо к повреждению клетки, либо к ее защите. Оба эти результаты важны для медицинских приложений.
Литература
1. Владимиров Ю., Рощупкин Д. И., Потапенко А. Я., Деев А. И. Биофизика; Медицина - Москва, 1983. - 272 c.
2. Волькенштейн, М.В. Биофизика; М.: Наука - Москва, 1981. - 576 c.
3. Плутахин Г. А., Кощаев А. Г. Биофизика; Лань - Москва, 2012. - 240 c.
4. Под редакцией Артюхова В. Г. Биофизика; Академический Проект, Деловая книга - Москва, 2009. - 304 c.
5. Рубин, А.Б. Биофизика. Биофизика клеточных процессов; М.: Университет; Издание 2-е, испр. и доп. - Москва, 2000. - 468 c
6. Антонов, В.Ф. Биофизика: Учебник для студентов высших учебных заведений / В.Ф. Антонов, А.М. Черныш, В.И. Пасечник. - М.: ВЛАДОС, 2006. - 287 c.
7. Плутахин, Г.А. Биофизика: Учебное пособие / Г.А. Плутахин, А.Г. Кощаев. - СПб.: Лань, 2012. - 240 c.
8. Сердюк, И. Методы в молекулярной биофизике: структура, функция, динамика. В 2-х т.Методы в молекулярной биофизике: структура, функция, динамика: Учебное пособие / И. Сердюк. - М.: КДУ, 2010. - 1304 c.
9. Черныш, А.М. Физика и биофизика: Учебник / В.Ф. Антонов, А.М. Черныш, Е.К. Козлова. - М.: ГЭОТАР-Медиа, 2013. - 472 c.
10. Штыков, В.В. Квантовая радиофизика: Учебное пособие для студентов вузов / В.В. Штыков. - М.: ИЦ Академия, 2009. - 336 c.
Фотодинамический эффект и фотодинамическая терапия