Именные реакции и реактивы в неорганической химии
Курсовая работа
по неорганической химии
НА ТЕМУ:
«Именные реакции и реактивы
в неорганической химии».
Содержание
Введение…………………………………………………………………………………...4
1. Именные реакции в неорганической химии
1.1. РЕАКЦИЯ БУНЗЕНА………………………………………………………………..5
1.2. Реакция Несслера…………………………………………………………………….5
1.3. Реакция Велера……………………………………………………………………….6
1.4. Реакция Маргграфа…………………………………………………………………..7
1.5. Реакция Бертолле (Бертолетова соль)……………………………………………..8
1.6. Смесь Кибальчича……………………………………………………………………8
1.7. Реакция Каро………………………………………………………………………….8
1.8. Жидкость Ваккенродера……………………………………………………………..9
1.9. Проба по Гемпелю……………………………………………………………………9
1.10. Реакция Глаубера…………………………………………………………………..10
1.11. Реакция Дикона……………………………………………………………………10
1.12 Реакция Фогеля……………………………………………………………………..11
1.13. Реакция Марша…………………………………………………………………….11
1.14. Реакция Мора и Фольгарда………………………………………………………..12
1.15. Реакция Чугаева……………………………………………………………………13
1.16. Реакция Гриньяра………………………………………………………………….13
1.17. Реакция Вюрца……………………………………………………………………..14
1.18. Реакция Фриделя-Крафтса………………………………………………………...14
1.19. Реакция Рамзая……………………………………………………………………15
1.20. Реакция Коновалова………………………………………………………………15
2. Именные реактивы
2.1. Реактив Несслера……………………………………………………………………17
2.2. Реактив Швейцера…………………………………………………………………..17
2.3. Реактив Фишера……………………………………………………………………..18
2.4. Барбитуровая кислота (раствор в пиридине)……………………………………...18
2.5. Баритовая вода………………………………………………………………………18
2.6. Реактив Беттендорфа………………………………………………………………..19
2.7. Реактив Букэ…………………………………………………………………………19
2.8. Реактив Бушарда…………………………………………………………………….19
2.9. Реактив Вагнера……………………………………………………………………..19
2.10. Реактив ван-Урка…………………………………………………………………..20
2.11. Реактив Грисса……………………………………………………………………..20
2.12. Реактив Драгендорфа……………………………………………………………...20
2.13 Реактив Фелинга……………………………………………………………………21
2.14. Реактивы менее употребляемые…………………………………………………..21
3. Экспериментальная часть……………………………………………………...24
Выводы…………………………………………………………………………………...28
Список литературы………………………………………………………………………29
Введение
Уже более ста лет в органической химии используются реакции, получившие название по фамилии химиков, открывших или детально изучивших эти реакции.
Всего известно более 1000 именных органических, неорганических и аналитических реакций. Их число продолжает увеличиваться, так как нет до сих пор общепринятой номенклатуры химических реакций. Название реакции по имени ее первооткрывателя дает возможность кратко передать смысл происходящего превращения.
Цель курсовой работы: рассмотреть именные реакции и реактивы, применяемые в неорганической химии.
Задачи:
1. Познакомиться с наиболее известными именными реакциями.
2. Изучить широко применяемые в неорганической химии именные реактивы.
3. Провести эксперименты именных реакций и сделать выводы о наблюдаемых явлений.
1. Именные реакции в неорганической химии
1.1. РЕАКЦИЯ БУНЗЕНА
Прямое назначение реактива Фишера (Карл Фишер — немецкий химик-аналитик) — определение содержания воды в органических и неорганических веществах. Реакция, положенная в основу этого метода, — взаимодействие иода I2 с диоксидом серы SO2:
I2 + SO2 + 2H2O= 2HI + H2SO4
была открыта Бунзеном еще в 1853 г. В безводной среде I2 с SO2 не реагирует, но достаточно уже следов влаги, чтобы реакция началась. В 1935 г. Фишер сделал реакцию Бунзена аналитической, проходящей со 100%-м выходом, добавив к I2 и SO2 пиридин C5H5N и метанол СН3ОН. Пиридин связывает продукты реакции, а метанол служит растворителем исходных веществ:
2C5H5N • I2 + C5H5N • SO2 + Н2O=2C5H5N • HI + C5H5N • SO3.
Смесь метанола, пиридина, иода и диоксида серы получила на звание реактива Фишера.
1.2. Реакция Несслера.
Чаще всего в лаборатории используют для анализа азотсодержащих веществ методы Несслера или Кьельдаля.
Юлиус Несслер (1827—1905) —немецкий химик-аналитик — предложил в 1868 г. для качественного и количественного опре деления примесей аммиака NH3 и солей аммония (например, хлорида аммония) в различных веществах реакцию взаимодействия аммиака с щелочным раствором комплексного со единения тетраиодомеркурата калия K2[HgI4]:
2K2[HgI4] + NH3 + ЗКОН=(Hg2N)I Н2О + 7KI + 2Н2О.
В результате реакции образуется вещество (Hg2N)I*H2О, прида ющее анализируемому раствору желтый цвет, когда аммиака очень мало. При больших его количествах выпадает осадок бурого цвета1.
Позднее, в 1883 г., Иохан-Густав-Кристоффер Кьельдаль (1849— 1900), датский химик, разработал другой метод анализа, названный впоследствии его именем. Вещество, которое предстоит анали зировать, он сначала разлагал кипячением с концентрированной серной кислотой, часто в присутствии катализаторов. При этом азот органического соединения превращался в сульфат аммония (NH4)2SО4, как, например, в случае анализа карбамида CO(NH2)2:
CO(NH2)2 + H2SО4 + Н2О=СО2 + (NH4)2SО4.
После добавления к сульфату аммония раствора гидроксида натрия NaOH выделялся газообразный аммиак, который нагреванием уда ляли из раствора:
(NH4)2SО4 + 2NaOH=2NH3 + Na2SО4 + 2H2О
и поглощали точно отмеренным количеством разбавленной серной кислоты. Можно для определения количества аммиака (или катиона аммония) в завершающей части анализа использовать и реакцию Несслера.
1.3. Реакция Велера
В воздухе животноводческого помещения всегда повышенное содержание аммиака; аммиак отлично поглощается водой и кисло тами, а это приводит к большому искажению результатов химиче ского анализа.
Вёлер в 1828 г. Случайно обнаружил, что при нагревании водного раствора цианата аммония NH4NCO обра зуется карбамид (NH2)2CO (мочевина). Это был первый синтез органического вещества из неорганического, проведенный чисто химическим методом в лаборатории:
NH4NCO = (NH2)2CO,
а сама реакция получила название реакции Вёлера. Это пример обратимой реакции таутомерии — превращения одного структур ного изомера в другой.
Прошло сорок лет, и карбамид стали получать по реакции Александра Ивановича Базарова (1845—1907), русского химика и агронома, директора Никитского ботанического сада в Крыму. Синтез карбамида по Базарову состоял во взаимодействии аммиака NH3 и диоксида углерода СО2 при 180° С в присутствии пара воды как катализатора:
2NH3 + СО2=(NH2)2CO + Н2О
Любопытно, что применение другой реакции Вёлера сохра нилось до наших дней. Она лежит в основе современного про мышленного способа получения белого фосфора:
Ca3(PО4)2+5C + 3SiО2=P2 + 5CO + 3CaSiО3
Фосфат кальция Са3(РО4)2 (апатит, фосфорит) сме шивают с коксом С и диоксидом кремния SiО2 (песок), а затем прокаливают. Фосфор состава Р2 возгоняется из реакционной смеси и конденсируется в холодильнике уже в виде белого воскообразного вещества состава Р4 — белого фосфора. Вместе с ним удаляется и газообразный монооксид углерода СО, а в реакторе остается рас плавленный метасиликат кальция CaSiО3.
1.4. Реакция Маргграфа
В основе одного из самых старых способов получения чистой ортофосфорной кислоты лежит реакция Маргграфа.
Маргграф предложил получать ортофосфорную кислоту Н3РО4 нагреванием белого или красного фосфора с азотной кисло той:
Р4 + 20HNO3 = 4Н3РО4 + 20NO2 + 4Н2О.
После удаления газообразного диоксида азота остается только водный раствор ортофосфорной кислоты.
1.5. Реакция Бертолле (Бертолетова соль)
Для получения триоксохлората калия КСlO3 Бертолле предложил пропускать хлор С12 в горячий раствор гидроксида калия КОН в воде. Уже через несколько минут из раствора начинают выпадать белые пластинчатые кристаллы КСlO3:
6КОН + С12=КСlO3+5КС1 + ЗН2O.
Кристаллы отфильтровывают и высушивают при температуре не выше 100° С. Триоксохлорат калия применяют в производстве спичек. Описанная выше простая реакция получила впоследствии название реакции Бертолле, а ее продукт — «берто летова соль».
1.6. Смесь Кибальчича
Так называли смесь, состоящую из триоксохлората калия КС1О3 и сахара С12Н22О11. Ее использовали в качестве запала к кустарно изготовленным бомбам. Если смочить смесь каплей концентри рованной серной кислоты H2S04, то происходит сильная вспышка:
ЗКС1О3 + H2SО4 = 2С1О2 + КСlO4 + k2so4 + Н2О.
Выделяющийся диоксид хлора СlО2 тотчас же разлагается на хлор С12 и кислород О2:
2 СlО 2 = С12 +2О2,
воспламеняя сахар:
С12Н22О11+12О2=12СО2 + 11Н2О.
1.7. Реакция Каро
Реакция Каро (Никодем Каро, 1871—1935, немецкий химик) — это реакция взаимодействия триоксохлоросульфата водорода HSC1О3 с безводным пероксидом водорода Н2О2:
HSC1О3 + Н2О2=H2SO5 + НС1.
Один из продуктов реакции — пероксомоносерную кислоту H2SО5 — еще до сих пор называют кислотой Каро. Она образует лег коплавкие бесцветные красивые кристаллы, прикосновение которых к бензолу С6Н6 сопровождается взрывом. Это один из сильнейших окислителей. Есть еще способ получения кислоты: надо смешать концентрированную серную кислоту с пероксодисульфатом калия K2S208, а затем добавить в полученную кашицу лед:
k2s2o8+Н2О=k2so4+h2so5.
1.8. Жидкость Ваккенродера
Эта жидкость — смесь политионовых кислот состава H2SхО6, где х>3, тонкодисперсной серы и небольших количеств серной кислоты H2S042.
В 1845 г. немецкий химик, врач и аптекарь Генрих-Вильгельм- Фердинанд Ваккенродер (1798—1854) установил, что при пропу скании сероводорода H2S в охлаждаемый ниже 0° С водный раствор диоксида серы SО2 образуется «необычная смесь», получившая впоследствии его имя. Образование одной из политионовых кислот такой смеси:
H2S + 3SО2 = H2S4О6.
1.9. Проба по Гемпелю
Вальтер Гемпель (1851—1916) — немецкий химик-аналитик — предложил проводить восстановление серосодержащих веществ нат рием Na, магнием Mg или алюминием А1. Для этого исследуемый образец в сухом виде он помещал на листочек или пластинку металла, заворачивал в бумагу и обертывал тонкой проволокой, а затем поджигал. Серосодержащие вещества в процессе восстановления металлами превращались в сульфиды. Потом Гемпель растягивал проволоку и погружал продукты сгорания в пробирку с водой. Если теперь слегка подкислить раствор, произойдет вы деление сероводорода H2S:
A12S3 + 6НС1=3H2S +2A1C13,
который можно обнаружить по почернению фильтровальной бу мажки, смоченной раствором нитрата свинца Pb(NО3)2 или суль фата меди CuSО4:
Pb(NО3)2 + H2S = PbS + 2HNО3.
Образующиеся сульфиды свинца PbS или меди CuS вызывают появление на бумаге черных пятен.
1.10. Реакция Глаубера
Немецкий алхимик Глаубер впервые получил многие соли и кислоты. В истории химии наиболее известны две реакции Глаубера.
Первая реакция Глаубера — получение сульфата натрия при взаимо действии хлорида натрия NaCl с серной кислотой H2SО4:
2NaCl + H2SО4 = Na2SО4 + 2НС1
Вторая из предложенных Глаубером реакций связана с синтезом трихлорида сурьмы SbCl3 («сурьмяного масла»):
3HgCl2 + Sb2S3 = 2SbCl3 + 3HgS.
При нагревании смеси хлорида ртути HgCl2 и сульфида сурьмы Sb2S3 хлорид сурьмы отгоняется и собирается в охлаждаемом приемнике.
1.11. Реакция Дикона
Генри Дикон (1822—1876) — английский химик-технолог—в 1867 г. разработал способ непрерывного получения хлора С12 путем каталитического окисления хлороводорода НС1 кислородом воздуха при температуре 400°С с участием катализатора дихлорида меди СиС12:
4НС1 + О2 = 2С12 + 2Н2О.
Эта реакция получила название реакции Дикона, а промышленная технология — процесса Дикона. В процессе Дикона получают не чистый С12, а смесь воздуха с 11% С12. Из этой смеси С12 не выделяют, так как она им бедна, а используют смесь для производ ства хлорной извести CaCl(OCl):
Са(ОН)2 + С12 = СаС1(ОС1) + Н2О.
1.12 Реакция Фогеля
Вернер Фогель (р. 1925 г.) —немецкий химик-аналитик—пред ложил применять для открытия примеси соединений кобальта Со в анализируемых растворах реакцию образования тиоцианатного комплекса этого элемента, вызывающего синее окрашивание рас твора. Реакция Фогеля заключалась в добавлении к исследуемому раствору концентрированного водного раствора тиоцианата ам мония NH4NCS:
CoC12 + 4NH4NCS = (NH4)2[Co(NCS)4] + 2NH4Cl.
Продукт реакции тетратиоцианатокобальтат аммония — синего цве та. Чувствительность реакции Фогеля повысится, если к раствору добавить амиловый спирт С5Н11ОН. Полученный комплекс прак тически полностью перейдет в слой спирта, который не смешивается с водным раствором, а интенсивность окраски возрастает3.
1.13. Реакция Марша
Реакция Марша предложена в 1836 г. Джей мсом Маршем (1790—1846), английским химиком-аналитиком. Реакция Марша служит для качественного открытия очень малых количеств мышьяка As. Все соединения мышьяка в кислом растворе восстанавливаются металлическим цинком до арсина AsH3:
K3AsО3 + 3Zn + 9НС1 = 3ZnCl2+AsH3 + 3H2О + 3KC1.
Образующийся очень ядовитый бесцветный газ арсин пропускают через нагретую стеклянную трубку. Арсин разлагается на водород и мышьяк, оседающий на холодных частях трубки в виде буро черного зеркала:
2AsH3 = 2As + ЗН2 .
1.14. Реакция Мора и Фольгарда
При количественном определении содержания галогенид-ионов титрованием анализируемой пробы раствором нитрата серебра AgNО3 очень трудно зафиксировать точку эквивалентности, когда пора прекратить добавление раствора AgNО3.
Карл-Фридрих Мор (1806—1879) — немецкий химик и фар мацевт — предложил для определения конца титрования добавлять в анализируемый раствор хромат калия К2СО4. Как только все галогенид-ионы будут израсходованы в реакции осаждения гало генида серебра, например хлорида серебра AgCl:
Ag++Cl-=AgCl,
начнется выделение более растворимого хромата серебра Ag2CrО4 кирпично-красного цвета. Это и будет сигналом появления точки эквивалентности.
По способу Фольгарда окончание реакции осаждения галогенида серебра замечают по появлению красной окраски рас твора, вызванной образованием тиоцианата железа [Fe(NCS)3]. Фольгард предложил добавлять в титруемый раствор тиоцианат калия KNCS и нитрат железа Fe(NО3)3. В точке эквивалентности тиоцианат серебра AgNCS превращается в галогенид серебра, а освободившиеся тиоцианат-ионы NCS- немедленно образуют с катионами железа ярко-красный тиоцианат железа:
Ag+ +NCS-= AgNCS,
AgNCS + Cl- = AgCl + NCS-,
Fe(NО3)3 + 3KNCS=[Fe(NCS)3]+ 3KNО3
1.15. Реакция Чугаева
Для осуществления реакции Чугаева к анализируемому раствору прибавляют аммиак NH3 до слабощелочной реакции, а затем несколько капель спиртового раствора диметилглиоксима (CH3)2C2(NOH)2. Если в растворе содержится примесь никеля, то появляется красно-фиолетовая окраска. При большом содержании никеля выпадает осадок красного цвета:
NiCl2 + 2(CH3)2C2(NOH)2 + 2NH3 = [Ni {(CH3)2C2(NOH)NO) 2] + 2NH4C1.
Образующееся в этой реакции комплексное соединение носит на звание бис(диметилглиоксимато)никель(II).
1.16. Реакция Гриньяра
Франсуа-Огюст-Виктор Гриньяр (1871—1935) —французский хи мик-органик, лауреат Нобелевской премии — предложил свою ре акцию для синтеза металл органических соединений. Например, получение диметилцинка (CH3)2Zn осуществляют прямым взаимо действием в среде органического растворителя иодметана и цинка:
2CH3I + 2Zn = (CH3)2Zn + Znl2.
Так как цинкорганические соединения самовоспламеняются на воздухе, то значительно удобнее использовать для работы магнийорганические соединения, которые чаще всего и называют реактивами Гриньяра. С помощью реактивов Гриньяра можно получить спирты, карбоновые кислоты, насыщенные углеводороды — алканы. В ча стности, чтобы синтезировать этан С2Н6, на бромэтан С2Н5Вг действуют магниевым порошком Mg, а затем выделенный броммагнийэтан (бромид этилмагния) разлагают водой:
C2H5Br+Mg= C2H5MgBr,
C2H5MgBr+H2О=C2H6 +Mg(OH)Br.
1.17. Реакция Вюрца
Реакция была открыта Вюрцем в 1855 г. и является одной из важнейших для получения насыщенных углеводородов (алканов). Например, для получения этана С2Н6 к раствору подметана СН31 в этиловом эфире (С2Н5)2О добавляют металлический натрий:
2CH3I + 2Na=C2H6 +2NaI.
Здесь происходит соединение двух фрагментов — метальных ра дикалов СН3 —и удлинение углеводородной цепочки, при этом образуется этан. А для синтеза ароматических соединений исполь зуют «модификацию Фиттига»:
C6H5Br+CH3Br+2Na=С6Н5СН3 + 2NaBr.
В этой реакции на смесь бромбензола С6Н5Вг и бромметана СН3Вг действуют металлическим натрием Na. Продукт реакции — толуол С6Н5СН3. Фиттиг открыл эту реакцию в 1885 г4.
Если в подобном процессе участвует алкоголят металла, на пример этилат натрия C2H5ONa, то можно «выстроить» молекулу эфира в соответствии с реакцией Уильямсона. Александер Уильям сон (1824—1904), английский химик-органик, президент Лондон ского королевского общества, открыл эту реакцию в 1852 г. Она позволяет получать простые эфиры из алкоголятов металлов и алкилгалогенидов. Например, синтез метилэтилового эфира С2Н5ОСН3 проводят смешиванием этилата натрия с иодметаном СН31:
C2H5ONa + CH3I = C2H5OCH3+Nal.
1.18. Реакция Фриделя-Крафтса
Если прибавить хлорид алюминия А1С13 к смеси бензола С6Н6 и алкилгалогенида, например хлорметана СН3С1, то происходит энергичное выделение хлороводорода НС1 и образование толуола С6Н5СН3:
С6Н6 + СН3С1=НС1 + С6Н5СН3.
Хлорид алюминия выполняет здесь функцию катализатора, и в этом сущность реакции Фриделя—Крафтса. Напомним, что Шарль Фридель (1832—1899) —французский химик-органик, член Па рижской академии наук, а Джеймс-Мейсон Крафте (1839—1917) — американский химик-органик, член Национальной академии наук США.
1.19. Реакция Рамзая
Рамзай обнаружил, что при пропускании через раска ленные железные трубки смеси ацетилена и циановодорода HCN образуется пиридин:
2H2C2 + HCN=C5H5N.
Реакция, открытая им в 1877 г., получила название реакции Рамзая. В 1914 г. Чичибабин открыл две реакции, получившие его имя. Он обнаружил, что при действии на нагретый пиридин C5H5N амидом натрия NaNH2 наблюдается выделение водорода Н2:
C5H5N + NaNH2 = C5H4N(NHNa) + Н2
Если затем продукт реакции обработать водой, то можно получить 2-аминопиридин, необходимый для производства ряда лекарств:
C5H4N(NHNa) + Н2О = C5H4(NH2) + NaOH.
Вторая реакция Чичибабина — это образование 2-оксипиридина- та калия при пропускании пара пиридина над нагретым до 400°С гидроксидом калия КОН:
C5H5N + КОН = C5H4N(OK) + Н2 .
1.20. Реакция Коновалова
Хорошо известен способ получения нитросоединений — реакция нитрования: взаимодействие органического вещества с азотной кислотой HNО3. Реакция получила имя Коновалова. Михаил Ива нович Коновалов (1858—1906), русский химик-органик, был рек тором Киевского политехнического института.
Например, метан СН4 в такой реакции, протекающей при повышенном давлении, превращается в нитрометан:
СН4+HN3 = СН3NO2+H2O.
Виктор Мейер (1848—1897) —немецкий химик, президент Не мецкого химического общества — предложил получать алифати ческие нитросоединения действием нитрита серебра на алкилгалогениды. Например, бромметан превращается при помощи ре акции Мейера в нитрометан CH3N02:
CH3Br+AgNО2=CH3NО2 + AgBr
2. Именные реактивы.
2.1. Реактив Несслера
В 50 мл воды растворяют 50 г иодида калия. К этому раствору при постоянном перемешивании прибавляют насыщенный раствор хлорида ртути (II) (6 г хлорида ртути (II) в 100 мл воды) до появления устойчивого осадка йодида ртути. Затем прибавляют 200 мл 6 н. раствора гидроксида калия и воду до 520 мл. Реактив сохраняют в темном месте.
При взаимодействии с NH3 и солями аммония образует красно-коричневый осадок:
2[HgI4]2- + NH3 +3ОН- [OHg2NH2]I + 7I- + 2Н2О.
Несслера реактив применяют для обнаружения и фотометрического определения NH3 при 436 нм с пределом обнаружения 1,4 мкг. Мешают гуанидин и его производные, первичные и вторичные спирты. С восстановителями (первичные и вторичные спирты, альдегиды и др.) Несслера реактив образует металлич. ртуть, например:
RCHO + [HgI4]2- + 2ОН-RCOOH + Hg + Н2О + 4I-.
На этой реакции основано использование Несслера реактива для обнаружения спиртов и альдегидов, а также для идентификации гидрокси аминокислот в бумажной и тонкослойной хроматографии.
2.2. Реактив Швейцера
В 1857 г. швейцарский химик Матиас-Эдуард Швейцер (1818— 1860) обнаружил, что концентрированный водный раствор гидр оксида тетраамминмеди(II) [Cu(NH3)4](OH)2, получаемый в ре акции:
Cu(OH)2 + 4NH3 = [Cu (NH3)4](OH)2
при взаимодействии гидроксида меди Си(ОН)2 и водного раствора аммиака NH3, растворяет целлюлозу. Если полу ченный раствор целлюлозы пропускать через фильеры (отверстия малого диаметра) в ванну с разбавленной серной кислотой, то получаются тонкие «шелковые» нити медно-аммиачного волокна — чистой регенерированной целлюлозы, не содержащей ни меди, ни азота: реактив Швейцера в серной кислоте разрушается:
[Cu(NH3)4](OH)2 + 3H2SО4 = CuSО4 + 2(NH4)2SО4 + 2H2О
и выделяет растворенную в нем целлюлозу. В растворе остаются сульфат меди CuSО4 и сульфат аммония (NH4)2SО4.
2.3. Реактив Фишера
2C5H5N • I2 + C5H5N • SO2 + Н2O=2C5H5N • HI + C5H5N • SO3.
Смесь метанола, пиридина, иода и диоксида серы получила на звание реактива Фишера.
2.4. Барбитуровая кислота (раствор в пиридине)
В колбу вносят 3 г барбитуровой кислоты, прибавляют 15 мл свежеперегнанного пиридина и 3 мл концентрированной соляной кислоты. Содержимое колбы хорошо взбалтывают, прибавляют воду до 50 мл и фильтруют. Этот реактив должен быть свежеприготовленным.
Барбитуровая кислота (раствор в пиридине) - реагент на циановодород (НСN), его соли - цианиды, а также роданиды.
2.5. Баритовая вода
5 г гидроксида бария взбалтывают со 100 мл свежепрокипяченной, а затем охлажденной дистиллированной воды. Этот раствор должен быть свежеприготовленным.
Баритовая вода применяется как реагент для обнаружения углекислого газа.
Ba(OH)2 +CO2 =BaCO3 +H2
Выпадает осадок белого цвета и выделяется газ водород.
2.6. Реактив Беттендорфа
Антон-Йозеф-Губерт Беттендорф (1839—1902), немецкий химик, предложил в 1869 г. для обнаружения мышьяка As в растворе добавлять к концентрированной хлороводородной кислоте НС1 несколько капель анализируемого раствора, а затем 0,5 мл концентрированного раствора дихлорида олова SnCl2 в той же кислоте.
Смешивают 5 частей кристаллического хлорида олова (II), 1 часть 38% соляной кислоты и полученную кашицу насыщают сухим хлористым водородом. Раствор фильтруют через асбестовый фильтр и хранят по возможности заполненых доверху маленьких склянках.
Реактив Беттендорфа - применяется для обнаружения свободного мышьяка в кислотах; также для определения стрихнина.
В этом случае жидкость, если в ней содержится соединение мышьяка, например его трихлорид AsCl3, быстро буреет, и через некоторое время выпадает черный осадок мышьяка, а в растворе остается гексахлоростаннат водорода H2[SnCl6]:
2AsCl3 + 3SnCl2 + 6НС1=2As 1 + 3H2[SnCl6].
Сурьма в тех же условиях не выделяется.
2.7. Реактив Букэ
2 объемные части концентрированной серной кислоты растворяют в 3 частях этилового спирта.
2.8. Реактив Бушарда
В 10-15 мл воды растворяют 2 г йодида калия. К полученному раствору прибавляют 1,27 г йода. После растворения йода прибавляют воду до 100 мл.
2.9. Реактив Вагнера
В 1887 г. русский химик-органик Егор Егорович Вагнер (1849— 1903) разработал общий способ окисления этиленовых углеводо родов разбавленным водным раствором перманганата калия КМn04. Продуктами окисления оказались гликоли — двухатом ные спирты, содержащие две группы ОН у насыщенных атомов углерода. Например, этилен С2Н4 превращается в эти ленгликоль СН2(ОН)СН2ОН, а из раствора осаждается черно-бурый осадок диоксида марганца Мn02:
ЗС2Н4 + 2КМn04 + 4Н20 = ЗСН2(ОН)СН2ОН + 2Mn02 + 2КОН.
Мировое производство этиленгликоля сейчас превышает 15 млн. т в год5.
В 10-15 мл воды растворяют 2 г йодида калия. И этому раствору прибавляют 1 г йода. После растворения йода прибавляют воду до 50 мл.
2.10. Реактив ван-Урка
К 35 мл дистиллированной воды приливают при перемешивании 65 мл концентрированной серной кислоты и еще в горячий раствор вносят 0,03 мл 10% раствора хлорида окисного железа после охлаждения раствора до 500 С добавляют 0,2 г п-диметиламинобензальдегида. Реактив употребляют не ранее чем через сутки. Годен 7 дней.
2.11. Реактив Грисса
Для получения этого реактива приготовляют 2 раствора: 1 %-й раствор сульфаниловой кислоты в 30 %-м растворе уксусной кислоты (раствор А) и 0,1 %-й раствор 1-нафтиламина в 30 %-м растворе уксусной кислоты (раствор Б). Перед употреблением смешивают равные объемы растворов А и Б. Реактив применяется для обнаружения нитритов.
Реактив Грисса - для определения нитритов. Ранее полагалось, что и нитратов, однако поздние публикации опровергают этот факт.
2.12. Реактив Драгендорфа
В 20 мл азотной кислоты растворяют 8 г основного нитрата висмута. Полученный раствор вливают в раствор, содержащий 27,2 г йодида калия в 30 мл воды. Через несколько дней жидкость фильтруют и разбавляют водой до 100 мл.
Реактив Драгендорфа - на алкалоиды.
2.13 Реактив Фелинга
Реактив Фелинга («фелингова жидкость») — это раствор сульфата меди CuS04 и тартрата калия-натрия KNa(C4H4О6) в 10%-м водном растворе гидроксида натрия NaOH. Все указанные вещества взаимо действуют следующим образом:
CuSО4 + 2NaOH=Cu(OH)2 + Na2SО4,
Cu(OH)2 + 2KNaC4H4О6=Na2[Cu(C4H4О6)2] + 2KOH.
В первой реакции образуется гидроксид меди Сu(ОН)2, который в осадок не выпадает, а тотчас же вступает в реакцию образования растворимого дитартратокупрата натрия Na2[Cu(C4H4О6)2], прида ющего жидкости синий цвет. Таким образом, реактив Фелинга содержит этот комплекс, сульфат натрия Na2SО4 и гидроксиды натрия и калия КОН. Реактив Фелинга применяют для обнаружения соединений мышьяка:
Na3AsО3 + 2Na2[Cu(C4H4О6)2] + 4NaOH= Cu2О + Na3AsО4 + 4Na2(C4H4О6) + 2H2О,
а также альдегидов, моносахаридов и др. соединений, с которыми при нагревании он образует желто-оранжевые, красные вещества или красновато-желтый осадок оксида димеди Сu20. «Фелингову жидкость», в частности, используют для диагностики диабета путем определения содержания сахара в моче больных.
Реактив был предложен немецким химиком-органиком и тех нологом Германом-Христианом Фелингом (1812—1885) в 1849 г.
2.14. Реактивы менее употребляемые
|
Реактив Дюкенуа |
2г. ванилина растворяют в 100 мл 1% спиртового раствора ацетальдегида. Реактив Дюкенуа - на тетрагидроканнобинолы. |
|
Реактив Зонненшейна |
К раствору моногидрофосфата натрия прибавляют раствор молибдата аммония в азотной кислоте. Образовавшийся осадок отфильтровывают и растворяют в небольшом объеме раствора карбоната натрия. Раствор выпаривают досуха, сухой остаток прокаливают, а затем охлаждают. К остатку прибавляют десятикратное количество воды и азотную кислоту до растворения осадка. Реактив Зонненшейна - применяется для саждения алкалоидов и их синтетических аналогов. Образуются аморфные осадки. |
|
Реактив Карно |
Смешивают 1 объем 0,5 н раствора азотнокислого висмута Bi(NO3)3*5H2O с 3 объемами 0,5 н раствора серноватистокислого натрия Na2S2O3*5H2O и добавляют 10-20 объемов этилового спирта. Применяют только свежеприготовленным. |
|
Реактив Копани-Цвиккера |
1 грамм нитрата кобальта растворяют в 100 мл этилового спирта. |
|
Реактив Либермана |
1г нитрита натрия растворяют 10 мл концентрированной серной кислоте. Реактив Либермана - на тиофен. Например, для обнаружения его в бензоле. Дает зеленую окраску, переходящую в синюю. |
|
Реактив Лукаса |
0,5 г безводного хлорида цинка при охлаждении растворяют в 0,5 моль концентрированной соляной кислоты. |
|
Реактив Майера |
К 1,35 г хлорида ртути (II) прибавляют 20 мл 25 %-го раствора хлорида калия. После растворения хлорида ртути прибавляют воду до 100 мл. Реактив Майера - на алкалоиды индольного ряда. |
|
Реактив Марки |
К 1 мл концентрированной серной кислоты прибавляют каплю формалина и охлаждают. Этот реактив используют свежеприготовленным. Реактив Марки - дает фиолетовую окраску в присутствии растительных ядов (наркотиков) группы опия - морфий, героин, кодеин. |
|
Реактив Манделина |
К 0,01 г ванадата аммония прибавляют 2 мл концентрированной серной кислоты. Реактив должен быть свежеприготовленным. |
|
Реактив Марше |
В горячем растворе, содержащем 10 г йодида калия в 30 мл воды, растворяют 5 г йодида кадмия. Полученный раствор смешивают с равным объемом насыщенного раствора йодида калия. |
|
Реактив Миллона |
Этот реактив представляет собой смесь нитратов одно- и двухвалентной ртути, которая содержит примесь азотистой кислоты. Описано несколько способов приготовления реактива Миллона: |
|
Реактив Молиша |
1) альфа - Нафтола 0,5г растворить в 95% этиловом спирте. Довести до 10 мл. |
|
Реактив Мэкье |
1 г селеновой кислоты растворяют в 100 мл концентрированной серной кислоте. |
3. Экспериментальная часть
Мы проделали химические опыты. Рассмотрим некоторые из них.
Опыт №1. Получение бертолетовой соли.
Подготовка. Собрать установку, изображенную на рис. 1. Прибор 1 и I для получения хлора соединить с промывными склянками 2 и II на подставках. Эти склянки содержат воду для очистки проходящего через них хлора. Промывные склянки 3 и III/
Рис. 1. Получение гипохлорита и хлората калия
соединенные со склянками 2 и II, содержат концентрированный раствор гидроксида калия. Склянку 3 поместить в стакан с охладительной смесью, склянку III — в стакан с водой. Оба стакана поставить на треножники. Чтобы III не лопнула при нагревании, между ее дном и дном стакана поместить прокладку из тонкой корковой пробки. Газоотводные трубки промывных склянок 3 и III присоединить через тройник 4 к стеклянной трубке, отводящей газ в кристаллизатор 5 со щелочью.
Выполнение. Нагреть воду в стакане со склянкой III до 70—80° С. Через обе склянки со щелочью пропустить ток хлора, получающегося в колбах 1 и I. Проходя через охлаждаемый раствор едкого кали, хлор образует с ним гипохлорит калия КСlO3. Поступая же в горячий раствор едкого кали, хлор образует там хлорат калия КСlO3 (бертолетову соль), который при охлаждении раствора выпадает в осадок:
С12+2КOН=2КС1+КСlO4 + Н2O (на холоду)
ЗС12+6КОН=5КС1+КСlО3+ЗН2О (при нагревании)
Бертолетова соль
Опыт №2. Получение ортофосфорной кислоты окислением фосфора
азотной кислотой (реакция Маргграфа).
Оборудование и материалы. 1. Фарфоровая чашка. 2. Треножник с асбестированной сеткой. 3. Горелка, 4. Стеклянная палочка. 5. Красный фос фор. 6. Азотная кислота (5н.).
Выполнение. Под тягой в чашку поместить 0,5 а красного фосфора, прибавить 10—15 мл азотной кислоты и нагреть на не большом пламени, непрерывно помешивая. По мере испарения азот ной кислоты прибавлять ее небольшими порциями до растворения фосфора. По прибавлении последней порции кислоты продолжать нагревать на небольшом пламени, пока не прекратится выделение бурых паров диоксида азота:
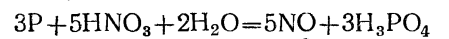
Опыт №3. Взаимодействие галогенидов с хлорной водой
Хлор вытесняет бром и иод из их соединений. Проверим это. Приготовим пробирки с растворами иодида калия, хлорида натрия, бромида натрия. В каждую из пробирок добавляем равный объем хлорной воды. В пробирке с иодидом калия выделился иод,
2KI + Cl2 = I2 + 2KCl
в пробирке с бромидом натрия – бром.
2NaBr + Cl2 = Br2 + 2NaCl
Мы убедились в том, что хлор вытесняет иод и бром из их солей. В пробирке с хлоридом натрия, конечно, никаких изменений не произошло. Иод и бром в промышленности получают действием хлора на иодиды и бромиды.
Опыт №4. Взаимодействие брома с алюминием
Бром в обычных условиях - тяжелая красно-бурая жидкость. Бром - единственный жидкий неметалл. Бром ядовит, имеет резкий, неприятный, удушливый запах. Бром по свойствам сходен с хлором, но менее активен. легко испаряется, образуя бурые пары. В круглодонную колбу нальем немного брома. Опустим в колбу кусочек алюминиевой фольги. Закроем колбу пробкой с хлоркальциевой трубкой, в которую насыпан активированный уголь. Уголь служит для поглощения паров брома. Через некоторое время алюминий раскаляется и энергично сгорает с образованием бромида алюминия.
2AI + 3 Br2 = 2 AIBr3
Оборудование: колба круглодонная, хлоркальциевая трубка с адсорбентом ( активированный уголь), пробка, штатив.
Опыт №5. Взаимодействие хлора с медью
Даже малоактивные металлы энергично взаимодействуют с хлором. Нагреем пучок медной проволоки в пламени горелки и внесем ее в цилиндр, наполненный хлором. Медь раскаляется, взаимодействует с хлором, с кончика проволоки на дно цилиндра начинает капать расплавленный хлорид меди (II):
Сu + CI2 = CuCI2
Оборудование: цилиндр, тигельные щипцы, керамическая или стеклянная пластинка, горелка.
Выводы
Разумеется, этим перечнем не исчерпываются все именные реакции. Мы не охарактеризовали еще многие другие реакции, которые подробно изучают уже в высшей школе.
Даже простой перечень рассмотренных нами именных реакций свидетельствует о том, что обычный школьник знает не так уж и мало из курса неорганической химии. Еще раз с удовольствием отмечаем, что из тех химических реакций, которые изучаются в базовом курсе основной и средней школы, значительное число реакций впервые осуществлено российскими химиками – нашими соотечественниками.
1. В данной курсовой работе, мы рассмотрели наиболее известные именные реакции.
2. Познакомились именными реактивами в неорганической химии.
3. Провели несколько опытов и наглядно посмотрели, как протекают именные реакции.
Список литературы
- Ахметов Н.С. Общая и неорганическая химия. - М.:Высшая школа, 2001
- Жамбулова М. Ш. Развитие неорганической химии (Историко-методологический аспект). Алма-Ата, 1981.- 187 с.
- Популярная библиотека химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова — М.: Наука, 1983. — 575 с., — 572 с.
- Реми Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. — 775 с
- Степин Б. Д., Аликберова Л. Ю. Книга по химии для домашнего чтения. М., Химия, 1994 на стр. 316.
- Шрайвер Э. Неорганическая химия. Т. 1,2. / Э. Шрайвер, П. Эткинс — М.: Мир, 2004. — 679 с., — 486 с.
1 Ахметов Н.С. Общая и неорганическая химия. - М.:Высшая школа, 2001
2 Реми Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. — 775 с
3 Степин Б. Д., Аликберова Л. Ю. Книга по химии для домашнего чтения. М., Химия, 1994 на стр. 316.
4 Шрайвер Э. Неорганическая химия. Т. 1,2. / Э. Шрайвер, П. Эткинс — М.: Мир, 2004. — 679 с., — 486 с.
5 Популярная библиотека химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова — М.: Наука, 1983. — 575 с., — 572 с.
Именные реакции и реактивы в неорганической химии