Рассмотрение мембранных (ионоселективных) электродов с различного рода мембранами
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ 3
- Теория мембранных потенциалов 4
- Кинетика процесса переноса заряда через границу раздела между двумя электролитами 5
- Селективность мембран 7
- Электроды с жидкой мембраной 10
- На основе жидких катионитов 11
- На основе жидких анионитов 12
- Электроды с твердыми мембранами 14
- Газовые электроды 17
- Области применения 19
ЗАКЛЮЧЕНИЕ 21
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ 22
ВВЕДЕНИЕ
Для определения состава и свойств различных соединений и растворов используются различные физико-химические методы анализа. В большинстве случаев нужно определить концентрацию различных ионов в растворе. Для этого существуют разнообразные ионоселективные электроды, главной особенностью которых является так называемая селективность к определенному виду ионов.
Целью данной работы является рассмотрение мембранных (ионоселективных) электродов с различного рода мембранами. Для достижения данной цели перед нами возникает ряд задач: изучить разнообразие, принцип действия, область применения данных электродов.
- Теория мембранных потенциалов
Мембрана (от лат. Membrana – пергамент) – эластичная двухмерная пластина, как принято называть в физике. В химии же под этим термином подразумевают материал, в виде тонкого слоя, играющий роль фазы, которая делит между собой другие объемные фазы. Если этот слой проницаем одинаково для всех компонентов фаз, примыкающих к нему, то его назначением является предотвращение быстрого смешивания фаз. Такая мембрана носит название диафрагмы. Мембрана должна иметь определенную селективность к пропусканию различных компонентов, основанную на ее различной проницаемости. Это так называемая полупроницаемая мембрана. Мембраны, которые разделяют два электролита, и являются непроницаемыми в одинаковой степени для всех ионов, называются электрохимическими мембранами. Именно такие мембраны мы будем рассматривать в данной работе. [1]
По агрегатному состоянию применяемые в электродах мембраны могут быть твердыми, стеклообразными, жидкими и газообразными. Для эффективного разделения верхних фаз, которыми чаще всего бывают растворы, необходимо, чтобы мембраны были непористыми и нерастворимыми в воде. Нужную механическую устойчивость можно придать с помощью связующих материалов. Основными частями мембранных ионоселективных электродов являются относительно толстые, электронейтральные мембраны.
Существует связь между селективностью по проницаемости и потенциометрической ионной селективностью мембраны. Так как процесс проникновения компонентов включает распределение на границах «мембрана - раствор» и перемещение внутри мембраны, ионную селективность часто выражают при помощи параметров ионной экстракции и коэффициентов диффузии или подвижностей. [2]
Вполне исчерпывающее обсуждение мембранных явлений было дано Лакшминараянайахом [3]. Он рассмотрел 16 основных соотношений между главными факторами, вызывающими так называемы мембранный транспорт, и потоками вещества, заряда и объема.
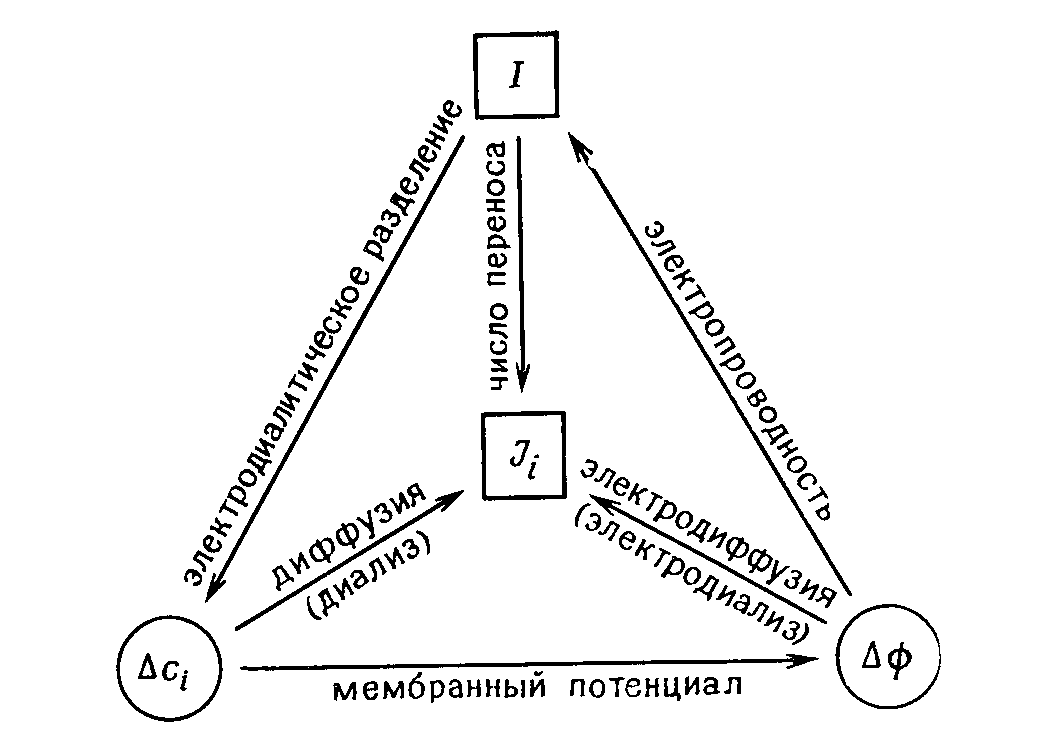
Рисунок 1.1 Схематическое изображение изотермических транспортных свойств непористых мембран при постоянном давлении [4]
- Кинетика процесса переноса заряда через границу раздела между двумя электролитами
Рассмотрим пример двух несмешивающихся растворов электролитов, к границе раздела которых приложена разность потенциалов V от внешнего источника напряжения, отличающаяся от равновесной разности потенциалов . Тогда в этой системе возникает электрический ток, который в самом элементарном случае соответствует переносу через границу раздела фаз одного вида ионов. Предположим, что система состоит из фонового электролита l, концентрации которого в фазах и составляют с () и с () соответственно, и однозарядного иона i, соответствующие концентрации которого сl() и сl() гораздо меньше, чем с () и с (). Скорость межфазного переноса этого иона под действием неравновесной разности потенциалов V равна по величине парциальной плотности тока jl, описываемой уравнением
(1.1.1)
где имеет значение +1 или -1, константа скорости гетерогенного переноса и концентрация иона в непосредственной близости от границы раздела фаз. Запишем теперь выражение для отношения констант скорости
(1.1.2)
Подставляя (2) в (1), получаем
(1.1.3)
Концентрации соответствуют концентрациям переносимого иона на сторонах, прилегающих к поверхности раздела фаз, и являются функциями разностей потенциалов в диффузных двойных слоях в соответствии с равновесным распределением Больцмана
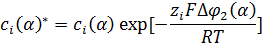
(1.1.4)
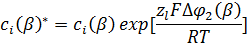
Более того, константа kl связана со стандартной свободной энергией переноса, а через нее с разностью стандартных потенциалов в соответствии с соотношением Бренстеда
(1.1.5)
где и стандартна константа скорости переноса иона I между фазами и .
Константа скорости (с размерностью см/с) определяется как произведение частотного фактора P и энергии пересольватации Er , идущей на замену сольватного оболочки одного растворителя на оболочку другого.
(1.1.6)
Частотный фактор можно представить как отношение расстояния между двумя точками переноса к времени, затрачиваемому на этот перенос. Расстояние это будет равняться сумме диаметров молекул растворителей в фазах и (). Согласно уравнению ЭйнштейнаСмолуховского, перенос частицы в произвольном направлении (x) следующим образом:
(1.1.7)
где D – средний коэффициент диффузии частицы, в первом приближении равный среднему геометрическому коэффициентов диффузии в каждой фазе .
Для отношения среднего расстояния переноса к соответствующему времени записываем
) (1.1.8)
Поскольку данная частица проходит расстояние за время в произвольном направлении, ее сдвиг в направлении, перпендикулярном границе раздела фаз, выражается как . Тогда для константы скорости переноса заряда окончательно имеем
(1.1.9)
Теоретического подхода для расчета энергии пересольватации до сих пор не разработано. [1]
- Селективность мембран
Главной частью гальванических элементов, которые применяются в работе с мембранными электродами, является система, состоящая из полунепроницаемой мембраны, которая делит два раствора электролита разной концентрации между собой :
Рисунок 1.2.1. Схема мембраны [2]
Мембраны, которые обычно применяется в ионометрии, должны быть проницаемы, во-первых, для ионов только одного знака и, во-вторых, для определенного сорта ионов в присутствии других ионов того же знака заряда.
Между растворами электролитов, разделенными мембраной, возникает разность потенциалов, или мембранный потенциал , который алгебраически складывается из двух фазовых граничных потенциалов 1 и 2 и диффузионного диф внутри мембраны:
(1.2.1)
Под граничными потенциалами 1 и 2 нужно понимать разность между потенциалами мембраны и раствора: *.
В общем случае следует допустить возможность диффузии электролита через мембрану. Поэтому за счет различия в подвижностях катиона и аниона и наличия градиента электрохимического потенциала внутри мембраны возникает диффузионный потенциал.
В работах Шульца и Стефановой [5] для объяснения селективных свойств ионитовых мембран привлечены различные возможные механизмы переноа ионов в мембране: сольватационный, вакансионный, направленно диссоциационный. При сольватационном механизме электричество через мембрану переносят свободные ионы. При вакансионном механизме противоионы находятся в недиссоциированном состоянии. При направленно диссоциационном механизме из недиссоциированных групп ионы переходят в соседний слой не только по вакансиям, но и в междоузлия (с последующим связыванием ионов в этом слое). Такой механизм переноса должен обеспечивать высокую селективность ионообменной мембраны.
Для создания высокоселективных электродных систем важно, чтобы ионит или лиганд, введенные в мембрану и избирательно сорбирующие данный ион, обеспечивали такой механизм переноса заряда, при котором в электродном поведении мембраны в полной мере проявились бы селективные свойства мембрано-активных веществ.
- Электроды с жидкой и пленочной мембраной
Жидкие мембраны это растворы в органических растворителях ионообменных веществ (жидкие катиониты или аниониты) или нейтральных хелатов, отделенные от водных растворов нейтральными пористыми перегородками (полимерными, стеклянными или др.). Иногда перегородки отсутствуют, а растворы просто наслаиваются друг на друга. Поры нейтральной перегородки заполняют органическим или водным раствором, что дает электролитический контакт между фазами. Такая мембрана обычно остается долгое время достаточно стабильной.
В электродах с жидкими мембранами к мембранному веществу предъявляется одно требование, так как если какой-либо ион способен вообще существовать в фазе мембраны, то он в ней будет двигаться по закону диффузии, и поэтому проблема обеспечения подвижности интересующего иона в мембране сама собой разрешается. Селективность жидких мембран будет определяться ограничением внедрения посторонних ионов в поверхность мембраны. Так как жидкая фаза находится в контакте с водными растворами, она должна быть нерастворимой в воде и иметь низкое давление паров, чтобы избежать интенсивного ее испарения. Эти требованиям могут отвечать жидкие органические вещества, обладающие сравнительно большим молекулярным весом и низкими диэлектрическими проницаемостями.
Их основным недостатком является постепенное вымывание анализируемым раствором ионообменника, что сокращает срок работы электрода.
Этих трудностей удалось избежать после разработки электродов с пленочными мембранами. В таких электродах в тонкую мембрану из гидрофобного полимера (поливинилхлорида) вводят пластификатор и растворенное в нем электродно-активное вещество, вступающее в ионообменную реакцию с анализируемым ионом в растворе. В настоящее время промышленность выпускает пленочные ионоселективные электроды на катионы Na+, К+, NH4+, Са2+, Mg2+; электроды для определения общей жестокости воды; на анионы галогенидов, NCS–, NО3–. Существуют электроды и на другие ионы.
В зависимости от типа электродно-активного вещества различают катионные, анионные и нейтральные (хелатные) жидкие мембраны.
- На основе жидких катионитов
Электродно-активными веществами, которые определяют катионную функцию мембранных жидкостных электродов, являются органичсекие высокомолекулярные кислоты и их соли с карбоксильной, сульфо-, фосфорно- и тиофосфорнокислыми группами. Довольно подробно изучены электроды на основе динонилнафталинсульфокислоты, монодиоктилфенилфосфорной, дидецилфосфорной, ди(2-этилгексил)фосфорной, тиофосфорных, монокарбоновых и тиокарбоновых кислот.
Системы с динонилнафталинсульфокислотой чувствительны ко многим катионам (Ca2+, Ni2+,Cr2+,La3+,Th4+), но нернстовская зависимость потенциала от концентрации получена только для высокозарядных катионов (трех- и выше). Для двузарядных катионов угловой коэффициент * составляет при 20°С 16-18 мВ (вместо теоретических 29). Интервал линейной зависимости ЭДС элемента с мембраной от –lg aMz+ �существенно шире для трехзарядных катионов (0,2-10-4 М) по сравнению с двузарядными Ca2+ (100 - 2·10-2 M).
Рассмотрим наиболее интересные примеры жидких мембранных электродов с функциями одно- и двузарядных катионов.
Кальций-селективный электрод. Наиболее широко исследованы Ca2+-электроды на основе кальциевых солей диэфиров фосфорной кислоты. С жидкостным Ca2+-электродом определяют коэффициент активности в нейтральных и щелочных средах. Стоит обратить внимание на применение для селективного Ca2+-электрода мембраны с поливинилхлоридной матрицей, содержащей теноилтрифторацетон (R1H) (ионообменник – лиганд) и трибутилфосфат (R2) или тригексилфосфат (растворитель). Обмен можно описать реакцией:
2.1.1
Матеровой было подробно изучены свойства подобного электрода с массовым соотношением: ПВХ : трибутилфосфат : теноилтрифторацетон = 1 : 3 : 1. [6]
Область применения таких электродов весьма обширная:
- определение коэффициентов активности иона Ca2+;
- исследование ассоциации MgSO4 и CaSO4 в морской воде;
- комплексонометрическое титрование;
- определение жестокости воды и т.д.
Также существуют различные мембранные ионоселективные электроды на основе жидких катионитов, таких как:
- Электрод, селективный по отношению к сумме катионов кальция и магния. Его практическое значение велико, из-за отсутствия селективного электрода на ионы Mg2+. Такой электрод применяют при анализе природных вод и изучении процессов образования накипи.
- Цинк-, медь-, свинец-, кадмий-, сурьма- и таллий-селективные электроды.
- На основе жидких анионитов
В отличие от катионоселективных электродов, для которых наиболее перспективны мембрано-активные вещества, являющиеся нейтральными и заряженными лигандами, почти все анионоселективные электроды получены на основе солей аминов и четвертичных аммониевых оснований, являющихся типичными жидкими анионообменниками. Можно считать, что для жидких ионитов на основе солей четвертичных аммониевых оснований существует такой ряд анионов в порядке уменьшения их электродной и ионообменной селективности:
Существуют различные мембранные ионоселективные электроды на основе жидких аниоионитов, таких как:
- Галоген-селективные электроды
- Нитрат-селективный электрод. Данный электрод имеет высокое практическое значение в биологии, почвоведении, сельском хозяйстве, промышленности. Применим в изучении комплексообразования; определение нитратов в пищевых продуктах; исследование удобрений.
- Перхлорат-селективный электрод
- Тетрафторборат-селективный электрод
- Роданид (тиоцианат)-селективный электрод
- Фосфат-селективный электрод
- Карбонат- и бикарбонат-селективный электрод
- Электроды, селективные к органическим анионам [7]
- Электроды с твердыми мембранами
Мембраны данного вида электродов представляют собой моно- или поликристаллы трудно растворимых в воде солей. В этих мембранах обычно один из двух составляющих ионов способен под действием электрического поля перемещаться в кристаллической решетке по ее дефектам. Примерами могут служить мембраны из солей галогенидов серебра, которые обладают ионной проводимостью, осуществляемой ионами серебра. Поведение этих мембран, в простейших случаях, идентично поведению соответствующих электродов второго рода (хлорсеребряного и каломельного). Тонкая пластинка из монокристалла, например, хлорида серебра, может быть мембраной электрода, обратимой по отношению к иону Cl-, который закреплен в кристаллической решетке. В то же время такой электрод обладает и катионной Ag+-функцией за счет постоянства произведения растворимости ПРAgCl.
Кристаллические мембраны отличаются очень высокой селективностью, превышающей селективность жидкостных электродов на несколько порядков. Это связано с тем, что селективность у твердых кристаллических мембранных электродов достигается за счет вакансионного механизма переноса заряда, при котором вакансии заполняются только определенным подвижным ионом (Ag+), так как форма, размер, распределение заряда вакансии соответствуют только определенному подвижному иону. К электродам с твердой мембраной относятся: лантанфторидный электрод (мембрана на основе монокристалла LаF3), сульфидсеребряные электроды, галогенсеребряные электроды, электроды на основе сульфидов (халькогенидов) некоторых двузарядных ионов металлов, стеклянные электроды.
Наибольшее распространение получил стеклянный электрод.
Стеклянный электрод. С помощью данного вида электродов определяют рН растворов. Их изготавливают из специального электродного стекла, в состав которого входят оксиды алюминия, натрия, калия, бора и др. Мембрана таких электродов представляет собой тонкостенный шарик (~0,1 мм) диаметром 5 – 8 мм.
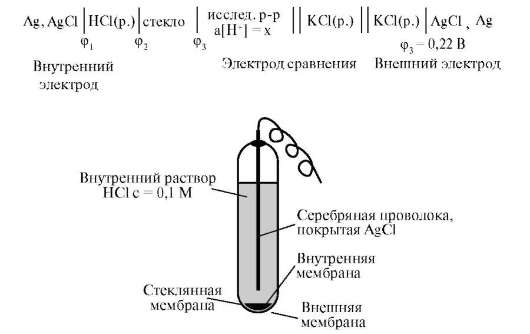
Рисунок 3.1 Устройство стеклянного электрода
Существуют стеклянные электроды, которые позволяют определить концентрацию ионов Na+, K+. В основе теории стеклянного электрода лежит представление о том, что стекло - это ионообменник, который может вступать в ионообменное взаимодействие с раствором. Стекло при этом рассматривается как твердый электролит. Стекло, состоящее из окислов натрия, кальция, кремния, обладает резко выраженным специфическим сродством к ионам Н+. Вследствие этого при соприкосновении с водными растворами в поверхностном слое стекол образуется слой, в котором ионы Na+ оказываются почти полностью замещенными на ионы Н+. Поэтому мембранный электрод, изготовленный из такого стекла, обладает Н+-функцией.
Введение в состав стекла окислов бария, цезия, лантана и замена натрия на литий значительно расширяет диапазон Н+-функции стеклянного электрода. Введение же окислов алюминия и бора значительно снижают Н+-функции стеклянного электрода. Таким путем удалось создать ионоселективные стеклянные электроды для ионов Na+, K+, Li+, Ag+.
Продолжительность функционирования стеклянного электрода определяется рядом факторов: состав стекла, толщина рН-чувствительного поверхностного слоя мембраны, температура и состав раствора, в котором электрод используется. Разрушение стекла водными растворами происходит в результате сорбции воды стеклом и глубокое ее проникновение в толщу. Коррозионному действию щелочных растворов, образующихся при экстракции щелочных компонентов стекла, подвергается и горловое стекло. Кремнекислородная сетка испытывает воздействие с обеих сторон мембраны. В конце концов, развиваются трещины, приводящие к нарушению функции электрода. Для защиты электрода от разрушения необходимо хранить его в воде, так как в воде происходит выщелачивание связанных ионными силами основных компонентов стекла и замена их ионами водорода, в результате чего на поверхности стекла образуется слой гидролизованного кремнезема, предохраняющий стекло от дальнейшего разрушения.
- Газовые электроды
Особое место в потенциометрических методах анализа отведено газовым (газочувствительным) электродам. Главное отличие от ионоселективных – использование промежуточной реакции, в результате чего из молекул определяемых веществ образуются ионы, концентрация которых измеряется соответствующим ионоселективным электродом. [6]
Газовый электрод включает ионоселективный и сравнительный электроды, контактирующие с небольшим объемом вспомогательного раствора, который отделен от исследуемого раствора газовой прослойкой или гидрофобной газопроницаемой мембраной. В основе действия газовых электродов лежат реакции с участием газов, например:
4.1
4.2
4.3
4.4
4.5
4.6
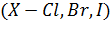
Газ адсорбируется на химически инертном электроде, что способствует передаче электронов через границу раздела. Как правило, используют платину, которая еще и катализирует реакцию.
Электродный потенциал зависит от давления газа и активности ионов в растворе. Так, для хлорного электрода
4.1
и в комбинации с водородным электродом получаем элемент , в котором при прохождении 1 фарадея электричества осуществляется реакция
, 4.2
приводящая к образованию 1 грамм-молекулы HCl; при этом .
- Области применения
Ионоселективные электроды применяют не только в химической промышленности, но и в медицине. Обладая рядом достоинств, электроды не лишены недостатков. Так некоторые электроды не могут быть использованы в присутствии определенного сорта ионов (например, перхлорат-селективный электрод не может обнаруживать ClO4- в присутствии следующих ионов: MnO4- IO4-, ReO4-, SCN-). Главным достоинством ионоселективных электродов является то, что они не оказывают влияния на исследуемый раствор. Большое значение приобретают ионоселектнвные электроды в медицине и биологии. С их помощью стало возможным следить за изменением ионного состава биологических жидкостей в динамике процессов, а также получать информацию о внутриклеточном изменении концентрации (активности) ионов Na+, К+, Са2+. и др.
Ионоселективные электроды находят применение в химическом анализе для изучения комплексообразования, ассоциации ионов; в качестве детекторов при анализе в проточных системах, что особенно важно для автоматизации контроля производственных процессов.
ЗАКЛЮЧЕНИЕ
Мембрана основной компонент любого ИСЭ. Она делит между собой внутренний раствор с постоянной концентрацией определяемого иона и исследуемый раствор. Также мембрана служит средством электролитического контакта между ними. Она обладает ионообменными свойствами, причем проницаемость ее к ионам разного типа различна – это называется селективностью. Таким образом, ИСЭ - это аналитические устройства, которые позволяют с помощью ионоселективной мембраны узнавать конкретный тип ионов и давать информацию об их количестве в виде электрического сигнала - потенциала, который связан с активностью (концентрацией) определяемого иона в анализируемом растворе.
В данной работе мы рассмотрели множество различных мембранных (ионоселективных) электродов, их принцип действия и области применения. Существуют и еще более сложные электроды, которые созданы на основе выше описанных. Область изучения и применения мембранных электродов безгранична, и всегда будет актуальной для науки, промышленности и медицины.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ
- Корыта И., Штулик К. Ионоселективные электроды: Пер. с чешск. Москва: Мир, 1989. – 272 с.
- Камман, К. Работа с ионселективными электродами. Москва: Мир, 1980. – 285 с.
- Лакшминараянайах Н. Мембранные электроды: Пер./Под ред. канд. хим. наук А.А. Белюстина. - Л.: Химия, 1979. - 260 с., ил. - Нью-Йорк. Академик Пресс, 1976.
- Морф В. Принципы работы ионоселективных электродов и мембранный транспорт: Пер. с англ. – М.: Мир, 1985. – 280с.. ил.
- Никольский Б. П., Матерова Е. А. Ионоселективные электроды. – Л.: Химия, 1980. – 240 с.. ил
- Аналитическая химия и физико-химические методы анализа. В 2 томах. Том 2; Academia - Москва, 2012. - 416 c.
- Васильев В. П. Аналитическая химия. В 2 книгах. Книга 2. Физико-химические методы анализа; Дрофа - Москва, 2007. - 383 c.
- Справочное руководство по применение ионоселективных электродов: Пер. с англ./ Под ред. Д-ра хим. Наук, проф. О.М. Петрухина – М.: Мир, 1986. – 231 с., ил.
Рассмотрение мембранных (ионоселективных) электродов с различного рода мембранами