Преобразование энергии в клетке.
Преобразование энергии в клетке.
Общие вопросы и электронный транспорт
Общая схема биоэнергетических процессов
Первоначальным источником энергии для живых организмов служит энергия солнечного света, за счет которой растения и фотосинтезирующие микроорганизмы синтезируют сложные органические вещества (жиры, белки, углеводы и др.). Животные используют химическую энергию, выделяющуюся при окислении органических веществ, синтезированных растениями (Рис.1).
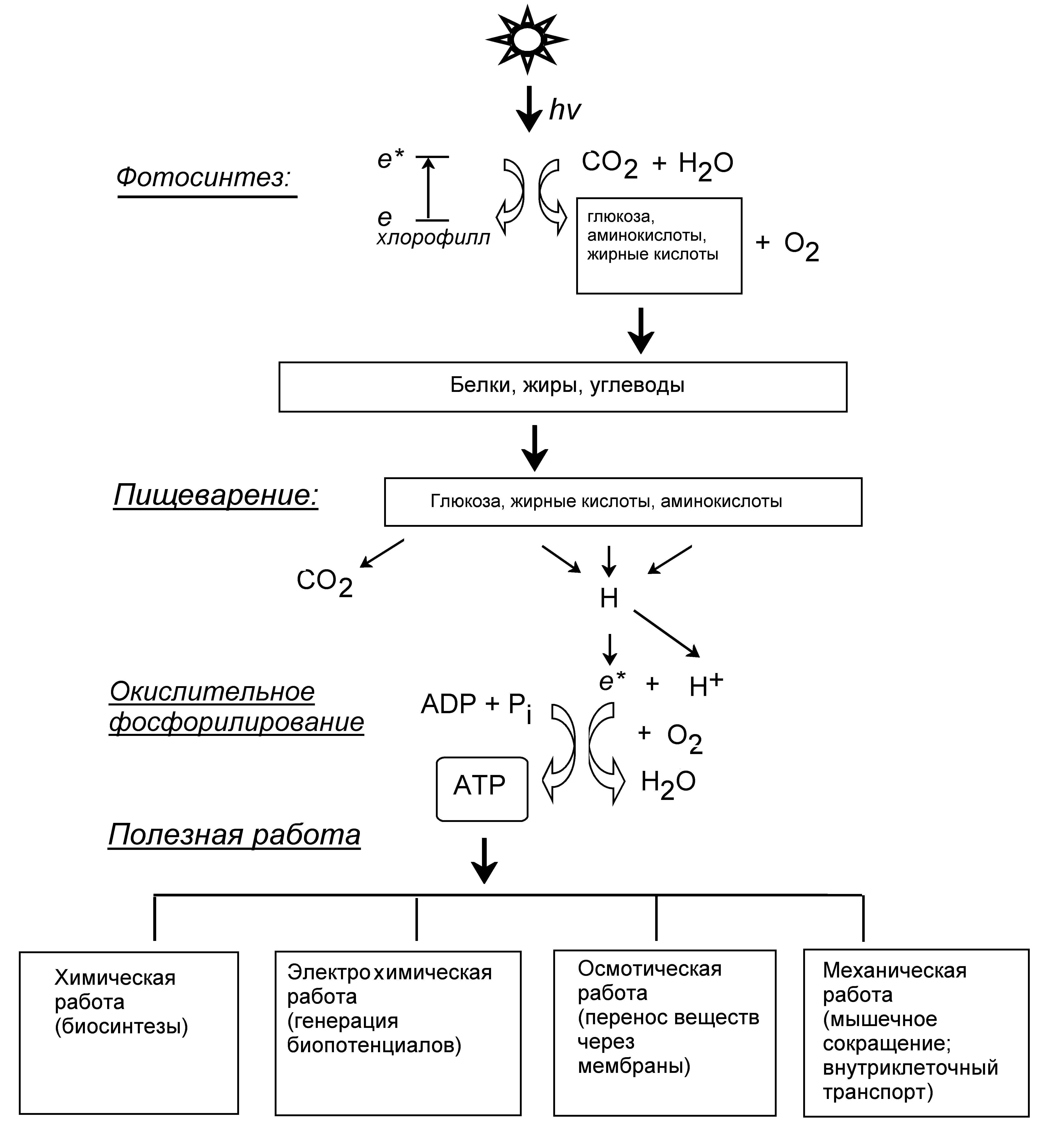
Рисунок 1 - Общая схема преобразования энергии в биосистемах. Pi – неорганический фосфат, НРО42; е* - возбужденный электрон
Свободная энергия биохимических реакций
Только часть внутренней энергии системы может использоваться для выполнения полезной работы. Она называется свободной энергией. Остальная энергия рассеивается в виде тепла. Для характеристики свободной энергии используется термодинамический потенциал Гиббса:
G = H – TS = U + PV – TS ,
где H = U + PV – энтальпия, U – внутренняя энергия, P – давление, V – объем системы, T – температура, S – энтропия. Величина TS - диссипирующая часть внутренней энергии, необратимо рассеивающаяся в среде. Изменение G:
.
В биологических процессах, проходящих при постоянных температурах и давлениях с незначительным изменением объема (если не выделяются газы):
,
где F - свободная энергии Гельмгольца: F =U – TS .
Критерием вероятности самопроизвольного превращения в системе является изменение свободной энергии: система переходит в равновесное состояние с наименьшей свободной энергией, когда или .
Для растворенного вещества Х с концентрацией [X] величину G можно представить как сумму членов, зависящего и не зависящего от концентрации:
G = Go + RT ln[X],
где R – универсальная газовая постоянная, а Go - стандартный термодинамический потенциал, характеризующий данное вещество. Он определяется в стандартных условиях: [X] = 1 моль/л; T = 25 oC. В состоянии равновесия, когда G = 0:
Go = - RT ln[X].
Если взаимодействуют x молекул вещества X, то:
Go = -xRT ln[X].
Рассмотрим химическую реакцию:
,
где a, b, c и d – стехиометрические коэффициенты или количества молекул каждого вида, участвующих в элементарной реакции. Константа равновесия К:
,
а термодинамический потенциал:
где [A], [B]… - равновесные концентрации. Стандартные свободные энергии химических реакций можно вычислить из табличных значений стандартных свободных энергий субстратов и продуктов реакции:
или определить аналитически, измерив равновесные концентрации и рассчитав К. Так как в равновесии: , то .
Окислительно-восстановительные потенциалы
Основная часть свободной энергии заключенной в органических молекулах, составляющих продукты питания, выделяется на заключительных этапах биологического окисления, когда электроны ступенчато переносятся на кислород по цепи из нескольких молекул-переносчиков электронов. Процессы переноса электронов называются окислительно-восстановительными. Молекула, отдавшая электрон оказывается в окисленном состоянии, а принявшая электрон – в восстановленном. Соответственно, процесс отдачи электрона называют окислением, а принятия - восстановлением данного вещества. Доноры электронов – восстановители, а акцепторы электронов – окислители, так как они восстанавливают или окисляют данное вещество. Они всегда функционируют как сопряженные окислительно-восстановительные или редокс-пары (от английского reduction – восстановление и oxidation – окисление). Так, в реакции:
Fe2+ e + Fe3+
Fe2+ является донором электронов, т.е. восстановителем, а Fe3+ - акцептором электронов, т.е. окислителем. Вместе они представляют собой редокс-пару.
Для характеристики окислительно-восстановительных реакций используют понятие стандартного окислительно-восстановительного потенциала , являющегося мерой электрон-движущей силы (э.д.с.). Его определяют в стандартных условиях (концентрации веществ 1 М, 25 оС, рН 7,0) относительно стандартного полуэлемента с известной э.д.с. В качестве такого стандарта берут водородный полуэлемент, в котором происходит реакция:
Н2 2 Н+ + 2 е
Для ее осуществления в воду опускают платиновую пластинку, омываемую потоком газообразного водорода Н2 при 25 оС, давлении 1 атм и концентрации Н+, равной 1,0 М (это соответствует рН=0). Потенциал такого полуэлемента, называемого водородным электродом, принимают равным нулю. Он называется полуэлементом, т.к. эта реакция может быть сопряжена с другой окислительно-восстановительной реакцией, также образующей полуэлемент, в котором происходит другая окислительно-восстановительная реакция, например,
Fe2+ e + Fe3+.
Если соединить проводником (солевым мостиком) водородный и исследуемый полуэлементы, то между ними пойдет ток электронов (рис.2), и в равновесии установится некоторая разность потенциалов . Она может быть положительной или отрицательной в зависимости от направления тока, т.е. в зависимости от сродства данного вещества к электронам по сравнению с Н2.
Например, сильный окислитель О2 имеет положительный окислительно-восстановительный потенциал, а сильный восстановитель NADH – отрицательный. Зная величину , можно найти соответствующую величину стандартной свободной энергии по формуле:
,
где n - число переносимых электронов, а F=96500 Дж/(моль*В) – число Фарадея.
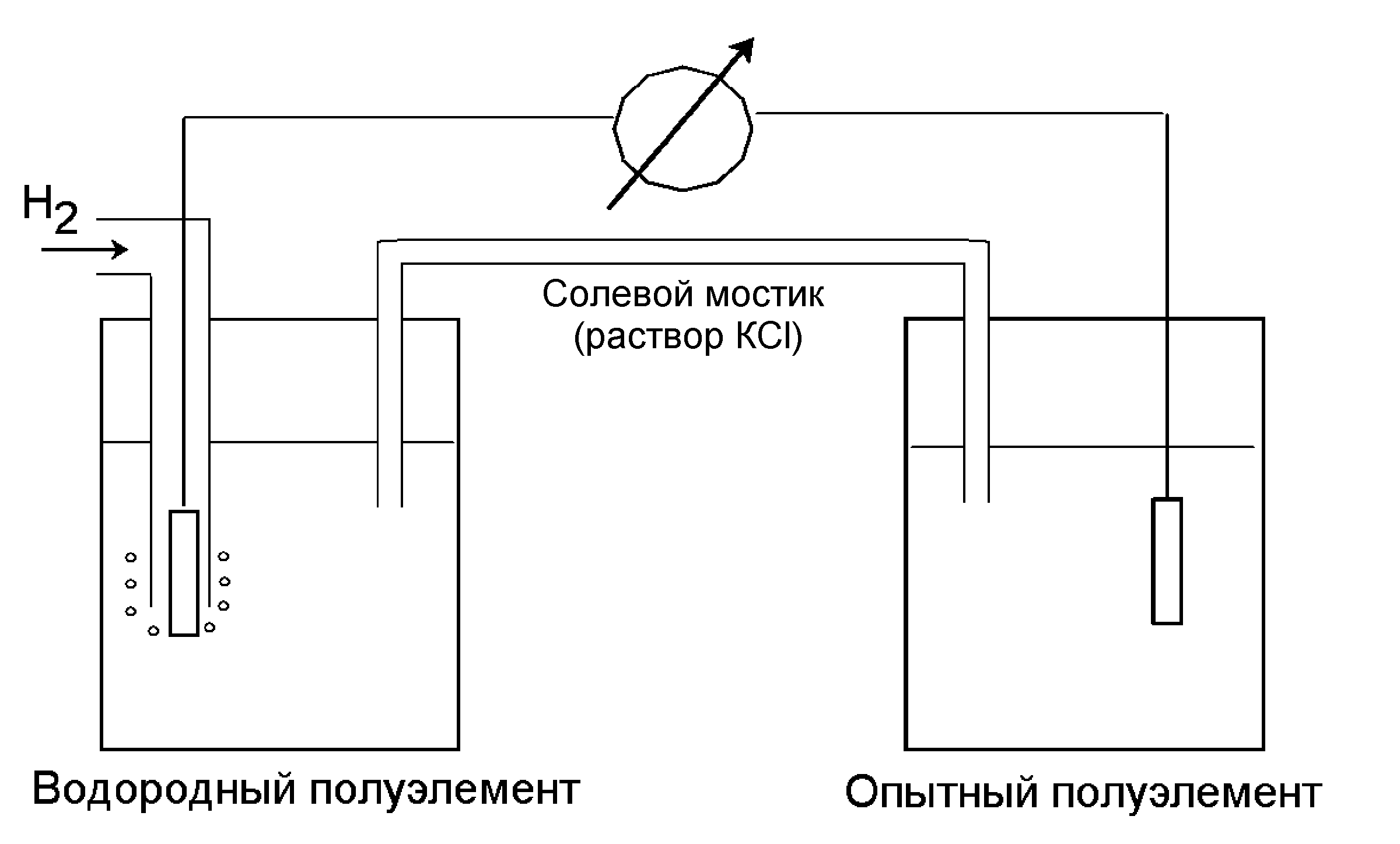
Рисунок 2 - Измерение стандартного окислительно-восстановительного потенциала
Аденозинтрифосфат (ATP)
Аденозинтрифосфат (АТР) - адениновый рибонуклеотид с цепочкой из трех фосфатных групп (рис.3) - является универсальным аккумулятором энергии и элементарной «энергетической единицей» в клетках. Впервые ATP был выделен из мышечной ткани К. Леманом, С. Фиске и Й. Субарроу в 1929 году. В 1931 году В.А. Энгельгардт установил связь между клеточным дыханием, т. е. поглощением кислорода клетками, и фосфорилированием аденозиндифосфата (ADP) или, иначе говоря, синтезом ATP в результате присоединения к ADP еще одной фосфатной группы –РО32 (неорганический фосфат, Pi). Этот процесс назван окислительным фосфорилированием. Ф. Липман предположил (1941), что ATP – главный и универсальный переносчик энергии в клетках.
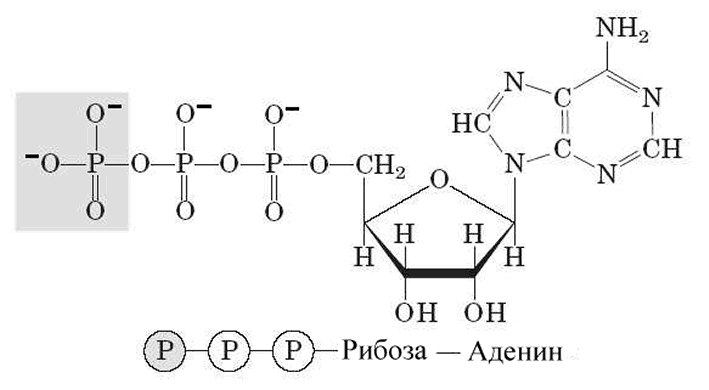
Рисунок 3 - Аденозинтрифосфат (ATP)
При рН=7,0 ATP4 и ADP3 являются анионами с высокими отрицательными зарядами. Точнее, заряд ATP оценивается в -3,8 за счет небольшого положительного заряда азота в аденине: . В живых клетках только небольшая часть ATP и ADP присутствует в виде свободных анионов, а основная часть образует комплексы с магнием: Mg2+ATP4 и Mg2+ADP3.
ATP относится к макроэргическим соединениям, содержащим «богатую энергией» связь между фосфатными группами (обычно обозначаемую: ~ ). Это, однако, не значит, что сама энергия очень большая. Связь между О и Р – это обычная ковалентная связь с энергией порядка 100 ккал/моль. Такая энергия может выделиться при полном разрыве связи и разнесении ADP2 и РО32 на бесконечное расстояние:
O O O
I I I
Аденозин ОРО~Р + PO
II II II
O O O
Полностью ее использовать невозможно. Смысл термина «макроэргическая связь» в том, что при переносе концевой фосфатной группы на какую-нибудь молекулу выделяется большая энергия, чем при переносе других групп. Обычно за стандартный акцептор принимают воду и говорят о свободной энергии гидролиза ATP:
ATP4 + Н2О + Н+ ADP3 + Pi2
или:
O O O O O O
I I I I I I
Аденозин ОРО~РO~PO + HOH + H + Аденозин ОРО~Р O + HO-P-O
II II II II II II
O O O O O O
ATP Вода ADP Pi
В стандартных условиях, т. е. при 25С, рН = 7,0, избытке Mg2+ и концентрациях исходных веществ и продуктов этих реакций 1 моль/л:
ккал/моль.
Так как в живых клетках концентрации ATP, ADP и фосфатов отличаются от стандартной (1,0 моль/л) и обычно равны нескольким ммоль/л, то:
~ 12,5 ккал/моль.
Эта величина не является константой, а зависит от конкретных условий. Основной причиной сравнительно большой величины является электростатическое отталкивание отрицательных зарядов в молекуле ATP4. Благодаря ему молекула ATP4 находится в напряженном состоянии. При гидролизе ATP4 происходит разделение зарядов в связи РО и получаются продукты с большим суммарным отрицательным зарядом: ADP3 и НРО42 , что увеличивает электростатическое отталкивание между ними и препятствует их
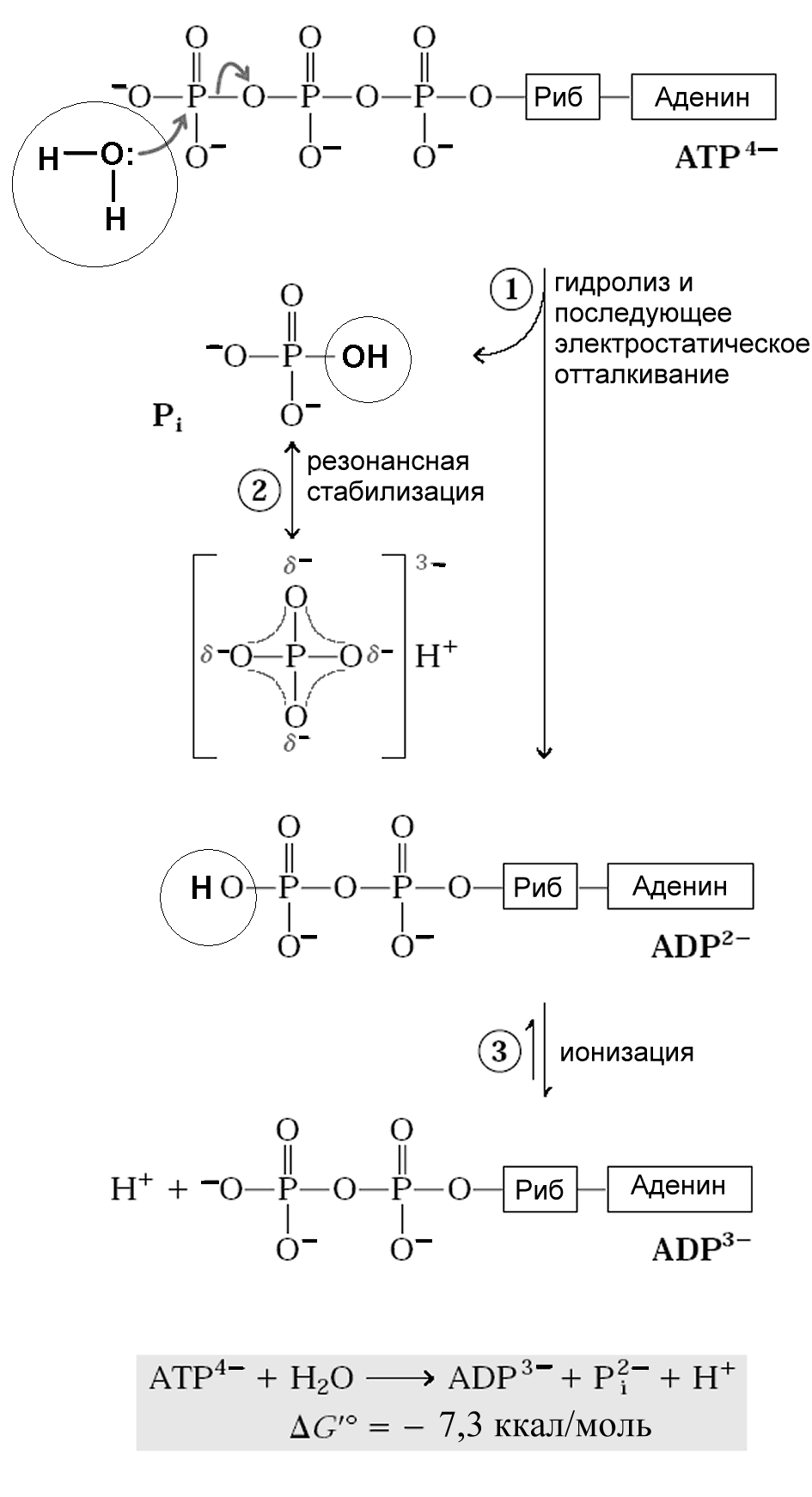
Рисунок 4 - Механизмы выделения повышенной энергии при гидролизе макроэргической связи в молекуле ATP. 1. При гидролизе ATP происходит разделение зарядов, которое усиливает электростатическое отталкивание отрицательных зарядов. 2. Отщепляющийся неорганический фосфат (Pi) стабилизируется при образовании резонансных гибридов, в которых каждая связь Р-О имеет одинаковую степень двойной связи и ион водорода не связан постоянно с одним из кислородов. 3. Получающийся ADP2 немедленно ионизируется и высвобождает протон в среду с очень низкой концентраций (10-7 при pH = 7). 4. Более высокая степень гидратации продуктов гидролиза ADP, Pi и H+ по сравнению с ATP (не показано на рисунке) (По Nelson, Cox, 2005)
соединению в молекулу АТР. Другая причина состоит в том, что ADP3 и НРО42 являются гибридами нескольких резонансных состояний с разным расположением групп =О, О и –ОН. Резонансная форма с четырьмя равноценными атомами кислорода О более устойчива в свободном виде, чем в составе ATP, т. к. часть их электронов находится на более низких орбитах и обладает меньшей энергией. При гидролизе ATP4 электроны могут переходить на более низкие уровни в ADP3 и НРО42, чем в ATP4 . И, наконец, ADP2-быстро отдает ион водорода (протон) в среду и ионизируется. Образуется больше ионов ADP3, НРО42, и Н+, чем в случае АТР4. Эти ионы гидратируются, т.е. создают вокруг себя оболочку из молекул воды, которая энергетически выгодна и препятствует рекомбинации этих ионов (рис.4).
В водных растворах равновесие должно быть сдвинуто в сторону гидролиза ATP. В принципе, при термодинамическом равновесии концентрация ATP должна быть много меньше концентрации ADP:
[ATP]/[ADP] << 1.
Но хотя гидролиз ATP энергетически выгоден, он происходит очень медленно благодаря сравнительно высокому активационному барьеру. Поэтому обычное соотношение ATP : ADP в клетках примерно равно 10 : 1, и запасенная в молекуле ATP энергия может очень долго оставаться нереализованной.
ATP используется там и тогда, где и когда необходимо выполнить полезную работу. Расщепление ATP и использование выделяющейся при этом энергии для совершения полезной механической, химической, осмотической или электрической работы совершается специальными ферментами ATPазами, которые «умеют работать с АТР», т.е. обладают специальными активными центрами, специфически связывающими и расщепляющими АТР.
ATP не обладает наибольшей стандартной энергией Go среди биохимических веществ. В клетках есть вещества с большей или меньшей стандартной энергией гидролиза фосфатных групп (таблица 1). ATP, в принципе, является посредником, переносчиком фосфатных групп от высокоэнергетических фосфорилированных соединений к низкоэнергетическим акцепторным молекулам с меньшей стандартной энергией. В клетках никогда не происходит прямого переноса фосфатных групп от какого-нибудь высокоэнергетического соединения к низкоэнергетическому. Практически все реакции переноса фосфатных групп протекают с участием системы ATP/ADP.
|
Таблица 1. Стандартные энергии гидролиза некоторых фосфатов
|
|
Фосфаты
|
|
|
|
Фосфоенолпируват
Креатинфосфат
|
-14,8
-10,3
|
Высокоэнергетические фосфаты
|
|
ATP
|
-7,3
|
|
|
Глюкозо-1-фосфат
Глицерол-1-фосфат
|
-5,0
-2,2
|
Низкоэнергетические фосфаты
|
Энергии от одной реакции к другой в изотермических условиях может передаваться при помощи общего промежуточного продукта:
A + B C + D ( )
D + E F + G ()
Если изменение в первой реакции , то она не может протекать самопроизвольно без притока энергии от внешнего источника. Таким источником может служить вторая реакция при условии, что общее изменение свободной энергии . Эту роль и играет реакция гидролиза ATP.
Иногда в качестве промежуточной энергетической единицы используется не ATP, а гуанозинтрифосфат (GTP). Например, при синтезе белка в рибосомах. Но GTP не образуется в клетках самостоятельно, а получается в результате переноса фосфатной группы от ATP на GDP.
В организме человека содержится в среднем около 50 г ATP. Но если за сутки средний человек весом 70 кг расходует 2800 ккал, то ему необходимо потреблять: 2800 ккал /12,5 ккал моль-1 = 224 моль или примерно 110 кг ATP. Следовательно, для обеспечения организма энергией эти 50 г ATP должны многократно расщепиться и вновь синтезироваться из ADP. За сутки организм человека синтезирует количество ATP, примерно равное массе его тела.
Глюкоза
В катаболических процессах поступающие c пищей белки, жиры и углеводы расщепляются до аминокислот, жирных кислот или простых сахаров, которые затем деградируют до простейших молекул H2O, CO2 и NH3, а заключенная в них энергия запасается в молекулах ATP (рис.1). Так, полимеры глюкозы крахмал и гликоген (рис.5), сначала разлагаются до мономеров, а затем в процессе окисления глюкоза расщепляется на СО2 и Н2О.
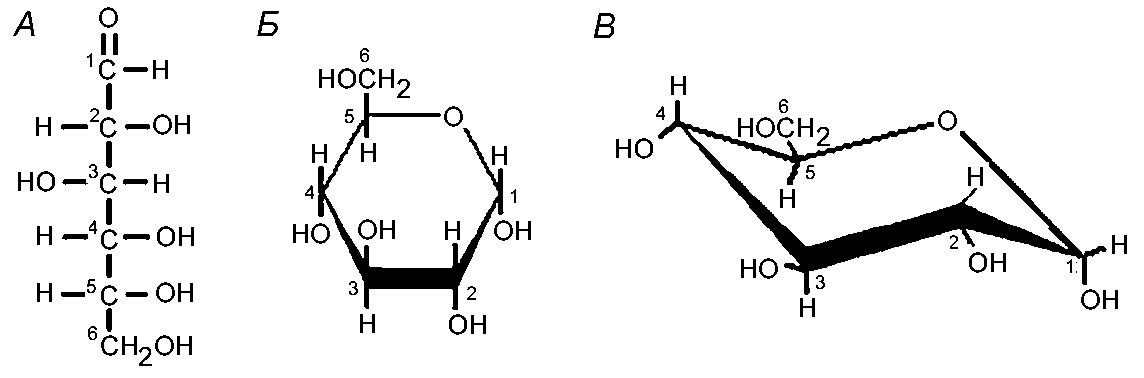
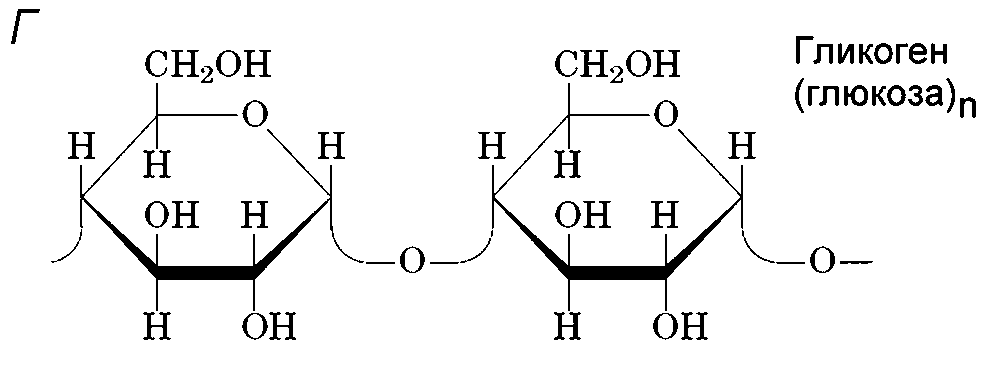
Рисунок 5 - Глюкоза может существовать в линейной (А) или кольцевой форме (Б или В). Структура В («кресло») реальней отображает пространственную конформацию глюкозы, чем структура Б. Такая конформация называется. Г. Гликоген и крахмал – полимеры из глюкозы. Крахмал из растительных клеток имеет линейную структуру, а гликоген из клеток животных – разветвленную
Высокоупорядоченная шестиуглеродная молекула глюкозы обладает большей свободной энергией, заключенной преимущественно в ковалентных связях С–С и С–О, чем простые продукты ее окисления - вода и углекислый газ. Значительный вклад в нее вносит энтропийный член. При окислении глюкозы
С6Н12О6 + 6О2 6СО2 + 6Н2О.
выделяется энергия 686 ккал/моль. Если суммировать энергии всех ковалентных связей (Таблица 2) в кольцевой молекуле глюкозы (Рис. 5,Б) и 6 молекулах О2:
5 связей С-С : 5 * 83 ккал/моль = 415 ккал/моль;
7 связей С-Н : 7 * 99 ккал/моль = 693 ккал/моль;
7 связей С-О : 7 * 84 ккал/моль = 588 ккал/моль;
5 связей О-Н : 5 * 112 ккал/моль = 560 ккал/моль;
6 связей О-О : 6 * 116 ккал/моль = 696 ккал/моль,
то получим 2952 ккал/моль. А в 12 связях С=О шести молекул СО2 и в 12 связях О-Н шести молекул Н2О, получающихся при окислении глюкозы, содержится (12*170) + (12*112) = 3384 ккал/мол. Т.е. энергетический выигрыш этой реакции 432 ккал/моль. Но в ней выделяется 686 ккал/моль. Вероятно, разница 686 – 432 = 254 ккал/моль приходится на счет энтропийной компоненты, связанной с потерей упорядоченности высокоорганизованной молекулы глюкозы.
Таблица 2. Энергии ковалентных связей (по Nelson, Cox, 2005)
|
Связи
|
|
Связи
|
|
|
C=O
|
170
|
H-H
|
104
|
|
C=C
|
146
|
P-O
|
100
|
|
P=O
|
120
|
C-H
|
99
|
|
О-О
|
116
|
C-O
|
84
|
|
O-H
|
112
|
C-C
|
83
|
Горение глюкозы описывается тем же уравнением, но при горении вся выделяющаяся энергия сразу рассеивается в виде тепла, а в клетке разложение глюкозы идет ступенчато через ряд промежуточных стадий, на которых можно не только извлечь свободную энергию, но и запасти ее в молекулах ATP.
Гликолиз
Первый этап разложения глюкозы в клетках - гликолиз. Это сложный комплекс из 10 реакций, в которых из глюкозы образуется пировиноградная кислота (пируват). Место этого процесса в схеме биоэнергетических реакций в клетках приведено на Рис.6. Гликолиз - универсальный путь расщепления глюкозы, использующийся клетками животных, растений и многих микроорганизмов.
Суммарное уравнение гликолиза:
С6Н12О6 + 2ADP + 2Pi 2С3Н6О3 + 2ATP + 2Н2О + 47 ккал/моль.
В процессе гликолиза из глюкозы извлекается небольшая часть энергии, т.к. трикарбоновая молекула пирувата ненамного проще, чем шестиуглеродная молекула глюкозы: только 47 ккал/моль, из которых 14,6 ккал/моль запасается в двух молекулах ATP. Это как бы «половинка глюкозы». Хотя гликолиз менее эффективен, чем аэробные биоэнергетические процессы, приводящие к полному окислению глюкозы, в которых выделяется 686 ккал/моль (см. ниже), в условиях недостатка кислорода он может служить основным источником энергии в клетке, правда, недолгое время. Дело в том, что в цитоплазме много гликолитических систем, и они могут быстро мобилизоваться; тогда гликолиз становится основным источником энергии. Другой вариант анаэробного гликолиза – спиртовое брожение в клетках дрожжей и других микроорганизмов.
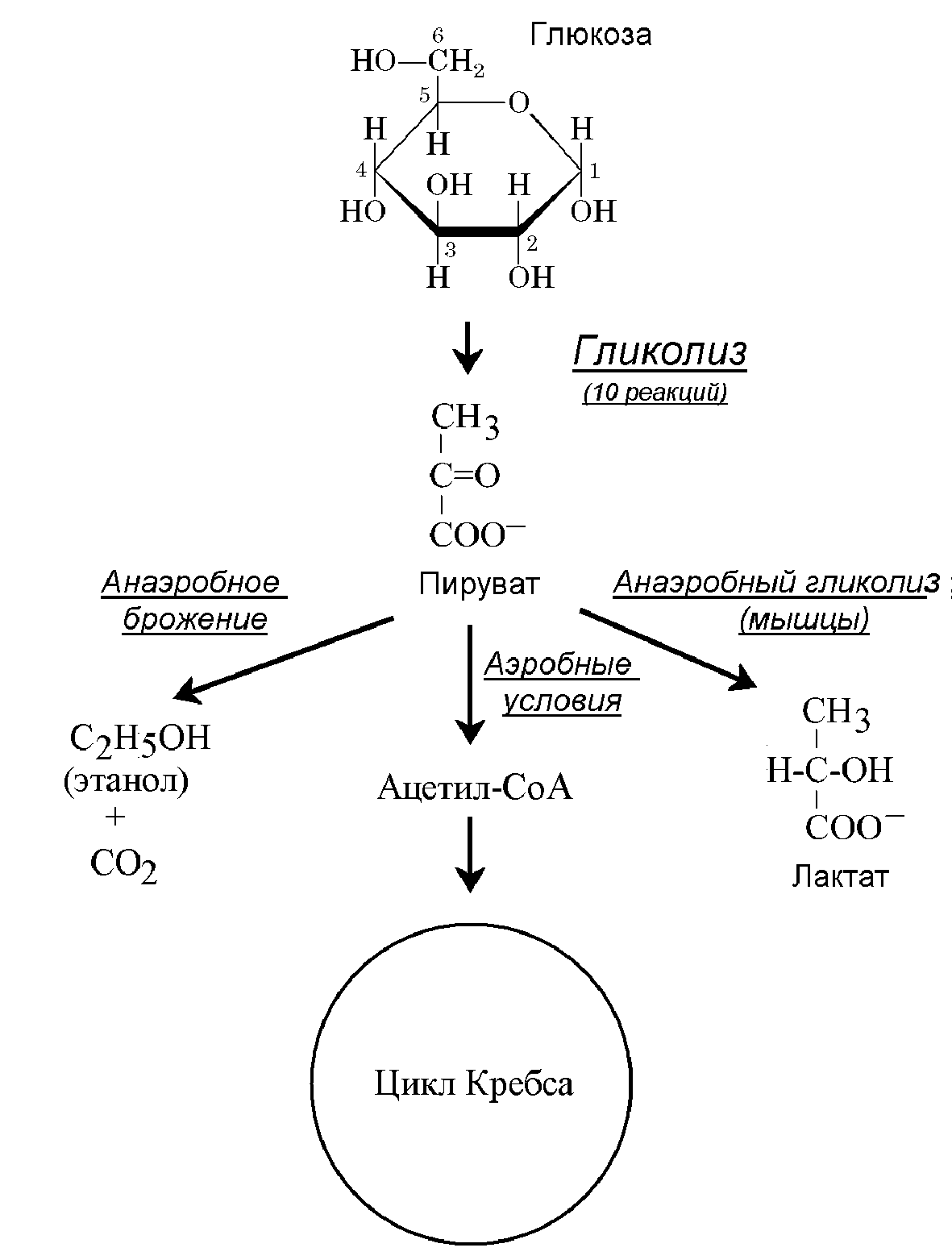
Рисунок 6 - Аэробный и анаэробный гликолиз
Ацетилкофермент А и цикл Кребса
В присутствии кислорода, т.е. в аэробных условиях, происходит полное окисление глюкозы с разрывом остальных межуглеродных связей в углеродном каркасе глюкозы, образованием простейших соединений СО2 и Н2О и выделением основного количества энергии. На первом этапе (Рис.6) пируват, получающийся в процессе аэробного гликолиза, взаимодействует с молекулой кофермента А (CоА), образуя ацетилкофермент А (AcCoA) (Рис.7). При этом к молекуле СоА добавляется ацетильная группа СН3СО с двумя атомами углерода и выделяется молекула СО2. Образование АсСоА - исключительно сложная задача, выполняемая пируватдегидрогеназным комплексом, состоящим из трех ферментов Е1, Е2 и Е3 объединенным в огромный мультиферментный комплекс массой 6 МДа и размером 45 нм (больше рибосомы!). Он содержит 60 молекул Е2 и по 20-30 молекул Е1 и Е3. В этом комплексе пируват подвергается 5 последовательным реакциям, пока не образуется АсСоА.
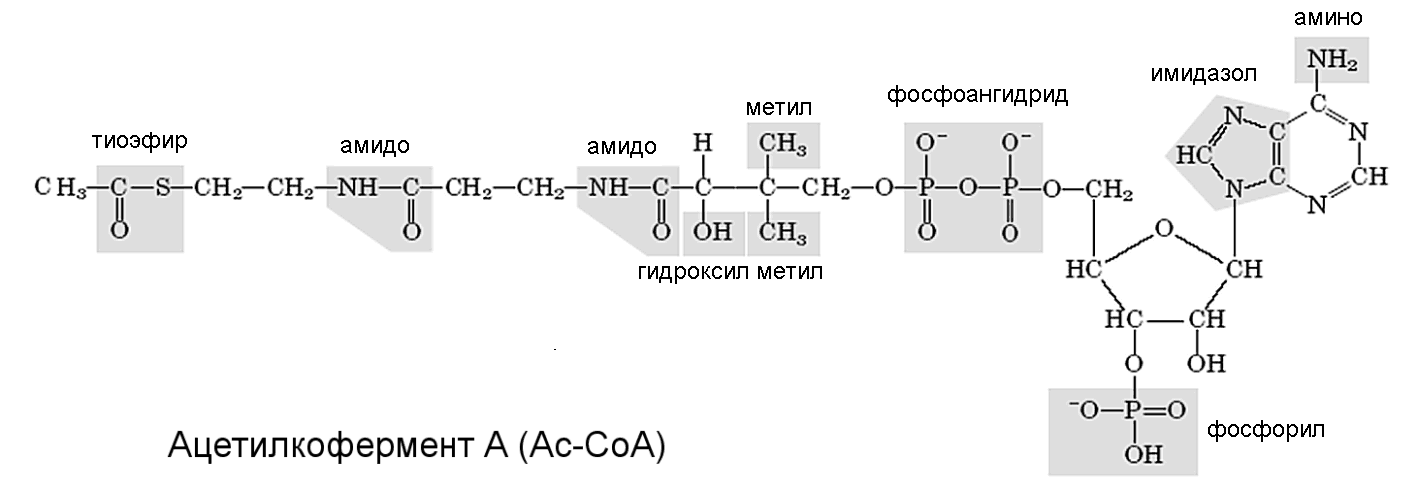
Рисунок 7 - Ацетилкофермент А
Другие органические молекулы претерпевают химические превращения, в ходе которых также образуется АсСоА. Так, жиры сначала разлагаются на глицерин и жирнокислотные цепочки, от которых в процессе -окисления отщепляются двухуглеродные фрагменты и присоединяются к СоА с образованием АсСоА. Белки распадаются до отдельных аминокислот, и почти все из них могут метаболизироваться с образованием АсСоА. Таким образом, АсСоА - универсальное промежуточное звено, связывающее разложение различных компонентов пищи с неким универсальным процессом, на котором сходятся все метаболические пути и в ходе которого выделяется и запасается основное количество энергии. Этот процесс называется циклом трикарбоновых кислот, или циклом лимонной кислоты, или циклом Кребса (рис.8). В нем осуществляется дальнейшее разложение углеродного скелета, и выделяется 2 молекулы СО2.
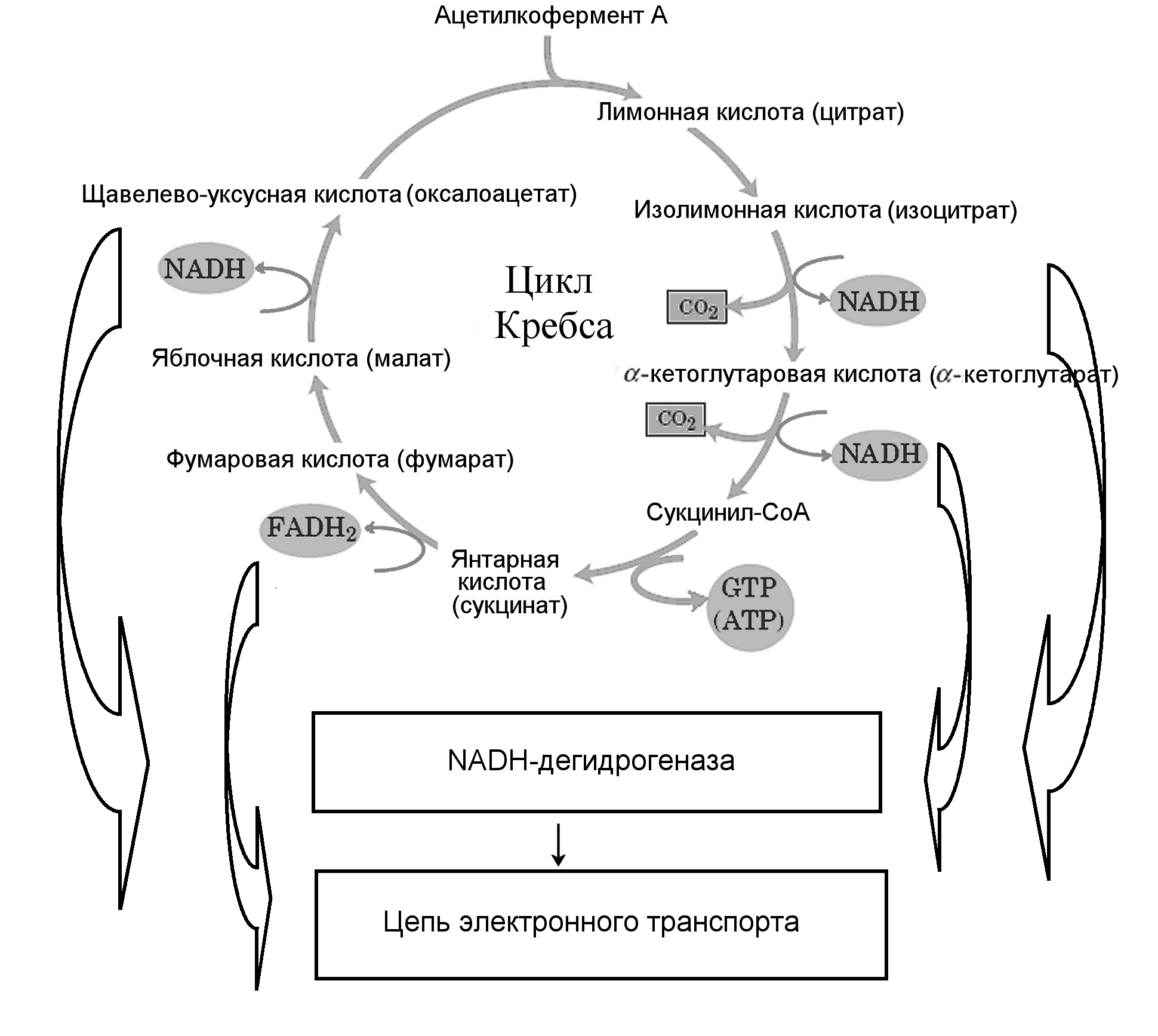
Рисунок 8 - Цикл Кребса
Для этого Ac-CoA поступает в циклический процесс из 8 реакций. Он присоединяет двухуглеродную ацетильную группу к трехуглеродной щавелевоуксусной кислоте (оксалоацетату). При этом получается пятиуглеродная лимонная кислота (цитрат). Затем от субстратов изоцитрата и -кетоглутарата отщепляется по молекуле углекислого газа СО2, выделяющегося в ходе дыхания, а ферменты изоцитрат-, -кетоглутарат-, сукцинат- и малатдегидрогеназы отщепляют по два атома водорода от изоцитрата, -кетоглутарата, сукцината и малата, соответственно, с помощью своих коферментов NADH или FADH2 (Рис.8) 1. Этот циклический процесс происходит в митохондриальном матриксе. Потом высокоэнергетические электроны из этих атомов водорода переносятся по цепи электронного транспорта на кислород с образованием воды, а выделившаяся по пути энергия используется для создания протонного градиента на внутренней митохондриальной мембране, за счет которого синтезируется АТР (рис.9)
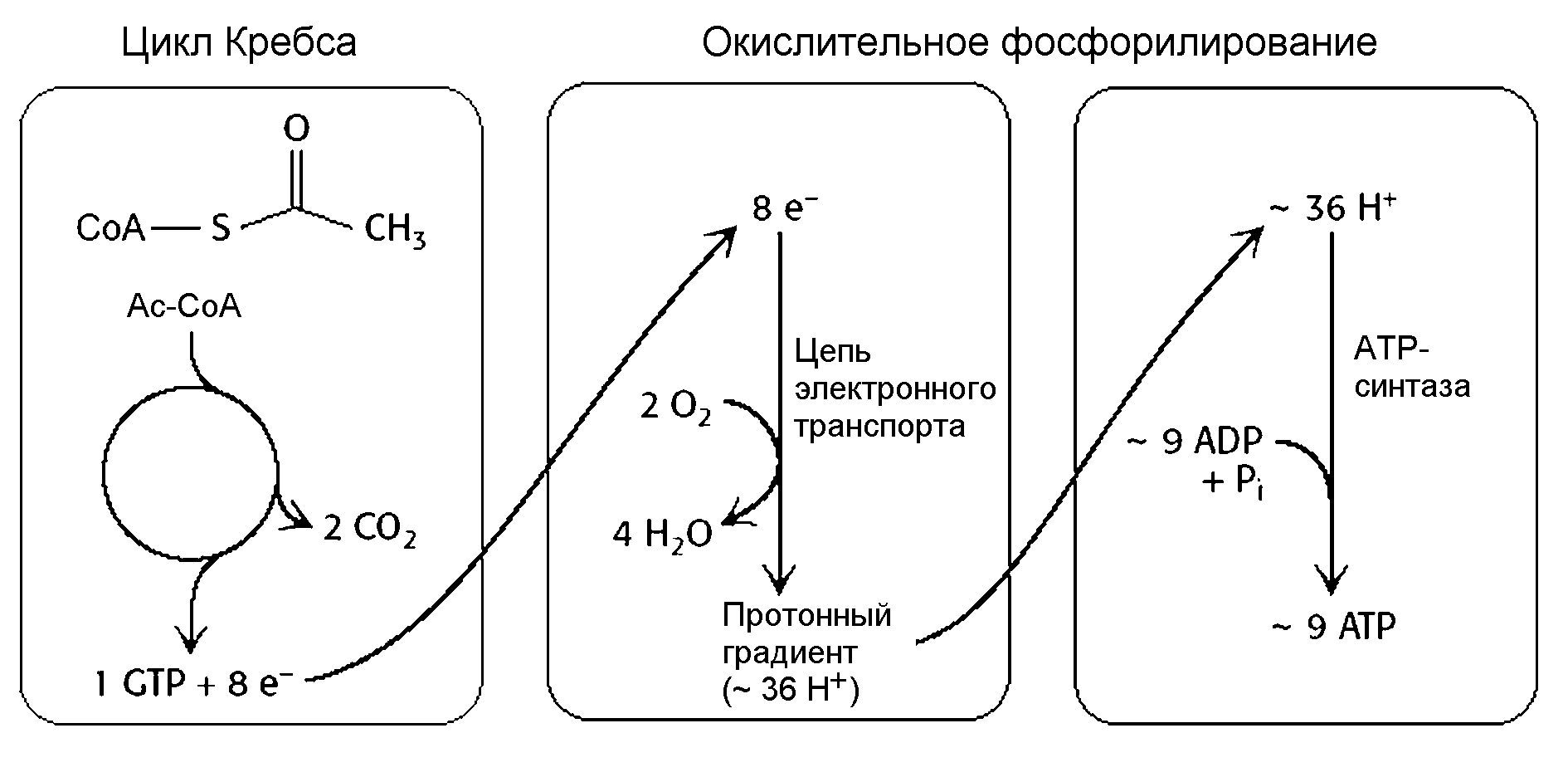
Рисунок 9 - Связь цикла Кребса, электронного транспорта и синтеза ATP (По Berg et al., 2002)
Митохондрии
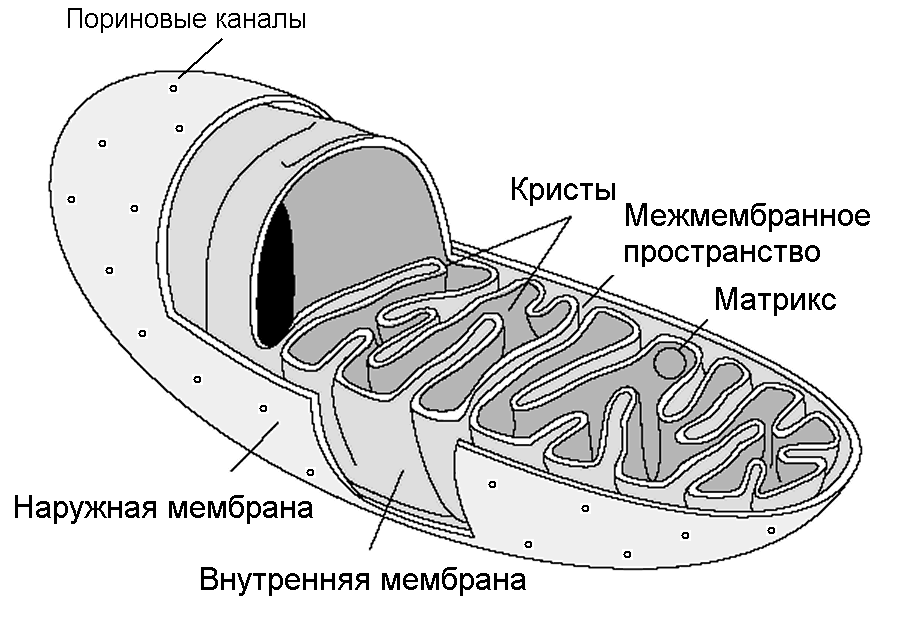
Митохондрии - внутриклеточные органеллы, в которых происходят основные биоэнергетические процессы. Они содержатся в цитоплазме всех клеток высших организмов - эукариот. На электронно-микроскопических фотографиях митохондрии имеют круглую, овальную или вытянутую форму. Их типичный диаметр порядка 0,2 мкм и длина до 3 мкм. В клетках от десятков до тысяч митохондрий. С помощью трехмерной реконструкции электронно-микроскопических изображений показано, что во многих клетках есть митохондрион - одна гигантская, разветвленная как куст, митохондрия, охватывающая ядро (Рис.10). Круглые и овальные структуры, видимые на электронно-микроскопических фотографиях, могут представлять собой поперечные срезы ветвей митохондриона. На периферии клетки есть также и отдельные независимые митохондрии.
|
А
0,2 мкм
|
Б
|
Рисунок 10 - Строение митохондрии. А. Структура отдельной митохондодрии. Б. Митохондрион дрожжевой клетки (Компьютерная 3D реконструкция)
Митохондрии обычно располагаются около структур, потребляющих ATP, или около источников "топлива". Они часто локализуются вокруг ядра или плазматической мембраны, поставляя им ATP. При физиологических или патологических процессах митохондрии могут перемещаться в места наиболее напряженной работы. При изменении функционального состояния клетки или повреждении митохондрион может разбираться или собираться.
Особенностью строения митохондрий является наличие двух мембран: наружной и внутренней. Последняя образует многочисленные впячивания – кристы, благодаря которым значительно увеличивается поверхность внутренней мембраны, на которой расположены основные биоэнергетические ферменты. Вследствие этого, в митохондриях есть два изолированных внутренних компартмента - межмембранное пространство и матрикс. В наружной митохондриальной мембране (НММ) белок порин образует гидрофильные поры, проницаемые для молекул с молекулярным весом до 5 кДа, которые проникают в межмембранное пространство, но не в матрикс.
Внутренняя мембрана митохондрий (ВММ) на 75 % состоит из белков и на 25 % - из липидов. В нее встроены компоненты цепи электронного транспорта (более 10000 наборов) и молекулы Н+-ATP-синтетазы. ВММ непроницаема даже для таких малых ионов, как протоны Н+. Особое значение имеют участки контакта наружной и внутренней мембран, где расположены белки ATP/ADP-транслоказы, транспортирующие ADP в матрикс митохондрий, а получившийся ATP – во внешнюю среду, и белки-переносчики различных ионов и метаболитов (органических кислот, жирных кислот, аминокислот и т.д.).
В митохондриях печени 67 % всех белков находится в матриксе, 21 % - в НММ, 6 % - в ВММ и 6 % - в межмембранном пространстве. В матриксе находятся ферменты цикла Кребса, пируватдегидрогеназный комплекс, ферменты окисления жирных кислот и окисления аминокислот и другие. В матриксе также содержится множество низкомолекулярных веществ – органических кислот, жирных кислот, аминокислот, нуклеотидов, ионов и т.д.
У митохондрий, в отличие от других органелл, имеется своя ДНК (мтДНК). В мтДНК человека содержится 37 генов, включая 13 генов, кодирующих субъединицы некоторых белков цепи электронного транспорта и ATP-синтетазы. Остальные гены кодируют рибосомные и транспортные РНК, участвующие в синтезе белка в митохондриальном матриксе. Гены около 900 митохондриальных белков или их субъединиц расположены в ядерной ДНК. Эти белки синтезируются в цитоплазме, а затем транспортируются в митохондрии. Пока не ясно, как координируется цитоплазматический и митохондриальный биосинтез белков. Ведь белки, у которых одна субъединица синтезируется в ядре, а другая в митохондрии должны производиться в эквивалентных количествах, для чего нужен обмен информацией между этими компартментами.
Перенос электронов
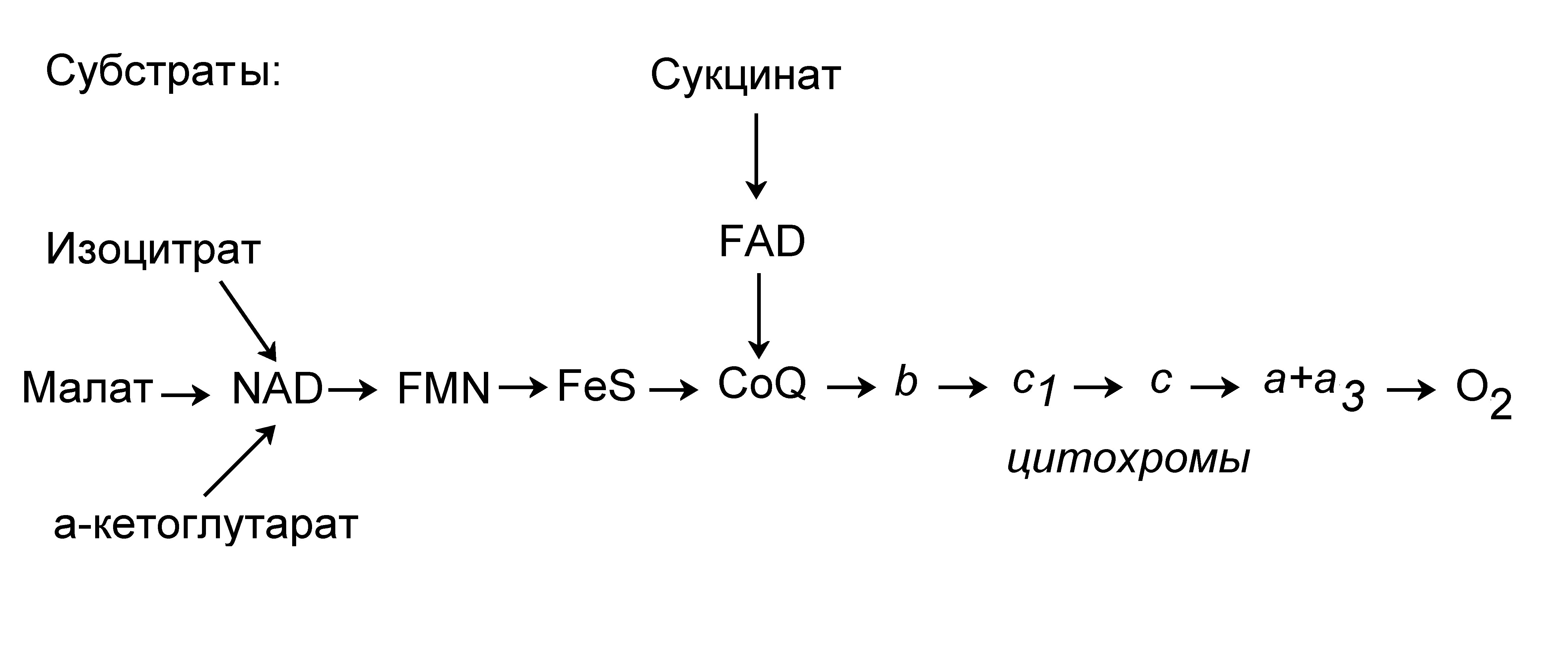
Электроны атомов водорода, отобранных от субстратов цикла Кребса, поступают в цепь переноса электронов, называемую также цепью электронного транспорта (ЦЭТ), или респираторной, или дыхательной цепью, а ионы водорода Н+ переходят в водную среду. ЦЭТ состоит из нескольких молекул разной природы, способных легко восстанавливаться (принимать электроны) и окисляться (отдавать электроны). По этой цепи электроны переносятся ступенчато, от одного переносчика к другому и небольшими порциями отдают свою энергию, пока не поступят на конечный акцептор – кислород (Рис.9, 11). Присоединению электронов к кислороду, осуществляемому цитохромоксидазой, или комплексом цитохромов (а+а3), сопутствует поглощение 4 протонов Н+. В результате образуется молекула воды:
4 Н+ + 4 е + О2 2 Н2О.
Смесь газообразных водорода и кислорода, называемая гремучим газом, легко взрывается с образованием воды. При этом за очень короткое время в виде тепла, света и звука выделяется значительная энергия, которую напрямую нельзя запасти. А в дыхательной цепи эта энергия высвобождается небольшими порциями на каждом этапе переноса электронов. Это позволяет провести реакцию в мягких условиях при 37 о С и 1 атм и запасти значительную часть выделившейся энергии в виде протонного градиента на внутренней митохондриальной мембране. За счет энергии этого градиента и синтезируются ATP. За один оборот цикла Кребса в цепь электронного транспорта подается 8 электронов, за счет энергии которых через митохондриальную мембрану переносится примерно 36 протонов Н+. Энергия, запасенная в протонном градиенте, может использоваться для синтеза 9 молекул АТР.
Цепь электронного транспорта
При переносе электронов осуществляются окислительно-восстановительные реакции, в которых молекулы-переносчики электронов последовательно окисляются или восстанавливаются (отдают или присоединяют электроны, соответственно). В молекулах переносчиков электроны локализуются на системе -уровней органических молекул с сопряженными связями (пиридиннуклеотидов, флавинов, хинонов) или на атомах металлов с переменной валентностью, таких как железо (Fe2+ Fe3+) или медь (Cu+ Cu2+). В ходе переноса от субстратов цикла Кребса на кислород (Рис.11) электроны постепенно переходят на все более низкие энергетические уровни. В этом процессе выделяется и запасается основная доля энергии питательных веществ. Перенос электронов осуществляется в ЦЭТ тремя способами: (а) прямым переносом, как в реакции: Fe3+ + e Fe2 +; (б) переносом атома водорода (т.е. одновременным переносом H+ и e) и (в) переносом гидрид-иона :H, т.е. протона, окруженного одновременно двумя электронами. Для характеристики окислительно-восстановительных процессов используется термин «восстановительный эквивалент», обозначающий перенос электрона независимо от способа переноса.
В трех пунктах цикла Кребса ферменты малатдегидрогеназа, изоцитратдегидрогеназа и -кетоглутаратдегидрогеназа отбирают по два атома Н от субстратов малата, изоцитрата и -кетоглутарата и переносят один из них на свой кофермент никотинамидадениндинуклеотид (NAD+) в виде гидрид-иона :H (Рис.12А). Второй атом водорода в виде протона H+ уходит при этом в воду:
R-CH2-OH + NAD+ NADH + R-C=O + H+ (в воду)
H
Далее фермент NADH-дегидрогеназа с коферментом FMN (флавинаденинмононуклеотид) отнимает два восстановительных эквивалента в виде гидрид-иона :H у NADH:
NADH + H+ + FMN NAD+ + FMNH2
А.
Б.
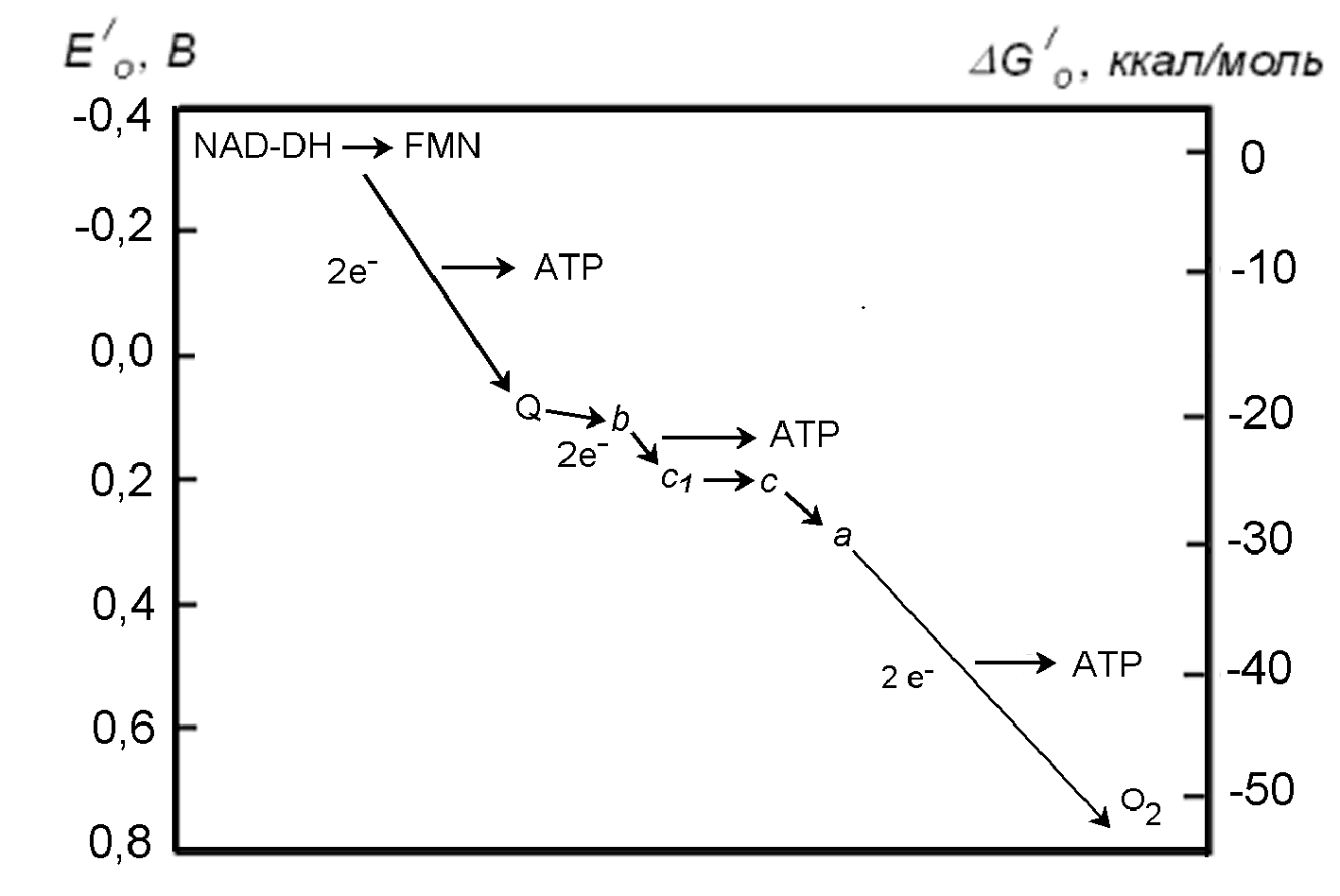
Рисунок 11 - Цепь электронного транспорта. А. Последовательность переносчиков электронов в ЦЭТ. Б. Диаграмма, схематично отображающая энергию, выделяющуюся на разных ступенях ЦЭТ
Затем водород переносится на кофермент Q (CoQ):
FMNH2 + CoQ FMN + CoQH2.
От молекул CoQ электроны переносятся по одному на цепочку белков цитохромов и далее на кислород, который при этом соединяется с ионами H+ с образованием молекулы воды. При прохождении пары электронов по этому пути выделяется наибольшее количество энергии (Рис.11). Действительно, по данным об окислительно-восстановительных потенциалах на разных этапах переноса электронов, приведенным в таблице 3, можно вычислить значения соответствующих стандартных изменений свободной энергии: . Разность энергий при переносе пары электронов между конечным звеном ЦЭТ ( O2 + 2H+ + 2e H2O) и начальным звеном (NAD+ + H+ + e NADH) составляет:= -37,6 – 2 7,36 = - 52,3 ккал/моль.
Дыхательный коэффициент – отношение потребленного фосфата к потребленному кислороду Р:О оценивается как 3:1, т.е. восстановление атома кислорода двумя переносимыми по цепи электронами позволяет присоединить 3 молекулы неорганического фосфата к 3 молекулам ADP, что дает 3 молекулы ATP. Для этого в стандартных условиях требуется 3(-7,3 ккал/моль) = -21,9 ккал/моль, т.е. к.п.д. этого процесса составляет примерно 42%.
От другого компонента цикла Кребса, сукцината, фермент сукцинатдегидрогеназа с коферментом флавинадениндинуклеотидом (FAD) также отбирает два атома водорода (Рис.8,11) и присоединяет их к CoQ, перенося при этом два восстановительных эквивалента. В этом случае при прохождении более короткого участка ЦЭТ синтезируются только 2 молекулы ATP. Но этот путь не менее, а более энергоемкий, т.к. сукцинатдегидрогеназа отличается большей производительностью.
Таблица 3. Редокс-реакции (полуреакция) компонентов цепи электронного транспорта митохондрий
|
Редокс-реакции (полуреакция) компонентов цепи электронного транспорта митохондрий
|
, В
|
ккал/моль
|
|
2H+ + 2e H2
|
- 0.414
|
19,00
|
|
NAD+ + H+ + e NADH
|
- 0.320
|
17,36
|
|
NADP+ + H+ + 2 e NADPH
|
- 0.324
|
14,90
|
|
NADH дегидрогеназа (FMN) + 2H+ + 2 e
NADH дегидрогеназа (FMNH2)
|
- 0.30
|
13,8
|
|
CoQ + 2H+ + 2 e CoQ-H2
|
+ 0.045
|
- 2,07
|
|
Цитохром b (Fe3+) + e Цитохром b (Fe2+)
|
+ 0.077
|
-1,77
|
|
Цитохром с (Fe3+) + e Цитохром с (Fe2+)
|
+ 0.22
|
-5,06
|
|
Цитохром с1 (Fe3+) + e Цитохром с1 (Fe2+)
|
+0,254
|
-5,84
|
|
Цитохром a (Fe3+) + e Цитохром a (Fe2+)
|
+0.29
|
-6,67
|
|
Цитохром a3 (Fe3+) + e Цитохром a3 (Fe2+)
|
+ 0.35
|
-8,05
|
|
O2 + 2H+ + 2e H2O
|
+0.817
|
-37,6
|
Определение стандартных редокс-потенциалов митохондриальных переносчиков электронов (Таблица 3) позволило установить их порядок в ЦЭТ (Рис.11). Напомним, что электроны всегда переходят от переносчиков с отрицательным редокс-потенциалом к переносчикам с более положительным потенциалом. Рассмотрим подробнее молекулы переносчиков электронов.
Никотинамидадениндинуклеотид (NAD)
Никотинамидадениндинуклеотид - кофермент многих дегидрогеназ. Его окисленная форма - NAD+ , восстановленная – NADH (Рис.12,а). В качестве кофермента иногда используется NADP+/NADPH, где фосфорилирован второй атом углерода у рибозы (Рис.12,а). NAD-зависимые дегидрогеназы участвуют во многих окислительно-восстановительных процессах. Они играют коллекторную роль, собирая восстановительные эквиваленты от компонентов цикла Кребса изоцитрата, -кетоглутарата, малата и других субстратов и передают электроны в ЦЭТ. При этом у субстратов отбираются два атома водорода. Один в виде иона Н+ переходит в среду, а другой в виде гидрид-иона :Н переносится на NAD+ вместе с двумя восстановительными эквивалентами.
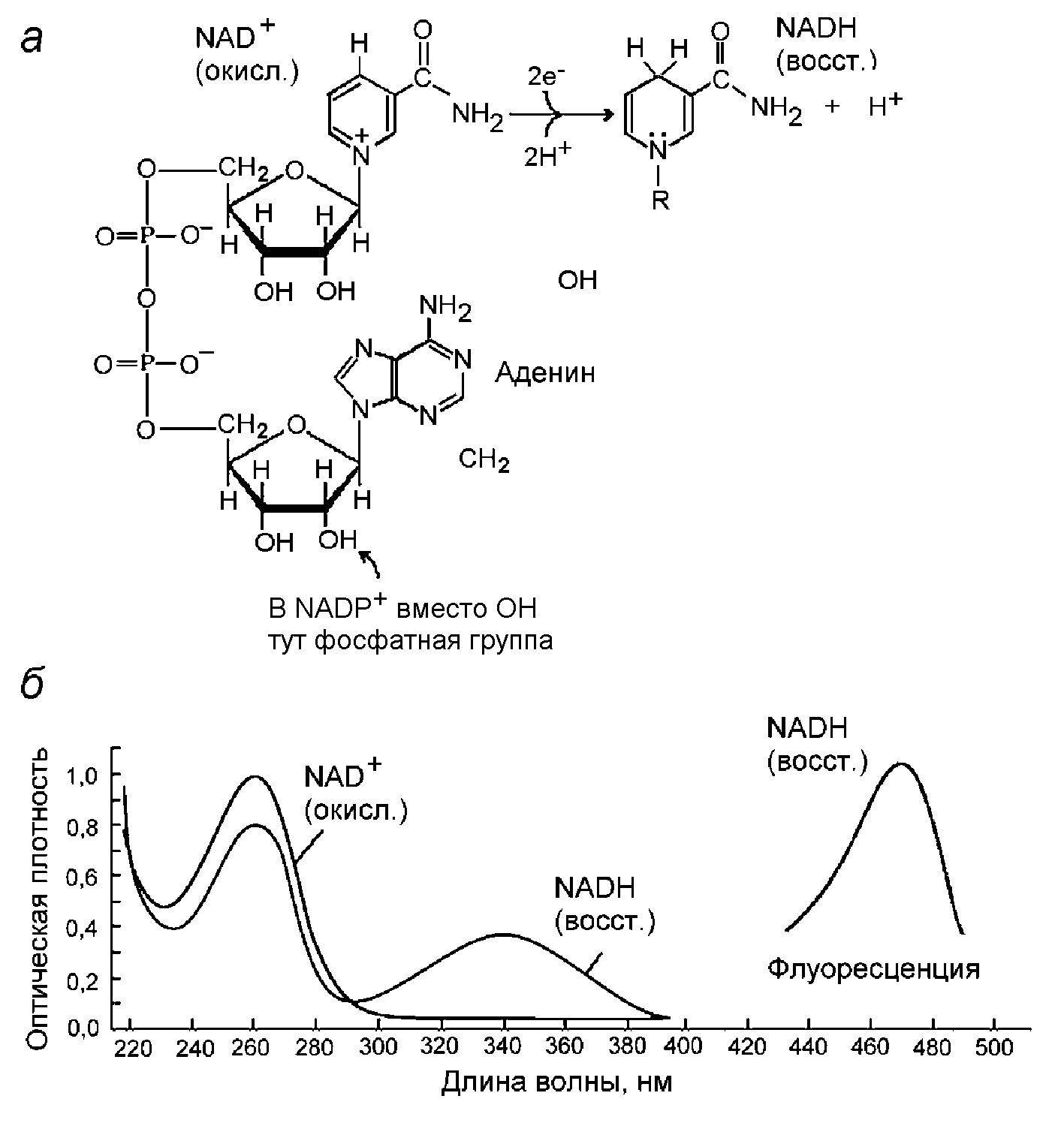
Рисунок 12 - Никотинамидадениндинуклеотид (а) Строение NAD+ и его восстановление в NADH (б). Спектры поглощения света и флуоресценции NAD+ и NADH
Процессы переноса электронов с участием NAD удобно изучать спектральными методами. Как и любой нуклеотид, NAD поглощает УФ свет с максимумом при 260 нм. В окисленном состоянии (NAD+) он не имеет других полос поглощения и не флуоресцирует, а в восстановленном состоянии (NADH) появляется широкая дополнительная полоса поглощения в области 300-380 нм с максимумом при 340 нм и флуоресценция с максимумом при 470 нм (Рис.12,б). По этим спектральным полосам можно судить о редокс-состоянии NAD.
Флавиновые нуклеотиды
Флавиновые нуклеотиды флавинаденинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD) (Рис.13,а) являются коферментами таких дегидрогеназ, как NADH-дегидрогеназа и сукцинатдегидрогеназа, соответственно. Они забирают восстановительные эквиваленты у NADH и переносят электроны на кофермент Q (в этом переносе участвуют железо-серные центры). Они могут участвовать в одно- или двухэлектронном переносе, принимая один электрон и переходя при этом в полувосстановленную семихинонную форму, или два электрона и переходя в полностью восстановленные формы FMNН2 и FADН2. Это позволяет им служить посредниками между двухэлектронными (NADH) и одноэлектронными переносчиками (кофермент Q).
При окислении оптические спектры флавиннуклеотидов резко изменяются. В спектрах поглощения света кроме «нуклеотидной» полосы при 260 нм появляются дополнительные полосы при 370 и 450 нм и флуоресценция с максимумом при 530 нм (Рис. 13,б). Поэтому изучение оптических свойств клеток, в частности, отношения поглощения света при длинах волн 370 и 450 нм, или флуоресценции при 470 и 520 нм позволяет получить данные о соотношении восстановленных пиридиннуклеотидов и окисленных флавиннуклеотидов, и таким образом охарактеризовать интенсивность переноса электронов по ЦЭТ.
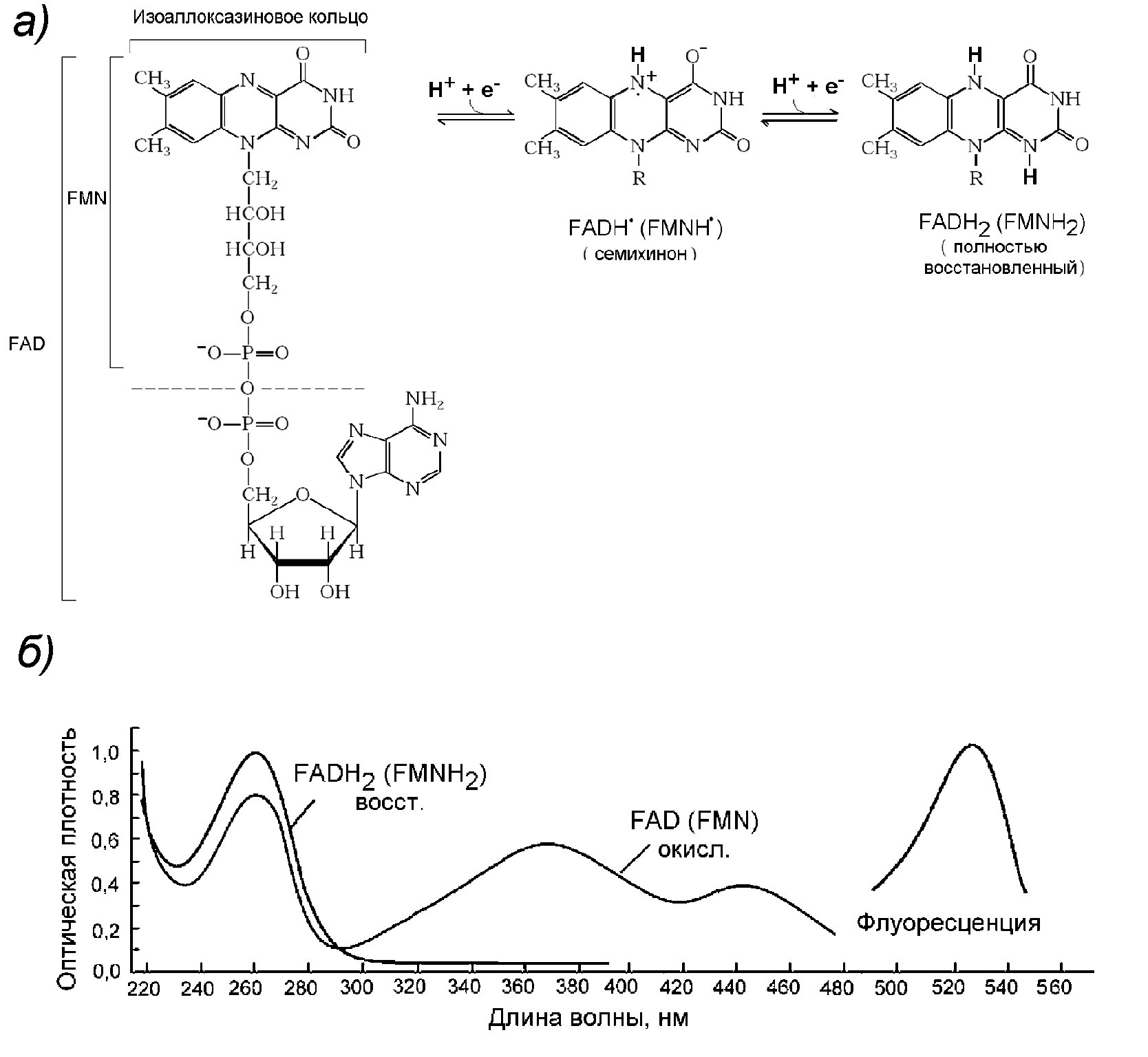
Рисунок 13 - Флавиновые переносчики электронов. (а). FAD и FMN. (б).Спектры поглощения света и флуоресценции флавинов
Железо-серные белки
Флавиновые и пиридиновые дегидрогеназы обычно присутствуют в ЦЭТ в комплексе с белками, несущими железо-серные центры. Бывают центры с одним (Fe-S), двумя (2Fe-2S) или четырьмя атомами железа и серы (4Fe-4S), которые присоединяются к белковым цистеинам (Рис.14). Их присутствие в ЦЭТ обязательно. Входящие в их состав атомы железа участвуют в одноэлектронном переносе от флавинов (FMN или FAD) на убихинон, меняя свою валентность от Fe+2 до Fe+3 и наоборот. В митохондриях есть, по меньшей мере, восемь разных железо-серных белков. Их окислительно-восстановительные потенциалы варьируют от -0,65 до +0,45 в зависимости от микроокружения иона железа. Структура железо-серных белков пока не изучена.
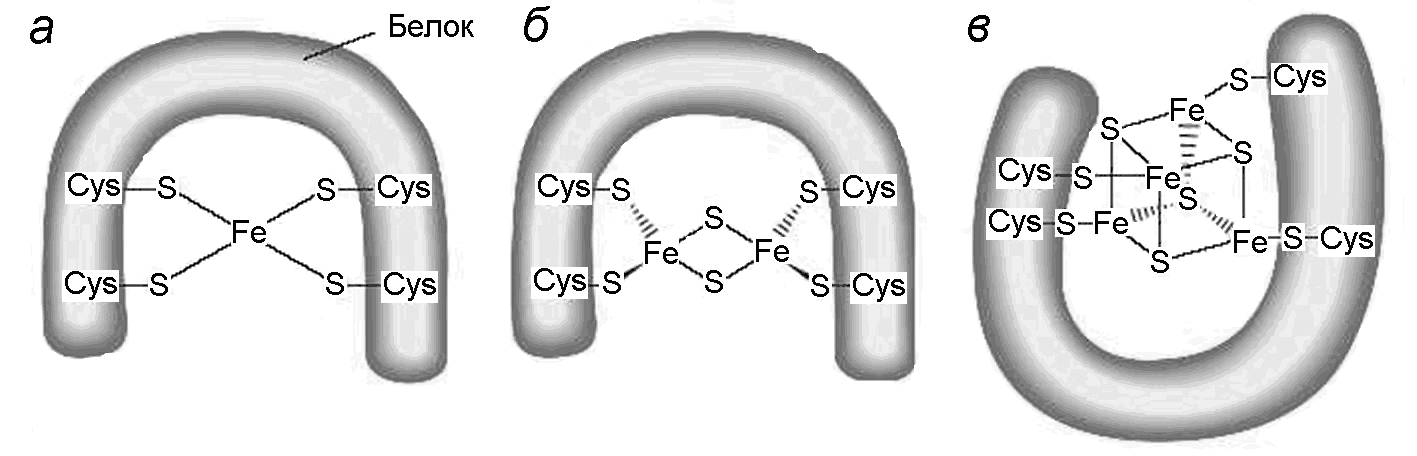
Рисунок 14 - Структура железо-серных центров (по Nelson, Cox, 2005)
Кофермент Q
Кофермент Q (CoQ), или убихинон (вездесущий хинон), - гидрофобное вещество с хиноновой головкой и очень длинным хвостом из 10 (иногда 6 или 8) изопреновых мономеров, т.е. из 40 углеродных звеньев (Рис. 15). Иногда он обозначается как Q10. Благодаря гидрофобному хвосту, CoQ погружен в липидный слой внутренней митохондриальной мембраны. CoQ не является фиксированным компонентом ЦЭТ. Он мигрирует внутри митохондриальной мембраны, перенося электроны по одному или по два, переходя при этом в полувосстановленную (семихинон-радикал) или полностью восстановленную форму (Рис.15), от флавопротеинов (предположительно, через Fe-S центры) на цитохром b.
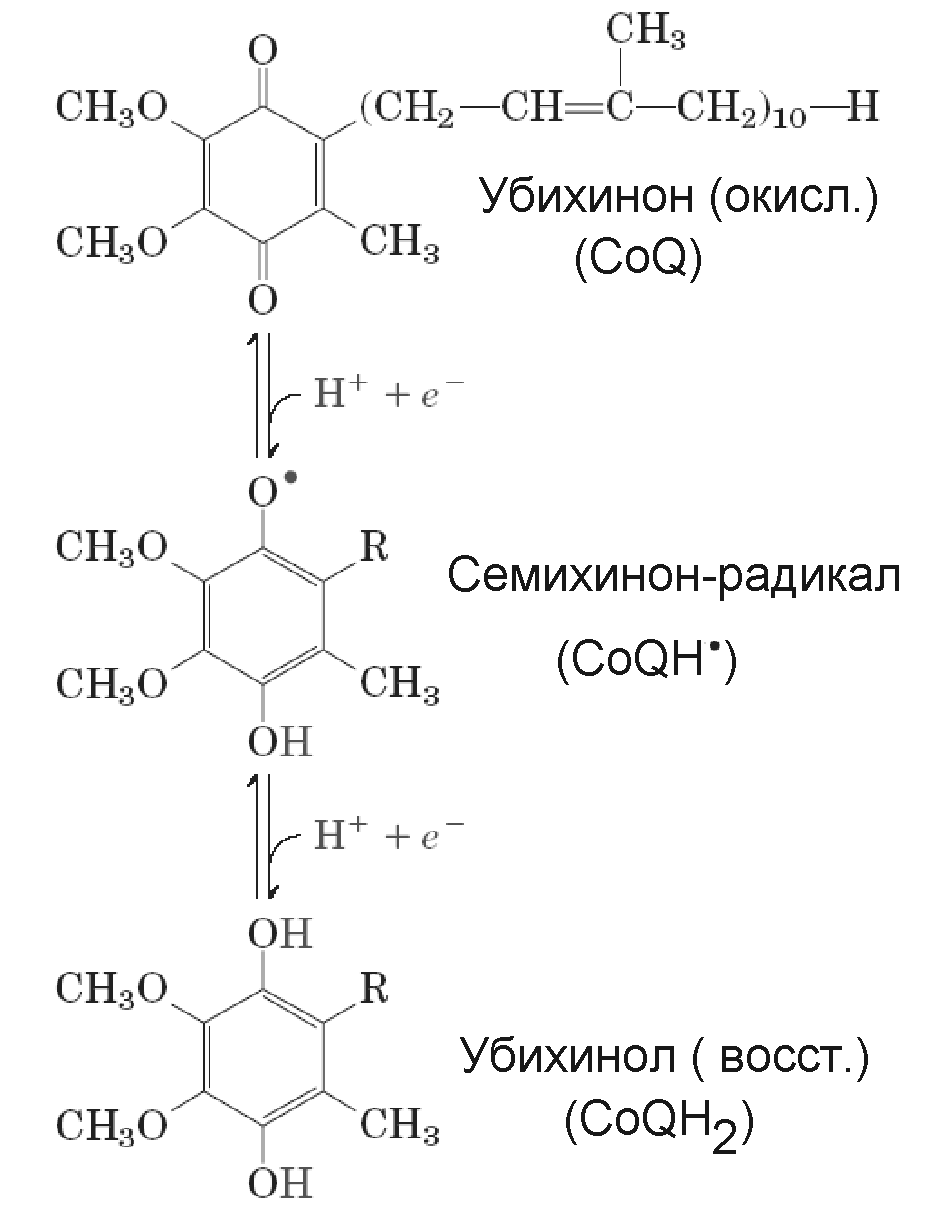
Рисунок 15 - Кофермент Q и его окислительно-восстановительные превращения
Цитохромы
Цитохромы - это группа белков, содержащих в качестве коферментов гем (Рис.16). В геме порфириновое кольцо содержит в центре ион железа, способный легко присоединять электрон (и при этом восстанавливаться) или отдавать e- (и при этом окисляться), переходя от ферри-формы (Fe3+) к ферро-форме (Fe2+) и наоборот:
Fe3+ + e Fe2+
(окисленное) (восстановленное)
Разные виды цитохромов отличаются по спектральным свойствам, т.е. по энергетическим уровням электронов. Это обусловлено разными боковыми заместителями в молекуле гема и различной структурой белка, создающей разное микроокружение гема. Для порфиринов характерен резкий максимум поглощения света в области 400-440 нм, обусловленный распределенной системой -электронов в порфириновом кольце. Это полоса Соре, или -полоса. Дополнительные максимумы в зелено-красной области спектра обусловлены поглощением света ионами железа (Таблица 4). У восстановленных цитохромов есть еще два максимума в области 520-530 нм и 550-600 нм, а у окисленных цитохромов полоса Соре обычно сдвигается влево, а длинноволновые полосы и сливаются в одну (Рис.17).
Цепь цитохромов b,c1 и c переносит электроны по одному от KoQ на цитохромоксидазу, которая присоединяет их к ионам водорода и кислороду, в результате чего получается молекула воды. Разумеется, цель этого процесса - не синтез воды, а извлечение энергии из высокоэнергетических электронов.
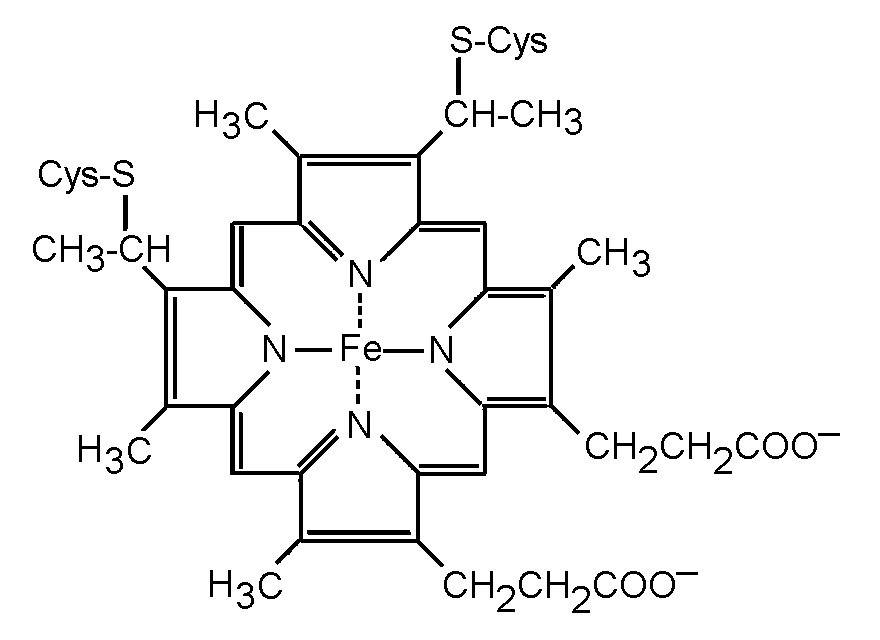
Рисунок 16 - Структура гема
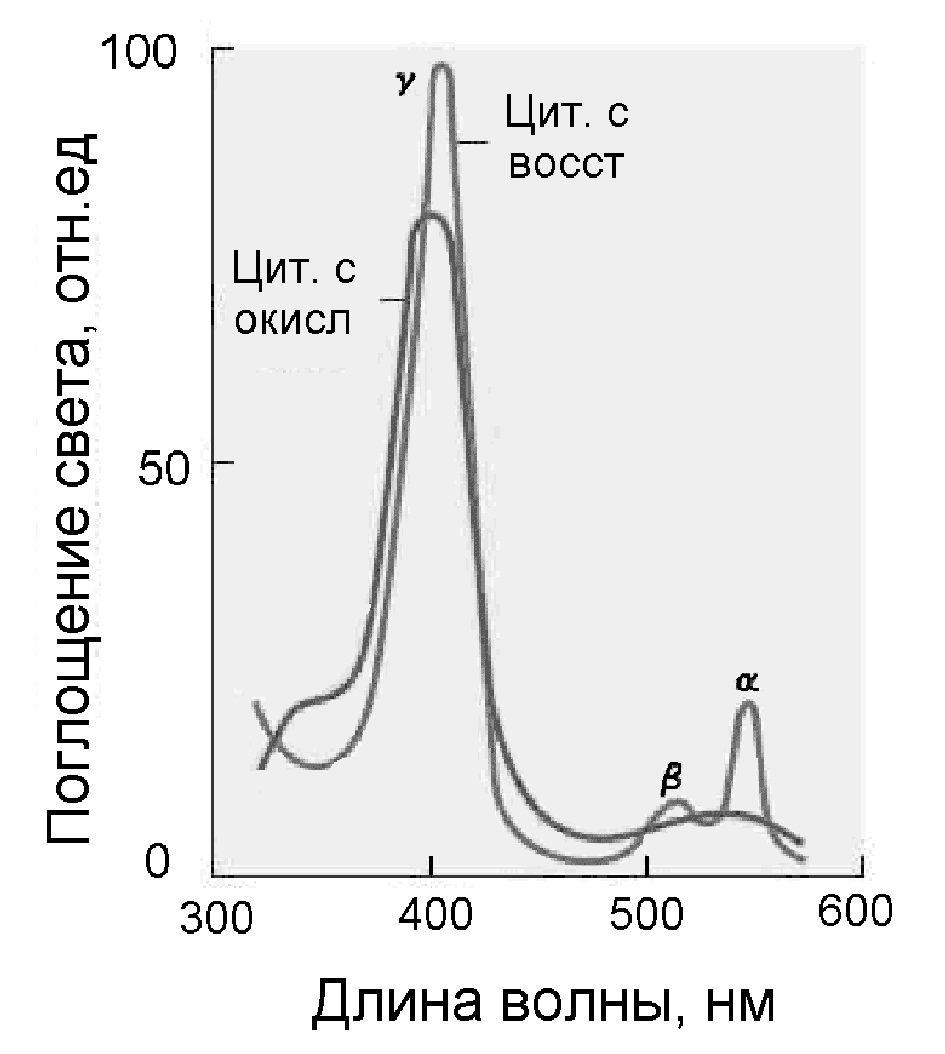
Рисунок 17- Спектры поглощения окисленного и восстановленного цитохрома с
Таблица 4. Максимумы поглощения света восстановленными цитохромами
|
Цитохромы
|
max, нм
|
|
b
|
563
|
532
|
429
|
|
c1
|
554
|
524
|
418
|
|
c
|
550
|
521
|
415
|
|
a
|
600
|
|
439
|
|
a3
|
603
|
|
443
|
Электронпереносящие комплексы
Переносчики электронов встроены во внутреннюю мембрану митохондрий. Они образуют в ней 4 крупных надмолекулярных белковых комплекса, названных дыхательными ансамблями I, II, III и IV (рис.18). В последние годы расшифрована пространственная структура этих комплексов, что позволило прояснить детали их функционирования.
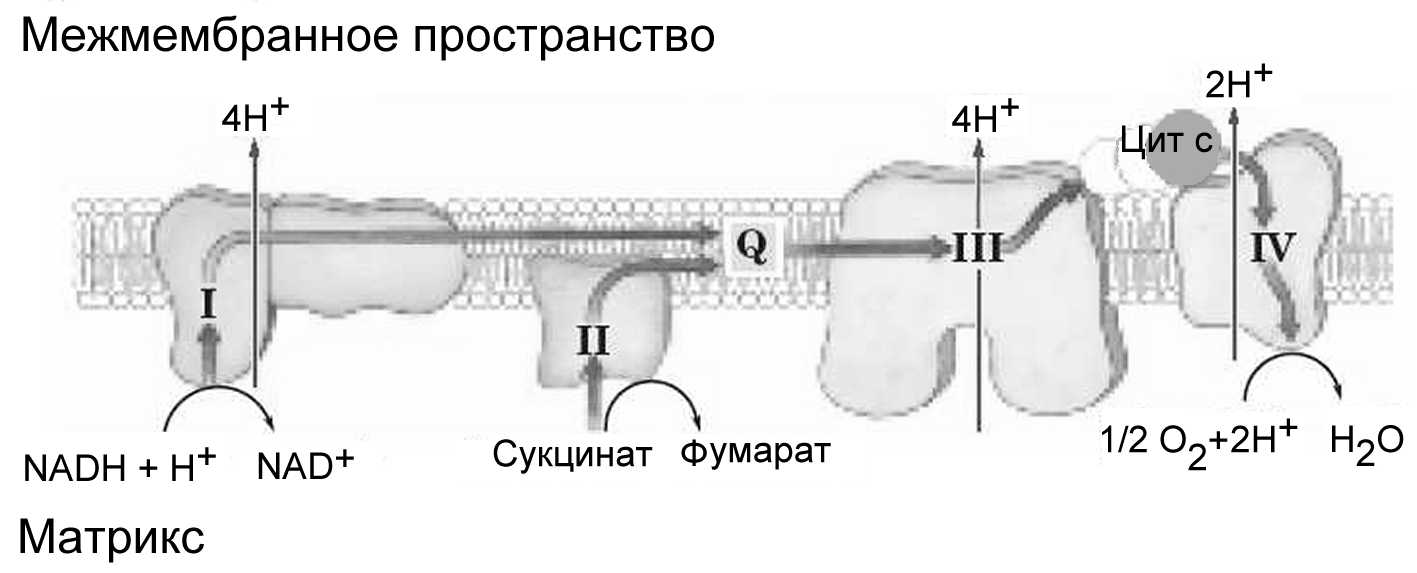
Рисунок 18 - Дыхательные ансамбли ЦЭТ. I – NADH-дегидрогеназа, II – сукцинатдегидрогеназа, III – комплекс цитохромов bc1 ; IV – цитохромоксидаза.
Стрелки указывают пути переноса электронов. (по Nelson, Cox, 2005)
Комплекс I : NADH-дегидрогеназа
Комплекс I - весьма крупный мультибелковый комплекс с молекулярной массой около 850 кДа содержит 43 полипептидных цепи, включая собственно NADH-дегидрогеназу и, как минимум, 6 (Fe-S)-центров. Его молекулярная масса около 850 кДа. Он имеет L-образную форму. Одна из его частей располагается в мембране, а другая простирается в матрикс (Рис.19). FMN, входящий в состав NADH-дегидрогеназы, принимает электроны от группы NADH дегидрогеназ цикла Кребса (изоцитрат-, -кетоглутарат-, или малатдегидрогеназы) и с помощью Fe-S центров железо-серных белков передает их дальше на CoQ, который диффундирует в мембране и передает затем электроны на комплекс III. Перенос пары электронов в этом комплексе сопровождается переносом 4 протонов через внутреннюю митохондриальную мембрану в межмембранное пространство митохондрий. Суммарная реакция, осуществляемая комплексом I:
NADH + H+ + CoQ NAD+ + CoQH2,
Или с учетом одновременного переноса протонов из матрикса, который при этом становится отрицательно заряженным, в межмембранное пространство, приобретающее положительный заряд:
NADH + 5HN+ + CoQ NAD+ + CoQH2 + 4HP+,
где P и N обозначают положительно и отрицательно заряженные компартменты.
Комплекс II: сукцинатдегидрогеназа
Пространственная структура комплекса II недавно расшифрована. Он состоит из 4 субъединиц с общей массой 140 кДа (Рис.20). Его субъединицы A и B простираются далеко в матрикс. Субъединица A содержит сайты связывания сукцината и FAD, субъединица B - три (Fe2-S2)-центра. Субъединицы C и D - интегральные белки, состоящие из трех внутримембранных -спиралей, встроенных во внутреннюю митохондриальную мембрану. Они содержат гем и центр связывания CoQ. Комплекс II получает электроны от сукцината и переносит их на CoQ. Расстояние в нем между FAD и сайтом связывания сукцината, или между FAD и центром связывания CoQ превышает 4,0 нм и, казалось бы, электронный транспорт на такое расстояние маловероятен. Но между ними, видимо, располагаются (Fe2-S2)-центры, играющие роль промежуточных переносчиков, расстояния между которыми не больше 1,1 нм, что позволяет эффективно переносить электроны.
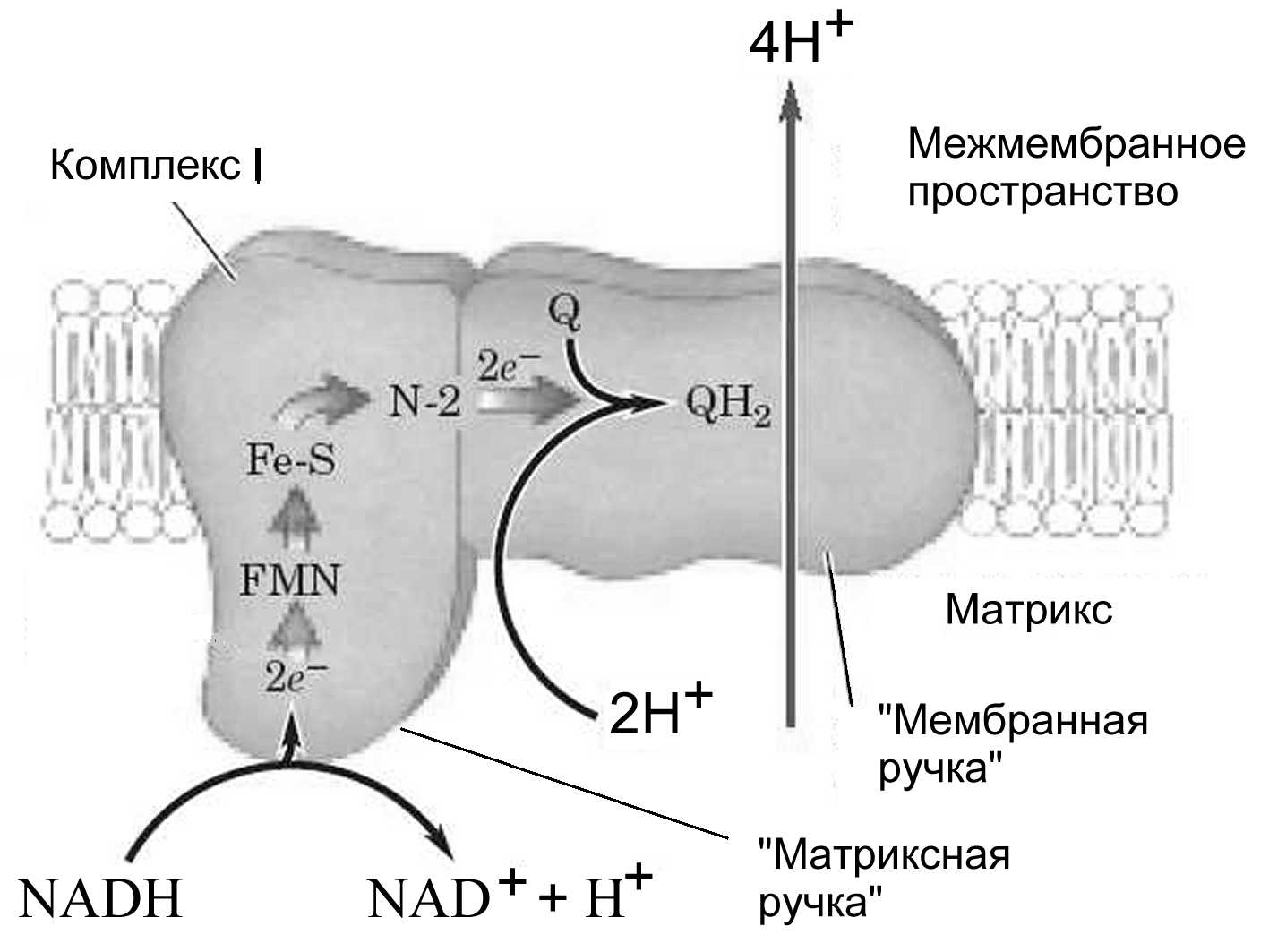
Рисунок 19 – Схема строения комплекса I, встроенного во внутреннюю митохондриальную мембрану. Широкими стрелками показан путь переноса электронов. Также показано направление переноса протонов (Nelson, Cox, 2005)
Предполагается, что имеющийся в этом комплексе гем не участвует в переносе электронов, но защищает его от окислительного повреждения. Перенос пары электронов от комплекса II на кислород сопровождается синтезом двух молекул ATP (Р:О = 2:1). Но на самом деле, этот путь может производить больше ATP, чем NADH-дегидрогеназный путь, в котором получается 3 ATP, так как производительность сукцинатдегидрогеназы, ее число оборотов, выше.

Рисунок 20 - Пространственная структура комплекса II (по Nelson, Cox, 2005)
Комплекс III: цитохромы bc1
Структура комплекса III также недавно расшифрована (Рис.21). Это димер из двух мономеров по 250 кДа, каждый из которых состоит из 11 полипептидных цепей. Сердцевину комплекса образуют три белка: цитохром b с двумя гемами bH и bL - высоко- и низкопотенциальным, железо-серный белок Риске с (Fe2-S2)-центром и цитохром с1 со своим гемом. Комплекс имеет два отдельных центра связывания CoQ, расположенных ближе к внутренней и наружной стороне ВММ: QN и QP, соответственно. Для работы этого комплекса существенна его димерная структура. Поверхность между мономерами образует два кармана, в каждом из которых помещается QN из одного мономера и QP из другого. Предполагается, что CoQ движется в пределах этих карманов. Комплекс цитохромов bc1 может находиться в двух конформациях. В одной Fe2S2 центр находится близко к цитохрому с1, получающему от него электроны, но далеко от сайта связывания CoQH2, поставляющего ему электроны, и от цитохрома b. В другой - Fe2S2 центр перемещается от цитохрома с1 к цитохрому b.
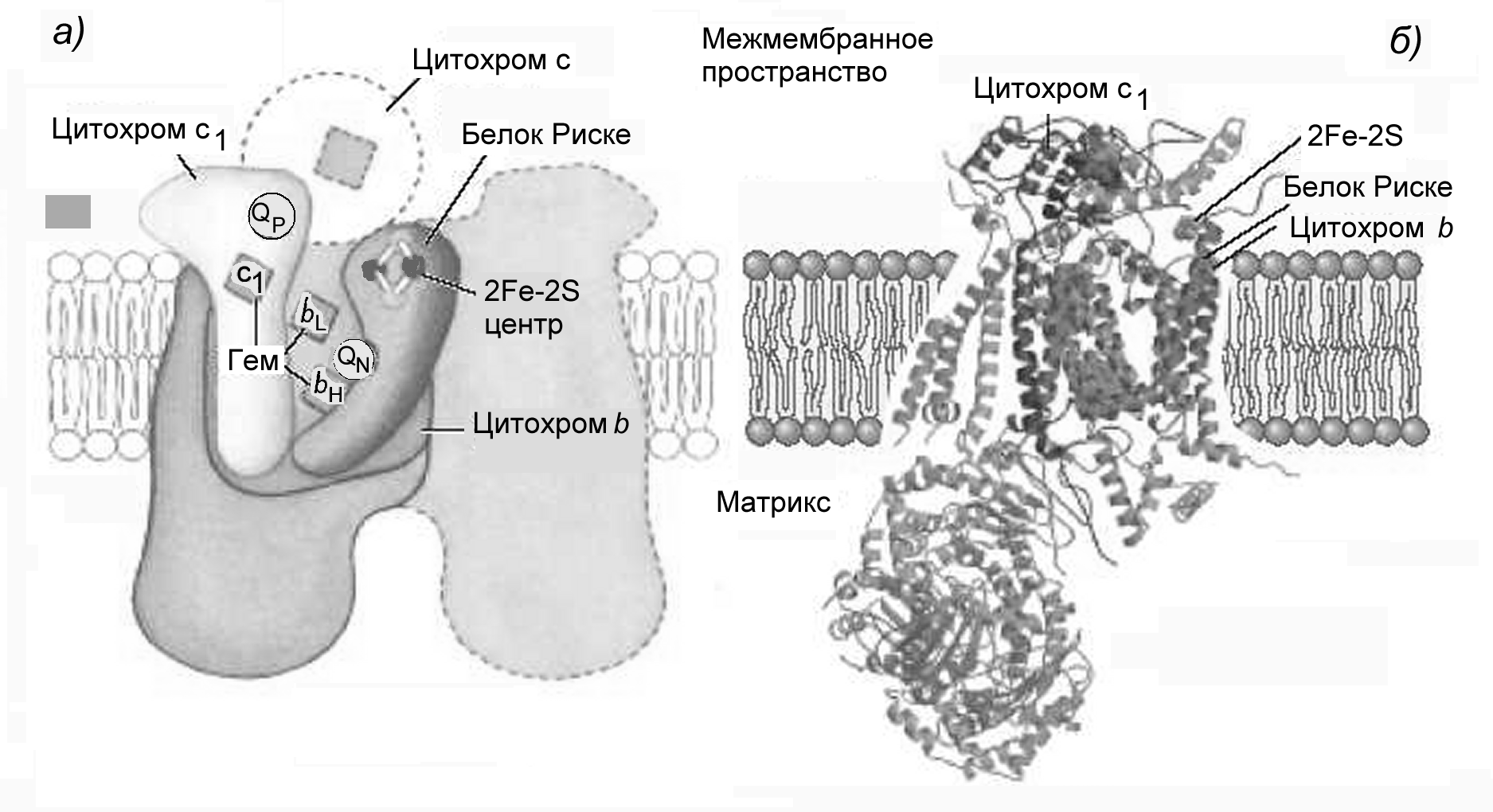
Рисунок 21 - Структура комплекса III (цитохромы bc1). (а) схема строения; (б) третичная структура (по Nelson, Cox, 2005)
Цитохромы и (Fe-S) центры могут переносить одновременно только один электрон, а каждая молекула NADH отдает 2 электрона. Для синтеза одной молекулы воды необходимо сразу 4 электрона. Для согласования различий в числе переносимых электронов в электронтранспортной цепи есть коллекторы, собирающие и распределяющие электроны. Ими являются КоQ и цитохром с. Они не находятся в стехиометрическом соответствии, а образуют пулы подвижных переносчиков, в которых электроны собираются, а при необходимости распределяются между акцепторами.
Цитохром с - небольшой белок из 104-109 аминокислот (у разных организмов) с молекулярной массой около 13 кДа, адсорбированный на внешней поверхности внутренней митохондриальной мембраны, где он фиксируется особыми липидами кардиолипинами. Это подвижный переносчик, мигрирующий по поверхности мембраны и переносящий по одному электрону от комплекса III к комплексу IV. Благодаря положительным зарядам на своей поверхности (19 лизинов), он электростатически притягивается к цитохромоксидазе, несущей на поверхности отрицательные заряды, что может способствовать их сближению и переносу электрона на более низкие орбитали гема цитохромоксидазы.
Комплекс IV - цитохромоксидаза
Комплекс IV, или комплекс цитохромов (а+а3), также называемый цитохромоксидазой состоит из 13 белков с общей молекулярной массой 204 кДа (Рис.22). Главную роль в нем играют три субъединицы. Субъединица I содержит два гема, а и а3, и атом меди CuB, который вместе с атомом железа из гема a3 образует биметаллический центр Fe-Cu. Атомы меди способны изменять валентность: Cu2+ Cu+ . Они обуславливают способность цитохромоксидазы поглощать красный свет (600-630 нм). Субъединица II содержит еще два атома меди, связанных с серой, наподобие того, как железо связано с серой в Fe2S2 центре. Они образуют двухядерный центр CuA, расположенный в межмембранной пространстве, на наружной стороне внутренней митохондриальной мембраны вблизи от центра связывания цитохрома с. Функции субъединицы III пока не ясны.
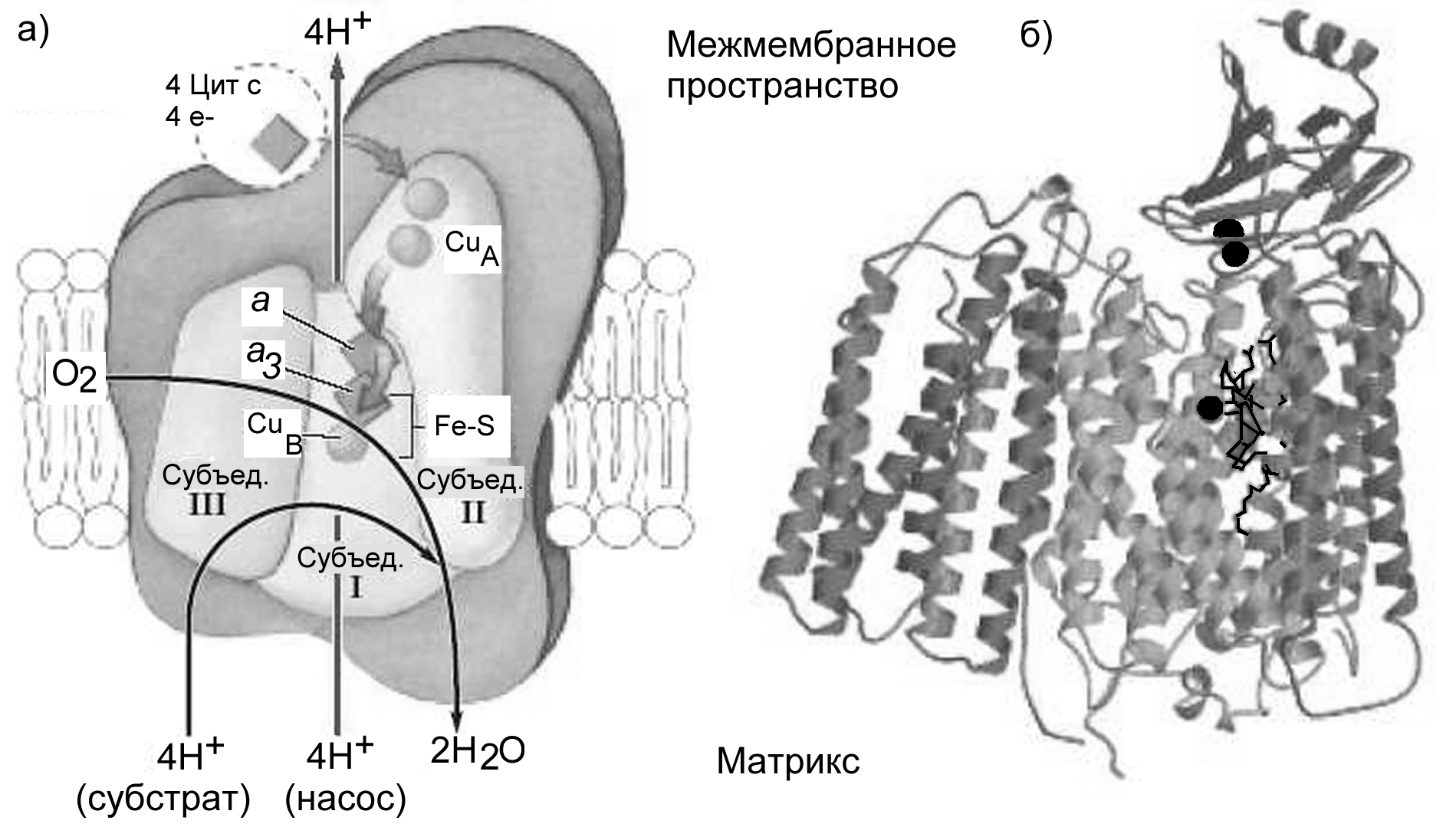
Рисунок 22 - Комплекс IV - цитохромоксидаза. (а) схема строения; (б) третичная структура. Атомы меди показаны в виде черных шариков, черными линиями обозначено положение гема а3 (по Nelson, Cox, 2005)
Роль цитохромоксидазы особенно важна: она непосредственно взаимодействует с молекулярным кислородом и осуществляет синтез воды:
4Н+ + 4е + О2 2Н2О.
Для полного восстановления кислорода и синтеза воды необходимы 4 электрона и 4 протона. Протоны берутся из воды, а электроны по одному передаются на цитохромоксидазу от цитохрома с. Поэтому необходимо удерживать молекулу кислорода и приходящие электроны и протоны до тех пор, пока они не соберутся вместе. Еще одна проблема состоит в том, что при переносе электронов на кислород может образоваться очень активный супероксид-анион, О2, окисляющий и повреждающий разные биомолекулы. Это предотвращается тем, что кислород, получающий электроны, крепко зафиксирован в биметаллическом центре между атомами Fe и Cu (Рис.23). Предполагается, что четыре молекулы цитохрома с передают по одному электрону на двухядерный центр CuA., а затем через гем а - на биметаллический центр Fe-Cu. При этом сначала на биметаллический центр по одному поступают два электрона и восстанавливают ионы Fe3+ и Cu2+ до Fe2+ и Cu+. Затем молекула кислорода фиксируется между этими ионами, и оба электрона переносятся от атомов железа и меди на кислород. Ввиду очень большого сродства кислорода к электронам на этом этапе выделяется значительная доля энергии. Затем на кислород передаются два протона и третий электрон, и образуется одна молекула воды. При подаче четвертого электрона и двух протонов на оставшийся атом кислорода, связанный с Fe2+, образуется вторая молекула воды (Рис.21). На этот процесс расходуется более 90% потребляемого клетками кислорода.
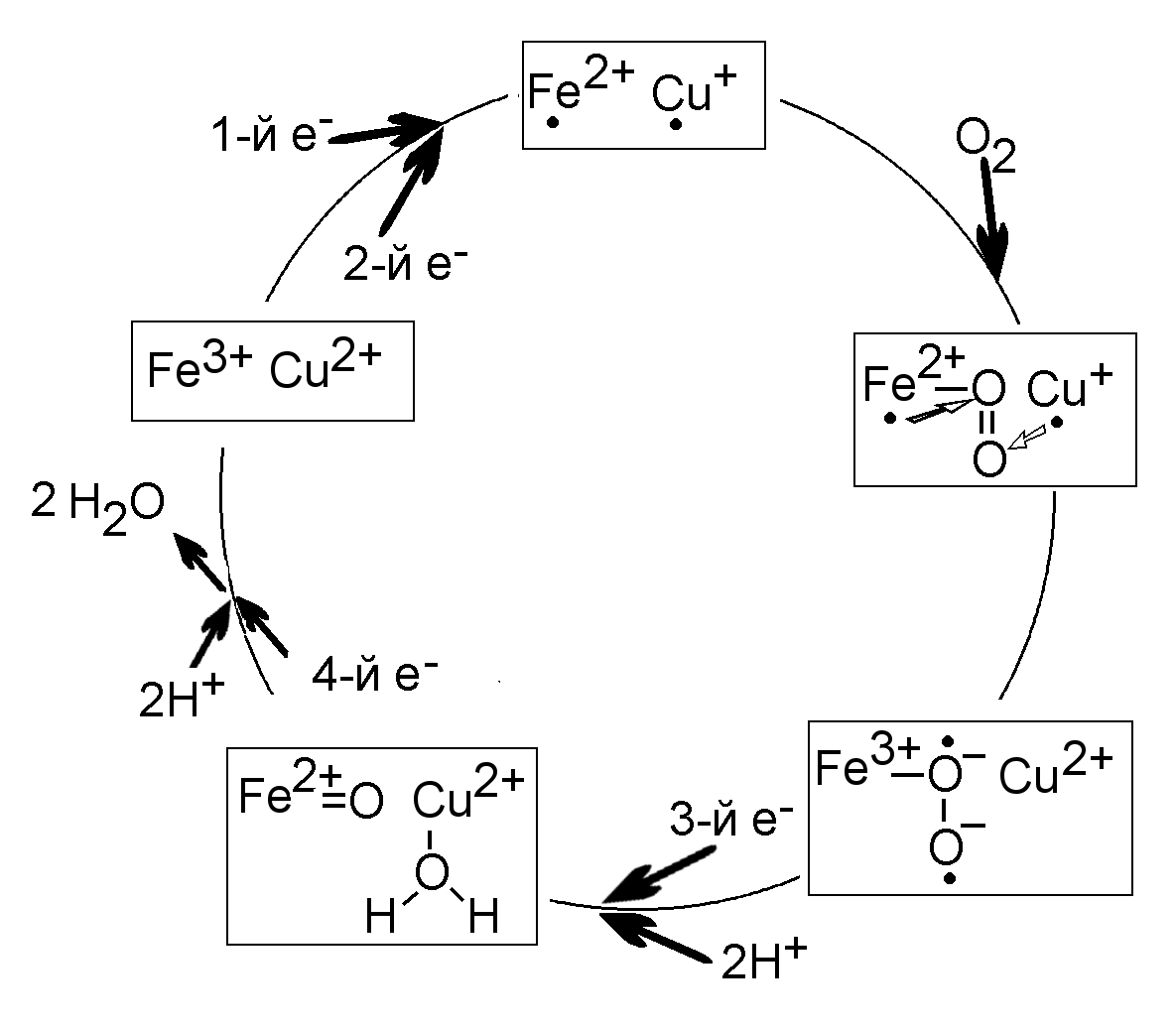
Рис.23. Синтез воды цитохромоксидазой: предполагаемый цикл работы. Большие точки обозначают электроны.
Надо отметить, что в течение одного цикла цитохромоксидазный комплекс потребляет не 4, а 8 протонов. Четыре из них идут на синтез двух молекул воды, а остальные переносятся через митохондриальную мембрану, создавая протонный градиент. Механизм переноса протонов в комплексе IV пока не известен. Суммарная реакция, осуществляемая комплексом IV:
4 Цит. с (восст.) + 8 Н+N + O2 4 Цит. с (окисл.) + 4 HP+ + 2 H2O
Физические механизмы переноса электронов в ЦЭТ
Каков физический механизм переноса электрона по цепи электронного транспорта с фиксированными переносчиками? Возможно два механизма переноса электрона из одной ямы во вторую: над- и подбарьерный (Рис. 24):
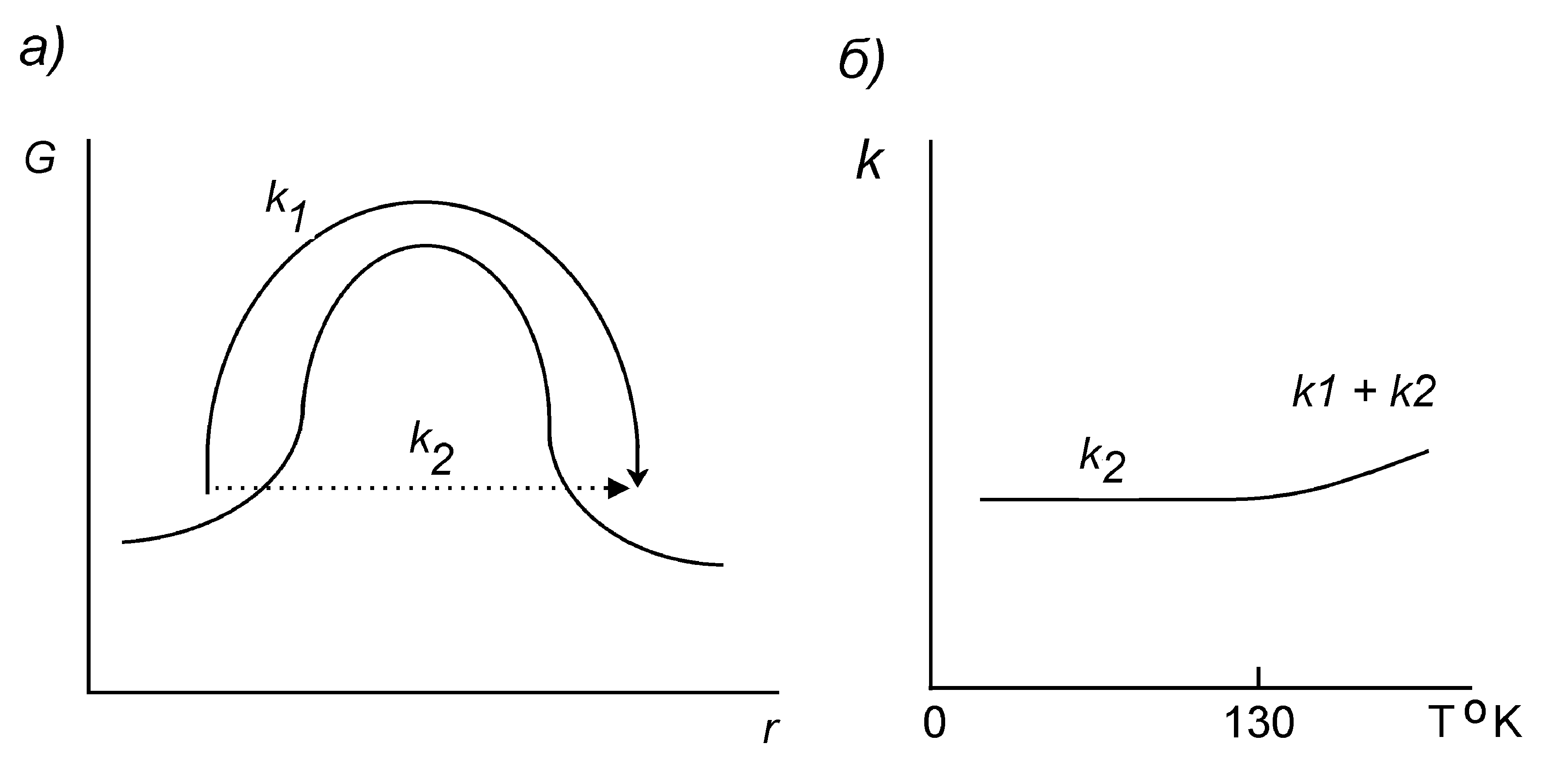
Рисунок 24 - Над- и подбарьерный переходы (а) и зависимость константы скорости переноса электронов в хлоропластах k (отн. ед.) от температуры (б)
1) Надбарьерный переход с константой скорости k1 описывается формулой Эйринга:
k1 = exp(),
где k - постоянная Больцмана, h – постоянная Планка, R - универсальная газовая постоянная, G – высота потенциального барьера.
2) Туннельный, или подбарьерный перенос, описывается формулой Гамова с константой скорости k2:
,
где: k2 - число переходов в единицу времени [c -1]; - частота столкновений электрона с барьером. Ее можно оценить из частоты осцилляций электронов: ~1017 с-1; L - ширина барьера; me - масса электрона; U – высота барьера; а E1 - энергия электрона в первой яме.
Экспериментально обнаружено, что в ЦЭТ хлоропластов, устроенной аналогично ЦЭТ митохондрий, заметный перенос электронов между отдельными центрами-переносчиками происходит даже при 4о К, причем скорость переноса не зависит от температуры вплоть до 130о К. Даже при комнатной температуре вероятность туннельного переноса k2 на порядок превосходит вероятность надбарьерного переноса k1 (Рис.24). Это позволило предположить, что перенос электронов происходит главным образом путем туннелирования между донорно-акцепторными группами переносчиков, в которых электроны находятся в потенциальных ямах, разделенных сравнительно высокими и широкими потенциальными барьерами. Для такой системы выполняются условия квазиклассического приближения, когда барьер достаточно высок и его параметры мало зависят от наличия переносимого электрона. Считается, что правая и левая ямы не взаимодействуют, т.е. присутствие электрона в одной яме практически не влияет на состояние другого центра, т.е. на положение атомных ядер и на параметры барьера. И действительно, электронные (оптические) спектры поглощения молекул-переносчиков не изменяются при изменении редокс-состояния соседей. Поэтому можно считать, что в каждом центре электрон находится в самосогласованном поле ядер и других электронов и аппроксимировать такое поле потенциальным профилем, представленным на Рис. 25.
Рисунок 25 - Две несимметричные потенциальные ямы, разделенные потенциальным барьером
Физически донорно-акцепторные группы представляют собой атомы металлов с переменной валентностью (Fe2+ Fe3+) или коферменты, обладающие системой сопряженных связей, в которой делокализованы -электроны. Они легко присоединяют и отдают электроны. Эти "проводящие" группы отделены друг от друга диэлектрическими молекулами белков и липидов, образующими потенциальные барьеры. В ЦЭТ переносчики плотно упакованы и мало подвижны друг относительно друга. В такой системе можно описывать волновой функцией только движение электрона, полагая, что ядра и остальные электроны создают потенциальный рельеф.
Для митохондриальной ЦЭТ можно следующим образом оценить величины, входящие в формулу Гамова. Ширина барьера L для переносчиков ЦЭТ примерно равна как двойному радиусу глобулы белка-переносчика - около 2 нм. Разницу (U-E1) можно оценить из спектров поглощения света молекулами переносчиков. Это величина порядка 1-2 eV.
Поведение электрона в системе из двух потенциальных ям зависит от разности электронных уровней в них: E=E1-E2 и от резонансного расщепления Er, возникающего при равенстве энергий E1=E2 за счет взаимодействия электронных уровней:
где: Е=Е1=Е2 - энергия резонанса при одинаковых уровнях в потенциальных ямах 1 и 2. При E >>Er переход не происходит. Условие туннелирования: E 0,1 0,06 eV. При E < Er возникают квантово-механические осцилляции электрона между ямами с периодом Tr=4h/Er. Электрон будет с одинаковой вероятностью переходить слева направо и наоборот. Электронная плотность будет в среднем равномерно распределена между ямами, т.е. электрон будет делокализован. Направленное движение электрона осуществляется, если электроны будут все время поступать в левую яму, а из правой – уходить.
На некоторых участках ЦЭТ разность электронных уровней переносчиков меньше 0,1 eV, но на других, особенно тех, где осуществляется сопряжение переноса электронов с переносом протонов, E > 0,5 eV; это следует из измерений окислительно-восстановительных потенциалов, которые всегда соответствуют равновесным конформациям. В этом случае, казалось бы, туннелирование электронов маловероятно. Но сближение уровней возможно в результате релаксационных конформационных перестроек.
Как осуществляется сближение уровней Е1 и Е2 в реальных системах? Его могло бы обеспечить возбуждение колебательных подуровней, т.е. некоторая диссипация энергии, обеспечивающая подгонку электронных уровней и компенсацию энергетического дисбаланса. Колебания атомов в сложных молекулах образуют почти сплошной спектр. Так, у бензола плотность колебательных подуровней 104 1/eV, а у белков еще больше. Но перенос электрона в белках способен возбудить не любые колебательные степени свободы, а только "сильно сопряженные" с перемещением заряда. Лишь некоторые группы в молекулах белков-переносчиков способны перемещаться под влиянием движущегося электрона. То есть в данном случае колебательный спектр дискретен. Иными словами, при переносе электрона возбуждаются электроно-конформационные переходы в белковой части молекул между дискретными пространственно-энергетическими состояниями, и именно они способствуют сближению энергетических уровней электрона в обеих ямах с точностью до 0,1 eV.
Туннелирование электронов на расстояния 1-2 нм происходит за короткое время порядка 10-7 -10-6 сек, а конформационные переходы в молекуле белка - за 10-3-10-1сек. Именно медленные релаксационные конформационные превращения левого белка-переносчика после прихода на него электрона обеспечивают подгонку уровней в этой яме к уровням в правой яме, куда надлежит перенести электрон. Для туннелирования требуется не столько совпадение электронных уровней донора и акцептора в равновесных конформациях, сколько наличие виртуального электронного уровня донора электронов в восстановленной конформации (с электроном), равного одному из равновесных уровней акцептора в окисленном состоянии (без электрона). Когда электрон поступает на донор в левой яме, вследствие электроно-конформационного взаимодействия левый белок начинает претерпевать конформационные превращения, при которых смещаются все электронные уровни в левой яме. Когда в ходе этого конформационного превращения эти уровни совпадут с уровнями акцептора электронов в правой яме, произойдет туннелирование электрона. При этом энергия, выделяющаяся в ходе медленного конформационного превращения, может быть использована для выполнения полезной работы по переносу протонов и, в дальнейшем, по синтезу ATP. После ухода электрона левый белок начинает релаксировать в исходное состояние, а правый, в свою очередь, претерпевать конформационные переходы. Эти процессы приводят к рассогласованию уровней, и обратное туннелирование электронов оказывается невозможным. Зато при этом могут совпасть электронные уровни во второй и третьей ямах, и электрон будет туннелироваться дальше по цепи.
Следует отметить, что перенос электронов происходит не по прямой между донором и акцептором, а вдоль более сложного пути - "электронной тропы", на которой потенциальный барьер ниже, отклонению электрона с "тропы" препятствует резкое повышение потенциального барьера, как на трассе бобслея. Участками "электронных троп" могут быть -спиральные участки, ароматические группы с сопряженными связями и делокализацией электронов.
Кинетическая схема переноса электронов в ЦЭТ с указанием времени полуокисления (в мс):
750 800 80 5 2,5 0,5 0,4
NADH ФМН b c1 c a a3 O2
показывает ускорение электронного потока по мере приближения к конечному звену, особенно после цитохрома с1. Если в клетках достаточно кислорода, то все цитохромы почти все время находятся в окисленном состоянии (без электронов).
В стационарном состоянии скорость потока электронов в ЦЭТ митохондрий 10-100 электронов в секунду.
Рекомендуемая литература
- Скулачев В.П. Энергетика биологических мембран. М. Наука, 1989.
- Албертс Б. и др. Молекулярная биология клетки. 2 изд. М. Мир, 1994.
- Самойлов В.О. Медицинская биофизика. Санкт-Петербург, Спецлит, 2004.
- Рубин А.Б. Биофизика, т. 2. М., Изд. МГУ, 2000, 2004.
- Alberts B. et al. Molecular Cell Biology. 4-th edition. Garland Science. New York, 2002.
- Nelson D. L., Cox M. M. Lehninger Principles of Biochemistry, Fourth Edition, W.H. Freeman & Company; 2005.
- Berg J. M., Tymoczko J.L., Stryer L. Biochemistry, Fifth Edition. W.H. Freeman & Company; 2002.
1 Подробнее эти процессы описаны в учебниках по биохимии.
E1
E2
U
E
Преобразование энергии в клетке.