KIMYONING ASOSIY TUSHUNCHALARIGA OID MASALALAR YECHISH
O’zbekiston respublikasi oliy
va o’rta maxsus ta’lim vazirligi
buxoro davlat universiteti
kimyo –biologiya fakulteti
umumiy kimyo kafedrasi
5 440400 –kimyo ta’lim yo’nalishi
1 kurs 1A guruh talabasi Аbdiyev Behzodning
noorganik kimyo fanidan
«KIMYONING ASOSIY TUSHUNCHALARIGA
OID MASALALAR YECHISH » mavusida yozgan
REFERATi
buxorO –10
REJA
- Modda. Oddiy va murakkab modda.
- Modda, oddiy va murakkab modda tushunchalari tavsifi
- Modda, oddiy va murakkab moddalarga doir mashq va masalalar yechich namunalari
- Molekula va atom. Kimyoviy element.
- Molekula, atom va kimyoviy element tushunchalari tavsifi va ularga misollar
- Valentlik va oksidlanish darajasi.
- Valentlik va oksidlanish darajasi tushunchalari tavsifi
- Valentlik va oksidlanish darajasiga doir mashq va masalalar yechich namunalari
- Molekulyar yoki molyar massa. Mol.
- Molekulyar yoki molyar massa va mol tushunchalari tavsifi
- Mol, molekulyar yoki molyar massaga doir mashq va masalalar yechich namunalari
Masalalar
Xulosalar
Masalalarning javoblari
Adabiyotlar
- Modda. Oddiy va murakkab modda.
1.1. Modda, oddiy va murakkab modda tushunchalari tavsifi
Tabiiy fanlardagi «Jismlar, moddalar va tabiat hodisalari» mauzusida jonli va jonsiz tabiatdagi narsalar jism deb atalishini, shu jismlar uch xil (qattiq, suyuq va gaz) holatda bo’lishi, ayniqsa biologiya fanlarida “Urug’ning tarkibi” mavzusida o’simlik organizmida organik va mineral moddalar, xususan, kraxmal, oqsil va yog’moddalar bo’lishi, shuningdek fizika fanidagi “Jism, modda, materiya” mavzusida fizik jismning tarkibini tashkil etgan narsa modda deyilishi hammaga ma’lum.
Dastlab “modda” va “jism” tushunchalarini bir-biridan farqlab olish lozim. Buning uchun atrofga nazar tashlash kifoya. Masalan, turmushda har kuni foydalaniladigan pichoq, egov, o’roq, ketmon, mix, tesha, bolta, mashina, traktorlarning ko’pchilik qismlari, qurilishda va sanoatda ishlatiladigan trubalar, armatura va hokazolar nimadan qilingan deb so’rashsa, shu zahoti temirdan deb javob berish mumkin. Bu yerda nomlari tilga olingan hamma buyumlar jismlar bo’lib, ularning tarkibi temir moddasidan iborat ekanligini tushunib olish oson.
Shunday qilib jismlarning tarkibini tashkil qilgan narsalar moddalar deyiladi
Hozirgi kunda tabiatda topilgan va sun’iy tarzda olingan sof moddalarning soni 10 mln.dan ortiq. Ularning har biri boshqa moddalardan o’zining xossalari bilan farq qiladi.
Odatdagi sharoitda fizikaviy va kimyoviy xossalari o’zgarmaydigan moddalar sof (toza) moddalar deyiladi. Moddalar tabiatda sof holda juda kam uchrab, asosan aralashmalar holida uchraydi.
Aralashmalar ulardagi moddalar zarrachalarining katta-kichikligiga qarab bir jinsli va bir jinsli bo’lmagan aralashmalarga bo’linadi. Aralashmalar hamda sof (toza) moddalarning barchasi ham ikki asosiy tipga bo’linadi: oddiy va murakkab moddalar.
Oddiy va murakkab modda tushunchalari o’z-o’zidan korsatib turibdiki ular moddalar tarkibining oddiy va murakkabligi bilan farq qiladi.
Bir xil element atomlaridan tashkil topgan moddalar - oddiy moddalar deyiladi. Masalan mis metali, yoki havodagi kislorod. Bunday misollardan ko’plab keltirish mumkin.
Har xil elementlar atomlaridan tashkil topgan moddalar -murakkab moddalar deyiladi. Masalan oddiy iste’mol qilayatgan suvimizni olaylik. Suv tarkibi kislorod va vodorod elementlaridan tashkil topgan.
1.2. Modda, oddiy va murakkab moddalarga doir mashq va masalalar yechich namunalari
1. Quyidagi ro’yxatda keltirilganlardan qaysi biri jism, qaysi biri modda ekanligini alohida yozib chiqing: mis, piyola, qaychi, temir, suv, oyna, oltingugurt, yog’och, cho’mich, chelak, sirka, pichoq, osh tuzi, kraxmal, antenna.
Yechish. Bu keltirilganlardan sof modda holda quyidagilarni ko’rsatish mumkin: mis, temir, suv, oltingugurt, osh tuzi, kraxmal. Bular-ning o’zi ham oddiy va murakkab moddalarga bo’linadi. Bulardan –mis, temir, oltingugurt oddiy moddalar. Qolganlari esa murakkab moddalardir.
Jismlarga keladigan bo’lsak yuqoridagilardan –piyola, qaychi, oyna, yog’och, cho’mich, chelak, pichoq, antenna oddiy va murakkab moddalarning aralashmasi yani aralashmalardir.
2. Quyidagilarga misollar keltiring: a) sof oddiy modda; b) sof murakkab modda; c) oddiy moddalar aralashmasi; d) murakkab moddalar aralashmasi.
Yechish. a) sof oddiy modda –alyminiy metali, olmos, geliy gazi;
b) sof murakkab modda – suv, ichimlik sodasi, ammoniyli seltra;
c) oddiy moddalar aralashmasi – havo, kumushli yoki oltinli qotishmalar;
d) murakkab moddalar aralashmasi –barcha jismlar misol bo’la oladi.
II. Molekula va atom. Kimyoviy element
2.1. Molekula, atom va kimyoviy element tushunchalari tavsifi
va ularga misollar
Molekula va atomlar haqidagi tasavvurlarning shakllanishi mashhur ingliz kimyogari R.Boyl (1627 –y), rus olimi M.V.Lomonosov (1711 –y), ingliz kimyogarlari J. Dalton (1776 –y) va J.Pristli (1733 – 1804 y), italyan olimi A.Avagadro (1776 –y) nomlari bilan bog’liq. Ular kimyo tarixida birinchi bor molekula va atomlarning moddiy zarrachalar sifatida mavjudligini, ularning tabiati va xilma –xillik sabablarini tajriba yo’li bilan isbotlab berdilar.
Atrofimizda mavjud bo’lgan moddalar va ulardan tashkil topgan jismlar nima uchun xilma –xil? Ular xossalar jihatdan bir –biridan farq qilishi-ning sababi nimada? Nima uchun bir xil moddalarning kimyoviy o’zgarishi uchun bir xil, boshqa xil moddalarning shunday o’zgarishi uchun boshqa xil sharoit kerak? Bu savollarga moddaning tarkibini bilmasdan javob berish qiyin.
Qattiq muzning suyuq suvga aylanishi, suyuq suvning isiganida bug’lanishi, suv bug’i yozning issiq kunlarida ko’zga ko’rinmasligi, kuz paytida daryolar, ko’llar va zovurlar suvi ustida bug’, tuman paydo bo’lishi va boshqa omillar suvning ko’zga ko’rinmaydigan juda mayda zarrachalar –molekulalardan tashkil topganligi haqida dalolat beradi.
1 –misol. Qoramtir –pushti rangli kaliy permanganat tuzi kristallari suvda eritilib tomoqni chayqash, yaralarni yuvish uchun qo’llanishini bilamiz. Demak, bu qattiq modda suvda eritilganda uning zarrachalari (molekulalari) butun eritma hajmiga tarqalib, uni pushti rangga bo’yaydi. Shu eritmani sekin bug’latib, qaytadan qattiq modda olish mumkin. Tuz eriganda uning molekulasi boshqa modda molekulasiga aylanmaydi.
Bunday tajribani osh tuzi va shakar bilan ham o’tkazish mumkin. Xulosa qilib aytganda: Moddaning xossalarini o’zida saqlaydigan uning eng mayda zarrachasi molekula deyiladi. Fizikaviy hodisalar paytida modda molekulasi o’z xossalarini saqlab qoladi, chunki u boshqa moddaga aylanmaydi.
Atom tushunchasini izohlash uchun oddiy bir suv parchalanishini misol olsak bo’ladi.
2-misol. Suv molekulasi elektr toki ta’sirida parchalanganda dastlab kislorod va vodorod atomlari hosil bo’ladi. Ammo hosil bo’lgan ikkita bir xil atomlar darhol o’zaro birikib, vodorod bilan kislorod molekulalarini hosil qiladi. Kislorod bilan vodorod atomlari kimyoviy reaksiyalar paytida o’zidan kichikroq zarrachalarga bo’linmaydi.
Atomlar –moddalarning kimyoviy jihatdan bo’linmaydigan eng mayda zarrachalaridir.
Shunday qilib, atomlar kimyoviy reaksiyalar paytida boshqa atomga aylanmaydi. Yadro reaksiyalari deb nomlangan reaksiyalar paytida esa bir xil atom boshqa xil atomga aylanishi mumkin.
Shuningdek ingliz kimyogari Robert Boyl fanga birinchi bor “Kimyo viy element” tushunchasini kiritdi. R.Boylning fikriga ko’ra kimyoviy element moddaning shunday tarkibiy qismiki, uni kimyoviy reaksiyalar paytida yana ham kichikroq oddiy moddalarga parchalab bo’lmaydi.
Keyinchalik boshqa ingliz olimi J.Dalton kimyoviy element atomlarning ma’lum bir turi, bir element atomlari bir xil bo’ladi, har xil elementlarining atomlari massasi jiharidan bir-biridan farq qiladi. Degan xulosalarni aytdi. Shu tariqa u kimyoviy element haqidagi tushunchalarni atom-molekulyar ta’limot bilan uyg’unlashtirdi.
Kimyoviy element haqidagi yana ham oydinlashtirish uchun misollarga murojaat etamiz.
3 –misol. Tadqiqotlar 12 g uglerodda 6,021023 dona uglerod atomi borligini ko’rsatdi. Uning har bir atomi yadrosida 6 ta proton bo’lib, ular atomning yadro zaryadini ifodalaydi.
Uglerod atomlarining hammasida yadro zaryadi bir xil bo’ladi. Shunga asoslanib kimyoviy elementga qiyidagicha ta’rif berish mumkin:
Yadro zaryadlari bir xil bo’lgan atomlarning muayyan turi kimyo- viy element deyiladi.
Hozirgi kunda yadro zaryadlari bir xil bo’lgan elementlarning 110 turi ma’lum bo’lib, ulardan yaxshi o’rganilgan 105 tasi jadvalga kiritilgan.
«Kimyoviy element» va «modda» tushunchalari orasidagi bog’liqlik. Hozirgacha biz bir qator moddalar: vodorod, kislorod, uglerod, suv, karbonat angidrid, temir, oltingugurt va boshqalar haqidagi fikr yuritdik hamda har bir moddani o’z nomi bilan atadik. Sanab o’tilgan moddalarning ayrimlarining tarkibi bir xil element atomlaridan (masalan kislorod moddasining tarkibi shu nomdagi elemnt atomlaridan), boshqalari-ning tarkibi har xil elementlarning atomlaridan (masalan, suv moddasi kislorod bilan vodorod elementlarining atomlaridan) tashkil topgan bo’ladi. “Atom”, “kimyoviy element” va “modda” tushunchalari mazmu-nini tahlil qilib quyi dagi xulosalarni chiqarish mumkin:
a) atom –kimyoviy elementning tarkibiy qismi;
b) kimyoviy element –moddaning tarkibiy qismi;
v) ba’zi moddalar – bir xil modda elemet atomlaridan tashkil topgan bo’ladi.
III. Valentlik va oksidlanish darajasi
3.1. Valentlik va oksidlanish darajasi tushunchalari tavsifi
Ikki element o’zaro birikib ikki yoki undan ortiq xil murakkab moddalarni hosil qilganda shu ikki elementning har bir modda molekulasidagi massa nisbati har xil bo’ladi.
Uglerodning is gazi va karbonat angidrid deb atalgan oksidlari mavjud. Ularning molekula formulasi CO va CO2. Atomlarning massa nisbatlari CO da 12:16 yoki 3:4, CO2 da esa 12:32 yoki 3:8. Demak, moddaning tarkibidagi elementlarning miqdoriy tavsifini faqat massalar nisbati orqali o’rganish hamma vaqt ham qo’l kelavermaydi.
Moddalar molekulasidagi elementlarning miqdoriy nisbatlarini bir- muncha qulay ifodalash maqsadida 1853 yilda ingliz kimyogari Eduard Franklend kimyo faniga “valentlik” tushunchasini kiritdi.
“Valentlik” so’zi o’zbekcha tarjima qilinsa “kuch” ma’nosini bildiradi. Fizika kursidan ma’lumki, kuch –o’zaro ta’sir va bog’lanish demakdir. Shunday ekan, kuch har qanday moddiy zarrachaning boshqa moddiy zarracha bilan o’zaro ta’siri va bog’lanishini ifodalab beradigan xossasidir.
Valentlik biron kimyoviy element atomining boshqa element atomlaridan muayyan sondagisini biriktirib olish xossasidir.
Vodorod birikmalarida hamma vaqt bir valentli bo’ladi. Shu tufayli vodorod atomining valentligi “valentlik birligi” sifatida qabul qilingan. Vodorod bilan birikma hosil qilgan boshqa elementlarning valentligi vodorod atomlarining soniga qarab aniqlanadi.
Masalan HCl (vodorod xlorid), H2O (suv), NH3 (ammiak), CH4 (metan) misollarida buni yaqqol ko’rish mumkin. Demak ikki elementdan tashkil topgan murakkab moddalar molekulasidagi elementlar valentliklarining umumiy soni o’zaro teng bo’ladi. Birikmalarda elementlar xlor, kislorod, azot, uglerod valentliklari tegishlicha 1, 2, 3 va 4.
CO va CO2 misolida ikkita element atomi o’zaro birikib, ikki yoki undan ortiq xil sof moddalarni hosil qilishini ko’rish mumkin. Demak elementlar o’z birikmalarida o’zgarmas va o’zgaruvchan valentlikni namoyon qilishi mumkin.
O’zgaruvchan valentli elementlarning qanday valentlik namoyon qi-lishi kimyoviy reaksiya borayotgan sharoitga bevosita bog’liq.
Ma’lumki elementlar birikib moddalarni hosil qilganda atomlarnig valentliklariga muvofiq birikadi. Bog’lanish esa o’z navbatida elektronlar ishtirokida amalga oshirilib valentlikni ham mana shu bog’lanish hosil qila olgan elektronlar belgilaydi.
Murakkab moddalar tarkibidagi atomlarning o’zaro bog’lanish tabiatini, ya’ni ulardagi elektronlarning kimyoviy bog’lanishda ishtirok etish darajasini ifodalash uchun “oksidlanish darajasi” deb ataladigan kattalik qabul qilingan.
Elementlar atomining birikmadagi oksidlanish darajasi kimyoviy bog’lanishda ishtirok etgan elektronlar soniga va ularning yadrolar o’rtasidagi taqsimotiga qarab -1 dan -4 gacha va +1 dan +8 gacha bo’lishi mumkin.
Oddiy moddalarda kimyoviy bog’lanishning tabiatidan qat’iy nazar, elementlar atomining oksidlanish darajasi “0” ga teng bo’ladi. Buning boisi shundaki, nisbiy elektromanfiyliklari bir xil bitta element atomlari-ning yadrolari o’rtasida elektronlar teng taqsimlangan bo’ladi.
Murakkab moddalarning hosil bo’lishida hamma vaqt ikki yoki undan ortiq element atomlari ishtirok etgani uchun ularning nisbiy elektromanfiyliklari bir xil bo’lmaydi. Shunga muvofiq, kimyoviy bog’lanish hosil bo’lishida ishtirok etgan elektronlar har xil elementlar atomi yadrolari o’rtasida teng taqsimlanmaganligi tufayli molekulalar turli darajada qutb- langan, yani elektron juftlar biror atomga tomon siljigan bo’ladi. Birikmalarda elementlarning oksidlanish darajasini uning atomidan boshqa atomga ko’chib otgan yoki qabul qilingan elektronlar soni belgilaydi.
3.2. Valentlik va oksidlanish darajasiga doir mashq va masalalar yechich namunalari
Mashq. Н2О2, Н2О, FeS2, HNO3, N2O, К4[Fe(CN)6] birikmalarida elementlar valentligini va oksidlanish darajasini aniqlang:
Н2О2 tuzilishi: Н –О –О –Н bo’lib, unda Н (+1) va har bir kislorod orasida ko’chib o’tishi bo’lmaganligi tufayli (kovalent bog’lanish) kislorod -1 oksidlanish darajasini namoyon qiladi. Demak, valentligi 2 bo’la turib, oksidlanish darajasi -1 (yani vodoroddan 1 ta ko’chib otganligi asbabli)ga teng. Н2О da esa vodorod +1 va kislorod 2 valentli hamda –oksidlanish darajasini namoyon qiladi.
Demak, ko’pgina birikmalarda valentli va oksidlanish darajalari bir xil qiymatga egaligi tufayli ularni doimo baravar deyishni Н2О2 kabi birikmalar inkor etadi.
FeS2 –temir kolchedani(pirit)da Fe 2 valentli, S ham 2 valentli va Fe (+2) oksidlanish darajasini, S эса (-1) oksidlanish darajasini namoyon qiladi. Xuddi Н2О2 dagidek holat kuzatiladi.
S
Fe
S
HNO3 va N2O tuzilishlarida quyidagilarni izoghlash mumkin:
O
H –O –N
O
N1 = N2 = O
Nitrat kislotadagi azotning oksidlanish darajasi (+5) va valentligi 4 ga teng. N2О da (N1) ning oksidlanish darajasi (0), valentligi 2; (N2) nuing esa oksidlanish darajasi (+2), valentligi 4 ga teng. Azot oksididdagi azotlarning oksidlanish darajasini o’rtacha olganda (+1) deb qabul qilish mumkin, chunki kislorod har bir azotdan 1 tadan qabul qiladi.
К4[Fe(CN)6] dagi elementlarni tahlil qilamiz:
N 4-
C
NC C N
Fe
NC C N
C
N
Ichki sferada Fe valentligi 2 ga teng lekin, kovalentligi 6 ga teng.
Fe ning oksidlanish darajasi (+2) ga teng , yani:
К (+1), СN (-1), Fe (+x)
4(+1) + x + 6(-1) = 0 x = 2 (+2)
IV. Molekulyar yoki molyar massa.
Mol
4.1. Molekulyar yoki molyar massa va mol tushunchalari tavsifi
Oddiy moddalarning massalari ham, murakkab moddalar molekulalarining massalari ham massaning atom birligida ifodalanadi. Oddiy yoki murakkab moddalarning nisbiy molekulyar massalari ularning molekula massalari massaning atom birligidan bir necha marta og’ir ekanligini ko’rsatadi.
Moddaning molekula formulasini bilgan holda uning nisbiy molekulyar massasini hisoblab topish mumkin. Buning uchun shu modda molekulasini tashkil qiladigan elementlar atomlarining nisbiy massalari jamlanadi. Misol tariqasida bitta oddiy modda (O2) va ikkita murakkab modda (CaO, NaHCO3) ning nisbiy molekula massalarini (Mr bilan belgilanadi) hisoblab ko’raylik.
Mr(O2) = Ar(O) + Ar(O) = 16+16= 32 m.a.b.
Mr(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 m.a.b.
Mr(NaHCO3) = Ar(Na) + Ar(H) + Ar(C) + 3Ar(O) = 23 + 1 +12+ 3x16 = 23 + 1 + 12 +48 = 84 m.a.b.
Moddalarning molekua massalarini massaning atom birligida ifodalash amaliy kimyo uchun noqulay. Shuning uchun “molekulyar massa” yoki “molyar massa”, “mol” va “gram-molekula” tushunchalaridan foydalaniladi.
Moddaning molyar massasi son jihatidan unung massaning atom birligida ifodalangan qiymatiga teng va M harfi bilan ifodalanadi. Mol esa modda miqdorini ifodalashning asosiy usuli bo’lib, bu 0,012 kg (12g) uglerodda nechta uglerod atomi bo’lsa, tarkibida shuncha zarrachalar (atomlar, molekulalar) bo’lgan moddaning miqdoridir. Boshqacha aytganda 12 g uglerodda 6,021023 dona uglerod atomi bo’lsa, boshqa mod-dalarning bir molida ham shuncha atom yoki molekula bo’ladi.
Moddaning mol miqdori (nyu ba’zan n bilan ham) belgisi bilan ifodalanadi. Uning qiymati moddaning biron massasi (m) ni uning molekula massasi (M) ga bo’lish bilan topiladi:
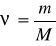 bundan
bundan 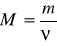 m = M
m = M
Moddaning bir mol miqdorining grammda ifodalangan massasi gram-mol (g-mol) deyiladi.
Masalan, Mr (CuO) = Ar(Cu) + Ar (O) = 64 + 16 = 80 m.a.b. Massaning atom birligi (1,6610-24g) grammda ifodalanganligi tufayli CuO ning mol massasi 80 massa atom birligiga, gram-moli esa 80 g ga teng bo’ladi.
4.2. Mol, molekulyar yoki molyar massaga doir mashq va masalalar yechich namunalari
1- masala. Quyidagi moddalarning nisbiy molekulyar massalarini hisoblang: Ca(OH)2, Na2SO4, Ba(NO3)2, H3PO4.
Yechish. Moddalarning nisbiy molekulyar massalarini hisoblaymiz:
Mr(Ca(OH)2) = Ar(Ca) + 2Ar(O) + 2Ar(H) = 40 + 2x16 + 2x1 =
40+ 32 + 2 = 74 m.a.b.
Mr(Na2SO4)= 2Ar(Na) + Ar(S) + 4Ar(O) = 2x23 + 32 + 4x16 =
+ 32 + 64 = 142 m.a.b.
Mr(Ba(NO3)2) = Ar(Ba) + 2Ar(N) + 6Ar(O) = 137 + 2x14 + 6x16 =
137 + 28 + 96 = 261 m.a.b.
Mr(H3PO4)= 3Ar(H) + Ar(P) + 4Ar(O) = 3x1 + 31 + 4x16 =
+ 31 + 64 = 98
2 –masala. 49 g sulfat kislota necha molni tashkil qilishini hisoblang.
Yechish. 1- usul. Moddaning nisbiy molekulyar massasini hisoblaymiz:
Mr(H2SO4)= 2Ar(H) + Ar(S) + 4Ar(O) = 2x1 + 32 + 4x16 =
+ 32 + 64 = 98 m.a.b.
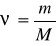 tenglamadan foydalanib 49 g sulfat kislota necha molni tashkil qilishini hisoblaymiz:
tenglamadan foydalanib 49 g sulfat kislota necha molni tashkil qilishini hisoblaymiz:
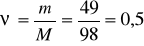 mol
mol
2 –usul. Masalani proporsiya usulida ham yechish mumkin.
Dastlab sulfat kislotaning nisbiy molekulyar massasini hisoblaymiz:
Mr(H2SO4)= 2Ar(H) + Ar(S) + 4Ar(O) = 2x1 + 32 + 4x16 =
2 + 32 + 64 = 98 m.a.b.
98 g H2SO4 ————mol
49 g H2SO4 ————x mol x=49g1mol/98g = 0,5 mol.
3 –masala. Gramm –mol massasi 80 g bo’lgan CuO ning 0,3 mol miqdori qancha gramm bo’ladi?
Dastlab sulfat kislotaning nisbiy molekulyar massasini hisoblaymiz:
Mr(CuO)= Ar(Cu) + Ar(O) = 64 + 16 = 80 m.a.b. yoki gramm/mol
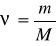 tenglamadan foydalanib mis oksidining massasini (m) hisoblaymiz:
tenglamadan foydalanib mis oksidining massasini (m) hisoblaymiz:
m= M = 0,3 mol 80 g/mol =24 gramm.
Masala va mashqlar
- Quyida keltirilgan nomlardan fizik jismlarning va kimyoviy moddalarning nomlarini ikkita ustunga alohida-alohida yozing: koptok, oltin, plastmassa, mix, mis, stakan, rezina, bo’r.
- Quyidagilardan: a) shishadan; b) alyuminiydan; v) rezinadan;
g) po’latdan tayyorlangan buyumlarga misollar keltiring.
- Agar osh tuzi bilan shakar hovonchaga solib alohida –alohida qo’yilsa, ikkala modda tashqi ko’rinishidan bir –biriga juda o’xshash bo’ladi. Ularni qanday xossalariga ko’ra bir –biridan farqlash mumkin? (Moddalarni totib ko’rish yaramaydi!)
- Po’lat, cho’yan va temirni qanday xossalariga ko’ra bir –biridan farqlash mumkin? Ulardan qanday buyumlar tayyorlanadi?
- Osh tuzi, ichimlik soda va tish poroshogi qaysi jihatdan o’xshash va xossalari bir – biridan qanday farq qiladi?
- Quyida ko’rsatilgan moddalar orasida kimyoviy toza (individual) moddalar bormi: a) namdan va changdan tozalangan havo;
b) filtrlangan daryo suvi; v)gazli suv? Javobingizni izohlab bering.
- Quyida ko’rsatilgan moddalardan qaysilari aralashmalar, qaysilari esa toza moddalar: a) granit; b) shakar; v) osh tuzi; g) distillangan suv?
- Kukun qilib tuyilgan quyidagi aralashmalarni qanday qilib tarkibiy qismlarga ajratish mumkin: a) bo’r va osh tuzi; b) qum, shakar va ko’mir?
- Uchta moddaning: mis qirindilari, qipiq va temir qirindisidan iborat aralashmani tarkibiy qismlarga ajratish rejasini tuzing.
- 5 g biror kukun qaynayotgan suvning kichik hajmida eritildi. Sovitilganda eritmadan 3 g kristall tushdi. Ular fitrlab olindi va yana shuncha hajmdagi qaynayotgan suvda eritildi; shundan keyin sovitilganda 2,9 g kristall tushdi. Dastlabki kukun toza modda bo’lganmi yoki aralashmami?
- 20 sm3 vodorod bilan 10 sm3 toza kislorodni aralashmasi portlatilganda 3 sm3 hajmda gaz qoldig’i qoldi. Vodorod toza bo’lganmi? Javobingizni izohlang.
- Tarkibida oltingugurt, temir kuporosi, mis (II) oksidi va temir qi-rindilari bor sun’iy aralashmadan individual moddalarni qanday ajratib olish mumkin? Javobingizni izohlab bering.
- Ham atom, ham molekula deb atash mumkin bo’lgan zarrachalarga misollar keltiring. Bu hollarda “molekula” degan tushuncha bilan “atom” degan tushuncha bir –biriga nima uchun mos keladi?
- Tabiatda qaysi elementlar ko’proq ma’lum: metallarmi yoki metalmaslarmi? 109 ta elementdan taxminan qanchasi metallar va qanchasi metalmaslarga kiradi?
- Metalni metalmasdan qaysi alomatlariga va xossalariga ko’ra farqlash mumkin? Ular orasida keskin chegara (farq) bormi?
- Ma’lumotnomalarda 100 g tuxum sarig’ida 8,6 mg temir bo’ladi de-yilgan. Bu yerda “temir” deganda oddiy moddani tushunish kerakmi yoki kimyoviy elementnimi?
- Simob (II) oksid murakkab modda ekanligini qanday isbotlash mumkin? U qaysi elementlarning atomlaridan tarkib topgan?
- Qaysi jumlada oddiy modda sifatidagi kislorod haqida gap boradi: a) baliq suv tarkibidagi kislorod bilan nafas oladi; b) kislorod ko’pchilik minerallar tarkibiga kiradi?
- Tarkibida kislorod bo’lishiga qaramay, qaynagan suvda baliq nima uchun nafas ololmaydi?
- Quyidagi modalardan qaysilari oddiy va qaysilari murakkab: tuz, suv, bo’r, oltingugurt, shakar, grafit, malaxit?
- Bo’r qizdirilganda so’ndirilmagan ohak bilan karbonat angidridga ajraladi. Bo’r qanday kimyoviy elementlardan tarkib topgan?
- Bir modda kislorodda yondirilganda karbonat angidrid, azot va zuv hosil bo’ladi. Bu shu modda tarkibida qanday kimyoviy elementlar borligidan dalolat beradi?
- Bitta oddiy moddadan boshqa oddiy modda hosil qilish mumkinmi? Yangi modda hosil bo’lganligining isboti sifatida qanday misollar keltirish mumkin?
- Quyidagi ko’rsatilgan moddalardan qaysilari oddiy va qaysilari murakkab moddalar: apatit, olmos, soda, kvars, ohak, temir, uran, kislorod, benzol, marmar, yoqut, parafin, polietilen.
- Bitta murakkab moddadan sifat va miqdoriy tarkibi xuddi shunday boshqa murakkab hosil qilish mumkinmi?
- Alkimyogarlar o’rta asrlarda bitta elemntni boshqa elementga, masalan, misni oltinga, simobni esa kumushga aylantirish uchun behuda uringan edilar. Bitta kimyoviy elementning boshqa kimyoviy elementga aylanishini bilasizmi?
- Quyidagilarning qaysi birining massasi katta: a) uglerod atominikimi yoki suv molekulasinikimil; b) suv molekulasinikimi yoki magniy ato- minikimi; v) yod atominikimi yoki kislorod molekulasinikimi?
- Azot molekulasining massasi krypton atomining massasidan necha marta kichik?
- Argon atomining massasi vodorod molekulasi massasidan necha marta katta?
- Quyidagi moddalarning nisbiy molekulyar massalarini hisoblab to-ping: a) karbonat angidrid; b) sulfat kislota; v) ichimlik soda; g) sirka kislota.
- Uglerod vodorod bilan reaksiyaga kirishganda nisbiy molekulyar massasi kislorodning nisbiy atom massasiga teng bo’lgan birikma hosil qiladi. Shu birikmaning formulasini yozing.
- Yer qobig’ida kislorod, kremniy, aluminiy va kalsiyning miqdori massa jihatidan tegishlicha 47,00 %, 29,50 %, 8,05 % va 2,96 % ga teng. Keltirilgan ma’lumotlarga asoslanib, bu elementlarni ularning hissasiga to’g’ri keladigan atomlar soniga qarab bir qatorga joylashtiring.
- Nisbiy molekulyar massalari ikkita birikmaning nisbiy molekulyar massalarining yig’indisidan iborat bo’lgan sizga ma’lum moddalarning nomini ayting.
- Azot bilan uglerodning nisbiy molekulyar massalari bir xil bo’lgan oksidlarining formulasini yozing.
- 0,5 mol uglerodda taxminan nechta atom bo’ladi?
- 0,25 mol temir nehcta atomga to’g’ri keladi?
- 2 mol misda nechta atom bo’lsihini hisoblab toping.
- Suv molekulalarining 10 mol moddaga to’g’ri keladigan sonini aniqlang.
- Moddaning miqdori 1,5 mol bo’lishi uchun karbonat angidrid CO2 molekulalaridan taxminan nechta olish kerak?
- Quyidagilarning qaysi birida moddaning massasi ko’p: a)1 mol alyuminiy atomlari; b) 1 mol temir atomlari; v) 1 mol simob atomlari?
- 4 mol uglerod atomlariga to’g’ri keladigan modda massasini hisoblab toping.
- 0,5 mol suv molekulalarining massasi qanchaga teng?
- Karbonat angidrid molekulalarining 1 molida taxminan nechta atom bo’ladi?
- Quyidagilarning qaysi birida moddaning massasi ko’p: a) 3 mol uglerod atomlari; b) 2,5 mol suv molekulalari; v) 2 mol karbonat angidrid molekulalari; g) 0,5 mol simob atomlari?
- Formulalari NH3, PH3, HCl, SiH4, H2S bo’lgan birikmalarda azot, fosfor, xlor, kremniy va oltingugurtning valentligi qanchaga teng?
- Formulalari ZnS, Cu2S, Al2S3, SnS2, P2S5 bo’lgan birikmalarda elementlarning valentligi qanchaga teng?
- Quyidagi birikmalarda: a)bir valentli; b)ikki valentli; v)uch valentli; g) to’rt valentli; d) besh valentli bo’lgan elementlarning nomini ayting. Na2O, HCl, PH3, Fe2O3, MgO, ZnO, CO2, P2O5, CaO.
- Quyidagi elementlarning vodorod bilan hosil qilgan birikmalarining formulalarini yozing: a) azot (III); b) kremniy (IV); v) oltingugurt (II); g) brom (I).
- Ksenon bir valentli ftor bilan hosil qilgan birikmalarida ikki, to’rt va olti valentli bo’ladi. Shu birikmalarning formulalarini yozing.
- Kremniyning kislorod bilan hosil qilgan birikmasida 16 g kislorodga 14 g kremniy to’g’ri keladi. Kremniyning nisbiy atom massasi 28. Shu birikmaning formulasi va undagi kremniyning valentligi qanday?
- Azot oksidlarining birida 16 g kislorodga 14 g, boshqa oksidda esa –7 g azot to’g’ri keladi. Azotning nisbiy atom massasi 14 bo’lsa, uning oksidlarida bu birukmalarining formulalari va ularda azotning valentligi qanday?
- Fosfor xlor bilan tarkibi PCl3 va PCl5 bo’lgan birikmalar hosil qiladi. Fosforning valentlik qiymatlari xlor bilan hosil qilgan birikmalaridagi kabi bo’ladigan oksidlarining formulalarini yozing.
- Quyidagi birikmalarda elementlar valentligini aniqlang: a) rux nitrat; b) alyuminiy sulfat; v) ammoniy dixromat; g) kalsiy gidroortofosfat.
xulosalar
Kimyoning asosiy tushunchalariga oid masalalar yechishda quyidagi
qoidalarga rioya qilish zarur degan xulosaga kelindi:
- Masalani yechishga kirishishdan oldin masala shartini qayta –qayta o’qish, va mantiqan mulohaza yuritish, nimalar ma’lum hamda nimalarni aniqlash lozimligini fikran belgilash kerak.
- Masala shartida qiymatlarni ifodalashda SI sistemasidagi birliklardan va qisqartmalardan foydalanish kerak.
- Kimyoning asosiy tushunchalariga oid masalalarni yechishga kirishishdan oldin uni shartiga ko’ra tahlil qilib, yechish usuli belgilab olinadi. Bunda mumkin qadar oson usulni tanlash zarur.
- Masalani ayni bir usul bilan yechgandan so’ng uning natijasini boshqa bir usul bilan tekshirib ko’rish kerak.
Masala va masqlarning javoblari
6. Yo’q. 8. a)suvda eritiladi, filtrlanadi va suvi bug’latib yuboriladi. 10. Moddalar aralashmasi. 11. Yo’q. 13. Nodir gazlar. 14. Metalmaslar. 15. Deyarli barcha metallar qattiq, yaltiroq bo’ladi. Farq ham bor. 16. Kim yoviy element. 17. Parchalash kerak. Simob va kislorod. 18. a. 19. Qaynagan suvda erkin erigan kislorod bo’lmaydi. 20. Oddiy –temir, oltingugurt, grafit; qolganlari murakkab. 21. Ca, C, O. 22. C, H, N. 23. Mumkin (allotropoiya). 24. Oddiy - olmos, ohak, temir, uran, kislorod, qolgani murakkab. 25. Mumkin (izomeriya). 26. Yadro reaksiyalari. 27. a)suv; b)magniy; v) yod. 28. 3 marta. 29. 20 marta. 30. a) 44; b) 98; v) 84; g) 60. 31. CH4. 32. Ca<Al<Si<O. 33. Kristalogidratlar. 34. N2O va CO2. 35. 3,011023 ta. 36. 1,51023 ta. 37. 1,2041024 ta. 38. 6,02 1024 ta. 39. 9,031023 ta. 40. v. 41. 48 g. 42. 9 g. 43. 1,81024 ta. 44. g. 45. 3, 3, 1, 4, 2. 46. 2-2, 1-2, 3-2, 4-2, 5-2. 47. a) Na, H, Cl; b)O, Mg, Zn, Ca; v) P, Fe; g) C; d)P. 48. a) NH3; b) SiH4; v) H2S; g)HBr. 49. XeF2, XeF4, XeF6. 50. SiO2; 4. 51. NO (2) va NO2 (4). 52. P2O3 va P2O5. 53. a) Zn(2), N(4), O(2); b) Al(3), S(6), O (2); v) N(4), H(1), O(2); g) Ca(2), H(1), P(5), O(2).
Adabiyotlar
- O.M.Yoriyev, H.N.Mavlyanov, A.R. Hafizov. Umumiy kimyo jadvallarda. –Buxoro. Buxoro Davlat Universiteti, 2001. –b.
- Axmetov N.S. Obshaya i neorganicheskaya ximiya. –M.: Visshaya shkola, 1998.
- Remsden E.N. Nachalo sovremennoy ximii. –L.: Ximiya, 1989. –s.
- Parpiyev N.A., Rahimov X.R., Muftaxov A.G. Anorganik kimyi nazariy asoslari. –T.: O’zbekiston, 2000.
- Yeryomina Ye.A. i dr. Ximiya. –M.: Drofa, 1998. –s.
- Lidin R.A., Alikberova L.Yu., Loginova G.P. Neorganicheskaya ximiya v voprosax. –M.: Ximiya, 1981. –s.
- Petrov M.M. i dr. Neorganicheskaya ximiya. –L.: Ximiya, 1989. –s.
- Yerigin D.P., Shishkin Ye.A. Metodika resheniya zadach po ximii. – M.: Prosvesheniye, 1989.
- Axmetov N.S., Azizova M.K., Badigina L.I. Laboratorniye i seminarskiye zanyatiye po neorganicheskoy ximii. –M.: Mir, 1980. –s.
- Gavruseyko N.P. Proverochniye raboti po neorganicheskoy ximii. – M.: Prosvesheniye, 1990. –s.
- Z.kvapnevskiy, T.Sharshanevich, R.Kiyeshkovskiy, M.Gonet, E.Krayevskiy, V.Ufnalskiy. Polskiye ximicheskiye olimpiadi. –M.: Mir, 1980. –s.
- Gruchenko G., Kaygorodova G.A. Obucheniye uchashixsya k resheniyu raschyotnix zadach po ximii. –Smolensk, 1984.
- Yerigin D.P., Orlova L.N., Zadachi i primeri c mejpredmetnim soderjaniyem (ximiya, fizika, biologiya). –M.: MGPI, 1981.
- Kolyagin Yu.M., Oganesyan V.A. Uchis reshat zadachi. –M.: Prosvesheniye, 1987.
- Linkova N.O. Analizirovat xod poiska resheniy//Texnika i nauka. –. –№ 11. –s.34.
- A.G.Muftaxov. Ximiyadan olimpiada masalalari va ularning yechimlari. –T.: O’qituvchi, 1993. –b.
- Mayboroda V.D. i dr. Resheniye zadach po ximii s ispolzovaniyem programmiruyemix mikrokalkulyatorov. –Mn.: Universitetskoye, 1988. –s.
- Volovich P.M. Sbornik zadach po neorganicheskoy ximii. –M.: Rolf, 1999. –s.
- Budrudjak P. Zadachi po ximii.: Per s ruminsk. –M.: Mir, 1989. –s.
- Magdiseyeva N.N., Kuzmenko N.Ye. Uchis reshat zadach po ximii. – M.: Prosvesheniye, 1986. –s.
- Maxmutov M.M. Organizatsiya problemnogo obucheniya v shkole. – M.: Prosvesheniye, 1977.
- Chernobelskaya G.M., Chertkov I.N. Ximiya. –M.: Meditsina, 1991. – 576s.
- Sbornik konkursnix zadach po ximii s resheniyami. –M.:Izd-vo MGU, 1983.
- Ibragimova G.T., Axmerov Q. Umumiy ximiyani mustaqil o’rganish. –T.: O’qituvchi, 1993. –b.
- Romanseva L.M. i dr. Sbornik zadach uprajneniy po bshey ximii. – M.: Vissh. sk., 1991. –s.
- Stotskiy L.R. Fizicheskiye velichini i ix yedinitsi. –M.: Prosvesheniye, 1984.
- Goldfarb Ya.L., Xodakov Yu.V., Dodonov Yu.B. Ximiyadan masala va mashqlar to’plami. –T.: O’qituvchi, 1993. –b.
- A.S.Karnauxov i dr. Sbornik zadach i uprajneniy po neorganicheskoy ximii. – M.: Prosvesheniye, 1982. –s.
- S.A.Balezin, G.S.Razumovskiy, A.I.Filko. Anorganik ximiyadan praktikum. –T.: O’qituvchi, 1966. –b.
- Xomchenko G.P., Xomchenko I.G. Zadachi po ximii dlya postupayushix v vuzi. –M.: Vissh. shk., 1986.
- Churanov S.S. Ximicheskiye olimpiadi v shkole. –M.: Prosvesheniye, 1982.
- Venetskiy S.I. Metallar olamida. –T.: O’qituvchi, 1991. –b.
- H.N.Mavlyanov va bosh. Radioaktivlik va yadro reaksiyalari mavzusiga oid masalalar yechish. Buxoro. Buxoro Davlat Universiteti, 2003. –b.
- Samiy polniy katalog uchebnikov, zadachnikov i reshebnikov po ximii. http://www.ramdex.ru/dir/273/17
- Ye.V. Savinkina, G.P.Loginova. Ximiya. Praktikum dlya shkoli klasa gumanitarnogo profilya. М.: AST-PRESS, 2001 g. - 244 s. http://center.fio.ru/method/ getblob.asp?id=10001810
- Reshebnik po ximii dlya abituriyentov. TeachPro Multimediyniy zadachnik. Na CD... http://softsearch.ru/programs/2833.shtml
- Zadachnik po ximii. Kurs neorganicheskoy ximii. http://en.edu.ru/db/msg/ 5709/ _sp/2761/3221
7
33
KIMYONING ASOSIY TUSHUNCHALARIGA OID MASALALAR YECHISH