РАДІОЧАСТОТНА АБЛЯЦІЯ У ПЛАНІ ПОРУШЕНЬ РИТМУ СЕРЦЯ. ПРОБЛЕМИ МЕТОДУ
red54;;;;;РАДІОЧАСТОТНА АБЛЯЦІЯ У ПЛАНІ ПОРУШЕНЬ РИТМУ СЕРЦЯ. ПРОБЛЕМИ МЕТОДУ.
На сучасному етапі розвитку медицини фібриляція передсердь є однією з головних проблем, з якою стикається сучасна охорона здоров’я . Окрім того, що симптоми, які спостерігаються під час фібриляції передсердь викликають дискомфорт і призводять до певного погіршення якості здоров’я і життя, ФП супроводжується збільшенням ризику тромбоемболічних ускладнень серцевої недостатності і серцево-судинної смертності. На протязі багатьох років фармакотерапія залишалась єдиним інструментом, який дозволяв контролювати динаміку здоров’я і симптоми у пацієнтів з ФП. Проте досвід клінічних операцій і досліджень, а також час, протягом якого ці маніпуляції велися дозволили скласти враження, що застосування анти-аритмічних препаратів не завжди дозволяє добитися бажаного і необхідного ефекту і реакції, у зв'язку з чим робилися все нові і нові, часто невдалі, спроби створення якісно нових методів лікування. Так, запропонована в 1998 році M. Haissaguerre концепція фокусної активності легеневих вен лягла в основу принципово нового підходу до катетерної абляції ФП. За останнє десятиріччя відбулося стрімке перетворення методики абляції з експериментальної і теоретичної на практичну, тобто абляція стала звичайною рутинною операцією, яку здійснюють у багатьох операційних закладах. Оскільки фібриляція передсердь є складним порушенням ритму серця і вимагає міждисциплінарного підходу, я сподіваюсь , що моя робота буде становити інтерес не тільки для кардіохірургів, а й для всіх фахівців, що беруть участь у веденні пацієнтів з ФП. Фібриляція передсердь є досить поширеним надшлуночковим порушенням ритму серця, для якого характерно хаотичне скорочення передсердь.
Радіочастотна абляція міокарда (РЧА) –це малоінвазивний метод покликаний лікувати аритмії і тахікардії з використанням ендовоскулярних катетерів, які проводять струм високої частоти. Принцип РЧА базується на точковому впливі електрода на ділянку із порушенням провідності, блокуванні проведення паталогічних імпульсів та відновленні нормального ритму.
Суть проведення данної операції зводиться до термічного впливу на тканину. В результаті того, що струм, провзаємодіявши з тканиною міокарду, що має певний опір, пов’язаний з місткістю вологи у тканині і властивостей безпосередньо самої тканини, перетворюється у тепло і створює теплову дію на зону, що прилягає до контакту з електродом. Ступінь впливу визначається не лише площою безпосередньої зони взаємодії електроду з тканиною, але й фізичними і хімічними властивостями тканини, а також її вологістю.
- Суть методу радіочастотної абляції
Абляція, її ступінь і успішність залежить від наступних факторів: перш за все це температура розігріву електроду, тривалість термічного впливу і звичайно ж площа, на яку здійснюється безпосередньо вплив, тобто локація нагріву. Є низка факторів, які спричинють певну противагу темрічному впливу абляції. Перш за все це конвекційне охолодження. Воно відбувається завдяки омиванню робочої поверхні електроду потоками крові. Величина конвекції прямомпропорційно пов’язана зі швидкістю потоку крові і залежить від загальної площі електроду. Звичайно ж: чим більша площа електроду і чим більша швидкість потоку-тим більше ступінь охолодження. Таким чином, проаналізувавши позитивні і негативні фактори, що впливають на абляцію і ступінь розігріву електроду можна створити модель абляції.
При проведенні РЧА використовують струми високих частот. Для проведення абляції, як правило, застосовують «корисну» частоту порядка 500 кГц, але її значення можуть коливатися від 300 до 1000 кГц, в залежності від необхідного ступеню впливу на міокард. При виході частоти за допустимі межі в пацієнта буде спостерігатися біль і м’язові скорочення або фібриляція шлуночків. Електричний струм подається на конкретні ділянки міокарду через спеціальні трансвенозні катетерні електроди, розмір кінчику катетера коливається від 4 до 10 мм (див. рис. 1.4). При проходженні струму через міокард відбувається конверсія, або перетворення електромагнітної енергії в механічну енергію іонів, в наслідок зштовхування цих іонів з поверхньою тканини спостерігається тертя іонів і її проникання в тканину, завдяки супротиву тканини виробляється теплота, яка і є інстументом впливу.
Тканину міокарду можна представити, як провідник з певним опором. При проходженні струму в провіднику з опором відбувається зіткнення електрично-заряджених частинок з іонами і молекулами речовини.
При цьому кінетична енергія рухомих частинок передається іонам і молекулам, що і призводить до нагрівання провідника Такий тип нагрівання носить назву омічного, він є головним механізмом нагріву тканин міокарда. Площа електроду обернено пропорційна до щільності струму, так як площі електродів дуже малі, що пов’язано з точністю проведення операції, то щільність енергії, випромінюваної з кінчика є досить високою. Струм високої щільності прикладають до тканини міокарда, яка виступає своєрідним резистором, що і призводить до утворення тепла.
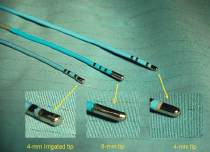
Рис. 1.1. Різноманітні конфігурації катетерних електродів для РЧА
В залежності від мети прикладання електроду, струм можуть використовувати в одно полярному чи біполярному режимі . Найпоширеніший спосіб –це використання одно полярного режиму. У такому випадку струм випромінюється електродом малої площі, взаємодіє з тканиною, нагріваючи її спочатку локально, потім теплота розповсюджується у певній зоні і розсіюється по усьому тілу, а далі виходить на електрод з великою поверхнею, який розташовують на дистальній поверхні тіла. Площа поверхні вихідного електрода повинна складати від 100 до 250 см2. Використовуючи правильну геометрію і розміри вихідного електроду, а також допоміжні електрокардіографічні гелі на виході ми можемо отримати дуже малий струм невеликої щільності, що практично не призводить до впливу на тканини, що не потребують дії тепла.
- Переваги методу
Метод РЧА дозволяє прямо вразити ціль і при цьому не завдати шкоди здоровим тканинам і імунній системі. РЧА не супроводжується побічними впливами, які властиві хіміотерапії, а також виключається небезпека розвитку рясних кровотеч та порушення цілісності органів, як це буває при проведенні хірургічної операції.
Немає потреби проводити глибоке загальне знеболювання. Як правило, для усунення дискомфортних відчуттів достатньо місцевої анестезії в місцях проколів (стегнова вена чи артерія, підключична вена) та легкої загальної седації.
Звичайно, треба пам’ятати, що навіть малоінвазивна операція є операцією на серці з певним ризиком розвитку потенційних ускладнень. Хоча в переважній більшості випадків знання анатомії та фізіології в комбінації з новітніми технологіями та досвідом дали можливість знизити цю цифру до 0,5%.
- Проблеми методу
В минулому підрозділі ми розглянули переваги методу, проте на рівні з його недоліками існують і певні труднощі, пов’язані з проведенням цієї операції.
Перш за все нам потрібно досягнути певного, досить точного рівня трансмурального пошкодження радіочастотною енергією. Проблема полягає в тому, що на рентгені ми можемо спостерігати тільки рівень потужності і рівень температури нагріву і не можемо оцінити розмір плями деструкції, а саме глибину проникнення і ширину проникнення. Хірурги, під час проведення операції опираються тільки на відповідь тканини, тобто на те, чи зберігається фібриляція після припинення теплової дії, проте вони не можуть судити про ступінь ураження тканини, який залежить від цілої низки параметрів, що будуть описані у наступних розділах. За допомогою методу МРТ можна провести дослідження абляції за її ступенем проникнення у тканину і шириною плями, проте цей метод є досить неточним, тому що часто зображення виходить досить розмитим, що ускладнює аналіз. Також метод МРТ є дуже дорогим і потребує часу. Часто матеріальне положення пацієнта не дозволяє йому провести цей метод дослідження, тим паче досить часто у пацієнта на це не залишається часу. Також при проведенні РЧА можуть спостерігатися недопустимі ускладнення: перш за все це кипіння крові, біля поверхні контакту електроду з тканиною (рис.1) ( це пояснюється тим, що більш за все нагрівається саме кінчик електроду, і енергія, що випромінюється з цієї поверхні може бути або зависокою, або теплообмін між тканиною буде не досить швидким)
При занадто сильному вдавлюванні кінчика електроду в тканину буде спостерігатися відсутність омивання цього кінчику кров’ю, тобто відсутність природного охолодження, що має значний вплив і може стати причиною обвуглення тканини, що є зоною контакту з електродом. При цьому негативному явищі можуть утворюватися пузирі газу, виникати розрив поверхні тканини з опіками(рис.2) а також пошкодження судинної системи навколо серця.
Рисунок 1.1- Наслідки кипіння крові(утворення осаду на поверхні електроду)
Рисунок 1.2 -Розрив поверхні тканини за рахунок тісного контакту
Рисунок 1.3- Судинна система навколо серця
Як можна бачити на рисунку (рис. 3) судинна сітка є досить щільною, тому треба дуже обережно проводити абляцію і слідкувати за чітким і точним положенням електроду у порожнині тіла. Пошкодження судинної сітки відбувається дуже швидко, що пояснюється малою товщиною її розгалужень, а також відсутністю явища охолодження кров’ю електрода, що викликає його високий нагрів. Необхідно відзначити, що використання методу абляції пов'язане з виникненням такого грізного ускладнення, як перфорація стравоходу [10, 13]. У середньому такого роду ускладнення зустрічається в 1% випадків і пов'язане з близьким розташуванням задньої стінки лівого передсердя і передньої стінки стравоходу.
- Фізичний зміст радіочастотного впливу. Електрична модель міокарду серця
За рахунок проходження електромагнітного потоку через тканину викликає певне збудження і рух іонів, що в наслідок дії на них електромагнітних полів починають рухатися і за рахунок фрикційного тепла нагрівають оточуючу тканину. Варто зазначити, що при нагріві вище 50-60оС до 70оС розвивається коагуляційний некроз, тобто відбувається руйнування тканини серця, що викликає аномалію ритму. В результаті мікродеструкції, викликаної розігрівом, на тканині утворюється так званий «рубець», який значно зменшує еластичність ділянки. В результаті усувається основна причина порушення серцевого ритму. Як говорилось у минулому підрозділі:температура вища 100оС призводить до кипіння або обвуглювання тканини з утворенням пузирів газу, і як можливий результат до розриву поверхні тканини, що є неприпустимим в клінічній практиці, тому дуже важливо слідкувати за усіма параметрами, як електричними так і фізіологічними, які впливають на ступінь температурного впливу(рис 1.4).
Я вважаю, що доцільно розглянути систему, як електричний ланцюг, де кожен елемент системи буде мати електричний аналог. На рисунку 1.1 показано загальну схему РЧА тканин міокарда серця. Коло складають радіочастотний генератор (РЧГ), кабелі, поверхневий референтний електрод, тіло пацієнта і основний складовий елемент, що поєднує в собі змінні абляційний електрод, контакт електрод-тканина, контакт електрод-кров.
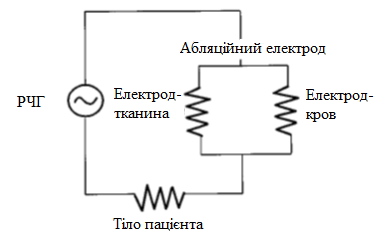
Рисунок 1.5 - Схема РЧА тканин міокарда серця
- Залежність процесу радіочастотної абляції від параметрів
Радіочастотна абляція залежить як від фізіологічних параметрів і самого протікання процесу так і від електричних і фізичних характеристик обладнання. А саме від параметрів радіочастотної енергії, які встановлюються лікарем і моніторуються радіочастотним генератором. Також абляція залежить від форми і розмірів електроду, проте на цьому зупинимось пізніше.
1.5.1 Залежність РЧА від параметрів радіочастотної енергії, форми і матеріалів електроду.
Перш за все варто розглянути залежність радіочастотної абляції від рівня радіочастотної енергії, що характеризується такими параметрами і показниками як вихідна потужність, температура абляційного електроду (мається на увазі як температура кінчику так і температура самого корпусу електроду, що нагрівається внаслідок теплепередачі від кінчику), тривалість аплікації, розмірів абляційного електроду, імпедансу, щільності струму.(рис.1.6)
Рисунок 1.6-Моніторинг електричних параметрів під час РЧА
При РЧА глибина ураження а також площа і ступінь ураження залежить від використаної потужності генератора. При збільшенні потужності пропорційно збільшується температура впливу, при занадто великих температурах впливу і при великих потужностях може спостерігатися обуглення тканини та її пересихання. Варто відмітити що при достатньому рівні охолодження ми можемо подати на електрод вищий рівень потужності, що пояснюється тим, що при наявності штучного(зрошувальна система) чи природного(кров і температура тканин) охолодження відвід теплоти від поверхні електроду відбувається досить швидко і при малій потужності ми не отримаємо рубець. Без достатнього рівня потужності не буде досягнутий необхідний тепловий і клінічний ефект. З графіку видно , що рівень деструкції прямо пропорційно пов’язаний з поданою на електрод вихідною потужністю: чим вище рівень поданої енергії, тим вище температура і тим більший вплив чинить РЧА. . Для кожного випадку постійна потужність (низька, середня, висока) прикладається на протязі 200 секунд. ( рис. 1.7)
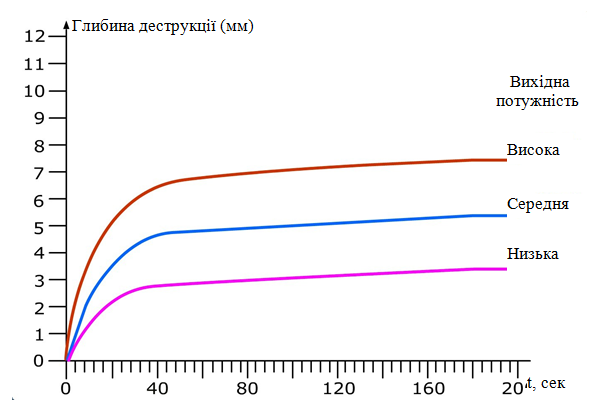
Рисунок 1.7 - Вплив вихідної потужності на глибину пошкодження тканини
Температура тканини залежить від прикладеної до неї сили РЧ струму і часу, впродовж якого цей струм подається, а також від температури розігріву електроду. Можливість збільшення потужності на виході генератору, для досягнення більшого ефекту, обмежена, так як існує можливість перегріву тканин і абляційного електроду. Перегрів може привести до небажаних наслідків, таких як, наприклад, збільшення опору кола, обвуглювання, поява згустків, виділення пари.
Температура електроду напряму визначає температуру тканини, тому, відстеження температури електроду під час абляції, може бути використано як індикатор утворення пошкоджень та їх розміру. Так як температура абляційного електроду підвищується тільки за рахунок переносу тепла від тканини, температура суміжного міокарда завжди вище температури абляційного електроду (під час проходження струму через тканину). Температура електроду вимірюється температурним датчиком (термопарою або термістором), який знаходиться на кінці катетеру (рисунок1.8).
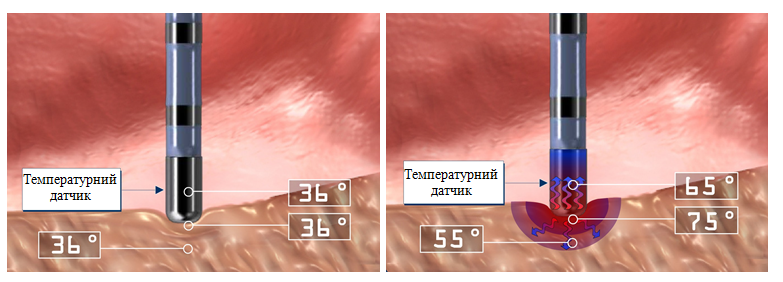
а) б)
Рисунок 1.8 - Температура абляційного електроду і тканин: а) при відсутності струму у колі, б) під час абляції.
Експериментальні дослідження показали, що температура на відстані 3 мм від зони контакту електроду з тканиною міокарду збільшується прогресивно в залежності від тривалості контакту від 10 до 60 с. Ці дослідження важливі тим, що вони показують, що для ефективності РЧА тривалість контакту електроду з тканиною повинна складати принаймні 60 с. Саме стільки часу потрібно для досягнення стаціонарного стану. Іншим фактором, що впливає на розміри зони нагріву є температура в зоні резистивного нагріву. Чим більша температура в резистивній зоні, тим більше тепла передається в глибші зони тканини міокарду. Теплопередача продовжується і після припинення прикладення радіочастотного струму. Це може призвести до занадто глибокого термічного впливу, що може мати клінічні наслідки. Оптимальна температура РЧА іще не досконало досліджена. Зазвичай в процедурах використовують тривалість впливу до 60 с при температурі від 50 до 700С. Проте характеристики тканини міокарду значно коливаються в залежності від патологій та особливостей організму, тому ця цифра доволі мінлива. Температура, що перевищує 95 є неприйнятною, оскільки призводить до некрозу тканини.
Моніторинг імпедансу
Величина струму, що подається радіочастотним генератором в багато чому залежить від імпедансу між абляцій ним катетром і індиферентним електродом. Він також залежить від декількох факторів: внутрішні властивості тканини, контактний натиск катетера, розмір електрода катетера, розмір індиферентного електрода, наявність згустків, площа поверхні тіла. Вимірювання імпедансу відбувається з будь-якого абляційного катетера, не потребує спеціального датчика. Більші електроди катетера і більші індиферентні електроди зумовлюють зменшення імпедансу. Як правило початковий імпеданс до РЧА ––Ом. Поганий контакт з тканиною дає менший на 20-50% імпеданс від початкового, так як опір крові менший ніж тканини. Більші електроди катетера через більшу робочу площу теж дають менший імпеданс. Падіння імпедансу –зворотній феномен, оскільки зростання температури під час РЧА не завжди говорить про незворотні зміни в міокарді при нагріванні. Тому моніторинг імпедансу не є достатім індикатором розміру пошкодження, а свідчить лише про наявність нагрівання тканини. Падіння імпедансу на 5-10 Ом свідчить про успішну РЧА при температурі 50-60 град.С., а не про утворення згустку. Якщо падіння імпедансу більші, починає формуватися згусток. При утворенні згустку спостерігається різкий підйом імпеданса до 250 Ом. Генератори запрограмовані так щоб при надмірних падіннях чи стрибках імпедансу зупиняти подачу енергії.
Падіння імпедансу як інструмент моніторингу має ряд обмежень, недоліків. Якщо потік крові низький, кров також нагрівається і моніторується падіння імпедансу. Також велике зростання температури тканини на невеликій площі при поганому контакті електрода або невелике зростання температури при хорошому контакті також зумовлює однакове падіння імпедансу. Однакові за ступенем нагрівання тканини при різних ступенях контакту електроду зумовлюють різні зміни в падінні імпедансу. Резистивне нагрівання швидше ніж провідне, але глибина пошкодження менша ніж при провідному. В той час падіння імпедансу буде більшим при резистивному нагріванні. Отже падіння імпедансу не є надійним показником. Хоч утворення згустків і супроводжується різким зростанням імпедансу під час РЧА, але відсутність зростання імпедансу не є надійним індикатором, що їх не утворюється. Особливо для електродів більшого розміру, для яких значення виміряного імпедансу менше.
Моніторинг температури
Моніторинг температури електроду і пов’язаний з нею зворотним зв’язком контроль за вихідною потужністю запобігає перегріву тканини і формування згустків, дозволяє утворювати ефективні пошкодження в цільовій зоні. Але температура електроду залежить від конвективного охолодження і контакту електроду з тканиною. Тому не завжди добре корелює з розмірами пошкодження. Температура тканини вища за температуру електроду. Тому при цільовій температурі електроду за рахунок його охолодження, може подаватися більша потужність, створюватися більші пошкодження і відбуватися перегрів тканини з утворення кратерів на тканині і напалів.
Тому температуру відсічки електроду потрібно виставляти не більше 70 град.С.
В режимі контролю температури: Подача потужності і зміна її значення відбувається автоматично в замкнутому циклі в залежності від контролю температури.
В режимі контролю потужності: Потужність встановлюється і змінюється вручну для підтримання стабільної цільової температури. Потужність продовжують подавати, якщо спостерігається клінічний ефект, протягом 5-10 сек після досягнення цільової температури або необхідного падіння імпедансу.
Ситуація коли необхідна температура не досягається і потужність не набирається більше 20 В свідчить про поганий контакт електрода з тканиною. Потрібно змінити положення електрода.
Необхідна температура нагрівання залежить від виду аритмії. Для АВВРТ –-55 град.С, для ВПВ, ПТ, ШТ –-60 град.С. Для 4 мм електрода температура має бути менша 80 град.С. В ділянках серця з високим потоком крові температура електроду нижча, ніж температура тканини, тому цільова температура 60 град.С. В ділянках серця з низьким потоком крові, температура електроду точніше відображає температуру тканини, цільова температура вища 70-80 град.С.
Для 4 мм електроду пошкодження утворюється в перші 30 сек впливу, збільшення часу впливу не створює більшого пошкодження.
При використанні 8 мм електрода більша частина його знаходиться в крові і охолоджується кровю, тому є ще більша різниця між температурою електроду і температурою тканини. Цільова температура обирається 60 град.С, потужність до 50-60 Вт.
Частко згусток може бути малого розміру, спочатку він тісно прилягає до тканини чи до краю електрода, не викликаючи різких стрибків імпедансу чи зростання температури. Тому відсутність температурних і електричних маркерів не завжди говорить, що абляція безпечна.
Клінічна ефективність РЧА, зона ураження, ступінь охолодження і глибина у великій мірі залежить від форми наконечника і його загальної площі. При перших операціях використовували 2-х міліметрові катетерні електроди. Проте дослідження показали, що великі електроди ( 4 мм проти
1,25 мм) дозвзоляють збільшити передачу потужності в 3 рази і помітно
зменшити кількість точок прикладення, які потрібні для утворення атріовентрикулярних блокад[36]. З плином часу і клінічних досліджень і спостережень було встановлено що електроди з більшою площою дають
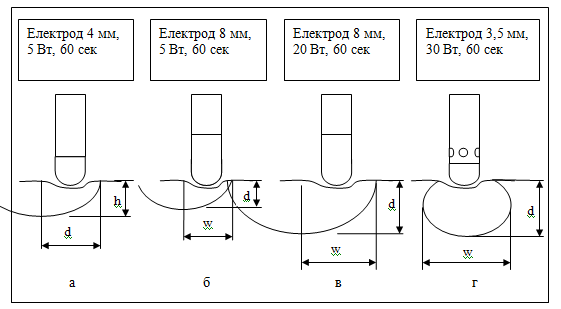
Рисунок 1.9 - Форма та розміри радіочастотних деструкцій, отриманих різними типами електродів: w –ширина, d –глибина пошкодження.
набагато більш ефективну абляцію. Більший розмір абляційного ураження пояснюється наступним: по-перше, при заданій температурі ділянки тканина-електроди, розмір пошкодження залежить від розмірів джерела РЧ струму ( кінця електроду); по-друге, великі електроди мають більший контакт з циркулюючою кров’ю, що призводить до більшого конвекційного охолодження і збільшення кількості енергії, що прикладається до тканини міокарду[28]. Зараз використовують 4 мм, 8 мм катетерні електроди для абляції, а також 3.5 мм електроди з охолодженням (див. рис. 1.9). За рахунок того, що великі електроди випромінюють досить велику енергію, виникає значний ризик абляційного ураження, бо такі електроди несуть ризик неоднорідного нагріву і контролювати точну зону дії за допомогою таких електродів досить важко. Також біля поверхні активної зони електроду може спостерігатися пляма з занадто високою температурою, що називається крайовим ефектом. [54]
В останні роки повним ходом йде дослідження форми, зрошувальної системи, розмірів і різноманітних конфігурацій електродів, що пов’язано з винаходом нових матеріалів і медичних систем. Зв’язок збільшених електродів з ефективністю РЧА був вже розглянутий у минулому розділі. В клінічній практиці частіше всього застосовують 4-мм і 8-мм електроди(рідше 10-мм), що пов’язано з універсальністю і задовільним рівнем випромінюваної енергії , проте збільшення розмірів викликає низку певних недоліків: зменшення розширення в електрографі, що призводить до зменшення якості відображення абляційної мішені; при збільшення активної поверхні електроду важче контролювати напрямок поширення теплової плями; виграючи у ефективності ми втрачаємо у гнучкості і універсальності катетера. Використання електродів з великою активною площою може призвести до надлишкового нагрівання, що потенційно може призвести до обвуглювання або утворення згустків крові, які можуть викликати тромбоемболію. Також треба враховувати те, що електроди з більшою площею випромінюють значно більше енергії, а значить треба більш пильно контролювати температуру і вихідну потужність. Останнім часом стали застосовувати довгі електроди, що дозволяють отримати великі лінійні площі пошкодження і довгі лінійні деструкції, проте ми втрачаємо в глибині проникнення і в ступені контакту «електрод-тканина». Також можуть спостерігатися розриви контакту, що викликає великі труднощі у здійсненні однорідної абляції [57, 75]. Зараз активно досліджуються і впроваджуються електроди з іншими типами активних наконечників, проте говорити про їх переваги і недоліки ще рано.
Стандартним матеріалом для катетерних електродів для радіочастотної абляції є платина, однак варто розглядати і золоті електроди. Як відомо, теплопровідність золота в чотири рази більша, ніж у платини, а відповідно дозволяє доставити до місця деструкції більшу потужність, що дає змогу отримати більш глибоке ураження при тій же температурі електрода без зростання опору. Покращене охолодження золотих електродів (за рахунок теплообміну в крові) дозволяє передавати більш високий рівень радіочастотної енергії. Отже, більш великих розмірів деструкції можна досягнути при тих же температурах і розмірах електроду, однак при коректному підборі матеріалу. Проте, покращений теплообмін золотих електродів втрачає свою ефективність в тих районах, де потік крові мінімальний, тобто при мінімальному конвекційному охолодженні на кінчику електроду. У таких випадках електроди із гіршою теплопровідністю дозволяють досягнути глибшої зони деструкції.
Часто для абляції застосовують платинові і золоті електроди. Перевагою платинових електродів є те, що вони виключають забруднення крові іонами, які можуть виділятися під час розігріву, саме тому вони часто застосовуються у хімічній промисловості, проте платинові електроди є досить дорогими. До їх переваг слід віднести те, що вони зберігають форму і об’єм при розігріві і охолодженні, вони тугоплавкі і можуть пришвидшувати хімічні реакції. Слід відмітити те, що теплопровідність золота є вищою, а це означає, що завдяки таким електродам ми можемо доставити до місця деструкції набагато більшу потужність, чим і викликати більшу ступінь впливу електрода на тканину без збільшення опору. Покращене охолодження золотих електродів (за рахунок теплообміну в крові) дозволяє передавати більш високий рівень радіочастотної енергії. Таким чином підбір матеріалу, з яких буде виготовлений електрод є дуже важливим аспектом розвитку сучасної абляції, так як при тих самих температурах і габаритах можна отримати більшу або меншу потужність випромінювання, просто змінюючи сплав електроду. При мінімальному конвекційному охолодженні на кінчику електроду теплообмін золотих електродів втрачає свою ефективність, тому що в таких випадках омивання кров’ю, а значить і відвід теплоти є незначним. У таких ситуація використання електродів з меншою теплопровідністю є більш доцільним.
1.5.2 Залежність рівню РЧА від термодинамічних характеристик морфо-функціональних ділянок радіочастотного впливу.
Як зазначалось раніше, процес абляції залежить не тільки від технічних параметрів і фізичних характеристик електроду, але й від фізичних явищ у самому середовищі, контакту між електродом і тканиною, від штучного(зрошувальна система) і природного(омивання кров’ю) охолодження, сили контакту між електродном і тканиною, а саме від щільності прилігання поверхні електроду до тканини і ,звичайно, від параметрів тканини міокарду. Також треба враховувати не тільки відстань електрод-тканина, а й площу контакту, яка в певній мірі залежить від типу і форми електроду. Під параметрам тканини міокарду маються на увазі її гістологічні характеристики, таких як швидкість нагріву тканини, швидкість віддачі теплоти оточуючому середовищу, тобто відведенню теплоти а також від швидкості крові в тканині.
Резистивне нагрівання є визначальним фактором в формуванні зони впливу РЧА на тканину міокарда. Проте, ефект має місце бути лише на дуже малих відстанях між кінчиком електроду і тканиною( порядка 2 мм), оскільки основним параметром, що визначає нагрів є щільність струму, бо обернено пропорційно зв’язана з відстанню до зони впливу. Глибина проникнення тепла залежить від теплопровідності даної тканини, що залежить від її структури, щільності волокон, вологості і хімічного складу. Теплопровідність полягає у передачі теплоти від більш нагрітої зони до менш нагрітої, при цьому поділ на зони є досить умовним. Важливим фактом є те, що процес резистивного нагріву дуже швидкий в порівнянні з теплопереносом, що пояснюється щільністю струму і маленькою відстанню
Ступінь деструкції тканин і ефективність абляції у великій мірі залежить від теплопередачі тканини і суміжного середовища. Внаслідок дії явища конвекції кров відводить теплоту, що знижує ефективність РЧА. Тепловіддача від циркуляції крові більш значна в ендокардіальній поверхні абляційного ураження, тому і їх розмір менший на ендокардіальній поверхні, ніж на інтраміокардіальній. У випадку щільного контакту в ділянці тканина –електрод, конвекційне охолодження відіграє позитивну роль в РЧА, оскільки призводить до оптимізації передачі енергії до необхідної ділянки тканини. Потрібно відмітити особливість впливу конвекційного охолодження від близько розташованих до ділянки впливу епікардіальних коронарних артерій. Інтраміокардіальні артерії із швидким потоком крові виступають у якості своєрідних радіаторів. Нещодавні дослідження на правому шлуночку кролика показали, що навіть невеликий потік крові через інтраміокардіальні судини може запобігти утворенню блокади, зберігши шкідливу активність ділянки де проводилась РЧА [17]. Цей механізм виступаючи проти підвищення температури в прилеглій до коронарних артерій зонах, крім негативного впливу на формування області деструкції має захисну функцію. Він перешкоджає надмірному нагріванню коронарних артерій.
У великій мірі температура електроду і тканини, на яку здійснюється безпосередньо вплив залежить від конвекції, що створюється потоком крові. Чим вища швидкість току крові у місці взаємодії, тим більшої ступені охолодження зазнає система «електрод-кров». Тому розмір деструкції, якої зазнає тканина буде залежати не лише від випромінюваної потужності, але й низки факторів, серед яких омивання кров’ю відіграє важливу роль. При будь-якій температурі електроду, радіочастотна потужність, що підводиться до тканини значно зменшується у місцях із слабким рівнем кровотоку. При слабкому потоці крові спостерігається зменшене охолодження електроду, що дозволяє електроду досягнути необхідної температури при нижчому рівні радіочастотної енергії. Це означає, що в режимі контролю температури величина деструкції буде меншою. У таких ділянках підвищення температури електроду до 65-700С лише мінімально збільшує радіочастотну потужність, яка доставляється до тканини, проте значно збільшує ризик утворення тромбів і збільшення імпедансу. В той же час, у ділянках із хорошим потоком крові збільшується охолодження електроду за рахунок конвекції. В таких випадках для отримання необхідного ефекту треба подати більшу потужність, а значить і розмір деструкції буде більшим.
Дотик електроду до тканини повинен бути мінімальним, що , перш за все пов’язано з ризиком перегрівання і обвуглення тканини, а також з ризиком пропалювання тканини наскрізь. Дані негативні явища пояснюються тим, що у випадку проникання кінчика електроду у тканину від або погано або повністю не омивається кров’ю, що викликає занадто велику генерацію енергії, яка не встигає перерозподілитися між зонами міокарду, в результаті чого відбувається надмірна шкідлива деструкція.
.6 Полярність системи РЧА
Радіочастотна абляція широко використовується при катетерних методах лікування аритмій. На сьогоднішній день можливе застосування як моно-полярних, так і біполярних систем радіочастотної абляції. Аплікація енергії веде до нагрівання міокарда до 50-55 ° С і вище, що викликає його незворотний некроз. Активний хірургічний електрод для монополярної радіочастотної абляції гнучкий і використовується для ендокардіального і епікардіального впливу, при цьому індиферентний (нейтральний) електрод підкладається під спину пацієнта.
Протягом останніх років все більшу популярність завойовує метод біполярної радіочастотної абляції. При цьому використовуються два активних тканинних електрода, ніжно затискають між собою тканину серця, що в свою чергу дозволяє досить ефективно і безпечно створювати трансмуральне пошкодження міокарда передсердь [23]. Метод біполярної радіочастотної абляції найбільш підходить для проведення поєднаних операцій на зупиненому серці з використанням штучного кровообігу, коли необхідна одночасна корекція структурної патології серця і лікування ФП.
Мікрохвильова енергія також визнана ефективним альтернативним джерелом енергії в області хірургічного лікування ФП [24]. Енергія доставляється до міокарду допомогою антени, під'єднується до рукоятки приладу. При цьому антена може бути довгою і тонкою, що робить можливим виконання з її допомогою епікардіальної абляції мініінвазивним способом. Ізоляція легеневих вен може бути виконана за допомогою мікрохвильової абляції на працюючому серці з 4-5-см мініторакотомією або повністю торакоскопічним способом на «закритій» грудній клітці.
З впровадженням в клінічну практику різних технологій для абляції хірургічні операції з лікування ФП стали відносно безпечними і нетривалими процедурами. Для створення необхідних ушкоджень у лівому передсерді потрібно всього лише 20-30 хвилин оперативного часу.
Новітніми досягненнями в хірургії ФП є поява торакоскопічних методик ізоляції легеневих вен і резекції вушка лівого передсердя на працюючому серці в експерименті [1-6] і в клініці у пацієнтів з ізольованою формою ФП.
Крім цього, для успіху хірургічного лікування ФП необхідно оцінювати електрофізіологічні особливості аритмії у кожного конкретного пацієнта, а також документувати ефективність створюваних ліній електричної ізоляції безпосередньо під час операції.
- Залежність розміру пошкодження РЧА від типу аритмії
Завдяки тим параметрам, які описувались у минулих розділах, і наявній моделі, створеній нами під час проходження переддипломної практики ми можемо чітко контролювати і спостерігати за рівнем пошкодження тканини, а саме за розміром плями деструкції, температурою розігріву тканини і поверхні електроду і ,найголовніше, за глибиною проникнення випромінення у тканину. В залежності від типу тканини(знаючи її товщину і фізичні параметри), і типу аритмії завдяки нашій програмі можна чітко контролювати увесь процес РЧА. Також треба враховувати, що у різних відділеннях серця показники тканини різні, що обумовлено наявністю жирового прошарку а також різною товщиною зони міокарду. Структура м’язового волокна і ступінь омивання ділянки кров’ю значною мірою впливають на абляцію, тому ці данні теж треба враховувати.
Таблиця 1. Залежність між типом аритмії і розмірами пошкодження
|
Тип аритмії |
Зона радіочастотного впливу |
Розміри |
|
Синдром Вольфа-Паркінсона-Вайта (ВПВ) |
Передсердно-шлуночкова борозна, навколо мітрального та трікуспідального клапанів, додатковий шлях проведення |
-8 мм |
|
Атріовентрикулярна вузлова реципрокна тахікардія (АВВРТ) |
“Повільний шлях” АВ з’єднання |
довжина 5-6 мм, ширина 2-4 мм, товщина 1,5 мм |
|
Тріпотіння передсердь (ТП) |
Праве передсердя, кава-трікуспідальний перешийок |
товщина стінки 2-3 мм |
|
Фібриляція передсердь (ФП), передсердяна тахікардія (ПТ) |
Ліве передсердя, гирла лененевих вен |
товщина стінки 2-3 мм |
|
Шлуночкова тахікардія (ШТ), екстрасистолія (ШЕ) |
Правий та лівий шлуночок |
товщина стінки 4-6 мм та 9-11 мм |
6. ОХОРОНА ПРАЦІ