Влияние пиррола, пирролидина, пиридина, пиперидина, пиперазина, анилина и циклогексиламина на радиационно-химическое окисление оксигенированного этанола
Оглавление
Перечень использованных сокращений и обозначений……………………..……………..3
Реферат……………………………………………………………..……………….……..…..4
Введение………………………………………………………….………………….………..5
ГЛАВА 1. Литературный обзор………………………………….………………….…....…6
1.1. Радиопротекторы, классификация……………………….………………….……….6
1.2. Антиоксидантные и радиопротекторные свойства азотсодержащих соединений………………………………………………….……………………………...………..8
1.3. Общие сведения об исследуемых соединениях…………….……………….….....14
1.3.1. Пирролидиновые алкалоиды……………..……………………………………14
1.3.2. Пиридиновые алкалоиды………………………………………………………16
1.3.3. Пиперидиновые алкалоиды……………………………………………………17
1.3.4. Пиперазиновые алкалоиды…………………………………………………….18
1.4. Радиолиз этанола как модель изучения реакционной способности тестируемых соединений в свободнорадикальных процессах............................................................................19
ГЛАВА 2. Экспериментальная часть………………………………….………...…..…..…21
2.1. Материалы……………………….…………………………………………...……...21
2.2. Очистка исследуемых веществ…………..……………………….……...…...…….21
2.3. Приготовление исследуемых образцов……..…...……………………………..….22
2.4. Инициирование свободнорадикальных процессов…………………………....….22
2.5 Методика анализа продуктов реакции…………………………………….………..23
2.6 Математическая обработка результатов………………………………….………...23
ГЛАВА 3. Результаты и обсуждение…………..……………………………….……....….24
3.1. Результаты радиационно-химического эксперимента …..………………….….…24
3.2. Антиоксидантные свойства пятичленных азотсодержащих гетероциклических соединений……………………………………………………………………………….…….…..25
3.3. Антиоксидантные свойства шестичленных азотсодержащих гетероциклических соединений………………………………………………………………………………….….…..28
3.4. Антиоксидантные свойства анилина и циклогексиламина….…………….……...33
Заключение……………………………………………….……………………….………....37
Список использованных источников……………………………………….……...……....38
Перечень использованных
сокращений и обозначений
-ГУР – -гидроксилсодержащие углеродцентрированные радикалы
-ГЭР – -гидроксиэтильные радикалы
-ПГЭР – -пероксигидроксиэтильные радикалы
G – радиационно-химический выход частиц/эВ
pKb – отрицательный логарифм константы основности
АА – ацетальдегид
АФК – активные формы кислорода
БД – буандиол-2,3
ГАМК – гамма-аминомасляная кислота
МЭА – 2-меркаптоэтиламин
ПВ – пероксид водорода
ПОЛ – перекисное окисление липидов
ФУД – фактор уменьшения дозы
Реферат
Диплом 39 с., 2 рис., 3 табл., 20 граф., 23 источника.
Амины, кислородцентрированные радикалы, радиолиз, радиопротекторы, оксигенированный этанол.
В работе было изучено влияние пиррола, пирролидина, пиридина, пиперидина, пиперазина, анилина и циклогексиламина на радиационно-химическое окисление оксигенированного этанола.
Установлено, что среди исследованых соединений наиболее сильными восстановителями кислородцентрированных радикалов оказались: пирролидин, пиперидин, пиперазин, циклогексиламин. Пиридин и анилин проявили более слабую реакционную способность. Пиррол не проявил антиоксидантных способностей.
Рэферат
Дыплом 39 с., 2 рыс., 3 табл., 20 граф., 23 крынiцы.
Амiны, кiслародцэнтраваныя радыкалы, радыёлiз, радыёпратэктары, аксiгенiраваны этанол.
У рабоце вывучаны ўплыў пiрролу, пiрралiдыну, пiрыдыну, пiпeрыдыну, пiпeразiну, анiлiну и цыклагексiламiну на радыяцыённа-хiмiчныя пераўтварэння аксiгенiраванага этанолу.
Устаноўлена, што сярод даследаванных саедзененняў найбольш моцнымi васстанавiцелямi кiслародцэнтраваных радыкалаў з’яўляюцца: пiрралiдын, пiперыдын, пiперазiн i цыклагексiламiн. Пiрыдын i анiлiн праявiлi больш слабую рэакцыённую спасобнасць. Пiррол не паказаў антыаксiдантных здольнасцей.
Abstract
Diplom 39p., 2 fig., 3 tabl., 20 plots., 23 sources.
Amines, oxygencentered radical, radiolysis, radioprotector, oxygenated ethanol.
The effects of pyrrole, pyrrolidine, pyridine, piperidine, piperazine, anyline and cyclohexilamine on the radiation-induced transformations of oxygenated ethanol solutions were studied.
It has been determined that pyrrolidine, piperidine, piperazine and cyclohexilamine is the most strong reduction agents for oxygencentered radicals. Pyridine and aniline showed weaker reactivity. Pyrrole showed no antioxidant abilities.
Введение
Активные формы кислорода (АФК), образующиеся в живых организмах в процессе жизнедеятельности либо под действием внешних факторов, являются инициаторами свободнорадикальных превращений биомолекул [1]. АФК в присутствии кислорода могут инициировать цепные процессы окисления, среди которых наиболее изученным является перекисное окисление липидов (ПОЛ), приводящее к нарушению целостности биомембран и образованию токсичных веществ [1, 2]. Нормальное функционирование биосистем сопряжено с поддержанием необходимого уровня образования и расходования АФК при помощи антиоксидантной системы организма. В качестве вспомогательных средств для коррекции случаев развития окислительного стресса (воспалительные процессы, лучевая терапия, аварийное воздействие ионизирующих излучения и др.) можно использовать внешние источники низкомолекулярных антиоксидантов: водо- и жирорастворимые витамины, растительные полифенолы и другие соединения [1]. Несмотря на довольно широкий перечень известных антиоксидантов существует необходимость создания более эффективных ингибиторов окисления, специфичных к определенным процессам окисления либо способных локально накапливаться в тканях живых организмов.
В работах [3, 4] была показана способность триптофана и его производных ингибировать процесс радиационно-индуцированного окисления насыщенного кислородом этанола. Был предложен механизм восстановления кислородцентрированных радикалов за счет реакции переноса электрона с неподеленной пары атома азота аминогрупп производных триптофана в соответствии со схемой (1):
Установление факторов, оказывающих влияние на реализацию предложенного механизма, откроет широкие перспективы для поиска эффективных ингибиторов свободнорадикального окисления в живой и неживой природе среди азотсодержащих соединений.
Поэтому в настоящей работе исследовано влияние структуры циклических аминов на их способность восстанавливать кислородцентрированные радикалы, образующиеся при радиационно-химических превращениях насыщенного кислородом этанола.
ГЛАВА 1.
1. Литературный обзор
1.1. Радиопротекторы, классификация
Радиопротекторы это вещества, облегчающие тяжесть поражения человека или животных ионизирующим излучением (- или рентгеновские лучи, потоки протонов и нейтронов). Радиопротекторы вводятся в организм до облучения с целью уменьшения биологических эффектов поглощенной дозы радиации. Их радиозащитная активность характеризуется фактором уменьшения дозы, равным отношению доз радиации, оказывающих одинаковый биологический эффект на организм, в присутствии радиопротекторов и в их отсутствие. Химические соединения, применяемые после облучения, не относят к радиопротекторам, а рассматривают как средства для лечения лучевой болезни [5].
К настоящему времени известно несколько классификаций радиопротекторов. В большинстве из них за основу взяты принципы химического строения вещества или механизмы защитного действия. Однако наиболее употребляемой является классификация согласно которой все радиопротекторы подразделяют в зависимости от сроков радиозащитного эффекта и длительности их действия[6]. В соответствии с этой классификацией все радиозащитные препараты могут быть подразделены на две группы: кратковременного и пролонгированного действия.
К радиопротекторам первой группы относят большинство известных радиозащитных соединений: например, различные аминотиолы (меркамин, пропамин, аминоэтилизотиоуроний и др.), аминокислоту цистеин, цистамин, некоторые биогенные амины, не содержащие сульфгидрильных групп, цианофоры, аминофеноны, некоторые спирты отдельные представитель углеводов и др. Основное назначение радиопротекторов кратковременного действия – защита организма от одномоментного и относительно непродолжительного облучения с достаточно высокой мощностью дозы.
Имеется несколько основных гипотез механизма действия радиопротекторов этой группы:
1. Гипотеза, рассматривающая радиопротекторы как вещества, вызывающие временное снижение концентрации кислорода в ткани. Предполагается, что при этом уменьшается возможность образования окисляющих радикалов и перекисей в процессе облучения. В конечном итоге это должно привести к повышению радиоустойчивости.
2. Гипотеза механизма действия радиопротекторов как веществ, вызывающих инактивацию свободных радикалов. Согласно этому представлению серосодержащие радиопротекторы способны связывать радикалы, образующиеся при радиационном воздействии. Предполагается, что в результате этого процесса окисляющие радикалы не поражают молекулы клеток.
3. Представление о радиопротекторах как химических соединениях, защищающих «критические» молекулы клеток. Гипотеза предполагает, что в результате химических реакций серосодержащие радиопротекторы реагируют с сульфгидрильными группами биологически важных молекул и тем самым «прикрывают» их от действия ионизирующей радиации.
4. Представление о радиопротекторах как соединениях, повышающих радиоустойчивость биохимических систем. Эта гипотеза основывается на том, что абсолютное большинство радиопротекторов одномоментного действия оказывает радиозащитный эффект только в том случае, если их вводят в субтоксических дозах. При этом тормозятся различные радиочувствительные биохимические системы, например биосинтез ДНК, окислительное фосфорилирование в микроструктурах клеток, образование макроэргических соединений в ядре клетки и т. д.
Механизм временного торможения биохимических систем в свою очередь основывается на способности радиопротекторов вступать в химические связи с молекулами ферментов. Существенную роль при этом играет временное образование смешанно-дисульфидной связи между радиопротекторами и содержащими сульфгидрильную группу молекулами белков-ферментов.
Радиопротекторы пролонгированного действия способны обеспечить защиту при протяженном во времени облучении. Пролонгированный эффект защиты от ионизирующего излучения можно наблюдать после введения ряда биологически активных препаратов. Механизм радиозащитного действия радиопротекторов пролонгированного действия типа биогенных стимуляторов (например, витамины) связан с постепенным увеличением радиорезистентности организма и повышением активности компенсаторных и восстановительных процессов (в большинстве случаев связан с изменением гормонального фона и, как следствие, вызванного этими изменениями биохимических процессов в организме). Так, например, длительное введение в организм витаминов группы Р уменьшает возможность образования геморрагии у облученных животных. Механизм этого явления обусловлен, в частности, способностью витамина Р подавлять активность гиалуронидазы — комплекса ферментов, вызывающих ферментативный распад гиалуроновой кислоты. В свою очередь одна из функций этой кислоты состоит в том, что она «цементирует» соединительную ткань.
В настоящее время ведется поиск «идеального радиопротектора». Идеальный радиопротектор (для случая общего облучения) должен:
1) проявлять высокую радиозащитную эффективность (ФУД = 2-3);
2) быть эффективным не только против острого, но и против хронического облучения;
3) быть эффективным при пероральном приеме (или по крайней мере при внутримышечном введении) и быстро распределятся по органам и тканям;
4) проявлять высокую эффективность уже через несколько минут после введения и сохранять ее в течение длительного времени после введения;
5) быть эффективным против различных видов ионизирующего излучения;
6) не проявлять неблагоприятных побочных эффектов, т.е. должен быть нетоксичным;
7) быть недорогим;
8) быть химически стабильным (долго храниться в обычных условиях) и удобным для применения.
1.2. Антиоксидантные и радиопротекторные свойства азотсодержащих соединений
Среди азотсодержащих соединений обладающих радиопротекторными свойствами можно выделить следующие группы:
- Аминотиолы;
- Соединения содержащие нитрильную группу;
- Конденсированные системы с пиррольным кльцом.
Простейшим представителем аминотиолов является 2-меркаптоэтиламин (цистеамин, МЭА). Он является продуктом декарбоксилирования аминокислоты цистеина и является более эффективным радиопротектором (ФУД = 1.7) чем цистеин. О радиозащитной эффективности МЭА впервые сообщил З. Бак в 1952 г [6]. Обнаружение радиозащитных свойств МЭА стимулировало огромный интерес к поиску эффективных радиопротекторов среди серосодержащих химических соединений, особенно среди аналогов МЭА, в которых варьировало число атомов углерода между атомами серы и азота, а также подвешивались различные химические группировки к аминной и тиольной группе. Оказалось, что наиболее эффективными радиопротекторами были соединения с 2 или 3 углеродными атомами между атомами азота и серы. Среди этих аналогов МЭА было найдено много эффективных радиопротекторов, например: аминоэтилизотиуроний (1.2.1, ФУД = 1.7), меркаптоэтилгуанидин (1.2.2, ФУД = 1.7), гаммафос (1.2.3, ФУД = 2.7).
Предполагают, что основными механизмами радиозащитного действия аминотиолов и других меркаптоалкиламинов являются следующие: перехват свободных радикалов, реституция поврежденных молекул ДНК путем донирования атома водорода. Известно применение гаммафоса при радиотерапии злокачественных опухолей благодаря его уникальной способности защищать от ионизирующего излучения нормальные ткани организма и не влиять на радиочувствительность опухолевых тканей. Предполагают, что избирательная защита нормальных клеток обусловлена двумя причинами: концентрация мембраносвязанной щелочной фосфатазы (фермент, который отщепляет фосфатную группу и, таким образом, активирует гаммафос, т.к. для проявления его радиозащитного действия требуется свободная SH группа) в нормальных клетках в 275 раз выше, чем в опухолевых клетках; кровоснабжение опухолей гораздо хуже, чем нормальных тканей и поэтому поступление гаммафоса из крови в опухолевую ткань происходит значительно медленнее, чем в нормальную ткань.
Противолучевое действие цианидов связывают с их способностью блокировать активность железосодержащих дыхательных ферментов. Цианид натрия – исторически первый радиопротектор открытый в 1949г [6]. В настоящее время известно много радиопротекторов содержащих нитрильную группу, например: малононитрил, амигдалин(1.2.4).
Среди гетероциклических соединений, изученных в качестве потенциальных радиопротекторов, широко представлены конденсированные системы. Важное место среди конденсированных гетероциклов занимают производные индола, в котором имеется пиррольное кольцо.
Обширные исследования методов синтеза и противолучевых свойств индолилалкиламинов привели к созданию радиозащитного препарата мексамина (1.2.5а), аналога серотонина (1.2.5b), и явились основой для дальнейшего поиска радиопротекторов в этом ряду соединений [7]. Мексамин и серотонин вызывают региональную гипоксию в некоторых радиочувствительных тканях организма. Установлено, что эти соединения защищают от воздействия -лучей не хуже серосодержащих радиопротекторов.
Изучение N-пептидных производных индолилалкиламинов показало выраженный радиозащитный эффект. Исследование радиозащитных свойств О-ацилпроизводных серотонина (1.2.6), ацильных аналогов мексамина – показало, что введение остатков насыщенных жирных кислот по фенольному гидроксилу не снижает защитного действия по сравнению с серотонином или мексамином.
Было установлено, что удлинение углеродной цепи ацильного заместителя сопровождается повышением токсичности. При этом эти соединения по своему защитному эффекту мало отличаются от действия серотонина.
Для получения радиопротекторов ряда индолилалкиламинов обладающих пролонгированным действием был синтезирован ряд производных серотонина – сложных диэфиров серотонина и дикарбоновых кислот (1.2.7а-f): фумаровой (а), янтарной (b), адипиновой (c), себациновой (d), терефталевой (e) и п,п-дифенилдикарбоновой (f).
Эти соединения не уступают по защитной активности серотонину и мексамину, однако они являются более токсичными. Наиболее эффективным радиопротектором среди представленных соединений оказалось производное янтарной кислоты (1.2.7b). Соединения (1.2.7d,e), в отличие от мексамина и серотонина, обладают способностью сохранять высокие защитные свойства в течение 1 часа.
Присоединение молекулы глицерина к триптамину (1.2.9а) повышает его противолучевую эффективность (1.2.8).
Введение алкоксигруппы (1.2.9b) не приводит к повышению противолучевых свойств, а введение оксиэтильной группы (1.2.9c) снижает радиозащитный эффект.
Было установлено [8], что триптамин, содержащий в положении 5 индольный заместитель (1.2.10), превосходит по радиозащитному эффекту исходный триптамин, но уступает мексамину. В то же время 5-замещенные изотриптамины (1.2.11) оказались малоэффективными.
В процессе поиска радиопротекторов интерес вызывал синтез и изучение серосодержащих производных триптамина и серотонина [9,10].
Замена в триптамине аминогруппы на тиольную (1.2.12), а также соответствующий дисульфид не привели к усилению противолучевого действия. Замена в серотонине гидроксильной группы на тиольную (1.2.13) позволило получить соединение сопоставимое по эффективности с серотонином.
Полученные S-функциональные производные -меркаптоэтиламина с индольным заместителем у атома углерода (1.2.14) не проявили заметной радиозащитной активности. Также были синтезированы соединения, у которых атом водорода в аминогруппе триптамина или мексамина замещен меркаптоалкильными заместителями (1.2.15). Однако ни одно из них не имело преимущества как радиопротектор по сравнению с исходными незамещенными аминами.
Тиоамиды, содержащие остаток триптамина (1.2.16), проявляют высокий радиозащитный эффект [11].
Был синтезирован ряд соединений, не содержащих аминоэтильную группу в третьем положении (1.2.17). Среди 5-алкокси и 5-ацетилзамещенных, а также
3-карбонильных производных индола были найдены вещества с умеренной протекторной активностью.
Исследования на животных и людях показали, что мелатонин является уникальным антиоксидантом [12], способным защищать ДНК [13] и хромосомы [14] от ионизирующей радиации. Мелатонин нейтрализует разрушительные последствия окислительных процессов, которые являются основной причиной старения.
Ряд свойств выделяет мелатонин из общей группы антиоксидантов. Он обладает прямым и косвенным антиоксидантным действием. Его косвенное действие проявляется в активации ферментативной антиоксидантной системы – супероксиддисмутазы и глутатионпероксидазы. Он активирует производство глутатиона клеткой, промотирует активность глутатионредуктазы, которая восстанавливает окисленный глутатион. Прямой антиоксидантный эффект мелатонина показан на примере его влияния на процессы перекисного окисления липидов и повреждения ДНК. Этот эффект проявляется в виде его взаимодействия со свободными радикалами, а также активацией ферментативного механизма репарации ДНК [12].
Мелатонин не обладает прооксидантными свойствами, в отличие от многих классических антиоксидантов. Он безопасен в терапевтических и фармакологических дозах. Так же мелатонин обладает противовоспалительными свойствами [15]. В человеческом организме его синтез может осуществляться каждой клеткой, обладающей ДНК, тем самым, защищая организм от вредного воздействия патогенных свободных радикалов. В то же время мелатонин является амфифильной молекулой, благодаря чему он легко преодолевает такие физиологические препятствия как гематоэнцефалический барьер и мембраны (в том числе ядерную мембрану).
К преимуществам индолилалкиламинов как радиопротекторов относится их достаточно высокая эффективность при применении в сравнительно небольших дозах и быстрое развитие защитного эффекта после введения в организм. Радиозащитное действие индолилалкиламинов связывают, в основном, с индукцией гипоксии в организме вследствие их вазоконстрикторного (сосудосуживающего) действия и, возможно, с перехватом свободных радикалов. Еще один представитель аминов применяющийся в качестве радиопротектора – алкалоид колхицин. Он является сильным антимитотиком, связывающимся с белком тубулином, образующим микротрубочки, и, вследствие этого, блокирующим деление клеток на стадии метафазы.
Действие биологически активных азотсодержащих радиопротекторов, в конечном счете, приводит к снижению выхода химически высокоактивных радикальных частиц в момент облучения, угнетению обменных процессов в клетке, повышению уровня эндогенных сульфгидрильных соединений.
Среди веществ, изученных к настоящему времени в качестве потенциальных радиопротекторов, имеются представители практически всех классов органических соединений. Одно из первых мест занимают гетероциклические соединения различного строения. Это объясняется их высокой и многоплановой биологической активностью.
1.3. Общие сведения об исследуемых соединениях, биохимические функции
1.3.1. Пирролидиновые алкалоиды.
Пирролидин является родоначальником большого количества природных алкалоидов. Они представлены соединениями двух типов: производными пирролидина и производными его бициклического аналога тропана [16]. К ним относятся никотин, гиос-циамин, атропин, скополамин, кокаин и др. В качестве биосинтетического предшественника пирролидиновых алкалоидов выступает аминокислота орнитин.
Никотин действует на никотиновые ацетилхолиновые рецепторы: протонированный атом азота пирролидинового цикла в никотине имитирует четвертичный атом азота в ацетилхолине, а атом азота пиридина имеет характер основания Льюиса, как и кислород кетогруппы тацетилхолина. В низких концентрациях он увеличивает активность этих рецепторов, что, среди прочего, ведёт к увеличению количества стимулирующего гормона адреналина (эпинефрина). Выброс адреналина приводит к ускорению сердцебиения, увеличению кровяного давления и учащению дыхания, а также к большему уровню глюкозы в крови. Никотин в основном метаболизируется в печени окислением и N-деметилированием. При этом протекает разрыв пирролидинового цикла и N-метилирование пиридинового цикла, а окисление никотина ведёт к котинину. Эти метаболиты из организма выводятся с мочой.
Атропин(1.3.1) так же действует на ацетилхолиновые рецепторы. Введение атропина в организм сопровождается уменьшением секреции слюнных, желудочных, бронхиальных, потовых желёз, поджелудочной железы, учащением сердечных сокращений (вследствие уменьшения тормозящего действия на сердце блуждающего нерва), понижением тонуса гладкомышечных органов (бронхи, органы брюшной полости и др.). Действие атропина выражено сильнее при повышенном тонусе блуждающего нерва.
Самый известный пирролидиновый алкалоид – кокаин(1.3.2). Кокаин действует на 3 принципиально значимые для нервной деятельности нейромедиаторные системы: дофаминовую, норадреналиновую, серотониновую. Связывая транспортеры моноаминов, кокаин нарушает обратный нейрональный захват нейромедиаторов пресинаптической мембраной. В результате нейромедиатор остаётся в синаптической щели и с каждым прохождением нервного импульса концентрация его растёт, что приводит к усилению воздействия на соответствующие рецепторы постсинаптической мембраны. Одновременно с этим истощается запас нейромедиатора в депо пресинаптической мембраны, особенно ярко наблюдается этот эффект при неоднократном употреблении кокаина. С каждым нервным импульсом выделяется все меньше нейромедиаторов и компенсаторно возрастает плотность рецепторов к данному катехоламину на постсинаптической мембране, данное явление особенно характерно для дофаминовых рецепторов.
1.3.2. Пиридиновые алкалоиды.
Пиридиновые алкалоиды могут быть разделены на три подгруппы: те, которые содержат только пиридиновый гетероциклический фрагмент; те, которые содержат еще дополнительный гетероциклический фрагмент; третью подгруппу составляют алкалоиды, в молекулах которых пиридиновый цикл сконденсирован с алициклами.
К первой группе относят: тригонелин(1.3.3), рицинин(1.3.4), производные 3-гидрокси-2-метилпиридина и др. Производные 3-гидрокси-2-метилпиридина также называют витамин B6: пиридоксин(1.3.5), пиридоксаль(1.3.6), пиридоксамин(1.3.7) и их фосфаты, среди которых наиболее важен пиридоксальфосфат(1.3.8). Различные формы в организме человека превращаются в пиридоксальфосфат — кофактор ферментов, которые катализируют декарбоксилирование и трансаминирование аминокислот. Участвует во многих аспектах метаболизма макроэлементов, синтезе нейротрансмиттеров (серотонина, дофамина, адреналина, норадреналина, ГАМК), гистамина, синтезе и функции гемоглобина, липидном синтезе, глюконеогенезе, экспрессии генов [17].
Среди второй группы пиридиновых алкалоидов наиболее известны: никотин(1.3.9), норникотин(1.3.10), анабазин(1.3.11) и др. Анабазин — агонист никотиновых ацетилхолиновых рецепторов, снижает влечение к курению. В больших дозах оказывает аналептическое действие, в том числе возбуждает дыхательный центр продолговатого мозга. В высоких дозах он вызывает деполяризующий блок, что вызывает симптомы, сходные с никотиновым отравлением, и, в тяжелых случаях, смерть отасистолии. Применяется в современной медицине от никотиновой зависимости в виде таблеток, пленок, жевательных резинок [18].
1.3.3. Пиперидиновые алкалоиды.
Пиперидиновые алкалоиды отличаются достаточной разнообразностью и распространенностью, но этого нельзя сказать о их биологической активности. Гидробромид ареколина в основном применяется в ветеринарной практике в качестве слабительного и глистогонного средства, а также как заменительпилокарпина и эзерина в офтальмологии. По действию ареколин(1.3.12) близок к мускарину и ацетилхолину. Под влиянием ареколина усиливается слюноотделение, снижается кровяное давление, происходит сокращение гладкой мускулатуры, суживаются зрачки. Ареколин в небольших дозах возбуждает, а в больших дозах парализует центральную нервную систему.
Другой представитель пиперидиновых алкалоидов – лобелин(1.3.13). В медицинской практике применялся в качестве аналептика, как стимулятор дыхания, в качестве вспомогательных средств для отвыкания от курения [19].
1.3.4. Пиперазиновые алкалоиды.
Наиболее известными пиперазиновыми алкалоидами являются трифлуоперазин(1.3.14) и перфеназин(1.3.15). Они являются нейролептиками фенотиазинового ряда, одни из наиболее активных антипсихотиков. Антипсихотический эффект сочетается с умеренным стимулирующим (психоэнергизирующим) и растормаживающим эффектом. При галлюцинаторных и галлюцинаторно-бредовых состояниях проявляет седативное действие [20].
1.4. Радиолиз этанола как модель изучения реакционной способности тестируемых соединений в свободнорадикальных процессах
-Гидроксиэтильные радикалы, возникающие при радиолизе этанола, являются одними из простейших представителей монофункциональных -ГУР. В настоящей работе радиолиз этанола был использован в качестве модельной системы для изучения способности тестируемых соединений регулировать процессы с участием кислородцентрированных радикалов на примере -ПГЭР. Поэтому представляется важным рассмотреть механизм свободнорадикальных превращений субстрата. Мы не будем рассматривать реакции, протекающие на ранней стадии радиолиза, которые подчиняются законам гетерогенной кинетики, так как растворенные вещества в милимолярной концентрации не способны влиять на ход этих реакций [21].
При радиолизе этанола генерируются ионы, радикалы и молекулярные продукты (1.1). Уравнения, в результате которых происходит образование основных радикальных интермедиатов, приведены ниже [22,23]:
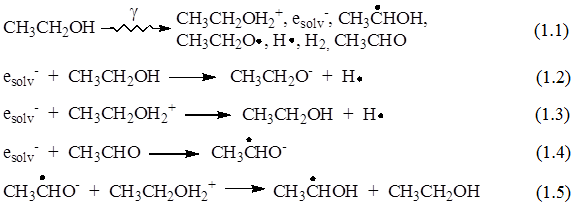
В радиолитических превращениях растворенных веществ в разбавленных спиртовых растворах атом Н играет малую роль, так как он быстро взаимодействует со спиртом по следующему уравнению реакции:
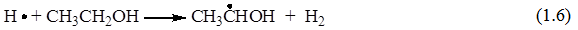
Таким образом, атомы Н могут реагировать с растворенными веществами только в концентрированных растворах. В остальных случаях атомы Н расходуются в реакции (1.6), образуя -ГЭР.
Кислород, присутствуя в системе, эффективно взаимодействует с -ГЭР (1.7), атомами Н (1.8) и еsolv- (1.9-10).
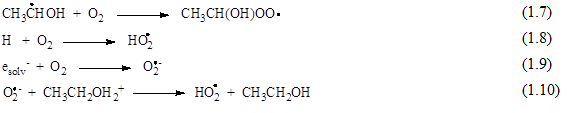
В этаноле, насыщенном кислородом (С(О2) 8·10-3 М), сольватированные электроны практически полностью реагируют с кислородом (1.4.12), тогда как расход атомов Н в реакциях с О2 (1.8) и спиртом (1.6) составляет ~25% и ~75%, соответственно. Реакции рекомбинации и диспропорционирования -ГЭР подавляются нацело, в связи с чем, во избежание влияние кислорода на результаты радиационно-химического эксперимента при радиолизе деаэрированного этанола, необходимо максимально избавляться от него путем вакуумирования растворов или работы в инертной атмосфере (Ar). В насыщенных кислородом растворах становится возможной реализация цепного процесса окисления этанола, благодаря протеканию реакций (1.11, 1.12), которые продолжают цепь. Гидроксиэтилпероксильные радикалы фрагментируют по общей схеме (1.13). В результате диспропорционирования -ПГЭР и гидропероксильных радикалов происходит обрыв цепи (1.14-17).
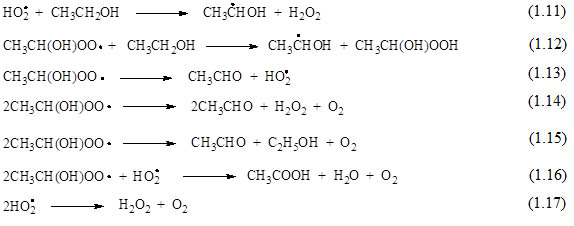
Таким образом, АА и H2O2 являются основными продуктами радиолиза насыщенного кислородом этанола. По изменению их радиационно-химических выходов в присутствии тестируемых соединений, как и в случае АА и БД для деаэрированного этанола, можно судить о механизме взаимодействия исследуемых соединений с -ГУР.
Глава 2.
Экспериментальная часть
2.1. Материалы
В работе с предварительной очисткой использовались следующие соединения:
пиррол(2.1.1), пирролидин(2.1.2), пиридин(2.1.3), пиперидин(2.1.4), пиперазин(2.1.5), анилин(2.1.6), циклогексиламин(2.1.7). Этанол-ректификат (96 об. %) перед использованием очищали перегонкой на ректификационной колонке. Структурные формулы азотсодержащих гетероциклических соединений приведены на рис. 1.
Рисунок 1. Структурные формулы исследуемых соединений
2.2. Очистка исследуемых соединений
Пиррол. Бесцветная жидкость, т. кип. 130 °C. Сперва осушали пиррол с помощью прокаленного сульфата кальция. Затем перегоняли в атмосфере азота с разделением фракций. Приемник с пирролом продували азотом и хранили в морозильной камере.
Пирролидин. Бесцветная жидкость с характерным аммиачным запахом, дымит на воздухе, т. кип. 88 °C. Пирролидин перегоняли в атмосфере азота с разделением фракций. Пирролидин хранили в холодильники в сосуде в атмосфере азота.
Пиридин. Бесцветная жидкость, т. кип. 115 °C. Осушали пиридин твердым гидроксидом калия. Далее очищали методом перегонки при пониженном давлении. Хранили пиридин в холодильнике.
Пиперидин. Бесцветная жидкость, т. кип. 106 °C. Перегоняли с разделением фракций. Хранили в холодильнике.
Пиперазин. бесцветные, гигроскопичные кристаллы, т. пл. 106 °C, т. кип. 146 °C. Сушили пиперазин в вакууме при нагревании, затем очищали методом сублимации в вакууме. Хранили пиперазин в холодильнике в плотно закрытой банке.
Анилин. Бесцветная жидкость, т. кип. 185 °C. Сушили анилин твердым гидроксидом калия, затем очищали методом перегонки под вакуумом в присутствии хлорида олова(II) (для удаления примесей сульфатов). Хранили анилин в холодильнике.
Циклогексиламин. Бесцветная жидкость, т. кип. 135 °C. Сушили циклогексиламин прокаленным хлоридом кальция. Перегоняли в присутствии гидроксида калия. Перегнанный циклогексиламин переводили в гидрохлорид и перекристаллизовывали из воды несколько раз. Затем обратно превращали в амин и перегоняли в присутствии гидроксида калия в атмосфере азота. Хранили циклогексиламин в холодильнике.
2.3. Приготовление исследуемых образцов
В настоящей работе растворы готовились весовым методом: путем растворения точно взвешенных навесок в мерной посуде. Концентрации тестируемых соединений в растворах составляли 10-3 моль/л. В силу высокой летучести растворителя для приготовления оксигенированных растворов тестируемых веществ в этаноле их продували кислородом высокой степени чистоты (99,9%) в пикнометрах в течение 20 мин., после чего объем доводили до метки оксигенированным растворителем, затем раствор перемешивали, разливали в пенициллиновые флаконы и закрывали крышкой.
2.4. Инициирование свободнорадикальных процессов
Для инициирования радиационно-индуцированных процессов в изучаемых системах использовали -излучение изотопа 60Co. Облучение образцов проводили в закрытых пенициллиновых флаконах на установке MPX--25М. Мощность дозы составляла 0,21±0,007 Гр/сек. Интервал поглощенных доз для деаэрированных систем составлял 0-315 Гр.
2.5. Методика анализа продуктов реакций
Образующийся при радиолизе этанола ацетальдегид определяли газохроматографическим методом на хроматографе GC-17A фирмы «SHIMADZU» с использованием кварцевой капиллярной колонки Stabilwax-DA: l=30 м, внутренний диаметр – 0,53 мм, толщина пленки неподвижной фазы – 1 мкм. Качественный и количественный анализ проводили с использованием внешнего стандарта. Условия анализа: начальная температура 40 С, скорость подъема до 180 С – 13 С/мин., температура инжектора – 220 С; температура детектора – 220 С; газ-носитель – азот; детектор – пламенно-ионизационный; объем задаваемой пробы – 1 мкл.
Для определения пероксида водорода использовали реагентоспектрофотометрический метод, основанный на образовании желтого комплекса пероксида водорода с сульфатом титанила в сернокислом растворе, используя адаптированную к работе методику. К 3 частям исследуемого образца прибавляли 1 часть насыщенного раствора TiOSO4 в 4 М серной кислоте и после интенсивного перемешивания на автошейкере в течение 10 минут определяли оптическую плотность при 405 нм. Измерения проводили на спектрофотометре Specord S600. Калибровку спектрофотометра проводили по предварительно приготовленным, методом последовательного разбавления в мерной посуде, растворам пероксида водорода. Концентрации калибровочных растворов находились в диапазоне от 510-6 до 10-3 М. Идентификация продуктов радиационно-индуцированных превращений исследуемых соединений не проводилась.
2.6. Математическая обработка результатов
Радиационно-химические (G) выходы образования продуктов реакций рассчитывали на линейных участках зависимости концентраций веществ от поглощенной дозы. Статистическую обработку результатов эксперимента проводили с использованием метода наименьших квадратов.
Глава 3.
Результаты и обсуждение
В настоящей работе была изучена способность ряда циклических аминов регулировать процессы с участием -пероксигидроксиэтильных радикалов(-ПГЭР), образующихся при радиолизе оксигенированного этанола.
3.1. Результаты радиационно-химического эксперимента
При радиолизе этанола генерируются ионы, радикалы и молекулярные продукты (3.1). Уравнения (3.2-3.5), в результате которых происходит образование основных радикальных интермедиатов, приведены ниже:
В радиолитических превращениях растворенных веществ в разбавленных спиртовых растворах атом Н• играет малую роль, так как он быстро взаимодействует со спиртом:
Таким образом, атомы Н могут реагировать с растворенными веществами только в концентрированных растворах. В остальных случаях атомы Н расходуются в реакции (3.6), образуя -ГЭР.
При радиолизе насыщенного кислородом 96 % (об.) этанола, образующиеся по реакциям (3.1-3.6) -ГЭР с диффузионно-лимитируемой скоростью присоединяют кислород (реакция 3.7) с образованием пероксильных радикалов (1). Фрагментация последних приводит к образованию АА и гидропероксильных радикалов:
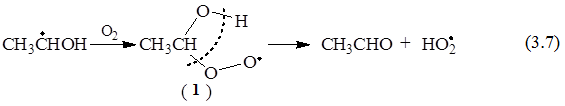
Дальнейшие реакции (3.8) и (3.9) приводят к образованию еще одного основного продукта радиолиза насыщенного кислородом этанола – пероксида водорода (ПВ):
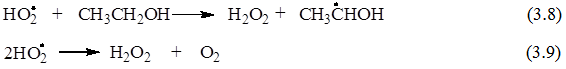
Характер влияния тестируемых соединений на величину и соотношение радиационно-химических выходов продуктов радиолиза оксигенированного этанола (ПВ и АА) определяется реакционной способностью и механизмом взаимодействия исследуемых соединений с -ПГЭР. Пропорциональное снижение G(AA) и G(ПВ) может свидетельствовать о способности тестируемого соединения восстанавливать -ПГЭР.
3.2. Антиоксидантные свойства пятичленных азотсодержащих гетероциклических соединений
На графиках 1-6 приведены построенные на основе экспериментальных данных зависимости концентрации АА и ПВ от поглощенной дозы для чистого этанола и в присутствии исследуемых веществ. Данные зависимости были использованы для расчета радиационно-химических выходов ПВ и АА в отсутствие добавок и в присутствии пиррола и пирролидина. Расчет G осуществляли по тангенсу угла наклона линейных участков зависимостей, который характеризует реакционную способность исследуемых веществ по отношению к -ПГЭР.
График 1. Кинетическая зависимость накопления ацетальдегида от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
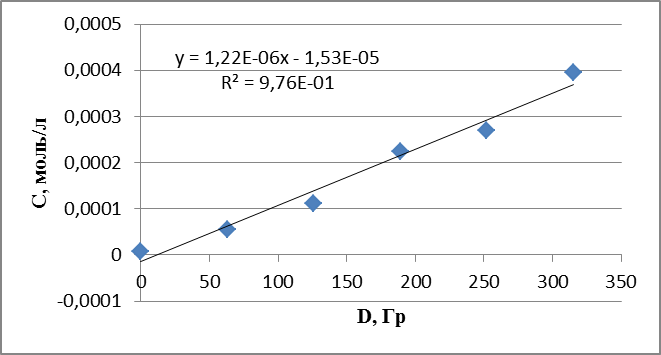
График 2. Кинетическая зависимость накопления пероксида водорода от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
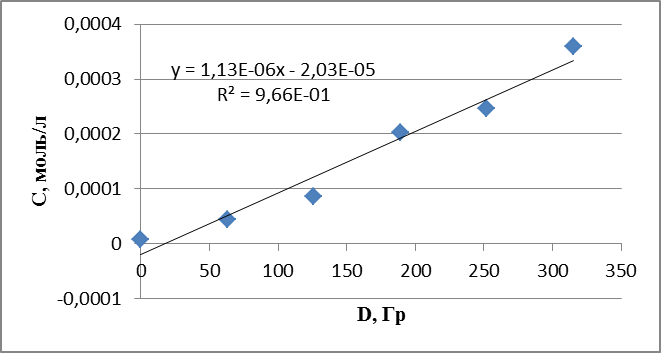
График 3. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиррола в оксигенированном этаноле).
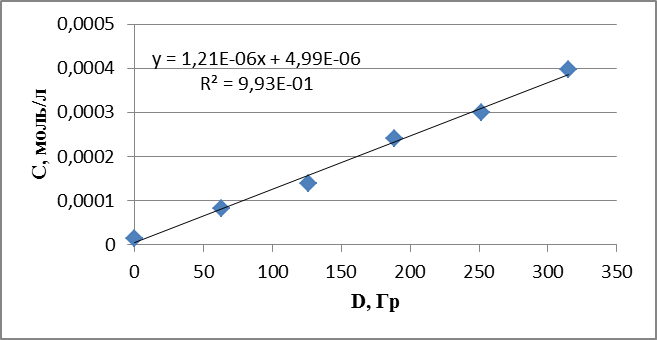
График 4. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиррола в оксигенированном этаноле).
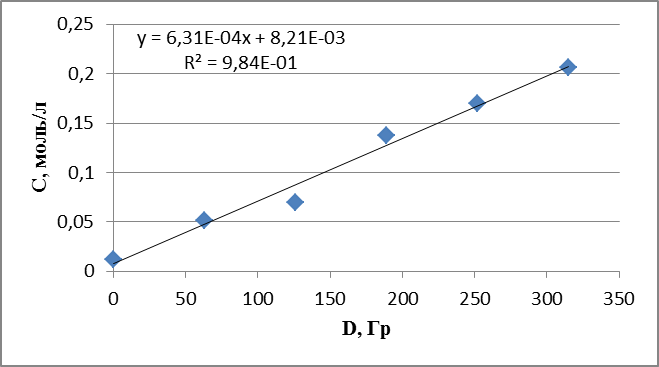
График 5. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пирролидина в оксигенированном этаноле).
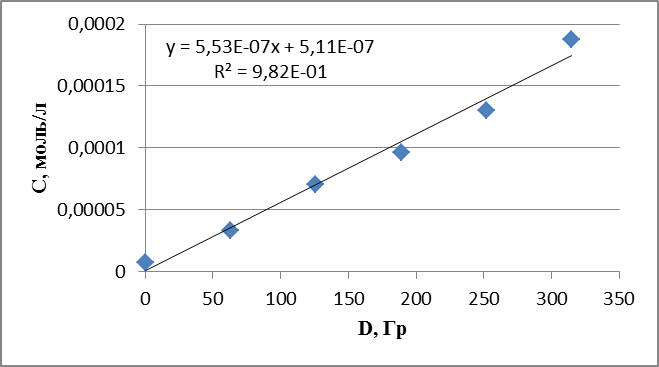
График 6. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пирролидина в оксигенированном этаноле).
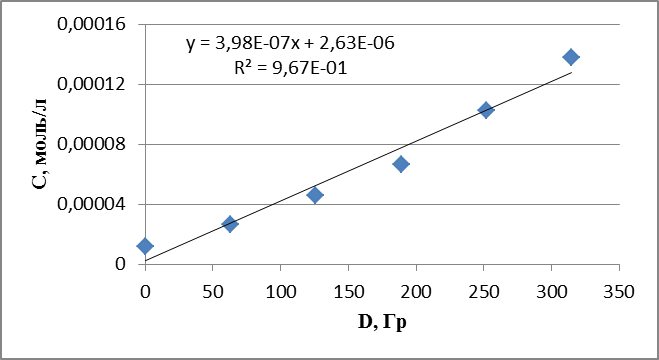
Полученные величины G продуктов радиолиза оксигенированного этанола в присутствии пиррола и пирролидина сведены в табл.1. Установлено, что пиррол не влияет на величину радиационно-химического выхода АА и ПВ. Таким образом, пиррол не взаимодействует с кислородцентрированными радикалами. В отличие от пиррола, пирролидин значительно уменьшает радиационно-химические выходы продуктов радиолитического окисления этанола. Это указывает на его способность ингибировать радиационно-химическое окисление этанола. Вероятным механизмом восстановления кислородцентрированных радикалов является перенос электрона с неподеленной пары электронов атома азота (схемы 3.10-11) на кислородцентрированные радикалы. В результате происходит обрыв короткоцепного процесса окисления этанола.
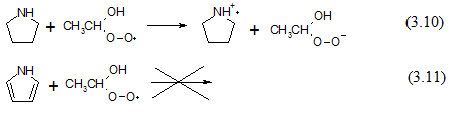
Предложенный механизм объясняет низкую реакционную способность пиррола, неподеленная пара электронов атома азота которого принимает участие в создании ароматической системы, из-за чего ее участие в восстановлении кислородцентрированных радикалов затруднено.
Таблица 1. Влияние пятичленных азотсодержащих гетероциклических соединений на радиационно-индуцированные превращения оксигенированного этанола.
|
Тестируемое соединение |
Радиационно-химический выход (G), |
||
|
Ацетальдегид |
Пероксид водорода |
||
|
Без добавок |
14,65 ± 1,51 |
13,45 ± 1,42 |
|
|
Пирролидин |
5,60 ± 0,28 |
4,63 ± 0,56 |
|
|
Пиррол |
14,90 ± 1,77 |
14,47 ± 1,63 |
Таким образом, включение неподеленной пары электронов атома азота в образование ароматической системы молекулы должно приводить к потери азотсодержащими соединениями антиоксидантных свойств по отношению к кислородцентрированным радикалам.
3.3. Антиоксидантные свойства шестичленных азотсодержащих гетероциклических соединений
На графиках 7-14 приведены построенные на основе экспериментальных данных зависимости концентрации АА и ПВ от поглощенной дозы для чистого этанола и в присутствии исследуемых веществ. Данные зависимости были использованы для расчета радиационно-химических выходов ПВ и АА в отсутствие добавок и в присутствии пиридина, пиперидина и пиперазина. Расчет G осуществляли по тангенсу угла наклона линейных участков зависимостей, который характеризует реакционную способность исследуемых веществ по отношению к -ПГЭР.
График 7. Кинетическая зависимость накопления ацетальдегида от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
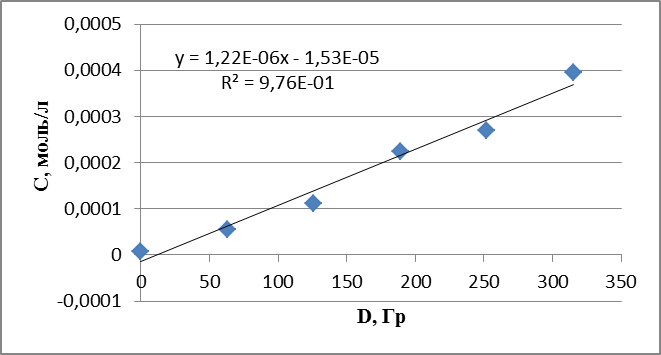
График 8. Кинетическая зависимость накопления пероксида водорода от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
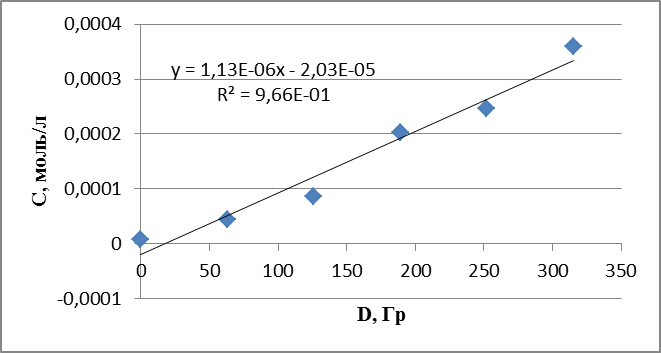
График 9. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиридина в оксигенированном этаноле).
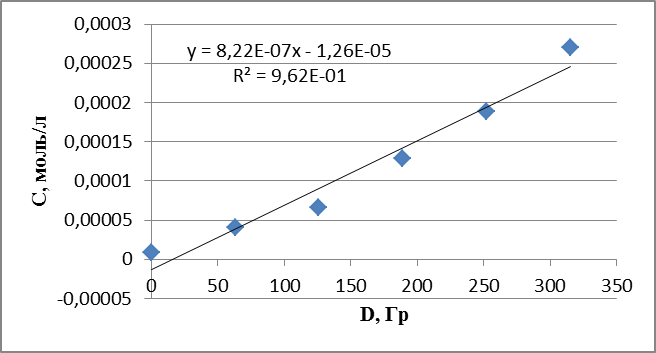
График 10. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиридина в оксигенированном этаноле).
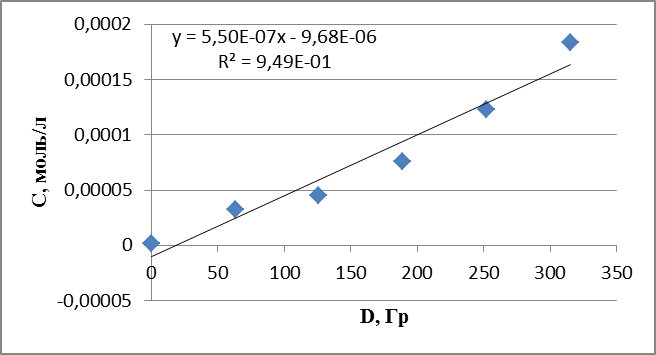
График 11. Кинетическая зависимость накопления ацетальденида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиперидина в оксигенированном этаноле).
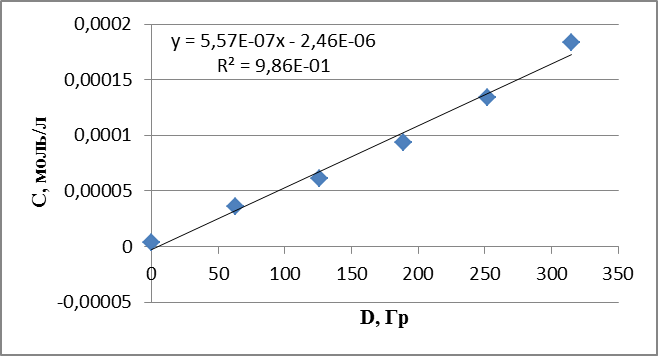
График 12. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиперидина в оксигенированном этаноле).
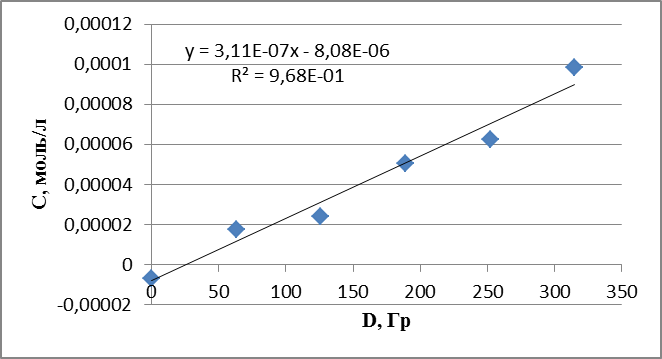
График 13. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиперазина в оксигенированном этаноле).
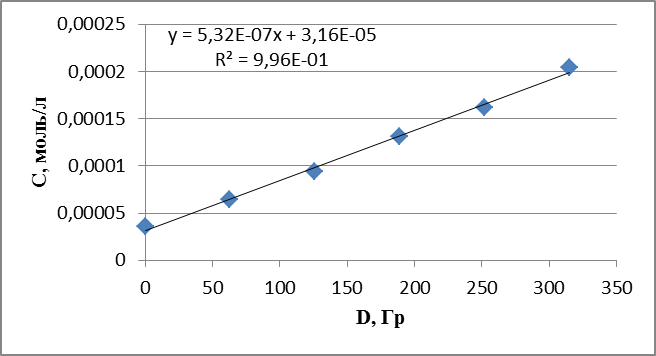
График 14. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора пиперазина в оксигенированном этаноле).
Полученные величины G продуктов радиолиза оксигенированного этанола в присутствии пиридина, пиперидина и пиперазина сведены в табл. 2. Установлено, что все три вещества влияют на величину радиационно-химических выходов продуктов радиолиза оксигенированного этанола – ПВ и АА, что указывает на их реакционную способность по отношению к -ПГЭР.
Таблица 2. Влияние шестичленных азотсодержащих гетероциклических соединений на радиационно-индуцированные превращения оксигенированного этанола.
|
Тестируемое соединение |
Радиационно-химический выход (G), |
||
|
Ацетальдегид |
Пероксид водорода |
||
|
Без добавок |
14,65 ± 1,51 |
13,45 ± 1,42 |
|
|
Пиридин |
9,82 ± 1,11 |
6,61 ± 0,99 |
|
|
Пиперидин |
5,61 ± 0,43 |
3,72 ± 0,38 |
|
|
Пиперазин |
6,43 ± 0,42 |
4,36 ± 0,74 |
В ряду пиридин-пиперазин-пиперидин наблюдается возрастание реакционной способности по отношению к -ПГЭР, снижение выхода ПВ и АА. Это можно обьяснить с точки зрения гибридизации орбиталей атома азота в гетероциклах. В пиридине неподеленная пара электронов атома азота занимает sp2 гибридную орбиталь, поэтому атом азота в пиридине более электроотрицательный чем sp3 гибридные атомы азота в пиперазине и пиперидине, следовательно он прочнее удерживает свою электронную пару, тем самым уступая им в способности реагировать по механизму переноса электрона.
Так же полученные данные коррелируют с pKb исследуемых соединений: пиридин – 8,75, пиперазин – 5,2, пиперидин – 2,76. Можно сделать вывод, что с падением pKb и, следовательно, возрастанием основных свойств, возрастает способность аминов восстанавливать кислородцентрированные радикалы по механизму переноса электрона.
3.4. Антиоксидантные свойства анилина и циклогексиламина.
На графиках 15-20 приведены построенные на основе экспериментальных данных зависимости концентрации АА и ПВ от поглощенной дозы для чистого этанола и в присутствии исследуемых веществ. Данные зависимости были использованы для расчета радиационно-химических выходов ПВ и АА в отсутствие добавок и в присутствии анилина и циклогексиламина. Расчет G осуществляли по тангенсу угла наклона линейных участков зависимостей, который характеризует реакционную способность исследуемых веществ по отношению к -ПГЭР.
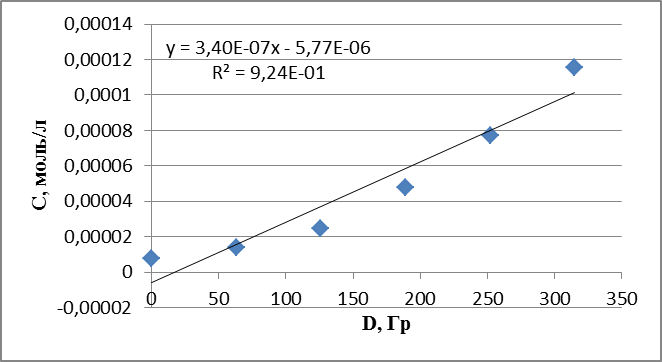
График 15. Кинетическая зависимость накопления ацетальдегида от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
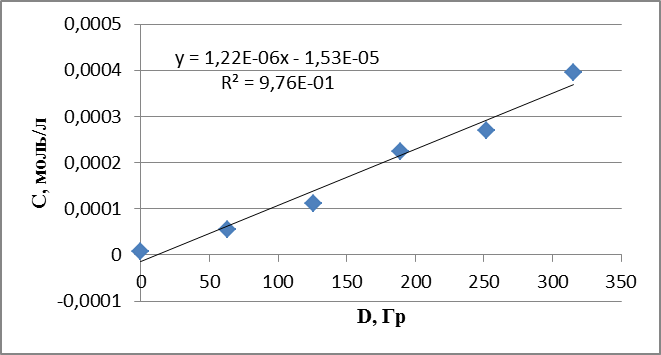
График 16. Кинетическая зависимость накопления пероксида водорода от поглощенной дозы (построена по данным, полученным при радиолизе оксигенированного этанола).
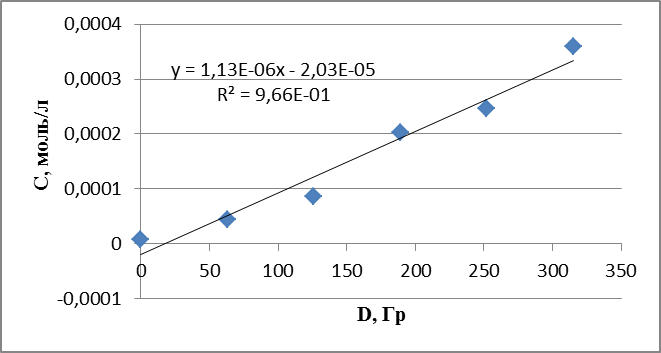
График 17. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора анилина в оксигенированном этаноле).
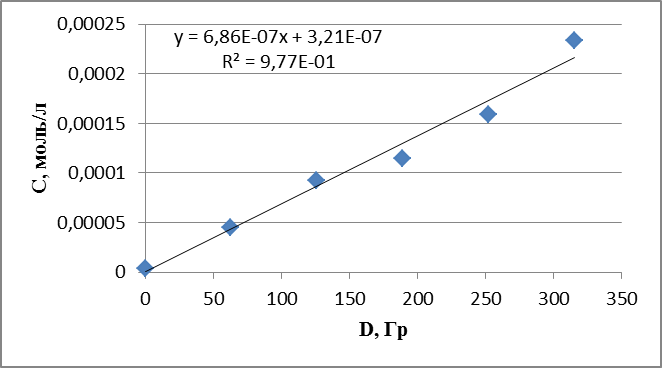
График 18. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора анилина в оксигенированном этаноле).
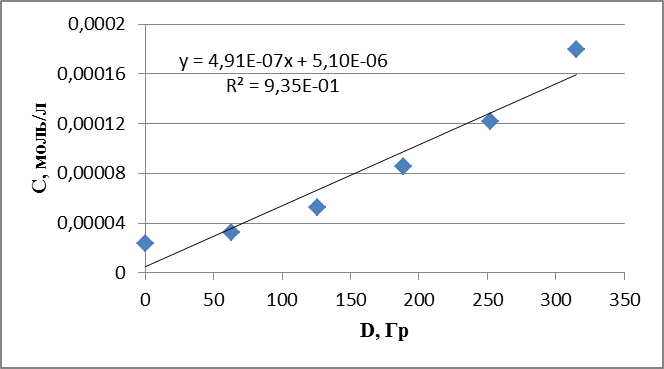
График 19. Кинетическая зависимость накопления ацетальдегида соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора циклогексиламина в оксигенированном этаноле).
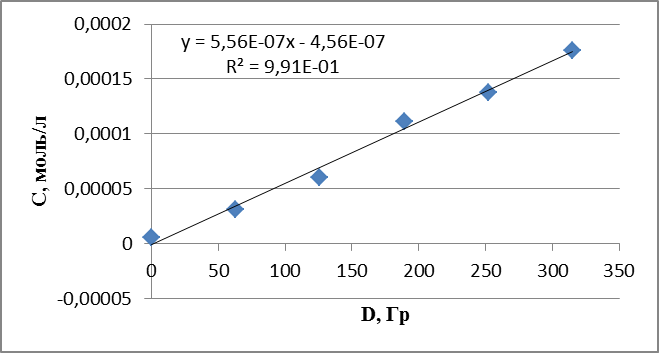
График 20. Кинетическая зависимость накопления пероксида водорода соединения от поглощенной дозы (построена по данным, полученным при радиолизе раствора циклогексиламина в оксигенированном этаноле).
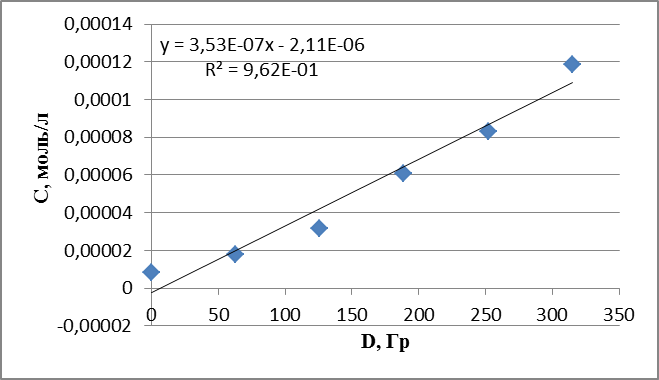
Полученные величины G продуктов радиолиза оксигенированного этанола в присутствии анилина и циклогексиламина сведены в табл. 3. Установлено, что оба вещества влияют на величину радиационно-химических выходов продуктов радиолиза оксигенированного этанола – ПВ и АА, что указывает на их реакционноую способность по отношению к -ПГЭР.
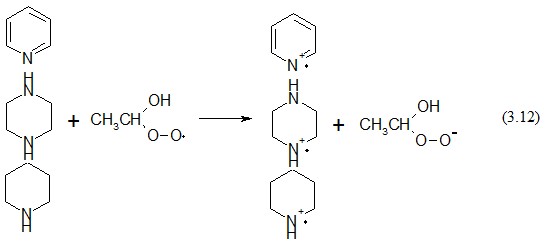
Циклогексиламин более чем в 2 раза снижает радиационно-химический выход АА и в 4 раза радиационно-химический выход ПВ. Анилин уступает циклогексиламину по восстановительным свойствам. Это можно объяснить наличием ароматической системы в анилине. Неподеленная пара электронов аминогруппы в анилине находится в сопряжении с ароматической системой бензольного кольца, что снижает электронную плотность на атоме азота, и соответственно снижает антиоксидантные свойства анилина. Как видно из схемы приведенной на рис.2, при планарной конфигурации молекулы, не поделенная пара электронов атома азота расположена в одной плоскости с электронами ароматической системы, создавая тем самым единую сопряженную систему. При перпендикулярной конфигурации сопряжение отсутствует, и электроны могут участвовать в восстановлении. С этим явлением связана более низкая реакционная способность анилина по сравнению с циклогексиламином.
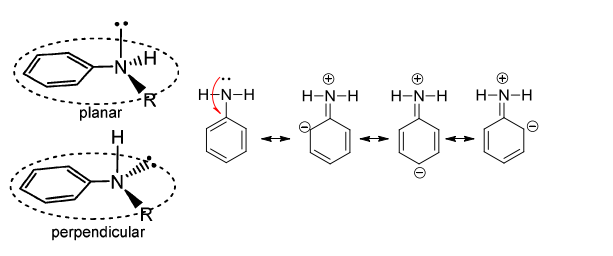
Рисунок 2. Схема делокализации неподеленной пары электронов атома азота анилина с ароматической системой молекулы.
Как и в случае шестичленных азотсодержащих гетероциклов антиоксидантные свойства коррелируют с основными свойствами веществ. Так pKb анилина составляет 9,13, в то время как для циклогексиламина – 3,36, то есть чем выше основные свойства амина, тем более лучшим донором электронов он является.
Таблица 3. Влияние анилина и циклогексиламина на радиационно-индуцированные превращения оксигенированного этанола.
|
Тестируемое соединение |
Радиационно-химический выход (G), |
||
|
Ацетальдегид |
Пероксид водорода |
||
|
Без добавок |
14,65 ± 1,51 |
13,45 ± 1,42 |
|
|
Циклогексиламин |
6,65 ± 0,63 |
3,69 ± 0,33 |
|
|
Анилин |
9,15 ± 0,51 |
5,87 ± 0,88 |
ЗАКЛЮЧЕНИЕ
В настоящей работе была исследована способность ряда циклических аминов ингибировать радиационно-химическое окисление насыщенного кислородом этанола.
На основании полученных данных можно сделать вывод о механизме восстановления и влиянии структуры на их восстановительные свойства. Результаты работы подтверждают, что восстановление кислородцентрированных радикалов аминами происходит по механизму переноса электрона с не поделенной пары электронов атома азота:
Было установлено, что вовлечение электронной пары атома азота в создание ароматической системы, например в случае пиррола, полностью блокирует её восстановительную способность, в то время как пирролидин, в котором отсутствует ароматическая система, проявляет восстановительные свойства.
Было показано, что пиридин, пиперазин и пиперидин обладают антиоксидантными свойствами. Пиридин уступает пиперазину и пиперидину в способности восстанавливать кислородцентрированные радикалы. Это связано с различной гибридизацией атома азота в этих соединениях, и, как следствие, различной электроотрицательностью.
Было показано, что анилин и циклогексиламин способны восстанавливать кислородцентрированные радикалы, однако анилин оказался менее реакционноспособным. Это связано с взаимодействием аминогруппы с ароматической системой бензольного кольца посредством системы сопряжения.
Из полученных данных можно сделать перечень требований к структуре амина при поиске эффективных радиопротекторов:
1) не поделенная пара электронов не должна участвовать в создании ароматической системы;
2) в молекуле не должно быть сопряженных систем с аминогруппой;
3) атом азота должен быть в состоянии sp3 гибридизации.
Список использованных источников
- Halliwell, B. Free radicals in biology and medicine / B. Halliwell, J.M.C. Gutteridge. – Oxford: University Press, 2007. – 851 p.
- Antunes F., Salvador A., Marinho H.S., Alves R., Pinto R.E. // Free Rad. Biol. Med. – 1996. – Vol. 21, № 7. – P. 917-943.
- Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Radiation Physics and Chemistry. – 2014. – Vol. 98. – P. 77-85.
- Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Free Radical Research – 2014. – Vol. 48, № 10. – P. 1200-1205.
- Химическая энциклопедия: В5 т.: т. 4. Под ред. Зефирова Н.С. – М.: Большая Российская энцикл., 1995. Т.4. 639с.
- Владимиров В. Г. Радиопротекторы и современная их классификация. – Воен.-мед. журн. – 1978. № 6. С. 39-43.
- Радиопротекторы: структура и функции. Владимиров В.Г., Красильников И.И., Арапов О.В.; Под ред. Владимирова, В.Г. – Киев: Наук. думка, 1989. – 264 с.
- Жеребченко П. Г. Противолучевые свойства индолилалкиламинов. – Атомиздат, М. 1971. – 200 с.
- Чиликин Л. Г., Горелова Н. В., Шварц Г. Я., Суворов Н. Н. Хим.-фарм. ж. 1979. т. 13. № 4. С. 48.
- Васин М. В., Антипов В. В., Суворов Н. Н., Морозовская И. М., Ильина Г. Н. Радиобиология. 1974. т. 14. с. 242.
- Shinoda M., Ohta S., Hino T., Akaboshi S. J. Pharm. Soc. Japan. 1974. V. 94. P. 1620.
- Vijayalaxmi, Reiter R. J., Herman T. S., Meltz M. L. Melatonin and radioprotection from genetic damage: In vivo/in vitro studies with human volunteers. – Mutat. Res. 1996. V. 371. P. 221-228.
- Karbownik M, Reiter R. J., Qi W., Garcia J. J., Tan D. X., Manchester L. C., Vijayalaxmi. Protective effects of melatonin against oxidation of guanine bases in DNA and decreased microsomal membrane fluidity in rat liver induced by whole body ionizing radiation. – Mol. Cell Biochem. 2000. V. 211. P. 137-144.
- Assayed M. E. Protection of rat chromosomes by melatonin against gamma radiation-induced damage. – Mutation research. 2009. V. 677(1-2). P. 14-20.
- Ahmet Korkmaz, Lucien C. Manchester. Reactive nitrogen species; devastating intracellular players and melatonin as a defender. – J. of Exper. and Integrative Med. 2011. 1(2). Р. 63-65.
- Тарханов И. Р., Яды сердечные // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Племенков В.В. Введение в химию природных соединений. – Казань – 2001. С. 237-249.
- Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 85
- Машковский М. Д. Лекарственные средства. — 15-е изд. — М.: Новая Волна, 2005. — С. 56. — 1200 с.
- Справочник по клинической фармакологии и фармакотерапии / Чемакин И.С., Пелещук Ф.П. и др. / Киев: Здоров’я, 1987. – 736с.
- Пикаев А.К. Современная радиационная химия. Радиолиз газов и жидкостей.— М.: Наука, 1986. – 440 с.
- Freeman G.R. Radiation chemistry of ethanol: A review of data on yields, reaction rate parameters, and spectral properties of transients. Washington: NBS. 1974.
- В.Д.Майборода, Л.А.Масловская, Н.И.Коваленко, В.П.Петряев. Реакции e-(aq) при радиолизе водных растворов этанола. – Химия высоких энергий. 1986. Т. 20. С. 21-26.
Влияние пиррола, пирролидина, пиридина, пиперидина, пиперазина, анилина и циклогексиламина на радиационно-химическое окисление оксигенированного этанола